Що таке аміак? Формула і властивості аміаку
Аміак - з'єднання, що є найважливішим джерелом азоту для живих організмів, а також знайшло застосування в різних галузях промисловості. Що таке аміак, які його властивості? Давайте розберемося.
Що таке аміак: основні характеристики
Аміак (нітрид водоводу) - з'єднання азоту з воднем, що має хімічну формулу NH 3. Форма молекули нагадує трігональную піраміду, в вершині якої розташований атом азоту.
Аміак є газ, який не має кольору, але володіє різким специфічним запахом. Щільність аміаку майже в два рази менше, ніж щільність повітря. При температурі 15 o C вона становить 0,73 кг / м 3. Щільність аміаку рідкого в нормальних умовах дорівнює 686 кг / м 3. Молекулярна маса речовини - 17,2 г / моль. Відмінною особливістю аміаку є його висока розчинність в воді. Так, при температурі 0 ° C її значення досягає близько 1200 об'ємів в обсязі води, при 20 ° C - 700 обсягів. Розчин «аміак - вода» (аміачна вода) характеризується слабощелочнойреакцією і досить унікальною властивістю в порівнянні з іншими лугами: зі збільшенням концентрації щільність знижується.
Як утворюється аміак?
Що таке аміак в організмі людини? Це кінцевий продукт азотистого обміну. Більшу його частину печінку конвертує в сечовину (карбамід) - менш токсична речовина.
Аміак у природних умовах утворюється в результаті розкладання органічних сполук, що містять азот. Для використання в промисловості ця речовина отримують штучним шляхом.
Отримання аміаку в промислових і лабораторних умовах
У промислових умовах аміак отримують шляхом каталітичного синтезу з азоту і водню:
N 2 + 3H 2 → 2NH3 + Q.
Процес отримання речовини проводять при температурі 500 ° C і тиску 350 атм. В якості каталізатора використовується Отриманий аміак видаляється охолодженням. Азот і водень, що не прореагували, повертаються на синтез.
У лабораторних умовах аміак отримують в основному шляхом слабкого нагрівання суміші, що складається із суміші хлориду амонію і гашеного вапна:
2NH 4 Cl + Ca (OH) 2 → CaCl 2 + 2NH 3 + 2H 2 O.
Для осушення готове з'єднання пропускається через суміш вапна і їдкого натру. Досить сухий аміак можна отримати шляхом розчинення в ньому металевого натрію і подальшої перегонки.
Де використовується аміак?
Нітрид водню широко застосовується в різних галузях промисловості. Величезні його кількості використовуються для і різних добрив (сечовина, нітрат амонію та ін.), Полімерів, синильної кислоти, соди, амонієвих солей і інших видів продукції хімічного виробництва.

У легкій промисловості властивості аміаку застосовують при очищенні і фарбуванні таких тканин, як шовк, вовна і бавовна. У сталеливарному виробництві він використовується для збільшення твердості стали шляхом насичення її поверхневих шарів азотом. У нафтохімічній промисловості за допомогою нітриду водню нейтралізують кислотні відходи.
Завдяки своїм термодинамічних властивостях рідкий аміак використовується в якості холодоагенту в холодильному обладнанні.
NH 3 + HNO 3 → NH 4 NO 3.
При взаємодії з HCl утворюється хлорид амонію:
NH 3 + HCl → NH 4 Cl.

Солі амонію є тверді кристалічні речовини, що розкладаються у воді і мають властивості, властивими солям металів. Розчини сполук, утворених в результаті взаємодії аміаку і сильних кислот, мають слабокислу реакцію.
За рахунок атомів азоту нітрид водню є активним відновником. Відновні властивості його проявляються при нагріванні. При горінні в атмосфері кисню він утворює азот і воду. У присутності каталізаторів взаємодія з киснем дає Нітрид водню має здатність відновлювати метали з оксидів.
Галогени в результаті реакції з аміаком утворюють нітрати азоту - небезпечні вибухові речовини. При взаємодії з карбоновими кислотами та їх похідними нітрид водню утворює аміди. У реакціях з вугіллям (при 1000 ° С) і метаном він дає
З іонами металів аміак утворює амінокомплекси, або аміакати (комплексні сполуки), що мають характерну особливість: атом азоту завжди пов'язаний з трьома атомами водню. В результаті комплексоутворення змінюється забарвлення речовини. Так, наприклад, блакитний розчин при додаванні нітриду водню набуває інтенсивний синьо-фіолетовий колір. Багато з амінокомплексов мають достатню стійкість. Завдяки цьому вони можуть бути отримані в твердому вигляді.

У рідкому аміаку добре розчиняються як іонні, так і неполярні неорганічні і органічні сполуки.
Санітарно-гігієнічні характеристики
Аміак відносять до четвертого Гранично допустима максимально-разова концентрація (ГДК) в повітрі населених пунктів дорівнює 0,2 мг / м 3, середньодобова - 0,04. У повітрі робочої зони вміст аміаку не повинно бути вище 20 мг / м³. При таких концентраціях запах речовини не відчувається. Фіксуватися людським нюхом він починає при 37 мг / м³. Тобто якщо запах аміаку відчувається, це означає, що допустимі норми знаходження речовини в повітрі значно перевищені.
Вплив на людський організм
Що таке аміак з точки зору впливу на людину? Це токсикант. Його відносять до речовин, здатним надавати задушливе і нейротропну дію, інгаляційне отруєння якими може призвести до набряку легенів і ураження нервової системи.
Аміачні пари дратівливо впливають на шкірні покриви, слизові оболонки очей та органів дихання. Концентрація речовини, при якій проявляється роздратування зіву, становить 280 мг на куб. метр, очей - 490 мг на куб. метр. Залежно кількості нітриду водню в повітрі можуть виникати першіння в горлі, затруднення дихання, напади кашлю, біль в очах, рясне сльозотеча, хімічний опік рогівки, втрата зору. При змісті аміаку 1,5 г на куб. метр протягом години розвивається токсичний набряк легенів. При контакті рідкого аміаку і його розчинів (у високих концентраціях) зі шкірою можливі почервоніння, свербіж, печіння, дерматити. Так як зріджений нітрид водоводу при випаровуванні поглинає тепло, можливі обмороження різного ступеня.
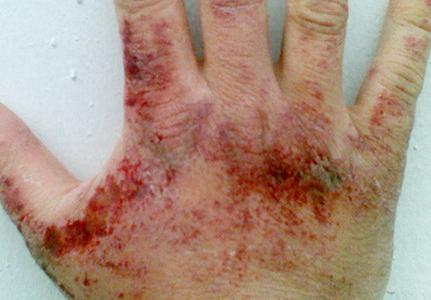
Симптоми отруєння аміаком
Отруєння даними токсикантом може викликати зниження слухового порога, нудоту, запаморочення, головний біль та ін. Можливі зміни в поведінці, зокрема сильне збудження, марення. Прояв симптомів в ряді випадків має переривчастий характер. Вони можуть на деякий час припинятися, а потім відновлюватися з новою силою.
З огляду на всі можливі наслідки впливу аміаку, дуже важливо дотримуватися запобіжних заходів при роботі з цією речовиною і не допускати перевищення його концентрації в повітряному середовищі.









