Какво е амоняк? Амонячна формула и свойства
Амоняк - съединение, което е най-важният източник на азот за живи организми, както и намерени приложения в различни индустрии. Какво е амоняк, какви са неговите свойства? Нека го разберем.
Какво е амоняк: основни характеристики
Амоняк (хидродиев нитрид) е азотно съединение с водород, имащ химична формула NH3. Формата на молекулата прилича на тригоналната пирамида, в горната част на която е азотен атом.
Амонякът е газ, който няма цвят, но с остър специфична миризма. Плътността на амоняка е почти два пъти по-малка от плътността на въздуха. При температура от 15 ° С е 0.73 kg / m3. Плътността на амонячната течност при нормални условия е 686 kg / m3. Молекулно тегло на веществото - 17.2 g / mol. Отличителна черта на амоняка е високата си разтворимост във вода. Така, при температура от 0 ° С, тя достига около 1 200 тома в обема на водата, при 20 ° С - 700 тома. Разтворът "амоняк - вода" (амонячна вода) се характеризира с слабо алкална реакция и доста уникален имот в сравнение с други основи: с увеличаване на концентрацията, намалява плътността.
Как се образува амоняк?
Какво е амоняк в човешкото тяло? Това е ограничен продукт на азотния обмен. Голямата част от черния дроб се превръща в урея (карбамид) по-малко токсично вещество.
Амоняк в естествени условия се образува в резултат на разграждането на органични съединения, съдържащи азот. За промишлена употреба това вещество се получава чрез изкуствено.
Получаване на амоняк в индустриални и лабораторни условия
В промишлените условия амонякът се получава чрез каталитичен синтез от азот и водород:
N2 + 3H2 → 2NH3 + Q.
Процесът на получаване на вещество се извършва при температура от 500 ° С и налягане от 350 атм. Като катализатор, полученият амоняк се отстранява чрез охлаждане. Азот и водород, които не реагират, върнат към синтез.
При лабораторни условия амонякът се получава главно чрез слабо нагряване на сместа, състояща се от амониев хлорид и коси:
2NH4CL + Ca (OH) 2 → CaCl 2 + 2NH 3 + 2H2O.
За да се отцеди, завършената връзка преминава през смес от вар и каустична сода. Доста сух амоняк може да бъде получен чрез разтваряне на метален натрий и последваща дестилация.
Къде е амоняк?
Хидроген нитрид се използва широко в различни индустрии. Използват се огромни количества и различни торове (карбамид, амониев нитрат и т.н.), полимери, синилова киселина, сода, амониеви соли и други видове химически производствени продукти.

В леката индустрия амонячните свойства се използват при почистване и оцветяване на такива тъкани, като коприна, вълна и памук. В производството на стомана се използва за увеличаване на стоманената твърдост чрез насищане на повърхностните слоеве с азот. В нефтохимическата индустрия с помощта на водороден нитрид неутрализира кисели отпадъци.
Благодарение на термодинамичните си свойства, течният амоняк се използва като хладилен агент в хладилно оборудване.
NH3 + HNO 3 → NH4NO3.
Когато взаимодействате с НС1, се образува амониев хлорид:
NH3 + HCl → NH4C1.

Амониевите соли са твърди кристални вещества, които се разлагат във вода и притежават свойства, присъщи метални соли. Разтворите на съединения, образувани в резултат на взаимодействието на амоняк и силни киселини, имат слабо кисела реакция.
Благодарение на азотните атоми, водородният нитрид е активно редуциращо средство. Свойствата за възстановяване се проявяват при нагряване. При изгаряне в кислородна атмосфера, тя образува азот и вода. В присъствието на катализатори взаимодействието с кислород дава водород нитрид има способността да възстановява металите от оксиди.
Халогени в резултат на реакция с амоняк образуват азотни халиди - опасни експлозиви. Когато взаимодействат с карбоксилни киселини и техните производни, амидите на водородните нитрид форми. Във въглищни реакции (при 1000 ° C) и метан, който дава
С йони на метали, амоняк образуват аминокиселини или амоняк (сложни съединения), имащи характеристична характеристика: азотният атом винаги се свързва с три водородни атома. В резултат на сложността, картината на веществото се променя. Така например, синьо решение с добавянето на водороден нитрид придобива интензивен син-лилав цвят. Много от аминокиселините са достатъчно устойчиви. Благодарение на това те могат да бъдат получени в твърда форма.

В течен амоняк както йонни, така и не-полярни неорганични и органични съединения са добре разтворени.
Санитарни и хигиенни характеристики
Амонякът се отнася до четвъртата максимална допустима максимална концентрация (МПК) във въздуха на населените места е 0.2 mg / m 3, средно дневно - 0.04. Във въздуха на работната зона съдържанието на амоняк не трябва да бъде по-високо от 20 mg / m³. При такива концентрации миризмата на вещество не се усеща. Фиксиран с човешка миризма, тя започва при 37 mg / m³. Това означава, че ако миризмата на амоняк се усеща, това означава, че допустимите стандарти за намиране на вещество във въздуха са значително надвишени.
Въздействие върху човешкото тяло
Какво е амоняк от гледна точка на въздействието върху човек? Това е токсикантно. Той се отнася до вещества, които могат да се укрепват и невротропният ефект, инхалационното отравяне, което може да доведе до оток и засягаща нервната система.
Амонячните двойки се влияят досадно върху кожата, лигавиците на очите и респираторните органи. Концентрацията на веществото, при която се проявява дразненето на ОСЕ, е 280 mg на кубичен метър. Метър, око - 490 mg на куб. метър. В зависимост от количеството водороден нитрид във въздуха, може да има подреждане в гърлото, затруднено дишане, атаки на кашлица, болки в очите, изобилие разкъсване, химически изгаряния на роговица, загуба на зрение. Когато съдържанието на амоняк е 1,5 g на кубичен метър. Метевът за един час развива токсичен белодробен оток. При контакт с течен амоняк и неговите разтвори (във високи концентрации) е възможно зачервяване, сърбеж, изгаряне, дерматит. Тъй като втечнен нитрид на водоснабдяването по време на изпаряване поглъща топлина, измръзване е измръзване.
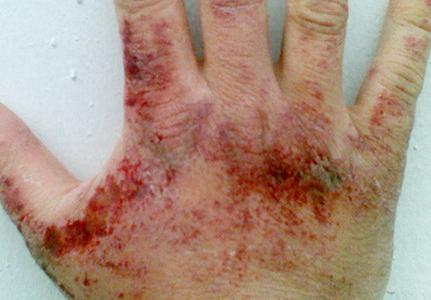
Симптоми на отравяне амоняк
Отравянето на този токсикант може да доведе до намаляване на слуховия праг, гадене, замаяност, главоболие и т.н. Може да има промени в поведението, по-специално силна възбуда, глупост. Проявата на симптомите в някои случаи е прекъсната. Те могат да спрат за известно време и след това да се подновят с нова сила.
Като се имат предвид всички възможни последици от въздействието на амоняка, е много важно да се спазват предпазните мерки при работа с това вещество и да се предотврати превишаването на нейната концентрация във въздуха.









