Co je amoniak? Vzorec a vlastnosti amoniaku
Ammoniak - sloučenina, která je nejdůležitějším zdrojem dusíku pro živé organismy, stejně jako nalezené aplikace v různých průmyslových odvětvích. Jaký je amoniak, jaké jsou jeho vlastnosti? Pojďme to přijít.
Co je amoniak: hlavní charakteristiky
Ammoniak (nitrid hydrodium) je dusíková sloučenina s vodíkem majícím chemický vzorec NH3. Formulář molekuly se podobá trigonální pyramidu, jehož vrcholem je atom dusíku.
Amoniak je plyn, který nemá barvu, ale má ostrý specifický zápach. Hustota amoniaku je téměř dvakrát menší než hustota vzduchu. Při teplotě 15 ° C je 0,73 kg / m 3. Hustota amoniaku kapaliny za normálních podmínek je 686 kg / m 3. Molekulová hmotnost látky - 17,2 g / mol. Výrazný rys amoniaku je jeho vysoká rozpustnost ve vodě. Při teplotě 0 ° C se tedy dosahuje přibližně 1 200 svazků v objemu vody při 20 ° C - 700 svazků. Roztok "amoniaku - voda" (voda amoniaku) se vyznačuje slabě alkalickou reakcí a poměrně jedinečným vlastnictvím ve srovnání s jinými zásadami: se zvýšením koncentrace se hustota snižuje.
Jak se tvořil amoniak?
Co je amoniak v lidském těle? Jedná se o konečný produkt burzy dusíku. Jeho velká část jater je přeměněna na močovinu (karbamid) méně toxická látka.
V důsledku rozkladu organických sloučenin obsahujících dusík se vytvoří amoniak v přírodních podmínkách. Pro průmyslové použití se tato látka získá uměle.
Získání amoniaku v průmyslových a laboratorních podmínkách
V průmyslových podmínkách se amoniak získá katalytickou syntézou z dusíku a vodíku:
N 2 + 3H 2 → 2NH3 + Q.
Proces získání látky se provádí při teplotě 500 ° C a tlaku 350 atm. Jako katalyzátor se výsledný amoniak odstraní chlazením. Dusík a vodík, které nemají reagovány, se vrátily do syntézy.
V laboratorních podmínkách se amoniak získá převážně slabým ohřevem směsi sestávajícího z chloridu amonného a vláční vápno:
2NH 4 Cl + CA (OH) 2 → CACl 2 + 2NH 3 + 2H 2 O.
K vypouštění, hotové spojení se projeví směsí vápna a žíravé sody. Zcela suchý amoniak může být získán rozpuštěním kovové sodíku a následné destilace.
Kde je amoniak?
Nitrid vodíku je široce používán v různých průmyslových odvětvích. Obrovské množství se používají pro a různá hnojiva (močovina, dusičnany amonný atd.), Polymery, sinylové kyseliny, sody, amonné soli a jiné typy výrobních výrobních výrobků.

Ve světlém průmyslu se při čištění a barvení takových tkanin používají vlastnosti amoniaku, jako je hedvábí, vlna a bavlna. V produkci oceli se používá ke zvýšení ocelové tvrdosti nasycením jeho povrchových vrstev s dusíkem. V petrochemickém průmyslu s pomocí nitridu vodíku neutralizuje kyselý odpad.
Díky svým termodynamickým vlastnostem se kapalný amoniak používá jako chladivo v chladivém zařízení.
NH3 + HNO 3 → NH 4 č. 3.
Při interakci s HC1 je vytvořen chlorid amonný:
NH3 + HC1 → NH 4 Cl.

Amoniové soli jsou pevné krystalické látky, které se rozkládají ve vodě a vlastnostmi vlastností inherentních kovových solí. Roztoky sloučenin vytvořených v důsledku interakce amoniaku a silných kyselin mají slabě kyselou reakci.
Vzhledem k atomům dusíku je nitrid vodíku aktivní redukční činidlo. Vlastnosti zotavení se projevují při zahřátí. Při spalování v atmosféře kyslíku tvoří dusík a vodu. V přítomnosti katalyzátorů, interakce s kyslíkem poskytuje nitrid vodíku, má schopnost obnovit kovy z oxidů.
Halogeny v důsledku reakce s amoniakem forma halogenidy dusíku - nebezpečné výbušniny. Při interakci s karboxylovými kyselinami a jejich deriváty, formy nitridu vodíku se amidy amidy. V uhelných reakcích (při 1000 ° C) a metanu
S ionty kovů, amoniaku tvoří aminokyseliny nebo amoniak (komplexní sloučeniny), mající charakteristickou funkcí: atom dusíku je vždy spojován se třemi atomy vodíku. V důsledku složitosti se obraz látky změní. Takže například modrý roztok s přidáním nitridu vodíku získává intenzivní modrou fialovou barvu. Mnohé z aminokyselin jsou dostatečně odolné. Díky tomu mohou být získány v pevné formě.

V kapalném amoniaku jsou i iontové i nepolární anorganické a organické sloučeniny dobře rozpuštěny.
Sanitární a hygienické vlastnosti
Amoniak se odkazuje na čtvrtou maximální koncentraci maximální doby (MPC) ve vzduchu osad je 0,2 mg / m3, průměrně denně - 0,04. Ve vzduchu pracovního prostoru by obsah amoniaku neměl být vyšší než 20 mg / m³. V takových koncentracích není pach látky pociťována. Opravena lidským zápachem začíná při 37 mg / m³. To znamená, že je-li cítit vůni amoniaku, znamená to, že přípustné standardy nálezu látky ve vzduchu jsou významně překročeny.
Dopad na lidské tělo
Jaký je amoniak z hlediska dopadu na osobu? To je toxický. To se odkazuje na látky schopné posilovat a neurotropní účinek, otrava vdechování, které mohou vést k edému a postihování nervového systému.
Páry amoniaku jsou nepříjemně ovlivňující pokožku, sliznice očí a respiračních orgánů. Koncentrace látky, při které se projevuje podráždění OCE, je 280 mg na kubický metr. Měřič, oko - 490 mg na kostku. Metr. V závislosti na množství nitridu vodíku ve vzduchu může být uspořádání v krku, obtížnost dýchání, útoky proti kašli, bolesti očí, hojné trhání, chemické popáleniny rohovky, ztráta vidění. Když je obsah amoniaku 1,5 g na kubický metr. Měřič po dobu jedné hodiny se vyvíjí toxický plicní edém. Při kontaktu se tekutým amoniakem a jeho roztokem (ve vysokých koncentracích), zarudnutí je možné, svědění, spalování, dermatitida. Vzhledem k tomu, že zkapalněný nitrid přívodu vody během odpaření absorbuje teplo, omrzliny je omrzliny.
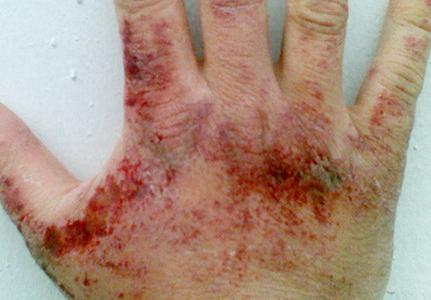
Symptomy otravy amoniaku
Otrava tohoto toxivu může způsobit snížení sluchové prahové hodnoty, nevolnost, závratě, bolesti hlavy atd. Mohou být změny v chování, zejména silné vzrušení, nesmysl. Projekt symptomů v některých případech je přerušovaný. Na chvíli se mohou zastavit, a pak obnovit s novou silou.
Vzhledem ke všem možným důsledkům dopadu amoniaku je velmi důležité dodržovat opatření při práci s touto látkou a zabránit překročení jeho koncentrace ve vzduchu.









