Was ist Ammoniak? Ammoniakformel und Eigenschaften
Ammoniak - eine Verbindung, die die wichtigste Stickstoffquelle für lebende Organismen ist, sowie gefundene Anwendungen in verschiedenen Branchen. Was ist Ammoniak, was sind ihre Eigenschaften? Lass es uns herausfinden.
Was ist Ammoniak: Hauptmerkmale
Ammoniak (Hydrodiumnitrid) ist eine Stickstoffverbindung mit Wasserstoff mit einer chemischen Formel NH 3. Die Molekülform ähnelt der trigonalen Pyramide, auf deren Richtung ein Stickstoffatom ist.
Ammoniak ist ein Gas, das keine Farbe hat, sondern einen scharfen spezifischen Geruch hat. Die Ammoniakdichte ist fast zweimal weniger als die Luftdichte. Bei einer Temperatur von 15 ° C ist es 0,73 kg / m 3. Die Dichte der Ammoniakflüssigkeit unter normalen Bedingungen beträgt 686 kg / m 3. Molekulargewicht der Substanz - 17,2 g / mol. Ein unverwechselbares Merkmal von Ammoniak ist seine hohe Löslichkeit in Wasser. Bei einer Temperatur von 0 ° C erreicht es somit etwa 1.200 Volumina im Wasservolumen, bei 20 ° C - 700 Bänden. Die "Ammoniakwasser" -Lösung (Ammoniakwasser) zeichnet sich durch eine schwach alkalische Reaktion und ein ziemlich einzigartiges Grundstück im Vergleich zu anderen Alkalien aus: Mit einer Erhöhung der Konzentration nimmt die Dichte ab.
Wie ist Ammoniak gebildet?
Was ist Ammoniak im menschlichen Körper? Dies ist ein endliches Produkt des Stickstoffaustauschs. Sein großer Teil der Leber wird in Harnstoff (Carbamid) weniger toxisch umgewandelt.
Ammoniak bei natürlichen Bedingungen ist durch die Zersetzung organischer Verbindungen mit Stickstoff gebildet. Für den industriellen Gebrauch wird diese Substanz durch künstlich erhalten.
Ammoniak bei Industrie- und Laborbedingungen
Bei den industriellen Bedingungen wird Ammoniak durch katalytische Synthese aus Stickstoff und Wasserstoff erhalten:
N 2 + 3h 2 → 2nh3 + Q.
Das Verfahren zur Erlangung einer Substanz erfolgt bei einer Temperatur von 500 ° C und einem Druck von 350 atm. Als Katalysator wird das resultierende Ammoniak durch Kühlung entfernt. Stickstoff und Wasserstoff, der nicht reagiert, kehrt zur Synthese zurück.
Bei Laborbedingungen wird Ammoniak hauptsächlich durch schwache Erwärmung der Mischung aus Ammoniumchlorid und behaartem Kalk erhalten:
2NH 4 CL + CA (OH) 2 → CACL 2 + 2NH 3 + 2H 2 O.
Zum Abfließen wird die fertige Verbindung durch eine Mischung aus Kalk- und Natronlauge geleitet. Das ziemlich trockene Ammoniak kann durch Auflösen von Metallnatrium und anschließender Destillation erhalten werden.
Wo ist Ammoniak?
Wasserstoffnitrid wird in verschiedenen Branchen weit verbreitet. Es werden riesige Mengen für und verschiedene Düngemittel (Harnstoff, Ammoniumnitrat usw.), Polymere, Sinylsäure, Soda, Ammoniumsalze und andere Arten von chemischen Produktionsprodukten eingesetzt.

In der leichten Industrie werden Ammoniakeigenschaften beim Reinigen und Färbung solcher Stoffe wie Seide, Wolle und Baumwolle verwendet. In der Stahlproduktion wird es verwendet, um die Härte der Stahlhärte durch Sättigung seiner Oberflächenschichten mit Stickstoff zu erhöhen. In der petrochemischen Industrie mit Hilfe von Wasserstoffnitrid neutralisieren Sie saure Abfälle.
Aufgrund seiner thermodynamischen Eigenschaften wird flüssiges Ammoniak als Kältemittel in Kühlgeräten verwendet.
NH 3 + HNO 3 → NH 4 Nein 3.
Bei der Interaktion mit HCl wird Ammoniumchlorid gebildet:
NH 3 + HCl → NH 4 Cl.

Ammoniumsalze sind solide kristalline Substanzen, die sich in Wasser zersetzen und Eigenschaften inhärenten Metallsalzen besitzen. Lösungen von Verbindungen, die als Ergebnis der Wechselwirkung von Ammoniak und starken Säuren ausgebildet sind, weisen eine schwach saure Reaktion auf.
Aufgrund der Stickstoffatome ist Wasserstoffnitrid ein aktives Reduktionsmittel. Wiederherstellungseigenschaften manifestieren sich beim Erhitzen. Beim Verbrennen in einer Sauerstoffatmosphäre bildet es Stickstoff und Wasser. In Anwesenheit von Katalysatoren hat die Wechselwirkung mit Sauerstoff Wasserstoffnitrid die Fähigkeit, Metalle aus Oxiden wiederherzustellen.
Halogene als Folge einer Reaktion mit Ammoniakform Stickstoffhalogeniden - gefährliche Sprengstoffe. Bei der Interaktion mit Carbonsäuren und ihren Derivaten bildet sich das Wasserstofftitrid amide. In Kohlenreaktionen (bei 1000 ° C) und Methan gibt es
Mit den Ionen von Metallen, Ammoniak bilden Aminosäuren oder Ammoniak (komplexe Verbindungen) mit einem charakteristischen Merkmal: Ein Stickstoffatom ist immer mit drei Wasserstoffatomen verbunden. Infolge der Komplexierung ändert sich das Gemälde der Substanz. So erwirbt zum Beispiel eine blaue Lösung mit der Zugabe von Wasserstoffnitrid intensive blau-purpurrote Farbe. Viele der Aminosäuren sind ausreichend widerstandsfähig. Aufgrund dessen können sie in fester Form erhalten werden.

Bei flüssigem Ammoniak sind sowohl ionische als auch unpolare anorganische und organische Verbindungen gut aufgelöst.
Sanitäre und hygienische Eigenschaften
Ammoniak wird auf die vierte maximal zulässige Maximalzeitkonzentration (MPC) in der Settlasse in der Luft der Siedlungen bezeichnet, ist 0,2 mg / m 3, durchschnittlich täglich - 0,04. In der Luft des Arbeitsbereichs sollte der Ammoniakgehalt nicht höher als 20 mg / m³ sein. In solchen Konzentrationen ist der Geruch von Substanz nicht gefühlt. Mit dem menschlichen Geruch fixiert er beginnt bei 37 mg / m³. Das heißt, wenn der Geruch von Ammoniak spürbar ist, bedeutet dies, dass die zulässigen Standards des Findens einer Substanz in der Luft erheblich übertroffen werden.
Auswirkungen auf den menschlichen Körper
Was ist Ammoniak aus dem Sicht der Auswirkungen auf eine Person? Das ist toxisch. Es wird auf verstärkbare und neurotrope Wirkung fähig bezeichnet, die Inhalationsvergiftung, die zu Ödem führen kann und das Nervensystem beeinträchtigt.
Ammoniakpaare beeinflussen ärgerlich die Haut, Schleimhäute der Augen und Atmungsorgane. Die Konzentration der Substanz, bei der die Reizung des OCE manifestiert, beträgt 280 mg pro Kubikmeter. Meter, Eye - 490 mg pro Cube. Meter. In Abhängigkeit von der Menge an Wasserstoffnitrid in der Luft kann es eine Anordnung im Hals geben, die Atemnot, Hustenangriffe, Augenschmerzen, reichlich zerreißende, chemische Verbrennungen von Hornhaut, Sehverlust. Wenn der Gehalt an Ammoniak 1,5 g pro Kubikmeter beträgt. Das Messgerät für eine Stunde entwickelt giftige Lungenödem. Bei der Kontaktaufnahme mit flüssigem Ammoniak und seinen Lösungen (in hohen Konzentrationen) ist Rötung möglich, Juckreiz, Brennen, Dermatitis. Da das verflüssigte Nitrid der Wasserwasserzufuhr während des Verdampfungss Wärme absorbiert, ist Frostbite erfroren.
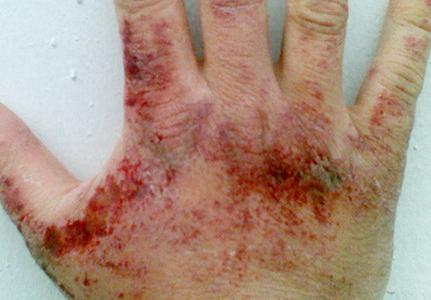
Symptome der Vergiftung von Ammoniak
Die Vergiftung dieses Tolkants kann dazu führen, dass der Gehörstrom, Übelkeit, Schwindel, Kopfschmerzen usw. Veränderungen abnimmt. Es kann Verhaltensänderungen geben, insbesondere starker Erregung, Unsinn. Die Manifestation von Symptomen ist in einigen Fällen intermittierend. Sie können eine Weile aufhören und dann mit einer neuen Kraft erneuern.
In Anbetracht aller möglichen Folgen der Auswirkungen von Ammoniak ist es sehr wichtig, Vorsichtsmaßnahmen bei der Arbeit mit dieser Substanz einzuhalten und das Überschreiten seiner Konzentration in der Luft zu verhindern.









