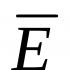منیزیم یک فلز مهم برای صنعت و زندگی انسان است. منیزیم
قدرت، جاذبه، قدرت - اینگونه بود که مردم یونان باستان کلمه "magnes" را تفسیر کردند. در این کشور شهری به نام مگنزیا وجود داشت. در نزدیکی این سکونتگاه ها سنگ آهن مغناطیسی استخراج می شد که همانطور که مشخص است قدرت جذب اجسام فلزی را دارد.
ولی، منیزیم فلزینام آن نه به خاطر سنگ حاوی آهن، بلکه به خاطر پودر "منیزیای سفید" است. یونانیان آن را از یک ماده معدنی که در نزدیکی سکونتگاه باستانی نیز موجود بود به دست آوردند. پس از تکلیس، سنگ به پودر سفید تبدیل شد - اکسید منیزیم. یونانی ها نمی دانستند که این ماده فلزی است، اما متوجه خواص درمانی این ترکیب شدند. به بیماری های کبد و کلیه کمک می کرد و نقش ملین را ایفا می کرد.
این دارو برای قرنها از بین نرفت و در سال 1808، جفری دیوی طی آزمایشهایی یک فلز ناشناخته را از آن جدا کرد. دانشمندی از انگلستان بدون فکر کردن طولانی، عنصر کشف شده را منیزیم نامید. این همان چیزی است که هنوز در اروپا به آن می گویند. روس ها به آن می گویند منیزیم فلزیبا تشکر از کتاب درسی هرمان هس. با وجود ریشه آلمانی اش، شیمیدان روسی است. در سال 1831 یک کتاب درسی غربی را ترجمه کرد. این دانشمند کلمه منیزیم را به منیزیم تبدیل کرد. به این ترتیب این عنصر در علم روسیه نام ویژه ای گرفت.
در جدول تناوبی عناصر شیمیایی منیزیمجایگاه دوازدهم را به خود اختصاص داده است. در زیرگروه اصلی گروه در شماره دو قرار دارد. عنصر سفید با بازتاب های نقره ای است. این رنگ مشخصه تمام فلزات قلیایی خاکی است که همراه با استرانسیم، رادیوم و باریم شامل منیزیم نیز می شود. در میان فلزات "کرک" است. به عنوان مثال، آهن و مس تقریباً 5 برابر سنگین تر هستند. حتی آلومینیوم سبک وزن بیشتر از عنصر شماره 12 روی کاسه خواهد بود.

سبک بودن منیزیم برای طراحان و سازندگان هواپیما مفید است. برای داشتن قابلیت پرواز خوب، لازم نیست سنگین باشند. با این حال، فلز خالص شماره 12 را نمی توان برای همان هواپیما استفاده کرد. او بیش از حد نرم و انعطاف پذیر است.
باید بسازیم آلیاژهای منگنز، آلومینیوم یا . آنها بدون افزودن وزن زیادی به منگنز قدرت می دهند. این مخلوط ها عمدتاً برای تولید روکش برای "پرندگان آهنی" استفاده می شود. به هر حال، اولین هواپیمای مبتنی بر آلیاژهای منیزیم، کار تکنسین های هواپیمای داخلی بود. این کشتی در سال 1934 ساخته شد و "Sergo Ordzhonekidze" نام گرفت.
عنصر منیزیمذوب شدن بسیار دشوار است فقط 650 درجه سانتیگراد مورد نیاز است. با این حال، در حال حاضر در 550 فلز شعله ور می شود و در اتمسفر حل می شود. شعله تولید شده بسیار چشمگیر است، بنابراین این فلز در صنعت پیروتکنیک کاربرد پیدا کرده است.
هیچ آتش بازی یا جرقه ای بدون آن کامل نمی شود. اگر منیزیم در خانه ذخیره می شود، بهتر است مواد سفید کننده در نزدیکی آن نریزند. در حضور کلر، عنصر دوازدهم حتی در دمای 25 درجه روشن می شود.

محصولات احتراق منیزیم پرتوهای فرابنفش و گرما هستند. حتی چند گرم فلز برای جوشاندن 200 میلی لیتر آب کافی است. این برای نوشیدن چای کاملاً کافی است. دانشمندان ورشو تصمیم گرفتند این عنصر را "اجبار" کنند تا غذا را گرم کند. فیزیکدانان آنها را در شیشه های کنسرو ساخته اند نوار منیزیم. هنگامی که ظرف باز می شود، داخل ظرف مشتعل می شود و محتویات شیشه گرم می شود. اینم یه ناهار آماده
قوطی های خود گرم شونده هزاران سال است که تولید می شوند. رسوبات منیزیمدر اعماق با ذخایر تنها 7 عنصر رقابت کنید. فقط سیلیکون، اکسیژن، آهن، آلومینیوم و کلسیم بیشتر است. فلز شماره 12 بخشی از دویست کانی است. این عنصر از کارنالیت در مقیاس صنعتی استخراج می شود.
منیزیم همچنین جزء اصلی ماگما، لایه داغ بین هسته سیاره و سطح آن است. در آب دریا عنصر شماره 12 حاوی 4 کیلوگرم بر متر مکعب است.
اگر آب اقیانوس با پوسته های خرد شده به صورت پودر مخلوط شود، نتیجه خواهد بود کلرید منیزیم. فلز خالص را می توان با الکترولیز از آن جدا کرد. اما این روش تنها در طول جنگ جهانی دوم مورد استفاده قرار گرفت. ما حدود 100 هزار تن عنصر شماره 12 را استخراج کردیم و آرام شدیم، زیرا فرآوری منابع دریاها در مخازن عظیم کار مشکلی است.
برای متالورژی، یکی از مصرف کنندگان اصلی منیزیم، ذخایر کافی در پوسته زمین وجود دارد. این فلز در تولید تقریباً همه آلیاژها ضروری است. عنصر شماره 12 باعث کاهش محتوای اکسیژن در آنها می شود که به شدت کیفیت محصول را بدتر می کند. تبدیل منیزیم به بخشی از هر آلیاژی آسان نیست. به دلیل سبک بودن در فلزات دیگر فرو نمی رود. به دلیل "واکنش انفجاری" به هوا، روی سطح مخلوط ها شعله ور می شود.

متالورژی ها باید فلز دمدمی مزاج را به شکل بریکت ها فشار دهند، وزنه ها را درون آنها قرار دهند و تنها پس از آن، آنها را برای ذوب مجدد در ترکیب قرار دهند.
سبکی منیزیم جذب و. آنها این عنصر را به آلیاژهای گرانبها اضافه می کنند تا اقلام سبک تر شوند. اگر دکوراسیون حجیم و دارای ابعاد چشمگیر باشد، این بسیار مفید است. همه نمی خواهند وزنی باورنکردنی برای یک جواهر حمل کنند. منیزیمبه کمک می آید.
اما، اگر ساخت جواهرات بدون منیزیم امکان پذیر است، پس زندگی امکان پذیر نیست. منیزیم فلزیبخشی از کلروفیل است. این بخشی از پوشش گیاهی است، ماده ای که مسئول فتوسنتز است. یعنی بدون عنصر شماره 12، فرآیند تبدیل دی اکسید کربن به اکسیژن غیرممکن خواهد بود. جو این سیاره متفاوت خواهد بود، بنابراین اگر منیزیم روی آن وجود نداشت، بشریت به سختی روی زمین ظاهر می شد.
این فلز همچنین به ضربان قلب انسان کمک می کند، نه تنها با تامین اکسیژن. منیزیم ضروری استبرای عملکرد پایدار عضله قلب طبق آمار، حملات قلبی عمدتاً در افرادی رخ می دهد که بدن آنها عنصر شماره 12 کافی را ندارد. بنابراین، خوردن دانه کدو تنبل، سبوس، نوشیدن کاکائو و چای ضرری ندارد. این غذاها حاوی بیشترین منیزیم هستند.
در کشور ما، ذخایر غنی منیزیت در اورال میانه (Satkinskoye) و در منطقه Orenburg (Khalilovskoye) واقع شده است. و در منطقه شهر سولیکامسک، بزرگترین ذخایر کارنالیت در جهان در حال توسعه است. دولومیت، رایج ترین مواد معدنی حاوی منیزیم، در مناطق دونباس، مسکو و لنینگراد و بسیاری از نقاط دیگر یافت می شود.
فلز منیزیم به دو روش الکتروترمال (یا متالوترمیک) و الکترولیتی تولید می شود. همانطور که از نام ها پیداست، هر دو فرآیند شامل برق هستند. اما در حالت اول، نقش آن به گرم کردن دستگاه واکنش کاهش مییابد و اکسید منیزیم بهدستآمده از مواد معدنی با مقداری عامل کاهنده، به عنوان مثال، زغالسنگ، سیلیکون، آلومینیوم کاهش مییابد. این روش کاملا امیدوارکننده است و اخیراً به طور فزاینده ای مورد استفاده قرار گرفته است. با این حال، روش صنعتی اصلی برای تولید منیزیم روش دوم، الکترولیتی است.
الکترولیت مذابی از کلریدهای بی آب منیزیم، پتاسیم و سدیم است. منیزیم فلزی در کاتد آهن آزاد می شود و یون های کلر در آند گرافیت تخلیه می شوند. این فرآیند در حمام های مخصوص الکترولیز انجام می شود. منیزیم مذاب به سطح حمام شناور می شود و هر از چند گاهی با ملاقه خلاء از آنجا خارج می شود و سپس در قالب ها ریخته می شود. اما این روند به همین جا ختم نمی شود: هنوز ناخالصی های زیادی در چنین منیزیم وجود دارد. بنابراین، مرحله دوم اجتناب ناپذیر است - تصفیه منیزیم. منیزیم را می توان به دو روش تصفیه کرد - با ذوب مجدد و شار یا تصعید در خلاء. معنای روش اول کاملاً مشخص است: افزودنی های ویژه - شارها - با ناخالصی ها برهمکنش می کنند و آنها را به ترکیباتی تبدیل می کنند که به راحتی می توان از فلز به صورت مکانیکی جدا شد. روش دوم - تصعید خلاء - به تجهیزات پیچیده تری نیاز دارد، اما با کمک آن، منیزیم خالص تری به دست می آید. تصعید در دستگاه های خلاء ویژه - مخازن استوانه ای فولادی انجام می شود. فلز "زمخت" در پایین مخزن قرار می گیرد، بسته می شود و هوا به بیرون پمپ می شود. سپس قسمت پایینی رتور گرم می شود و قسمت بالایی به طور مداوم توسط هوای بیرون خنک می شود. تحت تأثیر دمای بالا، منیزیم تصعید می شود - به حالت گازی می رود و حالت مایع را دور می زند. بخار آن بر روی دیواره های سرد قسمت فوقانی توده بالا می رود و متراکم می شود. به این ترتیب می توان یک فلز بسیار خالص حاوی بیش از 99.99 درصد منیزیم به دست آورد.
از پادشاهی نپتون
اما نه تنها پوسته زمین سرشار از منیزیم است - ذخایر عملاً پایان ناپذیر و دائماً پر شده در انبارهای آبی اقیانوس ها و دریاها ذخیره می شود. هر متر مکعب آب دریا حدود 4 کیلوگرم منیزیم دارد. در مجموع بیش از 64016 تن از این عنصر در آب های اقیانوس های جهان حل شده است.
استخراج منیزیم
منیزیم چگونه از دریا بدست می آید؟ آب دریا در مخازن بزرگ با شیر آهک ساخته شده از پوسته های دریای زمین مخلوط می شود. این شیر به اصطلاح منیزیم تولید می کند که خشک شده و به کلرید منیزیم تبدیل می شود. خب، پس فرآیندهای الکترولیتی وارد عمل می شوند.
منبع منیزیم می تواند نه تنها آب دریا، بلکه آب دریاچه های نمک حاوی کلرید منیزیم باشد. ما چنین دریاچه هایی را در کشور خود داریم: در کریمه - ساکی و ساسیک-سیواش، در منطقه ولگا - دریاچه التون و بسیاری دیگر.
عنصر شماره 12 و اتصالات آن برای چه اهدافی استفاده می شود؟
منیزیم بسیار سبک است و این ویژگی می تواند آن را به یک ماده ساختمانی عالی تبدیل کند، اما افسوس که منیزیم خالص نرم و شکننده است. بنابراین طراحان از منیزیم به شکل آلیاژ با فلزات دیگر استفاده می کنند. آلیاژهای منیزیم با آلومینیوم، روی و منگنز به طور گسترده مورد استفاده قرار می گیرند. هر یک از اجزاء سهم خود را در خواص کلی دارند: آلومینیوم و روی استحکام آلیاژ را افزایش می دهند، منگنز مقاومت ضد خوردگی آن را افزایش می دهد. خوب، منیزیم چطور؟ منیزیم آلیاژ را سبک می کند - قطعات ساخته شده از آلیاژ منیزیم 20-30٪ سبک تر از آلومینیوم و 50-75٪ سبک تر از چدن و فولاد هستند... عناصر زیادی وجود دارند که آلیاژهای منیزیم را بهبود می بخشند، مقاومت حرارتی و شکل پذیری آنها را افزایش می دهند و آنها را در برابر اکسیداسیون مقاوم تر می کند. اینها لیتیوم، بریلیم، کلسیم، سریم، کادمیوم، تیتانیوم و غیره هستند.
موشک منیزیمی بلند نمی شود، اما...
اما، متأسفانه، "دشمنان" نیز وجود دارد - آهن، سیلیکون، نیکل. آنها خواص مکانیکی آلیاژها را بدتر می کنند و مقاومت در برابر خوردگی آنها را کاهش می دهند.
آلیاژهای منیزیم به طور گسترده مورد استفاده قرار می گیرند. فن آوری هوانوردی و جت، راکتورهای هسته ای، قطعات موتور، مخازن بنزین و نفت، ابزار، بدنه خودرو، اتوبوس، اتومبیل، چرخ، پمپ روغن، چکش چکش، مته های پنوماتیک، دوربین عکاسی و فیلم، دوربین دوچشمی - این لیست کاملی از کاربردها نیست. آلیاژهای منیزیم
منیزیم نقش مهمی در متالورژی دارد. به عنوان یک عامل کاهنده در تولید برخی از فلزات با ارزش - وانادیم، کروم، تیتانیوم، زیرکونیوم استفاده می شود. منیزیم وارد شده به چدن مذاب آن را اصلاح می کند، یعنی ساختار آن را بهبود می بخشد و خواص مکانیکی آن را افزایش می دهد. ریخته گری اصلاح شده آهن با موفقیت جایگزین آهنگری فولادی می شود. علاوه بر این، متالوژیست ها از منیزیم برای اکسید زدایی فولاد و آلیاژها استفاده می کنند.
خاصیت منیزیم (به شکل پودر، سیم یا نوار) - برای سوزاندن با شعله سفید و خیره کننده - به طور گسترده در تجهیزات نظامی برای ساخت فلرهای روشنایی و سیگنال، گلوله ها و گلوله های ردیاب و بمب های آتش زا استفاده می شود. عکاسان با منیزیم آشنا هستند: «آرام باش! دارم فیلم میگیرم!» - و یک برق درخشان از منیزیم شما را برای لحظه ای کور می کند. با این حال، منیزیم کمتر و کمتر این نقش را ایفا می کند - لامپ برقی "Blitz" تقریباً در همه جا جایگزین آن شده است.
کاربردهای منیزیم
و منیزیم در کار باشکوه دیگری دخیل است - انباشت انرژی خورشیدی. بخشی از کلروفیل است که انرژی خورشیدی را جذب می کند و با کمک آن دی اکسید کربن و آب را به مواد آلی پیچیده (قند، نشاسته و غیره) تبدیل می کند که برای تغذیه انسان و حیوانات ضروری است. بدون کلروفیل زندگی وجود نخواهد داشت و بدون منیزیم کلروفیل وجود نخواهد داشت - حاوی 2٪ از این عنصر است. آیا این خیلی زیاد است؟ خودتان قضاوت کنید: مقدار کل منیزیم موجود در کلروفیل تمام گیاهان روی زمین حدود 100 میلیارد تن است! عنصر شماره 12 نیز تقریباً در تمام موجودات زنده یافت می شود.
اگر 60 کیلوگرم وزن دارید، تقریباً 25 گرم از این مقدار منیزیم است. خدمات منیزیم به طور گسترده در پزشکی استفاده می شود: همه با "نمک اپسوم" MgSO 4 -7H 2 O آشنا هستند. هنگامی که به صورت خوراکی مصرف شود، به عنوان یک ملین قابل اطمینان و سریع عمل می کند، و هنگامی که به صورت عضلانی یا داخل وریدی تجویز شود، باعث تسکین آن می شود. شرایط تشنجی و کاهش اسپاسم عروقی. اکسید منیزیم خالص (منیزیم سوخته) برای افزایش اسیدیته شیره معده، سوزش سر دل و مسمومیت با اسید استفاده می شود. پراکسید منیزیم به عنوان یک ضد عفونی کننده برای اختلالات معده عمل می کند.
اما پزشکی به زمینه های کاربرد ترکیبات منیزیم محدود نمی شود. بنابراین از اکسید منیزیم در تولید سیمان، آجر نسوز و در صنعت لاستیک استفاده می شود. پراکسید منیزیم ("Novozon") برای سفید کردن پارچه ها استفاده می شود. سولفات منیزیم در صنایع نساجی و کاغذ به عنوان ماده رنگرزی و از محلول آبی کلرید منیزیم برای تهیه سیمان منیزیم، زایلولیت و سایر مواد مصنوعی استفاده می شود. کربنات منیزیم MgCO 3 در تولید مواد عایق حرارتی استفاده می شود.
و در نهایت، یکی دیگر از زمینه های گسترده فعالیت برای منیزیم، شیمی آلی است. پودر منیزیم برای آبگیری مواد آلی مهم مانند الکل و آنیلین استفاده می شود. ترکیبات ارگانومیزیم به طور گسترده در سنتز بسیاری از مواد آلی استفاده می شود.
بنابراین، فعالیت منیزیم در طبیعت و اقتصاد ملی بسیار چند وجهی است. اما کسانی که فکر می کنند: "او قبلاً هر کاری که می توانست انجام داده است" به سختی درست می گویند. دلایل زیادی وجود دارد که باور کنیم بهترین نقش منیزیم هنوز در راه است.
 محصولات حاوی منیزیم
محصولات حاوی منیزیم - مواد خام روی سنگفرش. در صورت تمایل، منیزیم را می توان حتی از ... سنگفرش های ساده استخراج کرد: به هر حال، هر کیلوگرم سنگی که برای سنگفرش جاده ها استفاده می شود، تقریباً 20 گرم منیزیم دارد. با این حال، هنوز نیازی به چنین فرآیندی وجود ندارد - منیزیم از سنگ جاده بسیار گران است.
- منیزیم، دوم و عصر. چه مقدار منیزیم در اقیانوس وجود دارد؟ بیایید تصور کنیم که از اولین روزهای عصر ما، مردم شروع به استخراج یکنواخت و فشرده منیزیم از آب دریا کردند و تا امروز تمام ذخایر آبی این عنصر را به پایان رسانده اند. به نظر شما "شدت" استخراج باید چقدر باشد؟ به نظر می رسد که در هر ثانیه برای تقریبا 2000 سال لازم است که ماینینگ انجام شود. میلیون تن! اما حتی در طول جنگ جهانی دوم که تولید این فلز به حداکثر خود رسیده بود، سالانه تنها 80 هزار تن منیزیم از آب دریا به دست می آمد (!).
- داروهای خوش طعم. آمارها نشان می دهد که ساکنان مناطق با آب و هوای گرم کمتر از ساکنان شمالی دچار اسپاسم عروق خونی می شوند. پزشکی این را با ویژگی های تغذیه ای هر دو توضیح می دهد. از این گذشته، مشخص است که انفوزیون داخل وریدی و عضلانی محلول های نمک های منیزیم خاص اسپاسم و گرفتگی عضلات را تسکین می دهد. میوه ها و سبزیجات به انباشته شدن ذخایر لازم این املاح در بدن کمک می کنند. زردآلو، هلو و گل کلم به ویژه سرشار از منیزیم هستند. همچنین در کلم معمولی، سیب زمینی و گوجه فرنگی یافت می شود.
- احتیاط آسیب ندهید. کار با آلیاژهای منیزیم گاهی اوقات باعث ایجاد مشکلات زیادی می شود - منیزیم به راحتی اکسید می شود. ذوب و ریخته گری این آلیاژها باید در زیر لایه ای از سرباره انجام شود - در غیر این صورت فلز مذاب ممکن است در اثر تماس با هوا آتش بگیرد.
هنگام سنگ زنی یا صیقل دادن محصولات منیزیمی، یک دستگاه مکش گرد و غبار باید بالای دستگاه نصب شود، زیرا ذرات ریز منیزیم پراکنده در هوا، یک مخلوط انفجاری ایجاد می کنند.
با این حال، این بدان معنا نیست که هر کاری با منیزیم مملو از خطر آتش سوزی یا انفجار است. شما می توانید منیزیم را فقط با ذوب کردن آن آتش بزنید، و این کار در شرایط عادی چندان آسان نیست - رسانایی حرارتی بالای آلیاژ اجازه نمی دهد کبریت یا حتی مشعل محصولات ریخته گری را به پودر اکسید سفید تبدیل کند. اما تراشه ها یا نوار حرارتی منیزیمی واقعاً باید با دقت بسیار مورد استفاده قرار گیرند.
- شما مجبور نخواهید بود منتظر بمانید. لولههای رادیویی معمولی تنها پس از گرم شدن شبکههای آنها تا دمای 800 درجه سانتیگراد شروع به کار میکنند. هر بار که رادیو یا تلویزیون را روشن می کنید، باید کمی صبر کنید تا موسیقی شروع به پخش کند یا صفحه آبی سوسو بزند. برای از بین بردن این نقص لوله های رادیویی، دانشمندان لهستانی از گروه مهندسی برق دانشگاه صنعتی Wroclaw پوشش کاتد لامپ ها را با MgO پیشنهاد کردند: چنین لامپ هایی بلافاصله پس از روشن شدن شروع به کار می کنند.
- مشکل پوسته تخم مرغ چندین سال پیش، دانشمندان دانشگاه مینهسوتا در ایالات متحده، پوسته تخممرغ را به عنوان موضوعی برای تحقیقات علمی انتخاب کردند. آنها توانستند ثابت کنند که هر چه منیزیم بیشتر باشد، پوسته قوی تر است. به این معنی که با تغییر ترکیب خوراک مرغ های تخمگذار می توان استحکام پوسته را افزایش داد. اهمیت این نتیجه گیری برای کشاورزی را می توان با ارقام زیر قضاوت کرد: تنها در مینه سوتا، خسارات سالانه ناشی از جنگ تخم مرغ بیش از یک میلیون دلار است. هیچ کس در اینجا نخواهد گفت که این کار دانشمندان "ارزش لعنتی" را ندارد.
- منیزیم و... سکته قلبی. آزمایشهایی که توسط دانشمندان مجارستانی بر روی حیوانات انجام شد نشان داد که کمبود منیزیم در بدن استعداد ابتلا به حملات قلبی را افزایش میدهد. به برخی از سگ ها غذای غنی از نمک های این عنصر داده شد، برخی دیگر - فقیر. در پایان آزمایش، سگ هایی که رژیم غذایی آنها منیزیم کمی داشت، دچار انفارکتوس میوکارد شدند.
- مراقب منیزیم باشید! زیست شناسان فرانسوی معتقدند که منیزیم به پزشکان در مبارزه با بیماری جدی قرن بیستم مانند کار بیش از حد کمک می کند. مطالعات نشان می دهد که خون افراد خسته حاوی منیزیم کمتری نسبت به افراد سالم است و حتی ناچیزترین انحرافات "خون منیزیم" از هنجار بدون ردی از بین نمی رود.
لازم به یادآوری است که در مواردی که فرد اغلب به هر دلیلی تحریک می شود، منیزیم موجود در بدن "سوخته می شود". به همین دلیل است که در افراد عصبی و به راحتی تحریک پذیر، اختلالات در عملکرد عضلات قلب بیشتر مشاهده می شود.
- منیزیم کربنیک و اکسیژن مایع. ظروف بزرگ برای نگهداری اکسیژن مایع معمولاً به شکل یک استوانه یا توپ ساخته می شوند تا از اتلاف گرما کاسته شود. اما یک شکل ذخیره سازی به خوبی انتخاب شده همه چیز نیست. عایق حرارتی قابل اعتماد مورد نیاز است. برای این منظور، می توانید از یک خلاء عمیق (مانند فلاسک Dewar) استفاده کنید، می توانید از پشم معدنی استفاده کنید، اما اغلب پودر کربنات منیزیم شل بین دیواره های داخلی و خارجی انبار ریخته می شود. این عایق حرارتی هم ارزان و هم قابل اعتماد است.
منیزیم
منیزیم-من؛ متر[لات. منیزیم] عنصر شیمیایی (Mg)، فلزی سبک و چکشخوار به رنگ سفید نقرهای که با شعلهی روشن سفید میسوزد. اکسید منیزیم. فلر منیزیم.
◁ منیزیم، اوه، اوه. سنگ معدن M. آلیاژ M.
منیزیم(لات. منیزیم)، عنصر شیمیایی گروه دوم از سیستم تناوبی. نام از novolat. magnesia - منیزیم. فلز نقره ای، بسیار سبک و بادوام؛ چگالی 1.74 گرم بر سانتی متر 3، تی pl 650 درجه سانتی گراد. در هوا با یک فیلم اکسید محافظ پوشیده می شود. براده های ریز مشتعل شده و پودر منیزیم با شعله سفید روشن می سوزند. از نظر شیوع در پوسته زمین، در بین عناصر (مواد معدنی منیزیت، دولومیت، کارنالیت) رتبه 8 را دارد. به طور عمده در تولید آلیاژهای سبک، برای اکسید زدایی و گوگردزدایی از فلزات خاص، برای احیای Hf، Ti، U، Zr و سایر فلزات از ترکیبات (متالوترمی)، به عنوان جزء روشنایی و ترکیبات آتش زا برای پرتابه ها استفاده می شود. و موشک ها
منیزیممنیزیم (لات. منیزیم)، منیزیم (بخوانید منیزیم)، عنصر شیمیایی گروه IIA دوره سوم سیستم تناوبی مندلیف (سانتی متر.سیستم دوره ای عناصر مندلیف)، عدد اتمی 12، جرم اتمی 24.305. منیزیم طبیعی از سه هسته پایدار تشکیل شده است (سانتی متر. NUCLIDE): 24 میلی گرم (60/78 درصد وزنی)، 25 میلی گرم (11/10 درصد) و 26 میلی گرم (29/11 درصد). پیکربندی الکترونیکی یک اتم خنثی 1s 2
2 ثانیه 2
پ 6
3s 2
که بر اساس آن منیزیم در ترکیبات پایدار دو ظرفیتی است (حالت اکسیداسیون +2). ماده ساده منیزیم فلزی سبک، نقره ای-سفید و براق است.
تاریخچه کشف
ترکیبات منیزیم از دیرباز برای انسان شناخته شده است. نام لاتین عنصر از نام شهر باستانی مگنزیا در آسیای صغیر گرفته شده است که در مجاورت آن ذخایر معدنی منیزیت وجود دارد. (سانتی متر.مگنزیت). منیزیم فلزی اولین بار در سال 1808 توسط شیمیدان انگلیسی G. Davy به دست آمد (سانتی متر.دیوی همفری). مانند سایر فلزات فعال - سدیم، پتاسیم، کلسیم، دیوی از الکترولیز برای به دست آوردن منیزیم فلزی استفاده کرد. او الکترولیز را به مخلوط مرطوب شده منیزیم سفید (ترکیب آن، ظاهراً شامل اکسید منیزیم MgO و هیدروکسید منیزیم Mg(OH) 2) و اکسید جیوه HgO قرار داد. در نتیجه، دیوی یک آمالگام - آلیاژ یک فلز جدید با جیوه - دریافت کرد. پس از تقطیر جیوه، پودر فلز جدیدی باقی ماند که دیوی آن را منیزیم نامید.
منیزیم به دست آمده توسط دیوی نسبتاً کثیف بود؛ منیزیم خالص فلزی اولین بار در سال 1828 توسط شیمیدان فرانسوی A. Bussy به دست آمد.
بودن در طبیعت
منیزیم یکی از ده عنصر رایج در پوسته زمین است. حاوی 2.35 درصد وزنی منیزیم است. منیزیم به دلیل فعالیت شیمیایی بالایی که دارد به صورت آزاد یافت نمی شود، اما در بسیاری از مواد معدنی - سیلیکات ها، آلومینوسیلیکات ها، کربنات ها، کلریدها، سولفات ها و غیره وجود دارد. بنابراین، منیزیم در سیلیکات های الیوین گسترده وجود دارد. (سانتی متر.اولیوین)(Mg,Fe) 2 و سرپانتین (سانتی متر.سرپنتین) Mg6(OH)8. مواد معدنی حاوی منیزیم مانند آزبست از اهمیت عملی برخوردار هستند (سانتی متر.آزبست (معدنی))، منیزیت (سانتی متر.مگنزیت)، دولومیت (سانتی متر.دولومیت) MgCO 3 CaCO 3، بیشوفیت (سانتی متر. BISCHOFIT) MgCl 2 6H 2 O، کارنالیت (سانتی متر.کارنالیت) KCl MgCl 2 6H 2 O، اپسومیت (سانتی متر. EPSOMIT) MgSO 4 7H 2 O، کاینیت (سانتی متر. KAINIT) KCl·MgSO 4 · 3H 2 O، استراخانیت Na 2 SO 4 · MgSO 4 · 4H 2 O، و غیره. منیزیم در آب دریا (4٪ Mg در باقیمانده خشک)، در آب نمک های طبیعی و در بسیاری از آب های زیرزمینی یافت می شود.
اعلام وصول
روش معمول صنعتی برای تولید فلز منیزیم، الکترولیز مذاب مخلوطی از کلریدهای منیزیم بی آب MgCl 2، سدیم NaCl و پتاسیم KCl است. در این مذاب، کلرید منیزیم تحت کاهش الکتروشیمیایی قرار می گیرد:
MgCl 2 (الکترولیز) = Mg + Cl 2.
فلز مذاب به طور دوره ای از حمام الکترولیز خارج می شود و بخش های جدیدی از مواد خام حاوی منیزیم به آن اضافه می شود. از آنجایی که منیزیم به دست آمده از این طریق حاوی ناخالصی های نسبتاً زیادی است - حدود 0.1٪، در صورت لزوم، منیزیم "خام" در معرض تصفیه اضافی قرار می گیرد. برای این منظور، از پالایش الکترولیتی استفاده می شود، ذوب در خلاء با استفاده از افزودنی های ویژه - شارها، که ناخالصی ها را از منیزیم "حذف" می کند، یا تقطیر (تععید) فلز در خلاء. خلوص منیزیم تصفیه شده به 99.999 درصد و بالاتر می رسد.
روش دیگری برای به دست آوردن منیزیم ایجاد شده است - حرارتی. در این مورد، کک برای کاهش اکسید منیزیم در دمای بالا استفاده می شود:
MgO + C = Mg + CO
یا سیلیکون استفاده از سیلیکون امکان به دست آوردن منیزیم از مواد خام مانند دولومیت CaCO 3 · MgCO 3 را بدون جداسازی اولیه منیزیم و کلسیم ممکن می سازد. واکنش های زیر با مشارکت دولومیت رخ می دهد:
CaCO 3 MgCO 3 = CaO + MgO + 2CO 2،
2MgO + 2CaO + Si = Ca 2 SiO 4 + 2Mg.
مزیت روش حرارتی این است که به فرد اجازه می دهد منیزیم با خلوص بالاتر را بدست آورد. برای به دست آوردن منیزیم، نه تنها از مواد خام معدنی، بلکه از آب دریا نیز استفاده می شود.
خواص فیزیکی و شیمیایی
فلز منیزیم دارای یک شبکه کریستالی شش ضلعی است. نقطه ذوب 650 درجه سانتی گراد، نقطه جوش 1105 درجه سانتی گراد، چگالی 1.74 گرم بر سانتی متر مکعب (منیزیم یک فلز بسیار سبک است، فقط کلسیم و فلزات قلیایی سبک تر هستند. (سانتی متر.فلزات قلیایی)). پتانسیل استاندارد الکترود منیزیم Mg/Mg 2+ 2.37- ولت است. در سری پتانسیل استاندارد پشت سدیم و در مقابل آلومینیوم قرار دارد.
سطح منیزیم با یک فیلم متراکم از اکسید MgO پوشیده شده است که در شرایط عادی به طور قابل اعتمادی فلز را از تخریب بیشتر محافظت می کند. تنها زمانی که فلز تا دمای بالاتر از حدود 600 درجه سانتیگراد گرم شود، در هوا مشتعل می شود. منیزیم با تابش نور روشن می سوزد که ترکیب طیفی آن نزدیک به خورشید است. بنابراین در گذشته عکاسان در شرایط کم نور، در نور یک نوار منیزیم در حال سوختن عکاسی می کردند. هنگامی که منیزیم در هوا می سوزد، پودر سفید شل اکسید منیزیم MgO تشکیل می شود:
2Mg + O 2 = 2MgO.
نیترید منیزیم Mg 3 N 2 نیز به طور همزمان با اکسید تشکیل می شود:
3Mg + N2 = Mg3N2.
منیزیم با آب سرد واکنش نمی دهد (یا به طور دقیق تر، واکنش نشان می دهد، اما بسیار آهسته)، اما با آب گرم واکنش نشان می دهد، و یک رسوب سفید شل از هیدروکسید منیزیم Mg(OH) 2 تشکیل می شود:
Mg + 2H 2 O = Mg(OH) 2 + H 2.
اگر نوار منیزیم را آتش بزنید و در یک لیوان آب قرار دهید، فلز به سوختن ادامه می دهد. در این حالت هیدروژن آزاد شده در اثر برهمکنش منیزیم با آب بلافاصله در هوا مشتعل می شود. احتراق منیزیم در اتمسفر دی اکسید کربن ادامه می یابد:
2Mg + CO 2 = 2MgO + C.
توانایی منیزیم برای سوختن هم در آب و هم در فضای دی اکسید کربن به طور قابل توجهی خاموش کردن آتش را که در آن ساختارهای ساخته شده از منیزیم یا آلیاژهای آن می سوزند، پیچیده می کند. (سانتی متر.اکسید منیزیم)
اکسید منیزیم (سانتی متر.اکسید منیزیم) MgO یک پودر شکننده سفید است که با آب واکنش نمی دهد. قبلاً به آن منیزیای سوخته یا به سادگی منیزیا می گفتند. این اکسید دارای خواص اساسی است، با اسیدهای مختلف واکنش می دهد، به عنوان مثال:
MgO + 2HNO 3 = Mg(NO 3) 2 + H 2 O.
پایه مربوط به این اکسید، Mg(OH) 2، دارای استحکام متوسط است، اما عملاً در آب نامحلول است. می توان آن را به عنوان مثال با افزودن قلیایی به محلول هر نمک منیزیم به دست آورد:
2NaOH + MgSO 4 = Mg(OH) 2 + Na 2 SO 4.
از آنجایی که اکسید منیزیم MgO هنگام برهمکنش با آب قلیایی تشکیل نمی دهد و پایه منیزیم Mg(OH) 2 خاصیت قلیایی ندارد، منیزیم برخلاف "رفقای" خود - کلسیم، استرانسیوم و باریم، یک فلز خاکی قلیایی نیست.
فلز منیزیم در دمای اتاق با هالوژن ها واکنش می دهد، به عنوان مثال با برم:
Mg + Br 2 = MgBr 2.
هنگام گرم شدن، منیزیم با گوگرد واکنش می دهد و سولفید منیزیم می دهد:
Mg + S = MgS.
اگر مخلوطی از منیزیم و کک در یک اتمسفر بی اثر کلسینه شود، کاربید منیزیم از ترکیب Mg 2 C 3 تشکیل می شود (لازم به ذکر است که نزدیکترین همسایه منیزیم در گروه - کلسیم - در شرایط مشابه یک کاربید از منیزیم را تشکیل می دهد. ترکیب CaC 2). هنگامی که کاربید منیزیم با آب تجزیه می شود، یک همولوگ استیلن تشکیل می شود - پروپین C 3 H 4:
Mg 2 C 3 + 4H 2 O = 2Mg(OH) 2 + C 3 H 4.
بنابراین، Mg 2 C 3 را می توان پروپیلن منیزیم نامید.
رفتار منیزیم شبیه رفتار فلز قلیایی لیتیوم است (سانتی متر.لیتیوم)(نمونه ای از شباهت قطری عناصر در جدول تناوبی). بنابراین، منیزیم، مانند لیتیوم، با نیتروژن واکنش می دهد (واکنش منیزیم با نیتروژن هنگام گرم شدن رخ می دهد)، و در نتیجه نیترید منیزیم تشکیل می شود:
3Mg + N2 = Mg3N2.
مانند نیترید لیتیوم، نیترید منیزیم به راحتی توسط آب تجزیه می شود:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3.
منیزیم شبیه لیتیوم است زیرا کربنات MgCO 3 و فسفات Mg 3 (PO 4) 2 آن مانند نمک های لیتیوم مربوطه در آب محلول اندکی هستند.
منیزیم شبیه کلسیم است که وجود هیدروکربنات های محلول این عناصر در آب، سختی آب را تعیین می کند. (سانتی متر.سختی آب). همانطور که در مورد بی کربنات کلسیم (به هنر مراجعه کنید. بهالسیم (سانتی متر.کلسیم)سختی ناشی از بی کربنات منیزیم Mg(HCO 3) 2 موقتی است. هنگام جوشاندن، بی کربنات منیزیم Mg(HCO 3) 2 تجزیه می شود و کربنات اصلی آن، منیزیم هیدروکسی کربنات (MgOH) 2 CO 3، رسوب می کند:
2Mg(HCO 3) 2 = (MgOH) 2 CO 3 + 3CO 2 + H 2 O.
پرکلرات منیزیم Mg(ClO 4) 2 که از نظر انرژی با بخار آب برهمکنش می کند و در خشک کردن هوا یا سایر گازهای عبوری از لایه آن خوب است، هنوز کاربرد عملی دارد. در این حالت یک هیدرات کریستالی قوی Mg(ClO 4) 2 6H 2 O تشکیل می شود که این ماده را می توان با حرارت دادن در خلاء در دمای حدود 300 درجه سانتی گراد دوباره آبگیری کرد. پرکلرات منیزیم به دلیل خاصیت خشک کنندگی انیدرون نامیده می شود.
ترکیبات ارگانومیزیم در شیمی آلی اهمیت زیادی دارند. (سانتی متر.ترکیبات آلی منیزیم)، حاوی پیوند Mg-C. نقش مهمی در میان آنها به اصطلاح معرف Grignard ایفا می کند - ترکیبات منیزیم با فرمول عمومی RMgHal، که در آن R یک رادیکال آلی است، و Hal = Cl، Br یا I. این ترکیبات در محلول های اتری توسط برهمکنش تشکیل می شوند. منیزیم و هالوژن آلی مربوطه RHal و برای انواع مختلف سنتز استفاده می شود.
کاربرد
بخش عمده ای از منیزیم استخراج شده برای تولید آلیاژهای مختلف منیزیم سبک استفاده می شود. ترکیب این آلیاژها علاوه بر منیزیم، معمولاً شامل آلومینیوم، روی و زیرکونیوم است. چنین آلیاژهایی کاملاً قوی هستند و در ساخت هواپیما، ساخت ابزار و برای اهداف دیگر استفاده می شوند.
فعالیت شیمیایی بالای منیزیم فلزی امکان استفاده از آن را در تولید حرارتی منیزیم فلزاتی مانند تیتانیوم، زیرکونیوم، وانادیم، اورانیوم و غیره می دهد. در این حالت، منیزیم با اکسید یا فلوراید فلز حاصل واکنش می دهد، به عنوان مثال :
2Mg + TiO 2 = 2MgO + Ti.
2Mg + UF 4 = 2MgF 2 + U.
بسیاری از ترکیبات منیزیم به ویژه اکسید، کربنات و سولفات آن به طور گسترده استفاده می شود.
نقش بیولوژیکی منیزیم
منیزیم یک عنصر بیوژنیک است (سانتی متر.عناصر بیوژنیک)، به طور مداوم در بافت های همه موجودات وجود دارد. این بخشی از مولکول رنگدانه سبز گیاهان - کلروفیل است. (سانتی متر.کلروفیل)در متابولیسم مواد معدنی شرکت می کند، فرآیندهای آنزیمی را در بدن فعال می کند، مقاومت گیاهان به خشکی را افزایش می دهد. بیولومینسانس با مشارکت یونهای Mg + رخ می دهد (سانتی متر.بیولومینسانس)و تعدادی از فرآیندهای بیولوژیکی دیگر. کودهای منیزیم - آرد دولومیت، منیزیم سوخته و غیره - به طور گسترده در عمل استفاده می شوند.
منیزیم با غذا وارد بدن حیوانات و انسان می شود. نیاز روزانه انسان به منیزیم 0.3-0.5 گرم است بدن یک فرد متوسط (وزن بدن 70 کیلوگرم) حدود 19 گرم منیزیم دارد. اختلالات متابولیسم منیزیم منجر به بیماری های مختلفی می شود. آماده سازی منیزیم در پزشکی استفاده می شود - سولفات آن، کربنات، منیزیم سوخته.
فرهنگ لغت دایره المعارفی. 2009 .
مترادف ها:ببینید "منیزیم" در فرهنگ های دیگر چیست:
- (لات جدید magnium، از lat. magnesia). فلزی نقره ای رنگ که پایه منیزیا را تشکیل می دهد. فرهنگ لغات کلمات خارجی موجود در زبان روسی. Chudinov A.N., 1910. منیزیم یک فلز براق به رنگ سفید نقره ای است که به رنگ سفید بسیار روشن می سوزد... ... فرهنگ لغت کلمات خارجی زبان روسی
- (منیزیم)، منیزیم، عنصر شیمیایی گروه دوم جدول تناوبی، عدد اتمی 12، جرم اتمی 24.305; به فلزات قلیایی خاکی اشاره دارد. دمای ذوب 650 درجه سانتیگراد بخشی از کلروفیل منیزیم جزء آلیاژها، روشنایی و آتش زا است... دایره المعارف مدرن
- (نماد Mg)، عنصر فلزی به رنگ سفید نقره ای، یکی از فلزات قلیایی زمین. هشتمین عنصر فراوان در پوسته زمین. اولین بار در سال 1808 توسط هامفری دیوی جدا شد. در تغذیه انسان و دام ضروری است. منیزیم همیشه ... فرهنگ دانشنامه علمی و فنی
منیزیم- (منیزیم)، منیزیم، عنصر شیمیایی گروه دوم جدول تناوبی، عدد اتمی 12، جرم اتمی 24.305; به فلزات قلیایی خاکی اشاره دارد. نقطه ذوب 650 درجه سانتی گراد بخشی از کلروفیل منیزیم جزء آلیاژها، روشنایی و آتش زا است... فرهنگ لغت دایره المعارف مصور
منیزیم، رجوع به منیزیم شود. فرهنگ توضیحی دال. در و. دال. 1863 1866 … فرهنگ توضیحی دال
- (lat. Magnesium) Mg، عنصر شیمیایی گروه دوم سیستم تناوبی، عدد اتمی 12، جرم اتمی 24.305. نام از لاتین جدید magnesia magnesia است. فلز نقره ای، بسیار سبک و بادوام؛ چگالی 1.74 g/cm³، نقطه ذوب 650.C. در …… فرهنگ لغت دایره المعارفی بزرگ
Mg (lat. Magnesium * a. magnesium; n. Magnesium; f. magnesium; i. magnesio)، شیمیایی. عنصر دوره ای گروه دوم سیستم مندلیف، در. n 12، در. m. 24.312. طبیعی M. از مخلوطی از ایزوتوپ های پایدار 24Mg (78.6%)، 25Mg (10.11%) و ... تشکیل شده است. دایره المعارف زمین شناسی
منیزیم عنصری از زیر گروه اصلی گروه دوم، دوره سوم جدول تناوبی عناصر شیمیایی، با عدد اتمی 12 است که با نماد Mg (لات. منیزیم) نشان داده می شود. ماده ساده منیزیم (شماره CAS: 7439-95-4) فلزی سبک و چکش خوار به رنگ نقره ای-سفید است. در طبیعت نسبتاً گسترده است. هنگام سوختن مقدار زیادی نور و گرما آزاد می شود.
منشاء نام
در سال 1695 نمک از آب معدنی چشمه اپسوم در انگلستان جدا شد که طعم تلخ و خاصیت ملین داشت. داروسازان آن را نمک تلخ و همچنین نمک اپسوم یا اپسوم نامیدند. اپسومیت معدنی دارای ترکیب MgSO 4 · 7H 2 O است. نام لاتین عنصر از نام شهر باستانی مگنزیا در آسیای صغیر گرفته شده است که در مجاورت آن ذخایر معدنی منیزیت وجود دارد.
اولین بار توسط سر همفری دیوی در سال 1808 به شکل خالص آن جدا شد.
اعلام وصول
روش معمول صنعتی برای تولید فلز منیزیم، الکترولیز مذاب مخلوطی از کلریدهای منیزیم بی آب MgCl 2 (بیشوفیت)، سدیم NaCl و پتاسیم KCl است. کلرید منیزیم در مذاب تحت کاهش الکتروشیمیایی قرار می گیرد:
MgCl 2 (الکترولیز) = Mg + Cl 2.
فلز مذاب به طور دوره ای از حمام الکترولیز خارج می شود و بخش های جدیدی از مواد خام حاوی منیزیم به آن اضافه می شود. از آنجایی که منیزیم به دست آمده از این طریق حاوی ناخالصی های نسبتاً زیادی (حدود 0.1٪) است، در صورت لزوم، منیزیم "خام" در معرض تصفیه اضافی قرار می گیرد. برای این منظور از تصفیه الکترولیتی، ذوب در خلاء با استفاده از مواد افزودنی خاص - شارها که ناخالصی ها را از منیزیم "حذف می کند" یا تقطیر (تععید) فلز در خلاء استفاده می شود. خلوص منیزیم تصفیه شده به 99.999 درصد و بالاتر می رسد.
روش دیگری برای به دست آوردن منیزیم ایجاد شده است - حرارتی. در این مورد، سیلیکون یا کک برای کاهش اکسید منیزیم در دماهای بالا استفاده می شود:
MgO + C = Mg + CO
استفاده از سیلیکون امکان به دست آوردن منیزیم از مواد خام مانند دولومیت CaCO 3 · MgCO 3 را بدون جداسازی اولیه منیزیم و کلسیم ممکن می سازد. واکنش های زیر با مشارکت دولومیت رخ می دهد:
CaCO 3 MgCO 3 = CaO + MgO + 2CO 2،
2MgO + CaO + Si = CaSiO 3 + 2Mg.
مزیت روش حرارتی این است که به فرد اجازه می دهد منیزیم با خلوص بالاتر را بدست آورد. برای به دست آوردن منیزیم، نه تنها از مواد خام معدنی، بلکه از آب دریا نیز استفاده می شود.
مشخصات فیزیکی
منیزیم فلزی به رنگ سفید نقره ای با شبکه شش ضلعی، گروه فضایی P 6 3 / mmc است. در شرایط عادی، سطح منیزیم با یک فیلم محافظ بادوام از اکسید منیزیم MgO پوشانده میشود که با حرارت دادن در هوا تا دمای تقریبی 600 درجه سانتیگراد از بین میرود و پس از آن فلز با شعله سفید کورکننده میسوزد و اکسید منیزیم و نیترید Mg را تشکیل میدهد. 3 N 2. چگالی منیزیم در دمای 20 درجه سانتی گراد 1.737 گرم بر سانتی متر مکعب است، نقطه ذوب فلز t pl = 651 درجه سانتی گراد، نقطه جوش t جوش = 1103 درجه سانتی گراد، هدایت حرارتی در 20 درجه سانتی گراد 156 وات است. (m K). منیزیم با خلوص بالا انعطاف پذیر است، به راحتی فشرده می شود، نورد می شود و قابل برش است.
خواص شیمیایی
مخلوطی از پودر منیزیم با پرمنگنات پتاسیم KMnO 4 یک ماده منفجره است.
منیزیم داغ با آب واکنش می دهد:
Mg (اعلام شده) + H 2 O = MgO + H 2;
قلیاها بر منیزیم تأثیر نمی گذارند، به راحتی در اسیدها حل می شود و هیدروژن آزاد می کند:
Mg + 2HCl = MgCl 2 + H 2;
هنگامی که در هوا گرم می شود، منیزیم می سوزد و اکسید می شود؛ مقدار کمی نیترید نیز می تواند با نیتروژن تشکیل شود:
2Mg + O 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
ترکیبات منیزیم از دیرباز برای انسان شناخته شده است. مگنزیت (به یونانی Magnhsia oliqV) یک ماده معدنی نرم، سفید و صابونی (سنگ صابون یا تالک) بود که در منطقه Magnesia در تسالی یافت شد. وقتی این ماده معدنی کلسینه شد، پودر سفید رنگی به دست آمد که به منیزیم سفید معروف شد.
در سال 1695، N. Gro با تبخیر آب معدنی چشمه Epsom (انگلستان)، نمکی به دست آورد که طعم تلخ و اثر ملین داشت (MgSO 4 · 7H 2 O). چند سال بعد مشخص شد که این نمک هنگام تعامل با سودا یا پتاس، پودر سفید و شلی را تشکیل می دهد، همان پودری که هنگام کلسینه شدن منیزیت ایجاد می شود.
در سال 1808، هامفری دیوی، شیمیدان و فیزیکدان انگلیسی، با الکترولیز منیزیم سفید کمی مرطوب شده با اکسید جیوه به عنوان کاتد، ملغمه ای از فلز جدیدی را به دست آورد که قادر به تشکیل منیزیم سفید بود. به آن منیزیم می گفتند. دیوی فلز آلوده را بدست آورد و منیزیم خالص تنها در سال 1829 توسط شیمیدان فرانسوی Antoine Bussy (1794-1882) جدا شد.
توزیع منیزیم در طبیعت و استخراج صنعتی آن.
منیزیم در سنگ های کریستالی به شکل کربنات ها یا سولفات های نامحلول و همچنین (به شکل کمتر در دسترس) به شکل سیلیکات یافت می شود. برآورد محتوای کل آن به طور قابل توجهی به مدل ژئوشیمیایی مورد استفاده، به ویژه، به نسبت وزن سنگ های آتشفشانی و رسوبی بستگی دارد. در حال حاضر از مقادیر 2 تا 13.3 درصد استفاده می شود. شاید معقول ترین مقدار 2.76 درصد باشد که منیزیم را از نظر فراوانی در رتبه ششم بعد از کلسیم (4.66 درصد) و بالاتر از سدیم (2.27 درصد) و پتاسیم (1.84 درصد) قرار می دهد.
زمین های بزرگ مانند دولومیت ها در ایتالیا عمدتاً از دولومیت معدنی MgCa (CO 3) 2 تشکیل شده است. همچنین کانیهای رسوبی منیزیت MgCO 3، اپزومیت MgSO 4 · 7H 2 O، کارنالیت K 2 MgCl 4 · 6H 2 O، لنگبینیت K 2 Mg 2 (SO 4) 3 وجود دارد.
ذخایر دولومیت در بسیاری از مناطق دیگر از جمله مناطق مسکو و لنینگراد وجود دارد. ذخایر غنی از منیزیت در اورال میانه و در منطقه اورنبورگ یافت شد. بزرگترین ذخایر کارنالیت در منطقه سولیکامسک در حال توسعه است. سیلیکات های منیزیم توسط کانی بازالت الیوین (Mg,Fe) 2 (SiO 4)، سنگ صابون (تالک) Mg 3 Si 4 O 10 (OH) 2، آزبست (کریزوتیل) Mg 3 Si 2 O 5 (OH) 4 و میکا اسپینل MgAl 2 O 4 متعلق به سنگ های قیمتی است.
مقدار زیادی منیزیم در آب های دریاها و اقیانوس ها و در آب نمک های طبیعی یافت می شود. سانتی متر. شیمی هیدروسفر). در برخی از کشورها، آنها مواد اولیه برای تولید منیزیم هستند. از نظر محتوای عنصر فلزی در آب دریا، پس از سدیم در رتبه دوم قرار دارد. هر متر مکعب آب دریا حدود 4 کیلوگرم منیزیم دارد. منیزیم نیز در آب شیرین یافت می شود که همراه با کلسیم سختی آن را تعیین می کند.
منیزیم همیشه در گیاهان یافت می شود، زیرا بخشی از کلروفیل است.
مشخصات مواد ساده و تولید صنعتی منیزیم فلزی.
منیزیم فلزی براق سفید نقره ای، نسبتاً نرم، انعطاف پذیر و چکش خوار است. استحکام و سختی آن در نمونههای ریختهگری حداقل و برای نمونههای فشرده بالاتر است.
در شرایط عادی، منیزیم به دلیل تشکیل یک فیلم اکسید قوی در برابر اکسیداسیون مقاوم است. با این حال، به طور فعال با اکثر غیر فلزات، به ویژه هنگامی که گرم می شود، واکنش نشان می دهد. منیزیم در حضور هالوژن ها (در مجاورت رطوبت) مشتعل می شود و هالیدهای مربوطه را تشکیل می دهد و با شعله ای درخشان در هوا می سوزد و به اکسید MgO و نیترید Mg 3 N 2 تبدیل می شود.
2Mg (k) + O 2 (g) = 2MgO (k) ; DG° = -1128 kJ/mol
3Mg (k) + N 2 (t) = Mg 3 N 2 (k); DG° = -401 کیلوژول بر مول
با وجود نقطه ذوب پایین (650 درجه سانتیگراد)، ذوب منیزیم در هوا غیرممکن است.
هنگامی که در معرض هیدروژن تحت فشار 200 اتمسفر در دمای 150 درجه سانتیگراد قرار می گیرد، منیزیم هیدرید MgH 2 را تشکیل می دهد. منیزیم با آب سرد واکنش نشان نمی دهد، اما هیدروژن را از آب در حال جوش خارج می کند و هیدروکسید Mg(OH) 2 را تشکیل می دهد:
Mg + 2H 2 O = Mg(OH) 2 + H 2
در پایان واکنش، مقدار pH (10.3) محلول اشباع هیدروکسید منیزیم به تعادل مربوط می شود:
در مورد دوم، مخلوط حاصل از مونوکسید کربن و بخار منیزیم باید به سرعت با یک گاز بی اثر خنک شود تا از واکنش معکوس جلوگیری شود.
تولید جهانی منیزیم به 400 هزار تن در سال نزدیک می شود. تولیدکنندگان اصلی ایالات متحده آمریکا (43٪)، کشورهای CIS (26٪) و نروژ (17٪) هستند. در سال های اخیر، چین صادرات منیزیم خود را به شدت افزایش داده است. در روسیه، یکی از بزرگترین تولیدکنندگان منیزیم، کارخانه تیتانیوم منیزیم در برزنیکی (منطقه پرم) و کارخانه منیزیم سولیکامسک است. تولید منیزیم نیز در شهر آزبست در حال انجام است.
منیزیم سبک ترین ماده ساختاری مورد استفاده در مقیاس صنعتی است. چگالی آن (1.7 گرم در سانتی متر 3) کمتر از دو سوم آلومینیوم است. آلیاژهای منیزیم چهار برابر کمتر از فولاد وزن دارند. علاوه بر این، منیزیم قابلیت ماشینکاری بالایی دارد و می توان با استفاده از هر روش استاندارد فلزکاری (نورد، مهر زنی، کشیدن، آهنگری، جوش، لحیم کاری، پرچ) ریخته گری و دوباره کار کرد. بنابراین کاربرد اصلی آن به عنوان یک فلز ساختاری سبک وزن است.
آلیاژهای منیزیم معمولاً حاوی بیش از 90٪ منیزیم، و همچنین 2-9٪ آلومینیوم، 1-3٪ روی و 0.2-1٪ منگنز هستند. حفظ استحکام در دماهای بالا (تا 450 درجه سانتیگراد) هنگامی که با فلزات خاکی کمیاب (مثلاً پرازئودیمیم و نئودیمیم) یا توریم آلیاژ شود، به طرز چشمگیری بهبود می یابد. این آلیاژها را می توان برای محفظه موتور خودرو و همچنین بدنه هواپیما و ارابه فرود استفاده کرد. منیزیم نه تنها در هوانوردی، بلکه در ساخت پلهها، اسکلهها، سکوهای بار، نوار نقالهها و بالابرها و همچنین در تولید تجهیزات عکاسی و نوری استفاده میشود.
برای بهبود خواص مکانیکی، جوش پذیری و مقاومت در برابر خوردگی تا 5 درصد منیزیم به آلومینیوم صنعتی اضافه می شود. منیزیم همچنین برای محافظت کاتدی سایر فلزات در برابر خوردگی، به عنوان یک جاذب اکسیژن و عامل کاهش دهنده در تولید بریلیم، تیتانیوم، زیرکونیوم، هافنیوم و اورانیوم استفاده می شود. مخلوط پودر منیزیم با عوامل اکسید کننده در پیروتکنیک برای تهیه ترکیبات روشنایی و آتش زا استفاده می شود.
ترکیبات منیزیم
حالت اکسیداسیون غالب (+2) برای منیزیم توسط پیکربندی الکترونیکی، انرژی های یونیزاسیون و اندازه های اتمی آن تعیین می شود. حالت اکسیداسیون (+3) غیرممکن است، زیرا سومین انرژی یونیزاسیون برای منیزیم 7733 کیلوژول مول -1 است. این انرژی بسیار بیشتر از آن است که با تشکیل پیوندهای اضافی جبران شود، حتی اگر عمدتاً کووالانسی باشند. دلایل ناپایداری ترکیبات منیزیم در حالت اکسیداسیون (+1) کمتر مشخص است. ارزیابی آنتالپی تشکیل چنین ترکیباتی نشان می دهد که آنها باید با توجه به عناصر تشکیل دهنده خود پایدار باشند. دلیل اینکه ترکیبات منیزیم (I) پایدار نیستند، آنتالپی بسیار بالاتر تشکیل ترکیبات منیزیم (II) است که باید منجر به عدم تناسب سریع و کامل شود:
Mg(k) + Cl 2 (g) = MgCl 2 (k);
D ن° arr = -642 kJ/(mol MgCl2)
2Mg(k) + Cl 2 (g) = 2MgCl(k);
D ن° arr = -250 kJ/(2 mol MgCl)
2MgCl(k) = Mg(k) + MgCl 2 (k);
D ندرجه پراکندگی = -392 کیلوژول/(2 مول MgCl)
اگر بتوان یک مسیر مصنوعی یافت که عدم تناسب را دشوار می کند، چنین ترکیباتی ممکن است به دست آیند. شواهدی مبنی بر تشکیل ذرات منیزیم (I) در طی الکترولیز روی الکترودهای منیزیم وجود دارد. بنابراین، در طول الکترولیز NaCl بر روی آند منیزیم، هیدروژن آزاد می شود و مقدار منیزیم از دست رفته توسط آند با بار 1.3+ مطابقت دارد. به طور مشابه، در طول الکترولیز محلول آبی Na 2 SO 4، مقدار هیدروژن آزاد شده مطابق با اکسیداسیون آب توسط یون های منیزیم است که بار آن برابر با 1.4+ است.
اکثر نمک های منیزیم در آب بسیار محلول هستند. فرآیند انحلال با هیدرولیز جزئی همراه است. محلول های به دست آمده دارای یک محیط اسیدی ضعیف هستند:
2+ + H 2 O + + H 3 O +
ترکیبات منیزیم با بسیاری از فلزات غیر فلزی از جمله کربن، نیتروژن، فسفر و گوگرد به طور غیرقابل برگشتی توسط آب هیدرولیز می شوند.
هیدرید منیزیمترکیب MgH 2 یک پلیمر با پل زدن اتم های هیدروژن است. عدد هماهنگی منیزیم موجود در آن 4 است. این ساختار منجر به کاهش شدید پایداری حرارتی ترکیب می شود. هیدرید منیزیم به راحتی توسط اکسیژن و آب اتمسفر اکسید می شود. این واکنش ها با آزاد شدن زیاد انرژی همراه است.
نیترید منیزیم Mg 3 N 2. بلورهای زرد رنگ را تشکیل می دهد. هیدرولیز نیترید منیزیم هیدرات آمونیاک تولید می کند:
Mg 3 N 2 + 8H 2 O = 3Mg(OH) 2 + 2NH 3 H 2 O
اگر هیدرولیز نیترید منیزیم در یک محیط قلیایی انجام شود، هیدرات آمونیاک تشکیل نمی شود، اما گاز آمونیاک آزاد می شود. هیدرولیز در محیط اسیدی منجر به تشکیل کاتیون های منیزیم و آمونیوم می شود:
Mg 3 N 2 + 8H 3 O + = 3Mg 2 + + 2NH 4 + + 8H 2 O
اکسید منیزیم MgO منیزیم سوخته نامیده می شود. با پختن منیزیت، دولومیت، کربنات منیزیم پایه، هیدروکسید منیزیم و همچنین کلسینه کردن بیشوفیت MgCl 2 · 6H 2 O در اتمسفر بخار آب به دست می آید.
واکنش پذیری اکسید منیزیم به دمایی که در آن تولید می شود بستگی دارد. اکسید منیزیم تهیه شده در دمای 500 تا 700 درجه سانتیگراد منیزیم سبک نامیده می شود. به راحتی با اسیدهای رقیق و آب واکنش نشان می دهد و نمک های مربوطه یا هیدروکسید منیزیم را تشکیل می دهد و دی اکسید کربن و رطوبت هوا را جذب می کند. اکسید منیزیم که در دمای 1200 تا 1600 درجه سانتیگراد به دست می آید، منیزیم سنگین نامیده می شود. با مقاومت اسیدی و مقاومت در برابر آب مشخص می شود.
اکسید منیزیم به طور گسترده ای به عنوان یک ماده مقاوم در برابر حرارت استفاده می شود. با هدایت حرارتی بالا و خواص عایق الکتریکی خوب مشخص می شود. بنابراین از این ترکیب در رادیاتورهای عایق برای گرمایش موضعی استفاده می شود.
از گریدهای سبک تر منیزیا برای تهیه سیمان منیزیم و مصالح ساختمانی بر پایه آن و همچنین به عنوان عامل ولکانیزاسیون در صنعت لاستیک استفاده می شود.
هیدروکسید منیزیم Mg(OH) 2 کریستال های بی رنگ را تشکیل می دهد. حلالیت این ترکیب کم است (2·10-4 mol/l در دمای 20 درجه سانتی گراد). با اثر نمک های آمونیوم می توان آن را به محلول تبدیل کرد:
Mg(OH) 2 + 2NH 4 Cl = MgCl 2 + 2NH 3 H 2 O
هیدروکسید منیزیم از نظر حرارتی ناپایدار است و با حرارت دادن تجزیه می شود:
Mg(OH) 2 = MgO + H 2 O
در مقیاس صنعتی، هیدروکسید منیزیم از طریق بارش با آهک از آب دریا و آب نمک طبیعی تولید می شود.
هیدروکسید منیزیم پایه ملایمی است که به شکل محلول آبی (شیر منیزیم) برای کاهش اسیدیته شیره معده کاربرد فراوانی دارد. علاوه بر این، با وجود نرمی، Mg(OH) 2 اسیدها را 1.37 برابر بیشتر از سدیم هیدروکسید NaOH و 2.85 برابر بیشتر از بی کربنات سدیم NaHCO 3 خنثی می کند.
همچنین برای تولید اکسید منیزیم، تصفیه شکر، تصفیه آب در کارخانه های دیگ بخار و به عنوان جزئی از خمیردندان استفاده می شود.
کربنات منیزیم MgCO 3 کریستال های بی رنگ را تشکیل می دهد. به طور طبیعی به شکل بی آب (منیزیت) وجود دارد. علاوه بر این، پنتا، تری و مونوهیدرات کربنات منیزیم شناخته شده است.
حلالیت کربنات منیزیم در غیاب دی اکسید کربن حدود 0.5 میلی گرم در لیتر است. در حضور دی اکسید کربن و آب اضافی، کربنات منیزیم به بی کربنات محلول تبدیل می شود و هنگام جوشیدن، فرآیند معکوس رخ می دهد. کربنات و بی کربنات با اسیدها واکنش داده و دی اکسید کربن آزاد می کنند و نمک های مربوطه را تشکیل می دهند. هنگامی که کربنات منیزیم گرم می شود، بدون ذوب، تجزیه می شود:
MgCO 3 = MgO + CO 2
از این فرآیند برای تولید اکسید منیزیم استفاده می شود. علاوه بر این، کربنات منیزیم طبیعی ماده اولیه برای تولید منیزیم فلزی و ترکیبات آن است. همچنین به عنوان کود و برای کاهش اسیدیته خاک استفاده می شود.
پودر کربنات منیزیم شل بین دو جداره مخازن ذخیره اکسیژن مایع ریخته می شود. این عایق حرارتی ارزان و قابل اعتماد است.
سولفات منیزیم MgSO 4 در حالت بی آب و همچنین به شکل هیدرات های مختلف شناخته می شود. کیزریت MgSO 4 · H 2 O ، اپزومیت MgSO 4 · 7H 2 O و هگزا هیدرات MgSO 4 · 6H 2 O در طبیعت یافت می شوند.
در پزشکی از سولفات منیزیم هپتاهیدرات MgSO 4 · 7H 2 O استفاده می شود که معمولاً به نام اپسوم یا نمک تلخ شناخته می شود. این ترکیب اثر ملین دارد. با انفوزیون عضلانی یا داخل وریدی، سولفات منیزیم شرایط تشنجی را تسکین می دهد و اسپاسم عروقی را کاهش می دهد.
سولفات منیزیم در صنایع نساجی و کاغذ به عنوان ماده رنگرزی، وزن دهنده پنبه و ابریشم و به عنوان پرکننده کاغذ استفاده می شود. به عنوان یک ماده خام برای تولید اکسید منیزیم عمل می کند.
نیترات منیزیم Mg(NO 3) 2 کریستال های رطوبت سنجی بی رنگ هستند. حلالیت در آب در دمای 20 درجه سانتیگراد 73.3 گرم در 100 گرم است.هگزا هیدرات از محلول های آبی متبلور می شود. در دمای بالای 90 درجه سانتیگراد، آبگیری می شود و به مونو هیدرات تبدیل می شود. سپس آب با هیدرولیز جزئی و تجزیه به اکسید منیزیم جدا می شود. این فرآیند در سنتز اکسید منیزیم با خلوص بالا استفاده می شود. از نیترات منیزیم نیترات سایر فلزات و همچنین ترکیبات مختلف منیزیم به دست می آید. علاوه بر این، نیترات منیزیم بخشی از کودهای پیچیده و مخلوط های پیروتکنیک است.
پرکلرات منیزیم Mg(ClO 4) 2 کریستال های بی رنگ بسیار مرطوب را تشکیل می دهد. در آب (99.6 گرم در 100 گرم) و حلال های آلی بسیار محلول است. هگزا هیدرات از محلول های آبی متبلور می شود. محلولهای غلیظ پرکلرات منیزیم در حلالهای آلی و حلالهای آن با مولکولهای عامل کاهنده، انفجاری هستند.
پرکلرات منیزیم نیمه هیدراته، حاوی 2-2.5 مولکول آب، تحت نام تجاری "آنهیدرون" تولید می شود. برای به دست آوردن پرکلرات منیزیم بی آب، آن را در خلاء در دمای 200-300 درجه سانتیگراد خشک می کنند. از آن به عنوان خشک کننده گاز استفاده می شود. این نه تنها بخار آب، بلکه آمونیاک، بخار الکل، استون و سایر مواد قطبی را نیز جذب می کند.
پرکلرات منیزیم به عنوان یک کاتالیزور اسیلاسیون در واکنش فریدل- کرافت و همچنین به عنوان یک عامل اکسید کننده در میکروآنالیز استفاده می شود.
فلوراید منیزیم MgF 2 کمی در آب محلول است (0.013 گرم در 100 گرم در 25 درجه سانتیگراد). به طور طبیعی به عنوان ماده معدنی سلایت وجود دارد. فلوراید منیزیم از واکنش سولفات یا اکسید منیزیم با اسید هیدروفلوئوریک یا کلرید منیزیم با پتاسیم یا فلوراید آمونیوم به دست می آید.
فلوراید منیزیم بخشی از فلاکس ها، شیشه ها، سرامیک ها، لعاب ها، کاتالیزورها، مخلوط هایی برای تولید میکای مصنوعی و آزبست است. علاوه بر این، این ماده نوری و لیزری است.
کلرید منیزیم MgCl 2 یکی از مهم ترین نمک های منیزیم از نظر صنعتی است. حلالیت آن 54.5 گرم در هر 100 گرم آب در دمای 20 درجه سانتی گراد است. محلول های آبی غلیظ کلرید منیزیم اکسید منیزیم را حل می کند. MgCl 2 mMg(OH) 2 nH 2 O از محلول های به دست آمده متبلور می شود این ترکیبات جزء سیمان های منیزیم هستند.
کلرید منیزیم هیدرات های کریستالی را با 1، 2، 4، 6، 8 و 12 مولکول آب تشکیل می دهد. با افزایش دما، تعداد مولکول های آب تبلور کاهش می یابد.
در طبیعت، کلرید منیزیم به شکل مواد معدنی بیشوفیت MgCl 2 · 6H 2 O، کلرید منیزیت MgCl 2 و کارنالیت یافت می شود. در آب دریا، آب نمک دریاچه های نمک و برخی آب نمک های زیرزمینی یافت می شود.
کلرید منیزیم بدون آب در تولید منیزیم فلزی و اکسید منیزیم و هگزا هیدرات برای تولید سیمان منیزیم استفاده می شود. محلول آبی کلرید منیزیم به عنوان خنک کننده و ضد یخ استفاده می شود. به عنوان یک عامل یخ زدایی در فرودگاه ها، خطوط راه آهن و سوئیچ ها و همچنین در برابر یخ زدگی زغال سنگ و سنگ معدن عمل می کند. چوب با محلول کلرید منیزیم آغشته شده است تا در برابر آتش مقاوم شود.
منیزیم بروماید MgBr 2 بسیار محلول در آب است (101.5 گرم در 100 گرم در 20 درجه سانتیگراد). از محلول های آبی از -42.7 تا 0.83 درجه سانتیگراد به شکل دکاهیدرات متبلور می شود، در دماهای بالاتر - به شکل هگزا هیدرات. حلولات کریستالی متعددی مانند MgB 2 6ROH (R = Me، Et، Pr)، MgBr 2 6Me 2 CO، MgBr 2 3Et 2 O و همچنین آمین های MgBr 2 را تشکیل می دهد. n NH 3 ( n = 2–6).
ترکیبات پیچیده منیزیم. در محلول های آبی، یون منیزیم به شکل یک کمپلکس آبی 2+ وجود دارد. در حلال های غیرآبی، مانند آمونیاک مایع، یون منیزیم با مولکول های حلال کمپلکس تشکیل می دهد. حلال های نمک های منیزیم معمولاً از چنین محلول هایی متبلور می شوند. چندین کمپلکس هالید از نوع MX 4 2- شناخته شده است که X آنیون هالید است.
در میان ترکیبات پیچیده منیزیم، کلروفیل ها که کمپلکس های پورفیرین اصلاح شده منیزیم هستند، از اهمیت ویژه ای برخوردارند. آنها برای فتوسنتز در گیاهان سبز حیاتی هستند.
ترکیبات ارگانومیزیم. ترکیبات متعددی حاوی پیوندهای فلز-کربن برای منیزیم به دست آمده است. به خصوص تحقیقات زیادی به معرف های Grignard RMgX (X = Cl, Br, I) اختصاص یافته است.
معرف های گریگنارد مهم ترین ترکیبات آلی فلزی منیزیم و احتمالاً پرمصرف ترین معرف های آلی فلزی هستند. این به دلیل سهولت تولید و تطبیق پذیری مصنوعی آنها است. مشخص شده است که در محلول این ترکیبات می توانند حاوی انواع ذرات شیمیایی باشند که در حالت تعادل متحرک هستند.
معرفهای گریگنارد معمولاً با افزودن آهسته یک هالید آلی به سوسپانسیون چرخشهای منیزیم در یک حلال مناسب تحت هم زدن شدید و در غیاب کامل هوا و رطوبت تهیه میشوند. واکنش معمولا به آرامی شروع می شود. این می تواند توسط یک کریستال کوچک ید آغاز شود که لایه محافظ روی سطح فلز را از بین می برد.
معرف های گریگنارد به طور گسترده برای سنتز الکل ها، آلدئیدها، کتون ها، اسیدهای کربوکسیلیک، استرها و آمیدها استفاده می شوند و احتمالاً مهمترین معرف برای ایجاد پیوندهای کربن-کربن و همچنین پیوند بین اتم های کربن و سایر عناصر (نیتروژن، اکسیژن، گوگرد و غیره) .d.).
ترکیبات R2Mg معمولاً با حرارت دادن تجزیه می شوند. در حالت کریستالی ساختار پلیمرهای خطی با گروه های آلکیل پل زدنی دارند. ترکیب MgMe 2 یک پلیمر غیرفرار، پایدار تا 250 درجه سانتی گراد، نامحلول در هیدروکربن ها و فقط کمی محلول در اتر است. ترکیب MgEt 2 و همولوگ های بالاتر بسیار شبیه به MgMe 2 هستند، اما در دماهای پایین تر (175 تا 200 درجه سانتیگراد) تجزیه می شوند و در واکنش مخالف تشکیل آنها، آلکن و MgH2 مربوطه را تشکیل می دهند. MgPh 2 نیز مشابه آنهاست. در بنزن نامحلول است، در اتر حل می شود و مجتمع مونومری MgPh 2 · 2Et 2 O را تشکیل می دهد و در دمای 280 درجه سانتیگراد تجزیه می شود و Ph 2 و منیزیم فلزی را تشکیل می دهد.
نقش بیولوژیکی منیزیم
برگهای سبز گیاه حاوی کلروفیلهایی هستند که کمپلکسهای پورفیرین حاوی منیزیم هستند که در فتوسنتز نقش دارند.
منیزیم همچنین از نزدیک در فرآیندهای بیوشیمیایی در بدن حیوانات نقش دارد. یون های منیزیم برای شروع آنزیم های مسئول تبدیل فسفات ها، برای انتقال تکانه های عصبی و برای متابولیسم کربوهیدرات ها ضروری هستند. آنها همچنین در انقباض عضلانی که توسط یون های کلسیم آغاز می شود، نقش دارند.
چندین سال پیش، دانشمندان دانشگاه مینهسوتا در ایالات متحده دریافتند که پوستههای تخممرغ هر چه منیزیم بیشتری داشته باشند، قویتر هستند.
بدن یک فرد بالغ با وزن 65 کیلوگرم حاوی حدود 20 گرم منیزیم (عمدتا به شکل یون) است. بیشتر آن در استخوان ها متمرکز است. کمپلکس های منیزیم با ATP و ADP در مایع داخل سلولی وجود دارد.
نیاز روزانه به این عنصر 0.35 گرم است. با یک رژیم غذایی یکنواخت، کمبود سبزیجات و میوه های سبز و همچنین با الکلیسم، کمبود منیزیم اغلب رخ می دهد. زردآلو، هلو و گل کلم به ویژه سرشار از منیزیم هستند. همچنین در کلم معمولی، سیب زمینی و گوجه فرنگی یافت می شود.
آمارها نشان می دهد که ساکنان مناطق با آب و هوای گرم کمتر از ساکنان شمالی دچار اسپاسم عروق خونی می شوند. اعتقاد بر این است که دلیل این امر عادات غذایی در مناطق سردسیر است. آنها میوه و سبزیجات کمتری می خورند، به این معنی که منیزیم کمتری دریافت می کنند.
تحقیقات زیست شناسان فرانسوی نشان داده است که خون افراد خسته نسبت به افراد استراحت منیزیم کمتری دارد. اعتقاد بر این است که یک رژیم غذایی غنی از منیزیم باید به پزشکان در مبارزه با چنین بیماری جدی مانند کار بیش از حد کمک کند.
النا ساوینکینا