Cos'è l'ammoniaca? Formula e proprietà di ammoniaca
Ammoniaca - un composto, che è la fonte più importante di azoto per gli organismi viventi, oltre a applicazioni trovate in varie industrie. Cos'è l'ammoniaca, quali sono le sue proprietà? Comprendiamolo.
Cos'è l'ammoniaca: caratteristiche principali
L'ammoniaca (nitride idroodio) è un composto di azoto con idrogeno con una formula chimica nh 3. La forma della molecola assomiglia alla piramide trigonale, nella parte superiore del quale è un atomo di azoto.
L'ammoniaca è un gas che non ha colore, ma con un odore specifico tagliente. La densità di ammoniaca è quasi due volte meno della densità dell'aria. A una temperatura di 15 o c, è 0,73 kg / m 3. La densità del liquido di ammoniaca in condizioni normali è 686 kg / m 3. Peso molecolare della sostanza - 17.2 g / mol. Una caratteristica distintiva dell'ammoniaca è la sua elevata solubilità in acqua. Pertanto, ad una temperatura di 0 ° C, raggiunge circa 1.200 volumi nel volume dell'acqua, a 20 ° C - 700 volumi. La soluzione "ammoniaca - acqua" (acqua di ammoniaca) è caratterizzata da una reazione debolmente alcalina e una proprietà piuttosto unica rispetto ad altri alcali: con un aumento della concentrazione, la densità diminuisce.
Come è formata l'ammoniaca?
Cos'è l'ammoniaca nel corpo umano? Questo è un prodotto finito di scambio di azoto. La sua grande parte del fegato è convertita in sostanza meno tossica di urea (carbamide).
L'ammoniaca in condizioni naturali è formata come risultato della decomposizione di composti organici contenenti azoto. Per uso industriale, questa sostanza è ottenuta artificialmente.
Ottenere l'ammoniaca in condizioni industriali e di laboratorio
In condizioni industriali, l'ammoniaca è ottenuta dalla sintesi catalitica da azoto e idrogeno:
N 2 + 3H 2 → 2NH3 + Q.
Il processo di ottenimento di una sostanza viene effettuato ad una temperatura di 500 ° C e una pressione di 350 atm. Come catalizzatore, l'ammoniaca risultante viene rimossa dal raffreddamento. Azoto e idrogeno, che non hanno reagito, restituiti alla sintesi.
In condizioni di laboratorio, l'ammoniaca è ottenuta principalmente da deboli riscaldamento della miscela costituita da cloruro di ammonio e calce dai capelli:
2NH 4 CL + CA (OH) 2 → CACL 2 + 2NH 3 + 2H 2 O.
Per scaricare, la connessione finita viene passata attraverso una miscela di calce e soda caustica. L'ammoniaca abbastanza secca può essere ottenuta sciogliendo il sodio in metallo e la successiva distillazione.
Dov'è l'ammoniaca?
L'nitruro di idrogeno è ampiamente utilizzato in varie industrie. Enormi quantità sono utilizzate per e vari fertilizzanti (urea, nitrato di ammonio, ecc.), Polimeri, acido sinilico, soda, sali di ammonio e altri tipi di prodotti di produzione chimica.

Nell'industria della luce, le proprietà di ammoniaca vengono utilizzate durante la pulizia e la colorazione di tali tessuti, come seta, lana e cotone. Nella produzione di acciaio, è usato per aumentare la durezza dell'acciaio saturando i suoi strati superficiali con azoto. Nell'industria petrolchimica con l'aiuto del nitruro di idrogeno neutralizzare i rifiuti acidi.
A causa delle sue proprietà termodinamiche, l'ammoniaca liquida viene utilizzata come refrigerante nelle apparecchiature di refrigerazione.
NH 3 + HNO 3 → NH 4 n. 3.
Quando si interagisce con HCL, è formata il cloruro di ammonio:
NH 3 + HCL → NH 4 cl.

I sali di ammonio sono sostanze cristalline solide che si decompongono in acqua e in possesso di proprietà in anticipo di sali in metallo. Soluzioni di composti formati come risultato dell'interazione di ammoniaca e acidi forti hanno una reazione debolmente acida.
A causa degli atomi di azoto, l'nitruro di idrogeno è un agente di riduzione attivo. Le proprietà di recupero si manifestano quando riscaldate. Quando si brucia in un'atmosfera di ossigeno, forma azoto e acqua. In presenza di catalizzatori, l'interazione con l'ossigeno dà il nitruro di idrogeno ha la capacità di ripristinare i metalli dagli ossidi.
Alogeni come risultato di una reazione con ammoniaca forma alogenuri di azoto - esplosivi pericolosi. Quando si interagiscono con gli acidi carbossilici e i loro derivati, le forme di nitruro di idrogeno ammidano. In reazioni di carbone (a 1000 ° C) e metano che dà
Con gli ioni dei metalli, l'ammoniaca forma amminoacidi o l'ammoniaca (composti complessi), aventi una caratteristica caratteristica: un atomo di azoto è sempre associato a tre atomi di idrogeno. Come risultato della complessazione, il dipinto della sostanza cambia. Quindi, ad esempio, una soluzione blu con l'aggiunta di nitruro di idrogeno acquisisce un colore intensivo blu-viola. Molti degli amminoacidi sono sufficientemente resistenti. A causa di ciò, possono essere ottenuti in forma solida.

In ammoniaca liquida, sia composti inorganici e organici ionici che non polari che organici, sono ben disciolti.
Caratteristiche sanitarie e igieniche
L'ammoniaca è indicata alla quarta concentrazione massima massima massima consentita (MPC) nell'aria degli insediamenti è 0,2 mg / m 3, media quotidiana - 0,04. Nell'aria dell'area di lavoro, il contenuto di ammoniaca non dovrebbe essere superiore a 20 mg / m³. A tali concentrazioni, l'odore della sostanza non è sentito. Risolto fisso con odore umano Inizia a 37 mg / m³. Cioè, se si sente l'odore di ammoniaca, ciò significa che gli standard ammissibili di trovare una sostanza nell'aria sono notevolmente superati.
Impatto sul corpo umano
Qual è l'ammoniaca dal punto di vista dell'impatto su una persona? Questo è tossictro. Si riferisce alle sostanze in grado di rinforzare e effetto neurotropico, avvelenamento da inalazione che può portare all'edema e influire sul sistema nervoso.
Le coppie di ammoniaca sono fastidiosamente influenzano la pelle, le membrane mucose degli occhi e degli organi respiratorici. La concentrazione della sostanza in cui si manifesta l'irritazione dell'OCE è 280 mg per metro cubico. Metro, occhio - 490 mg per cubo. misuratore. A seconda della quantità di nitrudio di idrogeno nell'aria, potrebbe esserci un accordo in gola, difficoltà di respirazione, attacchi per la tosse, dolore agli occhi, strappo abbondante, ustioni chimiche della cornea, perdita di visione. Quando il contenuto di ammoniaca è 1,5 g per metro cubico. Il misuratore per un'ora sta sviluppando edema polmonare tossico. Quando si contatta l'ammoniaca liquida e le sue soluzioni (in alte concentrazioni), è possibile arrossamento, prurito, bruciore, dermatite. Dal momento che il nitruro liquefatto della rifornimento dell'acqua dell'acqua durante l'evaporazione assorbe il calore, il frostbite è congelato.
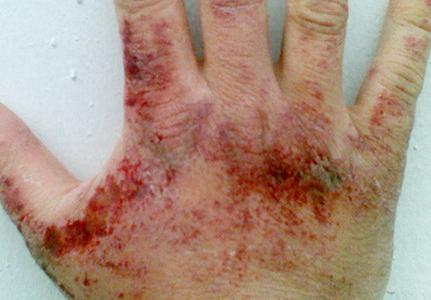
Sintomi di avvelenamento Ammoniaca
L'avvelenamento di questo tossico può causare una diminuzione della soglia uditiva, nausea, vertigini, mal di testa, ecc. Ci possono essere cambiamenti nel comportamento, in particolare eccitazione forte, sciocchezze. La manifestazione dei sintomi in alcuni casi è intermittente. Possono fermarsi per un po ', quindi rinnovare con una nuova forza.
Dato tutte le possibili conseguenze dell'impatto dell'ammoniaca, è molto importante rispettare le precauzioni quando si lavora con questa sostanza e impedirà il superamento della sua concentrazione nell'aria.









