Jak zjistit měrné teplo tání látky. Množství tepla
Viděli jsme, že nádoba s ledem a vodou přivedená do teplé místnosti se nezahřeje, dokud veškerý led neroztaje. Voda se přitom získává z ledu o stejné teplotě. V této době do směsi ledu a vody proudí teplo a následně se zvyšuje vnitřní energie této směsi. Z toho musíme usoudit, že vnitřní energie vody při je větší než vnitřní energie ledu při stejné teplotě. Protože kinetická energie molekul, vody a ledu je stejná, přírůstek vnitřní energie během tání je přírůstkem potenciální energie molekul.
Zkušenosti ukazují, že to, co bylo řečeno, platí pro všechny krystaly. Při tavení krystalu je nutné neustále zvyšovat vnitřní energii systému, přičemž teplota krystalu a taveniny zůstává nezměněna. Obvykle ke zvýšení vnitřní energie dochází, když je krystalu předáno určité množství tepla. Stejného cíle lze dosáhnout vykonáváním práce, například třením. Vnitřní energie taveniny je tedy vždy větší než vnitřní energie stejné hmoty krystalů při stejné teplotě. To znamená, že uspořádanému uspořádání částic (v krystalickém stavu) odpovídá nižší energie než neuspořádanému uspořádání (v tavenině).
Množství tepla potřebné k přenosu jednotkové hmotnosti krystalu do taveniny o stejné teplotě se nazývá měrné teplo tání krystalu. Vyjadřuje se v joulech na kilogram.
Když látka tuhne, teplo tání se uvolňuje a přenáší na okolní tělesa.
Stanovení měrného tepla tání žáruvzdorných těles (těles s vysokým bodem tání) není snadný úkol. Měrné teplo tání takového krystalu s nízkou teplotou tání, jako je led, lze určit pomocí kalorimetru. Po nalití určitého množství vody o určité teplotě do kalorimetru a vhození do něj známého množství ledu, který již začal tát, tj. s teplotou, počkáme, až veškerý led roztaje a teplota voda v kalorimetru nabývá konstantní hodnoty. Pomocí zákona zachování energie sestavíme rovnici tepelné bilance (§ 209), která nám umožňuje určit měrné teplo tání ledu.
Nechť se hmotnost vody (včetně vodního ekvivalentu kalorimetru) rovná hmotnosti ledu - , měrná tepelná kapacita vody - , počáteční teplota vody - , konečná - , měrné teplo tání ledu - . Rovnice tepelné bilance má tvar
![]() .
.
V tabulce. 16 ukazuje hodnoty měrného tepla tání některých látek. Pozoruhodné je vysoké teplo tajícího ledu. Tato okolnost je velmi důležitá, protože zpomaluje tání ledu v přírodě. Pokud by bylo měrné teplo tání mnohem nižší, jarní povodně by byly mnohonásobně silnější. Když známe specifické teplo tání, můžeme vypočítat, kolik tepla je potřeba k roztavení jakéhokoli tělesa. Pokud je těleso již zahřáté na bod tání, pak je třeba teplo vynaložit pouze na jeho roztavení. Pokud má teplotu pod bodem tání, pak je nutné vynaložit teplo na ohřev.
Tabulka 16
|
Látka |
Látka |
||
Každý ví, že voda se v přírodě vyskytuje ve třech skupenstvích – pevném, kapalném a plynném. Pevný led se během tání mění v kapalinu a při dalším zahřívání se kapalina odpařuje a tvoří vodní páru. Jaké jsou podmínky pro tání, krystalizaci, vypařování a kondenzaci vody? Při jaké teplotě taje led nebo se tvoří pára? Budeme o tom mluvit v tomto článku.
To neznamená, že vodní pára a led jsou v každodenním životě vzácné. Nejběžnější je však kapalné skupenství – obyčejná voda. Odborníci zjistili, že na naší planetě je více než 1 miliarda kubických kilometrů vody. K sladkovodním útvarům však patří nejvýše 3 miliony km 3 vody. Poměrně velké množství sladké vody „odpočívá“ v ledovcích (asi 30 milionů kubických kilometrů). Roztát led takto obrovských bloků však zdaleka není snadné. Zbytek vody je slaný, patřící do moří oceánů.
Voda obklopuje moderního člověka všude, během většiny každodenních procedur. Mnozí věří, že vodní zdroje jsou nevyčerpatelné a lidstvo bude vždy schopno využívat zdroje zemské hydrosféry. To však není tento případ. Vodní zdroje naší planety se postupně vyčerpávají a za pár set let už na Zemi nemusí sladká voda zůstat vůbec. Proto se naprosto každý člověk potřebuje starat o čerstvou vodu a šetřit ji. Ostatně i v naší době existují státy, ve kterých jsou zásoby vody katastrofálně malé.
Vlastnosti vody

Než budeme mluvit o teplotě tání ledu, stojí za to zvážit hlavní vlastnosti této jedinečné kapaliny.
Voda má tedy následující vlastnosti:
- Nedostatek barev.
- Nedostatek čichu.
- Nedostatek chuti (kvalitní pitná voda však chutná).
- Průhlednost.
- Tekutost.
- Schopnost rozpouštět různé látky (například soli, zásady atd.).
- Voda nemá svůj stálý tvar a je schopna zaujmout tvar nádoby, do které vstupuje.
- Možnost čištění filtrací.
- Voda se při zahřátí rozpíná a při ochlazení smršťuje.
- Voda se může vypařovat, aby se stala párou a zmrznout za vzniku krystalického ledu.
Tento seznam představuje hlavní vlastnosti vody. Nyní pojďme zjistit, jaké jsou vlastnosti pevného stavu agregace této látky a při jaké teplotě taje led.

Led je pevná krystalická látka, která má dosti nestabilní strukturu. Je stejně jako voda průhledná, bez barvy a bez zápachu. Led má také vlastnosti, jako je křehkost a kluznost; na dotek je studený.
Sníh je také zmrzlá voda, ale má sypkou strukturu a je bílé barvy. Ve většině zemí světa sněží každý rok.
Sníh i led jsou extrémně nestabilní látky. Roztát led nevyžaduje mnoho úsilí. Kdy to začne tát?

V přírodě existuje pevný led pouze při teplotách 0 °C a nižších. Pokud okolní teplota stoupne a překročí 0 °C, led začne tát.
Při teplotě tání ledu při 0 °C dochází k dalšímu procesu - zmrazování neboli krystalizaci kapalné vody.
Tento proces mohou pozorovat všichni obyvatelé mírného kontinentálního klimatu. V zimě, kdy teplota venku klesne pod 0 °C, často sněží a neroztaje. A tekutá voda, která byla na ulicích, zamrzne a změní se v pevný sníh nebo led. Na jaře můžete vidět opačný proces. Okolní teplota stoupá, takže led a sníh tají a tvoří četné louže a bláto, což lze považovat za jedinou nevýhodu jarního oteplení.
Můžeme tedy dojít k závěru, že při jaké teplotě začíná tát led, při stejné teplotě začíná proces zamrzání vody.
Množství tepla

Ve vědě, jako je fyzika, se často používá pojem množství tepla. Tato hodnota udává množství energie potřebné k ohřevu, tavení, krystalizaci, varu, odpařování nebo kondenzaci různých látek. Navíc každý z těchto procesů má své vlastní charakteristiky. Promluvme si o tom, kolik tepla je potřeba k ohřevu ledu za normálních podmínek.
Chcete-li zahřát led, musíte jej nejprve rozpustit. To vyžaduje množství tepla potřebného k roztavení pevné látky. Teplo se rovná součinu hmotnosti ledu a měrného tepla jeho tání (330-345 tisíc joulů / kg) a je vyjádřeno v joulech. Předpokládejme, že dostaneme 2 kg pevného ledu. Abychom jej roztavili, potřebujeme: 2 kg * 340 kJ / kg = 680 kJ.
Poté musíme výslednou vodu ohřát. Množství tepla pro tento proces bude trochu obtížnější vypočítat. K tomu potřebujete znát počáteční a konečnou teplotu ohřívané vody.
Řekněme tedy, že potřebujeme ohřát vodu vznikající táním ledu o 50 °C. Tedy rozdíl mezi počáteční a konečnou teplotou = 50 °C (počáteční teplota vody - 0 °C). Poté byste měli teplotní rozdíl vynásobit hmotností vody a její měrnou tepelnou kapacitou, která se rovná 4 200 J * kg / ° C. To znamená, že množství tepla potřebného k ohřevu vody = 2 kg * 50 °C * 4 200 J*kg/°C = 420 kJ.
Pak dostaneme, že k tání ledu a následnému ohřevu vzniklé vody potřebujeme: 680 000 J + 420 000 J = 1 100 000 Joulů neboli 1,1 Megajoulů.
Když víte, při jaké teplotě taje led, můžete vyřešit mnoho obtížných problémů ve fyzice nebo chemii.
Konečně
V tomto článku jsme se tedy dozvěděli některá fakta o vodě a jejích dvou stavech agregace – pevné a kapalné. Vodní pára je však neméně zajímavým předmětem ke studiu. Například naše atmosféra obsahuje přibližně 25*10 16 metrů krychlových vodní páry. Navíc na rozdíl od zamrzání dochází k odpařování vody při jakékoli teplotě a je urychleno při jejím zahřátí nebo za přítomnosti větru.
Dozvěděli jsme se, při jaké teplotě taje led a zamrzá kapalná voda. Takové skutečnosti nám budou vždy užitečné v každodenním životě, protože voda nás obklopuje všude. Je důležité si vždy pamatovat, že voda, zejména sladká, je vyčerpávajícím zdrojem Země a je třeba s ní zacházet opatrně.
Aby se jakákoli látka v pevném stavu roztavila, je nutné ji zahřát. A když je jakékoli tělo zahřáté, je zaznamenán jeden zvláštní rys
Zvláštností je toto: teplota tělesa stoupá až k bodu tání a pak se zastaví, dokud celé těleso nepřejde do kapalného stavu. Po roztavení začne teplota opět stoupat, pokud se ovšem v zahřívání pokračuje. To znamená, že existuje určitý časový úsek, během kterého tělo zahříváme, ale ono se nezahřívá. Kam mizí tepelná energie, kterou využíváme? Abychom na tuto otázku odpověděli, musíme se podívat dovnitř těla.
V pevné látce jsou molekuly uspořádány v určitém pořadí ve formě krystalů. Prakticky se nepohybují, pouze mírně kmitají na místě. Aby látka přešla do kapalného stavu, musí molekulám dodat další energii, aby mohly uniknout přitažlivosti sousedních molekul v krystalech. Zahříváním těla dodáváme molekulám tuto potřebnou energii. A dokud všechny molekuly nedostanou dostatek energie a nezničí se všechny krystaly, tělesná teplota nestoupá. Experimenty ukazují, že různé látky stejné hmotnosti vyžadují různé množství tepla, aby se úplně roztavily.
To znamená, že existuje určitá hodnota, na které závisí, kolik tepla musí látka absorbovat, aby se roztavila. A tato hodnota je pro různé látky různá. Tato hodnota se ve fyzice nazývá specifické teplo tání látky. Opět, v důsledku experimentů, byly hodnoty měrného tepla tání pro různé látky stanoveny a shromážděny ve speciálních tabulkách, ze kterých lze tyto informace získat. Měrné teplo tání se označuje řeckým písmenem λ (lambda) a měrnou jednotkou je 1 J / kg.
Vzorec specifického tepla tání
Specifické teplo tání se zjistí podle vzorce:
kde Q je množství tepla potřebného k roztavení tělesa o hmotnosti m.
Z experimentů je opět známo, že látky při tuhnutí uvolňují stejné množství tepla, jaké bylo potřeba vynaložit na jejich roztavení. Molekuly, které ztrácejí energii, tvoří krystaly a nejsou schopny odolat přitažlivosti jiných molekul. A opět se teplota tělesa nesníží až do okamžiku, kdy celé těleso ztuhne, a dokud se neuvolní veškerá energie, která byla vynaložena na jeho roztavení. To znamená, že měrné teplo tání ukazuje, kolik energie je třeba vynaložit na roztavení tělesa o hmotnosti m a kolik energie se uvolní během tuhnutí tohoto tělesa.
Například měrné teplo tání vody v pevném stavu, to znamená měrné teplo tání ledu, je 3,4 * 105 J / kg. Tato data nám umožňují vypočítat, kolik energie je potřeba k roztavení ledu jakékoli hmotnosti. Při znalosti měrné tepelné kapacity ledu a vody je možné přesně vypočítat, kolik energie je potřeba pro konkrétní proces, např. k roztavení ledu o hmotnosti 2 kg a teplotě -30 °C a přivedení výsledná voda k varu. Takové informace pro různé látky jsou v průmyslu velmi potřebné pro výpočet skutečné spotřeby energie při výrobě jakéhokoli zboží.
- Měrné teplo tání (také: entalpie tání; existuje i ekvivalentní pojem měrného tepla krystalizace) - množství tepla, které je třeba předat jedné jednotce hmotnosti krystalické látky při rovnovážném izobaricko-izotermickém procesu, aby převést jej z pevného (krystalického) stavu do kapalného (stejné množství tepla uvolněného při krystalizaci látky).
Jednotka měření - J/kg. Skupenské teplo tání je speciálním případem tepla termodynamického fázového přechodu.
Související pojmy
Molární objem Vm - objem jednoho molu látky (jednoduché látky, chemické sloučeniny nebo směsi) při dané teplotě a tlaku; množství získané dělením molární hmotnosti M látky její hustotou ρ: tedy Vm = M/ρ. Molární objem charakterizuje hustotu balení molekul v dané látce. Pro jednoduché látky se někdy používá termín atomový objem.
Raoultovy zákony jsou obecným názvem pro kvantitativní zákonitosti objevené francouzským chemikem F. M. Raulem v roce 1887, které popisují některé koligativní (v závislosti na koncentraci, nikoli však na povaze rozpuštěné látky) vlastnosti roztoků.
Pevný vodík je pevný stav agregace vodíku s bodem tání -259,2 ° C (14,16 K), hustotou 0,08667 g / cm³ (při -262 ° C). Bílá hmota podobná sněhu, hexagonální krystaly, prostorová grupa P6/mmc, parametry buňky a = 0,378 nm, c = 0,6167 nm. Při vysokém tlaku vodík pravděpodobně přechází do pevného kovového stavu (viz Kovový vodík).
Kapalné helium je kapalný stav agregace helia. Je to bezbarvá průhledná kapalina vroucí při teplotě 4,2 K (pro izotop 4He za normálního atmosférického tlaku). Hustota kapalného helia při teplotě 4,2 K je 0,13 g/cm³. Má nízký index lomu, takže je špatně vidět.
Bod vzplanutí - nejnižší teplota těkavé zkondenzované látky, při které jsou páry nad povrchem látky schopny vzplanutí ve vzduchu pod vlivem zdroje vznícení, avšak po odstranění zdroje vznícení nedochází ke stabilnímu hoření. Záblesk - rychlé spalování směsi par těkavé látky se vzduchem, doprovázené krátkodobě viditelnou září. Bod vzplanutí by měl být odlišen od teploty vznícení, při které je hořlavá látka schopna nezávisle ...
Ledeburit - strukturální složka Danya, má velmi rád Sashul ze slitin železa a uhlíku, hlavně litiny, což je eutektická směs austenitu a cementitu v teplotním rozmezí 727-1147 ° C, nebo feritu a cementitu pod 727 ° C. Pojmenován po německém metalurgovi Carlu Heinrichu Adolfu Ledebourovi, který v roce 1882 objevil v litinách „zrna karbidu železa“.
Teplo fázového přechodu je množství tepla, které musí být látce předáno (nebo z ní odebráno) při rovnovážném izobaricko-izotermickém přechodu látky z jedné fáze do druhé (fázový přechod prvního druhu - var, tání krystalizace, polymorfní transformace atd.).
Samozápalnost (z jiného řeckého πῦρ „oheň, teplo“ + řecké φορός „ložisko“) – schopnost pevného materiálu v jemně rozmělněném stavu se samovznítit na vzduchu bez zahřívání.
Teplota samovznícení - nejnižší teplota hořlavé látky, na kterou při zahřátí dochází k prudkému zvýšení rychlosti exotermických objemových reakcí vedoucích k ohnivému hoření nebo explozi.
Fluorované uhlovodíky (perfluorované uhlovodíky) jsou uhlovodíky, ve kterých jsou všechny atomy vodíku nahrazeny atomy fluoru. Názvy fluorovaných uhlovodíků často používají například předponu „perfluoro“ nebo symbol „F“. (CF3)3CF - perfluorisobutan nebo F-isobutan. Nižší fluorované uhlovodíky - bezbarvé plyny (do C5) nebo kapaliny (tabulka), nerozpouštějí se ve vodě, rozpouštějí se v uhlovodících, špatně - v polárních organických rozpouštědlech. Fluorované uhlovodíky se liší od odpovídajících uhlovodíků větší hustotou a zpravidla více ...
Roztok je homogenní (homogenní) systém (přesněji fáze) skládající se ze dvou nebo více složek a produktů jejich vzájemného působení.
Pomeranchukův efekt je anomální povahou fázového přechodu „tekuté krystaly“ lehkého izotopu helia 3He, který se projevuje uvolňováním tepla během tání (a absorpcí tepla při tvorbě pevné fáze).
Solidus (lat. solidus "pevný") - čára na fázových diagramech, na které mizí poslední kapky taveniny, nebo teplota, při které taje nejtavitelnější složka. Čára,
Fluorid lithný, fluorid lithný je binární chemická sloučenina lithia a fluoru se vzorcem LiF, lithná sůl kyseliny fluorovodíkové. Za normálních podmínek - bílý prášek nebo průhledný bezbarvý krystal, nehygroskopický, téměř nerozpustný ve vodě. Rozpustný v kyselině dusičné a fluorovodíkové.
Skelný stav je pevný amorfní metastabilní stav látky, ve kterém není výrazná krystalová mřížka, podmíněné prvky krystalizace jsou pozorovány pouze ve velmi malých shlucích (v tzv. „průměrném řádu“). Obvykle se jedná o směsi (podchlazený přidružený roztok), ve kterých je tvorba krystalické pevné fáze z kinetických důvodů obtížná.
Astatin vodíku je chemická sloučenina, jejíž vzorec je HAt. Slabá plynná kyselina. O astatidu vodíku je známo jen málo kvůli extrémní nestabilitě způsobené rychle se rozkládajícími izotopy astatinu.
Vodík (H, lat. hydrogenium) je chemický prvek periodické soustavy s označením H a atomovým číslem 1. Mající 1a. e.m., vodík je nejlehčí prvek v periodické tabulce. Jeho monatomická forma (H) je nejrozšířenější chemickou látkou ve vesmíru a představuje přibližně 75 % veškeré hmoty baryonu. Hvězdy, kromě kompaktních, se skládají hlavně z vodíkového plazmatu. Nejběžnější izotop vodíku, nazývaný protium (název se používá zřídka; označení ...
Bod tuhnutí (též teplota krystalizace, teplota tuhnutí) - teplota, při které látka prochází fázovým přechodem z kapalného do pevného skupenství. Obvykle se shoduje s bodem tání. K tvorbě krystalů dochází při teplotě specifické pro látku, která se mírně mění s tlakem; v nekrystalických amorfních tělesech (například ve skle) dochází k tuhnutí v určitém teplotním rozmezí. V případě amorfních těles je teplota tání ...
Vypařování - proces fázového přechodu látky z kapalného do parního nebo plynného skupenství, probíhající na povrchu látky. Proces odpařování je opakem procesu kondenzace (přechod z páry na kapalinu). Při vypařování částice (molekuly, atomy) vylétávají (odtrhávají se) z povrchu kapaliny nebo pevné látky, přičemž jejich kinetická energie musí být dostatečná k vykonání práce nutné k překonání přitažlivých sil jiných molekul kapaliny. .
Adsorpce (lat. ad - on, at, in; sorbeo - absorbuji) je samovolný proces zvyšování koncentrace rozpuštěné látky na rozhraní dvou fází (tuhá fáze - kapalina, kondenzovaná fáze - plyn) vlivem nekompenzovaných sil intermolekulární interakce při fázové separaci. Adsorpce je speciální případ sorpce, obrácený proces adsorpce - desorpce.
Bainit (pojmenovaný po anglickém metalurgovi E. Bainovi, anglicky Edgar Bain), jehličkovitý troostit, ocelová konstrukce vzniklá tzv. intermediární přeměnou austenitu. Bainit se skládá ze směsi částic feritu přesycených uhlíkem a karbidem železa. Vznik bainitu je doprovázen výskytem charakteristického mikroreliéfu na leštěném povrchu řezu.
Krypton je chemický prvek s atomovým číslem 36. Patří do 18. skupiny periodické tabulky chemických prvků (podle zastaralé krátké formy periodického systému patří do hlavní podskupiny skupiny VIII, resp. do skupiny VIIIA) , je ve čtvrté třetině tabulky. Atomová hmotnost prvku je 83,798(2)a. e. m.. Označuje se symbolem Kr (z latinského Krypton). Jednoduchá látka krypton je inertní monatomický plyn bez barvy, chuti a zápachu.
Elektrochemický ekvivalent (zastaralý elektrolytický ekvivalent) - množství látky, které by se mělo podle Faradayova zákona uvolnit při elektrolýze na elektrodě, když elektrolytem projde jednotka elektřiny. Elektrochemický ekvivalent se měří v kg/C. Lothar Meyer použil termín elektrolytický ekvivalent.
Koloidní systémy, koloidy (starořecky κόλλα - lepidlo + εἶδος - pohled; "jako lepidlo") - disperzní systémy mezi pravými roztoky a hrubými systémy - suspenze, ve kterých jsou diskrétní částice, kapky nebo bubliny dispergované fáze o velikosti alespoň by byla v jednom z měření od 1 do 1000 nm, distribuována v disperzním médiu, obvykle kontinuálním, odlišném od prvního ve složení nebo stavu agregace. Ve volně rozptýlených koloidních systémech (dýmy, soly) se částice nesrážejí...
Ferit (lat. ferrum - železo), fázová složka slitin železa, která je tuhým roztokem uhlíku a legujících prvků v α-železe (α-ferit). Má na tělo centrovanou krychlovou krystalovou mřížku. Je fázovou složkou jiných struktur, například perlitu, sestávajícího z feritu a cementitu.
Krystalizace (z řeckého κρύσταλλος, původně - led, později - horský křišťál, křišťál) - proces tvorby krystalů z plynů, roztoků, tavenin nebo skel. Krystalizace se také nazývá tvorba krystalů s danou strukturou z krystalů jiné struktury (polymorfní přeměny) nebo proces přechodu z kapalného stavu do pevného krystalického stavu. Díky krystalizaci dochází k tvorbě minerálů a ledu, zubní skloviny a kostí živých organismů. Současný růst velkého...
Kalorimetr (z lat. calor – teplo a metor – měřit) – přístroj na měření množství tepla uvolněného nebo absorbovaného při jakémkoli fyzikálním, chemickém nebo biologickém procesu. Termín „kalorimetr“ navrhli A. Lavoisier a P. Laplace (1780).
Vitrifikace je průměrná charakteristika rozměrů vnitřních dutin (kanály, póry) porézního tělesa nebo částic drcené fáze dispergovaného systému.
Ve fyzice je tání přechod látky z pevného do kapalného skupenství. Klasickými příklady procesu tání jsou tání ledu a přeměna pevného kusu cínu na tekutou pájku při zahřátí páječkou. Přenos určitého množství tepla do těla vede ke změně jeho stavu agregace.
Proč se pevná látka stává tekutou?
Zahřívání pevného tělesa vede ke zvýšení kinetické energie atomů a molekul, které se za normální teploty jednoznačně nacházejí v uzlech krystalové mřížky, což umožňuje tělesu udržovat stálý tvar a velikost. Při dosažení určitých kritických hodnot rychlostí začnou atomy a molekuly opouštět svá místa, přeruší se vazby, tělo začne ztrácet svůj tvar – stává se kapalným. Proces tavení neprobíhá náhle, ale postupně, takže po určitou dobu jsou pevné a kapalné složky (fáze) v rovnováze. Tání se týká endotermických procesů, to znamená těch, které probíhají při absorpci tepla. Opačný proces, kdy kapalina tuhne, se nazývá krystalizace.

Rýže. 1. Přechod pevného, krystalického, skupenství hmoty do kapalné fáze.
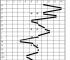
Bylo zjištěno, že až do konce procesu tavení se teplota nemění, ačkoli teplo je přiváděno neustále. Není zde žádný rozpor, protože přicházející energie během tohoto časového období je vynaložena na rozbití krystalických vazeb mřížky. Po zničení všech vazeb zvýší příliv tepla kinetickou energii molekul a následně začne stoupat teplota.

Rýže. 2. Graf tělesné teploty versus doba zahřívání.
Stanovení měrného tepla tání
Měrné teplo tání (označované řeckým písmenem „lambda“ - λ) je fyzikální veličina rovnající se množství tepla (v joulech), které musí být přeneseno na pevné těleso o hmotnosti 1 kg, aby bylo zcela převedeno do kapalná fáze. Vzorec pro měrné teplo tání je:
$$ λ =(Q \over m)$$
m je hmotnost tající látky;
Q je množství tepla přeneseného do látky během tavení.
Hodnoty pro různé látky jsou určeny experimentálně.
Když známe λ, můžeme vypočítat množství tepla, které musí být předáno tělesu o hmotnosti m k jeho úplnému roztavení:
V jakých jednotkách se měří měrné teplo tání?
Měrné teplo tání v SI (International System) se měří v joulech na kilogram, J / kg. Pro některé úkoly se používá mimosystémová jednotka měření - kilokalorie na kilogram, kcal / kg. Připomeňme, že 1 kcal = 4,1868 J.
Měrné skupenské teplo tání některých látek
Informace o specifických tepelných hodnotách pro konkrétní látku lze nalézt v odkazech na knihy nebo v elektronických verzích na internetových zdrojích. Obvykle jsou prezentovány ve formě tabulky:
Měrné skupenské teplo tání látek
Jednou z nejvíce žáruvzdorných látek je karbid tantalu – TaC. Taví se při teplotě 3990 0 C. TaC povlaky se používají k ochraně kovových forem, do kterých se odlévají hliníkové díly.

Rýže. 3. Proces tavení kovů.
co jsme se naučili?
Dozvěděli jsme se, že přechod z pevné látky na kapalinu se nazývá tání. K tání dochází přenosem tepla na pevnou látku. Měrné skupenské teplo tání ukazuje, kolik tepla (energie) je potřeba k tomu, aby pevná látka o hmotnosti 1 kg přešla do kapalného stavu.
Tématický kvíz
Vyhodnocení zprávy
Průměrné hodnocení: 4.7. Celkem obdržených hodnocení: 217.