Bei Verwendung von Katalysatoren ändert sich der Reaktionsweg. Einfluss von Katalysatoren auf die Geschwindigkeit chemischer Reaktionen
38. Einfluss des Katalysators auf die Geschwindigkeit chemischer Reaktionen. Gründe für den Einfluss des Katalysators.
Stoffe, die bei der Reaktion nicht verbraucht werden, aber ihre Geschwindigkeit beeinflussen, werden als Katalysatoren bezeichnet. Katalysatoren, die die Reaktionsgeschwindigkeit verringern, werden als Inhibitoren bezeichnet. Die Wirkung von Katalysatoren auf chemische Reaktionen nennt man Katalyse ... Das Wesen der Katalyse liegt darin, dass sich in Gegenwart eines Katalysators der Weg, auf dem die Gesamtreaktion abläuft, ändert, andere Übergangszustände mit anderen Aktivierungsenergien gebildet werden und sich damit auch die Geschwindigkeit ändert. chemische Reaktion... Unterscheiden Sie zwischen homogener und heterogener Katalyse. Bei der heterogenen Katalyse läuft die Reaktion auf der Katalysatoroberfläche ab. Daraus folgt, dass die Aktivität des Katalysators von der Größe und den Eigenschaften seiner Oberfläche abhängt. Um eine große Oberfläche zu haben, muss der Katalysator eine poröse Struktur aufweisen oder sich in einem stark fragmentierten Zustand befinden. Katalysatoren zeichnen sich durch ihre Selektivität aus: Sie wirken selektiv auf die Prozesse ein und lenken sie in eine bestimmte Richtung. Negative Katalyse wird verwendet, um Korrosion zu verhindern.
39. Reversible Prozesse. Chemisches Gleichgewicht. Gleichgewichtskonstante.
Reaktionen, die nur in eine Richtung verlaufen und mit der vollständigen Umwandlung der anfänglich reagierenden Stoffe in Endstoffe enden, werden als bezeichnet irreversibel... 2KClO 3 = 2KCl + 3O 2 . Reversibel man nennt solche Reaktionen, die gleichzeitig in zwei wechselseitig ablaufen gegenläufige Richtungen... 3H2 + N2 ⇆ 2NH3
Reversible Reaktionen laufen nicht vollständig ab: Keiner der Reaktanten wird vollständig verbraucht. Reversible Prozesse: Beim Mischen der Ausgangsstoffe ist die Geschwindigkeit der direkten Reaktion zunächst hoch und die Geschwindigkeit der Umkehrung gleich Null. Mit fortschreitender Reaktion werden die Edukte verbraucht und ihre Konzentrationen sinken, wodurch die Reaktionsgeschwindigkeit abnimmt. Gleichzeitig treten Reaktionsprodukte auf, deren Konzentration zunimmt und dementsprechend die Geschwindigkeit der Rückreaktion zunimmt. Wenn die Geschwindigkeiten der Hin- und Rückreaktion gleich werden, stellt sich ein chemisches Gleichgewicht ein. Es wird dynamisches Gleichgewicht genannt, da die Hin- und Rückreaktionen ablaufen, aber aufgrund der gleichen Geschwindigkeiten sind Änderungen im System nicht wahrnehmbar. Quantitatives Merkmal chemisches Gleichgewicht dient als eine Größe, die als Konstante des chemischen Gleichgewichts bezeichnet wird. Im Gleichgewicht sind die Geschwindigkeiten der Hin- und Rückreaktion gleich, während sich im System konstante Konzentrationen der Ausgangsstoffe und Reaktionsprodukte, sogenannte Gleichgewichtskonzentrationen, einstellen. Für 2CO + O 2 = 2CO 2 lässt sich die Gleichgewichtskonstante nach folgender Gleichung berechnen: Der Zahlenwert der Gleichgewichtskonstante charakterisiert in erster Näherung die Ausbeute dieser Reaktion. Die Reaktionsausbeute ist das Verhältnis der Menge der erhaltenen Substanz zu der Menge, die erhalten würde, wenn die Reaktion zu Ende verlaufen würde. K >> 1 die Reaktionsausbeute ist groß, K<10-6). В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в наиболее подвижной фазе. Катализатор не влияет на константу равновесия. Он может только ускорить наступление равновесия. K=e^(-ΔG/RT).
40. Der Einfluss verschiedener Faktoren auf die Verschiebung der Waage. Le Chatelier-Prinzip.
Befindet sich das System im Gleichgewicht, so bleibt es darin, solange die äußeren Bedingungen konstant bleiben. Der Prozess der Änderung von Bedingungen, die das Gleichgewicht beeinflussen, wird als Gleichgewichtsverschiebung bezeichnet.
Das Prinzip: Wenn das System. finden. im Gleichgewicht, um äußeren Einfluss auszuüben, dann das System des Verrats. auf eine Weise, die diese Auswirkungen ausgleicht.
Folgen: 1) Mit steigender Temp. Gleichgewicht verschoben. zugunsten einer endothermen Reaktion.
2) Mit steigendem Druck verschiebt sich das Gleichgewicht. zu einem kleineren Volumen (oder weniger.Anzahl von Molen)
3) Bei Konzentrationserhöhung eines der Ausgangsstoffe verschiebt sich das Gleichgewicht in Richtung einer Konzentrationserhöhung der Reaktionsprodukte und umgekehrt.
Stoffe, die an den Reaktionen teilnehmen und deren Geschwindigkeit erhöhen und bis zum Ende der Reaktion unverändert bleiben, werden als . bezeichnet Katalysatoren.
Das Phänomen einer Änderung der Reaktionsgeschwindigkeit unter dem Einfluss solcher Substanzen wird genannt Katalyse... Die unter Einwirkung von Katalysatoren ablaufenden Reaktionen heißen katalytisch.
In den meisten Fällen wird die Wirkung eines Katalysators dadurch erklärt, dass er die Aktivierungsenergie der Reaktion reduziert. In Gegenwart eines Katalysators durchläuft die Reaktion andere Zwischenstufen als ohne, und diese Stufen sind energetisch besser zugänglich. Mit anderen Worten, in Gegenwart eines Katalysators entstehen andere aktivierte Komplexe, für deren Bildung weniger Energie benötigt wird als für die Bildung von aktivierten Komplexen, die ohne Katalysator entstehen. Dadurch sinkt die Aktivierungsenergie stark: Einige Moleküle, deren Energie für aktive Kollisionen nicht ausreichte, erweisen sich nun als aktiv.
Zwischenprodukte wurden für eine Reihe von Reaktionen untersucht; in der Regel handelt es sich um sehr aktive, instabile Produkte.
Der Wirkungsmechanismus von Katalysatoren ist mit einer Abnahme der Aktivierungsenergie der Reaktion aufgrund der Bildung von Zwischenverbindungen verbunden. Die Katalyse kann wie folgt dargestellt werden:
A + K = A ... K
A ... K + B = AB + K,
wobei A ... K eine aktivierte Zwischenverbindung ist.
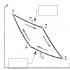
Abbildung 13.5 - Bild des Reaktionsweges der nicht-katalytischen A + B → AB-Reaktion (Kurve 1) und der homogen-katalytischen Reaktion (Kurve 2).
In der chemischen Industrie sind Katalysatoren weit verbreitet. Unter dem Einfluss von Katalysatoren können Reaktionen um einen Faktor von Millionen oder mehr beschleunigt werden. In einigen Fällen können unter Einwirkung von Katalysatoren solche Reaktionen initiiert werden, die unter diesen Bedingungen ohne sie praktisch nicht ablaufen.
Unterscheiden homogene und heterogene Katalyse.
Im Fall von homogene Katalyse Katalysator und Reaktanden bilden eine Phase (Gas oder Lösung). Im Fall von heterogene Katalyse der Katalysator befindet sich als eigenständige Phase im System.
Beispiele für homogene Katalyse:
1) Oxidation von SO 2 + 1 / 2O 2 = SO 3 in Gegenwart von NO; NO oxidiert leicht zu NO 2 und NO 2 oxidiert bereits SO 2;
2) Zersetzung von Wasserstoffperoxid in wässriger Lösung in Wasser und Sauerstoff: Ionen Cr 2 O 2 = 7, WO 2-4, MoO 2-4, die die Zersetzung von Wasserstoffperoxid katalysieren, bilden damit Zwischenverbindungen, die sich weiter zersetzen die Freisetzung von Sauerstoff.
Die homogene Katalyse erfolgt durch Zwischenreaktionen mit einem Katalysator, wodurch eine Reaktion mit hoher Aktivierungsenergie durch mehrere ersetzt wird, bei denen die Aktivierungsenergien niedriger und ihre Geschwindigkeit höher ist:
CO + 1 / 2O 2 = CO 2 (Katalysator - Wasserdampf).
Heterogene Katalyse ist in der chemischen Industrie weit verbreitet. Die meisten der derzeit von dieser Industrie hergestellten Produkte stammen aus der heterogenen Katalyse. Bei der heterogenen Katalyse läuft die Reaktion auf der Katalysatoroberfläche ab. Daraus folgt, dass die Aktivität des Katalysators von der Größe und den Eigenschaften seiner Oberfläche abhängt. Um eine große ("entwickelte") Oberfläche zu haben, muss der Katalysator eine poröse Struktur haben oder sich in einem stark fragmentierten (stark dispergierten) Zustand befinden. In der praktischen Anwendung wird der Katalysator üblicherweise auf einen Träger mit poröser Struktur (Bimsstein, Asbest usw.) aufgebracht.
Wie bei der homogenen Katalyse verläuft die Reaktion bei der heterogenen Katalyse über aktive Zwischenstufen. Aber hier sind diese Verbindungen Oberflächenverbindungen des Katalysators mit Reaktanten. Durch eine Reihe von Stufen, an denen diese Zwischenprodukte beteiligt sind, endet die Reaktion mit der Bildung von Endprodukten, und der Katalysator wird dadurch nicht verbraucht.
Alle katalytischen heterogenen Reaktionen umfassen Adsorptions- und Desorptionsschritte.
Die katalytische Wirkung der Oberfläche wird auf zwei Faktoren reduziert: eine Konzentrationserhöhung an der Grenzfläche und die Aktivierung von adsorbierten Molekülen.
Beispiele für heterogene Katalyse:
2H 2 O = 2H 2 O + O 2 (Katalysator – MnO 2);
H 2 + 1/2 O 2 = H 2 O (Katalysator – Platin).
Die Katalyse spielt in biologischen Systemen eine sehr wichtige Rolle. Die meisten chemischen Reaktionen, die im Verdauungssystem, im Blut und in den Zellen von Tieren und Menschen stattfinden, sind katalytische Reaktionen. Die Katalysatoren, hier Enzyme genannt, sind einfache oder komplexe Proteine. Speichel enthält also das Enzym Ptyalin, das die Umwandlung von Stärke in Zucker katalysiert. Ein im Magen vorkommendes Enzym, Pepsin, katalysiert den Abbau von Proteinen. Der menschliche Körper enthält etwa 30.000 verschiedene Enzyme: Jedes von ihnen dient als wirksamer Katalysator für die entsprechende Reaktion.
Katalysatoren sind Stoffe, die eine chemische Reaktion beschleunigen können, während die Katalysatoren selbst bei der chemischen Reaktion nicht verbraucht werden. Gefunden, dass Katalysatoren den Mechanismus einer chemischen Reaktion verändern. In diesem Fall treten andere, neue Übergangszustände auf, die durch eine geringere Höhe der Energiebarriere gekennzeichnet sind. Somit wird unter der Wirkung des Katalysators die
die Aktivierungsenergie des Prozesses (Abb. 3). Durch verschiedene Wechselwirkungen mit Zwischenpartikeln bleiben die Katalysatoren am Ende der Reaktion unverändert. Die Katalysatoren beeinflussen nur thermodynamisch zulässige Reaktionen. Der Katalysator kann keine Reaktion auslösen, weil hat keinen Einfluss auf seine treibenden Kräfte. Der Katalysator beeinflusst die chemische Gleichgewichtskonstante nicht, weil verringert gleichermaßen die Aktivierungsenergie von direkten und umgekehrten Reaktionen.
Abb.3 Energiediagramm des Reaktionsverlaufs A + B = AB a) ohne Katalysator und b) in Gegenwart eines Katalysators. Ea ist die Aktivierungsenergie einer nicht-katalytischen Reaktion; Еа 1 und Еа 2 - Aktivierungsenergie der katalytischen Reaktion; AK - intermediäre reaktive Verbindung des Katalysators mit einem der Reagenzien; A ... K, AK ... B - aktivierte Komplexe der katalytischen Reaktion; А ... В - aktivierter Komplex der nicht-katalytischen Reaktion; ∆E-Kat. - eine Abnahme der Aktivierungsenergie unter dem Einfluss des Katalysators.
Unterscheiden Sie zwischen homogener und heterogener Katalyse. Im ersten Fall befindet sich der Katalysator in der gleichen Phase mit den Reaktionspartnern, und im zweiten Fall ist der Katalysator ein Feststoff, an dessen Oberfläche eine chemische Reaktion zwischen den Reaktionspartnern stattfindet.
Chemisches Gleichgewicht
Chemische Reaktionen werden normalerweise in reversibel und irreversibel unterteilt. Irreversible chemische Reaktionen laufen bis zum vollständigen Verbrauch mindestens eines der Ausgangsstoffe, d.h. die Reaktionsprodukte wechselwirken entweder gar nicht miteinander oder sie bilden andere Stoffe als die ursprünglichen. Es gibt nur sehr wenige solcher Reaktionen. Zum Beispiel:
2KСlO 3 (tv) = 2KCl (tv) + 3О 2 (g)
In Elektrolytlösungen gelten Reaktionen, die zur Bildung von Niederschlägen, Gasen und schwachen Elektrolyten (Wasser, Komplexverbindungen) führen, als nahezu irreversibel.
Die meisten chemischen Reaktionen sind reversibel, d.h. sie gehen sowohl vorwärts als auch rückwärts. Dies wird möglich, wenn sich die Aktivierungsenergien der Vorwärts- und Rückwärtsprozesse unwesentlich voneinander unterscheiden und die Reaktionsprodukte in der Lage sind, sich in Ausgangsstoffe umzuwandeln. Die HI-Synthesereaktion ist beispielsweise eine typischerweise reversible Reaktion:
H 2 (g) + I 2 (g) ⇄ 2HI (g)
Das Massenwirkungsgesetz (Ausdruck der Reaktionsgeschwindigkeit) für den Vorwärts- bzw. Rückwärtsprozess hat die Form: = ∙;  = 2
= 2
Irgendwann tritt ein Zustand ein, in dem die Geschwindigkeiten der Hin- und Rückreaktion gleich werden = (Abb. 4).

Abb. 4 Geschwindigkeitsänderungen der Vorwärts- (und Rückwärts- (Reaktionen über die Zeit t
Dieser Zustand wird als chemisches Gleichgewicht bezeichnet. Es ist von Natur aus dynamisch (mobil) und kann sich je nach Änderung der äußeren Bedingungen in die eine oder andere Richtung verschieben. Ab dem Zeitpunkt des Gleichgewichts ändern sich unter konstanten äußeren Bedingungen die Konzentrationen der Ausgangsstoffe und Reaktionsprodukte im Laufe der Zeit nicht. Die dem Gleichgewichtszustand entsprechenden Konzentrationen der Reagenzien heißen Gleichgewicht... Um die Gleichgewichtskonzentration eines Reagenzes zu bestimmen, muss von seiner Anfangskonzentration die Menge einer Substanz abgezogen werden, die zum Zeitpunkt des Einsetzens eines Gleichgewichtszustands reagiert hat: MIT gleich = C ref. - MIT proreagir... Die Menge an Reagenzien, die in die Reaktion eingetreten sind und sich bis zum Zeitpunkt des Gleichgewichts der Produkte daraus gebildet haben, ist proportional zu den stöchiometrischen Koeffizienten in der Reaktionsgleichung.
Der Gleichgewichtszustand unter unveränderten äußeren Bedingungen kann beliebig lange bestehen. Im Gleichgewichtszustand
= [2, daher / [= 2 / ∙.
Bei konstanter Temperatur sind die Geschwindigkeitskonstanten des Vorwärts- und Rückwärtsprozesses konstante Werte.
Das Verhältnis zweier Konstanten ist auch der Wert der Konstanten K = / und heißt chemische Gleichgewichtskonstante... Es kann ausgedrückt werden
entweder durch die Konzentrationen der Reaktanten =, oder durch deren Partialdrücke  wenn die Reaktion unter Beteiligung von Gasen abläuft.
wenn die Reaktion unter Beteiligung von Gasen abläuft.
Im allgemeinen Fall ist für die Reaktion aA + bB +… ⇄cC + dD +… die chemische Gleichgewichtskonstante gleich dem Verhältnis des Produkts der Konzentrationen der Reaktionsprodukte zum Produkt der Konzentrationen der Ausgangsstoffe in Potenzen gleich ihren stöchiometrischen Koeffizienten.
Die Konstante des chemischen Gleichgewichts ist unabhängig vom Verlauf des Prozesses und bestimmt die Tiefe seines Verlaufs bis zum Erreichen des Gleichgewichtszustandes. Je größer dieser Wert ist, desto höher ist der Umwandlungsgrad von Reagenzien in Produkte.
Die chemische Gleichgewichtskonstante sowie die Reahängen nur von der Temperatur und der Art der reagierenden Stoffe ab und hängen nicht von deren Konzentration ab.
Bei heterogenen Prozessen geht die Feststoffkonzentration nicht in den Ausdruck für Reaktionsgeschwindigkeit und chemische Gleichgewichtskonstante ein, da die Reaktion läuft an der Oberfläche der Festphase ab, deren Konzentration über die Zeit konstant bleibt. Beispiel für eine Reaktion:
FeO (tv) + CO (g) ⇄ Fe (tv) + CO 2 (g)
der Ausdruck für die Gleichgewichtskonstante lautet:
K p und K mit stehen in Beziehung durch die Beziehung K P = K C (RT) ∆ n, wobei n = n prod. -n der Ausgangsstoffe - Änderung der Molzahl gasförmig Substanzen während der Reaktion. Für diese Reaktion gilt K p = K s, da n gasförmige Stoffe gleich Null sind.
Warum erhöhen Katalysatoren die Geschwindigkeit einer chemischen Reaktion? Es stellt sich heraus, dass sie ganz nach der Volksweisheit handeln: "Der Kluge geht nicht den Hügel hinauf, der Kluge wird den Berg umgehen." Damit Stoffe in Wechselwirkung treten können, muss ihren Teilchen (Moleküle, Atome, Ionen) eine bestimmte Energie, die sogenannte Aktivierungsenergie, gegeben werden (Abb. 13, a). Katalysatoren senken diese Energie, indem sie sich mit einer der reagierenden Substanzen verbinden und sie entlang des "Energieberges" leiten, um auf eine andere Substanz mit weniger Energie zu treffen. Daher laufen in Gegenwart eines Katalysators chemische Reaktionen nicht nur schneller, sondern auch bei einer niedrigeren Temperatur ab, was die Produktionskosten senkt.
Reis. 13.
Energiediagramme katalytischer Reaktionen mit konventionellen (a) und selektiven (b) Katalysatoren
Und nicht nur. Der Einsatz von Katalysatoren kann dazu führen, dass gleiche Stoffe unterschiedlich reagieren, also unter Bildung unterschiedlicher Produkte (Abb. 13, b). Zum Beispiel wird Ammoniak durch Sauerstoff zu Stickstoff und Wasser und in Gegenwart eines Katalysators zu Stickoxid (II) und Wasser oxidiert (schreiben Sie die Reaktionsgleichungen auf und betrachten Sie die Oxidations- und Reduktionsprozesse).
Der Prozess, die Geschwindigkeit einer chemischen Reaktion oder den Weg, den sie nimmt, zu ändern, wird als Katalyse bezeichnet. Wie bei Reaktionen gibt es homogene und heterogene Katalysearten. Bei der Verwendung von Enzymen wird die Katalyse als enzymatisch bezeichnet. Diese Art der Katalyse ist dem Menschen seit der Antike bekannt. Durch den enzymatischen Abbau organischer Stoffe lernte der Mensch Brot backen, Bier brauen, Wein und Käse herstellen (Abb. 14).

Reis. vierzehn.
Seit der Antike hat der Mensch die Katalyse verwendet, die beim Backen von Brot, beim Brauen von Bier, bei der Herstellung von Wein und bei der Käseherstellung auftritt.
Am bekanntesten im Alltag sind Enzyme, die in Waschpulvern enthalten sind. Mit ihnen können Sie die Wäsche beim Waschen von Flecken und unangenehmen Gerüchen befreien.
Schauen wir uns Katalysatoren anhand eines chemischen Experiments genauer an.
Wasserstoffperoxid (im Alltag wird es oft Wasserstoffperoxid genannt) ist ein Medikament, das in jeder Hausapotheke benötigt wird (Abb. 15).

Reis. fünfzehn.
Wasserstoffperoxidlösung
Das Verfallsdatum muss auf der Verpackung dieses Arzneimittels angegeben werden, da es sich während der Lagerung zersetzt:
![]()
Unter normalen Bedingungen läuft dieser Prozess jedoch so langsam ab, dass wir die Freisetzung von Sauerstoff nicht bemerken, und erst wenn wir die Flasche öffnen, in der das Wasserstoffperoxid lange gelagert wurde, können wir sehen, wie ein wenig Gas daraus freigesetzt wird . Wie kann dieser Prozess beschleunigt werden? Lassen Sie uns ein Laborexperiment durchführen.
Laborversuch Nr. 9 Abbau von Wasserstoffperoxid mit Mangan(IV)-oxid
Laborversuch Nr. 10
Nachweis von Katalase in Lebensmitteln
Katalysatoren machen nicht nur Produktionsprozesse wirtschaftlicher, sondern leisten auch einen wesentlichen Beitrag zum Umweltschutz. So sind moderne Pkw mit einem Katalysator ausgestattet, in dessen Inneren sich zellkeramische Katalysatorträger (Platin und Rhodium) befinden. Durch sie hindurch werden Schadstoffe (Kohlenstoffoxide, Stickstoff, unverbranntes Benzin) in Kohlendioxid, Stickstoff und Wasser umgewandelt (Abb. 16).

Reis. 16.
Ein Katalysator in einem Auto, der die Stickoxide seiner Abgase in harmlosen Stickstoff umwandelt
Für chemische Reaktionen sind jedoch nicht nur Katalysatoren wichtig, die die Reaktion beschleunigen, sondern auch Substanzen, die sie verlangsamen können. Solche Substanzen werden Inhibitoren genannt. Am bekanntesten sind Metallkorrosionsinhibitoren.
Laborversuch Nr. 11
Hemmung der Wechselwirkung von Säuren mit Metallen mit Urotropin
Im Wortschatz eines gewöhnlichen Menschen finden sich oft Wörter, die der Chemie entlehnt sind. Zum Beispiel Antioxidantien oder Antioxidantien. Welche Stoffe nennt man Antioxidantien? Sie haben wahrscheinlich bemerkt, dass Butter, wenn Sie sie längere Zeit lagern, ihre Farbe und ihren Geschmack ändert, einen unangenehmen Geruch annimmt - sie oxidiert an der Luft. Um den Verderb von Lebensmitteln zu verhindern, werden ihnen Antioxidantien zugesetzt. Sie spielen eine wichtige Rolle für die Erhaltung der menschlichen Gesundheit, da auch in seinem Körper unerwünschte Oxidationsprozesse ablaufen, wodurch ein Mensch krank wird, müde wird und schneller altert. Der menschliche Körper erhält Antioxidantien durch den Verzehr von Lebensmitteln, die beispielsweise Carotin (Vitamin A) und Vitamin E enthalten (Abb. 17).

Reis. 17.
Antioxidantien: a - β-Carotin; b - Vitamin E
So kann die Geschwindigkeit einer chemischen Reaktion mit Hilfe von Katalysatoren und Inhibitoren, Temperaturänderungen, Konzentration von Reaktanten, Druck (für homogene Gasreaktionen), Kontaktfläche von Reaktanten (für heterogene Prozesse) gesteuert werden. Und natürlich hängt die Geschwindigkeit der chemischen Reaktionen von der Art der reagierenden Substanzen ab.
Neue Wörter und Konzepte
- Katalysatoren.
- Enzyme.
- Katalyse (homogen, heterogen, enzymatisch).
- Inhibitoren.
- Antioxidantien
Aufgaben zum Selbststudium
- Was sind Katalysatoren? Welche Rolle spielen sie bei chemischen Reaktionen? Warum beschleunigen Katalysatoren den Ablauf chemischer Reaktionen?
- Welche Rolle spielte die enzymatische Katalyse in der Geschichte der menschlichen Zivilisation?
- Erstellen Sie einen Bericht über die Rolle von Katalysatoren in der modernen Fertigung.
- Erstellen Sie einen Bericht über die Rolle von Inhibitoren in der modernen Fertigung.
- Bereiten Sie ein Papier über die Rolle von Antioxidantien in der Medizin und der Lebensmittelindustrie vor.
In der 9.-10. Klasse der Sekundarstufe bilden sie weiter Konzepte über die Geschwindigkeit einer chemischen Reaktion, über den Einfluss verschiedener Faktoren auf die Geschwindigkeit chemischer Umwandlungen, erweitern und vertiefen das Wissen über Katalyse und Katalysatoren und geben Anregungen zu der Mechanismus katalytischer Phänomene.
Im Thema "Alkalimetalle", in dem Experimente wie die Wechselwirkung von Natrium mit Wasser und Salzsäure, die Wechselwirkung von Kalium und Natrium mit Wasser demonstriert werden, betont die Lehrkraft, dass einige dieser Reaktionen unter gleichen Bedingungen schneller ablaufen als andere. So reagiert beispielsweise Natrium mit Salzsäure stärker als mit Wasser; Kalium reagiert heftiger mit Wasser als Natrium. Nach Versuchen über die Verbrennung von Natrium, Kupfer, Antimon, Wasserstoff und organischen Substanzen in Chlor kann man Fragen stellen: "Warum wurde Antimonpulver zur Verbrennung in Chlor genommen und nicht Stücke? Warum brennt ein Bündel dünner Kupferdrähte in Chlor, aber ein dicker Draht brennt nicht?" In diesen Fällen erklärt sich die unterschiedliche Wechselwirkung der Stoffe entweder durch die Natur der Stoffe selbst und die Struktur der Atome oder durch eine unterschiedliche Kontaktfläche.
Im gleichen Thema ist es bei der Einführung der Schüler in die Eigenschaften von Salzsäure nützlich herauszufinden, warum sich die Reaktionen zwischen dieser Säure und Metallen (Zink, Magnesium) mit der Zeit beschleunigen. Die Beschleunigung hängt insbesondere davon ab, dass bei diesen Reaktionen viel Wärme freigesetzt wird und mit der Erwärmung von Stoffen die Wechselwirkungsgeschwindigkeit zunimmt.
Am Beispiel der Wechselwirkungsreaktion von Aluminium mit Jod sollte man sich daran erinnern, was ein Katalysator ist und zeigen, dass Wasser ein Katalysator sein kann. Auf das Asbestgewebe wird eine Mischung aus Jod- und Aluminiumpulver in einer Rutsche gegossen und einige Tropfen Wasser werden gegossen. Die Wechselwirkung von Stoffen unter Wassereinfluss wird beschleunigt, eine Flamme bricht aus. Der Lehrer weist darauf hin, dass bei der Mischung, die nicht aus dem Porzellanbecher auf das Netz gegossen wurde, der Blitz nicht aufgetreten ist, aber nach einiger Zeit und ohne Wasser auftreten kann.
Zu beachten ist, dass Wasser nicht nur die Wechselwirkung von Aluminium mit Jod beschleunigt, sondern auch bei vielen chemischen Prozessen eine katalytische Rolle spielt. Die katalytische Wirkung von Wasser bei der Verbrennung verschiedener Gase, die in der Technik verwendet werden, ist von großer Bedeutung.
Betrachtet man die Eigenschaften von Wasserstoffperoxid, wird darauf hingewiesen, dass Wasserstoffperoxid eine sehr zerbrechliche Substanz ist. Bei Lagerung in Glaswaren zersetzt es sich langsam unter Wärmeabgabe:
2H 2 O 2 = 2H 2 O 4 + O 2 + 46 kcal
Der Lehrer bittet die Schüler, die Bedingungen aufzulisten, die die Zersetzung von Wasserstoffperoxid beschleunigen. Sie können
geben in diesem Fall an: 1) Erhitzen, 2) die Wirkung von Katalysatoren, 3) eine Erhöhung der Konzentration der Lösung. Hinzuzufügen ist, dass die Zersetzung von Wasserstoffperoxid auch im Licht schneller erfolgt, dies kann durch Erfahrungen in außerschulischen Aktivitäten bestätigt werden. Gießen Sie Wasserstoffperoxid in zwei Flaschen, die in Gestellen befestigt sind, und verschließen Sie sie mit Stopfen mit Gasrohren. Stellen Sie die Röhrchen unter umgedrehte Zylinder oder mit Wasser gefüllte Reagenzgläser und senken Sie sie in ein breites Gefäß mit Wasser ab. Wickeln Sie eine der Flaschen mit schwarzem Papier ein. Stellen Sie die Geräte auf ein von der Sonne beleuchtetes Fenster oder beleuchten Sie sie mit einer elektrischen Lampe von 75-100 V. Die Erfahrung zeigt die schnelle Zersetzung von Wasserstoffperoxid unter Lichteinwirkung.
Dann untersuchen die Schüler in der Lektion selbstständig die Änderung der Zersetzungsgeschwindigkeit von Wasserstoffperoxid unter Einwirkung von Katalysatoren. Für die Arbeit geben sie eine 3-5% ige Lösung von Wasserstoffperoxid, Mangandioxid, konzentrierter Salzsäure, einem Splitter, einem Trichter, Filterpapier, mehreren Reagenzgläsern aus.
Aufgaben: 1) Prüfen Sie, ob sich in der ausgegebenen Lösung Wasserstoffperoxid zersetzt? 2) Beschleunigen Sie die Zersetzungsreaktion von Wasserstoffperoxid mit Mangandioxid. 3) Beweisen Sie, dass sich Mangandioxid durch die Reaktion chemisch nicht verändert hat * 4) Beweisen Sie, dass Mangandioxid, bereits als Katalysator verwendet, die Zersetzung von Wasserstoffperoxid wieder beschleunigen kann.
* (Probe mit Salzsäure beim Erhitzen.)
Nach selbstständiger Arbeit zeigt der Lehrer, dass verschiedene Katalysatoren verwendet werden können, um dieselbe chemische Reaktion zu beschleunigen, dass die Zersetzung einer anorganischen Substanz (Wasserstoffperoxid) durch organische Katalysatoren - Enzyme - beschleunigt wird. Eine 3%ige Wasserstoffperoxidlösung wird in einen kleinen Becher gegossen, dann wird ein kleines Stück rohes Fleisch hineingelegt. Sauerstoff wird intensiv aus der Lösung freigesetzt, da das Enzym Katalase im Blut und Gewebe von Tieren enthalten ist. Es sollte betont werden, dass Enzyme ausgezeichnete natürliche Reaktionsbeschleuniger sind. Eine der wichtigen Aufgaben der Chemie der Zukunft ist die künstliche Herstellung und industrielle Anwendung von Katalysatoren, die in ihrer Zusammensetzung und ihren katalytischen Eigenschaften Enzymen ähneln.
Es wurde ein Experiment durchgeführt, um zu erklären, warum die Zersetzung von Wasserstoffperoxid bei Lagerung in Glaswaren schneller abläuft. In drei Reagenzgläser wird eine Lösung von Wasserstoffperoxid gegossen, in eines wird eine Lösung von Schwefelsäure gegeben, in das andere wird Natronlauge gegeben und das dritte wird zum Vergleich (Kontrolllösung) belassen. Alle drei Lösungen werden erhitzt (nicht zum Sieden). Sauerstoff wird aus dem Reagenzglas mit Wasserstoffperoxid und Natronlauge stark freigesetzt, weniger stark - aus dem Reagenzglas mit Kontrolllösung. In Gegenwart von Schwefelsäure (Wasserstoffionen) zersetzt sich Wasserstoffperoxid nicht. OH-Ionen katalysieren die Zersetzung von Wasserstoffperoxid, daher zersetzt sich Wasserstoffperoxid in Glaswaren, deren Wände Hydroxylionen in die Lösung abgeben, leicht.
Die Konsolidierung und Entwicklung des Wissens über die Geschwindigkeit einer chemischen Reaktion wird weiter fortgesetzt. Der Lehrer führt ein Schwefeldioxid-Sauerstoff-Gemisch ohne Katalysator durch ein beheiztes Glasrohr und zeigt, dass die Bildung von Schwefelsäureanhydrid unter diesen Bedingungen nicht spürbar ist und fragt die Schüler, wie die Wechselwirkung von Gasen beschleunigt werden kann. Im Gespräch stellt sich heraus, dass solche Methoden zur Beschleunigung von Reaktionen wie Erhöhung der Konzentration von Reagenzien, Erhöhung der Temperatur ohne Verwendung eines Katalysators nicht die erforderlichen Ergebnisse liefern. Die Oxidationsreaktion von Schwefeldioxid zu Schwefelsäure ist reversibel:
2SO 2 + O 2 ↔ 2SO 3 + Q,
und eine Temperaturerhöhung beschleunigt die Zersetzung von Schwefelsäureanhydrid stärker als seine Bildung.
Es wird geprüft, ob Eisenoxid ein Katalysator für die Oxidationsreaktion von Schwefeldioxid ist. Beim Nachweis der Kontaktoxidation von Schwefeldioxid zu Schwefelsäureanhydrid in Gegenwart von Eisenoxid wird die Bildung von an Luft rauchender Schwefelsäureanhydrid beobachtet. Es zeigt sich dann, dass die Reaktion das Eisenoxid chemisch nicht verändert. Wiederholen Sie dazu die Erfahrung der Kontaktoxidation von Schwefeldioxid zu Schwefelsäureanhydrid mit derselben Portion Eisenoxid. Es sei ferner darauf hingewiesen, dass verschiedene Katalysatoren verwendet werden können, um die Oxidation von Schwefeldioxid zu beschleunigen. In der chemischen Industrie wurde neben Eisenoxid Platin verwendet, nun kommt Vanadiumpentoxid V 2 O 5 * zum Einsatz.
* (Der derzeit verwendete Vanadium-Katalysator hat eine komplexe Zusammensetzung (siehe: D. A. Epshtein. Chemielehrer für chemische Technologie, Moskau, Verlag der Akademie der Pädagogischen Wissenschaften der RSFSR, 1961).)
Es ist auch wichtig, die Eigenschaft des Katalysators hervorzuheben, die Reaktion zu beschleunigen, seine Reversibilität nicht zu beeinflussen: Die Oxidationsreaktion von Schwefeldioxid zu Schwefelsäure bleibt im Falle der Verwendung eines Katalysators reversibel.
Bei der Untersuchung des Kontaktverfahrens zur Herstellung von Schwefelsäure muss der Einsatz des Katalysators in der Industrie berücksichtigt werden. Ohne Katalysator wäre die schnelle Herstellung großer Mengen an Schwefelsäureanhydrid nicht möglich, sein Einsatz stellt jedoch einige zusätzliche Anforderungen an die Verfahrensbedingungen. Tatsache ist, dass sich Verunreinigungen der Reaktanden negativ auf den Katalysator auswirken. Arsentrioxid, wie sie sagen, "vergiftet" es negativ auf den Vanadium-Katalysator. Daher ist es notwendig, die reagierenden Gase gründlich von Verunreinigungen zu reinigen.
Wenn Schüler eine Frage haben, warum der Katalysator vergiftet ist, erklärt der Lehrer zunächst seine Wirkung anhand der Theorie der Bildung von Zwischenprodukten und betrachtet dann die giftige Wirkung von Verunreinigungen.
Die Beschleunigung von Reaktionen mit Hilfe eines Katalysators erfolgt dadurch, dass dieser mit den Ausgangsstoffen zerbrechliche Verbindungen eingeht und sich dann in freier Form wieder trennt. Diese Reaktionen sind viel schneller als die Reaktion zwischen Schwefeldioxid und Sauerstoff. Befinden sich Verunreinigungen im Gasgemisch, die mit dem Katalysator irreversible Reaktionen eingehen, wird dieser vergiftet. Trotz sorgfältiger Reinigung von Gasen nimmt die Aktivität von Katalysatoren, die bei der Herstellung von Schwefelsäure verwendet werden, mit der Zeit ab. Seine "Alterung" wird nicht nur durch eine allmähliche Vergiftung verursacht, sondern auch durch längeres Erhitzen und mechanische Zerstörung, die den Zustand der Katalysatoroberfläche verändern. Nicht die gesamte Oberfläche des Katalysators nimmt an der katalysierten Reaktion teil, sondern nur seine getrimmten Abschnitte - aktive Zentren, und die Anzahl dieser Zentren nimmt während der "Alterung" ab.
Im vorigen Abschnitt wurde diskutiert, wie im Lichte der Atomstrukturtheorie den Studenten die Wirkung von Energie auf die Anregung einer chemischen Reaktion erklärt werden soll. Damit kann die Frage gelöst werden, warum chemische Reaktionen beim Erhitzen beschleunigt werden. Die Studierenden wissen, dass mit steigender Temperatur in Stoffen die Zahl der aktiven Moleküle, die Bewegungsgeschwindigkeit der Moleküle und die Zahl ihrer Begegnungen pro Zeiteinheit zunimmt. In den Atomen aktiver Moleküle werden Elektronen auf höhere Energieniveaus bewegt, solche Moleküle sind instabil und können leichter mit Molekülen anderer Stoffe reagieren.
Die Theorie der elektrolytischen Dissoziation ermöglicht es zu erklären, warum Reaktionen zwischen Lösungen von Säuren, Salzen und Basen fast augenblicklich ablaufen. Die Lösungen dieser Substanzen enthalten bereits aktive Partikel - entgegengesetzt geladene Ionen. Daher verlaufen die Reaktionen zwischen wässrigen Lösungen von Säuren, Salzen und Basen sehr schnell und unterscheiden sich deutlich von den Reaktionen zwischen den gleichen Substanzen, die jedoch in trockener Form aufgenommen werden.
Zu Beginn der Lektion zum Thema "Die Geschwindigkeit einer chemischen Reaktion" erinnert der Lehrer daran, dass chemische Reaktionen mit unterschiedlichen Geschwindigkeiten ablaufen können, das Studium der Bedingungen, die sie beeinflussen, ist von großer praktischer Bedeutung.
Wie kann man die Geschwindigkeit einer chemischen Reaktion messen?
Die Studierenden wissen bereits, dass die Geschwindigkeit der chemischen Umwandlung an der Menge einer Substanz gemessen werden kann, die eine Reaktion eingegangen ist oder in einer bestimmten Zeit erhalten wird, dass die Geschwindigkeit der mechanischen Bewegung an der Strecke gemessen wird, die ein Körper pro Zeiteinheit zurücklegt ; Um diese Geschwindigkeit zu berechnen, verwenden Sie die Formel
Dabei ist v die Geschwindigkeit, S der Weg und t die Zeit.
Vor diesem Hintergrund schreiben die Schüler analog die Formel zur Berechnung der Geschwindigkeit einer chemischen Reaktion
wobei m die Menge eines Stoffes ist, die während der Zeit t in die Reaktion eingetreten ist oder durch sie gewonnen wird.
Überlegen Sie, was der Nachteil dieser Formel ist. Es stellt sich heraus, dass bei der Verwendung die berechnete Reaktionsgeschwindigkeit selbst für zwei Portionen derselben Substanz, die unter denselben Bedingungen eingenommen wird, unterschiedlich ist.
Angenommen, jede Sekunde werden 15 g einer Substanz in einem Gefäß zersetzt. Es stellt sich heraus, dass, wenn in dieses Gefäß eine Trennwand eingeführt wird, die die darin enthaltene Substanz im Verhältnis 1: 2 in zwei Teile aufteilt, im ersten (kleineren) Teil die Reaktion mit einer Geschwindigkeit von 5 g / s abläuft , und in der zweiten - 10 g / sek.
Damit die berechnete Geschwindigkeit die Reaktion selbst und nicht die Menge der Ausgangssubstanz charakterisiert, muss die Massenänderung der reagierenden Substanz bezogen auf das Volumen berücksichtigt werden, dh die Änderung in die Konzentration des reagierenden Stoffes. Daher kann die Geschwindigkeit einer chemischen Reaktion nach der Formel berechnet werden:
v = c 0 -c t / t
wobei c 0 die Anfangskonzentration einer der reagierenden Substanzen ist, c t die Konzentration derselben Substanz nach t Sekunden ist. Bei der Berechnung der Geschwindigkeit wird die Konzentration normalerweise in Mol pro Liter und die Zeit in Sekunden angegeben.
Diese Lektion konzentriert sich auf die wichtigsten Methoden zur Beschleunigung chemischer Reaktionen. Dazu wird ein Laborversuch durchgeführt, der zeigt, dass die Geschwindigkeit einer chemischen Reaktion von der Konzentration der reagierenden Stoffe abhängt.
Für das Experiment wird die folgende Ausrüstung verwendet, die auf Schülertischen gestellt wird: 1) ein Stativ mit drei Reagenzgläsern, von denen eines einen Kristall aus Natriumjodid oder Kaliumjodid (2 bis 3 Stecknadelköpfe) enthält, das andere enthält eine Lösung von Eisenchlorid und das dritte - leer; 2) eine Flasche oder ein Glas Wasser; 3) zwei identische Glasröhren; 4) Glasstab.
Der Lehrer fordert die Schüler auf, sich auf das Experiment vorzubereiten: 1) Wasser zu Natriumjodid geben, um 1/2 Reagenzglas der Lösung zu bilden, und die Flüssigkeit mit einem Stäbchen mischen, 2) 1/3 der resultierenden Lösung in ein anderes Reagenzglas gießen , 3) fügen Sie der gegossenen Lösung ein Reagenzglas mit einer Wasserlösung hinzu, so dass die Volumina der Lösungen von Natriumjodid (oder Kaliumjodid) in den Reagenzgläsern gleich sind.
Der Lehrer stellt Fragen, um zu überprüfen, wie die Schüler die Anweisungen verstehen:
1) Wie oft wird die Natriumjodidlösung im zweiten Reagenzglas verdünnt?
2) Wie oft ist die Salzkonzentration im ersten Röhrchen höher als im zweiten?
Es ist zu beachten, dass die Konzentration einer der Lösungen doppelt so hoch ist wie die Konzentration der anderen. Danach wird in zwei vorbereiteten Lösungen die Reaktion von Eisenchlorid mit Natriumjodid durchgeführt, die mit der Freisetzung von freiem Jod einhergeht:
2NaI + 2FeCl 3 = 2NaCl + 2FeCl 2 + I 2,
2I - + 2Fe 3+ = 2Fe 2+ + I 2.
Die Studierenden entscheiden, in welchem Reagenzglas die Wechselwirkungsrate von Salzen größer ist und nach welchen Kriterien sie beurteilt werden kann. Die Annahme wird durch Erfahrung geprüft.
In beide Reagenzgläser mit Lösungen von Natriumjodid (oder Kaliumjodid) zuerst die gleiche Menge Stärkepaste (1-2 ml) und dann nach dem Rühren einige Tropfen 5-10%ige Eisenchloridlösung gegossen. Es empfiehlt sich, in beide Reagenzgläser gleichzeitig eine Eisenchloridlösung zu geben. Eine blaue Farbe erscheint wahrscheinlicher in einem Reagenzglas mit einer Lösung höherer Konzentration. Im Reagenzglas, in dem die Konzentration der Lösung höher ist, werden Jodionen häufiger mit Eisenionen gefunden und interagieren daher häufiger mit ihnen - die Reaktion läuft schneller ab.
Der Lehrer zeigt das Verbrennen von Schwefel in der Luft und fragt die Schüler, wie diese Reaktion beschleunigt werden kann. Die Schüler schlagen vor, brennenden Schwefel in Sauerstoff zu geben und dieses Experiment durchzuführen. Basierend auf der Analyse der Experimente wird eine allgemeine Schlussfolgerung gezogen: Die Geschwindigkeit einer chemischen Reaktion hängt von der Konzentration der Reaktanten (von der Anzahl der Ionen oder Moleküle pro Volumeneinheit) ab.
Sie wenden sich der Frage nach der Auswirkung auf die chemische Reaktionsgeschwindigkeit der Oberfläche der reagierenden Substanzen zu. Die Schüler erinnern sich an die Reaktionen beim Rühren und Mahlen von Reaktionspartnern: Mahlen einer Mischung aus Ammoniak mit gelöschtem Kalk, Wechselwirkung von kleinen Marmor- oder Zinkstücken mit Salzsäure, Verbrennen von pulverisiertem Brennstoff in Düsen, Verwendung von zerkleinerten Erzen beim Schmelzen von Metallen und Pyrit in der Herstellung von Schwefelsäure. Die Bedingungen für das Rösten von Pyrit bei der Herstellung von Schwefelsäure werden genauer diskutiert. Zur Gewinnung von Schwefeldioxid wird zerkleinerter Pyrit verwendet, da dieser schneller verbrennt als in großen Stücken aufgenommener Pyrit. Besonders schnell verläuft die Verbrennung von Pyritpulver, wenn es mit einem Luftstrom aus der Düse ausgestoßen wird, sowie beim Verbrennen in einer Wirbelschicht, wenn die gesamte Oberfläche der Pyritstücke mit Luft in Berührung kommt.
Es ist zu beachten, dass chemische Reaktionen mit stark zerkleinerten brennbaren Stoffen mit einer Explosion einhergehen können. In Zuckerfabriken kam es beispielsweise zu Explosionen von Zuckerstaub.
Daraus wird geschlossen, dass die Geschwindigkeit der chemischen Reaktion, an der er teilnimmt, umso größer ist, je mehr der Feststoff gemahlen wird.
Anschließend wird der Einfluss der Temperatur auf die Geschwindigkeit der chemischen Reaktion analysiert. Die gleiche Menge Schwefelsäurelösung wird mit 1/4 der Hyposulfitlösung in ein Reagenzglas gegossen; Parallel zu diesem Experiment werden erhitzte Lösungen von Hyposulfit und Schwefelsäure abgelassen:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + SO 2 + S ↓
Die Zeit bis zur Trübung der Lösungen wird notiert. Der Lehrer sagt, dass wenn die Temperatur um 10 ° C steigt, die Geschwindigkeit der meisten Reaktionen um das 2-3-fache steigt.
Auf Basis der erworbenen Kenntnisse wird den Studierenden die Möglichkeit gegeben, die Beschleunigung chemischer Reaktionen beim Erhitzen von Stoffen zu erläutern.
Die Erfahrung mit der katalytischen Wirkung von Stoffen muss in dieser Lektion nicht demonstriert werden, da die Schüler diese an Beispielen der Zersetzung von Wasserstoffperoxid und der Oxidation von Schwefeldioxid kennengelernt haben. Sie listen die ihnen bekannten katalytischen Reaktionen auf, geben Definitionen von Katalyse und Katalysator.
Um das Wissen in dieser Lektion zu festigen, bieten sie Fragen:
- Was bestimmt die Geschwindigkeit einer chemischen Reaktion? Nenne Beispiele.
- Unter welchen Bedingungen erhöht sich die Geschwindigkeit einer chemischen Reaktion?
- Wie lässt sich im Lichte der Theorie der elektrolytischen Dissoziation erklären, dass die Wasserstoffentwicklung bei der Wechselwirkung von Zink mit Essigsäure viel langsamer abläuft als bei der Wechselwirkung von Zink mit Salzsäure?
- Welche Methoden können verwendet werden, um die Reaktion der Wechselwirkung von Zink mit Salzsäure zu beschleunigen?
- Warum flammt ein in der Luft glimmender Splitter in Sauerstoff auf?
- Sie erhalten zwei Reagenzgläser, in denen die Wechselwirkung von Calciumcarbonat mit Salzsäure langsam abläuft. Versuchen Sie, die chemische Reaktion in jedem Röhrchen mit verschiedenen Techniken zu beschleunigen.
- Warum nimmt die Geschwindigkeit einer chemischen Reaktion mit steigender Temperatur zu?
- Welche Methoden zur Beschleunigung chemischer Reaktionen werden bei der Herstellung von Schwefelsäure verwendet?
- Listen Sie auf, welche chemischen Reaktionen bekanntlich durch Katalysatoren beschleunigt werden.
Bei der Untersuchung der Reaktion der Ammoniaksynthese stoßen die Studierenden wieder auf den Einsatz eines Katalysators, und neben der Konsolidierung zuvor gewonnener Informationen über Katalyse und einen Katalysator kann dieses Wissen etwas entwickelt werden.
Der Lehrer weist darauf hin, dass beide Reaktionen - die Synthese von Ammoniak und dessen Zersetzung in Stickstoff und Wasserstoff - in Gegenwart des gleichen Katalysators - reduziertem Eisen - ablaufen, was sowohl Direkt- als auch Rückreaktionen gleichermaßen beschleunigt. Daher verschiebt der Katalysator das chemische Gleichgewicht nicht, sondern trägt nur dazu bei, diesen Zustand schneller zu erreichen. Um ihr Verständnis dieser Position zu testen, stellt der Lehrer ihnen Fragen:
- Ist es möglich, Ammoniak in der Produktion aus einem Gemisch aus Stickstoff und Wasserstoff unter hohem Druck und Erhitzen zu gewinnen, aber ohne Katalysator? Wieso den?
- Die Ammoniaksynthesereaktion wird durch Erhitzen und einen Katalysator beschleunigt. Was ist der Unterschied in der Wirkung dieser Bedingungen auf das chemische Gleichgewicht?
Der Lehrer führt die Schüler in die Synthese von Ammoniak in der Produktion ein und weist darauf hin, dass der Katalysator schnell seine Aktivität verliert, wenn die Gase (Wasserstoff und Stickstoff) nicht zuvor von Verunreinigungen befreit werden. Dabei wirken Sauerstoff, Wasserdampf, Kohlenmonoxid, Schwefelwasserstoff und andere Schwefelverbindungen toxisch.
Wie bei der katalytischen Oxidation von Schwefeldioxid zu Trioxid entfaltet der Katalysator bei der Ammoniaksynthese seine beschleunigende Wirkung nur in bestimmten Temperaturbereichen. Bei Temperaturen über 600 °C verringert reduziertes Eisen seine katalytische Aktivität.
Am Beispiel der Ammoniaksynthese kann der Wirkmechanismus des Katalysators betrachtet werden. Es wird darauf hingewiesen, dass auf der Oberfläche des Eisenkatalysators Eisennitrid gebildet wird:
Wasserstoff reagiert mit Nitrid, Ammoniak wird gewonnen:
FeN 2 + 3H 2 → Fe + 2NH 3.
Dann wird der Vorgang wiederholt.
Die Reaktionen der Bildung von Eisennitrid und seiner Wechselwirkung mit Wasserstoff sind sehr schnell.
Bei der Untersuchung der Reaktionen der Ammoniakoxidation werden die Studenten nach der Demonstration von Experimenten zur Verbrennung von Ammoniak in Sauerstoff und der katalytischen Oxidation von Ammoniak darauf aufmerksam gemacht, dass die Ausgangsmaterialien in diesen beiden Fällen die gleichen waren, jedoch abhängig von den Bedingungen (die Verwendung eines Katalysators) werden verschiedene Produkte erhalten. ...
Die Oxidation von Ammoniak kann mit der Bildung verschiedener Stoffe nach den Gleichungen einhergehen:
4NH 3 + 3O 2 = 2N 2 + 6H 2 O;
4NH 3 + 4O 2 = 2N 2 O + 6H 2 O;
4NH 3 + 5O 2 = 4NO + 6H 2 O.
Der Katalysator Platin beschleunigt nur die letzte dieser Reaktionen. Daher ist es mit einem Katalysator möglich, die Wechselwirkung von Ammoniak und Sauerstoff in die gewünschte Richtung zu lenken. Es findet Anwendung in der chemischen Industrie bei der Herstellung von Salpetersäure.
Die Ausbildung in der 9. Klasse des Konzepts der chemischen Produktion bietet große Möglichkeiten, die Schüler mit der praktischen Steuerung der Geschwindigkeit chemischer Reaktionen in Chemieanlagen vertraut zu machen.
Ausgehend von der Verallgemeinerung des Wissens über zuvor untersuchte Industrien (Salz-, Schwefel-, Salpetersäure, Ammoniak) bildet der Lehrer in den Schülern das Konzept der besten Bedingungen für die Durchführung chemischer Reaktionen in der Produktion: die Verwendung optimaler Temperaturen, eine Erhöhung der Konzentration der Reaktanten, eine Erhöhung der Kontaktoberfläche der Reaktanten, die Verwendung von Katalysatoren. Um die Umstände zu identifizieren, die die Anwendung jeder Bedingung einschränken, wird den Studenten anschließend die Frage gestellt: "Ist es möglich, die Temperatur unbegrenzt zu erhöhen, um chemische Reaktionen in der Produktion zu beschleunigen?" Es zeigt sich, dass starke Erwärmung das chemische Gleichgewicht in eine unerwünschte Richtung verschieben und bei Verwendung eines Katalysators dessen Aktivität verringern kann. Vor diesem Hintergrund werden in der Produktion nicht maximale, sondern optimale Temperaturen verwendet.
Andere Bedingungen für die Durchführung chemischer Reaktionen in der Produktion werden in gleicher Weise analysiert.
Das Studium von neuem Faktenmaterial zur Chemie in den IX-X-Klassen dient der weiteren Festigung des Wissens über die Geschwindigkeit einer chemischen Reaktion.
Beim Studium der Eigenschaften von weißem Phosphor sagt der Lehrer, dass das Leuchten von weißem Phosphor im Dunkeln auf seine langsame Oxidation an der Luft hinweist. Als nächstes wird überlegt, unter welchen Bedingungen die Oxidation von weißem Phosphor beschleunigt werden kann. Erhitzen, Fragmentierung von Phosphor, die Verwendung von Sauerstoff beschleunigen die Oxidation von Phosphor tatsächlich und lassen ihn aufblitzen.
Die Studierenden nutzen ihr Wissen zur Beschleunigung chemischer Prozesse, um die Bedingungen für die Superphosphatbildung vorherzusagen. Sie sagen, dass die Reaktion zwischen tertiärem Calciumphosphat und Schwefelsäure durch Erhitzen, Mahlen von Calciumphosphat, Rühren und Erhöhung der Schwefelsäurekonzentration beschleunigt werden kann. Der Lehrer fasst das Gesagte zusammen und fügt hinzu, dass in
Bei dieser Produktion wird eigentlich geheizt, aber dafür nutzen sie die Wärme, die während der Reaktion selbst freigesetzt wird, wenn gemahlenes tertiäres Calciumphosphat gründlich mit Schwefelsäure vermischt wird.
Beim Studium organischer Stoffe sind die Studierenden mit sehr vielen Prozessen konfrontiert, die unter Beteiligung von Katalysatoren führen, beispielsweise zur Herstellung von Flugbenzin, Kautschuk, aromatischen Kohlenwasserstoffen.
Die Rolle von Schwefelsäure bei der Hydratation von Ethylen kann berücksichtigt werden. Anstelle der langsamen Reaktion der Anlagerung von Wasser an Ethylen (C 2 H 4 + H 2 O → C 2 H 5 OH) laufen in Gegenwart von Schwefelsäure folgende Prozesse schnell nacheinander ab: 1) Schwefelsäure wird zu Ethylen hinzugefügt, wobei Ethylsulfat entsteht:
2) Ethylsulfat wird verseift, um Ethylalkohol und Schwefelsäure zu bilden.
Nach dem Abdestillieren des Alkohols tritt Schwefelsäure in gleicher Menge auf, die jedoch an der Bildung eines Zwischenprodukts beteiligt ist. Andere Beispiele für die katalytische Wirkung von Schwefelsäure (die Bildung von Ethylen und Ethylether aus Ethylalkohol) werden von den Studierenden bei der Hausaufgabe selbstständig analysiert.
Dieselben Stoffe, mit demselben Katalysator, aber bei unterschiedlichen Temperaturen reagieren zu unterschiedlichen Produkten. Dies sollte betont werden, wenn Sie sich mit den Eigenschaften von Alkoholen vertraut machen.
Die Wechselwirkung von Kohlenmonoxid mit Wasserstoff zeigt, dass mit unterschiedlichen Katalysatoren aus den gleichen Stoffen unterschiedliche organische Produkte gewonnen werden können. Diese Wechselwirkung kann unter Bildung von Methylalkohol, Kohlenwasserstoffen oder höheren Alkoholen erfolgen. Die gewünschte Richtung der Wechselwirkung von Stoffen wird durch den Einsatz eines Katalysators erreicht, der die entsprechende Reaktion beschleunigt, aber andere nicht wesentlich beeinflusst. Um die Reaktion der Methylalkoholbildung zu beschleunigen, wird als Katalysator eine Mischung von Chromoxiden mit Zinkoxid verwendet.
Nach dem Studium von Kohlenwasserstoffen und sauerstoffhaltigen organischen Verbindungen wird den Schülern zur Verallgemeinerung eine Aufgabe zur selbstständigen Arbeit im Klassenzimmer oder zu Hause angeboten: Wählen Sie aus diesem und jenem Abschnitt des Lehrbuchs alle Fälle katalytischer Reaktionen aus, und jeder Schüler erhält nur einen Teil des Lehrbuchmaterials, den er in der vorgesehenen Zeit einsehen kann ...
Bei der Analyse industrieller Methoden zur Gewinnung organischer Substanzen ist es nützlich, die Aufmerksamkeit der Studenten darauf zu lenken, dass die gleichen Techniken zur Steuerung der Geschwindigkeit chemischer Reaktionen verwendet werden, die bei der Herstellung von anorganischen