سیلیکون و ترکیبات آن سیلیکون در طبیعت
کلروسیلان ها مهم ترین معرف ها در صنایع شیمیایی هستند که بسیاری از آنها از کلرزنی پیوند سیلیکون-هیدروژن (Si-H) به دست می آیند. چنین کلرزنی معمولاً از طریق استفاده از معرفهای سمی و/یا گرانقیمت حاوی فلز حاصل میشود. محققان دانشگاه تل آویو یک روش کاتالیزوری جدید، ساده، انتخابی و بسیار کارآمد برای کلرزنی پیوندهای Si-H بدون استفاده از فلزات یافته اند. ترکیب بور tris(pentafluorophenyl)borane B(C 6 F 5) 3 به عنوان کاتالیزور و هیدروکلریک اسید هیدروکلریک به عنوان عامل کلرکننده استفاده می شود. مکانیسم واکنش بر اساس واکنشهای رقیب و محاسبات مکانیکی کوانتومی پیشنهاد شد. اثر در منتشر شد Angewandte Chemie International Edition- یکی از تاثیرگذارترین مجلات شیمی در جهان.
کلروسیلان ها - موادی با پیوند سیلیکون-کلر با فرمول کلی R3 Si-Cl (که در آن R هر گروه آلی، هیدروژن یا کلر دیگر است) - در بسیاری از شاخه های شیمی آلی استفاده می شود: سنتز داروها، پلیمرها و بسیاری دیگر. مواد به عنوان مثال، تقریباً هیچ سنتز آلی چند مرحله ای بدون آنها نمی تواند انجام شود، زیرا بسیاری از گروه های فعال با کمک آنها محافظت می شوند (همچنین به گروه محافظت مراجعه کنید). اگر چندین گروه فعال روی مولکول وجود داشته باشد، می توان یکی از آنها را به طور انتخابی (بدون تأثیر بر روی بقیه) توسط یک محافظ سیلیکونی (سیلیل اتر) با استفاده از کلروسیلان مناسب مسدود کرد، سپس واکنش های مورد نظر را می توان با سایر گروه های واکنش پذیر انجام داد. در مرحله بعد، محافظ سیلیکونی را می توان حذف کرد و گروه محافظت شده را برای واکنش های بعدی آزاد کرد. گروه محافظ سیلیکون به راحتی بدون تأثیر بر سایر قسمت های مولکول حذف می شود، بنابراین این محافظ بسیار محبوب است. گروه های مختلف برای محافظت به شرایط متفاوتی نیاز دارند. علاوه بر این، معمولاً گروههای مشابهی که در محیطهای شیمیایی مختلف قرار میگیرند، واکنشهای متفاوتی نشان میدهند. بنابراین شیمیدان ها به کلروسیلان هایی با واکنش پذیری متفاوت یا به عبارت دیگر با گروه های مختلف روی اتم سیلیکون نیاز دارند.
یکی از رایج ترین روش ها برای به دست آوردن کلروسیلان ها، کلرزنی پیوند سیلیکون-هیدروژن (Si-H) است. روشهای کلاسیک (از جمله تجاری) کلرزنی این پیوندها را میتوان به طور معمول به استوکیومتری (برای هر مول از پیوند کلردار، تعداد مول مربوط به عامل فعالکننده مورد نیاز است) و کاتالیزوری (کاتالیزور مولکول را فعال میکند و پس از آن کلرزنی، به حالت اولیه خود باز می گردد تا مولکول بعدی را فعال کند). کلرزنی استوکیومتری پیوندهای Si-H با استفاده از نمک های فلزی در ترکیب با منابع خطرناک کلر مانند کلریدهای سمی قلع، کلر عنصری سمی و تتراکلرید کربن سرطان زا انجام می شود. روش های شناخته شده کلرزنی کاتالیستی این پیوندها با منابع کلر غیر سمی (مانند اسید هیدروکلریک) شامل استفاده از کاتالیزورهای گران قیمت فلزات واسطه مانند پالادیوم است. به طور مستقیم، بدون فعال سازی، سیلان ها با اسید هیدروکلریک واکنش نمی دهند.
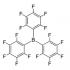
علیرغم این واقعیت که سیلیکون در جدول تناوبی مستقیماً زیر کربن قرار دارد، شیمی آنها بسیار متفاوت است (به عنوان مثال، به ساختارهای جفت یونی تماس و جدا شده از محلول از ترکیب سیلنیل-لیتیوم "Elements"، 09/23/ مراجعه کنید. 2016) برای اولین بار به دست آمد. به طور خاص، پیوند هیدروژن به سیلیکون ضعیفتر از پیوند کربن است، و قطبی شده است به طوری که هیدروژن دارای بار منفی است و میتواند مانند یک شبه هالوژن رفتار کند. این ویژگی توسط دانشمندان دانشگاه تل آویو برای فعال کردن پیوند Si-H با تریس (پنتا فلوروفنیل) بوران B(C 6 F 5) 3 استفاده شد. B(C 6 F 5) 3 یک ترکیب بور غیر سمی و نسبتاً ارزان (در مقایسه با فلزات واسطه) با سه حلقه پنتافلوروفنیل است. فلوروفنیلها چگالی الکترون را از اتم بور میکشند، بنابراین بور با اتم هیدروژن با بار منفی روی سیلیکون برهمکنش میکند و پیوند Si-H را ضعیف میکند و به کلر از اسید هیدروکلریک (HCl) اجازه میدهد تا جایگزین هیدروژن شود. از دو اتم هیدروژن (H - از سیلیکون و H + از اسید هیدروکلریک)، هیدروژن مولکولی H 2 به دست می آید (شکل 1).

یک مثال جداگانه از واکنش کلرزنی تری اتیل سیلان در شکل نشان داده شده است. 3. اسید کلریدریک با ریختن محلول غلیظ اسید سولفوریک روی نمک معمولی تولید می شود. اسید هیدروکلریک گازی تشکیل می شود که از طریق یک لوله به محلول تولوئن هم زده کلروسیلان و یک کاتالیزور وارد می شود. تنها با استفاده از یک مولکول B(C 6 F 5) 3 تا 100 مولکول Et 3 SiH (یعنی یک درصد مول، 1 مول درصد) با HCl اضافی، واکنش در 15 دقیقه به پایان می رسد.

با استفاده از محاسبات مکانیک کوانتومی، نویسندگان مدلی از ساختار حالت گذار واکنش (شکل 4) و انرژی مورد نیاز برای ادامه این واکنش در فاز گاز (25.5 کیلو کالری بر مول) به دست آوردند.

فقط باز کردن یک واکنش جدید برای انتشار در یک مجله خوب کافی نیست. لازم است حداقل امکان کاربرد گسترده آن نشان داده شود و مکانیسم پیشنهادی با آزمایش های اضافی و / یا محاسبات نظری تأیید شود. اما حتی این ممکن است کافی نباشد. برای یک انتشار بسیار خوب، مطلوب است که یک ویژگی از واکنش نشان داده شود که در واکنش های قبلا شناخته شده و استفاده شده وجود ندارد.
برای شروع، نویسندگان با روش خاص خود، با استفاده از B(C 6 F 5) 3 و اترات آن Et 2 O B ( C 6 F 5 ) 3 ، چندین سیلان با جانشین های مختلف R - از ارگانوسیلیکن (tBuMe 2 Si) کلر زدند. به سیلوکسید (Et 3 SiO): Me 2 (tBuMe 2 Si)SiH، Ph 2 (Et 3 SiO)SiH، Me 2 SiClH، Ph 2 SiClH، Ph 2 SiH 2، PhMeSiH 2. آنها همچنین موفق شدند کلرزنی گام به گام سیلان ها را با دو هیدروژن Ph 2 SiH 2، PhMeSiH 2، با استفاده از غلظت های مختلف کاتالیزور (از 1 تا 10 مول درصد) و تغییر زمان واکنش نشان دهند.
در این مرحله به غیر از خود واکنش، هیچ نتیجه غیرعادی پیدا نشد. سپس نویسندگان کلر زنی سیلان سه هیدروژنی واکنش پذیرتر PhSiH 3 را آزمایش کردند. در اینجا شایان ذکر است که کلرزنی گام به گام PhSiH 3 کار آسانی نیست، زیرا واکنش می تواند به راحتی از مرحله تک کلره (PhSiClH 2) به کلرزنی مضاعف (PhSiCl 2 H) عبور کند. در اینجا نویسندگان با یک غافلگیری خوشایند روبرو شدند. با 10 مول درصد B(C 6 F 5) 3، واکنش در 10 دقیقه پرش کرد و 87 درصد PhSiCl 2 H و 13 درصد PhSiClH 2 به دست آمد. با این حال، هنگامی که اترات Et 2 O B (C 6 F 5) 3 به عنوان کاتالیزور دقیقاً در شرایط مشابه (10 مول، 10 دقیقه) استفاده شد، نسبت محصولات تقریباً مخالف بود: 16٪ PhSiCl 2 H و 84% PhSiClH 2 (واکنش های 1 و 2 در جدول). با کاهش 10 برابری غلظت کاتالیزور، امکان تولید انحصاری PhSiClH 2 در یک مرحله (واکنش 4 در جدول) فراهم شد. کلرزنی مضاعف با اترات حتی پس از 1000 دقیقه به طور کامل انجام نمی شود (واکنش 6 در جدول).
چرا واکنش با اترات بسیار متفاوت از اصلی است؟ از این گذشته ، اترات فقط به دلیل راحتی مورد استفاده قرار گرفت - جداسازی آن آسان تر است و در هوا پایدارتر از همتای غیر اتری خود است. در محلول، مولکول دی اتیل اتر (Et 2 O) از بور جدا می شود و در تئوری باید مانند کاتالیزور اصلی رفتار کند. شاید خود مولکول دی اتیل اتر به نوعی در واکنش شرکت کند؟ تأیید این فرضیه با تجزیه و تحلیل محلول پس از واکنش به دست آمد - معلوم شد که اتان C 2 H 6 در آنجا وجود دارد که فقط از طریق تجزیه مولکول دی اتیل اتر می تواند در محلول ظاهر شود. سپس محققان واکنش استوکیومتری (به نسبت 1:1) PhSiH 3 را با Et 2 O·B(C 6 F 5) بدون افزودن HCl انجام دادند و فنیل (اتوکسی) سیلان و اتان را به عنوان محصولات به دست آوردند. دی اتیل اتر در واقع تجزیه شد (شکل 5).
ظاهراً این اولین مرحله از تمام واکنشهایی است که توسط اترات کاتالیز میشوند. در مرحله دوم، HCl با اتوکسی سیلان واکنش می دهد و اتانول آزاد می شود که به جای دی اتیل اتر به بور اضافه می شود و زنجیره کاتالیزوری را ادامه می دهد (شکل 6). نویسندگان پیشنهاد کردند که کلر زنی دوم کند می شود، زیرا اتانول با مولکول کلردار از قبل کندتر از مولکول غیرکلر شده واکنش می دهد. این فرض با یک آزمایش جداگانه و با استفاده از محاسبات مکانیکی کوانتومی انرژی های تمام مراحل واکنش با دو نوع کاتالیزور ثابت شد.

جایگزینی کاتالیزورهای مبتنی بر فلزات گرانبها در صنعت به دلیل هزینه بالای کاتالیزور، منابع محدود و سمیت بسیار حائز اهمیت است. تریس (پنتافلوئوروفنیل) بوران در بین شیمیدانان کاتالیزور محبوبیت پیدا می کند و احتمالاً واکنش های جالب بیشتری را در رابطه با آن مشاهده خواهیم کرد.
کربن قادر به ایجاد چندین تغییر آلوتروپیک است. اینها الماس (بی اثرترین اصلاح آلوتروپیک)، گرافیت، فولرن و کاربین هستند.
زغال سنگ و دوده کربن آمورف هستند. کربن در این حالت ساختار منظمی ندارد و در واقع از کوچکترین قطعات لایه های گرافیت تشکیل شده است. کربن آمورف تصفیه شده با بخار آب داغ، کربن فعال نامیده می شود. 1 گرم کربن فعال به دلیل وجود منافذ زیاد در آن، در مجموع بیش از سیصد متر مربع سطح دارد! کربن فعال به دلیل توانایی جذب مواد مختلف به طور گسترده ای به عنوان پرکننده فیلتر و همچنین جاذب داخلی برای انواع مسمومیت ها استفاده می شود.
از نقطه نظر شیمیایی، کربن آمورف فعال ترین شکل آن است، گرافیت فعالیت متوسطی از خود نشان می دهد و الماس یک ماده بسیار بی اثر است. به همین دلیل، خواص شیمیایی کربن در نظر گرفته شده در زیر باید در درجه اول به کربن آمورف نسبت داده شود.
کاهش خواص کربن
کربن به عنوان یک عامل کاهنده با غیر فلزات مانند اکسیژن، هالوژن و گوگرد واکنش می دهد.
بسته به مقدار اضافی یا کمبود اکسیژن در طی احتراق زغال سنگ، تشکیل مونوکسید کربن CO یا دی اکسید کربن CO 2 امکان پذیر است:
هنگامی که کربن با فلوئور واکنش می دهد، تترا فلوراید کربن تشکیل می شود:
هنگامی که کربن با گوگرد گرم می شود، دی سولفید کربن CS 2 تشکیل می شود:
کربن قادر است فلزات را پس از آلومینیوم در سری فعالیت از اکسیدهای آنها کاهش دهد. مثلا:
کربن همچنین با اکسیدهای فلزات فعال واکنش می دهد، با این حال، در این مورد، به عنوان یک قاعده، کاهش فلز مشاهده نمی شود، بلکه تشکیل کاربید آن است:
برهمکنش کربن با اکسیدهای غیرفلزی
کربن با دی اکسید کربن CO 2 وارد یک واکنش هم تناسبی می شود:
یکی از مهمترین فرآیندها از دیدگاه صنعتی به اصطلاح می باشد اصلاح بخار زغال سنگ. این فرآیند با عبور بخار آب از زغال سنگ داغ انجام می شود. در این حالت واکنش زیر رخ می دهد:
در دماهای بالا، کربن قادر است حتی چنین ترکیب بی اثری مانند دی اکسید سیلیکون را کاهش دهد. در این صورت بسته به شرایط امکان تشکیل سیلیکون یا کاربید سیلیکون وجود دارد. کربوراندوم):
همچنین کربن به عنوان یک عامل کاهنده با اسیدهای اکسید کننده، به ویژه اسیدهای سولفوریک و نیتریک غلیظ واکنش می دهد:
خواص اکسید کننده کربن
عنصر شیمیایی کربن بسیار الکترونگاتیو نیست، بنابراین مواد ساده ای که تشکیل می دهد به ندرت خواص اکسید کننده نسبت به سایر غیرفلزها از خود نشان می دهند.
نمونه ای از این واکنش ها برهمکنش کربن آمورف با هیدروژن است که در حضور کاتالیزور گرم می شود:
و همچنین با سیلیکون در دمای 1200-1300 در حدود C:
کربن در رابطه با فلزات دارای خواص اکسید کننده است. کربن قادر به واکنش با فلزات فعال و برخی فلزات با فعالیت متوسط است. واکنش ها هنگام گرم شدن ادامه می یابد:
| کاربیدهای فلز فعال توسط آب هیدرولیز می شوند:
و همچنین محلول های اسیدهای غیر اکسید کننده: در این حالت، هیدروکربن های حاوی کربن در همان حالت اکسیداسیون کاربید اصلی تشکیل می شوند. |
خواص شیمیایی سیلیکون
سیلیکون و همچنین کربن در حالت کریستالی و آمورف می تواند وجود داشته باشد و درست مانند کربن، سیلیسیم بی شکل به طور قابل توجهی از سیلیکون کریستالی از نظر شیمیایی فعال تر است.
گاهی اوقات سیلیکون آمورف و کریستالی اصلاحات آلوتروپیک آن نامیده می شود، که به طور دقیق، کاملاً درست نیست. سیلیکون آمورف اساساً یک کنگلومرا از کوچکترین ذرات سیلیکون کریستالی است که به طور تصادفی نسبت به یکدیگر مرتب شده اند.
برهمکنش سیلیکون با مواد ساده
غیر فلزات
در شرایط عادی، سیلیکون به دلیل بی اثر بودن، فقط با فلوئور واکنش نشان می دهد:
سیلیکون تنها زمانی با کلر، برم و ید واکنش نشان می دهد. مشخص است که بسته به فعالیت هالوژن، دمای متفاوتی مورد نیاز است:
بنابراین با کلر، واکنش در دمای 340-420 درجه سانتیگراد ادامه می یابد:
با برم - 620-700 o C:
با ید - 750-810 o C:
واکنش سیلیکون با اکسیژن ادامه می یابد، با این حال، به گرمایش بسیار قوی (1200-1300 درجه سانتیگراد) نیاز دارد، زیرا یک فیلم اکسید قوی تعامل را دشوار می کند:
در دمای 1200-1500 درجه سانتیگراد، سیلیکون به آرامی با کربن به شکل گرافیت در تعامل است تا کربن SiC را تشکیل دهد - ماده ای با شبکه کریستالی اتمی شبیه الماس و تقریباً از نظر قدرت کمتر از آن نیست:
سیلیکون با هیدروژن واکنش نمی دهد.
فلزات
به دلیل الکترونگاتیوی کم، سیلیکون می تواند خواص اکسید کننده را فقط در رابطه با فلزات از خود نشان دهد. از میان فلزات، سیلیکون با فعال (قلیایی و خاکی قلیایی)، و همچنین بسیاری از فلزات با فعالیت متوسط واکنش می دهد. در نتیجه این تعامل، سیلیسیدها تشکیل می شوند:
برهمکنش سیلیکون با مواد پیچیده
سیلیکون حتی هنگام جوشیدن با آب واکنش نمی دهد، با این حال، سیلیکون آمورف با بخار آب فوق گرم در دمای حدود 400-500 درجه سانتیگراد برهمکنش می کند. این هیدروژن و دی اکسید سیلیکون تولید می کند:
از بین تمام اسیدها، سیلیکون (در حالت آمورف خود) فقط با اسید هیدروفلوئوریک غلیظ واکنش می دهد:
سیلیکون در محلول های قلیایی غلیظ حل می شود. این واکنش با تکامل هیدروژن همراه است.
تحت تأثیر اسید کلریدریک روی سیلیسید، منیزیم Mg 2 Si، سیلیسیم هیدروژن SiH 4 مشابه متان به دست می آید:
Mg 2 Si + 4HCl \u003d 2MgCl 2 + SiH 4
سیلیکون هیدروژن SiH 4 یک گاز بی رنگ است که به طور خود به خود در هوا مشتعل می شود و می سوزد و دی اکسید سیلیکون و آب تشکیل می دهد.
SiН 4 + 2O 2 = SiO 2 + 2Н 2 O
علاوه بر SiH 4، تعدادی سیلان دیگر نیز شناخته شده است: Si 2 H 6 . Si 3 H 8 و غیره که در مجموع سیلان نامیده می شوند. سیلان ها شبیه هیدروکربن ها هستند، اما از نظر ناپایداری با آنها تفاوت دارند. بدیهی است که پیوند بین اتم های سیلیکون بسیار کمتر از پیوند بین اتم های کربن است که در نتیجه زنجیره های -Si-Si-Si- و غیره به راحتی از بین می روند. پیوند بین سیلیکون و هیدروژن نیز ناپایدار است که نشان دهنده تضعیف قابل توجه خواص متالوئیدی سیلیکون است.
کلرید SiCl 4 با حرارت دادن مخلوط سیلیس و زغال سنگ در جریان کلر به دست می آید:
SiO 2 + 2C + 2Cl 2 \u003d SiCl 4 + 2CO
یا کلرزنی سیلیکون فنی مایعی است که در دمای 57 درجه می جوشد. تحت تاثیر آب S1CI 4 با تشکیل اسیدهای سیلیسیک و هیدروکلریک تحت هیدرولیز کامل قرار می گیرد:
SiCl 4 + 3H 2 O \u003d H 2 SiO 3 + 4HCl
در نتیجه این واکنش، هنگامی که SiCl 4 در هوای مرطوب تبخیر می شود، دود متراکم تشکیل می شود. بنابراین، SiCl 4 به عنوان یک تولید کننده دود استفاده می شود.
فلوئور SiF 4 از برهمکنش فلوئورو تشکیل می شود. هیدروژن کلرید باسیلیس:
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
این گاز بی رنگ با بوی تند است.
اگر فلوراید را وارد آب کنید، محلولی از اسید فلوئوروسیلیک H 2 SiFe دریافت می کنید:
3SiF 4 + 3H 2 O \u003d 2H 2 SiF 6 + H 2 SiO 3
از یک محلول غلیظ، پس از خنک شدن، کریستال های ترکیب H 2 SiF6 2H 2 O برجسته می شوند.
فلوئوروسیلیک اسید H 2 SiF 6 یکی از اسیدهای قوی است. درجه تفکیک آن در 0.1 n. محلول 75 درصد است. حتی در غلظت های بسیار کم، قوی استضد عفونی کننده نمک های اسید فلوئوروسیلیک - فلوروسیلیکات ها بیشتر در آب محلول هستند. فلوئوروسیلیکات سدیم و باریم به طور گسترده ای برای کنترل آفات محصولات کشاورزی استفاده می شود. سدیم فلوئوروسیلیکات نیز در ساخت لعاب های مختلف استفاده می شود. فلوئوروسیلیکات های منیزیم و روی برای ضد آب بودن سیمان استفاده می شود.
شما در حال خواندن مقاله ای با موضوع ترکیبات سیلیکون با هیدروژن هستید
ویژگی عنصر
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
ایزوتوپ ها: 28 Si (92.27%). 29Si (4.68%); 30 Si (3.05%)
سیلیکون دومین عنصر فراوان در پوسته زمین پس از اکسیژن (27.6 درصد جرمی) است. در طبیعت در حالت آزاد وجود ندارد، عمدتاً به شکل SiO 2 یا سیلیکات ها یافت می شود.
ترکیبات Si سمی هستند. استنشاق کوچکترین ذرات SiO 2 و سایر ترکیبات سیلیکونی (به عنوان مثال، آزبست) باعث یک بیماری خطرناک - سیلیکوزیس می شود.
در حالت پایه، اتم سیلیکون دارای ظرفیت = II و در حالت برانگیخته = IV است.
پایدارترین حالت اکسیداسیون Si +4 است. در ترکیبات با فلزات (سیلیسیدها)، S.O. -4.
روش های بدست آوردن سیلیکون
رایج ترین ترکیب طبیعی سیلیکون سیلیس (سیلیس دی اکسید) SiO 2 است. این ماده اولیه اصلی برای تولید سیلیکون است.
1) بازیابی SiO 2 با کربن در کوره های قوس در 1800 "C: SiO 2 + 2C \u003d Si + 2CO
2) Si با خلوص بالا از یک محصول فنی طبق این طرح به دست می آید:
الف) Si → SiCl 2 → Si
ب) Si → Mg 2 Si → SiH 4 → Si
خواص فیزیکی سیلیکون اصلاحات آلوتروپیک سیلیکون
1) سیلیکون کریستالی - ماده ای به رنگ خاکستری نقره ای با درخشش فلزی، یک شبکه کریستالی از نوع الماس. m.p. 1415 "C، b.p. 3249" C، چگالی 2.33 g/cm3; یک نیمه هادی است.
2) سیلیکون آمورف - پودر قهوه ای.
خواص شیمیایی سیلیکون
در بیشتر واکنش ها، Si به عنوان یک عامل کاهنده عمل می کند:
در دماهای پایین، سیلیکون از نظر شیمیایی بی اثر است و هنگامی که گرم می شود، واکنش پذیری آن به شدت افزایش می یابد.
1. در دمای بالای 400 درجه سانتیگراد با اکسیژن برهمکنش دارد:
Si + O 2 \u003d SiO 2 اکسید سیلیکون
2. با فلوئور در دمای اتاق واکنش می دهد:
Si + 2F 2 = تترا فلوراید سیلیکون SiF 4
3. واکنش ها با سایر هالوژن ها در دمای = 300 - 500 درجه سانتیگراد ادامه می یابد.
Si + 2Hal 2 = SiHal 4
4. با بخار گوگرد در دمای 600 درجه سانتیگراد یک دی سولفید تشکیل می شود:
5. واکنش با نیتروژن در دمای بالای 1000 درجه سانتیگراد رخ می دهد:
3Si + 2N 2 = Si 3 N 4 سیلیکون نیترید
6. در دمای = 1150 درجه سانتیگراد با کربن واکنش می دهد:
SiO 2 + 3C \u003d SiC + 2CO
کربوراندوم از نظر سختی نزدیک به الماس است.
7. سیلیکون مستقیماً با هیدروژن واکنش نمی دهد.
8. سیلیکون در برابر اسیدها مقاوم است. فقط با مخلوطی از اسیدهای نیتریک و هیدروفلوریک (هیدروفلوریک) تعامل دارد:
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H 2 O
9. با محلول های قلیایی واکنش می دهد و سیلیکات می دهد و هیدروژن آزاد می کند:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2
10. از خواص کاهنده سیلیکون برای جداسازی فلزات از اکسیدهای آنها استفاده می شود:
2MgO \u003d Si \u003d 2Mg + SiO 2
در واکنش با فلزات، Si یک عامل اکسید کننده است:
سیلیکون با فلزات s و بیشتر فلزات d سیلیسیدها را تشکیل می دهد.
ترکیب سیلیسیدهای این فلز می تواند متفاوت باشد. (به عنوان مثال، FeSi و FeSi 2؛ Ni 2 Si و NiSi 2.) یکی از معروف ترین سیلیسیدها، سیلیسید منیزیم است که می توان آن را با برهمکنش مستقیم مواد ساده به دست آورد:
2Mg + Si = Mg 2 Si
سیلان (مونوسیلان) SiH 4
سیلان ها (هیدروژن های سیلیکونی) Si n H 2n + 2، (مقایسه با آلکان ها)، که در آن n \u003d 1-8. سیلان ها - آنالوگ های آلکان ها، در ناپایداری زنجیره های -Si-Si- با آنها متفاوت هستند.
Monosilane SiH 4 یک گاز بی رنگ با بوی نامطبوع است. محلول در اتانول، بنزین.
راه های بدست آوردن:
1. تجزیه سیلیسید منیزیم با اسید کلریدریک: Mg 2 Si + 4HCI = 2MgCI 2 + SiH 4
2. احیا هالیدهای Si با لیتیوم آلومینیوم هیدرید: SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
خواص شیمیایی.
سیلان یک عامل احیا کننده قوی است.
1.SiH 4 با اکسیژن حتی در دماهای بسیار پایین اکسید می شود:
SiH 4 + 2O 2 \u003d SiO 2 + 2H 2 O
2. SiH 4 به راحتی هیدرولیز می شود، به خصوص در یک محیط قلیایی:
SiH 4 + 2H 2 O \u003d SiO 2 + 4H 2
SiH 4 + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 4H 2
اکسید سیلیکون (IV) (سیلیکا) SiO 2
سیلیس به اشکال مختلف وجود دارد: کریستالی، بی شکل و شیشه ای. رایج ترین شکل کریستالی کوارتز است. هنگامی که سنگ های کوارتز از بین می روند، ماسه های کوارتزی تشکیل می شوند. تک بلورهای کوارتز شفاف، بی رنگ (سنگ کریستال) یا رنگی با ناخالصی در رنگ های مختلف (آمیتیست، عقیق، یاس و غیره) هستند.
SiO 2 آمورف به شکل اوپال معدنی به وجود می آید: ژل سیلیکا به طور مصنوعی به دست می آید که از ذرات SiO 2 کلوئیدی تشکیل شده و یک جاذب بسیار خوب است. شیشه ای SiO 2 به شیشه کوارتز معروف است.
مشخصات فیزیکی
در آب، SiO 2 بسیار کمی حل می شود، در حلال های آلی نیز عملا حل نمی شود. سیلیس یک دی الکتریک است.
خواص شیمیایی
1. SiO 2 یک اکسید اسیدی است، بنابراین سیلیس آمورف به آرامی در محلول های آبی قلیایی ها حل می شود:
SiO 2 + 2NaOH \u003d Na 2 SiO 3 + H 2 O
2. SiO 2 همچنین هنگام گرم شدن با اکسیدهای اساسی برهمکنش می کند:
SiO 2 + K 2 O \u003d K 2 SiO 3؛
SiO 2 + CaO \u003d CaSiO 3
3. SiO 2 که یک اکسید غیر فرار است، دی اکسید کربن را از Na 2 CO 3 (در طول همجوشی) جابجا می کند.
SiO 2 + Na 2 CO 3 \u003d Na 2 SiO 3 + CO 2
4. سیلیس با اسید هیدروفلوئوریک واکنش می دهد و هیدروفلوئوروسیلیک اسید H 2 SiF 6 را تشکیل می دهد:
SiO 2 + 6HF \u003d H 2 SiF 6 + 2H 2 O
5. در دمای 250 - 400 درجه سانتیگراد، SiO 2 با HF گازی و F 2 برهمکنش می کند و تترافلوروسیلان (تترا فلوراید سیلیکون) را تشکیل می دهد.
SiO 2 + 4HF (گاز) \u003d SiF 4 + 2H 2 O
SiO 2 + 2F 2 \u003d SiF 4 + O 2
اسیدهای سیلیسیک
شناخته شده:
اسید ارتوسیلیک H 4 SiO 4 ;
اسید متاسیلیک (سیلیک) H 2 SiO 3 ;
اسیدهای دی و پلی سیلیسیک
تمام اسیدهای سیلیسیک به قدری در آب حل می شوند و به راحتی محلول های کلوئیدی تشکیل می دهند.
راه های دریافت
1. رسوب توسط اسیدها از محلول های سیلیکات فلزات قلیایی:
Na 2 SiO 3 + 2HCl \u003d H 2 SiO 3 ↓ + 2 NaCl
2. هیدرولیز کلروسیلانها: SiCl 4 + 4H 2 O \u003d H 4 SiO 4 + 4HCl
خواص شیمیایی
اسیدهای سیلیسیک اسیدهای بسیار ضعیفی هستند (ضعیف تر از اسید کربنیک).
هنگامی که گرم می شوند، آنها آبگیری می کنند و سیلیس را به عنوان محصول نهایی تشکیل می دهند.
H 4 SiO 4 → H 2 SiO 3 → SiO 2
سیلیکات - نمک اسیدهای سیلیسیک
از آنجایی که اسیدهای سیلیسیک بسیار ضعیف هستند، نمک های آنها در محلول های آبی به شدت هیدرولیز می شوند:
Na 2 SiO 3 + H 2 O \u003d NaHSiO 3 + NaOH
SiO 3 2- + H 2 O \u003d HSiO 3 - + OH - (محیط قلیایی)
به همین دلیل، هنگامی که دی اکسید کربن از محلول های سیلیکات عبور می کند، اسید سیلیسیک از آنها جابجا می شود:
K 2 SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + CO 3
این واکنش را می توان به عنوان یک واکنش کیفی برای یون های سیلیکات در نظر گرفت.
در بین سیلیکات ها فقط Na 2 SiO 3 و K 2 SiO 3 بسیار محلول هستند که به آنها شیشه محلول و محلول های آبی آنها شیشه مایع می گویند.
شیشه
شیشه پنجره معمولی دارای ترکیب Na 2 O CaO 6SiO 2 است، یعنی مخلوطی از سیلیکات های سدیم و کلسیم است. از ذوب سود Na 2 CO 3 ، CaCO 3 سنگ آهک و شن و ماسه SiO 2 به دست می آید.
Na 2 CO 3 + CaCO 3 + 6SiO 2 \u003d Na 2 O CaO 6SiO 2 + 2CO 2
سیمان
یک ماده چسباننده پودری که هنگام برهمکنش با آب، توده پلاستیکی را تشکیل می دهد که در نهایت به بدنه ای سنگ مانند تبدیل می شود. مصالح اصلی ساختمان
ترکیب شیمیایی رایج ترین سیمان پرتلند (در درصد وزنی) - 20 - 23٪ SiO 2. 62 - 76% CaO; 4 - 7% Al 2 O 3; 2-5% Fe 2 O 3 ; 1-5٪ MgO.
سی یکی از فراوان ترین عناصر در پوسته زمین است. شایع ترین بعد از O2. در طبیعت، Si تنها به شکل یک ترکیب وجود دارد: SiO2. مهمترین عنصر پادشاهی گیاهی و جانوری است.
دریافت: فنی: SiO2 + 2C ==== Si + 2CO. خالص: SiCl4 + 2H2 = Si + 4HCl. SiH4 = (t) Si + 2H2. در متالورژی و فناوری نیمه هادی استفاده می شود. برای حذف O2 از Me مذاب و به عنوان بخشی جدایی ناپذیر از آلیاژها عمل می کند. برای ساخت فتوسل، تقویت کننده، یکسو کننده.
مشخصات فیزیکیآزا سیلیکون - رنگ خاکستری استیل. شکننده است، تنها زمانی که بیش از 800 درجه سانتیگراد گرم شود، تبدیل به یک ماده پلاستیکی می شود. شفاف به اشعه مادون قرمز، نیمه هادی. شبکه کریستالی مانند الماس مکعبی است، اما به دلیل طول پیوند بیشتر بین اتم های Si-Si در مقایسه با طول پیوند C-C، سختی سیلیکون بسیار کمتر از الماس است. آلوتروپیک سی-پودر خاکستری رنگ.
خواص شیمیایی: در n. y Si غیر فعال است و فقط با فلوئور گازی واکنش می دهد: Si + 2F2 = SiF4
سی آمورف واکنش پذیرتر است، سی مذاب بسیار فعال است.
هنگامی که تا دمای 400-500 درجه سانتیگراد گرم می شود، سیلیکون با O2، Cl2، Br2، S واکنش می دهد: سی + O2 = SiO2 . سی + 2 Cl2 = SiCl4
با نیتروژن، سیلیکون در دمای حدود 1000 درجه سانتیگراد نیترید Si3N4 را تشکیل می دهد.
با بورهای مقاوم در برابر حرارت و مواد شیمیایی SiB3، SiB6 و SiB12.،
با کربن - کاربید سیلیکون SiC (کاربوراندوم).
هنگامی که سیلیکون با فلزات گرم می شود، سیلیسیدها می توانند تشکیل شوند.
Si با اسیدها واکنش نشان نمی دهد، فقط با مخلوطی از HNO3 و HF آن را به اسید هگزافلوروسیلیک اکسید می کند: 3Si + 8HNO3 + 18HF = 3H2 + 4NO + 8H2O
به شدت در محلول های قلیایی در سرما حل می شود (خواص غیر فلزی): Si + 2NaOH + H2O = Na2SiO3 + 2 H2
در دماهای بالا، به آرامی با آب تعامل می کند: Si + 3H2O = H2SiO3 + 2H2
ترکیبات هیدروژنیسیسیلیکون به طور مستقیم با هیدروژن واکنش نمی دهد، ترکیبات سیلیکون با هیدروژن - سیلان هابا فرمول کلی SinH2n+2 به صورت غیر مستقیم به دست می آید. مونوسیلان SiH4مخلوط Ca2Si + 4HCl → 2CaCl2 + SiH4 سایر سیلان ها، دیسیلان Si2H6 و تریسیلان Si3H8.
پلی سیلان ها سمی، بی بو، از نظر حرارتی پایدارتر از СnH2n+2 عوامل کاهنده SiH4 + O2 = SiO2 + 2 H2O
هیدرولیز در آب SiH4 + 2H2O = SiO2 + 4H2
ترکیبات سیلیکون با فلزات - سیلیسیدها
منیون کووالانسی:سیلیسیدهای قلیایی، فلزات قلیایی خاکی و منیزیم Ca2Si، Mg2Si
به راحتی توسط آب از بین می رود: Na2Si + 3H2O = Na2SiO3 + 3 H2
تجزیه شده توسط اسیدها: Ca2Si + 2H2SO4 = 2CaSO4 + SiH4
II. شبیه فلز:سیلیسیدهای فلزات واسطه از نظر شیمیایی پایدار هستند و تحت اثر اسیدها تجزیه نمی شوند، حتی در دماهای بالا در برابر اکسیژن مقاوم هستند. آنها Tm بالایی دارند (تا 2000 درجه سانتیگراد). بسیاری از آنها رسانای فلزی هستند. رایج ترین MeSi، Me3Si2، Me2Si3، Me5Si3 و MeSi2.
سیلیسیدهای عناصر d برای به دست آوردن آلیاژهای مقاوم در برابر حرارت و مقاوم در برابر اسید استفاده می شود.سیلیسیدهای لانتانید در مهندسی انرژی هسته ای به عنوان جاذب نوترون استفاده می شود.
SiC - کاربوراندومماده جامد و نسوز. شبکه کریستالی شبیه به الماس است. این یک نیمه هادی است. برای ساختن جواهرات مصنوعی استفاده می شود
سیلیسبه راحتی با F2 و HF واکنش نشان می دهد: SiO2 + 4HF = SiF4 + 2 H2O. SiO2 + F2 = SiF4 + O2 در آب حل نمی شود.
هنگام گرم شدن در محلول های قلیایی حل می شود: SiO2 + 2NaOH = Na2SiO3 + H2O
تف جوشی شده با نمک: SiO2 + Na2CO3 = Na2SiO3 + CO2. SiO2 + PbO = PbSiO3
اسیدهای سیلیسیکاسیدهای بسیار ضعیف و کمی محلول در آب. اسیدهای سیلیسیک محلول های کلوئیدی در آب تشکیل می دهند.
نمک اسیدهای سیلیسیک سیلیکات نامیده می شود. SiO2 مربوط به اسید سیلیسیک است که می تواند با عمل یک اسید قوی روی سیلیکات Na2SiO3 + HCl = H2SiO3 + NaCl به دست آید.
H2SiO3 - متاسیلیک یا اسید سیلیسیک. H4SiO4 - اسید ارتوسیلیک فقط در محلول وجود دارد و در صورت تبخیر آب به طور غیرقابل برگشت به SiO2 تبدیل می شود.
سیلیکات ها- نمک های اسیدهای سیلیسیک، هر اتم Si یک اتم O2 چهار وجهی را در اطراف خود احاطه کرده است. رابطه نزدیک بین Si و O2.