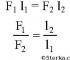Legătură covalentă simplă într-o moleculă. Legături simple (single) Tipuri de legături în compușii bioorganici
Atomii majorității elementelor nu există separat, deoarece pot interacționa între ei. Această interacțiune creează particule mai complexe.
Natura unei legături chimice este acțiunea forțelor electrostatice, care sunt forțele de interacțiune dintre sarcinile electrice. Electronii și nucleele atomice au astfel de sarcini.
Electronii aflați la nivelurile electronice exterioare (electronii de valență) fiind cei mai îndepărtați de nucleu interacționează cel mai slab cu acesta și, prin urmare, sunt capabili să se desprindă de nucleu. Ei sunt responsabili pentru legarea atomilor între ei.
Tipuri de interacțiuni în chimie
Tipurile de legături chimice pot fi reprezentate sub forma următorului tabel:
Caracteristica legaturii ionice
 Interacțiune chimică care se formează din cauza atractia ionilor având sarcini diferite se numește ionic. Acest lucru se întâmplă dacă atomii legați au o diferență semnificativă de electronegativitate (adică capacitatea de a atrage electroni) și perechea de electroni merge la un element mai electronegativ. Rezultatul unei astfel de tranziții a electronilor de la un atom la altul este formarea de particule încărcate - ioni. Între ei apare atracția.
Interacțiune chimică care se formează din cauza atractia ionilor având sarcini diferite se numește ionic. Acest lucru se întâmplă dacă atomii legați au o diferență semnificativă de electronegativitate (adică capacitatea de a atrage electroni) și perechea de electroni merge la un element mai electronegativ. Rezultatul unei astfel de tranziții a electronilor de la un atom la altul este formarea de particule încărcate - ioni. Între ei apare atracția.
Cei mai mici indicatori de electronegativitate au metale tipice, iar cele mai mari sunt nemetale tipice. Ionii sunt astfel formați prin interacțiuni între metale tipice și nemetale tipice.
Atomii de metal devin ioni încărcați pozitiv (cationi), donând electroni la nivelurile electronice externe, iar nemetalele preiau electroni, transformându-se astfel în încărcat negativ ioni (anioni).
Atomii se mută într-o stare energetică mai stabilă, completându-și configurațiile electronice.
Legătura ionică este nedirecțională și nesaturabilă, deoarece interacțiunea electrostatică are loc în toate direcțiile, respectiv, ionul poate atrage ioni de semn opus în toate direcțiile.
Dispunerea ionilor este astfel încât în jurul fiecăruia există un anumit număr de ioni încărcați opus. Conceptul de „moleculă” pentru compuși ionici nu are sens.
Exemple de educație
 Formarea unei legături în clorura de sodiu (nacl) se datorează transferului unui electron de la atomul de Na la atomul de Cl cu formarea ionilor corespunzători:
Formarea unei legături în clorura de sodiu (nacl) se datorează transferului unui electron de la atomul de Na la atomul de Cl cu formarea ionilor corespunzători:
Na 0 - 1 e = Na + (cation)
Cl 0 + 1 e = Cl - (anion)
În clorura de sodiu, există șase anioni de clor în jurul cationilor de sodiu, iar în jurul fiecărui ion de clor există șase ioni de sodiu.
În timpul formării interacțiunii dintre atomi din sulfura de bariu, au loc următoarele procese:
Ba 0 - 2 e = Ba 2+
S 0 + 2 e = S 2-
Ba cedează cei doi electroni ai săi la sulf, rezultând formarea de anioni de sulf S 2- și cationi de bariu Ba 2+.
Legături chimice metalice
 Numărul de electroni din nivelurile exterioare de energie ale metalelor este mic; aceștia se desprind ușor de nucleu. Ca rezultat al acestei separări, se formează ioni metalici și electroni liberi. Acești electroni sunt numiți „gazul de electroni”. Electronii se mișcă liber prin volumul metalului și sunt în permanență legați și desprinși de atomi.
Numărul de electroni din nivelurile exterioare de energie ale metalelor este mic; aceștia se desprind ușor de nucleu. Ca rezultat al acestei separări, se formează ioni metalici și electroni liberi. Acești electroni sunt numiți „gazul de electroni”. Electronii se mișcă liber prin volumul metalului și sunt în permanență legați și desprinși de atomi.
Structura substanței metalice este următoarea: rețeaua cristalină este coloana vertebrală a substanței, iar electronii se pot mișca liber între nodurile sale.
Exemplele includ:
Mg - 2e<->Mg 2+
Cs - e<->Cs +
Ca - 2e<->Ca 2+
Fe - 3e<->Fe 3+
Covalent: polar și nepolar
 Cel mai comun tip de interacțiune chimică este legătura covalentă. Valorile electronegativității elementelor care interacționează nu diferă brusc, în acest sens, are loc doar schimbarea perechii de electroni comune la un atom mai electronegativ.
Cel mai comun tip de interacțiune chimică este legătura covalentă. Valorile electronegativității elementelor care interacționează nu diferă brusc, în acest sens, are loc doar schimbarea perechii de electroni comune la un atom mai electronegativ.
Interacțiunea covalentă poate fi formată printr-un mecanism de schimb sau printr-un mecanism donor-acceptor.
Mecanismul de schimb se realizează dacă fiecare dintre atomi are electroni nepereche la nivelurile electronice exterioare și suprapunerea orbitalilor atomici duce la apariția unei perechi de electroni aparținând ambilor atomi. Când unul dintre atomi are o pereche de electroni la nivel electronic extern, iar celălalt are un orbital liber, atunci când orbitalii atomici se suprapun, perechea de electroni este socializată și interacționează conform mecanismului donor-acceptor.
Cele covalente sunt împărțite prin multiplicitate în:
- simplu sau singur;
- dubla;
- triplu.
Dublurile asigură socializarea a două perechi de electroni simultan, iar triplele - trei.
În funcție de distribuția densității electronice (polarității) între atomii legați, legătura covalentă se împarte în:
- nepolar;
- polar.
O legătură nepolară este formată din atomi identici, iar o legătură polară este formată prin electronegativitate diferită.
 Interacțiunea atomilor apropiați în electronegativitate se numește legătură nepolară. Perechea comună de electroni dintr-o astfel de moleculă nu este atrasă de niciunul dintre atomi, ci aparține în mod egal ambilor.
Interacțiunea atomilor apropiați în electronegativitate se numește legătură nepolară. Perechea comună de electroni dintr-o astfel de moleculă nu este atrasă de niciunul dintre atomi, ci aparține în mod egal ambilor.
Interacțiunea elementelor care diferă în electronegativitate duce la formarea de legături polare. Cu acest tip de interacțiune, perechile de electroni comuni sunt atrase de un element mai electronegativ, dar nu se transferă complet la acesta (adică nu are loc formarea ionilor). Ca urmare a unei astfel de schimbări a densității electronilor, pe atomi apar sarcini parțiale: una mai electronegativă - o sarcină negativă și una mai puțin pozitivă.
Proprietăți și caracteristici ale covalenței
Principalele caracteristici ale unei legături covalente:
- Lungimea este determinată de distanța dintre nucleele atomilor care interacționează.
- Polaritatea este determinată de deplasarea norului de electroni către unul dintre atomi.
- Direcționalitate - proprietatea de a forma legături orientate spre spațiu și, în consecință, molecule care au anumite forme geometrice.
- Saturația este determinată de capacitatea de a forma un număr limitat de legături.
- Polarizabilitatea este definită ca abilitatea de a schimba polaritatea atunci când este expus la un câmp electric extern.
- Energia necesară pentru a rupe o legătură, care determină rezistența acesteia.
 Un exemplu de interacțiune covalentă nepolară pot fi molecule de hidrogen (H2), clor (Cl2), oxigen (O2), azot (N2) și multe altele.
Un exemplu de interacțiune covalentă nepolară pot fi molecule de hidrogen (H2), clor (Cl2), oxigen (O2), azot (N2) și multe altele.
H + H → molecula H-H are o singură legătură nepolară,
O: +: O → O = O molecula are un dublu nepolar,
Ṅ: + Ṅ: → N≡N molecula are un triplu nepolar.
Ca exemple pot fi citate molecule de dioxid de carbon (CO2) și monoxid de carbon (CO), hidrogen sulfurat (H2S), acid clorhidric (HCL), apă (H2O), metan (CH4), oxid de sulf (SO2) și multe altele. a legăturii covalente a elementelor chimice...
Într-o moleculă de CO2, relația dintre atomii de carbon și oxigen este polară covalentă, deoarece hidrogenul mai electronegativ atrage densitatea electronică la sine. Oxigenul are doi electroni nepereche la nivelul exterior, iar carbonul poate furniza patru electroni de valență pentru a forma interacțiuni. Ca urmare, se formează legături duble și molecula arată astfel: O = C = O.
Pentru a determina tipul de legătură dintr-o anumită moleculă, este suficient să luăm în considerare atomii care o alcătuiesc. Substanțele simple metalele formează metale, metalele cu nemetale - ionice, substanțele simple nemetale - covalente nepolare, iar moleculele formate din diferite nemetale se formează printr-o legătură polară covalentă.
Legături simple (single) Tipuri de legături în compușii bioorganici.
| Nume parametru | Sens |
| Subiectul articolului: | Legături simple (single) Tipuri de legături în compușii bioorganici. |
| Categorie (categorie tematică) | Chimie |
Legătură covalentă. Conexiune multiplă. Comunicare nepolară. Comunicare polară.
Electroni de valență. Orbital hibrid (hibridizat). Lungimea link-ului
Cuvinte cheie.
Caracterizarea legăturilor chimice în compușii bioorganici
AROMATICE
PRELEZA 1
SISTEME CONECTATE: ACICLICE ȘI CICLICE.
1. Caracteristicile legăturilor chimice din compușii bioorganici. Hibridarea orbitalilor atomului de carbon.
2. Clasificarea sistemelor conjugate: aciclice și ciclice.
3 Tipuri de conjugare: π, π și π, p
4. Criterii de stabilitate a sistemelor conjugate - ʼʼ energia conjugată
5. Sisteme conjugate aciclice (neciclice), tipuri de conjugare. Principalii reprezentanți (alcadiene, acizi carboxilici nesaturați, vitamina A, caroten, licopen).
6. Sisteme cuplate ciclice. Criterii de aromatitate. regula lui Hückel. Rolul conjugării π-π-, π-ρ-în formarea sistemelor aromatice.
7. Compuși aromatici carbociclici: (benzen, naftalenă, antracen, fenantren, fenol, anilină, acid benzoic) - structură, formarea unui sistem aromatic.
8. Compuși aromatici heterociclici (piridină, pirimidină, pirol, purină, imidazol, furan, tiofen) - structură, caracteristici ale formării sistemului aromatic. Hibridizarea orbitalilor de electroni ai atomului de azot în timpul formării compușilor heteroaromatici cu cinci și șase membri.
9. Semnificația medicală și biologică a compușilor naturali care conțin sisteme conjugate de legături și aromatice.
Nivelul inițial de cunoștințe pentru stăpânirea temei (curs de chimie școlară):
Configurații electronice ale elementelor (carbon, oxigen, azot, hidrogen, sulf, halogeni), conceptul de „orbital”, hibridizarea orbitalilor și orientarea spațială a orbitalilor elementelor din perioada 2., Tipuri de legături chimice, caracteristici ale formării legături covalente σ- și π, modificarea electronegativității elementelor din perioada și grupa, principiile de clasificare și nomenclatură ale compușilor organici.
Moleculele organice se formează prin legături covalente. Legăturile covalente apar între două nuclee atomice datorită unei perechi comune (socializate) de electroni. Această metodă aparține mecanismului de schimb. Se formează legături nepolare și polare.
Legăturile nepolare sunt caracterizate printr-o distribuție simetrică a densității electronilor între cei doi atomi pe care îi conectează această legătură.
Legăturile polare sunt caracterizate printr-o distribuție asimetrică (neuniformă) a densității electronilor, aceasta este deplasată către un atom mai electronegativ.
Seria de electronegativitate (trasă în jos)
A) elemente: F> O> N> C1> Br> I ~~ S> C> H
B) atom de carbon: C (sp)> C (sp 2)> C (sp 3)
Legăturile covalente sunt de două tipuri: sigma (σ) și pi (π).
În moleculele organice, legăturile sigma (σ) sunt formate din electroni localizați în orbitali hibrizi (hibridați), densitatea electronilor este situată între atomi pe linia condiționată a legăturii lor.
Legăturile π (legăturile pi) apar atunci când doi orbitali p nehibridați se suprapun. Axele lor principale sunt situate paralele între ele și perpendiculare pe linia de legătură σ. Combinația de legături σ și π - se numește legătură dublă (multiple), constă din două perechi de electroni. O legătură triplă este formată din trei perechi de electroni - una σ - și două legături π - (în compușii bioorganici este extrem de rar).
σ -Legăturile sunt implicate în formarea scheletului moleculei, ele sunt principalele și π -legaturile pot fi considerate suplimentare, dar conferind moleculelor proprietati chimice deosebite.
1.2. Hibridizarea orbitalilor atomului de carbon 6 С
Configurația electronică a stării neexcitate a unui atom de carbon
exprimată prin distribuția electronilor 1s 2 2s 2 2p 2.
Mai mult, în compușii bioorganici, precum și în majoritatea substanțelor anorganice, un atom de carbon are o valență egală cu patru.
Există o tranziție a unuia dintre electronii 2s la un orbital 2p liber. Apar stări excitate ale atomului de carbon, care creează posibilitatea formării a trei stări hibride, denumite C sp 3, C sp 2, C sp.
Un orbital hibrid are caracteristici diferite de orbitalii s, p, d „puri” și este un „amestec” de două sau mai multe tipuri de orbitali nehibridați.
Orbitii hibrizi sunt caracteristici atomilor numai în molecule.
Conceptul de hibridizare a fost introdus în 1931 de către L. Pauling, laureat al Premiului Nobel.
Luați în considerare aranjarea în spațiu a orbitalilor hibrizi.
С s p 3 --- - - ---
Într-o stare excitată, se formează 4 orbitali hibrizi echivalenți. Dispunerea legăturilor corespunde direcției unghiurilor centrale ale unui tetraedru regulat, unghiul dintre oricare două legături este 109 0 28,.
În alcani și derivații lor (alcooli, haloalcani, amine), toți atomii de carbon, oxigen, azot sunt în aceeași stare hibridă sp 3. Atomul de carbon formează patru, atomul de azot formează trei, atomul de oxigen formează două covalente σ -conexiune. În jurul acestor legături, este posibilă rotația liberă a părților moleculei unele față de altele.
In starea excitata sp 2 apar trei orbitali hibrizi echivalenti, electronii situati pe ei formeaza trei σ - legături care sunt situate în același plan, unghiul dintre legături este de 120 0. 2p nehibridați - se formează orbitali a doi atomi vecini π -conexiune. Este situat perpendicular pe planul în care σ -conexiune. În acest caz, interacțiunea electronilor p se numește „suprapunere laterală”. Legătura multiplă nu permite rotația liberă a părților moleculei în jurul ei. Poziția fixă a părților moleculei este însoțită de formarea a două forme geometrice izomerice plane, care se numesc: izomeri cis (cis) și trans (trans). (cis- lat- pe o parte, trans- lat- peste).
π -conexiune
Atomii legați printr-o legătură dublă se află în starea de hibridizare sp 2 și
prezente în alchene, compuși aromatici, formează o grupare carbonil
> C = O, grupare azometină (grupare imino) -CH = N-
Cu sp 2 - --- - ---
Formula structurală a unui compus organic este descrisă folosind structuri Lewis (fiecare pereche de electroni dintre atomi este înlocuită cu o liniuță)
C2H6CH3-CH3HH
1.3... Polarizarea legăturilor covalente
Legătura covalentă polară se caracterizează printr-o distribuție neuniformă a densității electronilor. Pentru a indica direcția de deplasare a densității electronilor, sunt utilizate două imagini convenționale.
Polar σ - legătura... Deplasarea densității electronice este indicată de o săgeată de-a lungul liniei de comunicație. Capătul săgeții îndreaptă spre atomul mai electronegativ. Apariția sarcinilor parțiale pozitive și negative este indicată folosind litera ʼʼ bʼʼ ʼʼ deltaʼʼ cu semnul de sarcină dorit.
b + b- b + b + b- b + b-
CH 3 -> O<- Н СН 3 - >C1 CH3 -> NH2
metanol clormetan aminometan (metilamină)
Legătura π polară... Deplasarea densității electronilor este indicată de o săgeată semicirculară (curbată) deasupra legăturii pi, îndreptată de asemenea către atomul mai electronegativ. ()
b + b- b + b-
H2C = O CH3 - C === O
metanal |
CH3propanonă -2
1. Determinați tipul de hibridizare a atomilor de carbon, oxigen, azot din compușii A, B, C. Numiți compușii folosind regulile nomenclaturii IUPAC.
A. CH 3 -CH 2 - CH 2 -OH B. CH 2 = CH - CH 2 - CH = O
B. CH3-NH-C2H5
2. Faceți denumiri care caracterizează direcția de polarizare a tuturor legăturilor indicate în compuși (A - D)
A. CH 3 - Br B. C 2 H 5 - O - H C. CH 3 - NH - C 2 H 5
G. C2H5-CH = O
Legături simple (single) Tipuri de legături în compușii bioorganici. - concept și tipuri. Clasificarea și caracteristicile categoriei „Legătură simplă (singlă). Tipuri de legături în compușii bioorganici”. 2017, 2018.
Legătură chimică covalentă apare în moleculele dintre atomi datorită formării perechilor de electroni comuni. Tipul de legătură covalentă poate însemna atât mecanismul formării sale, cât și polaritatea legăturii. În general, legăturile covalente pot fi clasificate după cum urmează:
- Conform mecanismului de formare, o legătură covalentă poate fi formată printr-un mecanism de schimb sau donor-acceptor.
- În polaritate, o legătură covalentă poate fi nepolară sau polară.
- În ceea ce privește multiplicitatea, o legătură covalentă poate fi simplă, dublă sau triplă.
Aceasta înseamnă că o legătură covalentă într-o moleculă are trei caracteristici. De exemplu, într-o moleculă de acid clorhidric (HCl), se formează o legătură covalentă printr-un mecanism de schimb, este polară și simplă. În cationul de amoniu (NH 4 +), legătura covalentă dintre amoniac (NH 3) și cationul de hidrogen (H +) se formează conform mecanismului donor-acceptor; în plus, această legătură este polară și este simplă. Într-o moleculă de azot (N 2), o legătură covalentă este formată printr-un mecanism de schimb, este nepolară și este triplă.
La mecanism de schimb formarea unei legături covalente, fiecare atom are un electron liber (sau mai mulți electroni). Electronii liberi ai diferiților atomi formează perechi sub forma unui nor de electroni comun.
La mecanism donor-acceptor formarea unei legături covalente, un atom are o pereche de electroni liberi, iar celălalt are un orbital gol. Primul (donatorul) împarte perechea cu cel de-al doilea (acceptatorul). Deci, în cationul de amoniu, azotul are o pereche singură, iar ionul de hidrogen are un orbital liber.
Legătură covalentă nepolară format între atomii unui element chimic. Deci, în moleculele de hidrogen (H 2), oxigen (O 2) etc., legătura este nepolară. Aceasta înseamnă că perechea de electroni comună aparține în mod egal ambilor atomi, deoarece au aceeași electronegativitate.
Legătură covalentă polară se formează între atomi de diferite elemente chimice. Un atom mai electronegativ deplasează o pereche de electroni spre sine. Cu cât diferența de electronegativitate a atomilor este mai mare, cu atât electronii vor fi deplasați mai mult, iar legătura va fi mai polară. Deci, în CH 4, deplasarea perechilor de electroni comuni de la atomii de hidrogen la atomi de carbon nu este atât de mare, deoarece carbonul nu este mult mai electronegativ decât hidrogenul. Cu toate acestea, în fluorură de hidrogen HF, legătura este puternic polară, deoarece diferența de electronegativitate dintre hidrogen și fluor este semnificativă.
Legătură covalentă simplă format dacă atomii au o pereche de electroni, dubla- dacă doi, triplu- dacă trei. Un exemplu de legătură covalentă unică pot fi molecule de hidrogen (H 2), acid clorhidric (HCl). Un exemplu de dublă legătură covalentă este o moleculă de oxigen (O 2 ), în care fiecare atom de oxigen are doi electroni nepereche. Un exemplu de legătură covalentă triplă este o moleculă de azot (N 2).
Legătură covalentă. Conexiune multiplă. Comunicare nepolară. Comunicare polară.
Electroni de valență. Orbital hibrid (hibridizat). Lungimea link-ului
Cuvinte cheie.
Caracterizarea legăturilor chimice în compușii bioorganici
AROMATICE
PRELEZA 1
SISTEME CONECTATE: ACICLICE ȘI CICLICE.
1. Caracterizarea legăturilor chimice din compușii bioorganici. Hibridarea orbitalilor atomului de carbon.
2. Clasificarea sistemelor conjugate: aciclice și ciclice.
3 Tipuri de conjugare: π, π și π, p
4. Criterii de stabilitate a sistemelor conjugate - „energie de conjugare”
5. Sisteme conjugate aciclice (neciclice), tipuri de conjugare. Principalii reprezentanți (alcadiene, acizi carboxilici nesaturați, vitamina A, caroten, licopen).
6. Sisteme cuplate ciclice. Criterii de aromatitate. regula lui Hückel. Rolul conjugării π-π-, π-ρ-în formarea sistemelor aromatice.
7. Compuși aromatici carbociclici: (benzen, naftalenă, antracen, fenantren, fenol, anilină, acid benzoic) - structură, formarea unui sistem aromatic.
8. Compuși aromatici heterociclici (piridină, pirimidină, pirol, purină, imidazol, furan, tiofen) - structură, caracteristici ale formării sistemului aromatic. Hibridizarea orbitalilor de electroni ai atomului de azot în timpul formării compușilor heteroaromatici cu cinci și șase membri.
9. Valoarea medicală și biologică a compușilor naturali care conțin sisteme conjugate de legături și aromatice.
Nivelul inițial de cunoștințe pentru stăpânirea temei (curs de chimie școlară):
Configurații electronice ale elementelor (carbon, oxigen, azot, hidrogen, sulf. Halogeni), conceptul de „orbital”, hibridizarea orbitalilor și orientarea spațială a orbitalilor elementelor din perioada 2., Tipuri de legături chimice, caracteristici ale formării legături covalente σ și π, modificarea electronegativității elementelor din perioada și grupa, clasificarea și principiile nomenclaturii compușilor organici.
Moleculele organice se formează prin legături covalente. Legăturile covalente apar între două nuclee atomice datorită unei perechi comune (socializate) de electroni. Această metodă aparține mecanismului de schimb. Se formează legături nepolare și polare.
Legăturile nepolare sunt caracterizate printr-o distribuție simetrică a densității electronilor între cei doi atomi pe care îi conectează această legătură.
Legăturile polare sunt caracterizate printr-o distribuție asimetrică (neuniformă) a densității electronilor; aceasta este deplasată către un atom mai electronegativ.
Seria de electronegativitate (trasă în jos)
A) elemente: F> O> N> C1> Br> I ~~ S> C> H
B) atom de carbon: C (sp)> C (sp 2)> C (sp 3)
Legăturile covalente pot fi de două tipuri: sigma (σ) și pi (π).
În moleculele organice, legăturile sigma (σ) sunt formate din electroni localizați în orbitali hibrizi (hibridați), densitatea electronilor este situată între atomi pe linia condiționată a legăturii lor.
Legăturile π (legăturile pi) apar atunci când doi orbitali p nehibridați se suprapun. Axele lor principale sunt situate paralele între ele și perpendiculare pe linia de legătură σ. Combinația de legături σ și π - se numește legătură dublă (multiple), constă din două perechi de electroni. O legătură triplă constă din trei perechi de electroni - una σ - și două legături π - (este extrem de rar în compușii bioorganici).
σ -Legăturile sunt implicate în formarea scheletului moleculei, ele sunt principalele și π -legaturile pot fi considerate suplimentare, dar conferind moleculelor proprietati chimice deosebite.
1.2. Hibridizarea orbitalilor atomului de carbon 6 С
Configurația electronică a stării neexcitate a unui atom de carbon
este exprimată prin distribuția electronilor 1s 2 2s 2 2p 2.
Cu toate acestea, în compușii bioorganici, precum și în majoritatea substanțelor anorganice, atomul de carbon are o valență egală cu patru.
Există o tranziție a unuia dintre electronii 2s la un orbital 2p liber. Apar stări excitate ale atomului de carbon, care creează posibilitatea formării a trei stări hibride, denumite C sp 3, C sp 2, C sp.
Orbitalul hibrid are caracteristici diferite de orbitalii s, p, d „puri” și este un „amestec” de două sau mai multe tipuri de orbitali nehibridați.
Orbitii hibrizi sunt caracteristici atomilor numai în molecule.
Conceptul de hibridizare a fost introdus în 1931 de către L. Pauling, laureat al Premiului Nobel.
Luați în considerare aranjarea în spațiu a orbitalilor hibrizi.
С s p 3 --- - - ---
Într-o stare excitată, se formează 4 orbitali hibrizi echivalenți. Dispunerea legăturilor corespunde direcției unghiurilor centrale ale unui tetraedru regulat, unghiul dintre oricare două legături este 109 0 28,.
În alcani și derivații lor (alcooli, haloalcani, amine), toți atomii de carbon, oxigen, azot sunt în aceeași stare hibridă sp 3. Atomul de carbon formează patru, atomul de azot formează trei, atomul de oxigen formează două covalente σ -conexiune. În jurul acestor legături, este posibilă rotația liberă a părților moleculei unele față de altele.
In starea excitata sp 2 apar trei orbitali hibrizi echivalenti, electronii situati pe ei formeaza trei σ - legături care sunt situate în același plan, unghiul dintre legături este de 120 0. 2p nehibridați - se formează orbitali a doi atomi vecini π -conexiune. Este situat perpendicular pe planul în care σ -conexiune. Interacțiunea electronilor p este în acest caz numită „suprapunere laterală”. Legătura multiplă nu permite rotația liberă a părților moleculei în jurul ei. Poziția fixă a părților moleculei este însoțită de formarea a două forme geometrice izomerice plane, care se numesc: izomeri cis (cis) și trans (trans). (cis- lat- pe o parte, trans- lat- peste).
π -conexiune
Atomii legați printr-o legătură dublă se află în starea de hibridizare sp 2 și
prezente în alchene, compuși aromatici, formează o grupare carbonil
> C = O, grupare azometină (grupare imino) -CH = N-
Cu sp 2 - --- - ---
Formula structurală a unui compus organic este descrisă folosind structuri Lewis (fiecare pereche de electroni dintre atomi este înlocuită cu o liniuță)
C2H6CH3-CH3HH
1.3... Polarizarea legăturilor covalente
O legătură polară covalentă este caracterizată printr-o distribuție neuniformă a densității electronilor. Pentru a indica direcția de deplasare a densității electronilor, sunt utilizate două imagini convenționale.
Polar σ - legătura... Deplasarea densității electronice este indicată de o săgeată de-a lungul liniei de comunicație. Capătul săgeții îndreaptă spre atomul mai electronegativ. Apariția sarcinilor parțiale pozitive și negative este indicată folosind litera „b” „delta” cu semnul de sarcină dorit.
b + b- b + b + b- b + b-
CH 3 -> O<- Н СН 3 - >C1 CH3 -> NH2
metanol clormetan aminometan (metilamină)
Legătura π polară... Deplasarea densității electronilor este indicată de o săgeată semicirculară (curbată) deasupra legăturii pi, îndreptată de asemenea către atomul mai electronegativ. ()
b + b- b + b-
H2C = O CH3 - C === O
metanal |
CH3propanonă -2
1. Determinați tipul de hibridizare a atomilor de carbon, oxigen, azot din compușii A, B, C. Numiți compușii folosind regulile nomenclaturii IUPAC.
A. CH 3 -CH 2 - CH 2 -OH B. CH 2 = CH - CH 2 - CH = O
B. CH3-NH-C2H5
2. Faceți denumiri care caracterizează direcția de polarizare a tuturor legăturilor indicate în compuși (A - D)
A. CH 3 - Br B. C 2 H 5 - O - H C. CH 3 - NH - C 2 H 5
170762 0
Fiecare atom are un număr de electroni.
Intrând în reacții chimice, atomii donează, dobândesc sau socializează electroni, atingând cea mai stabilă configurație electronică. Cea mai stabilă este configurația cu cea mai mică energie (ca în atomii gazelor nobile). Acest model este numit „regula octet” (Figura 1).
Orez. unu.
Această regulă se aplică tuturor tipuri de legături... Legăturile electronice dintre atomi le permit să formeze structuri stabile, de la cele mai simple cristale până la biomolecule complexe, formând în cele din urmă sisteme vii. Se deosebesc de cristale prin metabolismul lor continuu. Mai mult decât atât, multe reacții chimice au loc după mecanisme transfer electronic, care joacă un rol esențial în procesele energetice din organism.
O legătură chimică este forța care ține doi sau mai mulți atomi, ioni, molecule sau orice combinație a acestora împreună..
Natura legăturii chimice este universală: este forța electrostatică de atracție dintre electronii încărcați negativ și nucleele încărcate pozitiv, determinată de configurația electronilor din învelișul exterior al atomilor. Capacitatea unui atom de a forma legături chimice se numește valenţă, sau starea de oxidare... Asociat cu valența este conceptul de electroni de valență- electroni care formează legături chimice, adică cei localizați în cei mai mari orbitali de energie. În consecință, învelișul exterior al atomului care conține acești orbitali se numește coajă de valență... În prezent, nu este suficientă indicarea prezenței unei legături chimice, dar este necesară clarificarea tipului acesteia: ionic, covalent, dipol-dipol, metalic.
Primul tip de conexiune esteionic conexiune
Conform teoriei electronilor a valenței lui Lewis și Kossel, atomii pot obține o configurație electronică stabilă în două moduri: în primul rând, prin pierderea de electroni, transformându-se în cationi, în al doilea rând, dobândirea lor, transformându-se în anionii... Ca rezultat al transferului de electroni din cauza forței electrostatice de atracție dintre ionii cu sarcini de semn opus, se formează o legătură chimică, numită Kossel " electrovalent„(Acum o cheamă ionic).
În acest caz, anionii și cationii formează o configurație electronică stabilă cu o înveliș electron exterior umplut. Legăturile ionice tipice sunt formate din cationi ai grupurilor T și II ale sistemului periodic și anioni ai elementelor nemetalice din grupele VI și VII (16 și, respectiv, 17 subgrupe, calcogeneși halogeni). Legăturile compușilor ionici sunt nesaturate și nedirecționale, deci păstrează posibilitatea interacțiunii electrostatice cu alți ioni. În fig. Figurile 2 și 3 prezintă exemple de legături ionice corespunzătoare modelului de transfer de electroni Kossel.
Orez. 2.
Orez. 3. Legătura ionică în molecula de clorură de sodiu (NaCl).
Este oportun să amintim aici unele dintre proprietățile care explică comportamentul substanțelor în natură, în special să luăm în considerare conceptul de aciziși temeiuri.
Soluțiile apoase ale tuturor acestor substanțe sunt electroliți. Își schimbă culoarea în moduri diferite indicatori... Mecanismul de acțiune al indicatorilor a fost descoperit de F.V. Ostwald. El a arătat că indicatorii sunt acizi sau baze slabe, a căror culoare în stările nedisociate și disociate este diferită.
Bazele sunt capabile să neutralizeze acizii. Nu toate bazele sunt solubile în apă (de exemplu, unii compuși organici care nu conțin - grupele OH sunt insolubile, în special, trietilamină N (C2H5)3); se numesc baze solubile alcalii.
Soluțiile apoase de acizi intră în reacții caracteristice:
a) cu oxizi metalici - cu formare de sare si apa;
b) cu metale - cu formarea de sare si hidrogen;
c) cu carbonați - cu formare de sare, CO 2 și N 2 O.
Proprietățile acizilor și bazelor sunt descrise de mai multe teorii. În conformitate cu teoria S.A. Arrhenius, acidul este o substanță care se disociază pentru a forma ioni N+, în timp ce baza formează ioni EL-. Această teorie nu ține cont de existența bazelor organice care nu au grupări hidroxil.
In linie cu proton Teoria lui Bronsted și Lowry, un acid este o substanță care conține molecule sau ioni care donează protoni ( donatori protoni), iar baza este o substanță formată din molecule sau ioni care acceptă protoni ( acceptori protoni). Rețineți că în soluțiile apoase, ionii de hidrogen există într-o formă hidratată, adică sub formă de ioni de hidroniu H3O+. Această teorie descrie reacții nu numai cu ioni de apă și hidroxid, ci și efectuate în absența unui solvent sau cu un solvent neapos.
De exemplu, în reacția dintre amoniac NH 3 (bază slabă) și clorura de hidrogen în faza gazoasă formează clorură de amoniu solidă, iar într-un amestec de echilibru de două substanțe există întotdeauna 4 particule, dintre care două sunt acizi, iar celelalte două sunt baze:
Acest amestec de echilibru constă din două perechi conjugate de acizi și baze:
1)NH 4 + și NH 3
2) acid clorhidricși Сl ‑
Aici, în fiecare pereche conjugată, acidul și baza diferă cu un proton. Fiecare acid are o bază conjugată cu el. Un acid puternic corespunde unei baze conjugate slabe, iar un acid slab corespunde unei baze conjugate puternice.
Teoria Bronsted-Lowry face posibilă explicarea unicității rolului apei pentru viața biosferei. Apa, în funcție de substanța care interacționează cu ea, poate prezenta proprietățile fie ale unui acid, fie ale unei baze. De exemplu, în reacțiile cu soluții apoase de acid acetic, apa este o bază, iar cu soluții apoase de amoniac, este un acid.
1) CH3COOH + H2O ↔ H3O + + CH 3 COO-. Aici, o moleculă de acid acetic donează un proton unei molecule de apă;
2) NH3 + H2O ↔ NH4 + + EL-. Aici, molecula de amoniac acceptă un proton dintr-o moleculă de apă.
Astfel, apa poate forma două perechi conjugate:
1) H2O(acid) și EL- (bază conjugată)
2) H3O+ (acid) și H2O(bază conjugată).
În primul caz, apa donează un proton, iar în al doilea, îl acceptă.
Această proprietate se numește amfiprotonicitate... Sunt numite substanțe care pot reacționa atât ca acizi, cât și ca baze amfoter... În natura vie, astfel de substanțe se găsesc adesea. De exemplu, aminoacizii sunt capabili să formeze săruri atât cu acizii, cât și cu bazele. Prin urmare, peptidele formează cu ușurință compuși de coordonare cu ionii metalici prezenți.
Astfel, o proprietate caracteristică a legăturii ionice este mișcarea completă a pachetului de electroni de legare la unul dintre nuclee. Aceasta înseamnă că există o regiune între ioni în care densitatea electronilor este aproape zero.
Al doilea tip de conexiune estecovalent conexiune
Atomii pot forma configurații electronice stabile prin împărțirea electronilor.
O astfel de legătură se formează atunci când o pereche de electroni este socializată pe rând. de la fiecare atom. În acest caz, electronii de legătură socializați sunt distribuiți în mod egal între atomi. Exemple de legături covalente includ homonuclear diatomic molecule H 2 , N 2 , F 2. Alotropii au același tip de conexiune. O 2 și ozon O 3 și molecula poliatomică S 8, precum și molecule heteronucleare acid clorhidric Acid clorhidric, dioxid de carbon CO 2, metan CH 4, etanol CU 2 N 5 EL, hexafluorură de sulf SF 6, acetilena CU 2 N 2. Toate aceste molecule au aceiași electroni în comun, iar legăturile lor sunt saturate și direcționate în același mod (Fig. 4).
Este important pentru biologi ca razele covalente ale atomilor din legăturile duble și triple să fie reduse în comparație cu o singură legătură.
Orez. 4. Legătura covalentă în molecula de Cl2.
Tipurile ionice și covalente de legături sunt două cazuri limitative ale multor tipuri existente de legături chimice și, în practică, majoritatea legăturilor sunt intermediare.
Compușii a două elemente situate la capete opuse ale uneia sau ale diferitelor perioade ale sistemului Mendeleev formează predominant legături ionice. Pe măsură ce elementele se apropie unele de altele în cadrul perioadei, caracterul ionic al compușilor lor scade, iar caracterul covalent crește. De exemplu, halogenurile și oxizii elementelor din partea stângă a tabelului periodic formează predominant legături ionice ( NaCl, AgBr, BaSO4, CaCO3, KNO3, CaO, NaOH), și aceiași compuși ai elementelor din partea dreaptă a tabelului sunt covalenti ( H20, CO2, NH3, NO2, CH4, fenol C6H5OH, glucoza C6H12O6, etanol C2H5OH).
Legătura covalentă, la rândul ei, are o altă modificare.
În ionii poliatomici și în moleculele biologice complexe, ambii electroni pot proveni doar din unu atom. Se numeste donator pereche electronică. Se numește atomul care socializează această pereche de electroni cu donatorul acceptor pereche electronică. Acest tip de legătură covalentă se numește coordonare (donator-acceptator, saudativ) comunicare(fig. 5). Acest tip de legătură este cel mai important pentru biologie și medicină, deoarece chimia celor mai importante elemente d pentru metabolism este în mare măsură descrisă de legăturile de coordonare.
Smochin. 5.
De regulă, într-un compus complex, un atom de metal acționează ca acceptor al unei perechi de electroni; dimpotrivă, cu legături ionice și covalente, atomul de metal este donor de electroni.
Esența legăturii covalente și varietatea acesteia - legătura de coordonare - pot fi clarificate folosind o altă teorie a acizilor și bazelor propusă de GN. Lewis. El a extins oarecum conceptul termenilor „acid” și „bază” conform teoriei Bronsted-Lowry. Teoria lui Lewis explică natura formării ionilor complecși și participarea substanțelor la reacțiile de substituție nucleofilă, adică la formarea CS.
Potrivit lui Lewis, un acid este o substanță capabilă să formeze o legătură covalentă prin acceptarea unei perechi de electroni dintr-o bază. Baza Lewis este o substanță care are o pereche de electroni singură, care, donând electroni, formează o legătură covalentă cu acidul Lewisic.
Adică, teoria lui Lewis extinde gama reacțiilor acido-bazice și la reacții în care protonii nu participă deloc. În plus, protonul însuși, conform acestei teorii, este, de asemenea, un acid, deoarece este capabil să accepte o pereche de electroni.
Prin urmare, conform acestei teorii, cationii sunt acizi Lewis, iar anionii sunt baze Lewis. Un exemplu sunt următoarele reacții:
S-a remarcat mai sus că subdiviziunea substanțelor în ionice și covalente este relativă, deoarece tranziția completă a unui electron de la atomii de metal la atomii acceptori din moleculele covalente nu are loc. În compușii cu o legătură ionică, fiecare ion se află în câmpul electric al ionilor de semn opus, deci sunt polarizați reciproc, iar învelișurile lor sunt deformate.
Polarizabilitate determinat de structura electronică, sarcina și dimensiunea ionului; este mai mare pentru anioni decât pentru cationi. Cea mai mare polarizabilitate dintre cationi este pentru cationii cu o sarcină mai mare și o dimensiune mai mică, de exemplu, pentru Hg 2+, Cd 2+, Pb 2+, Al 3+, Tl 3+... Are un puternic efect de polarizare N+. Deoarece influența polarizării ionilor este dublă, schimbă semnificativ proprietățile compușilor formați de aceștia.
Al treilea tip de conexiune estedipol-dipol conexiune
Pe lângă tipurile de comunicare enumerate, există și dipol-dipol intermolecular interacțiuni, numite și van der Waals .
Puterea acestor interacțiuni depinde de natura moleculelor.
Există trei tipuri de interacțiuni: dipol permanent - dipol permanent ( dipol-dipol atracţie); dipol permanent - dipol indus ( inducţie atracţie); dipol instantaneu - dipol indus ( dispersiv forțele gravitaționale sau londoneze; orez. 6).
Orez. 6.
Doar molecule cu legături covalente polare ( HCI, NH3, S02, H20, C6H5CI), iar puterea de legătură este 1-2 debay(1D = 3,338 × 10 ‑30 metri coulomb - Kl × m).
În biochimie, se distinge un alt tip de legătură - hidrogen legătură limitativă dipol-dipol atracţie. Această legătură se formează prin atracția dintre un atom de hidrogen și un mic atom electronegativ, cel mai adesea oxigen, fluor și azot. Cu atomi mari care au o electronegativitate similară (de exemplu, cu clor și sulf), legătura de hidrogen este mult mai slabă. Atomul de hidrogen diferă printr-o caracteristică esențială: atunci când electronii de legătură sunt trași înapoi, nucleul său - protonul - este expus și încetează să fie ecranat de electroni.
Prin urmare, atomul se transformă într-un dipol mare.
O legătură de hidrogen, spre deosebire de o legătură van der Waals, se formează nu numai în timpul interacțiunilor intermoleculare, ci și în cadrul unei molecule - intramolecular legătură de hidrogen. Legăturile de hidrogen joacă un rol important în biochimie, de exemplu, pentru stabilizarea structurii proteinelor sub formă de a-helix, sau pentru formarea unei duble helix ADN (Fig. 7).
Fig. 7.
Legăturile de hidrogen și van der Waals sunt mult mai slabe decât legăturile ionice, covalente și de coordonare. Energia legăturilor intermoleculare este indicată în tabel. unu.
Tabelul 1. Energia forțelor intermoleculare
Notă: Gradul de interacțiuni intermoleculare reflectă entalpia de topire și evaporare (fierbere). Compușii ionici necesită mult mai multă energie pentru a separa ionii decât pentru a separa molecule. Entalpiile de topire ale compușilor ionici sunt mult mai mari decât cele ale compușilor moleculari.
Al patrulea tip de conexiune estelegătură metalică
În cele din urmă, există un alt tip de legături intermoleculare - metal: conexiunea ionilor pozitivi ai rețelei de metale cu electronii liberi. Acest tip de conexiune nu se găsește în obiectele biologice.
Dintr-o scurtă prezentare a tipurilor de legături, un detaliu devine clar: un parametru important al unui atom sau al ionului metalic - un donor de electroni, precum și un atom - un acceptor de electroni, este marimea.
Fără a intra în detalii, observăm că razele covalente ale atomilor, razele ionice ale metalelor și razele van der Waals ale moleculelor care interacționează cresc pe măsură ce numărul lor ordinal în grupele sistemului periodic crește. În acest caz, valorile razelor ionilor sunt cele mai mici, iar valorile razelor van der Waals sunt cele mai mari. De regulă, la deplasarea în jos a grupului, razele tuturor elementelor cresc, atât covalente, cât și van der Waals.
Cele mai importante pentru biologi și medici sunt coordonarea(donator-acceptator) conexiuni considerate de chimia coordonării.
Bioanorganice medicale. G.K. Barașkov