Termodinamik harorat shkalasi. Mutlaq termodinamik harorat Termodinamik haroratning amaliy haroratga nisbati
1. 1848 yilda Uilyam Tomson (Lord Kelvin) Karnot teoremasi yordamida termometrik moddaning individual xususiyatlariga va termometr qurilmasiga bog'liq bo'lmagan ratsional harorat shkalasini tuzish mumkinligini ta'kidladi.
Karnot teoremasidan kelib chiqadiki, Karnot tsiklining samaradorligi faqat isitgich va muzlatgichning haroratiga bog'liq bo'lishi mumkin. Keling, t 1 va t 2 harflari bilan isitgich va muzlatgichning empirik haroratini, qandaydir termometr bilan o'lchaymiz.
Q1 - Q2 |
F (t 1, t 2) |
||
bu erda f (t1, t2) - t1 va t2 tanlangan empirik haroratlarning universal funktsiyasi. Uning turi Carnot mashinasi qurilmasiga va ishlatiladigan ishchi moddaning turiga bog'liq emas.
Qurmoq termodinamik harorat shkalasi, biz oddiy universal funktsiyani joriy qilamiz
= ϕ (t 1, t 2) |
|||||||
bu funktsiyalar bir -biri bilan chambarchas bog'liq |
|||||||
f (t1, t2) = |
Q1 - Q2 |
-1 = ϕ (t 1, t 2) -1 |
|||||
Keling, bu funktsiyaning shaklini aniqlaylik ϕ (t 1, t 2)
Buning uchun 3 ta Karnot tsiklini ko'rib chiqing. Bular. doimiy haroratda saqlanadigan 3 ta termal suv ombori mavjud
Carnot 1234 va 4356 tsikllari uchun siz yozishingiz mumkin
Q 1 = ϕ (t 1, t 2)
Q 2 = ϕ (t 2, t 3)
Q2 issiqligini yo'q qilib, biz bunga erishamiz
Q 1 = ϕ (t 1, t 2) ϕ (t 2, t 3)
BILAN 1256 -tsikl uchun boshqa tomon
Q 1 = ϕ (t 1, t 3)
ϕ (t 1, t 3) = ϕ (t 1, t 2) ϕ (t 2, t 3)
ϕ (t 1, t 2) = |
ϕ (t 1, t 3) |
||||
ϕ (t 2, t 3) |
|||||
Bu nisbat t3 ga bog'liq bo'lmasligi kerak. chunki bu tsikl 3 -chi suv omborini o'z ichiga olmaydi, uning harorati o'zboshimchalik bilan bo'lishi mumkin. Shunday qilib, funktsiya quyidagicha ko'rinishi kerak.
ϕ (t 1, t k) = Θ (t 1) Θ (t k) |
||||||
Θ (t 1) |
||||||
Θ (t 2) |
||||||
Qiymatdan beri |
Θ (t) faqat haroratga bog'liq, u holda bo'lishi mumkin |
|||||
tana harorati o'lchovi sifatida olinadi.
Quantity miqdori mutlaq termodinamik harorat deyiladi.
uning belgisi, ya'ni. mutlaq termodinamik harorat salbiy qiymatlarni qabul qila olmaydi.
Faraz qilaylik, jism borki, uning mutlaq harorati manfiy. Biz uni Karnot issiqlik dvigatelida muzlatgich sifatida ishlatamiz. Isitgich sifatida biz boshqa tanani olamiz, uning mutlaq harorati musbat. Bunday holda, biz termodinamikaning ikkinchi qonuni bilan ziddiyatni olamiz. (isboti yo'q)
Termodinamikaning ikkinchi qonunining postulati tomonidan ruxsat etilgan eng past harorat 0. Bu harorat deyiladi mutlaq nol harorat.
Termodinamikaning ikkinchi qonuni mutlaq nol haroratga erishish mumkinmi yoki yo'qmi degan savolga javob bera olmaydi. Bu bizga buni tasdiqlashga imkon beradi
jismni mutlaq noldan past sovutish mumkin emas.
Mutlaq nolga erishish termodinamikaning 3 -qonuni doirasida hal qilinadi.

2.4 Termodinamik harorat shkalasining ideal gaz termometr shkalasi bilan identifikatsiyasi
Bizda ishchi suyuqlik sifatida ideal gazni oladigan Karnot tsikli bo'ladi. Oddiylik uchun, biz gaz miqdori bir molga teng deb hisoblaymiz.
1-2 izotermik jarayon
Birinchi boshlanishiga ko'ra δ Q = dU + PdV. U = U (T) bo'lgani uchun, dU = 0
δ Q = PdV, PV = RT
Bu ifodani birlashtirib, biz topamiz
Q1 = RT 1 ln (V 1 / V 2)
Xuddi shunday
3-4 izotermik jarayon
Q2 = RT 2 ln (V 3 / V 4)
T 1 ln (V 1 / V 2) |
||||
ln (V 3 / V 4) |
||||
(2-3) (4-1) adiabatik jarayon
TV γ - 1 = konst
T 1 V γ 2−1 = T 2 V γ 3− 1
T 1 V γ 1−1 = T 2 V γ 4− 1
Molekulyar fizika |
||||||||
birini boshqasiga ajratish |
||||||||
Bu munosabatlar ideal ning harorati bog'liq bo'lgan ideal gazlar uchun ham amal qiladi.
Bu munosabatlardan kelib chiqadiki, mutlaq termodinamik harorat shkalasi ideal gaz termometrining mos keladigan harorat shkalasi bilan bir xil bo'ladi, agar ikkala holatda ham asosiy mos yozuvlar nuqtasining harorati. bir xil ma'no.
Masalan, muzning erishi harorati 273,16K.
(1) formuladan foydalanib, Carnot mashinasining samaradorligi ifodasini olish mumkin, bunda ideal gaz ishchi modda sifatida ishlatiladi.
Q1 - Q2 |
T 1 - T 2 |
||
2.5. Izotermik jarayonda issiqlikni mexanik ishga aylantirish. Karnoning ikkinchi teoremasi
Issiqlik - bu yuqori haroratli jismdan, masalan, ular aloqada bo'lganida, pastroq haroratli jismga o'tkaziladigan energiya. O'z -o'zidan, energiyaning bunday o'tkazilishi ishni bajarish bilan birga bo'lmaydi, chunki hech qanday jismlarning harakati yo'q. Bu faqat issiqlik uzatiladigan tananing ichki energiyasini ko'payishiga va haroratni tenglashtirishga olib keladi, shundan so'ng issiqlik uzatish jarayoni to'xtaydi. Ammo agar issiqlik bir vaqtning o'zida kengayishi mumkin bo'lgan tanaga o'tkazilsa, u ishni bajarishi mumkin.
Energiyaning saqlanish qonuniga ko'ra
δQ = dU + δ A
Eng katta "ish izotermik jarayonda, ichki energiya o'zgarmaganida amalga oshiriladi
δQ = δ A
Albatta, ko'proq ish bo'lishi mumkin emas.
Shunday qilib, maksimal ish bilan ta'minlangan issiqlik teng bo'lishi uchun, issiqlik manbai bilan uning o'rtasida harorat farqi bo'lmasligi uchun kengayayotgan tanaga issiqlik o'tkazilishi kerak.
To'g'ri, agar issiqlik manbai va u uzatiladigan jism o'rtasida harorat farqi bo'lmasa, u holda issiqlik o'tkazilmaydi!
Amalda, issiqlik o'tkazilishi uchun cheksiz kichik harorat farqi etarli, bu deyarli to'liq izotermiklik bilan bir xil. Bunday sharoitda issiqlik uzatish jarayoni cheksiz sekin va shuning uchun teskari. Bu. tsikl
Karnot - bu idealizatsiya qilingan tsikl, unda har bir tsiklda cheksiz kichik ishlar bajariladi va uni teskari deb hisoblash mumkin, chunki biz dissipativ jarayonlarni e'tiborsiz qoldiramiz.
Haqiqiy jarayon tarqaladi, chunki issiqlikning bir qismi ichki energiyani ko'paytiradi va bu holda ishlaydi
δ A n = δQ -dU ≤ δQ = δ A p
Bu. qaytarilmas jarayon, ishning zarariga tananing ichki energiyasini ortishiga olib keladi.
δ A n ≤δ A p
Bu ikkinchi Karnot teoremasini nazarda tutadi: Har qanday issiqlik dvigatelining samaradorligi, Karnot tsikliga muvofiq ishlaydigan, isitgich va muzlatgichning bir xil haroratida ishlaydigan ideal mashinaning samaradorligidan oshib ketishi mumkin emas.
η = Q1 - Q2 ≤ T 1 - T 2 (1) |
|
Ammo, agar biz ish muhitida sodir bo'layotgan o'zgarishlarni barqaror ko'rish jarayonimizni ko'rib chiqsak, Q1 va Q2 - qabul qilingan issiqlik miqdori va shunga mos ravishda ishchi muhit tomonidan chiqariladi. Shubhasiz, bu Q1 va Q2 miqdorlarga qarama -qarshi belgilar berilishi kerak. Tananing Q1 qabul qilgan issiqlik miqdorini ijobiy deb hisoblaymiz; keyin Q2 salbiy bo'ladi.
Shuning uchun (1) tengsizlikni quyidagicha qayta yozish mumkin:
Q1 + Q2 |
T 1 - T 2 |
|
Qaytariladigan jarayonlar holatida
Molekulyar fizika |
||||||||||||||||||||
Q1 + Q2 = T 1 - T 2 |
1 + Q 2 = 1 - T 2 |
|||||||||||||||||||
Va qaytarilmas (muvozanatsiz) jarayon bo'lsa |
||||||||||||||||||||
Bu munosabatlarni quyidagicha umumlashtirish mumkin: |
||||||||||||||||||||
≤0 |
||||||||||||||||||||
2 -savol |
1 -savol |
|||||||||||||||||||
T 1 T 1 |
+ ∫ 2 T 2 |
≤0 |
||||||||||||||||||
δ T Q ≤ 0
Bu munosabatlar Clausius tengsizligi deb ataladi.
Eslatib o'tamiz, amalda 0 ° an'anaviy bosimdagi muzning erish harorati deb qabul qilinadi, 100 ° esa normal bosimdagi suvning qaynash nuqtasi. Bu harorat oralig'ining yuzdan bir qismi amaliy harorat birligi - Selsiy (° C). Biroq, 0 ° C dan 100 ° C gacha bo'lgan intervalni simob va spirtli termometrlar uchun yuz teng qismga bo'linganda, ularning ko'rsatkichlari faqat 0 ° C va 100 ° S da mos keladi. Binobarin, qizdirilganda bu moddalarning kengayishi notekis sodir bo'ladi va shu tarzda yagona harorat shkalasini olish mumkin emas.
Yagona harorat shkalasini yaratish uchun uning qiymatini olish kerak, uning isishi yoki sovishi paytida o'zgarishi termometrik moddaning turiga bog'liq bo'lmaydi. Gaz bosimi shunday qiymatga ega bo'lishi mumkin, chunki juda zich bo'lmagan gazlar uchun bosimning harorat koeffitsienti gazning xususiyatiga bog'liq emas va ideal gaz bilan bir xil qiymatga ega. Eng yaxshi termometrik jism ideal gaz bo'ladi. Noyob vodorodning xossalari ideal gaz xususiyatlariga eng yaqin bo'lgani uchun, sezgir manometrga ulangan, kam uchraydigan vodorodli yopiq idish bo'lgan vodorod termomeri yordamida haroratni o'lchash maqsadga muvofiqdir. Vodorodning bosimi va harorati (4.3) nisbati bilan bog'liq bo'lgani uchun, haroratni manometr ko'rsatkichlaridan aniqlash mumkin.
0 ° muzning erishi haroratiga va 100 ° suvning qaynash nuqtasiga to'g'ri keladigan vodorod termometrida o'rnatilgan harorat shkalasi Selsiy shkalasi deyiladi.
E'tibor bering, Selsiy shkalasi bo'yicha nol shartli ravishda belgilanadi. Diplomning o'lchami ham o'zboshimchalik bilan. Bu shuni anglatadiki, ilmiy nuqtai nazardan, harorat shkalasining boshqa qurilishi joizdir.
Harorat o'lchovini oqilona tanlash formulalarni soddalashtirish va kuzatilgan qonuniyatlarning jismoniy ma'nosini chuqurroq tushunish imkonini beradi. Shu maqsadda Kelvin taklifi bilan yangi termal shkalasi joriy etildi, u hozir termodinamik harorat shkalasi deb ataladi. Ba'zan uni Kelvin shkalasi deb atashadi. Bu o'lchovda mutlaq nol harorati mos yozuvlar nuqtasi sifatida olinadi va daraja kattaligi, u iloji boricha Selsiy darajasiga to'g'ri kelishi uchun aniqlanadi.
SIda harorat birligi asosiy hisoblanadi va kelvin deb ataladi va haroratni o'qish uchun termodinamik harorat shkalasi ishlatiladi.
Xalqaro kelishuvga binoan, Kelvin o'lchami quyidagi shart bilan belgilanadi: suvning uch nuqtali harorati (§ 12.8) 273.16 K ga teng deb hisoblanadi. vodorod termometri shkalasidagi suvning uch nuqtasi 273,16 qismga bo'linadi, keyin shunday qismlardan biri kelvin hajmini aniqlaydi. Harorat suvning uch nuqtasiga to'g'ri kelganligi sababli, muzning yangi shkalada erishi harorati 273,15 K ni tashkil qiladi. Kelvin bir daraja Selsiy darajasiga teng bo'lgani uchun normal bosimdagi suvning qaynash nuqtasi 373,15 K bo'ladi. Kelajakda soddaligi uchun muzning erishi va qaynayotgan suvning harorati mos ravishda 273 va 373 K ga teng deb hisoblanadi.
Harorat T birinchi marta ideal termometr bosimi va harorati o'rtasidagi bog'liqlikka asoslangan gaz termometr yordamida empirik tarzda joriy qilingan. Ammo ideal gazning tenglamasi cheklangan bosim va harorat oralig'ida amal qiladi.
Karno tsikliga muvofiq ishlaydigan mashinaning samaradorligi ifodasidan shuni tushunsa bo'ladi
Umuman aytganda, bu nisbat empirik tarzda yangi mutlaq harorat shkalasini joriy qilishga imkon beradi ishlaydigan suyuqlikning xususiyatlariga bog'liq emas Karno tsiklining samaradorligi faqat yangi harorat va tenglikka bog'liq bo'ladi
F ( T X, T N).
1-2-3-6-1 va 4-3-5 ikkita "kichik tsikl" dan tashkil topgan isitgich T 1 va muzlatgich T 3 ning haroratlari bilan 1-2-5-6-1 Karnot tsiklini ko'rib chiqing. -6-4 oraliq harorat T 2 bilan. 1-2-5-6-1 tsiklini 1-2-3-4-1 va 4-3-5-6- dumaloq jarayonlarda ishlaydigan ikkita issiqlik dvigatelidan iborat kombinatsiyalangan issiqlik dvigatelining termodinamik tsikli deb talqin qilish mumkin. 4.
Uch tsikl uchun siz yozishingiz mumkin
, Q 3 / Q ¢ 2 = F ( T 3, T 2), .
Shuni ta'kidlash kerakki, 1-2-3-4-1 dumaloq jarayonda birinchi issiqlik mashinasining muzlatgichi olib tashlagan issiqlik Q ¢ 2 ikkinchi mashinaning ishchi tanasiga berilgan issiqlikka teng bo'ladi. dairesel jarayonga 4-3-5-6-4, ya'ni. birinchi mashinaning sovutgichi ikkinchisiga isitgich vazifasini bajaradi. Va ikkita issiqlik dvigatelining umumiy ishi 1-2-5-6-1 dumaloq jarayoniga mos keladigan birlashtirilgan issiqlik dvigatelining ishiga teng.
Chunki Q ¢ 3 / Q 1 = (Q ¢ 3 / Q ¢ 2) × (Q ¢ 2 / Q 1), keyin tenglik
Ammo chap tomon T 2 ga bog'liq emas. Bu qachon va qachon mumkin.
Miqdor termodinamik haroratdir va uni ideal gaz shkalasi bilan solishtirganda = shaklida yozish mumkin T, qayerda T - Kelvin shkalasi bo'yicha belgilangan harorat. Demak, ideal gaz termometr yordamida tuzilgan harorat shkalasi va termodinamik harorat shkalasi bir xil.
Shunday qilib, Karnot tsikli termodinamik harorat shkalasini tuzish va taklif qilish imkonini beradi termodinamik termometr ... Bunday termometrning ishlash printsipi - noma'lum haroratga ega bo'lgan tana o'rtasida Karno aylanishini tashkil qilish T X va ma'lum haroratga ega bo'lgan jism T(masalan, erigan muz yoki qaynoq suv bilan) va mos keladigan issiqlik miqdorini o'lchash Q X va Q. Formulani qo'llash
Termodinamik harorat Kelvin bilan o'lchangan harf bilan belgilanadi (K) (\ displey uslubi (K)) va mutlaq termodinamik shkalada o'lchanadi (Kelvin). Mutlaq termodinamik shkala fizikada va termodinamika tenglamalarida asosiy shkaladir.
Molekulyar kinetik nazariya, o'z navbatida, mutlaq haroratni termodinamik muvozanat sharoitida ideal gaz molekulalarining tarjima harakatining o'rtacha kinetik energiyasi bilan bog'laydi:
1 2 m v ¯ 2 = 3 2 k T, (\ Displaystyle (\ frac (1) (2)) m (\ bar (v)) ^ (2) = (\ frac (3) (2)) kT,)
qayerda m (\ Displaystyle m)─ molekula massasi, v ¯ (\ Displaystyle (\ bar (v))) Molec molekulalarning tarjima harakatining o'rtacha kvadrat tezligi, ─ mutlaq harorat, k (\ Displaystyle k) T Boltsmanning doimiyligi.
YouTube kolleji
1 / 3
Mutlaq harorat ➽ Fizika 10 -sinf ➽ Video darslik
2.1.3 Mutlaq harorat
Termodinamika | nihoyat biz mutlaq harorat va entropiyani qanday aniqlash kerakligini tushunamiz
Subtitrlar
Tarix
Haroratni o'lchash uning rivojlanishida uzoq va qiyin yo'lni bosib o'tdi. Haroratni to'g'ridan -to'g'ri o'lchash mumkin emasligi sababli, uni o'lchash uchun termometrik jismlarning xususiyatlari ishlatilgan, ular funksional ravishda haroratga bog'liq edi. Shu asosda har xil harorat o'lchovlari ishlab chiqilgan, ular deyiladi empirik va ularning yordami bilan o'lchangan harorat empirik deb ataladi. Empirik tarozilarning muhim kamchiliklari ularning uzluksizligining yo'qligi va har xil termometrik jismlar uchun harorat qiymatlari o'rtasidagi mos kelmaslikdir: mos yozuvlar nuqtalari o'rtasida ham, undan tashqarida ham. Empirik tarozilarning uzluksizligining yo'qligi, mumkin bo'lgan harorat oralig'ida o'z xususiyatlarini saqlab qolishga qodir bo'lgan moddaning yo'qligi bilan bog'liq. 1848 yilda Tomson (Lord Kelvin) harorat shkalasi darajasini ideal issiqlik dvigatelining samaradorligi uning chegaralarida bir xil bo'ladigan tarzda tanlashni taklif qildi. Keyinchalik, 1854 yilda, u termometrik jismlarning xususiyatlariga bog'liq bo'lmagan termodinamik shkala tuzish uchun teskari Karno funktsiyasidan foydalanishni taklif qildi. Biroq, bu g'oyani amalda amalga oshirish imkonsiz bo'lib chiqdi. 19-asrning boshlarida, haroratni o'lchash uchun "mutlaq" qurilmani qidirib, ular yana Gay-Lyussak va Charlz ideal gazlar qonunlariga asoslangan ideal gaz termometrining g'oyasiga qaytdilar. Gaz termometri uzoq vaqtdan beri mutlaq haroratni qaytarishning yagona usuli bo'lib kelgan. Mutlaq harorat shkalasini ko'paytirishning yangi yo'nalishlari kontaktsiz termometriyada Stefan-Boltzmann tenglamasi va kontakt termometriyasida Garri (Garri) Nyquist tenglamasidan foydalanishga asoslangan.
Termodinamik harorat shkalasini tuzishning fizik asoslari.
1. Termodinamik harorat shkalasi, asosan, Karnot teoremasi asosida qurilishi mumkin, bu ideal issiqlik dvigatelining samaradorligi ishchi suyuqlikning tabiati va dvigatel konstruksiyasiga bog'liq emasligini va faqat sovutgich va isitgichning harorati.
η = Q 1 - Q 2 Q 1 = T 1 - T 2 T 1, (\ displaystyle \ eta = (\ frac (Q_ (1) -Q_ (2)) (Q_ (1))) = (\ frac ( T_ (1) -T_ (2)) (T_ (1))),)
qayerda Q 1 (\ Displaystyle Q_ (1))- isitgichdan ishlaydigan suyuqlik (ideal gaz) oladigan issiqlik miqdori, Q 2 (\ displey uslubi Q_ (2))- ishchi suyuqlik sovutgichga beradigan issiqlik miqdori; T 1, T 2 (\ displey uslubi T_ (1), T_ (2))- mos ravishda isitgich va muzlatgichning harorati.
Yuqoridagi tenglamadan quyidagicha munosabatlar paydo bo'ladi:
Q 1 Q 2 = T 1 T 2 (\ Displaystyle (\ frac (Q_ (1)) (Q_ (2))) = (\ frac (T_ (1)) (T_ (2))))
Bu nisbat chizish uchun ishlatilishi mumkin mutlaq termodinamik harorat... Agar Karnot siklining izotermik jarayonlaridan biri Q 3 (\ displey uslubi Q_ (3)) o'zboshimchalik bilan o'rnatilgan suvning uch nuqtasi (mos yozuvlar nuqtasi) haroratida bajaring T 3 = 273,16 K, (\ displaystyle T_ (3) = 273,16K,) keyin har qanday boshqa harorat formula bo'yicha aniqlanadi T = 273.16 Q Q 3 (\ Displaystyle T = 273.16 (\ frac (Q) (Q_ (3))))... Shu tarzda o'rnatilgan harorat shkalasi deyiladi termodinamik Kelvin shkalasi... Afsuski, issiqlik miqdorini o'lchashning aniqligi past, bu yuqorida ta'riflangan usulni amalda amalga oshirishga imkon bermaydi.
2. Agar termometrik jism sifatida ideal gaz ishlatilsa, mutlaq harorat shkalasi tuzilishi mumkin. Darhaqiqat, Clapeyron tenglamasi munosabatni bildiradi
T = p V R (\ Displaystyle T = (\ frac (pV) (R)))
Agar siz gazning bosimini o'zgarmas hajmli muhrlangan idishda joylashgan idealga yaqin o'lchasangiz, siz shu tarzda haroratni shkalaga o'rnatishingiz mumkin. ideal gaz. Ushbu o'lchovning afzalligi shundaki, ideal gaz bosimi V = c o n s t (\ displaystyle V = const) haroratga qarab chiziqli o'zgaradi. Hatto juda kam uchraydigan gazlar ham o'z xususiyatlarida ideal gazdan bir oz farq qilar ekan, ideal gaz shkalasini amalga oshirish muayyan qiyinchiliklar bilan bog'liq.
3. Termodinamika bo'yicha turli darsliklar ideal gaz shkalasida o'lchangan harorat termodinamik haroratga to'g'ri kelishini isbotlaydi. Ammo shuni ta'kidlash kerakki: termodinamik va ideal gaz tarozilari son jihatdan bir xil bo'lishiga qaramay, sifat nuqtai nazaridan ular o'rtasida tub farq bor. Faqat termodinamik shkala termometrik moddaning xususiyatlaridan mutlaqo mustaqildir.
4. Yuqorida aytib o'tilganidek, termodinamik shkalaning, shuningdek ideal gaz shkalasining aniq takrorlanishi jiddiy qiyinchiliklarga to'la. Birinchi holda, ideal issiqlik dvigatelining izotermik jarayonlarida berilgan va chiqarilgan issiqlik miqdorini diqqat bilan o'lchash zarur. Bunday o'lchov noto'g'ri. Termodinamik (ideal-gaz) harorat shkalasini 10 dan 1337 oralig'ida ko'paytirish K (\ displey uslubi K) gaz termometridan foydalanish mumkin. Yuqori haroratlarda suv omborining devorlari orqali haqiqiy gazning tarqalishi sezilarli darajada namoyon bo'ladi va bir necha ming darajali haroratda poliatomik gazlar atomlarga parchalanadi. Hatto yuqori haroratlarda ham haqiqiy gazlar ionlanadi va Klapeyron tenglamasiga bo'ysunmaydigan plazma hosil bo'ladi. Past haroratda geliy bilan to'ldirilgan gaz termometrini o'lchash mumkin bo'lgan eng past harorat 1K (\ Displaystyle 1K)... Gaz termometrlarining imkoniyatlaridan yuqori bo'lgan haroratni o'lchash uchun maxsus o'lchash usullari qo'llaniladi. Batafsil ma'lumot uchun qarang Termometriya.
Karnot teoremasi termometrik moddaning individual xususiyatlariga va termometr qurilmasiga mutlaqo bog'liq bo'lmagan harorat shkalasini tuzishga imkon beradi. Bu harorat shkalasi 1848 yilda V.Tomson (Lord Kelvin) tomonidan taklif qilingan. U quyidagicha tuzilgan. Bo'lsin t 1 va t Isitgich va muzlatgichning 2 harorati, termometr bilan o'lchanadi. Keyin, Karnot teoremasiga ko'ra, Karno tsiklining samaradorligi
qayerda f(t 1 ,t 2) - tanlangan empirik haroratlarning universal funktsiyasi t 1 va t 2018-05-01 xoxlasa buladi 121 2. Uning shakli umuman Carnot mashinasining o'ziga xos qurilmasiga va ishlatiladigan ishchi moddaning turiga bog'liq emas. Kelajakda biz uchun oddiyroq universal harorat funktsiyasini ko'rib chiqish qulayroq bo'ladi
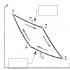
Bu funksiya osonlik bilan ifodalanadi f(t 1 ,t 2). J funktsiyasining umumiy shaklini aniqlash uchun t 1 ,t 2), harorati bir xil bo'lgan uchta issiqlik rezervuarini ko'rib chiqing. Bu suv omborlarining empirik harorati bilan belgilanadi t 1 , t 2 , t Mos ravishda 3. Ularni isitgich va muzlatgich sifatida ishlatib, biz uchta Karnot tsiklini o'tkazamiz ( a B C D, d-c-e-f, a-b-e-f) rasmda ko'rsatilgan. 11.1.
 Bu holda izotermalardagi harorat a-b, d-c, f-e tengdirlar t 1 , t 2 , t 3, va izotermalarda olingan issiqliklarning mutlaq qiymatlari Q 1 , Q 2 , Q Mos ravishda 3. Loop uchun a B C D va d-c-e-f yoza oladi
Bu holda izotermalardagi harorat a-b, d-c, f-e tengdirlar t 1 , t 2 , t 3, va izotermalarda olingan issiqliklarning mutlaq qiymatlari Q 1 , Q 2 , Q Mos ravishda 3. Loop uchun a B C D va d-c-e-f yoza oladi
Bu erdan tashqari Q 2, olamiz
 .
.
Birgalikda bu ikki tsikl bitta Karno tsikliga teng a-b-e-f beri izotermiya c-d qarama -qarshi yo'nalishda ikki marta o'tkaziladi va uni ko'rib chiqishdan chiqarib tashlash mumkin. Demak,
Bu iborani oldingi bilan solishtirib, biz olamiz
Chunki o'ng tomon bog'liq emas t 2, keyin bu munosabatlar argumentlarning har qanday qiymatlari uchun qondirilishi mumkin t 1 , t 2 , t 3 faqat j ( t 1 ,t 2) shaklga ega
 .
.
Shunday qilib, j ( t 1 ,t 2) bir xil funktsiya qiymatlarining nisbati Q ( t) da t = t 1 va t = t 2018-05-01 xoxlasa buladi 121 2. Q miqdori beri ( t) faqat haroratga bog'liq, uni tana harorati o'lchovi sifatida olish mumkin. Q miqdori mutlaq termodinamik harorat deyiladi. Q 1 va Q 2 termodinamik haroratlarning nisbati o'zaro bog'liqlik bilan aniqlanadi
Keyin Karno tsiklining samaradorligini quyidagicha yozish mumkin
 . (11.2)
. (11.2)
Ideal gaz (8.2) uchun Karno tsiklining samaradorligi bilan ifodani (11.2) solishtirganda, Karno tsiklidagi termodinamik va ideal gazli haroratlarning nisbatlari mos kelishiga ishonch hosil qilish mumkin.
Q 1 / Q 2 nisbatini asosan eksperimental tarzda topish mumkin. Buning uchun issiqliklarning mutlaq qiymatlarini o'lchash kerak Q 1 va Q 2, ishchi suyuqlik Karnot tsiklida Q 1 va Q 2 haroratli issiqlik rezervuarlaridan oladi. Biroq, bu nisbatning qiymati bo'yicha, Q 1 va Q 2 haroratlarining o'zi hali aniqlanmagan.
Mutlaq termodinamik haroratni aniq aniqlash uchun har qanday harorat nuqtasiga ma'lum bir Q qiymatini berish kerak, so'ngra (11.1) nisbati yordamida boshqa jismning haroratini hisoblash kerak. Ma'lum bir xarakterli haroratni takrorlash mumkin bo'lgan aniqlikka asoslanib, suvning uchlik nuqtasi asosiy mos yozuvlar nuqtasi sifatida tanlangan, ya'ni. muz, suv va suv bug'ining muvozanatdagi harorati (bosim R tr = 4,58 mm. rt. San'at). Bu haroratga qiymat beriladi T tr = 273,16 K aniq. Malumot haroratining bu qiymati termodinamik haroratning ideal gaz harorati bilan mos kelishini ta'minlash uchun tanlangan.
Qurilgan harorat shkalasi mutlaq termodinamik harorat shkalasi (Kelvin shkalasi) deb ataladi.
Karnot mashinasi faqat harorat shkalasini tuzishga imkon beradi. Bu haroratni amaliy o'lchash uchun mos emas. Biroq, termodinamikaning ikkinchi qonuni va Karnot teoremasining ko'p sonli oqibatlari haqiqiy termometrlarning o'qilishini to'g'rilashga imkon beradi, bu esa ularni mutlaq termodinamik shkalaga olib keladi. Buning uchun siz haroratga qo'shimcha ravishda har qanday aniq termodinamik munosabatlarni ishlatishingiz mumkin T faqat eksperimental ravishda o'lchanadigan miqdorlar kiritilgan.