Kremniy va uning birikmalari. Tabiatdagi kremniy
Xlorosilanlar kimyo sanoatida eng muhim reagentlar bo'lib, ularning ko'pchiligi kremniy-vodorod (Si-H) bog'ini xlorlash orqali olinadi. Bunday xlorlash odatda zaharli va/yoki qimmatbaho metall o'z ichiga olgan reagentlardan foydalanish orqali erishiladi. Tel-Aviv universiteti tadqiqotchilari metallardan foydalanmasdan Si-H aloqalarini xlorlashning yangi, oddiy, selektiv va yuqori samarali katalitik usulini topdilar. Bor birikmasi tris(pentaflorofenil)bor B(C 6 F 5) 3 katalizator, xlorid kislotasi HCl xlorlashtiruvchi sifatida ishlatiladi. Reaksiya mexanizmi raqobatdosh reaksiyalar va kvant mexanik hisoblari asosida taklif qilingan. Asar nashr etilgan Angewandte Chemie xalqaro nashri- dunyodagi eng nufuzli kimyoviy jurnallardan biri.
Xlorosilanlar - umumiy formulasi R 3 Si-Cl (bu erda R - har qanday organik guruh, vodorod yoki boshqa xlor) bo'lgan kremniy-xlor bog'iga ega bo'lgan moddalar - organik kimyoning ko'plab sohalarida qo'llaniladi: dorilar, polimerlar va boshqa ko'plab moddalar sintezi. moddalar. Masalan, deyarli hech qanday ko'p bosqichli organik sintez ularsiz amalga oshirilmaydi, chunki ko'plab faol guruhlar ularning yordami bilan himoyalangan (shuningdek, Himoya guruhiga qarang). Agar molekulada bir nechta faol guruhlar mavjud bo'lsa, ulardan biri tegishli xlorosilan yordamida kremniy qalqoni (silil efir) tomonidan tanlab (boshqalariga ta'sir qilmasdan) bloklanishi mumkin, keyin boshqa reaktiv guruhlar bilan kerakli reaktsiyalar amalga oshirilishi mumkin va keyingi bosqichda kremniy himoyasi olib tashlanishi mumkin, bu esa keyingi reaktsiyalar uchun himoyalangan guruhni bo'shatadi. Silikon himoya guruhi molekulaning boshqa qismlariga ta'sir qilmasdan juda oson olib tashlanadi, shuning uchun bu himoya juda mashhur. Turli guruhlar himoyalanish uchun turli xil sharoitlarni talab qiladi. Bundan tashqari, odatda turli xil kimyoviy muhitlarga joylashtirilgan bir xil guruhlar turli xil reaksiyaga kirishadi. Shuning uchun kimyogarlarga turli xil reaktivlikka ega yoki boshqacha aytganda, kremniy atomida turli guruhlarga ega bo'lgan xlorosilanlar kerak.
Xlorosilanlarni olishning eng mashhur usullaridan biri kremniy-vodorod (Si-H) bog'ini xlorlashdir. Ushbu bog'lanishlarni xlorlashning klassik (shu jumladan tijorat) usullarini an'anaviy ravishda stexiometrik (xlorlangan bog'lanishning har bir moli uchun faollashtiruvchi vositaning mos miqdordagi mollari kerak) va katalitik (katalizator molekulani faollashtiradi va undan keyin) bo'linishi mumkin. xlorlash, keyingi molekulani faollashtirish uchun asl holatiga qaytadi). Si-H bog'lanishlarini stoxiometrik xlorlash zaharli qalay xloridlari, zaharli elementar xlor va kanserogen uglerod tetraklorid kabi xavfli xlor manbalari bilan birgalikda metall tuzlari yordamida amalga oshiriladi. Ushbu bog'lanishlarni toksik bo'lmagan xlor manbalari (masalan, xlorid kislotasi) bilan katalitik xlorlashning ma'lum usullari palladiy kabi qimmat o'tish metall katalizatorlaridan foydalanishni o'z ichiga oladi. To'g'ridan-to'g'ri, faollashmasdan, silanlar xlorid kislotasi bilan reaksiyaga kirishmaydi.
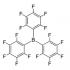
Kremniy davriy jadvalda to'g'ridan-to'g'ri uglerod ostida joylashganligiga qaramay, ularning kimyosi juda farq qiladi (masalan, "Elementlar" silenil-litiy birikmasining kontakt va solvat-ajratilgan ion juftlarining tuzilishi, 09/23/qarang. 2016) birinchi marta olingan. Xususan, vodorodning kremniy bilan bog'lanishi uglerodga qaraganda kuchsizroq va qutblangan bo'lib, vodorod manfiy zaryadlangan va o'zini psevdogalogen kabi tuta oladi. Bu xususiyat Tel-Aviv universiteti olimlari tomonidan tris(pentaflorofenil)bor B(C 6 F 5) 3 bilan Si-H aloqasini faollashtirish uchun foydalanilgan. B(C 6 F 5) 3 toksik bo'lmagan va nisbatan arzon (o'tish metallari bilan solishtirganda) uchta pentafluorofenil halqali bor birikmasidir. Ftorfenillar bor atomidan elektron zichligini tortib oladi, shuning uchun bor kremniydagi manfiy zaryadlangan vodorod atomi bilan o'zaro ta'sir qiladi va Si-H aloqasini zaiflashtiradi, bu esa xlorid kislotadan (HCl) xlorning vodorod o'rnini egallashiga imkon beradi. Ikki vodorod atomidan (H - kremniydan va H + xlorid kislotadan) molekulyar vodorod H 2 olinadi (1-rasm).

Trietilsilanni xlorlash reaktsiyasining alohida misoli shaklda ko'rsatilgan. 3. Sulfat kislotaning konsentrlangan eritmasini osh tuziga tomizish natijasida xlorid kislota hosil bo’ladi. Gazsimon xlorid kislota hosil bo'lib, u naycha orqali xlorosilan va katalizatorning aralashtirilgan toluol eritmasiga beriladi. Faqat bitta molekula B(C 6 F 5) 3 dan 100 tagacha Et 3 SiH molekulasidan (ya’ni bir mol foiz, 1 mol%) ortiqcha HCl bilan foydalanilsa, reaksiya 15 daqiqada yakunlanadi.

Kvant-mexanik hisob-kitoblar yordamida mualliflar reaksiyaning o‘tish holati strukturasi modelini (4-rasm) va bu reaksiyaning gaz fazasida borishi uchun zarur bo‘lgan energiyani (25,5 kkal/mol) oldi.

Yaxshi jurnalda chop etish uchun yangi reaktsiyani ochishning o'zi etarli emas. Hech bo'lmaganda uni keng qo'llash imkoniyatini ko'rsatish va taklif qilingan mexanizmni qo'shimcha tajribalar va / yoki nazariy hisob-kitoblar bilan tasdiqlash kerak. Ammo bu ham etarli bo'lmasligi mumkin. Juda yaxshi nashr qilish uchun allaqachon ma'lum bo'lgan va ishlatilgan reaktsiyalarda mavjud bo'lmagan reaktsiyaning xususiyatini ko'rsatish maqsadga muvofiqdir.
Boshlash uchun mualliflar B(C 6 F 5) 3 va uning eterati Et 2 O B (C 6 F 5) 3 dan foydalanib, o'zlarining usullari bilan xlorlangan, turli xil o'rinbosarlari R bo'lgan bir nechta silanlar - organosilikondan (tBuMe 2 Si) siloksidga (Et 3 SiO): Me 2 (tBuMe 2 Si) SiH, Ph 2 (Et 3 SiO) SiH, Me 2 SiClH, Ph 2 SiClH, Ph 2 SiH 2, PhMeSiH 2. Ular, shuningdek, silanlarni ikki vodorod Ph 2 SiH 2, PhMeSiH 2 bilan bosqichma-bosqich xlorlashni, turli xil katalizatorlar konsentratsiyasini (1 dan 10 mol% gacha) va reaksiya vaqtini o'zgartirishni ko'rsatishga muvaffaq bo'lishdi.
Ushbu bosqichda, reaktsiyaning o'zidan tashqari, g'ayrioddiy natijalar topilmadi. Keyin mualliflar ko'proq reaktiv uch vodorodli silan PhSiH 3 ning xlorlanishini sinab ko'rdilar. Bu erda shuni ta'kidlash kerakki, PhSiH 3 ni bosqichma-bosqich xlorlash oson ish emas, chunki reaktsiya monoxlorlanish bosqichini (PhSiClH 2) ikki marta xlorlash (PhSiCl 2 H) ga osongina o'tkazib yuborishi mumkin. Bu erda mualliflarni yoqimli ajablanib kutib olishdi. 10 mol% B(C 6 F 5) 3 bilan reaksiya 10 daqiqada sakrab, 87% PhSiCl 2 H va 13% PhSiClH 2 hosil qildi. Biroq, Et 2 O B(C 6 F 5) 3 eterati katalizator sifatida aynan bir xil sharoitlarda (10 mol%, 10 daqiqa) ishlatilganda, mahsulotlar nisbati deyarli qarama-qarshi bo'lib chiqdi: 16% PhSiCl 2 H va 84% PhSiClH 2 (jadvaldagi 1 va 2 reaksiyalar). Katalizator kontsentratsiyasini 10 baravar kamaytirish orqali bir bosqichda PhSiClH 2 ning eksklyuziv ishlab chiqarilishiga erishish mumkin edi (jadvalda 4-reaksiya). Eterat bilan ikki marta xlorlash 1000 daqiqadan keyin ham to'liq sodir bo'lmaydi (jadvaldagi 6-reaksiya).
Nima uchun efir bilan reaktsiya asl nusxadan juda farq qiladi? Axir, eterat faqat qulaylik tufayli ishlatilgan - uni izolyatsiya qilish osonroq va u efir bo'lmagan hamkasbiga qaraganda havoda barqarorroq. Eritmada dietil efir molekulasi (Et 2 O) bordan ajraladi va u nazariy jihatdan dastlabki katalizator bilan bir xil harakat qilishi kerak. Ehtimol, dietil efir molekulasining o'zi qandaydir tarzda reaktsiyada ishtirok etadimi? Ushbu gipotezaning tasdig'i reaktsiyadan keyin eritmani tahlil qilish orqali olingan - u erda etan C 2 H 6 mavjudligi ma'lum bo'ldi, u eritmada faqat dietil efir molekulasining parchalanishi orqali paydo bo'lishi mumkin. Keyin tadqiqotchilar HCl qo'shmasdan PhSiH 3 ning Et 2 O·B (C 6 F 5) bilan stoxiometrik (1: 1 nisbatda) reaktsiyasini o'tkazdilar va mahsulot sifatida fenil (etoksi)silan va etan oldilar. Dietil efir haqiqatda parchalangan (5-rasm).
Ko'rinib turibdiki, bu eterat tomonidan katalizlangan barcha reaktsiyalarning birinchi bosqichidir. Ikkinchisida HCl etoksisilan bilan reaksiyaga kirishadi va etanol ajralib chiqadi, u katalitik zanjirni davom ettirib, dietil efir o'rniga borga qayta qo'shiladi (6-rasm). Mualliflarning ta'kidlashicha, ikkinchi xlorlanish sekinlashadi, chunki etanol allaqachon xlorlangan molekula bilan xlorlanmagan molekulaga qaraganda sekinroq reaksiyaga kirishadi. Bu taxmin alohida tajriba va ikki turdagi katalizatorlar bilan reaksiyaning barcha bosqichlari energiyalarining kvant mexanik hisoblaridan foydalangan holda isbotlangan.

Sanoatda qimmatbaho metallar asosidagi katalizatorlarni almashtirish ikkinchisining yuqori narxi, cheklangan resurslari va zaharliligi tufayli juda muhimdir. Tris(pentaflorofenil)bor katalizchi kimyogarlar orasida mashhur bo'lib bormoqda va biz u bilan bog'liq ko'plab qiziqarli reaktsiyalarni ko'rishimiz mumkin.
Uglerod bir nechta allotropik modifikatsiyalarni hosil qilishga qodir. Bu olmos (eng inert allotropik modifikatsiya), grafit, fulleren va karbin.
Ko'mir va kuyik amorf ugleroddir. Ushbu holatdagi uglerod tartiblangan tuzilishga ega emas va aslida grafit qatlamlarining eng kichik bo'laklaridan iborat. Issiq suv bug'lari bilan ishlov berilgan amorf uglerod faollashtirilgan uglerod deb ataladi. 1 gramm faollashtirilgan uglerod, unda ko'plab teshiklar mavjudligi sababli, umumiy sirt uch yuz kvadrat metrdan oshadi! Turli moddalarni o'zlashtirish qobiliyati tufayli faollashtirilgan uglerod filtr to'ldiruvchisi, shuningdek, turli xil zaharlanishlar uchun enterosorbent sifatida keng qo'llaniladi.
Kimyoviy nuqtai nazardan, amorf uglerod uning eng faol shakli, grafit o'rtacha faollikni namoyish etadi, olmos esa o'ta inert moddadir. Shu sababli, quyida ko'rib chiqilgan uglerodning kimyoviy xossalari birinchi navbatda amorf uglerodga tegishli bo'lishi kerak.
Uglerodning kamaytiruvchi xossalari
Qaytaruvchi vosita sifatida uglerod kislorod, galogenlar va oltingugurt kabi metall bo'lmaganlar bilan reaksiyaga kirishadi.
Ko'mirni yoqish paytida kislorodning ortiqcha yoki etishmasligiga qarab, karbon monoksit CO yoki karbonat angidrid CO 2 hosil bo'lishi mumkin:
Uglerod ftor bilan reaksiyaga kirishganda, uglerod tetraflorid hosil bo'ladi:
Uglerodni oltingugurt bilan qizdirganda, uglerod disulfidi CS 2 hosil bo'ladi:
Uglerod oksidlaridan faollik seriyasida alyuminiydan keyin metallarni kamaytirishga qodir. Masalan:
Uglerod faol metallarning oksidlari bilan ham reaksiyaga kirishadi, ammo bu holda, qoida tariqasida, metallning qisqarishi emas, balki uning karbidining hosil bo'lishi kuzatiladi:
Uglerodning metall bo'lmagan oksidlari bilan o'zaro ta'siri
Uglerod karbonat angidrid CO 2 bilan proportsional reaksiyaga kirishadi:
Sanoat nuqtai nazaridan eng muhim jarayonlardan biri bu shunday deyiladi ko'mirning bug 'riformatsiyasi. Jarayon suv bug'ini issiq ko'mir orqali o'tkazish orqali amalga oshiriladi. Bunday holda, quyidagi reaktsiya sodir bo'ladi:
Yuqori haroratlarda uglerod hatto kremniy dioksidi kabi inert birikmani ham kamaytirishga qodir. Bunday holda, sharoitga qarab, kremniy yoki kremniy karbid hosil bo'lishi mumkin ( karborund):
Shuningdek, qaytaruvchi sifatida uglerod oksidlovchi kislotalar, xususan, konsentrlangan sulfat va nitrat kislotalar bilan reaksiyaga kirishadi:
Uglerodning oksidlovchi xossalari
Uglerod kimyoviy elementi yuqori elektronegativ emas, shuning uchun u hosil qilgan oddiy moddalar boshqa metall bo'lmaganlarga nisbatan kamdan-kam oksidlovchi xususiyatni namoyon qiladi.
Katalizator ishtirokida qizdirilganda amorf uglerodning vodorod bilan o'zaro ta'siri bunday reaktsiyalarga misol bo'ladi:
shuningdek, kremniy bilan taxminan 1200-1300 C haroratda:
Uglerod metallarga nisbatan oksidlovchi xususiyatga ega. Uglerod faol metallar va oraliq faollikdagi ba'zi metallar bilan reaksiyaga kirisha oladi. Reaksiyalar qizdirilganda davom etadi:
| Faol metall karbidlari suv bilan gidrolizlanadi:
shuningdek oksidlovchi bo'lmagan kislotalarning eritmalari: Bunday holda, uglevodorodlar asl karbiddagi kabi bir xil oksidlanish holatida uglerodni o'z ichiga olgan holda hosil bo'ladi. |
Kremniyning kimyoviy xossalari
Kremniy, shuningdek, kristalli va amorf holatda bo'lgan uglerod mavjud bo'lishi mumkin va xuddi uglerod holatida bo'lgani kabi, amorf kremniy ham kristalli kremniyga qaraganda sezilarli darajada kimyoviy faolroqdir.
Ba'zida amorf va kristalli kremniy uning allotropik modifikatsiyalari deb ataladi, bu esa, qat'iy aytganda, mutlaqo to'g'ri emas. Amorf kremniy asosan bir-biriga nisbatan tasodifiy joylashtirilgan kristalli kremniyning eng kichik zarralari konglomeratidir.
Kremniyning oddiy moddalar bilan o'zaro ta'siri
metall bo'lmaganlar
Oddiy sharoitlarda kremniy o'zining inertligi tufayli faqat ftor bilan reaksiyaga kirishadi:
Kremniy xlor, brom va yod bilan faqat qizdirilganda reaksiyaga kirishadi. Galogenning faolligiga qarab, mos ravishda boshqa harorat talab qilinishi xarakterlidir:
Shunday qilib, xlor bilan reaksiya 340-420 o C da davom etadi:
Brom bilan - 620-700 o C:
Yod bilan - 750-810 o C:
Kremniyning kislorod bilan reaksiyasi davom etadi, ammo kuchli oksid plyonkasi o'zaro ta'sirni qiyinlashtirganligi sababli u juda kuchli isitishni (1200-1300 ° C) talab qiladi:
1200-1500 ° S haroratda kremniy asta-sekin grafit shaklida uglerod bilan o'zaro ta'sirlanib, karborundum SiC hosil qiladi - olmosga o'xshash atom kristalli panjarasi bo'lgan va kuchi jihatidan deyarli undan kam bo'lmagan modda:
Kremniy vodorod bilan reaksiyaga kirishmaydi.
metallar
Elektromanfiyligi past bo'lganligi sababli, silikon faqat metallarga nisbatan oksidlovchi xususiyatlarni namoyon qilishi mumkin. Metalllardan kremniy faol (ishqoriy va gidroksidi tuproq), shuningdek, o'rta faollikdagi ko'plab metallar bilan reaksiyaga kirishadi. Ushbu o'zaro ta'sir natijasida silisidlar hosil bo'ladi:
Kremniyning murakkab moddalar bilan o'zaro ta'siri
Kremniy qaynayotganda ham suv bilan reaksiyaga kirishmaydi, ammo amorf kremniy 400-500 ° S haroratda qizib ketgan suv bug'lari bilan o'zaro ta'sir qiladi. Bu vodorod va kremniy dioksidi hosil qiladi:
Barcha kislotalardan kremniy (amorf holatda) faqat konsentrlangan gidroflorik kislota bilan reaksiyaga kirishadi:
Kremniy konsentrlangan ishqor eritmalarida eriydi. Reaktsiya vodorodning evolyutsiyasi bilan birga keladi.
Xlorid kislotaning silitsid, magniy Mg 2 Si, silikon vodorod SiH 4 ga ta'siri ostida metanga o'xshash:
Mg 2 Si + 4HCl \u003d 2MgCl 2 + SiH 4
Silikon vodorod SiH 4 rangsiz gaz boʻlib, havoda oʻz-oʻzidan yonib, kremniy dioksidi va suv hosil qiladi:
SiN 4 + 2O 2 = SiO 2 + 2N 2 O
SiH 4 dan tashqari bir qator boshqa silanlar ham ma'lum: Si 2 H 6. Si 3 H 8 va boshqalar, ular birgalikda silan deb ataladi. Silanlar uglevodorodlarga o'xshaydi, lekin ulardan beqarorligi bilan farqlanadi. Ko'rinib turibdiki, kremniy atomlari orasidagi bog'lanish uglerod atomlari orasidagi bog'lanishga qaraganda ancha kuchliroqdir, buning natijasida -Si-Si-Si- va hokazo zanjirlar osonlikcha buziladi. Kremniy va vodorod o'rtasidagi bog'lanish ham beqaror, bu kremniyning metalloid xususiyatlarining sezilarli darajada zaiflashishini ko'rsatadi.
Xlorid SiCl 4 kremniy va ko'mir aralashmasini xlor oqimida qizdirish orqali olinadi:
SiO 2 + 2C + 2Cl 2 \u003d SiCl 4 + 2CO
yoki texnik kremniyni xlorlash. Bu 57° da qaynaydigan suyuqlikdir. Suv ta'siri ostida S1CI 4 kremniy va xlorid kislotalar hosil bo'lishi bilan to'liq gidrolizlanadi:
SiCl 4 + 3H 2 O \u003d H 2 SiO 3 + 4HCl
Bu reaksiya natijasida SiCl 4 nam havoda bug'langanda zich tutun hosil bo'ladi; shuning uchun SiCl 4 tutun generatori sifatida ishlatiladi.
ftor SiF 4 floro-ning o'zaro ta'siridan hosil bo'ladi. vodorod xlorid bilan silika:
SiO 2 + 4HF \u003d SiF 4 + 2H 2 O
Bu o'tkir hidli rangsiz gaz.
Agar siz ftoridni suvga o'tkazsangiz, siz ftorsilik kislota H 2 SiFe eritmasini olasiz:
3SiF 4 + 3H 2 O \u003d 2H 2 SiF 6 + H 2 SiO 3
Konsentrlangan eritmadan sovutilganda H 2 SiF6 2H 2 O tarkibidagi kristallar ajralib turadi.
Ftorsilik kislota H 2 SiF 6 kuchli kislotalardan biridir. Uning dissotsilanish darajasi 0,1 n. eritma 75% ni tashkil qiladi. Hatto juda past konsentratsiyalarda ham kuchlidezinfektsiyalovchi. Ftorsilikat kislota tuzlari - ftorsilikatlar asosan suvda eriydi. Natriy va bariyning ftorsilikatlari qishloq xoʻjaligi ekinlarining zararkunandalariga qarshi kurashda keng qoʻllaniladi. Natriy florosilikat turli emallarni ishlab chiqarishda ham qo'llaniladi. Magniy va sink florosilikatlar tsementni suv o'tkazmaydigan qilish uchun ishlatiladi.
Siz vodorod bilan kremniy birikmalari mavzusidagi maqolani o'qiyapsiz
Elementning xarakteristikasi
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Izotoplar: 28 Si (92,27%); 29Si (4,68%); 30 Si (3,05%)
Kremniy yer qobig'ida kisloroddan keyin ikkinchi o'rinda turadi (massa bo'yicha 27,6%). Tabiatda erkin holatda uchramaydi, asosan SiO 2 yoki silikatlar holida uchraydi.
Si birikmalari toksikdir; SiO 2 va boshqa kremniy birikmalarining (masalan, asbest) eng kichik zarralarini nafas olish xavfli kasallik - silikozni keltirib chiqaradi.
Asosiy holatda kremniy atomi valentlik = II, qo'zg'alish holatida esa = IV ga ega.
Si ning eng barqaror oksidlanish darajasi +4. Metalllar (silitsidlar) bilan birikmalarda S.O. -4.
Kremniy olish usullari
Eng keng tarqalgan tabiiy kremniy birikmasi silika (kremniy dioksidi) SiO 2 dir. Bu kremniy ishlab chiqarish uchun asosiy xom ashyo hisoblanadi.
1) SiO 2 ni uglerod bilan yoy pechlarida 1800 "C da qayta tiklash: SiO 2 + 2C \u003d Si + 2CO
2) Texnik mahsulotdan yuqori tozalikdagi Si quyidagi sxema bo'yicha olinadi:
a) Si → SiCl 2 → Si
b) Si → Mg 2 Si → SiH 4 → Si
Kremniyning fizik xususiyatlari. Kremniyning allotropik modifikatsiyalari
1) Kristalli kremniy - kumush-kulrang rangdagi metall yaltiroq, olmos tipidagi kristall panjarali modda; m.p. 1415 "C, b.p. 3249" S, zichligi 2,33 g / sm3; yarimo'tkazgich hisoblanadi.
2) Amorf kremniy - jigarrang kukun.
Kremniyning kimyoviy xossalari
Ko'pgina reaktsiyalarda Si qaytaruvchi vosita sifatida ishlaydi:
Past haroratlarda kremniy kimyoviy jihatdan inertdir, qizdirilganda uning reaktivligi keskin ortadi.
1. 400°C dan yuqori T da kislorod bilan oʻzaro taʼsir qiladi:
Si + O 2 \u003d SiO 2 kremniy oksidi
2. Xona haroratida allaqachon ftor bilan reaksiyaga kirishadi:
Si + 2F 2 = SiF 4 kremniy tetraflorid
3. Boshqa halogenlar bilan reaksiyalar = 300 - 500 ° S haroratda boradi
Si + 2Hal 2 = SiHal 4
4. Oltingugurt bug'i bilan 600 ° C da disulfid hosil qiladi:
5. Azot bilan reaksiya 1000°S dan yuqori haroratda sodir bo‘ladi:
3Si + 2N 2 = Si 3 N 4 kremniy nitridi
6. = 1150°S haroratda uglerod bilan reaksiyaga kirishadi:
SiO 2 + 3C \u003d SiC + 2CO
Karborundum qattiqligida olmosga yaqin.
7. Kremniy vodorod bilan bevosita reaksiyaga kirishmaydi.
8. Kremniy kislotalarga chidamli. Faqat nitrat va gidroftorik (gidroflorik) kislotalar aralashmasi bilan o'zaro ta'sir qiladi:
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H 2 O
9. ishqor eritmalari bilan reaksiyaga kirishib, silikatlar hosil qiladi va vodorod ajralib chiqadi:
Si + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 2H 2
10. Kremniyning qaytaruvchi xossalari metallarni oksidlaridan ajratib olish uchun ishlatiladi:
2MgO \u003d Si \u003d 2Mg + SiO 2
Metallar bilan reaksiyalarda Si oksidlovchi moddadir:
Silikon s-metallar va koʻpchilik d-metallar bilan silisidlar hosil qiladi.
Ushbu metallning silitsidlarining tarkibi har xil bo'lishi mumkin. (Masalan, FeSi va FeSi 2; Ni 2 Si va NiSi 2.) Eng mashhur silisidlardan biri magniy silisid bo'lib, uni oddiy moddalarning bevosita o'zaro ta'sirida olish mumkin:
2Mg + Si = Mg 2 Si
Silan (monosilan) SiH 4
Silanlar (kremniy vodorodlari) Si n H 2n + 2, (alkanlar bilan solishtiring), bu erda n \u003d 1-8. Silanlar - alkanlarning analoglari, ulardan -Si-Si- zanjirlarining beqarorligi bilan farqlanadi.
Monosilane SiH 4 - yoqimsiz hidli rangsiz gaz; etanol, benzinda eriydi.
Qabul qilish usullari:
1. Magniy silisidning xlorid kislota bilan parchalanishi: Mg 2 Si + 4HCI = 2MgCI 2 + SiH 4
2. Si galogenidlarini litiy alyuminiy gidrid bilan qaytarilishi: SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
Kimyoviy xossalari.
Silan kuchli qaytaruvchi vositadir.
1.SiH 4 juda past haroratlarda ham kislorod bilan oksidlanadi:
SiH 4 + 2O 2 \u003d SiO 2 + 2H 2 O
2. SiH 4 oson gidrolizlanadi, ayniqsa ishqoriy muhitda:
SiH 4 + 2H 2 O \u003d SiO 2 + 4H 2
SiH 4 + 2NaOH + H 2 O \u003d Na 2 SiO 3 + 4H 2
Silikon (IV) oksidi (kremniy) SiO 2
Kremniy oksidi turli shakllarda mavjud: kristall, amorf va shishasimon. Eng keng tarqalgan kristalli shakli kvartsdir. Kvars jinslari vayron bo'lganda, kvarts qumlari hosil bo'ladi. Kvarts monokristallari shaffof, rangsiz (tosh kristalli) yoki turli xil rangdagi (ametist, agat, jasper va boshqalar) aralashmalar bilan bo'yalgan.
Amorf SiO 2 mineral opal shaklida uchraydi: kolloid SiO 2 zarralaridan iborat va juda yaxshi adsorbent bo'lgan silikagel sun'iy ravishda olinadi. Shishasimon SiO 2 kvarts oynasi sifatida tanilgan.
Jismoniy xususiyatlar
Suvda SiO 2 juda oz eriydi, organik erituvchilarda ham amalda erimaydi. Silika dielektrikdir.
Kimyoviy xossalari
1. SiO 2 kislota oksidi, shuning uchun amorf kremniy sekin ishqorlarning suvli eritmalarida eriydi:
SiO 2 + 2NaOH \u003d Na 2 SiO 3 + H 2 O
2. SiO 2 asosiy oksidlar bilan qizdirilganda ham oʻzaro taʼsir qiladi:
SiO 2 + K 2 O \u003d K 2 SiO 3;
SiO 2 + CaO \u003d CaSiO 3
3. SiO 2 uchuvchan bo'lmagan oksid bo'lib, karbonat angidridni Na 2 CO 3 dan siqib chiqaradi (birlashma paytida):
SiO 2 + Na 2 CO 3 \u003d Na 2 SiO 3 + CO 2
4. Silika gidroftorik kislota bilan reaksiyaga kirishib, gidroftorsilikat kislota H 2 SiF 6 hosil qiladi:
SiO 2 + 6HF \u003d H 2 SiF 6 + 2H 2 O
5. 250 - 400 ° S da SiO 2 gazsimon HF va F 2 bilan o'zaro ta'sirlanib, tetraflorosilan (kremniy tetraflorid) hosil qiladi:
SiO 2 + 4HF (gaz.) \u003d SiF 4 + 2H 2 O
SiO 2 + 2F 2 \u003d SiF 4 + O 2
Kremniy kislotalari
Ma'lum:
Ortosilik kislota H 4 SiO 4;
Metasilik (kremniy) kislota H 2 SiO 3;
Di- va polisilik kislotalar.
Barcha kremniy kislotalari suvda kam eriydi va oson kolloid eritmalar hosil qiladi.
Qabul qilish usullari
1. Ishqoriy metall silikatlar eritmalaridan kislotalar bilan cho’ktirish:
Na 2 SiO 3 + 2HCl \u003d H 2 SiO 3 ↓ + 2NaCl
2. Xlorosilanlarning gidrolizi: SiCl 4 + 4H 2 O \u003d H 4 SiO 4 + 4HCl
Kimyoviy xossalari
Kremniy kislotalar juda kuchsiz kislotalardir (karbon kislotadan kuchsizroq).
Ular qizdirilganda suvsizlanib, oxirgi mahsulot sifatida kremniy dioksidi hosil qiladi.
H 4 SiO 4 → H 2 SiO 3 → SiO 2
Silikatlar - kremniy kislotalarning tuzlari
Kremniy kislotalari juda zaif bo'lgani uchun ularning suvli eritmalaridagi tuzlari yuqori darajada gidrolizlanadi:
Na 2 SiO 3 + H 2 O \u003d NaHSiO 3 + NaOH
SiO 3 2- + H 2 O \u003d HSiO 3 - + OH - (ishqoriy muhit)
Xuddi shu sababga ko'ra, karbonat angidrid silikat eritmalari orqali o'tkazilganda, kremniy kislotasi ulardan ajralib chiqadi:
K 2 SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O \u003d H 2 SiO 3 ↓ + CO 3
Bu reaksiyani silikat ionlari uchun sifatli reaksiya deb hisoblash mumkin.
Silikatlar orasida faqat Na 2 SiO 3 va K 2 SiO 3 yaxshi eriydi, ular eruvchan shisha deb ataladi va ularning suvdagi eritmalari suyuq shisha deb ataladi.
Shisha
Oddiy oyna oynasi Na 2 O CaO 6SiO 2 tarkibiga ega, ya'ni natriy va kaltsiy silikatlarining aralashmasi. Soda Na 2 CO 3, CaCO 3 ohaktosh va SiO 2 qumini eritish orqali olinadi;
Na 2 CO 3 + CaCO 3 + 6SiO 2 \u003d Na 2 O CaO 6SiO 2 + 2CO 2
Sement
Suv bilan o'zaro ta'sirlashganda, plastik massa hosil qiladigan, oxir-oqibat qattiq toshga o'xshash tanaga aylanadigan changli bog'lovchi material; asosiy qurilish materiali.
Eng keng tarqalgan portlend tsementining kimyoviy tarkibi (og'irlik bo'yicha%) - 20 - 23% SiO 2; 62 - 76% CaO; 4 - 7% Al 2 O 3; 2-5% Fe 2 O 3; 1-5% MgO.
Si - yer qobig'ida eng ko'p tarqalgan elementlardan biri. O2 dan keyin eng keng tarqalgan. Tabiatda Si faqat birikma shaklida uchraydi: SiO2. O'simlik va hayvonot dunyosining eng muhim elementi.
Qabul qilish: Texnik: SiO2 + 2C ==== Si + 2CO. Sof: SiCl4 + 2H2 = Si + 4HCl. SiH4 =(t)Si + 2H2. Metallurgiya va yarimo'tkazgich texnologiyasida qo'llaniladi. Eritilgan Me dan O2 ni olib tashlash va qotishmalarning ajralmas qismi bo'lib xizmat qiladi. Fotosellar, kuchaytirgichlar, rektifikatorlar ishlab chiqarish uchun.
Jismoniy xususiyatlar aza. Silikon - kulrang-po'lat rang. mo'rt, faqat 800 ° C dan yuqori qizdirilganda, u plastik moddaga aylanadi. Infraqizil nurlanish uchun shaffof, yarimo'tkazgich. Kristal panjara olmosga o'xshab kubdir, lekin Si-Si atomlari orasidagi C-C bog'lanish uzunligiga nisbatan kattaroq bog'lanish uzunligi tufayli kremniyning qattiqligi olmosdan ancha past. Kul rangdagi allotropik Si-chang.
Kimyoviy xossalari: n da. y. Si faol emas va faqat gazsimon ftor bilan reaksiyaga kirishadi: Si + 2F2 = SiF4
Amorf Si ko'proq reaktiv, erigan Si juda faol.
400-500 °C haroratgacha qizdirilganda kremniy O2, Cl2, Br2, S bilan reaksiyaga kirishadi: Si + O2 = SiO2 . Si + 2 Cl2 = SiCl4
Azot bilan kremniy taxminan 1000 ° C haroratda Si3N4 nitridi hosil qiladi,
bor bilan - termal va kimyoviy chidamli boridlar SiB3, SiB6 va SiB12.,
uglerod bilan - silikon karbid SiC (karborundum).
Kremniyni metallar bilan qizdirganda, silisidlar hosil bo'lishi mumkin.
Si kislotalar bilan reaksiyaga kirishmaydi, faqat HNO3 va HF aralashmasi bilan uni oksidlanib, geksaftorsilik kislota hosil qiladi: 3Si + 8HNO3 + 18HF = 3H2 + 4NO + 8H2O
Sovuqda ishqor eritmalarida kuchli eriydi (metall bo'lmagan xossalari): Si + 2NaOH + H2O = Na2SiO3 + 2 H2
Yuqori haroratlarda u asta-sekin suv bilan o'zaro ta'sir qiladi: Si + 3H2O = H2SiO3 + 2H2
Vodorod birikmalariSi.Kremniy vodorod bilan bevosita reaksiyaga kirmaydi, kremniy birikmalari vodorod bilan - silanlar umumiy formula bilan SinH2n+2 bilvosita olinadi. Monosilan SiH4 Ca2Si + 4HCl → 2CaCl2 + SiH4 boshqa silanlarning aralashmasi, disilan Si2H6 va trisilan Si3H8.
Polisilanlar Zaharli, hidsiz, SnH2n+2 ga nisbatan issiqlikka chidamliligi kamaytiruvchi moddalar SiH4 + O2 = SiO2 + 2 H2O
SiH4 + 2H2O = SiO2 + 4H2 suvda gidrolizlang
Kremniyning metallar bilan birikmalari - SILICIDLAR
I.Ion-kovalent: gidroksidi, ishqoriy tuproq metallari va magniy Ca2Si, Mg2Si silisidlari
Suv bilan osongina yo'q qilinadi: Na2Si + 3H2O = Na2SiO3 + 3 H2
Kislotalar bilan parchalanadi: Ca2Si + 2H2SO4 = 2CaSO4 + SiH4
II. Metallga o'xshash: o'tish metall silisidlari.Kimyoviy jihatdan barqaror va kislotalar ta'sirida parchalanmaydi, hatto yuqori haroratlarda ham kislorodga chidamli. Ular yuqori Tm (2000 ° S gacha) ga ega. Ko'pchilik metall o'tkazuvchan. Eng keng tarqalgan MeSi, Me3Si2, Me2Si3, Me5Si3 va MeSi2.
d-elementlarning silisidlari issiqqa chidamli va kislotaga chidamli qotishmalar olish uchun ishlatiladi Lantanid silisidlari atom energetikasida neytron absorber sifatida ishlatiladi.
SiC - karborund Qattiq, o'tga chidamli modda. Kristal panjara olmosnikiga o'xshaydi. Bu yarimo'tkazgich. Sun'iy toshlar yasash uchun ishlatiladi
Silika F2 va HF bilan oson reaksiyaga kirishadi: SiO2 + 4HF = SiF4 + 2 H2O. SiO2 + F2 = SiF4 + O2 Suvda erimaydi.
Ishqor eritmalarida qizdirilganda eriydi: SiO2 + 2NaOH = Na2SiO3 + H2O
Tuzlar bilan sinterlangan: SiO2 + Na2CO3 = Na2SiO3 + CO2. SiO2 + PbO = PbSiO3
Kremniy kislotalari Suvda juda zaif, ozgina eriydigan kislotalar. Kremniy kislotalari suvda kolloid eritmalar hosil qiladi.
Silikat kislotalarning tuzlari silikatlar deyiladi. SiO2 kremniy kislotasiga mos keladi, uni kuchli kislotaning silikatNa2SiO3 + HCl = H2SiO3 + NaCl ga ta'sirida olish mumkin.
H2SiO3 - metasilikat yoki kremniy kislotasi. H4SiO4 - ortosilikat kislota faqat eritmada bo'ladi va suv bug'langanda qaytarib bo'lmaydigan tarzda SiO2 ga aylanadi.
silikatlar-kremniy kislotalarning tuzlari, har bir Si atomi tetraedral joylashgan O2 atomini o'rab oladi. Si va O2 o'rtasidagi yaqin aloqa.