Wie wird die Konstante gemessen? Die Boltzmann-Konstante spielt in der statischen Mechanik eine große Rolle
Als exakte quantitative Wissenschaft kommt die Physik nicht ohne eine Reihe sehr wichtiger Konstanten aus, die als universelle Koeffizienten in Gleichungen eingehen, die Beziehungen zwischen bestimmten Größen herstellen. Dies sind grundlegende Konstanten, dank derer solche Beziehungen invariant werden und das Verhalten physikalischer Systeme auf verschiedenen Skalen erklären können.
Zu diesen Parametern, die die Eigenschaften der Materie unseres Universums charakterisieren, gehört die Boltzmann-Konstante, eine Größe, die in einer Reihe der wichtigsten Gleichungen enthalten ist. Bevor man sich jedoch der Betrachtung seiner Merkmale und Bedeutung zuwendet, kann man nicht umhin, ein paar Worte über den Wissenschaftler zu sagen, dessen Namen es trägt.
Ludwig Boltzmann: Wissenschaftliche Errungenschaften
Einer der größten Wissenschaftler des 19. Jahrhunderts, der Österreicher Ludwig Boltzmann (1844-1906), leistete einen bedeutenden Beitrag zur Entwicklung der molekularkinetischen Theorie und wurde zu einem der Begründer der statistischen Mechanik. Er war der Autor der Ergodenhypothese, einer statistischen Methode zur Beschreibung eines idealen Gases, und der Grundgleichung der physikalischen Kinetik. Er beschäftigte sich intensiv mit Fragen der Thermodynamik (Boltzmanns H-Theorem, statistisches Prinzip für den zweiten Hauptsatz der Thermodynamik) und der Strahlungstheorie (Stefan-Boltzmann-Gesetz). In seinen Werken berührte er auch einige Themen der Elektrodynamik, Optik und anderer Bereiche der Physik. Sein Name ist in zwei physikalischen Konstanten verewigt, die weiter unten besprochen werden.
Ludwig Boltzmann war ein überzeugter und konsequenter Verfechter der Theorie des atomar-molekularen Aufbaus der Materie. Viele Jahre lang hatte er mit Missverständnissen und Ablehnung dieser Ideen in der wissenschaftlichen Gemeinschaft der damaligen Zeit zu kämpfen, als viele Physiker Atome und Moleküle als unnötige Abstraktion betrachteten, bestenfalls als konventionelles Mittel zur Vereinfachung von Berechnungen. Eine schmerzhafte Krankheit und Angriffe konservativer Kollegen lösten bei Boltzmann eine schwere Depression aus, die den herausragenden Wissenschaftler aus Unerträglichkeit in den Selbstmord trieb. Auf dem Grabdenkmal ist über der Büste Boltzmanns als Zeichen der Anerkennung seiner Verdienste die Gleichung S = k∙logW eingraviert – eines der Ergebnisse seiner fruchtbaren wissenschaftlichen Arbeit. Die Konstante k in dieser Gleichung ist die Boltzmann-Konstante.
Energie der Moleküle und Temperatur der Materie
Der Temperaturbegriff dient dazu, den Grad der Erwärmung eines bestimmten Körpers zu charakterisieren. In der Physik wird eine absolute Temperaturskala verwendet, die auf der Schlussfolgerung der molekularkinetischen Theorie über die Temperatur als Maß für die Energiemenge der thermischen Bewegung von Teilchen einer Substanz basiert (gemeint ist natürlich die durchschnittliche kinetische Energie von). eine Menge von Teilchen).
Sowohl das SI-Joule als auch das Erg, die im CGS-System verwendet werden, sind zu große Einheiten, um die Energie von Molekülen auszudrücken, und in der Praxis war es sehr schwierig, die Temperatur auf diese Weise zu messen. Eine praktische Temperatureinheit ist das Grad, und die Messung erfolgt indirekt durch die Aufzeichnung der sich ändernden makroskopischen Eigenschaften einer Substanz – beispielsweise des Volumens.

Wie hängen Energie und Temperatur zusammen?
Um die Zustände realer Materie bei Temperaturen und Drücken nahe dem Normalwert zu berechnen, wird erfolgreich das Modell eines idealen Gases verwendet, d. h. eines Gases, dessen Molekülgröße viel kleiner ist als das von einer bestimmten Gasmenge eingenommene Volumen und der Abstand dazwischen Teilchen übersteigt den Radius ihrer Wechselwirkung deutlich. Basierend auf den Gleichungen der kinetischen Theorie wird die durchschnittliche Energie solcher Teilchen als E av = 3/2∙kT bestimmt, wobei E die kinetische Energie, T die Temperatur und 3/2∙k der durch eingeführte Proportionalitätskoeffizient ist Boltzmann. Die Zahl 3 charakterisiert hier die Anzahl der Freiheitsgrade der translatorischen Bewegung von Molekülen in drei Raumdimensionen.
Der Wert k, der später zu Ehren des österreichischen Physikers Boltzmann-Konstante genannt wurde, gibt an, wie viel von einem Joule oder Erg ein Grad enthält. Mit anderen Worten, sein Wert bestimmt, um wie viel die Energie der thermischen chaotischen Bewegung eines Teilchens eines einatomigen idealen Gases statistisch gesehen im Durchschnitt bei einem Temperaturanstieg um 1 Grad zunimmt.

Wie oft ist ein Grad kleiner als ein Joule?
Der numerische Wert dieser Konstante kann auf verschiedene Weise ermittelt werden, beispielsweise durch Messung der absoluten Temperatur und des absoluten Drucks, mithilfe der idealen Gasgleichung oder mithilfe eines Brownschen Bewegungsmodells. Eine theoretische Ableitung dieses Wertes ist zum aktuellen Wissensstand nicht möglich.
Die Boltzmann-Konstante beträgt 1,38 × 10 -23 J/K (hier ist K Kelvin, ein Grad auf der absoluten Temperaturskala). Für eine Gruppe von Teilchen in 1 Mol eines idealen Gases (22,4 Liter) erhält man den Energie-Temperatur-Koeffizienten (universelle Gaskonstante), indem man die Boltzmann-Konstante mit der Avogadro-Zahl (Anzahl der Moleküle in einem Mol) multipliziert: R = kN A und beträgt 8,31 J/(mol∙kelvin). Im Gegensatz zu letzterer ist die Boltzmann-Konstante jedoch universellerer Natur, da sie in andere wichtige Beziehungen eingebunden ist und auch zur Bestimmung einer anderen physikalischen Konstante dient.
Statistische Verteilung molekularer Energien
Da makroskopische Materiezustände das Ergebnis des Verhaltens einer großen Ansammlung von Teilchen sind, werden sie mit statistischen Methoden beschrieben. Zu Letzterem gehört auch herauszufinden, wie die Energieparameter von Gasmolekülen verteilt sind:
- Maxwellsche Verteilung kinetischer Energien (und Geschwindigkeiten). Es zeigt, dass in einem Gas im Gleichgewichtszustand die meisten Moleküle Geschwindigkeiten nahe einer höchstwahrscheinlichen Geschwindigkeit v = √(2kT/m 0) haben, wobei m 0 die Masse des Moleküls ist.
- Boltzmann-Verteilung potentieller Energien für Gase, die sich im Feld beliebiger Kräfte befinden, beispielsweise der Schwerkraft der Erde. Es hängt von der Beziehung zwischen zwei Faktoren ab: der Anziehungskraft auf die Erde und der chaotischen thermischen Bewegung von Gaspartikeln. Je niedriger die potentielle Energie der Moleküle ist (näher an der Oberfläche des Planeten), desto höher ist ihre Konzentration.

Beide statistischen Methoden werden zu einer Maxwell-Boltzmann-Verteilung kombiniert, die einen Exponentialfaktor e - E/kT enthält, wobei E die Summe der kinetischen und potentiellen Energien ist und kT die bereits bekannte durchschnittliche Energie der thermischen Bewegung ist, gesteuert durch die Boltzmann-Konstante.
Konstantes k und Entropie
Im Allgemeinen kann die Entropie als Maß für die Irreversibilität eines thermodynamischen Prozesses charakterisiert werden. Diese Irreversibilität ist mit der Dissipation – Dissipation – von Energie verbunden. In dem von Boltzmann vorgeschlagenen statistischen Ansatz ist die Entropie eine Funktion der Anzahl der Möglichkeiten, auf denen ein physikalisches System realisiert werden kann, ohne seinen Zustand zu ändern: S = k∙lnW.
Hier gibt die Konstante k das Ausmaß des Entropiewachstums mit einer Zunahme dieser Anzahl (W) von Systemimplementierungsoptionen oder Mikrozuständen an. Max Planck, der diese Formel in ihre moderne Form brachte, schlug vor, der Konstante k den Namen Boltzmann zu geben.

Stefan-Boltzmann-Strahlungsgesetz
Das physikalische Gesetz, das festlegt, wie die energetische Leuchtkraft (Strahlungsleistung pro Flächeneinheit) eines absolut schwarzen Körpers von seiner Temperatur abhängt, hat die Form j = σT 4, d. h. der Körper emittiert proportional zur vierten Potenz seiner Temperatur. Dieses Gesetz wird beispielsweise in der Astrophysik verwendet, da die Strahlung von Sternen in ihren Eigenschaften der Schwarzkörperstrahlung ähnelt.
In diesem Zusammenhang gibt es eine weitere Konstante, die auch das Ausmaß des Phänomens bestimmt. Dies ist die Stefan-Boltzmann-Konstante σ, die ungefähr 5,67 × 10 -8 W/(m 2 ∙K 4) beträgt. Seine Dimension umfasst Kelvin – es ist also klar, dass auch hier die Boltzmann-Konstante k im Spiel ist. Tatsächlich ist der Wert von σ definiert als (2π 2 ∙k 4)/(15c 2 h 3), wobei c die Lichtgeschwindigkeit und h das Plancksche Wirkungsquantum ist. Die Boltzmann-Konstante bildet also zusammen mit anderen Weltkonstanten eine Größe, die wiederum Energie (Leistung) und Temperatur verknüpft – in diesem Fall im Verhältnis zur Strahlung.

Das physikalische Wesen der Boltzmann-Konstante
Oben wurde bereits darauf hingewiesen, dass die Boltzmann-Konstante zu den sogenannten Fundamentalkonstanten zählt. Es geht nicht nur darum, einen Zusammenhang zwischen den Eigenschaften mikroskopischer Phänomene auf molekularer Ebene und den Parametern von im Makrokosmos beobachteten Prozessen herzustellen. Und nicht nur, dass diese Konstante in einer Reihe wichtiger Gleichungen enthalten ist.
Es ist derzeit nicht bekannt, ob es ein physikalisches Prinzip gibt, auf dessen Grundlage es theoretisch abgeleitet werden könnte. Mit anderen Worten, es folgt aus nichts, dass der Wert einer gegebenen Konstante genau dieser sein sollte. Könnten wir statt Grad auch andere Größen und andere Einheiten als Maß für die Einhaltung der kinetischen Energie von Teilchen verwenden, dann wäre der Zahlenwert der Konstante ein anderer, aber es bliebe ein konstanter Wert. Neben anderen fundamentalen Größen dieser Art – der Grenzgeschwindigkeit c, dem Planck-Konstanten h, der Elementarladung e, der Gravitationskonstante G – akzeptiert die Wissenschaft die Boltzmann-Konstante als Gegebenheit unserer Welt und nutzt sie für eine theoretische Beschreibung des Physischen darin ablaufende Prozesse.
Boltzmann Ludwig (1844-1906)- großer österreichischer Physiker, einer der Begründer der molekularkinetischen Theorie. In den Werken von Boltzmann erschien die molekularkinetische Theorie erstmals als logisch kohärente, konsistente physikalische Theorie. Boltzmann gab eine statistische Interpretation des zweiten Hauptsatzes der Thermodynamik. Er hat viel dazu beigetragen, Maxwells Theorie des elektromagnetischen Feldes zu entwickeln und bekannt zu machen. Von Natur aus ein Kämpfer, verteidigte Boltzmann leidenschaftlich die Notwendigkeit einer molekularen Interpretation thermischer Phänomene und trug die Hauptlast im Kampf gegen Wissenschaftler, die die Existenz von Molekülen leugneten.
Gleichung (4.5.3) beinhaltet das Verhältnis der universellen Gaskonstante R zur Avogadro-Konstante N A . Dieses Verhältnis ist für alle Stoffe gleich. Zu Ehren von L. Boltzmann, einem der Begründer der molekularkinetischen Theorie, wird sie Boltzmann-Konstante genannt.
Boltzmanns Konstante ist:
 (4.5.4)
(4.5.4)
Gleichung (4.5.3) lautet unter Berücksichtigung der Boltzmann-Konstante wie folgt:
 (4.5.5)
(4.5.5)
Physikalische Bedeutung der Boltzmann-Konstante
Historisch gesehen wurde die Temperatur erstmals als thermodynamische Größe eingeführt und ihre Maßeinheit wurde festgelegt – Grad (siehe § 3.2). Nachdem der Zusammenhang zwischen der Temperatur und der durchschnittlichen kinetischen Energie der Moleküle festgestellt wurde, wurde klar, dass die Temperatur als die durchschnittliche kinetische Energie der Moleküle definiert und in Joule oder Erg, also statt in der Menge, ausgedrückt werden kann T Wert eingeben T* so dass 
Die so definierte Temperatur bezieht sich auf die in Grad ausgedrückte Temperatur wie folgt:

Daher kann die Boltzmann-Konstante als eine Größe betrachtet werden, die die Temperatur, ausgedrückt in Energieeinheiten, mit der Temperatur, ausgedrückt in Grad, in Beziehung setzt.
Abhängigkeit des Gasdrucks von der Konzentration seiner Moleküle und der Temperatur
Ausgedrückt haben E Aus der Beziehung (4.5.5) und deren Einsetzen in die Formel (4.4.10) erhalten wir einen Ausdruck, der die Abhängigkeit des Gasdrucks von der Molekülkonzentration und der Temperatur zeigt:
 (4.5.6)
(4.5.6)
Aus Formel (4.5.6) folgt, dass bei gleichen Drücken und Temperaturen die Konzentration der Moleküle in allen Gasen gleich ist.
Dies impliziert das Avogadro-Gesetz: Gleiche Gasvolumina bei gleichen Temperaturen und Drücken enthalten die gleiche Anzahl an Molekülen.
Die durchschnittliche kinetische Energie der Translationsbewegung von Molekülen ist direkt proportional zur absoluten Temperatur. Proportionalitätsfaktor- Boltzmann-Konstantek = 10 -23 J/K - muss sich erinnern.
§ 4.6. Maxwell-Verteilung
In vielen Fällen reicht die Kenntnis der Durchschnittswerte physikalischer Größen allein nicht aus. Wenn wir beispielsweise die durchschnittliche Körpergröße von Menschen kennen, können wir die Produktion von Kleidung in verschiedenen Größen nicht planen. Sie müssen die ungefähre Anzahl der Personen kennen, deren Körpergröße in einem bestimmten Intervall liegt. Ebenso ist es wichtig, die Anzahl der Moleküle zu kennen, deren Geschwindigkeit vom Durchschnittswert abweicht. Maxwell war der Erste, der herausfand, wie diese Zahlen ermittelt werden konnten.
Wahrscheinlichkeit eines zufälligen Ereignisses
In §4.1 haben wir bereits erwähnt, dass J. Maxwell das Konzept der Wahrscheinlichkeit eingeführt hat, um das Verhalten einer großen Ansammlung von Molekülen zu beschreiben.
Wie immer wieder betont wurde, ist es prinzipiell unmöglich, die Änderung der Geschwindigkeit (oder des Impulses) eines Moleküls über einen großen Zeitraum hinweg zu verfolgen. Es ist auch unmöglich, die Geschwindigkeiten aller Gasmoleküle zu einem bestimmten Zeitpunkt genau zu bestimmen. Aus den makroskopischen Bedingungen, in denen sich ein Gas befindet (ein bestimmtes Volumen und eine bestimmte Temperatur), ergeben sich nicht unbedingt bestimmte Werte der Molekülgeschwindigkeiten. Die Geschwindigkeit eines Moleküls kann als Zufallsvariable betrachtet werden, die unter gegebenen makroskopischen Bedingungen unterschiedliche Werte annehmen kann, so wie man beim Würfeln eine beliebige Anzahl von Punkten von 1 bis 6 erhalten kann (die Anzahl der Seiten des Würfels beträgt). sechs). Es ist unmöglich vorherzusagen, wie viele Punkte beim Würfeln erzielt werden. Aber die Wahrscheinlichkeit, beispielsweise fünf Punkte zu würfeln, ist bestimmbar.
Wie groß ist die Wahrscheinlichkeit, dass ein zufälliges Ereignis eintritt? Es soll eine sehr große Stückzahl produziert werden N Tests (N - Anzahl der Würfelwürfe). Zur gleichen Zeit, in N" In einigen Fällen gab es ein positives Ergebnis der Tests (d. h. eine Fünf fallen lassen). Dann ist die Wahrscheinlichkeit eines bestimmten Ereignisses gleich dem Verhältnis der Anzahl der Fälle mit günstigem Ausgang zur Gesamtzahl der Prozesse, sofern diese Anzahl beliebig groß ist:
 (4.6.1)
(4.6.1)
Bei einem symmetrischen Würfel beträgt die Wahrscheinlichkeit einer beliebigen Punktzahl von 1 bis 6 .
Wir sehen, dass sich vor dem Hintergrund vieler zufälliger Ereignisse ein bestimmtes quantitatives Muster offenbart, eine Zahl erscheint. Mit dieser Zahl – der Wahrscheinlichkeit – können Sie Durchschnittswerte berechnen. Wenn Sie also 300 Würfel werfen, beträgt die durchschnittliche Anzahl der Fünfer, wie aus Formel (4.6.1) hervorgeht, 300 = 50, und es macht überhaupt keinen Unterschied, ob Sie 300 oder 300 Mal mit demselben Würfel würfeln identische Würfel gleichzeitig.
Es besteht kein Zweifel, dass das Verhalten von Gasmolekülen in einem Gefäß viel komplexer ist als die Bewegung eines geworfenen Würfels. Aber auch hier kann man hoffen, bestimmte quantitative Muster zu entdecken, die die Berechnung statistischer Durchschnittswerte ermöglichen, wenn man das Problem nur auf die gleiche Weise stellt wie in der Spieltheorie und nicht wie in der klassischen Mechanik. Es ist notwendig, das unlösbare Problem aufzugeben, den genauen Wert der Geschwindigkeit eines Moleküls zu einem bestimmten Zeitpunkt zu bestimmen, und zu versuchen, die Wahrscheinlichkeit zu ermitteln, dass die Geschwindigkeit einen bestimmten Wert hat.
Nach dem Stefan-Boltzmann-Gesetz ist die Dichte der integralen hemisphärischen Strahlung E 0 hängt nur von der Temperatur ab und variiert proportional zur vierten Potenz der absoluten Temperatur T:
Die Stefan-Boltzmann-Konstante σ 0 ist eine physikalische Konstante, die im Gesetz enthalten ist und die volumetrische Dichte der Gleichgewichtswärmestrahlung eines absolut schwarzen Körpers bestimmt:

Historisch gesehen wurde das Stefan-Boltzmann-Gesetz vor dem Planckschen Strahlungsgesetz formuliert, woraus es als Konsequenz folgt. Das Plancksche Gesetz legt die Abhängigkeit der spektralen Flussdichte der Strahlung fest E 0 von der Wellenlänge λ und der Temperatur T:

wobei λ – Wellenlänge, m; Mit=2,998 · 10 8 m/s – Lichtgeschwindigkeit im Vakuum; T– Körpertemperatur, K;
H= 6,625 ×10 -34 J×s – Plancksches Wirkungsquantum.
Physikalische Konstante k, gleich dem Verhältnis der universellen Gaskonstante R=8314J/(kg×K) zur Avogadro-Zahl N / A.=6,022× 10 26 1/(kg×mol):

Anzahl unterschiedlicher Systemkonfigurationen aus N Teilchen für eine gegebene Menge von Zahlen n ich(Anzahl der Teilchen in ich-der Zustand, dem die Energie e i entspricht) ist proportional zum Wert:

Größe W Es gibt eine Reihe von Vertriebswegen N Teilchen nach Energieniveaus. Wenn Beziehung (6) wahr ist, wird davon ausgegangen, dass das ursprüngliche System der Boltzmann-Statistik gehorcht. Zahlensatz n ich, bei der die Nummer W Maximum, kommt am häufigsten vor und entspricht der wahrscheinlichsten Verteilung.
Physikalische Kinetik– mikroskopische Theorie von Prozessen in statistischen Nichtgleichgewichtssystemen.
Die Beschreibung einer großen Anzahl von Partikeln kann mit probabilistischen Methoden erfolgreich durchgeführt werden. Für ein einatomiges Gas wird der Zustand einer Reihe von Molekülen durch ihre Koordinaten und die Werte der Geschwindigkeitsprojektionen auf den entsprechenden Koordinatenachsen bestimmt. Mathematisch wird dies durch die Verteilungsfunktion beschrieben, die die Wahrscheinlichkeit charakterisiert, mit der sich ein Teilchen in einem bestimmten Zustand befindet:

ist die erwartete Anzahl von Molekülen in einem Volumen d d, deren Koordinaten im Bereich von bis +d liegen und deren Geschwindigkeiten im Bereich von bis +d liegen.
Wenn die zeitlich gemittelte potentielle Energie der Wechselwirkung von Molekülen im Vergleich zu ihrer kinetischen Energie vernachlässigt werden kann, wird das Gas als ideal bezeichnet. Ein ideales Gas wird Boltzmann-Gas genannt, wenn das Verhältnis der freien Weglänge der Moleküle in diesem Gas zur charakteristischen Größe der Strömung ist L natürlich, d.h.

Weil die Weglänge ist umgekehrt proportional 2(n ist die numerische Dichte 1/m 3, d ist der Durchmesser des Moleküls, m).
Größe
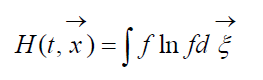
angerufen H-Boltzmann-Funktion für ein Einheitsvolumen, die mit der Wahrscheinlichkeit der Entdeckung eines Systems von Gasmolekülen in einem bestimmten Zustand verbunden ist. Jeder Zustand entspricht einer bestimmten Anzahl füllender sechsdimensionaler Raumgeschwindigkeitszellen, in die der Phasenraum der betrachteten Moleküle unterteilt werden kann. Bezeichnen wir W die Wahrscheinlichkeit, dass sich in der ersten Zelle des betrachteten Raums N 1 Moleküle befinden, in der zweiten N 2 usw.
Bis auf eine Konstante, die den Ursprung der Wahrscheinlichkeit bestimmt, gilt folgende Beziehung:
 ,
,
Wo 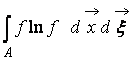 – H-Funktion eines Raumbereichs A mit Gas besetzt. Aus (9) geht hervor, dass W Und H miteinander verbunden, d.h. Eine Änderung der Wahrscheinlichkeit eines Zustands führt zu einer entsprechenden Entwicklung der H-Funktion.
– H-Funktion eines Raumbereichs A mit Gas besetzt. Aus (9) geht hervor, dass W Und H miteinander verbunden, d.h. Eine Änderung der Wahrscheinlichkeit eines Zustands führt zu einer entsprechenden Entwicklung der H-Funktion.

Das Boltzmannsche Prinzip stellt den Zusammenhang zwischen Entropie her S physikalisches System und thermodynamische Wahrscheinlichkeit W sie sagt:

(Veröffentlicht nach der Veröffentlichung: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Gesamtansicht des CUBE:

Wo ist die Massenkraft aufgrund der Anwesenheit verschiedener Felder (Gravitation, Elektrizität, Magnet), die auf das Molekül wirken? J– Kollisionsintegral. Es ist dieser Term der Boltzmann-Gleichung, der die Kollisionen von Molekülen untereinander und die entsprechenden Änderungen der Geschwindigkeiten wechselwirkender Teilchen berücksichtigt. Das Kollisionsintegral ist ein fünfdimensionales Integral und hat die folgende Struktur:

Gleichung (12) mit Integral (13) wurde für Stöße von Molekülen erhalten, bei denen keine Tangentialkräfte auftreten, d. h. kollidierende Teilchen gelten als vollkommen glatt.
Bei der Wechselwirkung ändert sich die innere Energie der Moleküle nicht, d.h. Es wird angenommen, dass diese Moleküle vollkommen elastisch sind. Es werden zwei Gruppen von Molekülen betrachtet, die vor der Kollision miteinander (Kollision) die Geschwindigkeiten und und nach der Kollision die Geschwindigkeiten und haben. Der Geschwindigkeitsunterschied wird Relativgeschwindigkeit genannt, d.h. . Es ist klar, dass für einen glatten elastischen Stoß . Verteilungsfunktionen f 1 ", f", f 1 , f beschreiben die Moleküle der entsprechenden Gruppen nach und vor Stößen, d. h. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Reis. 1. Kollision zweier Moleküle.
(13) enthält zwei Parameter, die den Ort kollidierender Moleküle relativ zueinander charakterisieren: B und ε; B– Zielentfernung, d.h. die kleinste Entfernung, die Moleküle ohne Wechselwirkung zurücklegen würden (Abb. 2); ε wird Kollisionswinkelparameter genannt (Abb. 3). Integration vorbei B von 0 bis ¥ und von 0 bis 2p (zwei externe Integrale in (12)) deckt die gesamte Ebene der Kraftwechselwirkung senkrecht zum Vektor ab

Reis. 2. Die Flugbahn der Moleküle.

Reis. 3. Betrachtung der Wechselwirkung von Molekülen in einem Zylinderkoordinatensystem: z, B, ε
Die kinetische Boltzmann-Gleichung wird unter den folgenden Annahmen und Annahmen abgeleitet.
1. Es wird angenommen, dass es hauptsächlich zu Kollisionen zweier Moleküle kommt, d.h. Die Rolle von Kollisionen von drei oder mehr Molekülen gleichzeitig ist unbedeutend. Diese Annahme ermöglicht es uns, für die Analyse eine Einzelpartikel-Verteilungsfunktion zu verwenden, die oben einfach als Verteilungsfunktion bezeichnet wird. Die Berücksichtigung der Kollision dreier Moleküle führt dazu, dass in der Studie eine Zwei-Teilchen-Verteilungsfunktion verwendet werden muss. Dementsprechend wird die Analyse deutlich komplizierter.
2. Annahme eines molekularen Chaos. Dies drückt sich darin aus, dass die Wahrscheinlichkeiten, Teilchen 1 am Phasenpunkt und Teilchen 2 am Phasenpunkt zu erkennen, unabhängig voneinander sind.
3. Kollisionen von Molekülen mit beliebiger Auftreffentfernung sind gleich wahrscheinlich, d. h. Die Verteilungsfunktion ändert sich am Wechselwirkungsdurchmesser nicht. Dabei ist zu beachten, dass das analysierte Element klein sein muss F innerhalb dieses Elements ändert sich nicht, aber gleichzeitig ist die relative Schwankung ~ nicht groß. Die zur Berechnung des Kollisionsintegrals verwendeten Wechselwirkungspotentiale sind sphärisch symmetrisch, d. h. ![]() .
.
Maxwell-Boltzmann-Verteilung
Der Gleichgewichtszustand des Gases wird durch die absolute Maxwellsche Verteilung beschrieben, die eine exakte Lösung der kinetischen Boltzmann-Gleichung ist:

Dabei ist m die Masse des Moleküls, kg.
Die allgemeine lokale Maxwellsche Verteilung, auch Maxwell-Boltzmann-Verteilung genannt:

für den Fall, dass sich das Gas als Ganzes mit Geschwindigkeit bewegt und die Variablen n, T von der Koordinate abhängen
und Zeit t.
Im Schwerefeld der Erde zeigt die exakte Lösung der Boltzmann-Gleichung:

Wo N 0 = Dichte an der Erdoberfläche, 1/m3; G– Erdbeschleunigung, m/s 2 ; H– Höhe, m. Formel (16) ist eine exakte Lösung der kinetischen Boltzmann-Gleichung entweder im unbegrenzten Raum oder in Gegenwart von Grenzen, die diese Verteilung nicht verletzen, während die Temperatur ebenfalls konstant bleiben muss.
Diese Seite wurde von Puzina Yu.Yu gestaltet. mit Unterstützung der Russischen Stiftung für Grundlagenforschung – Projekt Nr. 08-08-00638.
Die bestimmende Beziehung zwischen Temperatur und Energie. Benannt nach dem österreichischen Physiker Ludwig Boltzmann, der wichtige Beiträge zur statistischen Physik geleistet hat, in der diese Konstante eine Schlüsselrolle spielt. Sein experimenteller Wert im Internationalen Einheitensystem (SI) beträgt:
J/.Die Zahlen in Klammern geben den Standardfehler in den letzten Ziffern des Mengenwerts an. Die Boltzmann-Konstante kann aus der Definition der absoluten Temperatur und anderer physikalischer Konstanten ermittelt werden. Die Berechnung der Boltzmann-Konstante nach ersten Prinzipien ist jedoch zu komplex und mit dem aktuellen Wissensstand nicht durchführbar. Im natürlichen System der Planck-Einheiten ist die natürliche Einheit der Temperatur so gegeben, dass die Boltzmann-Konstante gleich eins ist.
Zusammenhang zwischen Temperatur und Energie
In einem homogenen idealen Gas bei absoluter Temperatur beträgt die Energie pro Translationsfreiheitsgrad, wie aus der Maxwell-Verteilung hervorgeht, . Bei Raumtemperatur (300 °C) beträgt diese Energie J oder 0,013 eV. In einem einatomigen idealen Gas hat jedes Atom drei Freiheitsgrade, die drei Raumachsen entsprechen, was bedeutet, dass jedes Atom eine Energie von hat.
Wenn wir die thermische Energie kennen, können wir die quadratische Durchschnittsgeschwindigkeit der Atome berechnen, die umgekehrt proportional zur Quadratwurzel der Atommasse ist. Die quadratische Durchschnittsgeschwindigkeit bei Raumtemperatur variiert zwischen 1370 m/s für Helium und 240 m/s für Xenon. Bei einem molekularen Gas wird die Situation komplizierter, beispielsweise hat ein zweiatomiges Gas etwa fünf Freiheitsgrade.
Definition von Entropie
Die Entropie eines thermodynamischen Systems ist definiert als der natürliche Logarithmus der Anzahl unterschiedlicher Mikrozustände, die einem gegebenen makroskopischen Zustand entsprechen (z. B. einem Zustand mit einer gegebenen Gesamtenergie).
Der Proportionalitätskoeffizient ist die Boltzmann-Konstante. Dieser Ausdruck, der den Zusammenhang zwischen mikroskopischen () und makroskopischen Zuständen () definiert, drückt die zentrale Idee der statistischen Mechanik aus.
siehe auch
Anmerkungen
Wikimedia-Stiftung. 2010.
Sehen Sie, was „Boltzmanns Konstante“ in anderen Wörterbüchern ist:
- (Symbol k), das Verhältnis der universellen GAS-Konstante zur AVOGADRO-ZAHL, gleich 1,381,10 23 Joule pro Grad Kelvin. Sie gibt den Zusammenhang zwischen der kinetischen Energie eines Gasteilchens (Atom oder Molekül) und seiner absoluten Temperatur an.... ... Wissenschaftliches und technisches Enzyklopädisches Wörterbuch
Boltzmann-Konstante- - [A. S. Goldberg. Englisch-Russisches Energiewörterbuch. 2006] Energiethemen im Allgemeinen EN Boltzmann-Konstante ... Leitfaden für technische Übersetzer
Boltzmanns Konstante- Boltzmann-Konstante Boltzmann-Konstante Eine physikalische Konstante, die die Beziehung zwischen Temperatur und Energie definiert. Benannt nach dem österreichischen Physiker Ludwig Boltzmann, der wichtige Beiträge zur statistischen Physik leistete, in der diese Konstante ... Erklärendes englisch-russisches Wörterbuch zur Nanotechnologie. - M.
Boltzmann-Konstante- Bolcmano konstanta statusas T sritis fizika atitikmenys: engl. Boltzmann ständiger Vok. Boltzmann Constante, f; Boltzmannsche Konstante, f rus. Boltzmann-Konstante, f pranc. Constante de Boltzmann, f … Fizikos terminų žodynas
Zusammenhang S k lnW zwischen Entropie S und thermodynamischer Wahrscheinlichkeit W (k Boltzmann-Konstante). Die statistische Interpretation des zweiten Hauptsatzes der Thermodynamik basiert auf dem Boltzmann-Prinzip: Natürliche Prozesse neigen dazu, die Thermodynamik umzuwandeln... ...
- (Maxwell-Boltzmann-Verteilung) Gleichgewichtsverteilung idealer Gasteilchen nach Energie (E) in einem externen Kraftfeld (z. B. in einem Gravitationsfeld); wird durch die Verteilungsfunktion f e E/kT bestimmt, wobei E die Summe der kinetischen und potentiellen Energien ist... Großes enzyklopädisches Wörterbuch
Nicht zu verwechseln mit der Boltzmann-Konstante. Stefan Boltzmanns Konstante (auch Stefans Konstante), eine physikalische Konstante, die die Proportionalitätskonstante im Gesetz von Stefan Boltzmann ist: die gesamte pro Flächeneinheit emittierte Energie... Wikipedia
Wert der Konstante Dimension 1,380 6504(24)×10−23 J K−1 8,617 343(15)×10−5 eV K−1 1,3807×10−16 erg K−1 Boltzmann-Konstante (k oder kb) eine physikalische Konstante, die definiert den Zusammenhang zwischen Temperatur und Energie. Benannt nach der österreichischen... ... Wikipedia
Statistische Güber die Impulse und Koordinaten von Teilchen eines idealen Gases, deren Moleküle der Klassik gehorchen. Mechanik, in einem äußeren Potentialfeld: Hier die Boltzmann-Konstante (universelle Konstante), absolut... ... Mathematische Enzyklopädie
Bücher
- Das Universum und die Physik ohne „dunkle Energie“ (Entdeckungen, Ideen, Hypothesen). In 2 Bänden. Band 1, O. G. Smirnov. Die Bücher widmen sich Problemen der Physik und Astronomie, die in der Wissenschaft seit Dutzenden und Hunderten von Jahren von G. Galileo, I. Newton, A. Einstein bis heute bestehen. Die kleinsten Materieteilchen und Planeten, Sterne und...