Правило Дюкло – Траубе. Вплив природи ПАР на їх поверхневу активність
Напишіть відгук про статтю "Правило Дюкло - Траубе"
Примітки
До:Вікіпедія:Ізольовані статті (тип: не вказано)Уривок, що характеризує Правило Дюкло – Траубе
І, підійшовши до ліжка, з-під чистих подушок дістав гаманець і велів принести вина.– Так, і тобі віддати гроші та лист, – додав він.
Ростов узяв листа і, кинувши на диван гроші, обійшовся обома руками на стіл і почав читати. Він прочитав кілька рядків і сердито глянув на Берга. Зустрівши його погляд, Ростов закрив обличчя листом.
— Проте грошей вам порядно надіслали, — сказав Берг, дивлячись на важкий гаманець, що вдавився в диван. - Ось ми так і скаржимо, граф, пробиваємось. Я вам скажу про себе.
- Ось що, Бергу мій любий, - сказав Ростов, - коли ви отримаєте з дому листа і зустрінетеся зі своєю людиною, у якої вам захочеться розпитати про все, і я буду тут, я зараз піду, щоб не заважати вам. Послухайте, йдіть, будь ласка, куди-небудь, куди-небудь... до біса! - крикнув він і зараз же, схопивши його за плече і лагідно дивлячись у його обличчя, мабуть, намагаючись пом'якшити грубість своїх слів, додав: - ви знаєте, не гнівайтесь; любий, голубчику, я від душі говорю, як нашому старому знайомому.
- Ах, помилуйте, граф, я дуже розумію, - сказав Берг, підводячись і кажучи в собі горловим голосом.
— Ви підіть до господарів: вони вас звали, — додав Борис.
Берг одягнув чистий, без цятки і смітника, сюртучок, збив перед дзеркалом скроні догори, як носив Олександр Павлович, і, переконавшись на погляд Ростова, що його сюртучок був помічений, з приємною усмішкою вийшов із кімнати.
- Ах, яка я худоба, проте! - промовив Ростов, читаючи листа.
- А що?
- Ах, яка я свиня, проте, що я жодного разу не писав і так налякав їх. Ах, яка я свиня, – повторив він, раптом почервонівши. - Що ж, пішли за вином Гаврило! Ну, гаразд, годі! - сказав він…
У листах рідних було вкладено ще рекомендаційний лист до князя Багратіона, який, за порадою Ганни Михайлівни, через знайомих дістала стара графиня і посилала синові, просячи його знести за призначенням і скористатися ним.
– Ось дурниці! Дуже мені потрібно, – сказав Ростов, кидаючи листа під стіл.
– Навіщо ти це покинув? – спитав Борис.
- Лист якийсь рекомендаційний, чи чорта мені в листі!
- Як чорта в листі? – піднімаючи та читаючи напис, сказав Борис. - Лист це дуже потрібне для тебе.
- Мені нічого не потрібно, і я в ад'ютанти ні до кого не піду.
- Від чого ж? – спитав Борис.
– Локейська посада!
1. Приготуйте 0,2, 0,1 0.05, 0,025 та 0,0125 М розчини трьох спиртів (або органічних кислот) одного гомологічного ряду.
2. Визначте величини їх поверхневих натягів за допомогою приладу та методу Ребіндера, результати та розрахунку запишіть у таблицю 3.6
3. Побудуйте на одному графіку ізотерми поверхневого натягу всіх використаних вами розчинів ПАР одного гомологічного ряду.
4. З графіка розрахуйте поверхневі активності Ds/DC всіх розчинів для всіх концентрацій початкових лінійних ділянок.
5. Розрахуйте відношення поверхневих активностей найближчих сусідів гомологічного ряду.
6. Зробіть висновок про виконання правила Дюкло – Траубе.
Таблиця 3.6.
| Розчини | З, Міль/л | P = h 2 - h 1 | s, дн/см | Ds/DC |
| 0 | P o = | s o = | ||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 | ||||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 | ||||
| 0,0125 | ||||
| 0,025 | ||||
| 0,05 | ||||
| 0,1 | ||||
| 0,2 |
КОНТРОЛЬНІ ПИТАННЯ:
Перед виконанням роботи:
1. Сформулюйте мету роботи.
2. Розкажіть порядок вимірювання для визначення поверхневого натягу методом Ребіндера.
3. Розкажіть методику визначення поверхневої активності розчинів ПАР та розрахунку адсорбції за Гіббсом.
4. Поясніть порядок роботи та розрахунків щодо перевірки здійсненності правила Дюкло – Траубе.
До захисту роботи:
1. Поверхневий натяг – це …
2. Вкажіть фактори, що впливають на поверхневий натяг рідин.
3. Чи є різниця у поверхневому натягу м'якої та жорсткої води, зразки якої знаходяться при однаковій температурі? Аргументуйте відповідь.
4. Поясніть відмінність термінів «абсорбція» та «адсорбція». Наведіть приклади адсорбції та абсорбції.
5. Зобразіть графіки залежності адсорбції від концентрації поверхнево-активної речовини при температурах Т1 та Т2, враховуючи, що Т2< Т 1.
6. Зобразіть графіки залежності поверхневого натягу від концентрації поверхнево-активної речовини при температурах Т1 та Т2, враховуючи, що Т2 > Т1.
7. Визначте площу, що припадає на одну молекулу аніліну С 6 Н 5 NH 2 на межі його з повітрям, якщо гранична адсорбція аніліну становить Г ? = 6.0 10 -9 кмоль/м 2 .
8. Наведіть приклад процесу, внаслідок якого поверхневий натяг води стає рівним нулю.
9. З ряду поданих нижче сполук виберіть такі, які збільшують поверхневий натяг води: NaOH, NH 4 OH, 6 Н 5 NH 2 , СН 3 -СН 2 -СН 2 -СН 2 -СООН, СН 3 -СН 2 ОNa, KCNS
10. На скільки відрізняються поверхневі активності етилового (СН 3 -СН 2 ОН) і бутилового (СН 3 -СН 2 -СН 2 -СН 2 ОН) спиртів однакової концентрації (при малих концентраціях).
11. Яка з наведених нижче сполук матиме найбільшу величину адсорбції при однаковій концентрації: НСООН, СН 3 -СООН або СН 3 -СН 2 -СООН? Аргументуйте відповідь.
ГАЗОВА ХРОМАТОГРАФІЯ
Хроматографічний метод поділу суміші речовин полягає в тому, що речовини, що становлять суміш, рухаються разом з несорбованим газом-носієм уздовж поверхні сорбенту (нерухомої фази), і при цьому безперервно відбуваються процеси сорбції та десорбції цих речовин. Нерухома фаза поміщена у вигляді насадки в трубку, яка називається хроматографічною колонкою, через яку повинні пройти всі впущені речовини, після чого на виході з колонки вони фіксуються хроматографічним детектором. Рух речовин уздовж колонки відбувається тільки разом із потоком газу-носія, у той час, як у сорбованому стані вони спрямовано не рухаються. Тому чим більший середній "час життя" молекул індивідуальної речовини в сорбованому стані, тим менша їхня середня швидкість руху вздовж колонки. На рис.3.1 представлена хроматограма, записана детектором, для суміші чотирьох речовин.
Мал. 4.1 Типова хроматограма суміші із чотирьох речовин.
Стрілкою на рис.4.1 позначений момент впуску суміші в потік газу-носія біля входу колонку. Загальний час проходження речовини через колонку ( час утримування ) t u складається з часу руху з газом-носієм t 0та сумарного часу перебування в сорбованому стані t R (виправлений час утримання):
t u = t o + t R 4.1
t 0 однаково всім речовин, оскільки вони переміщаються вздовж колонки разом із газом-носієм з лінійною швидкістю його руху u 0 . Так як утримування речовин у сорбованому стані відбувається за рахунок взаємодії молекул речовин, що розділяються з молекулами рідкої плівки (розподільна хроматографія) або поверхні твердої фази (адсорбційна хроматографія), то t R залежить від природи нерухомої фази. Компоненти суміші, що розрізняються по енергії взаємодії з цією нерухомою фазою, матимуть різні значення t R . Наприклад, енергія зазначених взаємодій для похідних вуглеводнів визначається довжиною вуглеводневого ланцюга та наявністю функціональних груп, отже, величина виправленого часу утримування t R є якісною характеристикою даної речовини за постійних умов досвіду: температури і об'ємної швидкості газу-носія (w ).
Середня лінійна швидкість руху i-го компонента суміші вздовж колонки u i = l/t u , де l- Довжина колонки, описується основним рівнянням:
 4.2
4.2
u 0 - швидкість газу-носія;
 - Коефіцієнт Генрі, тобто. коефіцієнт розподілу i-ї речовини між нерухомою та газовою фазами;
- Коефіцієнт Генрі, тобто. коефіцієнт розподілу i-ї речовини між нерухомою та газовою фазами;
З a і З - концентрації речовини у цих фазах при рівновазі відповідно;
 називається відношенням фаз і дорівнює відношенню обсягу V a нерухомої фази, в якому відбувається сорбція, до обсягу рухомої (газової) фази в колонці V = wt o., w – об'ємна швидкість газу-носія
.
називається відношенням фаз і дорівнює відношенню обсягу V a нерухомої фази, в якому відбувається сорбція, до обсягу рухомої (газової) фази в колонці V = wt o., w – об'ємна швидкість газу-носія
.
У зв'язку з тим, що Г i для різних речовин суміші відрізняються один від одного, рух їх вздовж колонки відбувається з різними середніми швидкостями, що призводить до їх поділу. Нессорбовані речовини, як і і газ-носій, проходять всю довжину колонки під час t 0 . Таким чином,
 , 4.З
, 4.З
тобто.  , 4.4
, 4.4
Звідки
 , 4.5
, 4.5
Помножуючи праву та ліву частини на w, отримуємо
 , 4.6
, 4.6
V R- виправлений утримуваний обсяг залежить тільки від обсягу нерухомої фази в колонці і коефіцієнта Генрі. Відносний об'єм, що утримується, двох компонентів 1 і 2, рівний не залежить від V a , а тільки від природи речовин і температури
 , 4.7
, 4.7
Таким чином, відносний об'єм, що утримується, є найбільш відтворюваною якісною характеристикою речовини в порівнянні з t u , t R і V R .
Це правило працює в розчинах гомологічних рядів ПАР і формулюється так:
Зі збільшенням довжини вуглеводневого радикалу на одну групу СН 2 , Поверхнева активність зростає в гомологічному ряду в 3 - 3,5 рази
Проілюструємо це правило графічно:

Рис.2.21. Ізотерми поверхневого натягу (а) та адсорбції (б) розчинів ПАР одного гомологічного ряду (1,2,3 - число груп -СН 2 - у вуглеводневому радикалі)
Звернемо увагу на те, що значення Г ∞ для одного гомологічного ряду залишається постійним. Це тим, що ємність моношару у разі залежить лише від площі, яку займає молекула ПАР у цьому шарі. У рядах карбонових кислот, спиртів ця площа визначається величиною полярної групи, однаковою для ряду ПАР.
Це правило дотримується для істинно розчинних ПАР. Т.к. поверхнева активність визначається для нескінченно розведених систем, легко пояснити її залежність від довжини вуглеводневого радикала. Чим довше радикал, тим більше виштовхується молекула ПАР з водного розчину, т.к. вбудовування радикала у воду збільшує G, і процес виходу молекул на поверхню енергетично дуже вигідний.
Рівняння Шишковського ( * )
Для випадку адсорбції молекул ПАР на межі розділу фаз можна використовувати обидва запропоновані рівняння адсорбції на однорідній поверхні. Прирівняємо їх один одному:
 =
=
 (2.56)
(2.56)
Розділимо змінні та проінтегруємо ці рівняння:

 ,
(2.57)
,
(2.57)
 , (2.58)
, (2.58)
Так як у розчинах ПАР внаслідок їх високої поверхневої активності значення абсолютної адсорбції Апрактично рівні надлишкової адсорбції Гтому виведене рівняння може бути записане і у вигляді:. (2.59)
Отримане рівняння зветься рівняння Шишковського. Спочатку воно було виведено їм емпірично для опису залежності поверхневого натягу від концентрації ПАР:
До рівняння (2.60) входять коефіцієнти і А, фізичний зміст яких видно з вище виведеного рівняння (2.59).
Зв'язок між поверхневим натягом та адсорбцією можна простежити в рівнянні Фрумкіна (*) :
 , (2.61)
, (2.61)
з якого випливає, що при однаковій адсорбції всі гомологи зменшують поверхневий натяг на ту саму величину ∆σ.
Відмінність поверхневої активності в гомологічному ряду ПАР зумовлена різною особливістю їхньої адсорбції, тобто. одне і те ж значення Г досягається для коротколанцюгових ПАР при значно більших С, ніж для довголанцюгових ПАР. Але якщо концентрації у гомологів такі, що й адсорбції однакові, всі вони знижують σ на одну й ту саму величину.
Експериментальне визначення геометричних розмірів молекули пав
Покажемо, що знаючи значення ємності моношару, можна розрахувати S o- площа, яку займає полярна група та δ - Довжину вуглеводневого радикалу молекули ПАР. Розраховані дані можна порівняти із незалежно визначеними іншими методами.
 ,
,
Площа, яку займає полярна група  (2.62)
(2.62)
Об'єм, який займає одна молекула V 1 = δ S o (2.63)
Молярну масу моношару можна визначити за формулою:
М=ρ δS o N a , (2.64)
де ρ - щільність ПАР, Na - число Авогадро (*) . А оскільки
S o *N a =1/Г ∞, то довжина вуглеводневого радикалу може бути визначена виходячи з рівняння:
 . (2.65)
. (2.65)
Численні експериментальні перевірки отриманого рівняння показали гарну згоду значень δ, обчислених за наведеним рівнянням та виміряними іншими методами.
Особливості будови поверхневого шару фази.
Проміжна фаза, що містить один або декілька молекулярних шарів
особливості:
– Усередині об'єму чистої речовини всі сили міжмолекулярної взаємодії врівноважені
– Рівнодіюча всіх сил, що впливають на поверхневі молекули, спрямована всередину рідини
– Поверхневі явища незначні, якщо співвідношення між масою тіла та поверхнею на користь маси тіла
– Поверхневі явища набувають значення, коли речовина знаходиться у роздробленому стані або у вигляді тонкого шару (плівки)
1 см 3 стрілка 10 -7 S = 6 000 м 2
1мм крові стрілка 4 – 5 млн еритроцитів; 1л стрілка > 30 мл клітин, S = 1000 м 2
S альвеол = 800 -1000 м 2; S капілярів печінки = 600 м 2
Поверхнева енергія Гіббса
σ– поверхневий натяг
Зменшення енергії Гіббса:
За рахунок зменшення площі поверхні (укрупнення частинок)
За рахунок зменшення величини поверхневого натягу (сорбція)
403)поверхневий натяг
Робота, що здійснюється на створення одиниці поверхні
Одиниці виміру Дж/м 2
Сила, що діє на одиницю довжини лінії, що обмежує поверхню рідини та спрямовану у бік зменшення цієї поверхні
Одиниці виміру Н/м 2
Залежність поверхневого натягу від природи речовин, температури та тиску.
Поверхневий натяг рідин зменшується зі зростанням температури та поблизу критичної температури стає рівним нулю. Зі збільшенням тиску поверхневе натяг на межі рідина-газ зменшується, тому що зростає концентрація молекул у газовій фазі і сила зменшується. Розчинені в-ва можуть підвищувати, знижувати і впливати на практичне натяг рідин. Поверхневий натяг на межі жид-жид залежить від природи сприк фаз. Воно тим більше, що менше сили молекулярної взаємодії між різнорідними молекулами.
Способи виміру поверхневого натягу рідини.
Метод відриву кільця від поверхні рідини
Метод підрахунку числа крапель певного обсягу досліджуваної рідини, що з капіляра (сталагмометричний)
Метод визначення тиску, який потрібний для відриву бульбашки повітря від капіляра, зануреного в рідину (метод Ребіндера)
Метод виміру висоти підняття рідини в капілярі, стінки якого добре нею змочуються.
Розподіл розчиненої речовини між поверхневим шаром та об'ємом фази.
теоретично можна уявити три випадки розподілу розчиненого в-ва між поверхневим шаром і об'ємом фази:1) кінець розчиненого в-ва в повному шарі більше, ніж в об'ємі фази.2) кінець розчиненого в-ва в повному шарі менше, ніж в обсязі фаз.3) конц розчиненого в-ва в повному шарі така ж як в об'ємі фаз.
Класифікація розчинених речовин щодо їх впливу на поверхневий натяг рідини (води).
классификация.1) розчинене в-в зниж ків натяж р-ля. Спирти, к-ти.2) розчинене в-во трохи підвищує пов натр -ля. Неорг к-ти, основи, солі.3) розчинене в-во практично не ізм пов нат р -ля. Сахароза.
Рівняння Гіббса для характеристики адсорбції розчинених речовин. Аналіз рівняння.
Г=-(C/RT)*(∆σ/∆C). Г-величина адсорбції на пов-ти р-ну. ∆σ/∆C-пов активність в-ва.Аналіз: ∆σ/∆C=0,Г=0. Це ПНВ. ∆σ/∆C>0, Г<0-поверхностно инактивные в-ва. ∆σ/∆C<0, Г>0-ПАВ.
Будова молекул та властивості поверхнево-активних речовин.
св-ва: Обмежено розчинні
Мають менший поверхневий натяг, ніж рідини
Різко змінюють поверхневі властивості рідини
Будова: Дифільна – різні ділянки молекули характеризуються різним ставленням до розчинника
Гідрофобні властивості: вуглеводневий радикал
Гідрофільні властивості: OH, NH 2 , SO 3 H
Класифікація поверхнево-активних речовин, приклади.
Молекулярні чи неіоногенні – спирти, жовч, білкові речовини
Іоногенні аніонактивні – мила, сульфокислоти та їх солі, карбонові кислоти
Іоногенні катіонактивні – органічні азотовмісні основи та їх солі
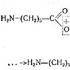
Вплив природи ПАР на їхню поверхневу активність. Правило Дюкло – Траубе.
Подовження ланцюга на радикал - CH 2 - збільшує здатність жирних кислот до адсорбції у 3,2 рази
Застосовується лише розбавлених розчинів й у температур, близьких до кімнатної, т.к. з підвищенням температури збільшується десорбція
Наявність гідрофільної та олеофільної (гідрофобної) частин у молекул ПАР є характерною відмінністю їх будови. За здатністю до дисоціації у водних розчинах поверхнево-активні речовини ділять на іоногенніі неіоногенні.У свою чергу іоногенні ПАР поділяють на аніонні, катіонні та амфолітні (амфотерні).
Аніонні ПАРдисоціюють у воді з утворенням поверхнево-активного аніону. До ПАР цього типу, що становить більшу частину світового виробництва всіх поверхнево-активних речовин, відносяться:
а) карбонові кислоти та їх солі (мила) загальної формули RCOOM (де М – одновалентний метал), наприклад, пальмітат натрію C 15 H 31 COONa, стеарат натрію C 17 H 35 COONa, олеат натрію C 17 H 33 COONa;
б) алкілсульфати ROSO 2 OM;
в) алкіларилсульфонати RArSO 2 OM;
г) речовини, що містять інші типи поверхнево-активних аніонів, наприклад, фосфати, тіосульфати і т.д.
У кислих середовищах солі карбонових кислот переходять у слабодисоційовані та малорозчинні кислоти, а в присутності деяких катіонів (кальцію, магнію) утворюють нерозчинні солі, що різко знижує ефективність їх дії як ПАР, особливо погіршує їх миючу дію. Величезними перевагами у цьому відношенні мають алкілсульфати та алкілсульфонати, які є солями сильних кислот і тому можуть бути використані в кислих та сольових розчинах.
Катіонні ПАРдисоціюють у воді з утворенням поверхнево-активного катіону. До катіонних ПАР відносяться:
а) солі первинних, вторинних та третинних аліфатичних та ароматичних амінів;
б) солі алкілзаміщених амонієвих основ тощо.
Катіонні ПАР - найбільш токсичні і найменш біологічно розкладаються з усіх ПАР; їх часто використовують як бактерицидні, фунгіцидні, дезінфікуючі речовини, інгібітори корозії.
Амфолітні ПАРмістять дві функціональні групи, одна з яких має кислий, а інша основний характер, наприклад карбоксильну та амінну групи. Залежно від рН середовища амфолітні ПАР виявляють аніонактивні або катіонактивні властивості:
Неіоногенні ПАРне дисоціюють у розчинах на іони. Методи їх отримання ґрунтуються на реакції приєднання етиленоксиду до спиртів, карбонових кислот, амінів та інших сполук. Наприклад, оксиетильовані алкілспирти марки «ОС» синтезують за реакцією:
ROH + nH 2 C-CH 2 ® RO(CH 2 CH 2 O) n H
Поліоксіетиленова ланцюг визначає гідрофільні властивості неіоногенних ПАР. Змінюючи довжину поліоксиетиленового ланцюга, легко регулювати їх колоїдно-хімічні властивості. Ці ПАР застосовують у будь-яких середовищах (кислої і лужної), і навіть у присутності розчинних солей. Поліоксиетиленові ефіри алкілфенолів марки ВП мають хороші миючі властивості.
До недоліків цих ПАР належить повільне розкладання через наявність у складі ароматичного радикала і, як наслідок, накопичення в об'єктах довкілля. Неіоногенні ПАР з алкільними радикалами здатні біологічно розкладатися досить повно та швидко.
Всі дифільні поверхнево-активні речовини щодо поведінки їх у воді ділять на істинно розчинні та колоїдні.
До першої групи відноситься великий клас розчинних у воді дифільних органічних сполук з невеликим вуглеводневим радикалом, наприклад, нижчі спирти, феноли, кислоти та їх солі, аміни. Речовини цього у розчині перебувають у молекулярно-дисперсном стані до концентрацій, відповідних їх насиченим розчинам і поділу системи дві суцільні фази. Ці речовини застосовуються як змочувачі спінювачів, гідрофобізаторів при флотації, диспергаторів, що полегшують процеси утворення нових поверхонь, і т.д.
Особливий інтерес становлять колоїдні поверхнево-активні речовини. Саме вони насамперед розуміються під терміном ПАР. Головною відмінністю цих речовин є здатність утворювати термодинамічно стійкі (ліофільні) гетерогенні дисперсні системи (асоціативні або міцелярні колоїди). До основних властивостей колоїдних ПАР, що зумовлюють їх широке застосування, належать висока поверхнева активність; здатність до мимовільного міцелоутворення – утворення ліофільних колоїдних розчинів при концентрації ПАР вище певного певного значення, званого критичною концентрацією міцелоутворення(ККМ); здатність до солюбилізації – різкого збільшення розчинності речовин у розчинах колоїдних ПАР внаслідок їхнього «впровадження» всередину міцели; висока здатність стабілізувати різноманітні дисперсні системи.
Поверхнева активність колоїдних ПАР залежить, головним чином, від довжини вуглеводневого радикалу. Збільшення довжини радикала однією групу -СН 2 - призводить до зростання поверхневої активності приблизно 3,2 разу ( правило Дюкло – Траубе). Це правило дотримується в основному для істинно розчинних ПАР.
Для органічних середовищ правило Дюкло - Траубе звертається: поверхнева активність знижується зі збільшенням довжини вуглеводневого радикалу ПАР.
На закінчення можна відзначити, що основною кількісною характеристикою ПАР є поверхнева активність, яка визначає їх здатність знижувати поверхневий натяг, викликати емульгування, піноутворення, диспергування та стабілізацію, змочування та інші явища.