Степен на окисление на железен оксид. Желязо
Съединения на желязо(II).
Съединенията на желязото със степен на окисление желязо +2 са нестабилни и лесно се окисляват до производни на желязо (III).
Fe 2 O 3 + CO = 2FeO + CO 2.
Железен (II) хидроксид Fe(OH) 2когато е прясно утаен, има сивкаво-зелен цвят, не се разтваря във вода, разлага се при температури над 150 ° C и бързо потъмнява поради окисление:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3.
Проявява леки амфотерни свойства с преобладаване на основни и лесно реагира с неокисляващи киселини:
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O.
Реагира с концентрирани алкални разтвори при нагряване, за да образува тетрахидроксоферат (II):
Fe(OH) 2 + 2NaOH = Na 2.
Проявява редуциращи свойства; при взаимодействие с азотна или концентрирана сярна киселина се образуват железни (III) соли:
2Fe(OH) 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 6H 2 O.
Получава се чрез взаимодействие на железни (II) соли с алкален разтвор в отсъствие на атмосферен кислород:
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4.
Желязни (II) соли.Желязото (II) образува соли с почти всички аниони. Обикновено солите кристализират под формата на зелени кристални хидрати: Fe (NO 3) 2 6H 2 O, FeSO 4 7H 2 O, FeBr 2 6H 2 O, (NH 4) 2 Fe (SO 4) 2 6H 2 O (сол Мора) и др. Солните разтвори имат бледозелен цвят и поради хидролизата имат кисела среда:
Fe 2+ + H 2 O = FeOH + + H +.
Те проявяват всички свойства на солите.
Когато стоят на въздух, те бавно се окисляват от разтворен кислород до железни (III) соли:
4FeCl 2 + O 2 + 2H 2 O = 4FeOHCl 2.
Качествена реакция на Fe 2+ катион - взаимодействие с калиев хексацианоферат (III) (червена кръвна сол):
FeSO 4 + K 3 = KFe↓ + K 2 SO 4
Fe 2+ + K + + 3- = KFe↓
В резултат на реакцията се образува синя утайка - желязо (III) - калиев хексацианоферат (II).
Степента на окисление +3 е характерна за желязото.
Железен (III) оксид Fe 2 O 3 -Веществото е кафяво на цвят и съществува в три полиморфни модификации.
Проявява леки амфотерни свойства с преобладаване на основни. Лесно реагира с киселини:
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O.
Не реагира с алкални разтвори, но при топене образува ферити:
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O.
Проявява окислителни и редуциращи свойства. При нагряване се редуцира от водород или въглероден оксид (II), проявявайки окислителни свойства:
Fe 2 O 3 + H 2 = 2FeO + H 2 O,
Fe 2 O 3 + CO = 2FeO + CO 2.
В присъствието на силни окислители в алкална среда проявява редуциращи свойства и се окислява до производни на желязо (VI):
Fe 2 O 3 + 3KNO 3 + 4KOH = 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
При температури над 1400°C се разлага:
6Fe 2 O 3 = 4Fe 3 O 4 + O 2.
Получава се чрез термично разлагане на железен (III) хидроксид:
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
или окисляване на пирит:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl,
Цели на урока:
- Запознайте учениците с елемента от вторичната група на периодичната таблица - желязото, неговата структура, свойства.
- Познайте местоположението на желязото в природата, методите за получаването му, приложение, физични свойства.
- Да може да характеризира желязото като елемент от вторична подгрупа.
- Да може да докаже химичните свойства на желязото и неговите съединения, да напише реакционни уравнения в молекулярна, йонна, редокс форма.
- Да се развият уменията на учениците за съставяне на уравнения на реакции с участието на желязо, да се формират знанията на учениците за качествени реакции към железни йони.
- Култивирайте интерес към темата.
Оборудване:желязо (прах, карфица, плоча), сяра, кислородна колба, солна киселина, железен (II) сулфат, железен (III) хлорид, натриев хидроксид, червени и жълти кръвни соли.
ПО ВРЕМЕ НА ЗАНЯТИЯТА
I. Организационен момент
II. Проверка на домашните
III. Учене на нов материал
1. Въведение на учителя.
– Значението на желязото в живота, ролята му в историята на цивилизацията. Един от най-често срещаните метали в земната кора е желязото. Започва да се използва много по-късно от други метали (мед, злато, цинк, олово, калай), което най-вероятно се дължи на ниското сходство на желязната руда с метала. За примитивните хора беше много трудно да разберат, че от руда може да се получи метал, който може успешно да се използва в производството на различни предмети; това се дължи на липсата на инструменти и необходимите устройства за организиране на такъв процес. Мина доста време, преди човекът да се научи да извлича желязо от руда и да прави стомана и чугун от него.
В момента железните руди са необходима суровина за черната металургия, онези минерали, без които нито една развита индустриална страна не може. Годишното световно производство на желязна руда е приблизително 350 000 000 тона. Те се използват за топене на желязо (съдържание на въглерод 0,2-0,4%), чугун (2,5-4% въглерод), стомана (2,5-1,5% въглерод).Стоманата има най-широко приложение в промишлеността от желязото и чугуна, което е защо има по-голямо търсене на топенето му.
За топене на чугун от желязна руда се използват доменни пещи, работещи с въглища или кокс; стоманата и желязото се топят от чугун в реверберационни пещи с открита пещ, конвертори на Бесемер или метода на Томас.
Черните метали и техните сплави са от голямо значение за живота и развитието на човешкото общество. От желязо се изработват всякакви предмети за бита и потреблението. Стотици милиони тонове стомана и чугун се използват за изграждането на кораби, самолети, железопътен транспорт, автомобили, мостове, железопътни линии, различни сгради, оборудване и други неща. Няма отрасъл на селското стопанство и индустрията, в който да не се използват желязото и различните му сплави.
Малкото минерали, които обикновено се срещат в природата и съдържат желязо, са желязната руда. Такива минерали включват: кафява желязна руда, хематит, магнетит и други, които образуват големи находища и заемат огромни площи.
Химическата връзка на магнетита или магнитната желязна руда, която има желязо-черен цвят и уникално свойство - магнетизъм, е съединение, състоящо се от железен оксид и железен оксид. В естествената среда може да се намери както под формата на зърнести или твърди маси, така и под формата на добре оформени кристали. Желязната руда е най-богата на съдържанието на метално желязо магнетит (до 72%).
Най-големите находища на магнетитни руди в нашата страна се намират в Урал, в планините Висока, Благодат, Магнитна, в някои райони на Сибир - басейна на река Ангара, планинска Шория, на територията на Колския полуостров.
2. Работа с класа. Характеристики на желязото като химичен елемент
а) Позиция в периодичната таблица:
Упражнение 1.Определете позицията на желязото в периодичната таблица?
Отговор:Желязото се намира в 4-ти голям период, четен ред, 8-ма група, второстепенна група.
б) структура на атома:
Задача 2.Начертайте състава и структурата на железния атом, електронна формула и клетки.
Отговор: Fe +3 2) 8) 14) 2) метал
p = 26
e = 26
n = (56 – 26) = 301s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Въпрос.Върху кои слоеве желязо са разположени валентните електрони? Защо?
Отговор.Валентните електрони са разположени на последния и предпоследния слой, тъй като това е елемент от вторичната подгрупа.
Желязото се класифицира като d-елемент, част е от триадата елементи – метали (Fe-Co-Ni);
в) редокс свойства на желязото:
Въпрос.Какво е желязото - окислител или редуктор? Какви степени на окисление и валентност проявява?
Отговор:
Fe 0 – 2e = Fe +3) редуциращ агент
Fe 0 – 3e = Fe +3
с.о.+ 2,+ 3; валентност = II и III, валентност 7 – не се показва;
г) железни съединения:
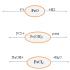
FeO – основен оксид
Fe(OH) 2 – неразтворима основа
Fe 2 O 3 – оксид с признаци на амфотерност
Fe(OH) 3 – основа с признаци на амфотерност
Летливите водородни съединения не са.
г) пребиваване сред природата.
Желязото е вторият най-разпространен метал в природата (след алуминия).В свободно състояние желязото се среща само в метеоритите.Най-важните природни съединения:
FeO*3HO – кафява желязна руда,
FeO – червена желязна руда,
FeO (FeO*FeO) – магнитна желязна руда,
FeS – железен пирит (пирит)
Съединенията на желязото се намират в живите организми.
3. Характеристика на простото вещество желязо
а) молекулярна структура, тип връзка, тип кристална решетка; (независимо)
б) физични свойства на желязото
Желязото е сребристосив метал, който има голяма ковкост, пластичност и силни магнитни свойства. Плътността на желязото е 7,87 g / cm 3, точката на топене е 1539 t o C.
в) химични свойства на желязото:
Атомите на желязото отдават електрони в реакциите и проявяват степени на окисление + 2, + 3 и понякога + 6.
В реакциите желязото е редуциращ агент. Но при обикновени температури той не взаимодейства дори с най-активните окислители (халогени, кислород, сяра), но при нагряване става активен и реагира с тях:
2Fe +3Cl 2 = 2FeCl 3 Железен(III) хлорид
3Fe + 2O 2 = Fe 2 O 3 (FeO*Fe O) Железен(III) оксид
Fe +S = FeS Железен(II) сулфид
При много високи температури желязото реагира с въглерод, силиций и фосфор.
3Fe + C = Fe 3 C Железен карбид (цементит)
3Fe + Si = Fe 3 Si Железен силицид
3Fe + 2P = Fe 3 P 2 Железен фосфид
Желязото реагира със сложни вещества.
Във влажен въздух желязото бързо се подкислява (корозира):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3
Fe(OH) 3 ––> FeOOH + H 2 O
Ръжда
Желязото е в средата на електрохимичните напрежения от метали, следователно е метал средна активност.Редукционната способност на желязото е по-малка от тази на алкалните, алкалоземните метали и алуминия. Само при високи температури горещото желязо реагира с вода:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2
Желязото реагира с разредена сярна и солна киселина, като измества водорода от тях:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
Fe 0 + 2H + = Fe 2+ + H 2 0
При обикновени температури желязото не взаимодейства с концентрирана сярна киселина, тъй като се пасивира от нея.При нагряване концентрираната сярна киселина окислява желязото до железен (III) сулфат:
2Fe + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Разредената азотна киселина окислява желязото до железен (III) нитрат:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
Концентрираната азотна киселина пасивира желязото.
От солните разтвори желязото измества металите, които са разположени вдясно от него в електрохимичната серия на напрежение:
Fe + CuSO 4 = FeSO 4 + Cu,
г) използване на желязо (самостоятелно)
д) получаване (заедно с ученици)
В промишлеността желязото се получава чрез редуцирането му от железни руди с въглерод (кокс) и въглероден оксид (II) в доменни пещи.
Химическият процес на доменната пещ е както следва:
C + O = CO
CO + C = 2CO
3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
Fe 3 O 4 + CO = 3FeO + CO 2
FeO + CO = Fe + CO 2
4. Съединения на желязото
Химични свойства на тези съединения.

Допълнение.Съединенията на желязото (II) са нестабилни, те могат да се окислят и да се превърнат в съединения на желязото (III).
Fe +2 Cl 2 + Cl 2 = Fe +3 Cl 3 образува редокс сграда
Fe +2 (OH) + H 2 O + O 2 = Fe +3 (OH) 3 схеми, изравнете.

Химични свойства на тези съединения

Също така, качествена реакция към Fe +2 е реакцията на железни (II) соли с вещество, наречено червена кръвна сол K3 - това е сложно съединение.
3FeCl + 2K 3 = Fe 3.
Желязото се кове перфектно, както при нормални, така и при повишени температури. Могат да се леят чугун и стомана. Едно вещество не може да се нарече биологично инертно. Въпреки това, неговата токсичност е много ниска. Това обаче е свързано не толкова с активността на елемента, колкото с неспособността на човешкото тяло да го усвои добре: максимумът е 20% от приетата доза. Желязото не може да се класифицира като екологично вещество. Основната вреда за околната среда обаче не се причинява от нейните отпадъци, тъй като желязото ръждясва доста бързо, а от производствените отпадъци - шлака и отделени газове.
производство
Желязото е много често срещан елемент, така че не изисква големи разходи. Депозитите се разработват както по открити, така и по мини методи. Всъщност всички минни руди съдържат желязо, но се разработват само тези, в които делът на метала е достатъчно голям. Това са богати руди - червено, магнитно и кафяво желязо със съдържание на желязо до 74%, руди със средно съдържание - марказит, например, и нискокачествени руди с съдържание на желязо най-малко 26% - сидерит.
Богатата руда веднага се изпраща в завода. Обогатяват се скали със средно и ниско съдържание.
Има няколко метода за производство на железни сплави. Като правило, топенето на всяка стомана включва производството на чугун. Топи се в доменна пещ при температура 1600 С. Шихтът - агломерат, пелети, се зарежда заедно с флюса в пещта и се обдухва с горещ въздух. В този случай металът се топи и коксът изгаря, което ви позволява да изгорите нежеланите примеси и да отделите шлаката.
За производството на стомана обикновено се използва бял чугун - в него въглеродът е свързан в химично съединение с желязото. Най-често срещаните 3 метода:
- открито огнище - разтопен чугун с добавяне на руда и скрап се топи при 2000 C, за да се намали съдържанието на въглерод. Допълнителни съставки, ако има такива, се добавят в края на топенето. По този начин се получава най-висококачествената стомана.
- кислородният конвертор е по-продуктивен метод. В пещта дебелината на чугуна се продухва с въздух под налягане 26 кг/кв. виж Смес от кислород и въздух или чист кислород може да се използва за подобряване на свойствата на стоманата;
- електрическо топене - по-често се използва за производство на специални легирани стомани. Чугунът се изпича в електрическа пещ при температура 2200 С.
Стоманата може да се получи и по директен метод. За да направите това, пелети с високо съдържание на желязо се зареждат в шахтова пещ и се продухват с водород при температура 1000 C. Последният редуцира желязото от оксида без междинни етапи.
Поради спецификата на черната металургия се продават или руди с определено съдържание на желязо, или готови продукти - чугун, стомана, ферит. Цените им варират значително. Средната цена на желязната руда през 2016 г. – богата, със съдържание на елементи над 60% – е 50 долара за тон.
Цената на стоманата зависи от много фактори, което понякога прави покачванията и спадовете на цените напълно непредвидими. През есента на 2016 г. разходите за фитинги и горещо и студено валцована стомана рязко се увеличиха поради също толкова рязкото покачване на цените на коксуващите се въглища, незаменим участник в топенето. През ноември европейските компании предлагат горещовалцувани стоманени рулони по 500 евро за тон.
Област на приложение
Обхватът на използване на желязото и железните сплави е огромен. По-лесно е да се посочи къде не се използва метал.
- Строителство - изграждането на всички видове рамки, от носещата рамка на мост до рамката на декоративна камина в апартамент, не може без стомана от различни степени. Фитинги, пръти, I-греди, канали, ъгли, тръби: в строителството се използват абсолютно всички фасонни и секционни продукти. Същото важи и за ламарината: от нея се прави покрив и т.н.
- Машиностроене - по отношение на здравина и устойчивост на износване има много малко, което може да се сравни със стоманата, така че частите на тялото на по-голямата част от машините са направени от стомана. Особено в случаите, когато оборудването трябва да работи при условия на високи температури и налягане.
- Инструменти – с помощта на легиращи елементи и закаляване на метала може да се придаде твърдост и здравина, близки до диамантите. Бързорежещите стомани са в основата на всички инструменти за обработка.
- В електротехниката използването на желязото е по-ограничено, именно защото примесите значително влошават електрическите му свойства, които и без това са ниски. Но металът е незаменим при производството на магнитни части на електрическо оборудване.
- Тръбопровод - от стомана и чугун са направени комуникации от всякакъв вид и тип: отоплителни, водоснабдителни системи, газопроводи, включително главни линии, обвивки за захранващи кабели, нефтопроводи и др. Само стоманата може да издържи на такива огромни натоварвания и вътрешно налягане.
- Използване в домакинството – стоманата се използва навсякъде: от обков и прибори за хранене до железни врати и брави. Здравината на метала и устойчивостта на износване го правят незаменим.
Желязото и неговите сплави съчетават здравина, издръжливост и устойчивост на износване. Освен това металът е сравнително евтин за производство, което го прави незаменим материал за съвременната национална икономика.
Това видео ще ви разкаже за железните сплави с цветни и тежки черни метали:
Човешкото тяло съдържа около 5 g желязо, по-голямата част (70%) е част от кръвния хемоглобин.
Физични свойства
В свободно състояние желязото е сребристо-бял метал със сивкав оттенък. Чистото желязо е пластично и има феромагнитни свойства. В практиката обикновено се използват железни сплави - чугун и стомана.
Fe е най-важният и най-разпространеният елемент от деветте d-метала от подгрупа VIII. Заедно с кобалта и никела образува „желязното семейство“.
Когато образува съединения с други елементи, често използва 2 или 3 електрона (B = II, III).
Желязото, както почти всички d-елементи от група VIII, не проявява по-висока валентност, равна на номера на групата. Максималната му валентност достига VI и се появява изключително рядко.
Най-типичните съединения са тези, в които Fe атомите са в степен на окисление +2 и +3.
Методи за получаване на желязо
1. Техническото желязо (легирано с въглерод и други примеси) се получава чрез карботермична редукция на естествените му съединения по следната схема:
Възстановяването става постепенно, на 3 етапа:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3FeO + CO 2
3) FeO + CO = Fe + CO 2
Чугунът, получен в резултат на този процес, съдържа повече от 2% въглерод. Впоследствие чугунът се използва за производството на стомана - железни сплави, съдържащи по-малко от 1,5% въглерод.
2. Много чисто желязо се получава по един от следните начини:
а) разлагане на Fe пентакарбонил
Fe(CO) 5 = Fe + 5СО
б) редукция на чист FeO с водород
FeO + H 2 = Fe + H 2 O
в) електролиза на водни разтвори на Fe +2 соли
FeC 2 O 4 = Fe + 2CO 2
железен (II) оксалат
Химични свойства
Fe е метал със средна активност и проявява общи свойства, характерни за металите.
Уникална характеристика е способността да "ръждясва" във влажен въздух:
При липса на влага със сух въздух желязото започва да реагира забележимо само при T> 150 ° C; при калциниране се образува "желязна скала" Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
Желязото не се разтваря във вода при липса на кислород. При много високи температури Fe реагира с водна пара, измествайки водорода от водните молекули:
3 Fe + 4H 2 O(g) = 4H 2
Механизмът на ръждясване е електрохимична корозия. Продуктът от ръжда е представен в опростена форма. Всъщност се образува хлабав слой от смес от оксиди и хидроксиди с променлив състав. За разлика от филма Al 2 O 3, този слой не предпазва желязото от по-нататъшно разрушаване.
Видове корозия
Защита на желязото от корозия
1. Взаимодействие с халогени и сяра при високи температури.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 = FeI 2
Образуват се съединения, в които преобладава йонният тип връзка.
2. Взаимодействие с фосфор, въглерод, силиций (желязото не се свързва директно с N2 и H2, но ги разтваря).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = Fe x Si y
Образуват се вещества с променлив състав, като бертолиди (ковалентният характер на връзката преобладава в съединенията)
3. Взаимодействие с "неокисляващи" киселини (HCl, H 2 SO 4 dil.)
Fe 0 + 2H + → Fe 2+ + H 2
Тъй като Fe се намира в серията активност вляво от водорода (E° Fe/Fe 2+ = -0,44 V), той е в състояние да измести H 2 от обикновените киселини.
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
4. Взаимодействие с "окисляващи" киселини (HNO 3, H 2 SO 4 конц.)
Fe 0 - 3e - → Fe 3+
Концентрираните HNO 3 и H 2 SO 4 "пасивират" желязото, така че при обикновени температури металът не се разтваря в тях. При силно нагряване настъпва бавно разтваряне (без освобождаване на Н2).
В секцията HNO 3 желязото се разтваря, преминава в разтвор под формата на Fe 3+ катиони и киселинният анион се редуцира до NO*:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
Много разтворим в смес от HCl и HNO3
5. Отношение към алкали
Fe не се разтваря във водни разтвори на алкали. Той реагира с разтопени алкали само при много високи температури.
6. Взаимодействие със соли на по-малко активни метали
Fe + CuSO 4 = FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Реакция с газообразен въглероден оксид (t = 200°C, P)
Fe (прах) + 5CO (g) = Fe 0 (CO) 5 желязо пентакарбонил
Fe(III) съединения
Fe 2 O 3 - железен (III) оксид.
Червено-кафяв прах, n. Р. в H 2 O. В природата - "червена желязна руда".
Методи за получаване:
1) разлагане на железен (III) хидроксид
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
2) изпичане на пирит
4FeS 2 + 11O 2 = 8SO 2 + 2Fe 2 O 3
3) разлагане на нитрати
Химични свойства
Fe 2 O 3 е основен оксид с признаци на амфотерност.
I. Основните свойства се проявяват в способността да реагират с киселини:
Fe 2 O 3 + 6H + = 2Fe 3+ + ZN 2 O
Fe 2 O 3 + 6HCI = 2FeCI 3 + 3H 2 O
Fe 2 O 3 + 6HNO 3 = 2Fe(NO 3) 3 + 3H 2 O
II. Слаби киселинни свойства. Fe 2 O 3 не се разтваря във водни разтвори на алкали, но когато се слее с твърди оксиди, алкали и карбонати, се образуват ферити:
Fe 2 O 3 + CaO = Ca(FeO 2) 2
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 = Mg(FeO 2) 2 + CO 2
III. Fe 2 O 3 - суровина за производство на желязо в металургията:
Fe 2 O 3 + ZS = 2Fe + ZSO или Fe 2 O 3 + ZSO = 2Fe + ZSO 2
Fe(OH) 3 - железен (III) хидроксид
Методи за получаване:
Получава се чрез действието на алкали върху разтворими Fe 3+ соли:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
По време на приготвянето Fe (OH) 3 е червено-кафява слузесто-аморфна утайка.
Fe (III) хидроксид също се образува по време на окисляването на Fe и Fe (OH) 2 във влажен въздух:
4Fe + 6H 2 O + 3O 2 = 4Fe(OH) 3
4Fe(OH) 2 + 2H 2 O + O 2 = 4Fe(OH) 3
Fe(III) хидроксид е крайният продукт от хидролизата на Fe 3+ соли.
Химични свойства
Fe(OH)3 е много слаба основа (много по-слаба от Fe(OH)2). Показва забележими киселинни свойства. По този начин Fe (OH) 3 има амфотерен характер:
1) реакциите с киселини протичат лесно:
2) прясна утайка от Fe(OH) 3 се разтваря в горещ конц. разтвори на KOH или NaOH с образуването на хидроксокомплекси:
Fe(OH) 3 + 3KOH = K 3
В алкален разтвор Fe (OH) 3 може да се окисли до ферати (соли на желязна киселина H 2 FeO 4, които не се освобождават в свободно състояние):
2Fe(OH) 3 + 10KOH + 3Br 2 = 2K 2 FeO 4 + 6KBr + 8H 2 O
Fe 3+ соли
Най-важните практически са: Fe 2 (SO 4) 3, FeCl 3, Fe (NO 3) 3, Fe (SCN) 3, K 3 4 - жълта кръвна сол = Fe 4 3 Пруско синьо (тъмно синя утайка)
б) Fe 3+ + 3SCN - = Fe(SCN) 3 тиоцианат Fe(III) (кървавочервен разтвор)