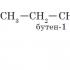انواع واکنش های شیمیایی در نمونه های شیمی معدنی. طبقه بندی واکنش های شیمیایی
طبقه بندی واکنش های شیمیایی در شیمی معدنی و آلی
واکنشهای شیمیایی یا پدیدههای شیمیایی، فرآیندهایی هستند که در نتیجه برخی از مواد، مواد دیگری تشکیل میشوند که از نظر ترکیب و (یا) ساختار با آنها متفاوت هستند.
در طی واکنش های شیمیایی، لزوماً تغییر در مواد رخ می دهد که در آن پیوندهای قدیمی شکسته می شوند و پیوندهای جدیدی بین اتم ها ایجاد می شود.
واکنش های شیمیایی باید از واکنش های هسته ایدر نتیجه یک واکنش شیمیایی، تعداد کل اتم های هر عنصر شیمیایی و ترکیب ایزوتوپی آن تغییر نمی کند. واکنش های هسته ای یک ماده متفاوت است - فرآیندهای تحول هسته های اتمی در نتیجه تعامل آنها با سایر هسته ها یا ذرات ابتدایی ، به عنوان مثال ، تبدیل آلومینیوم به منیزیم:
$↙(13)↖(27)(Al)+ ()↙(1)↖(1)(H)=()↙(12)↖(24)(Mg)+()↙(2)↖(4 )(او)$
طبقه بندی واکنش های شیمیایی چند وجهی است، به عنوان مثال. می تواند بر اساس ویژگی های مختلف باشد. اما هر یک از این ویژگی ها می تواند شامل واکنش بین مواد معدنی و آلی باشد.
بیایید طبقه بندی واکنش های شیمیایی را با توجه به معیارهای مختلف در نظر بگیریم.
طبقه بندی واکنش های شیمیایی بر اساس تعداد و ترکیب واکنش دهنده ها. واکنش هایی که بدون تغییر در ترکیب ماده رخ می دهد
در شیمی معدنی، چنین واکنش هایی شامل فرآیندهای به دست آوردن تغییرات آلوتروپیک یک عنصر شیمیایی است، به عنوان مثال:
$С_((گرافیت))⇄С_((الماس))$
$S_((لوزی))⇄S_((مونوکلینیک))$
$Р_((سفید))⇄Р_((قرمز))$
$Sn_((قلع سفید))⇄Sn_((قلع خاکستری))$
$3О_(2(اکسیژن))⇄2О_(3(ازون))$.
در شیمی آلی ، این نوع واکنش می تواند شامل واکنش های ایزومریزاسیون باشد ، که بدون تغییر نه تنها کیفی ، بلکه ترکیب کمی مولکول های مواد نیز به عنوان مثال رخ می دهد: به عنوان مثال:
1. ایزومریزاسیون آلکان ها.
واکنش ایزومریزاسیون آلکان ها اهمیت عملی زیادی دارد، زیرا هیدروکربن های همساختار توانایی کمتری برای انفجار دارند.
2. ایزومریزاسیون آلکن ها.

3. ایزومریزاسیون آلکین(واکنش A.E. Favorsky).
4. ایزومریزاسیون هالوآلکان ها(A.E. Favorsky).
5. ایزومریزاسیون سیانات آمونیوم با حرارت دادن

اوره برای اولین بار توسط F. Wöhler در سال 1882 با ایزومریزاسیون سیانات آمونیوم هنگام گرم شدن سنتز شد.
واکنش هایی که با تغییر در ترکیب یک ماده رخ می دهد
چهار نوع از این واکنش ها را می توان تشخیص داد: ترکیب، تجزیه، جایگزینی و تبادل.
1. واکنش های مرکب- اینها واکنش هایی هستند که در آن یک ماده پیچیده از دو یا چند ماده تشکیل می شود.
در شیمی معدنی، کل انواع واکنش های ترکیبی را می توان با استفاده از مثال واکنش های تولید اسید سولفوریک از گوگرد در نظر گرفت:
1) بدست آوردن اکسید گوگرد (IV):
$S+O_2=SO_2$ - یک ماده پیچیده از دو ماده ساده تشکیل می شود.
2) بدست آوردن اکسید گوگرد (VI):
$2SO_2+O_2(⇄)↖(t,p,cat.)2SO_3$ - یک ماده پیچیده از مواد ساده و پیچیده تشکیل می شود.
3) بدست آوردن اسید سولفوریک:
$SO_3+H_2O=H_2SO_4$ - دو ماده پیچیده یک ماده پیچیده را تشکیل میدهند.
نمونه ای از یک واکنش ترکیبی که در آن یک ماده پیچیده از بیش از دو ماده اولیه تشکیل می شود، مرحله نهایی تولید اسید نیتریک است:
$4NO_2+O_2+2H_2O=4HNO_3$.
در شیمی آلی، واکنشهای پیوستن معمولاً واکنشهای افزودن نامیده میشوند. انواع مختلف این واکنش ها را می توان با استفاده از نمونه ای از واکنشهای واکنشی که خصوصیات مواد اشباع نشده را توصیف می کند ، به عنوان مثال اتیلن در نظر گرفته شود:
1) واکنش هیدروژناسیون - افزودن هیدروژن:
$CH_2(=)↙(اتن)CH_2+H_2(→)↖(Ni,t°)CH_3(-)↙(اتان)CH_3;$
2) واکنش هیدراتاسیون - افزودن آب:
$CH_2(=)↙(اتن)CH_2+H_2O(→)↖(H_3PO_4,t°)(C_2H_5OH)↙(اتانول)؛$
3) واکنش پلیمریزاسیون:
$(nCH_2=CH_2)↙(اتیلن)(→)↖(p,cat.,t°)((-CH_2-CH_2-)_n)↙(پلی اتیلن)$
2. واکنش های تجزیه- اینها واکنش هایی هستند که در آن چندین ماده جدید از یک ماده پیچیده تشکیل می شود.
در شیمی معدنی ، کل انواع چنین واکنش هایی را می توان با استفاده از نمونه ای از واکنش های تولید اکسیژن با روش های آزمایشگاهی در نظر گرفت:
1) تجزیه اکسید جیوه (II):
$2HgO(→)↖(t°)2Hg+O_2$ - دو عدد ساده از یک ماده پیچیده تشکیل می شوند.
2) تجزیه نیترات پتاسیم:
$2KNO_3(→)↖(t°)2KNO_2+O_2$ - از یک ماده پیچیده یک ساده و یک پیچیده تشکیل می شود.
3) تجزیه پرمنگنات پتاسیم:
$2KMnO_4(→)↖(t°)K_2MnO_4+MnO_2+O_2$ - از یک ماده پیچیده دو پیچیده و یک ساده تشکیل می شود، یعنی. سه ماده جدید
در شیمی آلی ، واکنشهای تجزیه را می توان با استفاده از نمونه ای از واکنش های تولید اتیلن در آزمایشگاه و صنعت در نظر گرفت:
1) واکنش کم آبی (حذف آب) اتانول:
$C_2H_5OH(→)↖(H_2SO_4,t°)CH_2=CH_2+H_2O;$
2) واکنش هیدروژن زدایی (حذف هیدروژن) اتان:
$CH_3—CH_3(→)↖(Cr_2O_3,500°C)CH_2=CH_2+H_2;$
3) واکنش ترک خوردگی پروپان:
$CH_3-CH_2CH_3(→)↖(t°)CH_2=CH_2+CH_4.$
3. واکنش های جایگزینی- اینها واکنش هایی هستند که در نتیجه آنها اتم های یک ماده ساده جایگزین اتم های یک عنصر در یک ماده پیچیده می شوند.
در شیمی معدنی، نمونهای از این فرآیندها بلوکی از واکنشهایی است که ویژگیها، به عنوان مثال، فلزات را مشخص میکند:
1) تعامل فلزات زمین قلیایی و قلیایی با آب:
$ 2NA+2H_2O = 2NAOH+H_2 $
2) برهمکنش فلزات با اسیدهای موجود در محلول:
$ Zn+2Hcl = Zncl_2+H_2 $ ؛
3) برهمکنش فلزات با نمک در محلول:
$ fe+cuso_4 = feso_4+cu ؛ $
4) متالوترمی:
$2Al+Cr_2O_3(→)↖(t°)Al_2O_3+2Cr$.
موضوع مطالعه شیمی آلی مواد ساده نیست بلکه فقط ترکیبات است. بنابراین، به عنوان نمونه ای از یک واکنش جایگزینی، ما مشخصه ترین ویژگی ترکیبات اشباع، به ویژه متان، توانایی اتم های هیدروژن آن را برای جایگزینی با اتم های هالوژن ارائه می دهیم:
$ ch_4+cl_2 (→) ↖ (hν) (ch_3cl) ↙ (کلرومتان)+hcl $ ،
$ ch_3cl+cl_2 → (ch_2cl_2) ↙ (دیکلرومتان)+hcl $ ،
$ ch_2cl_2+cl_2 → (chcl_3) ↙ (تری کلرومتان)+hcl $ ،
$ CHCL_3+CL_2 → (CCL_4) ↙ (تتراکلرید کربن)+HCl $.
مثال دیگر ، برمناسیون یک ترکیب معطر (بنزن ، تولوئن ، آنیلین) است:
بیایید به ویژگی های واکنش های جایگزینی در مواد آلی توجه کنیم: در نتیجه چنین واکنش هایی، نه یک ماده ساده و پیچیده، مانند شیمی معدنی، بلکه دو ماده پیچیده تشکیل می شود.
در شیمی آلی ، واکنشهای جایگزینی همچنین شامل برخی واکنشهای بین دو ماده پیچیده ، به عنوان مثال ، نیتراسیون بنزن است:
$ C_6H_6+(HNO_3) ↙ (بنزن) (→) ↖ (H_2SO_4 (Conc.) ، T °) (C_6H_5NO_2) ↙ (نیتروبنزن)+H_2O $
این به طور رسمی یک واکنش مبادله ای است. این واقعیت که این یک واکنش جایگزینی است فقط در هنگام بررسی مکانیسم آن روشن می شود.
4. واکنشهای مبادله- این واکنش هایی است که در آن دو ماده پیچیده قطعات تشکیل دهنده آنها را تبادل می کنند.
این واکنش ها خصوصیات الکترولیت ها را مشخص می کند و در راه حل ها طبق قانون برتولت ، یعنی. فقط در صورتی که نتیجه تشکیل ماده رسوب ، گاز یا کمی جدا کننده باشد (به عنوان مثال ، $ H_2O $).
در شیمی معدنی ، این می تواند بلوک واکنش هایی باشد که به عنوان مثال خصوصیات قلیایی را توصیف می کند:
1) واکنش خنثی سازی که با تشکیل نمک و آب رخ می دهد:
$ naOH+hno_3 = nano_3+h_2o $
یا به شکل یونی:
$ OH^(-)+H^(+) = H_2O $ ؛
2) واکنش بین قلیایی و نمک ، که با تشکیل گاز رخ می دهد:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3+2H_2O$
یا به شکل یونی:
$NH_4^(+)+OH^(-)=NH_3+H_2O$;
3) واکنش بین قلیایی و نمک که با تشکیل یک رسوب رخ می دهد:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
یا به شکل یونی:
$Cu^(2+)+2OH^(-)=Cu(OH)_2↓$
در شیمی آلی، میتوانیم بلوکهایی از واکنشها را در نظر بگیریم که برای مثال، ویژگیهای اسید استیک را مشخص میکند:
1) واکنشی که با تشکیل یک الکترولیت ضعیف رخ می دهد - $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
$CH_3COOH+OH^(-)⇄CH_3COO^(-)+H_2O$;
2) واکنشی که با تشکیل گاز رخ می دهد:
$2CH_3COOH+CaCO_3=2CH_3COO^(-)+Ca^(2+)+CO_2+H_2O$;
3) واکنشی که با تشکیل رسوب رخ می دهد:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
$2CH_3COOH+SiO_3^(−)=2CH_3COO^(−)+H_2SiO_3↓$.
طبقه بندی واکنش های شیمیایی بر اساس تغییرات در حالت های اکسیداسیون عناصر شیمیایی تشکیل دهنده مواد
واکنش هایی که با تغییر در حالت اکسیداسیون عناصر یا واکنش های ردوکس رخ می دهد.
اینها شامل بسیاری از واکنشها، از جمله همه واکنشهای جایگزینی، و همچنین آن دسته از واکنشهای ترکیبی و تجزیه میشوند که حداقل یک ماده ساده در آن دخالت دارد، برای مثال:
1.$(Mg)↖(0)+(2H)↖(+1)+SO_4^(-2)=(Mg)↖(+2)SO_4+(H_2)↖(0)$
$((Mg)↖(0)-2(e)↖(-))↙(عامل کاهنده)(→)↖(اکسیداسیون)(Mg)↖(+2)$
$((2H)↖(+1)+2(e)↖(-))↙(اکسیدکننده)(→)↖(کاهش)(H_2)↖(0)$
2.$(2Mg)↖(0)+(O_2)↖(0)=(2Mg)↖(+2)(O)↖(-2)$
$((Mg)↖(0)-2(e)↖(-))↙(عامل کاهنده)(→)↖(اکسیداسیون)(Mg)↖(+2)|4|2$
$((O_2)↖(0)+4(e)↖(-))↙(اکسیدکننده)(→)↖(کاهش)(2O)↖(-2)|2|1$
همانطور که به یاد دارید، واکنش های ردوکس پیچیده با استفاده از روش تعادل الکترونی جمع آوری می شوند:
$(2Fe)↖(0)+6H_2(S)↖(+6)O_(4(k))=(Fe_2)↖(+3)(SO_4)_3+3(S)↖(+4)O_2+ 6H_2O $
$ ((fe) ↖ (0) -3 (e) ↖ (-)) ↙ (عامل کاهش) (→) ↖ (اکسیداسیون) (آهن) ↖ (+3) | 2 $
$ (s) ↖ (+6) +2 (e) ↖ (-)) ↙ (اکسید کننده) (→) ↖ (کاهش) (S) ↖ (+4) | 3 $
در شیمی آلی ، نمونه بارز واکنش های ردوکس خواص آلدهیدها است:
1. آلدهیدها به الکلهای مربوطه کاهش می یابد:
$ (ch_3- (c) ↖ (+1) () ↖ (o↖ (-2)) ↙ (h↖ (+1))+(h_2) ↖ (0))) ↙ (\ متن "استیکالدئید") ( →) ↖ (ni ، t °) (ch_3- (c) ↖ (-1) (h_2) ↖ (1) (o) ↖ (-2) (h) ↖ (+1)) ↙ (\ متن " اتیل الکل") دلار
$ ((ج) ↖ (1) +2 (e) ↖ (-)) ↙ (اکسید کننده) (→) ↖ (کاهش) (ج) ↖ (-1) | 1 $
$ ((H_2) ↖ (0) -2 (E) ↖ (-)) ↙ (عامل کاهش) (→) ↖ (اکسیداسیون) 2 (ح) ↖ (1) | 1 $
2. آلدهیدها در اسیدهای مربوطه اکسیده می شوند:
$ (ch_3- (c) ↖ (+1) () ↖ (o↖ (-2)) ↙ (h↖ (+1))+(ag_2) ↖ (+1) (o) ↖ (-2)) ↙ (\ متن "aceticaldehyde"))) (→) ↖ (t °) (ch_3- (ag) ↖ (0) (c) ↖ (+3) (o) ↖ (-2) (OH) ↖ (-2) +1)+2(Ag)↖(0)↓)↙(\متن"اتیل الکل")$
$ ((ج) ↖ (+1) -2 (e) ↖ (-)) ↙ (عامل کاهش) (→) ↖ (اکسیداسیون) (ج) ↖ (+3) | 1 $
$ (2 (Ag) ↖ (+1) +2 (E) ↖ (-)) ↙ (اکسید کننده) (→) ↖ (کاهش) 2 (Ag) ↖ (0) | 1 $
واکنش هایی که بدون تغییر حالت اکسیداسیون عناصر شیمیایی رخ می دهد.
این موارد ، به عنوان مثال ، تمام واکنشهای تبادل یونی و همچنین:
- بسیاری از واکنش های ترکیبی:
$Li_2O+H_2O=2LiOH;$
- بسیاری از واکنش های تجزیه:
$2Fe(OH)_3(→)↖(t°)Fe_2O_3+3H_2O;$
- واکنش های استریفیکاسیون:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
طبقه بندی واکنشهای شیمیایی با اثر حرارتی
بر اساس اثر حرارتی، واکنش ها به گرمازا و گرماگیر تقسیم می شوند.
واکنش های گرمازا
این واکنش ها با آزاد شدن انرژی رخ می دهد.
اینها تقریباً همه واکنشهای ترکیبی را شامل می شوند. یک استثنای نادر واکنش گرماگیر سنتز اکسید نیتریک (II) از نیتروژن و اکسیژن و واکنش گاز هیدروژن با ید جامد است:
$N_2+O_2=2NO - Q$,
$H_(2(g))+I(2(t))=2HI - Q$.
واکنش های گرمازا که با انتشار نور رخ می دهند به عنوان واکنش های احتراق طبقه بندی می شوند، به عنوان مثال:
$4P+5O_2=2P_2O_5+Q،$
$CH_4+2O_2=CO_2+2H_2O+Q$.
هیدروژناسیون اتیلن نمونه ای از واکنش گرمازا است:
$CH_2=CH_2+H_2(→)↖(امتیاز)CH_3-CH_3+Q$
در دمای اتاق اجرا می شود.
واکنش های گرماگیر
این واکنش ها با جذب انرژی رخ می دهد.
بدیهی است که اینها تقریباً همه واکنشهای تجزیه را شامل می شوند، به عنوان مثال:
الف) کلسیناسیون سنگ آهک:
$CaCO_3(→)↖(t°)CaO+CO_2-Q;$
ب) ترک بوتان:
مقدار انرژی آزاد شده یا جذب شده در نتیجه یک واکنش نامیده می شود اثر حرارتی واکنش، و معادله یک واکنش شیمیایی نشان دهنده این اثر نامیده می شود معادله ترموشیمیایی، مثلا:
$H_(2(g))+Cl_(2(g))=2HCl_((g))+92.3 کیلوژول،$
$N_(2(g))+O_(2(g))=2NO_((g)) - 90.4 کیلوژول دلار.
طبقه بندی واکنش های شیمیایی بر اساس وضعیت تجمع مواد واکنش دهنده (ترکیب فازی)
واکنش های ناهمگن
اینها واکنش هایی هستند که در آنها واکنش دهنده ها و محصولات واکنش در حالت های مختلف تجمع (در فازهای مختلف) قرار دارند:
$2Al_((t))+3CuCl_(2(sol))=3Cu_((t))+2AlCl_(3(sol))$,
$CaC_(2(t))+2H_2O_((l))=C_2H_2+Ca(OH)_(2(محلول))$.
واکنش های همگن
اینها واکنش هایی هستند که در آنها واکنش دهنده ها و محصولات واکنش در یک حالت تجمع (در یک فاز) هستند:
طبقه بندی واکنش های شیمیایی بر اساس مشارکت یک کاتالیزور
واکنش های غیر کاتالیزوری
واکنش های غیر کاتالیزوری رخ می دهد بدون مشارکت کاتالیزور:
$2HgO(→)↖(t°)2Hg+O_2$،
$C_2H_4+3O_2(→)↖(t°)2CO_2+2H_2O$.
واکنش های کاتالیزوری
واکنش های کاتالیزوری در حال انجام است با مشارکت یک کاتالیزور:
$2KClO_3(→)↖(MnO_2،t°)2KCl+3O_2،$
$(C_2H_5OH)↙(اتانول)(→)↖(H_2SO-4,t°)(CH_2=CH_2)↙(اتن)+H_2O$
از آنجایی که تمام واکنشهای بیولوژیکی که در سلولهای موجودات زنده رخ میدهند با مشارکت کاتالیزورهای بیولوژیکی خاص با ماهیت پروتئینی - آنزیمها رخ میدهند، همه آنها کاتالیزور هستند یا به عبارت دقیقتر، آنزیمی
لازم به ذکر است که بیش از 70% دلار صنایع شیمیایی از کاتالیزور استفاده می کنند.
طبقه بندی واکنش های شیمیایی بر اساس جهت
واکنش های برگشت ناپذیر
واکنش های برگشت ناپذیر تحت این شرایط فقط در یک جهت جریان دارند.
اینها شامل تمام واکنش های تبادلی همراه با تشکیل رسوب، گاز یا ماده کمی تفکیک کننده (آب) و همه واکنش های احتراق است.
واکنش های برگشت پذیر
واکنش های برگشت پذیر در این شرایط به طور همزمان در دو جهت مخالف رخ می دهد.
اکثریت قریب به اتفاق چنین واکنش هایی هستند.
در شیمی آلی، علامت برگشت پذیری توسط متضاد فرآیندها منعکس می شود:
- هیدروژناسیون - هیدروژن زدایی؛
- هیدراتاسیون - کم آبی؛
- پلیمریزاسیون - depolymerization.
تمام واکنش های استری شدن (همانطور که می دانید فرآیند مخالف، هیدرولیز نامیده می شود) و هیدرولیز پروتئین ها، استرها، کربوهیدرات ها و پلی نوکلئوتیدها برگشت پذیر هستند. برگشت پذیری زیربنای مهم ترین فرآیند در یک موجود زنده - متابولیسم است.
طبقه بندی واکنش های شیمیایی در شیمی معدنی و آلی بر اساس ویژگی های طبقه بندی مختلف انجام می شود که اطلاعات مربوط به آنها در جدول زیر آورده شده است.
با تغییر حالت اکسیداسیون عناصر
اولین نشانه طبقه بندی بر اساس تغییر در حالت اکسیداسیون عناصر تشکیل دهنده واکنش دهنده ها و محصولات است.
الف) ردوکس
ب) بدون تغییر حالت اکسیداسیون
ردوکسواکنش هایی نامیده می شوند که همراه با تغییر در حالت اکسیداسیون عناصر شیمیایی سازنده معرف ها هستند. واکنشهای ردوکس در شیمی معدنی شامل تمام واکنشهای جایگزینی و آن دسته از واکنشهای تجزیه و ترکیبی است که حداقل یک ماده ساده در آن دخالت دارد. واکنش هایی که بدون تغییر حالت اکسیداسیون عناصر تشکیل دهنده واکنش دهنده ها و محصولات واکنش رخ می دهد، شامل تمام واکنش های تبادلی می شود.

با توجه به تعداد و ترکیب معرف ها و فرآورده ها
واکنش های شیمیایی بر اساس ماهیت فرآیند، یعنی تعداد و ترکیب معرف ها و محصولات طبقه بندی می شوند.
واکنش های مرکبواکنش های شیمیایی هستند که در نتیجه آنها مولکول های پیچیده از چندین مولکول ساده تر به دست می آیند، به عنوان مثال:
4Li + O 2 = 2Li 2 O
واکنش های تجزیهواکنش های شیمیایی نامیده می شوند که در نتیجه آن مولکول های ساده از مولکول های پیچیده تر به دست می آیند، به عنوان مثال:
CaCO 3 = CaO + CO 2
واکنش های تجزیه را می توان به عنوان فرآیندهای معکوس ترکیب در نظر گرفت.
واکنش های جایگزینیواکنشهای شیمیایی هستند که در نتیجه یک اتم یا گروهی از اتمها در یک مولکول یک ماده با اتم یا گروهی از اتمهای دیگر جایگزین میشوند، برای مثال:
Fe + 2HCl = FeCl 2 + H 2
ویژگی متمایز آنها برهمکنش یک ماده ساده با یک ماده پیچیده است. چنین واکنش هایی در شیمی آلی نیز وجود دارد.
با این حال، مفهوم "جایگزینی" در شیمی آلی گسترده تر از شیمی معدنی است. اگر در مولکول ماده اصلی هر اتم یا گروه کاربردی توسط یک اتم یا گروه دیگر جایگزین شود ، اینها نیز واکنش های جایگزینی هستند ، اگرچه از نظر شیمی معدنی ، این روند مانند یک واکنش مبادله ای به نظر می رسد.
- مبادله (از جمله خنثی سازی).
واکنش های مبادله ایواکنشهای شیمیایی است که بدون تغییر حالت اکسیداسیون عناصر رخ می دهد و منجر به تبادل قسمت های تشکیل دهنده واکنش دهنده ها می شود ، به عنوان مثال:
agno 3 + kbr = agbr + kno 3

در صورت امکان ، در جهت مخالف جریان دهید
در صورت امکان، در جهت مخالف - برگشت پذیر و غیر قابل برگشت جریان دهید.
برگشت پذیرواکنش های شیمیایی هستند که در یک دمای معین به طور همزمان در دو جهت مخالف با سرعت های قابل مقایسه رخ می دهند. هنگام نوشتن معادلات برای چنین واکنشهایی، علامت مساوی با فلشهایی با جهت مخالف جایگزین میشود. ساده ترین مثال از یک واکنش برگشت پذیر، سنتز آمونیاک توسط برهمکنش نیتروژن و هیدروژن است:
N 2 +3H 2 ↔2NH 3
برگشت ناپذیرواکنش هایی هستند که فقط در جهت رو به جلو رخ می دهند و منجر به تشکیل محصولاتی می شوند که با یکدیگر تعامل ندارند. واکنشهای برگشتناپذیر شامل واکنشهای شیمیایی است که منجر به تشکیل ترکیبات کمی تفکیک شده، آزاد شدن مقدار زیادی انرژی و همچنین واکنشهایی میشود که در آن محصولات نهایی کره واکنش را به صورت گازی یا به شکل رسوب ترک میکنند. :
HCl + NaOH = NaCl + H2O
2Ca + O2 = 2CaO
BaBr 2 + Na 2 SO 4 = BaSO 4 ↓ + 2 NaBr

با اثر حرارتی
گرمازابه واکنش های شیمیایی گفته می شود که با آزاد شدن گرما رخ می دهد. نمادی برای تغییر در آنتالپی (محتوای گرما) ΔH، و اثر حرارتی واکنش Q. برای واکنش های گرمازا Q > 0، و ΔH< 0.
گرماگیرواکنش های شیمیایی هستند که شامل جذب گرما می شوند. برای واکنش های گرماگیر Q< 0, а ΔH > 0.
واکنش های ترکیبی عموماً واکنش های گرمازا و واکنش های تجزیه گرماگیر خواهند بود. یک استثنای نادر واکنش نیتروژن با اکسیژن است - گرماگیر:
N2 + O2 → 2NO - س

بر اساس فاز
همگنواکنشهایی که در یک محیط همگن اتفاق میافتند (مواد همگن در یک فاز، به عنوان مثال g-g، واکنشها در محلولها) نامیده میشوند.
ناهمگونواکنشهایی هستند که در یک محیط ناهمگن، روی سطح تماس مواد واکنشدهنده که در فازهای مختلف هستند، مثلاً جامد و گاز، مایع و گاز، در دو مایع غیرقابل امتزاج رخ میدهند.
با توجه به استفاده از کاتالیزور
کاتالیزور ماده ای است که یک واکنش شیمیایی را تسریع می کند.
واکنش های کاتالیزوریفقط در حضور یک کاتالیزور (از جمله آنزیمی) رخ می دهد.
واکنش های غیر کاتالیزوریدر غیاب کاتالیزور بروید.
بر اساس نوع انفصال
واکنش های همولیتیک و هترولیتیک بر اساس نوع شکاف پیوند شیمیایی در مولکول شروع کننده از هم متمایز می شوند.
همولیتیکبه واکنش هایی گفته می شود که در نتیجه شکستن پیوندها، ذراتی تشکیل می شوند که دارای یک الکترون جفت نشده - رادیکال های آزاد هستند.
هترولیتیکواکنش هایی هستند که از طریق تشکیل ذرات یونی - کاتیون ها و آنیون ها رخ می دهند.
- همولیتیک (شکاف مساوی، هر اتم 1 الکترون دریافت می کند)
- هترولیتیک (شکاف نابرابر - یک جفت الکترون دریافت می کند)
افراطی(زنجیره ای) واکنش های شیمیایی شامل رادیکال ها هستند، به عنوان مثال:
CH 4 + Cl 2 hv → CH 3 Cl + HCl
یونیواکنش های شیمیایی هستند که با مشارکت یون ها رخ می دهند، به عنوان مثال:
KCl + AgNO 3 = KNO 3 + AgCl↓
واکنشهای الکتروفیلی واکنشهای هترولیتی ترکیبات آلی با الکتروفیل ها هستند - ذرات که دارای یک بار مثبت کامل یا کسری هستند. آنها به واکنش های جایگزینی الکتروفیل و افزودن الکتروفیل تقسیم می شوند، به عنوان مثال:
C 6 H 6 + Cl 2 FeCl3 → C 6 H 5 Cl + HCl
H 2 C = CH 2 + Br 2 → BrCH 2 -CH 2 Br
واکنشهای نوکلئوفیلیک واکنشهای هترولیتیک ترکیبات آلی با نوکلئوفیل ها هستند - ذرات که دارای یک بار منفی کل یا کسری هستند. آنها به واکنش های جایگزینی نوکلئوفیل و افزودن هسته دوست تقسیم می شوند، به عنوان مثال:
CH 3 Br + NaOH → CH 3 OH + NaBr
CH 3 C(O)H + C 2 H 5 OH → CH 3 CH(OC 2 H 5) 2 + H 2 O
طبقه بندی واکنش های آلی
طبقه بندی واکنش های آلی در جدول آورده شده است:

واکنش های شیمیایی- اینها فرآیندهایی هستند که در نتیجه آنها از برخی مواد مواد دیگری تشکیل می شود که از نظر ترکیب و (یا) ساختار با آنها متفاوت است.
طبقه بندی واکنش ها:
من. با توجه به تعداد و ترکیب واکنش دهنده ها و محصولات واکنش:
1) واکنش هایی که بدون تغییر در ترکیب ماده رخ می دهد:
در شیمی معدنی، اینها واکنش های تبدیل برخی از تغییرات آلوتروپیک به برخی دیگر هستند:
C (گرافیت) → C (الماس)؛ P (سفید) → P (قرمز).
در شیمی آلی ، اینها واکنشهای ایزومریزاسیون هستند - واکنش هایی که منجر به تشکیل مولکول های سایر مواد با همان ترکیب کیفی و کمی از مولکول های یک ماده می شود ، یعنی. با فرمول مولکولی یکسان اما ساختار متفاوت.
CH 2 -CH 2 -CH 3 → CH 3 -CH-CH 3
n-بوتان 2- متیل پروپان (ایزوبوتان)
2) واکنش هایی که با تغییر در ترکیب ماده رخ می دهد:
الف) واکنشهای ترکیبی (در شیمی آلی علاوه بر این) - واکنش هایی که در طی آن دو یا چند ماده یک پیچیده دیگر را تشکیل می دهند: S + O 2 → SO 2
در شیمی آلی اینها واکنش های هیدروژناسیون، هالوژناسیون، هیدروهالوژناسیون، هیدراتاسیون، پلیمریزاسیون هستند.
ch 2 = ch 2 + hoh → ch 3 - ch 2 اوه
ب) واکنشهای تجزیه (در شیمی آلی ، حذف ، از بین بردن) - واکنش هایی که در طی آن چندین ماده جدید از یک ماده پیچیده تشکیل می شوند:
ch 3 - ch 2 OH → ch 2 = ch 2 + H 2 o
2KNO 3 → 2KNO 2 + O 2
در شیمی آلی، نمونههایی از واکنشهای حذف عبارتند از هیدروژن زدایی، آبگیری، آبزدایی و ترکخوردگی.
ج) واکنشهای جایگزینی - واکنش هایی که در طی آن اتمهای یک ماده ساده جایگزین اتمهای برخی از عناصر در یک ماده پیچیده (در شیمی آلی ، واکنش دهنده ها و محصولات یک واکنش اغلب دو ماده پیچیده هستند).
CH 4 + CL 2 → CH 3 Cl + HCl ؛ 2NA + 2H 2 O → 2NAOH + H 2
نمونههایی از واکنشهای جایگزینی که با تغییر در حالتهای اکسیداسیون اتمها همراه نیستند، بسیار کم هستند. لازم به ذکر است که واکنش اکسید سیلیکون با نمک های اسیدهای حاوی اکسیژن که مربوط به اکسیدهای گازی یا فرار است:
CACO 3 + SIO 2 = Casio 3 + Co 2
CA 3 (PO 4) 2 + 3Sio 2 = 3сASIO 3 + P 2 O 5
د) واکنش های تبادلی - واکنش هایی که طی آن دو ماده پیچیده اجزای خود را مبادله می کنند:
NaOH + HCl → NaCl + H 2 O ،
2CH 3 COOH + CaCO 3 → (CH 3 COO) 2 Ca + CO 2 + H 2 O
II. با تغییر حالت های اکسیداسیون عناصر شیمیایی تشکیل دهنده مواد
1) واکنش هایی که با تغییر در حالت های اکسیداسیون یا ORR رخ می دهد:
∙2| n +5 +3E - → N +2 (فرآیند کاهش ، عنصر - عامل اکسید کننده) ،
∙3| مس 0 - 2e - → مس +2 (فرآیند اکسیداسیون ، عنصر - عامل کاهش) ،
8HNO 3 + 3CU → 3CU (شماره 3) 2 + 2NO + 4H 2 O.
در شیمی آلی:
C 2 H 4 + 2KMNO 4 + 2H 2 O → CH 2 OH -CH 2 OH + 2MNO 2 + 2KOH
2) واکنشی که بدون تغییر حالت اکسیداسیون عناصر شیمیایی رخ می دهد:
li 2 o + h 2 o → 2lioh ،
hcooh + ch 3 oh → hcooch 3 + h 2 o
III. با اثر حرارتی
1) واکنشهای گرمازدایی با آزاد شدن انرژی رخ می دهد:
C + O 2 → CO 2 + Q،
CH 4 + 2O 2 → Co 2 + 2H 2 O + Q
2) واکنشهای اندوترمیک با جذب انرژی رخ می دهد:
сACO 3 → CAO + CO 2 - q
C 12 H 26 → C 6 H 14 + C 6 H 12 - Q
IV. با توجه به وضعیت تجمع مواد واکنش دهنده
1) واکنشهای ناهمگن - واکنش هایی که در طی آن واکنش دهنده ها و محصولات واکنش در حالت های مختلف تجمع قرار دارند:
Fe (sol) + cuso 4 (sol) → cu (sol) + feso 4 (sol) ،
CAC 2 (جامد) + 2H 2 O (L) → Ca (OH) 2 (محلول) + C 2 H 2 (G)
2) واکنش های همگن - واکنش هایی که طی آن واکنش دهنده ها و محصولات واکنش در حالت تجمع یکسان هستند:
H 2 (g) + Cl 2 (g) → 2HCl (g)،
2C 2 H 2 (g) + 5O 2 (g) → 4CO 2 (g) + 2H 2 O (g)
V. با مشارکت کاتالیزور
1) واکنش های غیر کاتالیزوری که بدون مشارکت کاتالیزور رخ می دهند:
2H 2 + O 2 → 2H 2 O، C 2 H 4 + 3O 2 → 2CO 2 + 2H 2 O
2) واکنش های کاتالیزوری شامل کاتالیزورها:
2H 2 O 2 → 2H 2 O + O 2
VI. به سمت
1) واکنش های برگشت ناپذیر در شرایط معین تنها در یک جهت رخ می دهد:
C 2 H 4 + 3O 2 → 2CO 2 + 2H 2 O
2) واکنش های برگشت پذیر تحت این شرایط به طور همزمان در دو جهت مخالف رخ می دهد: N 2 + 3H 2 ↔2NH 3
VII. با توجه به مکانیسم جریان
1) مکانیسم رادیکال.
A: B → A· + ·B
یک شکاف پیوند همولیتیک (برابر) رخ می دهد. در طول شکاف همولیتیک، جفت الکترون های تشکیل دهنده پیوند به گونه ای تقسیم می شوند که هر یک از ذرات حاصل یک الکترون دریافت می کند. در این حالت، رادیکال ها تشکیل می شوند - ذرات بدون بار با الکترون های جفت نشده. رادیکال ها ذرات بسیار واکنش پذیری هستند و واکنش های مربوط به آنها در فاز گاز با سرعت بالا و اغلب با انفجار رخ می دهد.
واکنشهای رادیکال بین رادیکالها و مولکولهای تشکیلشده در طول واکنش رخ میدهد:
2H 2 O 2 → 2H 2 O + O 2
CH 4 + Cl 2 → CH 3 Cl + HCl
به عنوان مثال: واکنش های احتراق مواد آلی و معدنی، سنتز آب، آمونیاک، واکنش های هالوژناسیون و نیتراسیون آلکان ها، ایزومریزاسیون و آروماتیزاسیون آلکان ها، اکسیداسیون کاتالیزوری آلکان ها، پلیمریزاسیون آلکن ها، وینیل کلرید و غیره.
2) مکانیسم یونی.
A: B → :A - + B +
یک شکاف پیوند هترولیتیک (نابرابر) رخ می دهد که هر دو الکترون پیوند با یکی از ذرات پیوند قبلی باقی می مانند. ذرات باردار (کاتیون ها و آنیون ها) تشکیل می شوند.
واکنشهای یونی در محلولهایی بین یونهایی که از قبل وجود داشته یا در طول واکنش تشکیل شدهاند، رخ میدهد.
به عنوان مثال، در شیمی معدنی این برهمکنش الکترولیت ها در محلول است؛ در شیمی آلی این واکنش های افزودن به آلکن ها، اکسیداسیون و هیدروژن زدایی الکل ها، جایگزینی یک گروه الکل و سایر واکنش هایی است که ویژگی های آلدئیدها و اسیدهای کربوکسیلیک را مشخص می کند.
هشتم. با توجه به نوع انرژی آغازگر واکنش:
1) واکنش های فتوشیمیایی زمانی رخ می دهد که در معرض کوانتوم های نور قرار گیرند. به عنوان مثال، سنتز کلرید هیدروژن، برهمکنش متان با کلر، تولید ازن در طبیعت، فرآیندهای فتوسنتز و غیره.
2) واکنش های تشعشعی توسط تشعشعات پرانرژی (اشعه ایکس، اشعه γ) آغاز می شود.
3) واکنش های الکتروشیمیایی توسط جریان الکتریکی، به عنوان مثال، در طول الکترولیز آغاز می شود.
4) واکنش های ترموشیمیایی با انرژی حرارتی آغاز می شود. اینها شامل تمام واکنش های گرماگیر و بسیاری از واکنش های گرمازا است که برای شروع به گرما نیاز دارند.
سرفصل های کد آزمون دولتی واحد: طبقه بندی واکنش های شیمیایی در شیمی آلی و معدنی.
واکنش های شیمیایی - این نوعی برهمکنش ذرات است که یک ماده شیمیایی دیگری را تولید می کند که از نظر خواص و ساختار با آنها متفاوت است. موادی که وارددر واکنش - معرف ها. موادی که شکل گرفتهدر طی یک واکنش شیمیایی - محصولات.
در طی یک واکنش شیمیایی، پیوندهای شیمیایی شکسته شده و پیوندهای جدید تشکیل می شود.
در طی واکنش های شیمیایی، اتم های درگیر در واکنش تغییر نمی کنند. فقط ترتیب اتصال اتم ها در مولکول ها تغییر می کند. بدین ترتیب، تعداد اتم های یک ماده در طول یک واکنش شیمیایی تغییر نمی کند.
واکنش های شیمیایی بر اساس معیارهای مختلف طبقه بندی می شوند. بیایید انواع اصلی طبقه بندی واکنش های شیمیایی را در نظر بگیریم.
طبقه بندی بر اساس تعداد و ترکیب مواد واکنش دهنده
بر اساس ترکیب و تعداد مواد واکنش دهنده، واکنش هایی که بدون تغییر در ترکیب مواد رخ می دهند، به واکنش هایی که با تغییر در ترکیب مواد رخ می دهند، تقسیم می شوند:
1. واکنش هایی که بدون تغییر در ترکیب مواد رخ می دهد (A → B)
به چنین واکنش هایی در شیمی معدنیانتقال آلوتروپیک مواد ساده از یک اصلاح به دیگری را می توان نسبت داد:
S orthorhombic → S monoclinic.
که در شیمی ارگانیکچنین واکنش هایی شامل واکنش های ایزومریزاسیون ، هنگامی که از یک ایزومر، تحت تأثیر یک کاتالیزور و عوامل خارجی، ایزومر دیگری (معمولاً یک ایزومر ساختاری) به دست می آید.
مثلاایزومریزاسیون بوتان به 2-متیل پروپان (ایزوبوتان):
CH 3 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH3)-CH3.
2. واکنش هایی که با تغییر ترکیب رخ می دهد
- واکنش های مرکب (A + B + ... → د)- اینها واکنش هایی هستند که در آن یک ماده پیچیده جدید از دو یا چند ماده تشکیل می شود. که در شیمی معدنیواکنش های مرکب شامل واکنش های احتراق مواد ساده، برهمکنش اکسیدهای بازی با اکسیدهای اسیدی و غیره است. در شیمی آلیچنین واکنش هایی را واکنش می نامند الحاقات واکنش های افزایشی — اینها واکنش هایی هستند که در آن مولکول دیگری به مولکول آلی مورد نظر اضافه می شود. واکنش های افزایشی شامل واکنش ها می شود هیدروژناسیون(برهمکنش با هیدروژن)، هیدراتاسیون(اتصال آب) هیدروهالوژناسیون(افزودن هالید هیدروژن) بسپارش(چسبیدن مولکول ها به یکدیگر برای تشکیل یک زنجیره بلند) و غیره.
مثلا، هیدراتاسیون:
CH 2 = CH 2 + H 2 O → CH 3 -CH 2 -OH
- واکنش های تجزیه (آ → B+C+…)- اینها واکنش هایی هستند که طی آن چندین ماده کمتر پیچیده یا ساده از یک مولکول پیچیده تشکیل می شود. در این صورت می توان هم مواد ساده و هم مواد پیچیده تشکیل داد.

مثلا، در هنگام تجزیه آب اکسیژنه:
2H2O2→ 2H 2 O + O 2.
در شیمی آلیواکنش های تجزیه و واکنش های حذف را جدا کنید . واکنشهای حذف — اینها واکنش هایی هستند که طی آن اتم ها یا گروه های اتمی از مولکول اصلی جدا می شوند و در عین حال اسکلت کربنی آن حفظ می شود.
مثلا، واکنش انتزاع هیدروژن (هیدروژناسیون) از پروپان:
C 3 H 8 → C 3 H 6 + H 2
به عنوان یک قاعده، نام چنین واکنش هایی حاوی پیشوند "de" است. واکنش های تجزیه در شیمی آلی معمولاً شامل شکستن یک زنجیره کربنی است.
مثلا، واکنش ترک خوردگی(تقسیم شدن به مولکول های ساده تر با حرارت دادن یا تحت تأثیر یک کاتالیزور):
C 4 H 10 → C 2 H 4 + C 2 H 6
- واکنش های جایگزینی - اینها واکنش هایی هستند که طی آن اتم ها یا گروه هایی از اتم های یک ماده با اتم ها یا گروه هایی از اتم های یک ماده دیگر جایگزین می شوند. در شیمی معدنی این واکنش ها بر اساس طرح زیر رخ می دهد:
AB + C = AC + B.
مثلا، فعال تر هالوژن هاآنهایی که کمتر فعال هستند را از ترکیبات جابجا کنید. اثر متقابل یدید پتاسیمبا کلر:
2KI + Cl 2 → 2KCl + I 2.
هر دو اتم ها و مولکول ها را می توان جایگزین کرد.
مثلا، بر اثر همجوشی اکسیدهای فرار کمترازدحام می کنند فرارتراز نمک ها بله، غیر فرار اکسید سیلیکونمونوکسید کربن را از کربنات سدیمهنگام ادغام:
Na 2 CO 3 + SiO 2 → Na 2 SiO 3 + CO 2
که در شیمی ارگانیک واکنش های جانشینی واکنش هایی هستند که در آن بخشی از یک مولکول آلی جایگزین شده است به ذرات دیگر. در این مورد، ذره جایگزین، به عنوان یک قاعده، با بخشی از مولکول جایگزین ترکیب می شود.
مثلا، واکنش کلرزنی متان:
CH 4 + Cl 2 → CH 3 Cl + HCl
از نظر تعداد ذرات و ترکیب محصولات متقابل، این واکنش بیشتر شبیه واکنش تبادلی است. با این اوصاف، توسط مکانیزمچنین واکنشی یک واکنش جایگزین است.
- واکنشهای مبادله - اینها واکنش هایی هستند که طی آن دو ماده پیچیده اجزای تشکیل دهنده خود را مبادله می کنند:
AB + CD = AC + BD

واکنش های مبادله شامل واکنش های تبادل یونی، در محلول ها جریان دارد. واکنشهایی که خواص اسیدی-بازی مواد و سایرین را نشان میدهند.
مثالواکنش های تبادل در شیمی معدنی - خنثی سازی اسید هیدروکلریک قلیایی:
NaOH + HCl = NaCl + H2O
مثالواکنش های تبادل در شیمی آلی - هیدرولیز قلیایی کلرو اتان:
Ch 3 -CH 2 -cl + KOH = CH 3 -CH 2 -OH + KCl
طبقه بندی واکنش های شیمیایی بر اساس تغییرات در حالت اکسیداسیون عناصر تشکیل دهنده مواد
با تغییر حالت اکسیداسیون عناصرواکنش های شیمیایی به دو دسته تقسیم می شوند واکنش های ردوکسو واکنش هایی که در جریان است بدون تغییر حالت اکسیداسیونعناصر شیمیایی
- واکنش های ردوکس (ORR) واکنش هایی هستند که در طی آن حالت های اکسیداسیونمواد تغییر دادن. در این صورت تبادل صورت می گیرد الکترون ها.
که در شیمی معدنی چنین واکنشهایی معمولاً شامل واکنشهای تجزیه، جایگزینی، ترکیب و همه واکنشهای شامل مواد ساده است. برای یکسان سازی ORR از روش استفاده می شود تعادل الکترونیکی(تعداد الکترون های داده شده باید برابر با تعداد دریافتی باشد) یا روش تعادل الکترون یون.
که در شیمی ارگانیک بسته به اینکه چه اتفاقی برای مولکول آلی میافتد، واکنشهای اکسیداسیون و کاهش را جدا کنید.
واکنش های اکسیداسیون در شیمی آلیواکنش هایی هستند که طی آن تعداد اتم های هیدروژن کاهش می یابدیا تعداد اتم های اکسیژن در مولکول آلی اصلی افزایش می یابد.
مثلااکسیداسیون اتانول تحت اثر اکسید مس:
CH 3 -CH 2 -OH + CuO → CH 3 -CH=O + H 2 O + Cu
واکنش های بهبودی در شیمی آلی، اینها واکنش هایی هستند که طی آن تعداد اتم های هیدروژن افزایش می یابدیا تعداد اتم های اکسیژن کاهش می یابددر یک مولکول آلی
مثلا، بهبود استالدئید هیدروژن:
CH 3 -CH=O + H 2 → CH 3 -CH 2 -OH
- واکنش های پروتولیتیک و متابولیک - اینها واکنش هایی هستند که در طی آن حالت های اکسیداسیون اتم ها تغییر نمی کند.
مثلا، خنثی سازی سود سوزآور اسید نیتریک:
NaOH + HNO 3 = H 2 O + NaNO 3
طبقه بندی واکنش ها بر اساس اثر حرارتی
با توجه به اثر حرارتی، واکنش ها به دو دسته تقسیم می شوند گرمازاو گرماگیر.
واکنش های گرمازا - اینها واکنش هایی هستند که با آزاد شدن انرژی به شکل گرما همراه هستند (+ س). چنین واکنش هایی تقریباً تمام واکنشهای ترکیبی را شامل می شود.
استثناها- واکنش نیتروژنبا اکسیژنبا آموزش اکسید نیتریک (II) - گرمازا:
N 2 + O 2 = 2NO - س
واکنش گازی هیدروژنبا سخت یدهمچنین گرماگیر:
H 2 + I 2 = 2HI - س
واکنش های گرمازدایی که نور تولید می کنند ، واکنش نامیده می شوند احتراق.
مثلااحتراق متان:
CH 4 + O 2 = CO 2 + H 2 O

همچنین گرمازاهستند:

واکنش های گرماگیر واکنش هایی هستند که با جذب انرژیبه صورت گرما ( - س ). به عنوان یک قاعده ، بیشتر واکنش ها با جذب گرما رخ می دهد تجزیه(واکنش هایی که نیاز به گرمایش طولانی مدت دارند).
مثلا، تجزیه سنگ آهک:
CaCO 3 → CaO + CO 2 - س
همچنین گرماگیرهستند:
- واکنش های هیدرولیز;
- واکنش هایی که فقط هنگام گرم شدن رخ می دهند;
- واکنش هایی که فقط رخ می دهنددر دماهای بسیار بالا یا تحت تأثیر تخلیه الکتریکی.
مثلاتبدیل اکسیژن به ازن:
3O 2 = 2O 3 - س
که در شیمی ارگانیک با جذب گرما، واکنش های تجزیه رخ می دهد. مثلا، ترک خوردن پنتان:
C 5 H 12 → C 3 H 6 + C 2 H 6 - س.
طبقه بندی واکنش های شیمیایی بر اساس وضعیت تجمع مواد واکنش دهنده (بر اساس ترکیب فازی)
مواد می توانند در سه حالت اصلی تجمع وجود داشته باشند - سخت, مایعو گازی. بر اساس حالت فازواکنش ها را به اشتراک بگذارید همگنو ناهمگون.
- واکنش های همگن - اینها واکنش هایی هستند که در آنها واکنش دهنده ها و محصولات هستند در یک فازو برخورد ذرات در حال واکنش در کل حجم مخلوط واکنش رخ می دهد. واکنش های همگن شامل فعل و انفعالات است مایع-مایعو گاز-گاز.
مثلا، اکسیداسیون دی اکسید گوگرد:
2SO 2 (g) + O 2 (g) = 2SO 3 (g)
- واکنش های ناهمگن - اینها واکنش هایی هستند که در آنها واکنش دهنده ها و محصولات هستند در فازهای مختلف. در این حالت فقط برخورد ذرات واکنش دهنده رخ می دهد در مرز تماس فاز. چنین واکنش هایی شامل فعل و انفعالات است مایع گاز ، جامد گاز ، جامد جامد و مایع جامد.
مثلا، اثر متقابل دی اکسید کربنو کلسیم هیدروکسید:
Co 2 (g) + ca (OH) 2 (محلول) = CACO 3 (تلویزیون) + H 2 O
برای طبقه بندی واکنش ها بر اساس حالت فاز ، مفید است که بتوانیم تعیین کنیم حالت های فازی مواد. این کار با استفاده از دانش در مورد ساختار ماده ، به ویژه در مورد ، بسیار آسان است.
مواد با یونی, اتمییا شبکه کریستالی فلزی، معمولا سختدر شرایط عادی؛ مواد با شبکه مولکولی، معمولا، مایعاتیا گازهادر شرایط عادی
لطفاً توجه داشته باشید که هنگام گرم شدن یا خنک شدن ، مواد می توانند از حالت فاز به حالت دیگر تغییر کنند. در این حالت ، لازم است که برای یک واکنش خاص و خصوصیات فیزیکی ماده ، روی شرایط تمرکز کنید.
مثلا، دریافت گاز سنتزدر دمای بسیار بالایی که در آن آب رخ می دهد رخ می دهد - بخار:
CH 4 (g) + H2O (g) = CO (g) + 3H 2 (g)
بنابراین، اصلاح بخار متان — واکنش همگن.
طبقه بندی واکنش های شیمیایی بر اساس مشارکت یک کاتالیزور
کاتالیزور ماده ای است که یک واکنش را سرعت می بخشد ، اما بخشی از محصولات واکنش نیست. کاتالیزور در واکنش شرکت می کند ، اما در طول واکنش عملاً مصرف نمی شود. به طور معمول، نمودار عمل کاتالیزور بهزمانی که مواد برهم کنش دارند A+Bرا می توان به صورت زیر نشان داد: A + K = AK. AK + B = AB + K.
بسته به حضور یک کاتالیزور ، واکنشهای کاتالیزوری و غیر کاتالیزوری متمایز است.
- واکنش های کاتالیزوری - این واکنش هایی است که با مشارکت کاتالیزورها رخ می دهد. به عنوان مثال ، تجزیه نمک Berthollet: 2KCLO 3 → 2KCl + 3O 2.
- واکنش های غیر کاتالیزوری - این واکنش هایی است که بدون مشارکت یک کاتالیزور رخ می دهد. به عنوان مثال ، احتراق اتان: 2C 2 H 6 + 5O 2 = 2CO 2 + 6H 2 O.
تمام واکنشهای موجود در سلولهای موجودات زنده با مشارکت کاتالیزورهای پروتئین ویژه - آنزیم ها رخ می دهد. چنین واکنش هایی را آنزیمی می نامند.
مکانیسم عمل و عملکرد کاتالیزورها در یک مقاله جداگانه با جزئیات بیشتر مورد بحث قرار می گیرد.
طبقه بندی واکنش ها بر اساس جهت
واکنش های برگشت پذیر - اینها واکنشی هستند که می توانند در هر دو جهت رو به جلو و معکوس اتفاق بیفتند ، یعنی. هنگامی که ، در شرایط معین ، محصولات واکنش می توانند با یکدیگر در تعامل باشند. واکنش های برگشت پذیر شامل اکثر واکنش های همگن، استری شدن. واکنش های هیدرولیز؛ hydrogenation-dehydrogenation, hydration-dehydration; تولید آمونیاک از مواد ساده، اکسیداسیون دی اکسید گوگرد، تولید هالیدهای هیدروژن (به جز هیدروژن فلوراید) و سولفید هیدروژن. سنتز متانول؛ تولید و تجزیه کربنات ها و بی کربنات ها و غیره
واکنش های برگشت ناپذیر - اینها واکنش هایی هستند که عمدتاً در یک جهت پیش می روند، یعنی. محصولات واکنش تحت این شرایط نمی توانند با یکدیگر واکنش نشان دهند. نمونه هایی از واکنش های برگشت ناپذیر: احتراق. واکنش های انفجاری؛ واکنش هایی که با تشکیل گاز، رسوب یا آب در محلول ها رخ می دهد. انحلال فلزات قلیایی در آب؛ و غیره.
خواص شیمیایی مواد در انواع واکنش های شیمیایی آشکار می شود.
تبدیل مواد همراه با تغییر در ترکیب و (یا) ساختار آنها نامیده می شود واکنش های شیمیایی. تعریف زیر اغلب یافت می شود: واکنش شیمیاییفرآیند تبدیل مواد اولیه (مواد اولیه) به مواد (محصولات) نهایی است.
واکنش های شیمیایی با استفاده از معادلات شیمیایی و نمودارهای حاوی فرمول مواد اولیه و محصولات واکنش نوشته می شوند. در معادلات شیمیایی برخلاف نمودارها، تعداد اتم های هر عنصر در سمت چپ و راست یکسان است که قانون بقای جرم را منعکس می کند.
در سمت چپ معادله فرمول های مواد شروع (معرف) ، در سمت راست نوشته شده است - مواد به دست آمده در نتیجه واکنش شیمیایی (محصولات واکنش ، مواد نهایی). علامت مساوی که طرف های چپ و راست را به هم وصل می کند نشان می دهد که تعداد کل اتم های مواد درگیر در واکنش ثابت است. این امر با قرار دادن ضرایب استوکیومتری عدد صحیح در مقابل فرمول ها حاصل می شود و روابط کمی بین واکنش دهنده ها و محصولات واکنش نشان می دهد.
معادلات شیمیایی ممکن است حاوی اطلاعات اضافی در مورد ویژگی های واکنش باشد. اگر یک واکنش شیمیایی تحت تأثیر تأثیرات خارجی (دما ، فشار ، تابش و غیره) اتفاق بیفتد ، این توسط نماد مناسب ، معمولاً در بالا (یا "زیر") علامت برابر نشان داده شده است.
تعداد زیادی از واکنش های شیمیایی را می توان به چندین نوع واکنش دسته بندی کرد که ویژگی های بسیار خاصی دارند.
مانند ویژگی های طبقه بندیموارد زیر را می توان انتخاب کرد:
1. تعداد و ترکیب مواد اولیه و محصولات واکنش.
2. وضعیت فیزیکی معرف ها و محصولات واکنش.
3. تعداد مراحلی که شرکت کنندگان در واکنش در آن قرار دارند.
4. ماهیت ذرات منتقل شده.
5. امکان وقوع واکنش در جهت جلو و معکوس.
6. علامت اثر حرارتی تمام واکنش ها را به موارد زیر تقسیم می کند: گرمازاواکنشهایی که با اثر بیرونی رخ میدهند - آزادسازی انرژی به شکل گرما (Q>0، ∆H<0):
C + O 2 = CO 2 + Q
و گرماگیرواکنش هایی که با اثر اندو رخ می دهند - جذب انرژی به شکل گرما (Q<0, ∆H >0):
N 2 + O 2 = 2NO - Q.
چنین واکنش هایی به عنوان ترموشیمیایی.
بیایید نگاهی دقیق تر به هر نوع واکنش بیندازیم.
طبقه بندی بر اساس تعداد و ترکیب معرف ها و مواد نهایی
1. واکنش های مرکب
هنگامی که یک ترکیب از چندین ماده واکنش دهنده ترکیب نسبتاً ساده واکنش نشان می دهد ، یک ماده از یک ترکیب پیچیده تر به دست می آید:
به عنوان یک قاعده، این واکنش ها با انتشار گرما همراه است، یعنی. منجر به تشکیل ترکیبات پایدارتر و کم انرژی تر می شود.
واکنش های ترکیبات مواد ساده همیشه در طبیعت ردوکس هستند. واکنش های مرکب که بین مواد پیچیده رخ می دهد می تواند بدون تغییر در ظرفیت رخ دهد:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2،
و همچنین به عنوان ردوکس طبقه بندی شود:
2FeCl 2 + Cl 2 = 2 FeCl 3.
2. واکنش های تجزیه
واکنش های تجزیه منجر به تشکیل چندین ترکیب از یک ماده پیچیده می شود:
A = B + C + D.
محصولات تجزیه یک ماده پیچیده می توانند هم مواد ساده و هم مواد پیچیده باشند.
از واکنش های تجزیه که بدون تغییر حالت های ظرفیت رخ می دهد ، قابل توجه تجزیه هیدراتهای کریستالی ، پایه ها ، اسیدها و نمک اسیدهای حاوی اکسیژن است:
| به | ||
| 4HNO3 | = | 2H 2 O + 4NO 2 O + O 2 O. |
2AgNO3 = 2 Ag + 2NO2 + O2،
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O.
واکنش های تجزیه ردوکس به ویژه برای نمک های اسید نیتریک مشخص است.
واکنشهای تجزیه در شیمی آلی ترک خوردگی نامیده میشوند:
C 18 H 38 = C 9 H 18 + C 9 H 20 ،
یا هیدروژن زدایی
C4H10 = C4H6 + 2H2.
3. واکنشهای جایگزینی
در واکنش های جانشینی، معمولاً یک ماده ساده با یک ماده پیچیده واکنش می دهد و یک ماده ساده دیگر و یک ماده پیچیده دیگر را تشکیل می دهد:
A + BC = AB + C.
این واکنش ها عمدتاً به واکنش های ردوکس تعلق دارند:
2al + fe 2 o 3 = 2fe + al 2 o 3 ،
Zn + 2Hcl = Znсl 2 + H 2 ،
2kbr + cl 2 = 2kcl + br 2 ،
2KLO 3 + L 2 = 2KLO 3 + CL 2.
نمونههایی از واکنشهای جایگزینی که با تغییر در وضعیت ظرفیت اتمها همراه نیستند، بسیار کم هستند. لازم به ذکر است که واکنش دی اکسید سیلیکون با نمک های اسیدهای حاوی اکسیژن که مربوط به انیدریدهای گازی یا فرار است:
caco 3 + sio 2 = casio 3 + co 2 ،
Ca 3 (PO 4) 2 + 3SiO 2 \u003d 3СаSiO 3 + P 2 O 5،
گاهی اوقات این واکنش ها به عنوان واکنش های مبادله ای در نظر گرفته می شوند:
CH 4 + CL 2 = CH 3 Cl + HCl.
4. واکنش های مبادله ای
واکنش های مبادله ایواکنش های بین دو ترکیب هستند که اجزای تشکیل دهنده خود را با یکدیگر مبادله می کنند:
AB + CD = AD + CB.
اگر فرآیندهای ردوکس در طی واکنشهای جانشینی رخ دهند، واکنشهای تبادلی همیشه بدون تغییر وضعیت ظرفیت اتمها رخ میدهند. این رایج ترین گروه واکنش بین مواد پیچیده - اکسیدها، بازها، اسیدها و نمک ها است:
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O،
agno 3 + kbr = agbr + kno 3 ،
CRCL 3 + ZNAON = CR (OH) 3 + ZNACL.
یک مورد خاص از این واکنش های مبادله ای است واکنش های خنثی سازی:
HCl + KOH = KCl + H 2 O.
به طور معمول ، این واکنش ها از قوانین تعادل شیمیایی پیروی می کنند و در مسیری پیش می روند که حداقل یکی از مواد از حوزه واکنش به شکل یک ماده گازی ، فرار ، رسوب یا افتادگی کم (برای راه حل ها) ترکیب شود:
nahco 3 + hcl = naCl + h 2 o + co 2 ،
CA (HCO 3) 2 + CA (OH) 2 = 2CACO 3 ↓ + 2H 2 O ،
CH 3 COONA + H 3 PO 4 = CH 3 COOH + NAH 2 PO 4.
5. واکنش های انتقال.
در واکنشهای انتقال، یک اتم یا گروهی از اتمها از یک واحد ساختاری به واحد دیگر حرکت میکنند:
AB + BC = A + B 2 C،
A 2 B + 2CB 2 = DIA 2 + DIA 3.
مثلا:
2AgCl + SnCl 2 = 2Ag + SnCl 4،
H 2 O + 2NO 2 = HNO 2 + HNO 3.
طبقه بندی واکنش ها بر اساس ویژگی های فاز
بسته به وضعیت تجمع مواد واکنش دهنده، واکنش های زیر متمایز می شوند:
1. واکنش های گازی
| H2+Cl2 | 2HCl. |
2. واکنش ها در محلول ها
NaOH (محلول) + HCl (p-p) = NaCl (p-p) + H 2 O (l)
3. واکنش های بین جامدات
| به | ||
| CaO (تلویزیون) + SiO 2 (تلویزیون) | = | CaSiO 3 (سل) |
طبقه بندی واکنش ها بر اساس تعداد فازها.
فاز به عنوان مجموعه ای از قطعات همگن یک سیستم با خواص فیزیکی و شیمیایی یکسان و جدا از یکدیگر توسط یک رابط شناخته می شود.
از این منظر، کل انواع واکنش ها را می توان به دو دسته تقسیم کرد:
1. واکنش های همگن (تک فاز).اینها شامل واکنش هایی است که در فاز گاز و تعدادی از واکنش هایی که در محلول ها رخ می دهند.
2. واکنش های ناهمگن (چند فازی).اینها شامل واکنش هایی است که در آنها واکنش دهنده ها و محصولات واکنش در فازهای مختلف هستند. مثلا:
واکنش های فاز گاز-مایع
CO 2 (g) + NaOH (p-p) = NaHCO 3 (p-p).
واکنش های فاز جامد گاز
CO 2 (گرم) + CaO (تلویزیون) = CaCO 3 (تلویزیون).
واکنش های فاز مایع-جامد
Na 2 SO 4 (محلول) + BaCl 3 (محلول) = BaSO 4 (tv) ↓ + 2NaCl (p-p).
واکنش های فاز مایع-گاز-جامد
Ca(HCO 3) 2 (محلول) + H 2 SO 4 (محلول) = CO 2 (r) + H 2 O (l) + CaSO 4 (sol)↓.
طبقه بندی واکنش ها بر اساس نوع ذرات منتقل شده
1. واکنش های پروتولیتیک.
به واکنش های اولیهشامل فرآیندهای شیمیایی است که ماهیت آنها انتقال یک پروتون از یک ماده واکنش دهنده به ماده دیگر است.
این طبقه بندی بر اساس تئوری اولیه اسیدها و بازها است که بر اساس آن اسید هر ماده ای است که یک پروتون اهدا می کند و باز ماده ای است که می تواند یک پروتون را بپذیرد، به عنوان مثال:
واکنش های پروتولیتیک شامل واکنش های خنثی سازی و هیدرولیز است.
2. واکنش های ردوکس.
اینها شامل واکنشهایی است که در آن مواد واکنشدهنده، الکترونها را مبادله میکنند و در نتیجه حالتهای اکسیداسیون اتمهای عناصر سازنده مواد واکنشدهنده را تغییر میدهند. مثلا:
Zn + 2H + → Zn 2 + + H 2،
FeS 2 + 8HNO 3 (conc) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O،
اکثریت قریب به اتفاق واکنشهای شیمیایی، واکنشهای ردوکس هستند و نقش بسیار مهمی دارند.
3. واکنش های تبادل لیگاند.
اینها شامل واکنش هایی است که طی آن انتقال یک جفت الکترون با تشکیل یک پیوند کووالانسی از طریق مکانیسم دهنده-گیرنده اتفاق می افتد. مثلا:
مس (NO 3) 2 + 4NH 3 = (NO 3) 2،
Fe + 5CO =
Al(OH) 3 + NaOH = .
یکی از ویژگی های بارز واکنش های تبادل لیگاند این است که تشکیل ترکیبات جدید ، به نام مجتمع ها ، بدون تغییر وضعیت اکسیداسیون رخ می دهد.
4. واکنش های تبادل اتمی - مولکولی.
این نوع واکنش شامل بسیاری از واکنشهای جایگزینی مورد مطالعه در شیمی آلی است که از طریق مکانیسم رادیکال ، الکتروفیلی یا هسته ای رخ می دهد.
واکنش های شیمیایی برگشت پذیر و غیر قابل برگشت
فرآیندهای شیمیایی برگشت پذیر آنهایی هستند که محصولات آنها قادر به واکنش با یکدیگر در همان شرایطی هستند که در آن به دست آمده برای تشکیل مواد اولیه به دست می آیند.
برای واکنش های برگشت پذیر، معادله معمولاً به صورت زیر نوشته می شود:
دو فلش با جهت مخالف نشان می دهد که در شرایط یکسان، هر دو واکنش رو به جلو و معکوس به طور همزمان رخ می دهند، به عنوان مثال:
CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O.
فرآیندهای شیمیایی برگشت ناپذیر آنهایی هستند که محصولات آنها قادر به واکنش با یکدیگر برای تشکیل مواد اولیه نیستند. نمونه هایی از واکنش های برگشت ناپذیر شامل تجزیه نمک برتوله هنگام گرم شدن است:
2KlО 3 → 2Kl + ЗО 2،
یا اکسیداسیون گلوکز توسط اکسیژن اتمسفر:
C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O .