Jak mierzy się stałą? Stała Boltzmanna odgrywa ważną rolę w mechanice statycznej
Fizyka, jako dokładna nauka ilościowa, nie może obejść się bez zestawu bardzo ważnych stałych, które są uwzględniane jako uniwersalne współczynniki w równaniach ustalających zależności między określonymi wielkościami. Są to stałe podstawowe, dzięki którym takie zależności stają się niezmienne i są w stanie wyjaśnić zachowanie układów fizycznych w różnych skalach.
Do takich parametrów charakteryzujących właściwości materii naszego Wszechświata należy stała Boltzmanna, czyli wielkość zawarta w szeregu najważniejszych równań. Zanim jednak przejdziemy do rozważenia jego cech i znaczenia, nie można nie powiedzieć kilku słów o naukowcu, którego imię nosi.
Ludwig Boltzmann: osiągnięcia naukowe
Jeden z najwybitniejszych naukowców XIX wieku, Austriak Ludwig Boltzmann (1844-1906) wniósł znaczący wkład w rozwój teorii kinetyki molekularnej, stając się jednym z twórców mechaniki statystycznej. Był autorem hipotezy ergodycznej, metody statystycznej w opisie gazu doskonałego i podstawowego równania kinetyki fizycznej. Dużo pracował nad zagadnieniami termodynamiki (twierdzenie H Boltzmanna, zasada statystyczna drugiej zasady termodynamiki), teorii promieniowania (prawo Stefana-Boltzmanna). W swoich pracach poruszał także zagadnienia elektrodynamiki, optyki i innych działów fizyki. Jego imię jest uwiecznione w dwóch stałych fizycznych, które zostaną omówione poniżej.
Ludwig Boltzmann był zdecydowanym i konsekwentnym zwolennikiem teorii atomowo-molekularnej budowy materii. Przez wiele lat musiał zmagać się z niezrozumieniem i odrzuceniem tych idei w środowisku naukowym tamtych czasów, kiedy wielu fizyków uważało atomy i cząsteczki za niepotrzebną abstrakcję, w najlepszym razie konwencjonalne urządzenie ułatwiające obliczenia. Bolesna choroba i ataki konserwatywnych kolegów wpędziły Boltzmanna w ciężką depresję, która nie mogąc znieść, doprowadziła wybitnego naukowca do samobójstwa. Na pomniku nagrobnym, nad popiersiem Boltzmanna, na znak uznania jego zasług, wyryto równanie S = k∙logW – jeden z efektów jego owocnej pracy naukowej. Stała k w tym równaniu jest stałą Boltzmanna.
Energia cząsteczek i temperatura materii
Pojęcie temperatury służy do scharakteryzowania stopnia nagrzania danego ciała. W fizyce stosuje się absolutną skalę temperatury, która opiera się na wnioskach z molekularnej teorii kinetycznej o temperaturze jako mierze odzwierciedlającej ilość energii ruchu termicznego cząstek substancji (co oznacza oczywiście średnią energię kinetyczną zestaw cząstek).
Zarówno dżul SI, jak i erg stosowane w układzie CGS to zbyt duże jednostki, aby wyrazić energię cząsteczek, a w praktyce bardzo trudno było mierzyć w ten sposób temperaturę. Wygodną jednostką temperatury jest stopień, a pomiar odbywa się pośrednio, poprzez rejestrację zmieniających się właściwości makroskopowych substancji – np. objętości.

Jak energia i temperatura są ze sobą powiązane?
Do obliczenia stanów rzeczywistej materii w temperaturach i ciśnieniach zbliżonych do normalnych z powodzeniem wykorzystuje się model gazu doskonałego, czyli takiego, którego wielkość cząsteczkowa jest znacznie mniejsza od objętości zajmowanej przez pewną ilość gazu, a odległość pomiędzy cząstek znacznie przekracza promień ich oddziaływania. Na podstawie równań teorii kinetycznej średnią energię takich cząstek wyznacza się jako E av = 3/2∙kT, gdzie E to energia kinetyczna, T to temperatura, a 3/2∙k to współczynnik proporcjonalności wprowadzony przez Boltzmanna. Liczba 3 charakteryzuje tutaj liczbę stopni swobody ruchu translacyjnego cząsteczek w trzech wymiarach przestrzennych.
Wartość k, którą później na cześć austriackiego fizyka nazwano stałą Boltzmanna, pokazuje, ile dżula lub erg zawiera jeden stopień. Inaczej mówiąc, jego wartość określa, o ile energia cieplnego ruchu chaotycznego jednej cząstki jednoatomowego gazu doskonałego wzrasta statystycznie średnio wraz ze wzrostem temperatury o 1 stopień.

Ile razy stopień jest mniejszy od dżula?
Wartość liczbową tej stałej można uzyskać na różne sposoby, na przykład mierząc temperaturę i ciśnienie bezwzględne, korzystając z równania gazu doskonałego lub korzystając z modelu ruchu Browna. Teoretyczne wyprowadzenie tej wartości na obecnym poziomie wiedzy nie jest możliwe.
Stała Boltzmanna jest równa 1,38 × 10 -23 J/K (tutaj K to kelwin, stopień w absolutnej skali temperatury). Dla grupy cząstek w 1 molu gazu doskonałego (22,4 litra) współczynnik zależności energii od temperatury (uniwersalna stała gazowa) otrzymuje się mnożąc stałą Boltzmanna przez liczbę Avogadro (liczbę cząsteczek w molu): R = kN A i wynosi 8,31 J/(mol∙kelwin). Jednak w przeciwieństwie do tego ostatniego, stała Boltzmanna ma bardziej uniwersalny charakter, ponieważ jest uwzględniana w innych ważnych relacjach, a także służy do określenia innej stałej fizycznej.
Rozkład statystyczny energii molekularnych
Ponieważ makroskopowe stany materii są wynikiem zachowania dużego zbioru cząstek, opisuje się je metodami statystycznymi. Ta ostatnia obejmuje również sprawdzenie, jak rozkładają się parametry energetyczne cząsteczek gazu:
- Maxwellowski rozkład energii kinetycznych (i prędkości). Pokazuje, że w gazie będącym w stanie równowagi większość cząsteczek ma prędkości bliskie pewnej najbardziej prawdopodobnej prędkości v = √(2kT/m 0), gdzie m 0 jest masą cząsteczki.
- Rozkład Boltzmanna energii potencjalnej gazów znajdujących się w polu dowolnych sił, np. grawitacji ziemskiej. Zależy to od związku pomiędzy dwoma czynnikami: przyciąganiem do Ziemi i chaotycznym ruchem termicznym cząstek gazu. W efekcie im niższa energia potencjalna cząsteczek (bliżej powierzchni planety), tym wyższe jest ich stężenie.

Obie metody statystyczne łączy się w rozkład Maxwella-Boltzmanna zawierający współczynnik wykładniczy e - E/ kT, gdzie E jest sumą energii kinetycznej i potencjalnej, a kT jest już znaną średnią energią ruchu termicznego, kontrolowaną przez stałą Boltzmanna.
Stała k i entropia
W sensie ogólnym entropię można scharakteryzować jako miarę nieodwracalności procesu termodynamicznego. Ta nieodwracalność jest związana z rozpraszaniem – rozpraszaniem – energii. W podejściu statystycznym zaproponowanym przez Boltzmanna entropia jest funkcją liczby sposobów, na jakie można zrealizować układ fizyczny bez zmiany jego stanu: S = k∙lnW.
Tutaj stała k określa skalę wzrostu entropii wraz ze wzrostem tej liczby (W) opcji implementacji systemu, czyli mikrostanów. Max Planck, który nadał tej formule współczesną formę, zaproponował nadanie stałej k nazwy Boltzmann.

Prawo promieniowania Stefana-Boltzmanna
Prawo fizyczne określające, w jaki sposób jasność energetyczna (moc promieniowania na jednostkę powierzchni) ciała absolutnie czarnego zależy od jego temperatury, ma postać j = σT 4, co oznacza, że ciało emituje proporcjonalnie do czwartej potęgi swojej temperatury. Prawo to stosuje się na przykład w astrofizyce, ponieważ promieniowanie gwiazd ma charakterystykę zbliżoną do promieniowania ciała doskonale czarnego.
W tej zależności jest jeszcze jedna stała, która również reguluje skalę zjawiska. Jest to stała Stefana-Boltzmanna σ, która wynosi w przybliżeniu 5,67 × 10 -8 W/(m 2 ∙K 4). Jego wymiar obejmuje kelwiny - co oznacza, że jest jasne, że w tym przypadku występuje również stała Boltzmanna k. Rzeczywiście, wartość σ definiuje się jako (2π 2 ∙k 4)/(15c 2 h 3), gdzie c jest prędkością światła, a h jest stałą Plancka. Zatem stała Boltzmanna w połączeniu z innymi stałymi światowymi tworzy wielkość, która ponownie łączy energię (moc) i temperaturę - w tym przypadku w odniesieniu do promieniowania.

Fizyczna istota stałej Boltzmanna
Zauważono już powyżej, że stała Boltzmanna jest jedną z tak zwanych stałych podstawowych. Nie chodzi tylko o to, że pozwala na ustalenie związku pomiędzy charakterystyką zjawisk mikroskopowych na poziomie molekularnym a parametrami procesów obserwowanych w makrokosmosie. I nie tylko, że ta stała jest zawarta w wielu ważnych równaniach.
Obecnie nie wiadomo, czy istnieje jakaś zasada fizyczna, na podstawie której można by to wyprowadzić teoretycznie. Innymi słowy z niczego nie wynika, że wartość danej stałej powinna być dokładnie taka. Moglibyśmy użyć innych wielkości i innych jednostek zamiast stopni jako miary zgodności z energią kinetyczną cząstek, wtedy wartość liczbowa stałej byłaby inna, ale pozostałaby wartością stałą. Wraz z innymi wielkościami podstawowymi tego rodzaju – prędkością graniczną c, stałą Plancka h, ładunkiem elementarnym e, stałą grawitacji G – nauka przyjmuje stałą Boltzmanna za daną naszego świata i wykorzystuje ją do teoretycznego opisu fizyki procesy w nim zachodzące.
Boltzmann Ludwig (1844-1906)- wielki austriacki fizyk, jeden z twórców teorii kinetyki molekularnej. W pracach Boltzmanna teoria kinetyki molekularnej pojawiła się po raz pierwszy jako logicznie spójna, spójna teoria fizyczna. Boltzmann podał statystyczną interpretację drugiej zasady termodynamiki. Zrobił wiele, aby rozwinąć i spopularyzować teorię pola elektromagnetycznego Maxwella. Boltzmann, wojownik z natury, z pasją bronił potrzeby molekularnej interpretacji zjawisk termicznych i poniósł główny ciężar walki z naukowcami zaprzeczającymi istnieniu cząsteczek.
Równanie (4.5.3) zawiera stosunek uniwersalnej stałej gazowej R do stałej Avogadro N A . Stosunek ten jest taki sam dla wszystkich substancji. Nazywa się ją stałą Boltzmanna na cześć L. Boltzmanna, jednego z twórców teorii kinetyki molekularnej.
Stała Boltzmanna wynosi:
 (4.5.4)
(4.5.4)
Równanie (4.5.3) uwzględniające stałą Boltzmanna zapisuje się następująco:
 (4.5.5)
(4.5.5)
Znaczenie fizyczne stałej Boltzmanna
Historycznie rzecz biorąc, temperaturę po raz pierwszy wprowadzono jako wielkość termodynamiczną i ustalono jej jednostkę miary - stopnie (patrz § 3.2). Po ustaleniu związku pomiędzy temperaturą a średnią energią kinetyczną cząsteczek stało się oczywiste, że temperaturę można zdefiniować jako średnią energię kinetyczną cząsteczek i wyrazić ją w dżulach lub ergach, czyli zamiast ilości T wprowadź wartość T* aby 
Tak zdefiniowana temperatura odnosi się do temperatury wyrażonej w stopniach w następujący sposób:

Dlatego stałą Boltzmanna można uznać za wielkość łączącą temperaturę wyrażoną w jednostkach energii z temperaturą wyrażoną w stopniach.
Zależność ciśnienia gazu od stężenia jego cząsteczek i temperatury
Wyraziwszy mi z zależności (4.5.5) i podstawiając ją do wzoru (4.4.10) otrzymujemy wyrażenie pokazujące zależność ciśnienia gazu od stężenia cząsteczek i temperatury:
 (4.5.6)
(4.5.6)
Ze wzoru (4.5.6) wynika, że przy tych samych ciśnieniach i temperaturach stężenie cząsteczek we wszystkich gazach jest takie samo.
Wynika z tego prawo Avogadro: równe objętości gazów w tych samych temperaturach i ciśnieniach zawierają tę samą liczbę cząsteczek.
Średnia energia kinetyczna ruchu translacyjnego cząsteczek jest wprost proporcjonalna do temperatury bezwzględnej. Czynnik proporcjonalności- Stała Boltzmannak = 10 -23 J/K - muszę pamiętać.
§ 4.6. Dystrybucja Maxwella
W dużej liczbie przypadków sama znajomość średnich wartości wielkości fizycznych nie wystarczy. Przykładowo znajomość średniego wzrostu ludzi nie pozwala nam na zaplanowanie produkcji odzieży w różnych rozmiarach. Musisz znać przybliżoną liczbę osób, których wzrost mieści się w określonym przedziale. Podobnie ważna jest znajomość liczby cząsteczek, których prędkości różnią się od wartości średniej. Maxwell jako pierwszy odkrył, w jaki sposób można określić te liczby.
Prawdopodobieństwo zdarzenia losowego
W § 4.1 wspomnieliśmy już, że aby opisać zachowanie dużego zbioru cząsteczek, J. Maxwell wprowadził pojęcie prawdopodobieństwa.
Jak wielokrotnie podkreślano, w zasadzie niemożliwe jest prześledzenie zmiany prędkości (lub pędu) jednej cząsteczki w dużym przedziale czasu. Niemożliwe jest także dokładne określenie prędkości wszystkich cząsteczek gazu w danym czasie. Z warunków makroskopowych, w jakich znajduje się gaz (pewna objętość i temperatura), niekoniecznie wynikają pewne wartości prędkości molekularnych. Prędkość cząsteczki można uznać za zmienną losową, która w danych warunkach makroskopowych może przyjmować różne wartości, tak jak za rzutem kostką można uzyskać dowolną liczbę punktów od 1 do 6 (liczba ścianek kości wynosi sześć). Nie da się przewidzieć liczby punktów, które wypadną w rzucie kostką. Ale prawdopodobieństwo wyrzucenia, powiedzmy, pięciu punktów jest możliwe do określenia.
Jakie jest prawdopodobieństwo wystąpienia zdarzenia losowego? Niech zostanie wyprodukowana bardzo duża liczba N testy (N - liczba rzutów kostką). Jednocześnie w N" przypadkach testy wypadły pozytywnie (tj. spadła piątka). Wówczas prawdopodobieństwo danego zdarzenia jest równe stosunkowi liczby przypadków z korzystnym wynikiem do całkowitej liczby prób, pod warunkiem, że liczba ta jest tak duża, jak to pożądane:
 (4.6.1)
(4.6.1)
W przypadku kości symetrycznej prawdopodobieństwo uzyskania dowolnej liczby punktów od 1 do 6 wynosi .
Widzimy, że na tle wielu zdarzeń losowych ujawnia się pewien wzór ilościowy, pojawia się liczba. Ta liczba - prawdopodobieństwo - pozwala obliczyć średnie. Jeśli więc rzucisz 300 kostkami, to średnia liczba piątek, jak wynika ze wzoru (4.6.1), będzie równa: 300 = 50 i nie ma absolutnie żadnej różnicy, czy rzucisz tą samą kostką 300 czy 300 identyczne kostki w tym samym czasie.
Nie ma wątpliwości, że zachowanie cząsteczek gazu w naczyniu jest znacznie bardziej złożone niż ruch rzuconej kostki. Ale i tutaj można mieć nadzieję na odkrycie pewnych wzorców ilościowych, które umożliwią obliczenie średnich statystycznych, jeśli tylko problem zostanie postawiony w taki sam sposób, jak w teorii gier, a nie jak w mechanice klasycznej. Należy porzucić nierozwiązywalny problem określenia dokładnej wartości prędkości cząsteczki w danym momencie i spróbować znaleźć prawdopodobieństwo, że prędkość ta ma określoną wartość.
Zgodnie z prawem Stefana-Boltzmanna gęstość całkowego promieniowania półkulistego mi 0 zależy tylko od temperatury i zmienia się proporcjonalnie do czwartej potęgi temperatury bezwzględnej T:
Stała Stefana – Boltzmanna σ 0 jest stałą fizyczną zawartą w prawie wyznaczającym gęstość objętościową równowagowego promieniowania cieplnego ciała absolutnie czarnego:

Historycznie rzecz biorąc, prawo Stefana-Boltzmanna zostało sformułowane przed prawem promieniowania Plancka, z którego w konsekwencji wynika. Prawo Plancka ustala zależność widmowej gęstości strumienia promieniowania mi 0 na długość fali λ i temperaturę T:

gdzie λ – długość fali, m; Z=2,998 10 8 m/s – prędkość światła w próżni; T– temperatura ciała, K;
H= 6,625 ×10 -34 J×s – stała Plancka.
Stała fizyczna k równy stosunkowi uniwersalnej stałej gazowej R=8314J/(kg×K) do liczby Avogadra nie dotyczy=6,022× 10 26 1/(kg×mol):

Liczba różnych konfiguracji systemu z N cząstki dla danego zbioru liczb n ja(liczba cząstek w I-stan, któremu odpowiada energia e i) jest proporcjonalny do wartości:

Ogrom W istnieje wiele sposobów dystrybucji N cząstek według poziomów energii. Jeżeli zależność (6) jest prawdziwa, to uważa się, że pierwotny system podlega statystyce Boltzmanna. Zestaw liczb n ja, pod którym jest numer W maksimum, występuje najczęściej i odpowiada najbardziej prawdopodobnemu rozkładowi.
Kinetyka fizyczna– mikroskopowa teoria procesów w układach statystycznie nierównowagowych.
Opis dużej liczby cząstek można z powodzeniem przeprowadzić metodami probabilistycznymi. W przypadku gazu jednoatomowego stan zbioru cząsteczek jest określony przez ich współrzędne i wartości rzutów prędkości na odpowiednie osie współrzędnych. Matematycznie opisuje to rozkład, który charakteryzuje prawdopodobieństwo znalezienia się cząstki w danym stanie:

jest oczekiwaną liczbą cząsteczek w objętości dd, której współrzędne mieszczą się w przedziale od do +d i których prędkości mieszczą się w przedziale od do +d.
Jeśli można zaniedbać uśrednioną w czasie energię potencjalną oddziaływania cząsteczek w porównaniu z ich energią kinetyczną, wówczas gaz nazywa się idealnym. Gaz doskonały nazywa się gazem Boltzmanna, jeśli stosunek długości drogi cząsteczek w tym gazie do charakterystycznej wielkości przepływu L oczywiście, tj.

ponieważ długość ścieżki jest odwrotnie proporcjonalna drugie 2(n to gęstość liczbowa 1/m 3, d to średnica cząsteczki, m).
Rozmiar
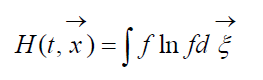
zwany H-Funkcja Boltzmanna dla jednostkowej objętości, która jest związana z prawdopodobieństwem wykrycia układu cząsteczek gazu w danym stanie. Każdemu stanowi odpowiada pewna liczba wypełniających sześciowymiarowych komórek prędkości przestrzennej, na które można podzielić przestrzeń fazową rozważanych cząsteczek. Oznaczmy W prawdopodobieństwo, że w pierwszej komórce rozważanej przestrzeni będzie N 1 cząsteczek, w drugiej N 2 itd.
Do stałej określającej początek prawdopodobieństwa obowiązuje zależność:
 ,
,
Gdzie 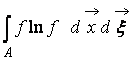 – H-funkcja obszaru przestrzeni A zajęty gazem. Z (9) wynika, że W I H ze sobą powiązane, tj. zmiana prawdopodobieństwa stanu prowadzi do odpowiedniej ewolucji funkcji H.
– H-funkcja obszaru przestrzeni A zajęty gazem. Z (9) wynika, że W I H ze sobą powiązane, tj. zmiana prawdopodobieństwa stanu prowadzi do odpowiedniej ewolucji funkcji H.

Zasada Boltzmanna ustanawia związek między entropią S układ fizyczny i prawdopodobieństwo termodynamiczne W jej stwierdza:

(opublikowano zgodnie z publikacją: Kogan M.N. Dynamika rozrzedzonego gazu. - M.: Nauka, 1967.)
Ogólny widok CUBE'a:

gdzie jest siła masowa wynikająca z obecności różnych pól (grawitacyjnych, elektrycznych, magnetycznych) działających na cząsteczkę; J– całka zderzeniowa. To właśnie ten człon równania Boltzmanna uwzględnia zderzenia cząsteczek ze sobą i odpowiadające im zmiany prędkości oddziałujących cząstek. Całka zderzeniowa jest całką pięciowymiarową i ma następującą strukturę:

Równanie (12) z całką (13) otrzymano dla zderzeń cząsteczek, w których nie powstają siły styczne, tj. zderzające się cząstki są uważane za idealnie gładkie.
Podczas interakcji energia wewnętrzna cząsteczek nie zmienia się, tj. zakłada się, że cząsteczki te są doskonale elastyczne. Rozważamy dwie grupy cząsteczek, które mają prędkości i przed zderzeniem ze sobą (kolizja) (ryc. 1), a po zderzeniu, odpowiednio, prędkości i . Różnicę prędkości nazywa się prędkością względną, tj. . Oczywiste jest, że dla gładkiego zderzenia sprężystego . Funkcje dystrybucji f 1 ", f", f 1 , f opisywać cząsteczki odpowiednich grup po i przed zderzeniami, tj. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Ryż. 1. Zderzenie dwóch cząsteczek.
(13) zawiera dwa parametry charakteryzujące położenie zderzających się cząsteczek względem siebie: B i ε; B– odległość celowania, tj. najmniejsza odległość, na jaką zbliżyłyby się cząsteczki w przypadku braku interakcji (ryc. 2); ε nazywany jest parametrem kątowym kolizji (rys. 3). Integracja zakończona B od 0 do ¥ i od 0 do 2p (dwie całki zewnętrzne w (12)) obejmuje całą płaszczyznę oddziaływania sił prostopadłą do wektora

Ryż. 2. Trajektoria cząsteczek.

Ryż. 3. Uwzględnienie interakcji cząsteczek w cylindrycznym układzie współrzędnych: z, B, ε
Równanie kinetyczne Boltzmanna wyprowadzono przy następujących założeniach i założeniach.
1. Uważa się, że występują głównie zderzenia dwóch cząsteczek, tj. rola zderzeń trzech lub więcej cząsteczek jednocześnie jest niewielka. To założenie pozwala nam użyć do analizy funkcji rozkładu pojedynczej cząstki, która powyżej jest nazywana po prostu funkcją rozkładu. Uwzględnienie zderzenia trzech cząsteczek prowadzi do konieczności wykorzystania w badaniach funkcji rozkładu dwóch cząstek. W związku z tym analiza staje się znacznie bardziej skomplikowana.
2. Założenie chaosu molekularnego. Wyraża się to tym, że prawdopodobieństwa wykrycia cząstki 1 w punkcie fazowym i cząstki 2 w punkcie fazowym są od siebie niezależne.
3. Równie prawdopodobne są zderzenia cząsteczek z dowolną odległością uderzenia, tj. funkcja rozkładu nie zmienia się na średnicy oddziaływania. Należy zaznaczyć, że analizowany element musi być mały, aby F w obrębie tego elementu nie zmienia się, ale jednocześnie tak, że względna fluktuacja ~ nie jest duża. Potencjały interakcji stosowane do obliczania całki zderzeniowej są sferycznie symetryczne, tj. ![]() .
.
Rozkład Maxwella-Boltzmanna
Stan równowagi gazu opisuje absolutny rozkład Maxwella, będący dokładnym rozwiązaniem równania kinetycznego Boltzmanna:

gdzie m jest masą cząsteczki, kg.
Ogólny lokalny rozkład Maxwella, zwany inaczej rozkładem Maxwella-Boltzmanna:

w przypadku, gdy gaz porusza się jako całość z prędkością, a zmienne n, T zależą od współrzędnej
i czas t.
W polu grawitacyjnym Ziemi dokładne rozwiązanie równania Boltzmanna pokazuje:

Gdzie N 0 = gęstość na powierzchni Ziemi, 1/m3; G– przyspieszenie ziemskie, m/s 2 ; H– wysokość, m. Wzór (16) jest dokładnym rozwiązaniem równania kinetycznego Boltzmanna albo w nieograniczonej przestrzeni, albo w obecności granic nie naruszających tego rozkładu, przy czym temperatura również musi pozostać stała.
Ta strona została zaprojektowana przez Puzinę Yu.Yu. przy wsparciu Rosyjskiej Fundacji Badań Podstawowych – projekt nr 08-08-00638.
Określający związek pomiędzy temperaturą i energią. Nazwany na cześć austriackiego fizyka Ludwiga Boltzmanna, który wniósł znaczący wkład w fizykę statystyczną, w której stała ta odgrywa kluczową rolę. Jego wartość eksperymentalna w Międzynarodowym Układzie Jednostek (SI) wynosi:
J/.Liczby w nawiasach oznaczają błąd standardowy ostatnich cyfr wartości ilości. Stałą Boltzmanna można wyznaczyć z definicji temperatury bezwzględnej i innych stałych fizycznych. Jednak obliczenie stałej Boltzmanna przy użyciu pierwszych zasad jest zbyt skomplikowane i niewykonalne przy obecnym stanie wiedzy. W naturalnym układzie jednostek Plancka naturalną jednostkę temperatury podaje się w taki sposób, że stała Boltzmanna jest równa jedności.
Zależność temperatury od energii
W jednorodnym gazie doskonałym w temperaturze absolutnej energia na każdy stopień swobody translacji wynosi, jak wynika z rozkładu Maxwella, . W temperaturze pokojowej (300°C) energia ta wynosi J, czyli 0,013 eV. W jednoatomowym gazie doskonałym każdy atom ma trzy stopnie swobody odpowiadające trzem osiom przestrzennym, co oznacza, że każdy atom ma energię .
Znając energię cieplną, możemy obliczyć średnią prędkość kwadratową atomów, która jest odwrotnie proporcjonalna do pierwiastka kwadratowego z masy atomowej. Średnia prędkość kwadratowa w temperaturze pokojowej waha się od 1370 m/s dla helu do 240 m/s dla ksenonu. W przypadku gazu molekularnego sytuacja staje się bardziej skomplikowana, np. gaz dwuatomowy ma około pięciu stopni swobody.
Definicja entropii
Entropię układu termodynamicznego definiuje się jako logarytm naturalny liczby odrębnych mikrostanów odpowiadających danemu stanowi makroskopowemu (na przykład stanowi o danej energii całkowitej).
Współczynnik proporcjonalności jest stałą Boltzmanna. To wyrażenie, które określa związek między stanami mikroskopowymi () i makroskopowymi (), wyraża centralną ideę mechaniki statystycznej.
Zobacz też
Notatki
Fundacja Wikimedia. 2010.
Zobacz, co oznacza „stała Boltzmanna” w innych słownikach:
- (symbol k), stosunek uniwersalnej stałej GAZU do LICZBY AVOGADRO, równy 1,381,10 23 dżuli na stopień Kelvina. Wskazuje związek pomiędzy energią kinetyczną cząstki gazu (atomu lub cząsteczki) a jej temperaturą bezwzględną.... ... Naukowy i techniczny słownik encyklopedyczny
Stała Boltzmanna- - [A.S. Goldberg. Angielsko-rosyjski słownik energii. 2006] Zagadnienia energetyczne ogólnie EN Stała Boltzmanna ... Przewodnik tłumacza technicznego
Stała Boltzmanna- Stała Boltzmanna Stała Boltzmanna Stała fizyczna określająca związek pomiędzy temperaturą i energią. Nazwany na cześć austriackiego fizyka Ludwiga Boltzmanna, który wniósł znaczący wkład w fizykę statystyczną, w której ta stała ... Objaśniający słownik angielsko-rosyjski dotyczący nanotechnologii. - M.
Stała Boltzmanna- Bolcmano konstanta statusas T sritis fizika atitikmenys: engl. Stały vok Boltzmanna. Boltzmann Constante, f; Boltzmannsche Konstante, f rus. Stała Boltzmanna, f pranc. Constante de Boltzmann, f… Fizikos terminų žodynas
Zależność S k lnW pomiędzy entropią S a prawdopodobieństwem termodynamicznym W (k stała Boltzmanna). Statystyczna interpretacja drugiej zasady termodynamiki opiera się na zasadzie Boltzmanna: naturalne procesy mają tendencję do przekształcania termodynamiki... ...
- (Rozkład Maxwella Boltzmanna) rozkład równowagowy cząstek gazu doskonałego według energii (E) w polu sił zewnętrznych (na przykład w polu grawitacyjnym); wyznacza się rozkładem f e E/kT, gdzie E jest sumą energii kinetycznej i potencjalnej... Wielki słownik encyklopedyczny
Nie mylić ze stałą Boltzmanna . Stała Stefana Boltzmanna (także stała Stefana), stała fizyczna będąca stałą proporcjonalności w prawie Stefana Boltzmanna: całkowita energia emitowana na jednostkę powierzchni... Wikipedia
Wartość stałej Wymiar 1,380 6504(24)×10−23 J K−1 8,617 343(15)×10−5 eV K−1 1,3807×10−16 erg K−1 Stała Boltzmanna (k lub kb) stała fizyczna, która definiuje związek pomiędzy temperaturą a energią. Nazwany na cześć austriackiej... ...Wikipedii
Funkcja rozkładu równowagi statystycznej nad pędami i współrzędnymi cząstek gazu doskonałego, których cząsteczki są zgodne z klasyką. mechanika, w zewnętrznym polu potencjału: Tutaj stała Boltzmanna (stała uniwersalna), bezwzględna... ... Encyklopedia matematyczna
Książki
- Wszechświat i fizyka bez „ciemnej energii” (odkrycia, pomysły, hipotezy). W 2 tomach. Tom 1, OG Smirnov. Książki poświęcone są problemom fizyki i astronomii istniejącym w nauce od dziesiątek i setek lat od G. Galileusza, I. Newtona, A. Einsteina po dzień dzisiejszy. Najmniejsze cząstki materii oraz planety, gwiazdy i...