Cum se măsoară constanta? Constanta lui Boltzmann joacă un rol major în mecanica statică
Ca știință cantitativă exactă, fizica nu se poate lipsi de un set de constante foarte importante care sunt incluse ca coeficienți universali în ecuații care stabilesc relații între anumite cantități. Acestea sunt constante fundamentale, datorită cărora astfel de relații devin invariante și sunt capabile să explice comportamentul sistemelor fizice la diferite scări.
Printre astfel de parametri care caracterizează proprietățile inerente materiei Universului nostru se numără constanta Boltzmann, mărime inclusă într-un număr dintre cele mai importante ecuații. Cu toate acestea, înainte de a trece la o analiză a trăsăturilor și semnificației sale, nu se poate să nu spună câteva cuvinte despre omul de știință al cărui nume îl poartă.
Ludwig Boltzmann: realizări științifice
Unul dintre cei mai mari oameni de știință ai secolului al XIX-lea, austriacul Ludwig Boltzmann (1844-1906) a adus o contribuție semnificativă la dezvoltarea teoriei cinetice moleculare, devenind unul dintre creatorii mecanicii statistice. El a fost autorul ipotezei ergodice, o metodă statistică în descrierea unui gaz ideal și al ecuației de bază a cineticii fizice. A lucrat mult pe probleme de termodinamică (teorema H a lui Boltzmann, principiul statistic pentru a doua lege a termodinamicii), teoria radiațiilor (legea Stefan-Boltzmann). În lucrările sale, a atins, de asemenea, unele probleme de electrodinamică, optică și alte ramuri ale fizicii. Numele său este imortalizat în două constante fizice, care vor fi discutate mai jos.
Ludwig Boltzmann a fost un susținător convins și consecvent al teoriei structurii atomo-moleculare a materiei. Timp de mulți ani, a trebuit să se lupte cu neînțelegerea și respingerea acestor idei în comunitatea științifică a vremii, când mulți fizicieni considerau atomii și moleculele ca o abstractizare inutilă, în cel mai bun caz un dispozitiv convențional pentru confortul calculelor. O boală dureroasă și atacurile colegilor conservatori l-au provocat pe Boltzmann într-o depresie severă, care, incapabil să suporte, l-a determinat pe remarcabilul om de știință să se sinucidă. Pe monumentul mormânt, deasupra bustului lui Boltzmann, în semn de recunoaștere a meritelor sale, este gravată ecuația S = k∙logW - unul dintre rezultatele muncii sale științifice fructuoase. Constanta k din această ecuație este constanta lui Boltzmann.
Energia moleculelor și temperatura materiei
Conceptul de temperatură servește la caracterizarea gradului de încălzire a unui anumit corp. În fizică, se utilizează o scară de temperatură absolută, care se bazează pe concluzia teoriei cinetice moleculare despre temperatură ca măsură care reflectă cantitatea de energie a mișcării termice a particulelor unei substanțe (adică, desigur, energia cinetică medie a un set de particule).
Atât joule SI, cât și erg utilizate în sistemul CGS sunt unități prea mari pentru a exprima energia moleculelor, iar în practică a fost foarte dificil să se măsoare temperatura în acest fel. O unitate convenabilă de temperatură este gradul, iar măsurarea este efectuată indirect, prin înregistrarea caracteristicilor macroscopice în schimbare ale unei substanțe - de exemplu, volumul.

Cum se leagă energia și temperatura?
Pentru a calcula stările materiei reale la temperaturi și presiuni apropiate de normal, se folosește cu succes modelul unui gaz ideal, adică unul a cărui dimensiune moleculară este mult mai mică decât volumul ocupat de o anumită cantitate de gaz și distanța dintre particulele depășesc semnificativ raza interacțiunii lor. Pe baza ecuațiilor teoriei cinetice, energia medie a unor astfel de particule este determinată ca E av = 3/2∙kT, unde E este energia cinetică, T este temperatura și 3/2∙k este coeficientul de proporționalitate introdus de Boltzmann. Numărul 3 caracterizează aici numărul de grade de libertate a mișcării de translație a moleculelor în trei dimensiuni spațiale.
Valoarea k, care a fost numită mai târziu constanta Boltzmann în onoarea fizicianului austriac, arată cât de mult dintr-un joule sau erg conține un grad. Cu alte cuvinte, valoarea sa determină cât de mult crește statistic energia mișcării haotice termice a unei particule dintr-un gaz ideal monoatomic, în medie, cu o creștere a temperaturii cu 1 grad.

De câte ori este un grad mai mic decât un joule?
Valoarea numerică a acestei constante poate fi obținută în diferite moduri, de exemplu, prin măsurarea temperaturii și presiunii absolute, folosind ecuația gazului ideal sau folosind un model de mișcare brownian. Derivarea teoretică a acestei valori la nivelul actual de cunoștințe nu este posibilă.
Constanta lui Boltzmann este egală cu 1,38 × 10 -23 J/K (aici K este kelvin, un grad pe scara de temperatură absolută). Pentru un grup de particule dintr-un mol de gaz ideal (22,4 litri), coeficientul care raportează energia la temperatură (constanta universală a gazului) se obține prin înmulțirea constantei lui Boltzmann cu numărul lui Avogadro (numărul de molecule dintr-un mol): R = kN A și este 8,31 J/(mol∙kelvin). Cu toate acestea, spre deosebire de aceasta din urmă, constanta Boltzmann este mai universală în natură, deoarece este inclusă în alte relații importante și servește și la determinarea unei alte constante fizice.
Distribuția statistică a energiilor moleculare
Deoarece stările macroscopice ale materiei sunt rezultatul comportării unei colecții mari de particule, ele sunt descrise folosind metode statistice. Acesta din urmă include, de asemenea, aflarea modului în care sunt distribuiți parametrii energetici ai moleculelor de gaz:
- Distribuția maxwelliană a energiilor (și vitezelor) cinetice. Ea arată că într-un gaz aflat în stare de echilibru, majoritatea moleculelor au viteze apropiate de viteza cea mai probabilă v = √(2kT/m 0), unde m 0 este masa moleculei.
- Distribuția Boltzmann a energiilor potențiale pentru gazele situate în câmpul oricăror forțe, de exemplu, gravitația Pământului. Depinde de relația dintre doi factori: atracția către Pământ și mișcarea termică haotică a particulelor de gaz. Ca urmare, cu cât energia potențială a moleculelor este mai mică (mai aproape de suprafața planetei), cu atât concentrația acestora este mai mare.

Ambele metode statistice sunt combinate într-o distribuție Maxwell-Boltzmann care conține un factor exponențial e - E/ kT, unde E este suma energiilor cinetice și potențiale, iar kT este energia medie deja cunoscută a mișcării termice, controlată de constanta Boltzmann.
Constanta k și entropia
Într-un sens general, entropia poate fi caracterizată ca o măsură a ireversibilității unui proces termodinamic. Această ireversibilitate este asociată cu disiparea - disiparea - energiei. În abordarea statistică propusă de Boltzmann, entropia este o funcție a numărului de moduri în care un sistem fizic poate fi realizat fără a-și schimba starea: S = k∙lnW.
Aici constanta k specifică scara creșterii entropiei cu o creștere a acestui număr (W) de opțiuni de implementare a sistemului sau microstări. Max Planck, care a adus această formulă în forma ei modernă, a sugerat să dea constantei k numele Boltzmann.

Legea radiației Stefan-Boltzmann
Legea fizică care stabilește modul în care luminozitatea energetică (puterea radiației pe unitatea de suprafață) a unui corp absolut negru depinde de temperatura acestuia are forma j = σT 4, adică corpul emite proporțional cu puterea a patra a temperaturii sale. Această lege este folosită, de exemplu, în astrofizică, deoarece radiația stelelor este apropiată ca caracteristici de radiația corpului negru.
În această relație există o altă constantă, care controlează și amploarea fenomenului. Aceasta este constanta Stefan-Boltzmann σ, care este de aproximativ 5,67 × 10 -8 W/(m 2 ∙K 4). Dimensiunea sa include kelvins - ceea ce înseamnă că este clar că constanta Boltzmann k este implicată și aici. Într-adevăr, valoarea lui σ este definită ca (2π 2 ∙k 4)/(15c 2 h 3), unde c este viteza luminii și h este constanta lui Planck. Deci constanta Boltzmann, combinată cu alte constante ale lumii, formează o cantitate care conectează din nou energia (puterea) și temperatura - în acest caz în raport cu radiația.

Esența fizică a constantei Boltzmann
S-a menționat deja mai sus că constanta lui Boltzmann este una dintre așa-numitele constante fundamentale. Ideea nu este doar că ne permite să stabilim o legătură între caracteristicile fenomenelor microscopice la nivel molecular și parametrii proceselor observate în macrocosmos. Și nu numai că această constantă este inclusă într-o serie de ecuații importante.
În prezent nu se știe dacă există vreun principiu fizic pe baza căruia ar putea fi derivat teoretic. Cu alte cuvinte, nu rezultă din nimic că valoarea unei constante date ar trebui să fie exact aceea. Am putea folosi alte cantități și alte unități în loc de grade ca măsură a conformității cu energia cinetică a particulelor, atunci valoarea numerică a constantei ar fi diferită, dar ar rămâne o valoare constantă. Alături de alte mărimi fundamentale de acest fel - viteza limită c, constanta Planck h, sarcina elementară e, constanta gravitațională G - știința acceptă constanta Boltzmann ca un dat al lumii noastre și o folosește pentru o descriere teoretică a fizicului. procesele care au loc în ea.
Boltzmann Ludwig (1844-1906)- mare fizician austriac, unul dintre fondatorii teoriei cinetice moleculare. În lucrările lui Boltzmann, teoria cinetică moleculară a apărut pentru prima dată ca o teorie fizică coerentă din punct de vedere logic. Boltzmann a dat o interpretare statistică a celei de-a doua legi a termodinamicii. A făcut multe pentru a dezvolta și a populariza teoria câmpului electromagnetic a lui Maxwell. Luptător din fire, Boltzmann a apărat cu pasiune necesitatea unei interpretări moleculare a fenomenelor termice și a suportat greul luptei împotriva oamenilor de știință care au negat existența moleculelor.
Ecuația (4.5.3) include raportul constantei universale de gaz R la constanta lui Avogadro N A . Acest raport este același pentru toate substanțele. Se numește constanta Boltzmann, în onoarea lui L. Boltzmann, unul dintre fondatorii teoriei cinetice moleculare.
Constanta lui Boltzmann este:
 (4.5.4)
(4.5.4)
Ecuația (4.5.3) ținând cont de constanta Boltzmann se scrie după cum urmează:
 (4.5.5)
(4.5.5)
Sensul fizic al constantei Boltzmann
Din punct de vedere istoric, temperatura a fost introdusă mai întâi ca mărime termodinamică și a fost stabilită unitatea sa de măsură - grade (vezi § 3.2). După stabilirea conexiunii dintre temperatură și energia cinetică medie a moleculelor, a devenit evident că temperatura poate fi definită ca energia cinetică medie a moleculelor și exprimată în jouli sau ergi, adică în loc de cantitate. T introduceți valoarea T* astfel încât 
Temperatura astfel definită este legată de temperatura exprimată în grade astfel:

Prin urmare, constanta lui Boltzmann poate fi considerată ca o mărime care leagă temperatura, exprimată în unități de energie, cu temperatura, exprimată în grade.
Dependența presiunii gazului de concentrația moleculelor și de temperatură
După ce s-a exprimat E din relația (4.5.5) și substituind-o în formula (4.4.10), obținem o expresie care arată dependența presiunii gazului de concentrația moleculelor și temperatură:
 (4.5.6)
(4.5.6)
Din formula (4.5.6) rezultă că la aceleași presiuni și temperaturi, concentrația moleculelor din toate gazele este aceeași.
Aceasta implică legea lui Avogadro: volume egale de gaze la aceleași temperaturi și presiuni conțin același număr de molecule.
Energia cinetică medie a mișcării de translație a moleculelor este direct proporțională cu temperatura absolută. Factorul de proporționalitate- constanta Boltzmannk = 10 -23 J/K - trebuie să-ți amintești.
§ 4.6. Distribuția Maxwell
Într-un număr mare de cazuri, cunoașterea valorilor medii ale cantităților fizice nu este suficientă. De exemplu, cunoașterea înălțimii medii a oamenilor nu ne permite să planificăm producția de îmbrăcăminte în diferite dimensiuni. Trebuie să știți numărul aproximativ de persoane a căror înălțime se află într-un anumit interval. De asemenea, este important să se cunoască numărul de molecule care au viteze diferite de valoarea medie. Maxwell a fost primul care a descoperit cum puteau fi determinate aceste numere.
Probabilitatea unui eveniment aleatoriu
În §4.1 am menționat deja că pentru a descrie comportamentul unei colecții mari de molecule, J. Maxwell a introdus conceptul de probabilitate.
După cum s-a subliniat în mod repetat, este, în principiu, imposibil de urmărit schimbarea vitezei (sau a impulsului) unei molecule într-un interval mare de timp. De asemenea, este imposibil să se determine cu exactitate vitezele tuturor moleculelor de gaz la un moment dat. Din condițiile macroscopice în care se află un gaz (un anumit volum și temperatură), nu urmează neapărat anumite valori ale vitezelor moleculare. Viteza unei molecule poate fi considerată ca o variabilă aleatorie, care în condiții macroscopice date poate lua valori diferite, așa cum atunci când aruncați un zar puteți obține orice număr de puncte de la 1 la 6 (numărul de laturi ale zarului este şase). Este imposibil de prezis numărul de puncte care vor apărea la aruncarea unui zar. Dar probabilitatea de a rula, să zicem, cinci puncte este determinabilă.
Care este probabilitatea ca un eveniment întâmplător să apară? Să se producă un număr foarte mare N teste (N - numărul de aruncări de zaruri). În același timp, în N" cazuri, a existat un rezultat favorabil al testelor (adică, scăderea unui cinci). Atunci probabilitatea unui eveniment dat este egală cu raportul dintre numărul de cazuri cu un rezultat favorabil și numărul total de încercări, cu condiția ca acest număr să fie cât de mare se dorește:
 (4.6.1)
(4.6.1)
Pentru un zar simetric, probabilitatea oricărui număr ales de puncte de la 1 la 6 este .
Vedem că pe fundalul multor evenimente aleatoare, se dezvăluie un anumit model cantitativ, apare un număr. Acest număr - probabilitatea - vă permite să calculați medii. Deci, dacă aruncați 300 de zaruri, atunci numărul mediu de cinci, după cum urmează din formula (4.6.1), va fi egal cu: 300 = 50 și nu are nicio diferență dacă aruncați același zar de 300 de ori sau de 300. zaruri identice în același timp.
Nu există nicio îndoială că comportamentul moleculelor de gaz într-un vas este mult mai complex decât mișcarea unui zar aruncat. Dar și aici se poate spera să se descopere anumite modele cantitative care fac posibilă calcularea mediilor statistice, dacă problema se pune la fel ca în teoria jocurilor, și nu ca în mecanica clasică. Este necesar să renunțăm la problema insolubilă a determinării valorii exacte a vitezei unei molecule la un moment dat și să încercăm să găsim probabilitatea ca viteza să aibă o anumită valoare.
Conform legii Stefan-Boltzmann, densitatea radiației semisferice integrale E 0 depinde numai de temperatură și variază proporțional cu puterea a patra a temperaturii absolute T:
Constanta Stefan–Boltzmann σ 0 este o constantă fizică inclusă în legea care determină densitatea volumetrică a radiației termice de echilibru a unui corp absolut negru:

Din punct de vedere istoric, legea Stefan-Boltzmann a fost formulata inaintea legii radiatiei lui Planck, din care rezulta ca o consecinta. Legea lui Planck stabilește dependența densității fluxului spectral al radiației E 0 pe lungimea de undă λ și temperatură T:

unde λ – lungimea de undă, m; Cu=2,998 10 8 m/s – viteza luminii în vid; T– temperatura corpului, K;
h= 6,625 ×10 -34 J×s – constanta lui Planck.
Constanta fizica k, egal cu raportul constantei universale a gazului R=8314J/(kg×K) la numărul lui Avogadro N / A.=6,022× 10 26 1/(kg×mol):

Numărul de configurații de sistem diferite de la N particule pentru un anumit set de numere n i(numărul de particule în i-starea căreia îi corespunde energia e i) este proporţională cu valoarea:

Magnitudinea W există o serie de moduri de distribuire N particule după nivelurile de energie. Dacă relația (6) este adevărată, atunci se consideră că sistemul original se supune statisticilor Boltzmann. Set de numere n i, la care numărul W maxim, apare cel mai frecvent și corespunde distribuției cele mai probabile.
Cinetica fizica– teoria microscopică a proceselor în sisteme de neechilibru statistic.
Descrierea unui număr mare de particule poate fi realizată cu succes folosind metode probabilistice. Pentru un gaz monoatomic, starea unui set de molecule este determinată de coordonatele acestora și de valorile proiecțiilor vitezei pe axele de coordonate corespunzătoare. Matematic, aceasta este descrisă de funcția de distribuție, care caracterizează probabilitatea ca o particulă să se afle într-o stare dată:

este numărul așteptat de molecule dintr-un volum d d ale cărui coordonate sunt în intervalul de la +d și ale căror viteze sunt în intervalul de la +d.
Dacă energia potențială medie în timp a interacțiunii moleculelor poate fi neglijată în comparație cu energia lor cinetică, atunci gazul se numește ideal. Un gaz ideal se numește gaz Boltzmann dacă raportul dintre calea liberă a moleculelor din acest gaz și dimensiunea caracteristică a fluxului L desigur, adică

deoarece lungimea traseului este invers proporțională nd 2(n este densitatea numerică 1/m 3, d este diametrul moleculei, m).
mărimea
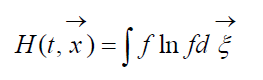
numit H-Funcția Boltzmann pentru o unitate de volum, care este asociată cu probabilitatea detectării unui sistem de molecule de gaz într-o stare dată. Fiecare stare corespunde unui anumit număr de celule de umplere cu șase dimensiuni de viteză spațială în care spațiul de fază al moleculelor luate în considerare poate fi împărțit. Să notăm W probabilitatea ca în prima celulă a spațiului luat în considerare să fie molecule N 1, N 2 în a doua etc.
Până la o constantă care determină originea probabilității, este valabilă următoarea relație:
 ,
,
Unde 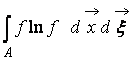 – Funcția H a unei regiuni a spațiului A ocupat de gaz. Din (9) este clar că WȘi H interconectate, adică o modificare a probabilității unei stări duce la o evoluție corespunzătoare a funcției H.
– Funcția H a unei regiuni a spațiului A ocupat de gaz. Din (9) este clar că WȘi H interconectate, adică o modificare a probabilității unei stări duce la o evoluție corespunzătoare a funcției H.

Principiul lui Boltzmann stabilește legătura dintre entropie S sistemul fizic și probabilitatea termodinamică W ea afirmă:

(publicat conform publicației: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Vedere generală a CUBULUI:

unde este forța de masă datorată prezenței diferitelor câmpuri (gravitaționale, electrice, magnetice) care acționează asupra moleculei; J– integrală de coliziune. Acest termen al ecuației Boltzmann ia în considerare ciocnirile moleculelor între ele și modificările corespunzătoare ale vitezelor particulelor care interacționează. Integrala de coliziune este o integrală cinci-dimensională și are următoarea structură:

Ecuația (12) cu integrala (13) a fost obținută pentru ciocnirile de molecule în care nu apar forțe tangențiale, i.e. particulele care se ciocnesc sunt considerate a fi perfect netede.
În timpul interacțiunii, energia internă a moleculelor nu se modifică, adică. se presupune că aceste molecule sunt perfect elastice. Considerăm două grupuri de molecule care au viteze și înainte de a se ciocni între ele (coliziune) (Fig. 1), iar după ciocnire, respectiv, viteze și . Diferența de viteză se numește viteză relativă, adică. . Este clar că pentru o coliziune elastică lină . Funcții de distribuție f 1 ", f", f 1 , f descrieți moleculele grupurilor corespunzătoare după și înainte de ciocniri, i.e. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Orez. 1. Ciocnirea a două molecule.
(13) include doi parametri care caracterizează locația moleculelor care se ciocnesc unul față de celălalt: bşi ε; b– distanța de vizare, de ex. cea mai mică distanță pe care moleculele s-ar apropia în absența interacțiunii (Fig. 2); ε se numește parametrul unghiular de coliziune (Fig. 3). Integrarea s-a terminat b de la 0 la ¥ și de la 0 la 2p (două integrale externe din (12)) acoperă întregul plan de interacțiune a forței perpendicular pe vector

Orez. 2. Traiectoria moleculelor.

Orez. 3. Luarea în considerare a interacțiunii moleculelor într-un sistem de coordonate cilindric: z, b, ε
Ecuația cinetică Boltzmann este derivată în baza următoarelor ipoteze și ipoteze.
1. Se crede că au loc în principal ciocniri a două molecule, adică. rolul ciocnirilor a trei sau mai multe molecule simultan este nesemnificativ. Această ipoteză ne permite să folosim o funcție de distribuție cu o singură particule pentru analiză, care mai sus este numită pur și simplu funcție de distribuție. Luarea în considerare a ciocnirii a trei molecule duce la necesitatea utilizării unei funcții de distribuție a două particule în studiu. În consecință, analiza devine semnificativ mai complicată.
2. Asumarea haosului molecular. Se exprimă prin faptul că probabilitățile de detectare a particulei 1 în punctul de fază și a particulei 2 în punctul de fază sunt independente unele de altele.
3. Ciocnirile de molecule cu orice distanță de impact sunt la fel de probabile, adică. funcția de distribuție nu se modifică la diametrul de interacțiune. De remarcat că elementul analizat trebuie să fie mic astfel încât fîn cadrul acestui element nu se modifică, dar în același timp astfel încât fluctuația relativă ~ să nu fie mare. Potențialele de interacțiune utilizate în calcularea integralei de coliziune sunt simetrice sferic, adică ![]() .
.
Distribuția Maxwell-Boltzmann
Starea de echilibru a gazului este descrisă de distribuția Maxwelliană absolută, care este o soluție exactă a ecuației cinetice Boltzmann:

unde m este masa moleculei, kg.
Distribuția Maxwelliană locală generală, altfel numită distribuție Maxwell-Boltzmann:

în cazul în care gazul se mișcă în întregime cu viteza și variabilele n, T depind de coordonată
și timpul t.
În câmpul gravitațional al Pământului, soluția exactă a ecuației Boltzmann arată:

Unde n 0 = densitatea la suprafața Pământului, 1/m3; g– accelerația gravitațională, m/s 2 ; h– înălțime, m. Formula (16) este o soluție exactă a ecuației cinetice Boltzmann fie în spațiu nelimitat, fie în prezența unor limite care nu încalcă această distribuție, în timp ce temperatura trebuie să rămână și ea constantă.
Această pagină a fost concepută de Puzina Yu.Yu. cu sprijinul Fundației Ruse pentru Cercetare de bază - proiect Nr. 08-08-00638.
Relația definitorie dintre temperatură și energie. Numit după fizicianul austriac Ludwig Boltzmann, care a adus contribuții majore la fizica statistică, în care această constantă joacă un rol cheie. Valoarea sa experimentală în Sistemul Internațional de Unități (SI) este:
J/.Numerele din paranteze indică eroarea standard în ultimele cifre ale valorii cantității. Constanta lui Boltzmann poate fi obținută din definiția temperaturii absolute și a altor constante fizice. Cu toate acestea, calcularea constantei lui Boltzmann folosind primele principii este prea complexă și imposibil de realizat cu stadiul actual al cunoștințelor. În sistemul natural de unități Planck, unitatea naturală de temperatură este dată astfel încât constanta lui Boltzmann este egală cu unitatea.
Relația dintre temperatură și energie
Într-un gaz ideal omogen la temperatură absolută, energia pentru fiecare grad de libertate de translație este, după cum rezultă din distribuția Maxwell, . La temperatura camerei (300°C) această energie este J, sau 0,013 eV. Într-un gaz ideal monoatomic, fiecare atom are trei grade de libertate corespunzătoare a trei axe spațiale, ceea ce înseamnă că fiecare atom are o energie de .
Cunoscând energia termică, putem calcula viteza pătrată medie a atomilor, care este invers proporțională cu rădăcina pătrată a masei atomice. Viteza pătrată medie la temperatura camerei variază de la 1370 m/s pentru heliu la 240 m/s pentru xenon. În cazul unui gaz molecular, situația devine mai complicată, de exemplu, un gaz diatomic are aproximativ cinci grade de libertate.
Definiţia entropy
Entropia unui sistem termodinamic este definită ca logaritmul natural al numărului de microstări distincte corespunzătoare unei stări macroscopice date (de exemplu, o stare cu o energie totală dată).
Coeficientul de proporționalitate este constanta lui Boltzmann. Această expresie, care definește legătura dintre stările microscopice () și macroscopice (), exprimă ideea centrală a mecanicii statistice.
Vezi si
Note
Fundația Wikimedia. 2010.
Vedeți ce este „constanta lui Boltzmann” în alte dicționare:
- (simbol k), raportul dintre constanta universală a GAZ și NUMĂRUL AVOGADRO, egal cu 1.381.10 23 jouli pe grad Kelvin. Indică relația dintre energia cinetică a unei particule de gaz (atom sau moleculă) și temperatura sa absolută.... ... Dicționar enciclopedic științific și tehnic
constanta Boltzmann- - [A.S. Goldberg. Dicționar energetic englez-rus. 2006] Subiecte energetice în general EN Boltzmann constant... Ghidul tehnic al traducătorului
constanta lui Boltzmann- Constanta Boltzmann Constanta Boltzmann O constantă fizică care definește relația dintre temperatură și energie. Numit după fizicianul austriac Ludwig Boltzmann, care a adus contribuții majore la fizica statistică, în care această constantă ... Dicționar explicativ englez-rus despre nanotehnologie. - M.
constanta Boltzmann- Bolcmano constant statusas T sritis fizika atitikmenys: engl. Boltzmann constantă vok. Boltzmann Constante, f; Boltzmannsche Konstante, f rus. constanta Boltzmann, f pranc. constante de Boltzmann, f … Fizikos terminų žodynas
Relația S k lnW dintre entropia S și probabilitatea termodinamică W (k constantă Boltzmann). Interpretarea statistică a celei de-a doua legi a termodinamicii se bazează pe principiul Boltzmann: procesele naturale tind să transforme termodinamica... ...
- (distribuția Maxwell Boltzmann) distribuția de echilibru a particulelor de gaz ideal prin energie (E) într-un câmp de forță extern (de exemplu, într-un câmp gravitațional); este determinată de funcția de distribuție f e E/kT, unde E este suma energiilor cinetice și potențiale... Dicţionar enciclopedic mare
A nu se confunda cu constanta lui Boltzmann. Constanta lui Stefan Boltzmann (și constanta lui Stefan), o constantă fizică care este constanta de proporționalitate din legea lui Stefan Boltzmann: energia totală emisă pe unitate de suprafață... Wikipedia
Valoarea constantei Dimensiunea 1,380 6504(24)×10−23 J K−1 8,617 343(15)×10−5 eV K−1 1,3807×10−16 erg K−1 Constanta Boltzmann (k sau kb) o constantă fizică care definește relația dintre temperatură și energie. Numit după austriacul... ... Wikipedia
Funcția de distribuție a echilibrului statistic asupra momentului și coordonatele particulelor unui gaz ideal, ale căror molecule se supun celei clasice. mecanică, într-un câmp potențial extern: Aici constanta Boltzmann (constantă universală), absolută... ... Enciclopedie matematică
Cărți
- Universul și fizica fără „energie întunecată” (descoperiri, idei, ipoteze). În 2 volume. Volumul 1, O. G. Smirnov. Cărțile sunt dedicate problemelor de fizică și astronomie care au existat în știință de zeci și sute de ani de la G. Galileo, I. Newton, A. Einstein până în zilele noastre. Cele mai mici particule de materie și planete, stele și...









