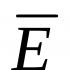Magniy sanoat va inson hayoti uchun muhim metalldir. Magniy
Kuch, joziba, kuch - qadimgi Yunoniston aholisi "magnes" so'zini shunday talqin qilishgan. Bu mamlakatda Magnesiya degan shahar bor edi. Ushbu aholi punktlari yaqinida magnit temir rudasi qazib olindi, ma'lumki, u metall buyumlarni jalb qilish kuchiga ega.
Lekin, metall magniy temir moddasi bo'lgan jins nomidan emas, balki "oq magnesiya" kukuni sharafiga nomlangan. Yunonlar uni qadimgi aholi punkti yaqinida mavjud bo'lgan mineraldan olishgan. Kalsinlashdan keyin tosh oq kukunga aylandi - magniy oksidi. Yunonlar bu moddaning metall ekanligini bilishmagan, ammo ular kompozitsiyaning shifobaxsh xususiyatlarini payqashgan. Bu jigar va buyrak kasalliklariga yordam berdi va laksatif rolini o'ynadi.
Dori ko'p asrlar davomida qo'llanilmadi va 1808 yilda Jeffri Davy tajribalar davomida undan noma'lum metallni ajratib oldi. Angliyalik olim uzoq o'ylamasdan topilgan elementga magniy deb nom berdi. Bu hali ham Evropada shunday deb ataladi. Ruslar buni chaqirishadi metall magniy Hermann Hessning darsligi uchun rahmat. Nemis ildizlariga qaramay, kimyogar rus. 1831-yilda u Gʻarb darsligini tarjima qilgan. Olim "magniy" so'zini "magniy" ga aylantirdi. Element rus fanida shunday nom oldi.
Kimyoviy elementlarning davriy sistemasida Magniy 12-o'rinni egallaydi. U guruhning asosiy kichik guruhida ikkinchi o'rinda joylashgan. Element kumush aks ettirilgan oq rangga ega. Bu rang stronsiy, radiy va bariy bilan bir qatorda magniyni ham o'z ichiga olgan barcha gidroksidi tuproq metallariga xosdir. Bu metallar orasida "paxmoq". Masalan, temir va mis deyarli 5 barobar og'irroqdir. Hatto engil alyuminiy ham idishdagi 12-sonli elementdan ustun turadi.

Magniyning engilligi samolyot dizaynerlari va ishlab chiqaruvchilari uchun foydalidir. Yaxshi uchish xususiyatlariga ega bo'lish uchun ular og'ir bo'lishi shart emas. Biroq, 12-sonli sof metallni bir xil samolyot uchun ishlatish mumkin emas. U juda yumshoq va egiluvchan.
Biz qilishimiz kerak marganets bilan qotishmalar, alyuminiy yoki . Ular ko'p og'irlik qo'shmasdan marganets kuchini beradi. Aralashmalar asosan "temir qushlar" uchun qoplama ishlab chiqarish uchun ishlatiladi. Aytgancha, magniy qotishmalariga asoslangan birinchi samolyot mahalliy samolyot texniklarining ishi edi. Kema 1934 yilda yaratilgan va "Sergo Ordjonekidze" deb nomlangan.
Magniy elementi eritish juda qiyin. Faqat 650 daraja Selsiy talab qilinadi. Biroq, allaqachon 550 da metall alangalanadi va atmosferada eriydi. Ishlab chiqarilgan olov juda ta'sirli, shuning uchun metall pirotexnika sanoatida qo'llanilishini topdi.
Birorta ham otashin yoki uchqun busiz tugamaydi. Agar magniy uyda saqlansa, uning yonida oqartirgichni to'kib tashlamaslik yaxshiroqdir. Xlor borligida 12-element 25 daraja haroratda ham yonadi.

Magniyning yonish mahsulotlari ultrabinafsha nurlar va issiqlikdir. Hatto bir necha gramm metall 200 mililitr suvni qaynatish uchun etarli. Bu choy ichish uchun etarli. Varshavalik olimlar elementni ovqatni isitish uchun "majburlash" ga qaror qilishdi. Fiziklar ularni konserva idishlariga yasadilar magniy lentasi. Idish ochilganda, qo'shimchalar yonib, idishning tarkibini isitadi. Mana, tayyor tushlik.
O'z-o'zidan isitiladigan qutilar ming yillar davomida ishlab chiqarilgan. Magniy konlari chuqurlikda atigi 7 ta element zahiralari bilan raqobatlashadi. Faqat ko'proq kremniy, kislorod, temir, alyuminiy va kaltsiy bor. 12-raqamli metall ikki yuzta mineralning bir qismidir. Element karnallitdan sanoat miqyosida olinadi.
Magniy, shuningdek, magmaning asosiy tarkibiy qismi, sayyora yadrosi va uning yuzasi orasidagi issiq qatlamdir. Dengiz suvida 12-sonli element har bir kubometr uchun 4 kilogrammni o'z ichiga oladi.
Agar okean suvi kukunga ezilgan qobiqlar bilan aralashsa, natija bo'ladi magniy xlorid. Undan elektroliz yo'li bilan sof metallni ajratib olish mumkin. Ammo bu usul faqat Ikkinchi Jahon urushi paytida qo'llanilgan. Biz 12-sonli 100 ming tonnaga yaqin elementni qazib oldik va tinchlandik, chunki dengiz resurslarini ulkan tanklarda qayta ishlash mashaqqatli ish.
Magniyning asosiy iste'molchilaridan biri bo'lgan metallurgiya uchun er qobig'ida etarli zaxiralar mavjud. Metall deyarli barcha qotishmalarni ishlab chiqarishda zarur. 12-sonli element ulardagi kislorod miqdorini kamaytiradi, bu esa mahsulot sifatini keskin yomonlashtiradi. Magniyni har qanday qotishmaning bir qismiga aylantirish oson emas. Yengilligi tufayli u boshqa metallarda cho'kmaydi. Havoga "portlovchi reaktsiya" tufayli aralashmalar yuzasida yonib ketadi.

Metallurglar injiq metallni briketlarga bosishlari, ularning ichiga og'irliklarni qo'yishlari va shundan keyingina ularni qayta eritish uchun tarkibga tushirishlari kerak.
Magniyning yengilligi o'ziga tortdi va. Buyumlarni engilroq qilish uchun ular qimmatbaho qotishmalarga element qo'shadilar. Agar bezak katta hajmli va ta'sirchan o'lchamlarga ega bo'lsa, bu juda foydali. Har kim ham zargarlik buyumlari uchun aql bovar qilmaydigan og'irlikni ko'tarishni xohlamaydi. Magniy yordamga keladi.
Ammo, agar magniysiz zargarlik buyumlarini yasash mumkin bo'lsa, unda hayot yo'q. Metall magniy xlorofill tarkibiga kiradi. U o'simliklarning bir qismi, fotosintez uchun javob beradigan moddadir. Ya'ni, 12-sonli elementsiz karbonat angidridni kislorodga aylantirish jarayoni mumkin emas edi. Sayyora atmosferasi boshqacha bo'lar edi, shuning uchun agar unda magniy bo'lmasa, insoniyat Yerda paydo bo'lishi qiyin edi.
Bu metall nafaqat kislorod bilan ta'minlabgina qolmay, balki inson yuragi urishiga ham yordam beradi. Magniy muhim ahamiyatga ega yurak mushaklarining barqaror ishlashi uchun. Statistik ma'lumotlarga ko'ra, yurak xurujlari asosan tanasida 12-sonli element etarli bo'lmagan odamlarda sodir bo'ladi. Shuning uchun qovoq urug'i, kepak iste'mol qilish, kakao va choy ichish zarar qilmaydi. Bu ovqatlar eng ko'p magniyni o'z ichiga oladi.
Mamlakatimizda boy magnezit konlari O'rta Uralsda (Satkinskoye) va Orenburg viloyatida (Xalilovskoye) joylashgan. Va Solikamsk shahri hududida dunyodagi eng yirik karnallit koni o'zlashtirilmoqda. Magniy o'z ichiga olgan minerallarning eng keng tarqalgani dolomit Donbass, Moskva va Leningrad viloyatlarida va boshqa ko'plab joylarda joylashgan.
Magniy metall ikki usulda ishlab chiqariladi - elektrotermik (yoki metallotermik) va elektrolitik. Nomlardan ko'rinib turibdiki, ikkala jarayon ham elektr energiyasini o'z ichiga oladi. Ammo birinchi holda, uning roli reaktsiya apparatini isitish uchun kamayadi va minerallardan olingan magniy oksidi ba'zi bir qaytaruvchi moddalar, masalan, ko'mir, kremniy, alyuminiy bilan kamayadi. Bu usul juda istiqbolli va yaqinda u tobora ko'proq foydalanilmoqda. Biroq, Mg ishlab chiqarishning asosiy sanoat usuli ikkinchi, elektrolitik hisoblanadi.
Elektrolit - magniy, kaliy va natriyning suvsiz xloridlari eritmasi; temir katodida metall magniy, grafit anodida esa xlor ionlari chiqariladi. Jarayon maxsus elektrolizatorli vannalarda amalga oshiriladi. Eritilgan magniy vannaning yuzasiga suzadi, u erdan vaqti-vaqti bilan vakuumli kepçe bilan chiqariladi va keyin qoliplarga quyiladi. Ammo jarayon shu bilan tugamaydi: bunday magniyda hali ham juda ko'p iflosliklar mavjud. Shuning uchun ikkinchi bosqich muqarrar - Mg ni tozalash. Magniy ikki usulda tozalanishi mumkin - qayta eritish va oqimlar yoki vakuumda sublimatsiya qilish. Birinchi usulning ma'nosi yaxshi ma'lum: maxsus qo'shimchalar - oqimlar - aralashmalar bilan o'zaro ta'sir qiladi va ularni metalldan mexanik ravishda oson ajratiladigan birikmalarga aylantiradi. Ikkinchi usul - vakuumli sublimatsiya - yanada murakkab uskunalarni talab qiladi, ammo uning yordami bilan toza magniy olinadi. Sublimatsiya maxsus vakuumli qurilmalarda - po'lat silindrsimon retortlarda amalga oshiriladi. "Qo'pol" metall retortning pastki qismiga joylashtiriladi, yopiladi va havo pompalanadi. Keyin retortning pastki qismi isitiladi, yuqori qismi esa doimiy ravishda tashqi havo bilan sovutiladi. Yuqori harorat ta'sirida magniy sublimatsiyalanadi - u suyuqlik holatini chetlab o'tib, gazsimon holatga o'tadi. Uning bug'i ko'tariladi va retortning yuqori qismidagi sovuq devorlarda kondensatsiyalanadi. Shu tarzda 99,99% dan ortiq magniyni o'z ichiga olgan juda sof metallni olish mumkin.
Neptun shohligidan
Ammo nafaqat er qobig'i magniyga boy - okeanlar va dengizlarning ko'k omborlarida deyarli tugamaydigan va doimiy ravishda to'ldiriladigan zaxiralar saqlanadi. Dengiz suvining har bir kubometrida taxminan 4 kg magniy mavjud. Bu elementning jami 64016 tonnadan ortigʻi jahon okeani suvlarida erigan.
Magniy qazib olish
Magniy dengizdan qanday olinadi? Dengiz suvi katta idishda dengiz chig'anoqlaridan tayyorlangan ohak suti bilan aralashtiriladi. Bu quritilgan va magniy xloridga aylanadigan magneziya sutini ishlab chiqaradi. Xo'sh, keyin elektrolitik jarayonlar o'ynaydi.
Magniyning manbai nafaqat dengiz suvi, balki magniy xlorid o'z ichiga olgan tuzli ko'llarning suvi ham bo'lishi mumkin. Mamlakatimizda bunday ko'llar mavjud: Qrimda - Saki va Sasik-Sivash, Volga mintaqasida - Elton ko'li va boshqalar.
12-sonli element va uning ulanishlari qanday maqsadlarda ishlatiladi?
Magniy juda engil va bu xususiyat uni ajoyib qurilish materialiga aylantirishi mumkin, ammo, afsuski, sof magniy yumshoq va mo'rt. Shuning uchun dizaynerlar magniyni boshqa metallar bilan qotishma shaklida ishlatadilar. Magniyning alyuminiy, sink va marganets bilan qotishmalari ayniqsa keng qo'llaniladi. Komponentlarning har biri umumiy xususiyatlarga o'z hissasini qo'shadi: alyuminiy va sink qotishma kuchini oshiradi, marganets korroziyaga qarshi chidamliligini oshiradi. Xo'sh, magniy haqida nima deyish mumkin? Magniy qotishmani engil qiladi - magniy qotishmasidan tayyorlangan qismlar alyuminiydan 20-30% engilroq va quyma temir va po'latdan 50-75% engilroqdir ... Magniy qotishmalarini yaxshilaydigan, ularning issiqlikka chidamliligi va egiluvchanligini oshiradigan ko'plab elementlar mavjud. ularni oksidlanishga chidamliroq qilish. Bular litiy, berilliy, kaltsiy, seriy, kadmiy, titanium va boshqalar.
Magniy raketasi uchmaydi, lekin...
Ammo, afsuski, "dushmanlar" ham bor - temir, kremniy, nikel; ular qotishmalarning mexanik xususiyatlarini yomonlashtiradi va korroziyaga chidamliligini kamaytiradi.
Magniy qotishmalari keng qo'llaniladi. Aviatsiya va reaktiv texnologiyalar, yadro reaktorlari, dvigatel qismlari, benzin va neft baklari, asboblar, avtomobil kuzovlari, avtobuslar, avtomashinalar, g'ildiraklar, moy nasoslari, jakkammerlar, pnevmatik matkaplar, foto va kinokameralar, durbinlar - bu ilovalarning to'liq ro'yxati emas. magniy qotishmalari.
Magniy metallurgiyada muhim rol o'ynaydi. Ayrim qimmatbaho metallar - vanadiy, xrom, titan, sirkoniy olishda qaytaruvchi sifatida ishlatiladi. Eritilgan quyma temirga kiritilgan magniy uni o'zgartiradi, ya'ni uning tuzilishini yaxshilaydi va mexanik xususiyatlarini oshiradi. O'zgartirilgan temir quyma po'lat zarblarni muvaffaqiyatli almashtiradi. Bundan tashqari, metallurglar po'lat va qotishmalarni deoksidlash uchun magniydan foydalanadilar.
Magniyning xossasi (chang, sim yoki lenta ko'rinishida) - oq, ko'zni qamashtiruvchi olov bilan yoqish - harbiy texnikada yorug'lik va signal chiroqlari, iz o'qlari va snaryadlar, yondiruvchi bombalar ishlab chiqarish uchun keng qo'llaniladi. Fotosuratchilar magniy bilan yaxshi tanish: “Tinchlaning! Men suratga olaman!” - va magniyning yorqin chaqnashi sizni bir lahzaga ko'r qiladi. Biroq, magniy bu rolni kamroq va kamroq o'ynaydi - elektr chiroq "blits" uni deyarli hamma joyda almashtirdi.
Magniyning qo'llanilishi
Va magniy yana bir ulug'vor ishda - quyosh energiyasini to'plashda ishtirok etadi. U quyosh energiyasini o'ziga singdiruvchi va uning yordami bilan karbonat angidrid va suvni odamlar va hayvonlarning oziqlanishi uchun zarur bo'lgan murakkab organik moddalarga (shakar, kraxmal va boshqalar) aylantiruvchi xlorofill tarkibiga kiradi. Xlorofillsiz hayot bo'lmaydi, magniysiz esa xlorofill bo'lmaydi - bu elementning 2% ni o'z ichiga oladi. Bu juda ko'pmi? O'zingiz baho bering: Yerdagi barcha o'simliklarning xlorofillidagi magniyning umumiy miqdori taxminan 100 milliard tonnani tashkil qiladi! 12-sonli element deyarli barcha tirik organizmlarda ham uchraydi.
Agar sizning vazningiz 60 kg bo'lsa, uning taxminan 25 grammi magniydir. Magniyning xizmatlari tibbiyotda keng qo'llaniladi: hamma "Epsom tuzi" MgSO 4 -7H 2 O bilan yaxshi tanish. Og'iz orqali qabul qilinganda u ishonchli va tez ta'sir qiluvchi laksatif bo'lib xizmat qiladi va mushak ichiga yoki tomir ichiga yuborilsa, u engillashtiradi. konvulsiv holatlar va tomirlarning spazmlarini kamaytiradi. Sof magniy oksidi (kuygan magneziya) me'da shirasining kislotaliligini oshirish, yurak urishi va kislota bilan zaharlanish uchun ishlatiladi. Magniy peroksid oshqozon kasalliklari uchun dezinfektsiyalash vositasi sifatida xizmat qiladi.
Ammo tibbiyot faqat magniy birikmalarini qo'llash sohalari bilan chegaralanmaydi. Shunday qilib, magniy oksidi tsement, o'tga chidamli g'isht ishlab chiqarishda va kauchuk sanoatida qo'llaniladi. Magniy peroksid ("Novozon") matolarni oqartirish uchun ishlatiladi. Magniy sulfat toʻqimachilik va qogʻoz sanoatida boʻyash uchun mordan sifatida, magniy xloridning suvdagi eritmasi esa magniy tsement, ksilolit va boshqa sintetik materiallarni tayyorlash uchun ishlatiladi. Magniy karbonat MgCO 3 issiqlik izolyatsion materiallar ishlab chiqarishda ishlatiladi.
Va nihoyat, magniy uchun yana bir keng faoliyat sohasi organik kimyodir. Magniy kukuni alkogol va anilin kabi muhim organik moddalarni suvsizlantirish uchun ishlatiladi. Organomagniy birikmalari ko'plab organik moddalarni sintez qilishda keng qo'llaniladi.
Shunday qilib, magniyning tabiatdagi va xalq xo'jaligidagi faoliyati juda ko'p qirrali. Ammo "u qo'lidan kelgan hamma narsani qildi" deb o'ylaydiganlar to'g'ri emas. Magniyning eng yaxshi roli hali oldinda, deb ishonish uchun barcha asoslar mavjud.
 Magniy o'z ichiga olgan mahsulotlar
Magniy o'z ichiga olgan mahsulotlar - Yo'lakchadagi xomashyo. Agar so'ralsa, magniyni hatto oddiy tosh toshlardan ham olish mumkin: axir, yo'l qoplamasi uchun ishlatiladigan har bir kilogramm toshda taxminan 20 g magniy mavjud. Biroq, hali bunday jarayonga ehtiyoj yo'q - yo'l toshidan magniy juda qimmatga tushadi.
- MAGNIY, IKKINCHI VA ERA. Okeanda qancha magniy bor? Tasavvur qilaylik, bizning eramizning birinchi kunlaridanoq odamlar dengiz suvidan magniyni bir xilda va intensiv ravishda olishni boshladilar va bugungi kunga kelib ushbu elementning barcha suv zaxiralarini tugatdilar. Sizningcha, konchilikning "intensivligi" qanday bo'lishi kerak? Ma'lum bo'lishicha, deyarli 2000 yil davomida har soniyada qazib olish kerak bo'ladi. million tonna! Ammo Ikkinchi Jahon urushi paytida ham, bu metall ishlab chiqarish maksimal darajada bo'lganida, dengiz suvidan yiliga atigi 80 ming tonna magniy olingan (!).
- MAZZLI DORILAR. Statistik ma'lumotlar shuni ko'rsatadiki, issiq iqlimi bo'lgan hududlar aholisi shimoliylarga qaraganda kamroq tez-tez qon tomirlari spazmlarini boshdan kechirishadi. Tibbiyot buni ikkalasining ham ozuqaviy xususiyatlari bilan izohlaydi. Axir, ma'lumki, ma'lum magniy tuzlari eritmalarining tomir ichiga va mushak ichiga infuziyalari spazm va kramplarni engillashtiradi. Meva va sabzavotlar organizmda bu tuzlarning zarur zaxirasini to'plashga yordam beradi. Ayniqsa, o‘rik, shaftoli va gulkaram magniyga boy. U oddiy karam, kartoshka va pomidorda ham mavjud.
- DIQQAT ZARAR QILMANG. Magniy qotishmalari bilan ishlash ba'zan juda ko'p muammolarni keltirib chiqaradi - magniy osongina oksidlanadi. Ushbu qotishmalarni eritish va quyish shlak qatlami ostida amalga oshirilishi kerak - aks holda erigan metall havo bilan aloqa qilishdan olov olishi mumkin.
Magniy mahsulotlarini silliqlash yoki parlatishda changni so'rish moslamasi mashinaning ustiga o'rnatilishi kerak, chunki havoda tarqalgan magniyning mayda zarralari portlovchi aralashmani hosil qiladi.
Biroq, bu magniy bilan har qanday ish yong'in yoki portlash xavfi bilan to'la degani emas. Siz magniyni faqat eritish orqali yoqishingiz mumkin va buni oddiy sharoitda qilish unchalik oson emas - qotishmaning yuqori issiqlik o'tkazuvchanligi gugurt yoki hatto mash'alni quyma mahsulotlarni oq oksid kukuniga aylantirishga imkon bermaydi. Lekin talaş yoki magniyli isitish tasmasi, albatta, juda ehtiyotkorlik bilan ishlov berish kerak.
- KUTISHINGIZ SHART EMAS. An'anaviy radio trubkalari faqat ularning panjaralari 800 ° S ga qadar qizdirilgandan keyin normal ishlay boshlaydi. Har safar radio yoki televizorni yoqsangiz, musiqa yangray boshlaguncha yoki ko‘k ekran miltillaguncha biroz kutishingiz kerak bo‘ladi. Radionaylarning bu kamchiligini bartaraf etish uchun Vrotslav texnologiya universitetining elektrotexnika bo'limining polshalik olimlari lampalarning katodlarini MgO bilan qoplashni taklif qilishdi: bunday lampalar yoqilgandan so'ng darhol ishlay boshlaydi.
- Tuxum qobig'i muammosi. Bir necha yil oldin AQShning Minnesota universiteti olimlari ilmiy tadqiqot ob'ekti sifatida tuxum qobig'ini tanladilar. Ular tarkibida magniy qancha ko'p bo'lsa, qobiq shunchalik kuchli ekanligini aniqlashga muvaffaq bo'lishdi. Bu shuni anglatadiki, tuxum qo'yadigan tovuqlar uchun ozuqa tarkibini o'zgartirish orqali qobiqning mustahkamligini oshirish mumkin. Qishloq xo'jaligi uchun ushbu xulosaning ahamiyatini quyidagi raqamlar bilan baholash mumkin: faqat Minnesota shtatida tuxum jangi tufayli yillik yo'qotishlar million dollardan oshadi. Bu erda hech kim olimlarning bu ishi "la'natga arzimaydi" deb aytmaydi.
- MAGNEZIY VA... YURUK XURMATI. Vengriya olimlari tomonidan hayvonlar ustida olib borilgan tajribalar shuni ko'rsatdiki, organizmda Mg etishmasligi yurak xurujlariga moyillikni oshiradi. Ba'zi itlarga ushbu elementning tuzlariga boy ovqat berildi, boshqalari - kambag'al. Tajriba oxiriga kelib, dietasida magniy kam bo'lgan itlar miokard infarktiga duchor bo'lishdi.
- MAGNIYGA E'tibor bering! Frantsuz biologlari magniy shifokorlarga 20-asrning haddan tashqari ish kabi jiddiy kasalligiga qarshi kurashda yordam berishiga ishonishadi. Tadqiqotlar shuni ko'rsatadiki, charchagan odamlarning qoni sog'lom odamlarnikiga qaraganda kamroq magniyni o'z ichiga oladi va hatto "magniy qoni" ning normadan eng ahamiyatsiz og'ishlari ham izsiz o'tmaydi.
Shuni esda tutish kerakki, odam biron bir sababga ko'ra tez-tez asabiylashsa, tanadagi magniy "yonib ketadi". Shuning uchun asabiy, oson qo'zg'aluvchan odamlarda yurak mushaklari faoliyatidagi buzilishlar ko'proq kuzatiladi.
- MAGNIY KARBONIK VA SUYUK KISLOROD. Suyuq kislorodni saqlash uchun katta idishlar odatda issiqlik yo'qotilishini kamaytirish uchun silindr yoki to'p shaklida tayyorlanadi. Lekin saqlashning yaxshi tanlangan shakli hamma narsa emas. Ishonchli issiqlik izolatsiyasi kerak. Ushbu maqsadlar uchun siz chuqur vakuumdan foydalanishingiz mumkin (Dewar flakonidagi kabi), siz mineral junni ishlatishingiz mumkin, lekin ko'pincha saqlash joyining ichki va tashqi devorlari orasiga bo'shashgan magniy karbonat kukuni quyiladi. Ushbu issiqlik izolatsiyasi ham arzon, ham ishonchli.
Magniy
MAGNIY-men; m.[lat. magniy] Kimyoviy element (Mg), yorqin oq olov bilan yonadigan kumush-oq rangdagi engil, egiluvchan metall. Magniy oksidi. Magniy yorilishi.
◁ Magniy, oh, oh. M rudalar. M. qotishmasi.
magniy(lot. Magniy), davriy sistemaning II guruhining kimyoviy elementi. Novolatdan olingan ism. magnesiya - magnesiya. Kumush metall, juda engil va bardoshli; zichligi 1,74 g/sm 3, t pl 650 ° S. Havoda u himoya oksidi plyonkasi bilan qoplanadi; yondirilgan mayda talaşlar va magniy kukunlari yorqin oq olov bilan yonadi. Yer qobig'ida tarqalishi bo'yicha u elementlar (magnezit, dolomit, karnallit minerallari) orasida 8-o'rinni egallaydi. U asosan engil qotishmalar ishlab chiqarishda, ba'zi metallarni deoksidlash va oltingugurtsizlantirishda, birikmalardan Hf, Ti, U, Zr va boshqa metallarni kamaytirish uchun (metallotermiya), snaryadlar uchun yorug'lik va yondiruvchi kompozitsiyalarning tarkibiy qismi sifatida ishlatiladi. va raketalar.
MAGNIYMAGNIY (lot. Magniy), Mg ("magniy" deb o'qing), Mendeleyev davriy tizimining uchinchi davri IIA guruhining kimyoviy elementi. (sm. MENDELEEV DAVRIY ELEMENTLAR TIZIMI), atom raqami 12, atom massasi 24.305. Tabiiy magniy uchta barqaror nukliddan iborat (sm. NUCLIDE): 24 Mg (og'irligi bo'yicha 78,60%), 25 Mg (10,11%) va 26 Mg (11,29%). Neytral atomning elektron konfiguratsiyasi 1s 2
2s 2
p 6
3s 2
, unga ko'ra barqaror birikmalardagi magniy ikki valentli (oksidlanish darajasi +2). Oddiy magniy moddasi engil, kumushrang-oq, yaltiroq metalldir.
Kashfiyot tarixi
Magniy birikmalari insonga uzoq vaqtdan beri ma'lum. Elementning lotincha nomi Kichik Osiyodagi qadimgi Magnesiya shahri nomidan kelib chiqqan bo'lib, uning atrofida magnezit mineral konlari joylashgan. (sm. MAGNEZIT). Metall magniy birinchi marta 1808 yilda ingliz kimyogari G. Davi tomonidan olingan (sm. DAVY Xamfri). Boshqa faol metallar - natriy, kaliy, kaltsiy kabi, Davy metall magniyni olish uchun elektrolizdan foydalangan. U oq magniyning namlangan aralashmasiga elektroliz qildi (uning tarkibi, aftidan, magniy oksidi MgO va magniy gidroksid Mg (OH) 2) va simob oksidi HgO ni o'z ichiga oladi. Natijada Davy amalgam - simob bilan yangi metall qotishmasini oldi. Simobni distillangandan so'ng, Davy magniy deb atagan yangi metall kukuni qoldi.
Davy tomonidan olingan magniy ancha iflos edi, sof metall magniy birinchi marta 1828 yilda frantsuz kimyogari A. Bussi tomonidan olingan.
Tabiatda bo'lish
Magniy er qobig'idagi eng keng tarqalgan o'nta elementlardan biridir. Og'irligi bo'yicha 2,35% magniyni o'z ichiga oladi. Yuqori kimyoviy faolligi tufayli magniy erkin shaklda topilmaydi, lekin ko'plab minerallar - silikatlar, aluminosilikatlar, karbonatlar, xloridlar, sulfatlar va boshqalar tarkibiga kiradi. Shunday qilib, magniy keng tarqalgan olivin silikatlarida mavjud. (sm. OLIVIN)(Mg,Fe) 2 va serpantin (sm. SERPENTINE) Mg6(OH)8. Asbest kabi magniy o'z ichiga olgan minerallar amaliy ahamiyatga ega (sm. ASBEST (mineral)), magnezit (sm. MAGNEZIT), dolomit (sm. DOLOMIT) MgCO 3 CaCO 3 , bisxofit (sm. BISCHOFIT) MgCl 2 6H 2 O, karnallit (sm. KARNALLIT) KCl MgCl 2 6H 2 O, epsomit (sm. EPSOMIT) MgSO 4 7H 2 O, kainit (sm. KAINIT) KCl·MgSO 4 ·3H 2 O, astraxanit Na 2 SO 4 ·MgSO 4 ·4H 2 O va boshqalar.Magniy dengiz suvida (quruq qoldiqda 4% Mg), tabiiy shoʻr suvlarda va koʻplab yer osti suvlarida uchraydi.
Kvitansiya
Magniy metallini ishlab chiqarishning odatiy sanoat usuli suvsiz magniy xloridlari MgCl 2, natriy NaCl va kaliy KCl aralashmasining eritmasini elektroliz qilishdir. Ushbu eritmada magniy xlorid elektrokimyoviy qaytarilishga uchraydi:
MgCl 2 (elektroliz) = Mg + Cl 2.
Eritilgan metall vaqti-vaqti bilan elektroliz vannasidan chiqariladi va unga magniy o'z ichiga olgan xom ashyoning yangi qismlari qo'shiladi. Shu tarzda olingan magniy tarkibida nisbatan ko'p aralashmalar mavjud - taxminan 0,1%, agar kerak bo'lsa, "xom" magniy qo'shimcha tozalashga duchor bo'ladi. Buning uchun elektrolitik tozalash qo'llaniladi, maxsus qo'shimchalar yordamida vakuumda eritiladi - magniydan aralashmalarni "olib tashlaydigan" oqimlar yoki vakuumda metallni distillash (sublimatsiya). Qayta qilingan magniyning tozaligi 99,999% va undan yuqori darajaga etadi.
Magniy olishning yana bir usuli ishlab chiqilgan - termal. Bunday holda, koks yuqori haroratda magniy oksidini kamaytirish uchun ishlatiladi:
MgO + C = Mg + CO
yoki silikon. Kremniydan foydalanish dolomit CaCO 3 · MgCO 3 kabi xom ashyolardan magniy va kaltsiyni oldindan ajratmasdan magniy olish imkonini beradi. Dolomit ishtirokida quyidagi reaktsiyalar sodir bo'ladi:
CaCO 3 MgCO 3 = CaO + MgO + 2CO 2,
2MgO + 2CaO + Si = Ca 2 SiO 4 + 2Mg.
Termal usulning afzalligi shundaki, u yuqori tozalikdagi magniyni olish imkonini beradi. Magniy olish uchun nafaqat mineral xom ashyo, balki dengiz suvi ham ishlatiladi.
Fizikaviy va kimyoviy xossalari
Magniy metalli olti burchakli kristall panjaraga ega. Erish temperaturasi 650°C, qaynash temperaturasi 1105°C, zichligi 1,74 g/sm 3 (magniy juda yengil metall, faqat kaltsiy va ishqoriy metallar engilroq. (sm. Ishqoriy metallar)). Magniy Mg/Mg 2+ ning standart elektrod potentsiali –2,37 V ni tashkil qiladi. Standart potentsiallar qatorida u natriy orqasida va alyuminiy oldida joylashgan.
Magniy yuzasi MgO oksidining zich plyonkasi bilan qoplangan, bu normal sharoitda metallni keyingi yo'q qilishdan ishonchli himoya qiladi. Faqat metall taxminan 600 ° C dan yuqori haroratgacha qizdirilganda u havoda yonadi. Magniy yorqin nurning emissiyasi bilan yonadi, spektral tarkibi quyoshga yaqin. Shuning uchun, o'tmishda, fotosuratchilar, kam yorug'lik sharoitida, yonayotgan magniy lentasi nurida suratga olingan. Magniy havoda yonganda magniy oksidi MgO ning bo'sh oq kukuni hosil bo'ladi:
2Mg + O 2 = 2MgO.
Magniy nitridi Mg 3 N 2 ham oksid bilan bir vaqtda hosil bo'ladi:
3Mg + N2 = Mg3N2.
Magniy sovuq suv bilan reaksiyaga kirishmaydi (aniqrog'i, reaksiyaga kirishadi, lekin juda sekin), lekin issiq suv bilan reaksiyaga kirishadi va magniy gidroksid Mg(OH) 2 ning bo'sh oq cho'kmasi hosil bo'ladi:
Mg + 2H 2 O = Mg(OH) 2 + H 2.
Agar magniy chizig'i olovga qo'yilsa va bir stakan suvga qo'yilsa, metall yonishda davom etadi. Bunday holda, magniyning suv bilan o'zaro ta'sirida ajralib chiqadigan vodorod darhol havoda yonadi. Magniyning yonishi karbonat angidrid atmosferasida davom etadi:
2Mg + CO 2 = 2MgO + C.
Magniyning suvda ham, karbonat angidrid atmosferasida ham yonish qobiliyati magniy yoki uning qotishmalaridan yasalgan tuzilmalar yonadigan yong'inlarni o'chirishni sezilarli darajada murakkablashtiradi. (sm. magniy oksidi)
Magniy oksidi (sm. magniy oksidi) MgO - suv bilan reaksiyaga kirishmaydigan oq mo'rt kukun. Ilgari u kuygan magnesiya yoki oddiygina magnesiya deb atalgan. Ushbu oksid asosiy xususiyatlarga ega, u turli kislotalar bilan reaksiyaga kirishadi, masalan:
MgO + 2HNO 3 = Mg(NO 3) 2 + H 2 O.
Ushbu oksidga mos keladigan asos Mg(OH) 2 o'rtacha quvvatga ega, ammo suvda amalda erimaydi. Uni, masalan, har qanday magniy tuzi eritmasiga ishqor qo'shish orqali olish mumkin:
2NaOH + MgSO 4 = Mg(OH) 2 + Na 2 SO 4.
Magniy oksidi MgO suv bilan o'zaro ta'sir qilganda ishqor hosil qilmaydi va magniy asosi Mg (OH) 2 ishqoriy xususiyatlarga ega emas, magniy o'zining "o'rtoqlari" - kaltsiy, stronsiy va bariydan farqli o'laroq, gidroksidi tuproq metali emas.
Magniy metall xona haroratida galogenlar bilan, masalan, brom bilan reaksiyaga kirishadi:
Mg + Br 2 = MgBr 2.
Qizdirilganda magniy oltingugurt bilan reaksiyaga kirishib, magniy sulfidini hosil qiladi:
Mg + S = MgS.
Agar magniy va koks aralashmasi inert atmosferada kaltsiylangan bo'lsa, Mg 2 C 3 tarkibidagi magniy karbidi hosil bo'ladi (ta'kidlash kerakki, magniyning guruhdagi eng yaqin qo'shnisi - kaltsiy - shunga o'xshash sharoitda magniyning karbidini hosil qiladi. tarkibi CaC 2). Magniy karbid suv bilan parchalanganda asetilen gomologi hosil bo'ladi - propin C 3 H 4:
Mg 2 C 3 + 4H 2 O = 2Mg(OH) 2 + C 3 H 4.
Shuning uchun Mg 2 C 3 ni magniy propilen deb atash mumkin.
Magniyning xatti-harakati gidroksidi metall litiyning xatti-harakatiga o'xshaydi (sm. LITIY)(davriy jadvaldagi elementlarning diagonal o'xshashligiga misol). Shunday qilib, magniy, litiy kabi, azot bilan reaksiyaga kirishadi (magniyning azot bilan reaktsiyasi qizdirilganda sodir bo'ladi), natijada magniy nitridi hosil bo'ladi:
3Mg + N2 = Mg3N2.
Litiy nitridi singari, magniy nitridi ham suv bilan oson parchalanadi:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3.
Magniy litiyga o'xshaydi, chunki uning karbonati MgCO 3 va fosfat Mg 3 (PO 4) 2 suvda, mos keladigan litiy tuzlari kabi yomon eriydi.
Magniy kaltsiyga o'xshaydi, chunki suvda bu elementlarning eriydigan gidrokarbonatlari mavjudligi suvning qattiqligini aniqlaydi. (sm. suvning qattiqligi). Kaltsiy bikarbonat misolida bo'lgani kabi (moddaga qarang). TO alsiy (sm. KALTSIY)), magniy bikarbonat Mg (HCO 3) 2 dan kelib chiqqan qattiqlik vaqtinchalik. Qaynatilganda magniy bikarbonat Mg(HCO 3) 2 parchalanadi va uning asosiy karbonati magniy gidroksikarbonat (MgOH) 2 CO 3 cho‘kma hosil qiladi:
2Mg(HCO 3) 2 = (MgOH) 2 CO 3 + 3CO 2 + H 2 O.
Suv bug'lari bilan energetik o'zaro ta'sir qiluvchi va uning qatlamidan o'tadigan havo yoki boshqa gazni quritishda yaxshi bo'lgan magniy perxlorat Mg(ClO 4) 2 hali ham amaliy qo'llaniladi. Bunda kuchli kristallgidrat Mg(ClO 4) 2 6H 2 O hosil bo`ladi.Bu moddani vakuumda 300°C atrofida qizdirish orqali yana suvsizlantirish mumkin. Magniy perklorat o'zining qurituvchi xususiyatlariga ko'ra angidron deb ataladi.
Organomagniy birikmalari organik kimyoda katta ahamiyatga ega. (sm. ORGANOMAGNEZIY BIRIKMALARI), tarkibida Mg-C aloqasi mavjud. Ular orasida Grignard reaktivi deb ataluvchi muhim rol o'ynaydi - RMgHal umumiy formulali magniy birikmalari, bu erda R organik radikal va Hal = Cl, Br yoki I. Bu birikmalar o'zaro ta'sir natijasida efir eritmalarida hosil bo'ladi. magniy va tegishli organik halogen RHal va eng turli sintezlar uchun ishlatiladi.
Ilova
Qazib olingan magniyning asosiy qismi turli xil engil magniy qotishmalarini ishlab chiqarish uchun ishlatiladi. Ushbu qotishmalarning tarkibi, magniyga qo'shimcha ravishda, odatda alyuminiy, sink va tsirkonyumni o'z ichiga oladi. Bunday qotishmalar juda kuchli va samolyot ishlab chiqarishda, asbobsozlikda va boshqa maqsadlarda qo'llaniladi.
Metall magniyning yuqori kimyoviy faolligi uni titan, tsirkoniy, vanadiy, uran va boshqalar kabi metallarning magniy-termik ishlab chiqarishda qo'llash imkonini beradi. Bu holda, magniy hosil bo'lgan metallning oksidi yoki ftoridlari bilan reaksiyaga kirishadi, masalan. :
2Mg + TiO 2 = 2MgO + Ti.
2Mg + UF 4 = 2MgF 2 + U.
Ko'pgina magniy birikmalari, ayniqsa uning oksidi, karbonati va sulfati keng qo'llaniladi.
Magniyning biologik roli
Magniy biogen element hisoblanadi (sm. BIOGENIK ELEMENTLAR), barcha organizmlarning to'qimalarida doimo mavjud. U o'simliklarning yashil pigmenti - xlorofill molekulasining bir qismidir. (sm. Xlorofill), mineral almashinuvida ishtirok etadi, organizmdagi ferment jarayonlarini faollashtiradi, o'simliklarning qurg'oqchilikka chidamliligini oshiradi. Bioluminesans Mg + ionlari ishtirokida sodir bo'ladi (sm. BIOLUMINESCENSIYA) va boshqa bir qator biologik jarayonlar. Magniyli o'g'itlar - dolomit uni, kuygan magnesiya va boshqalar amaliyotda keng qo'llaniladi.
Magniy hayvonlar va odamlarning tanasiga oziq-ovqat bilan kiradi. Insonning magniyga bo'lgan kunlik ehtiyoji 0,3-0,5 g.O'rtacha odamning tanasida (tana vazni 70 kg) taxminan 19 g magniy mavjud. Magniy almashinuvining buzilishi turli kasalliklarga olib keladi. Magniy preparatlari tibbiyotda qo'llaniladi - uning sulfati, karbonati, kuygan magneziyasi.
ensiklopedik lug'at. 2009 .
Sinonimlar:Boshqa lug'atlarda "magniy" nima ekanligini ko'ring:
- (yangi lat. magniy, lot. magnesiyadan). Magnesiya asosini tashkil etuvchi kumushsimon metall. Rus tiliga kiritilgan xorijiy so'zlarning lug'ati. Chudinov A.N., 1910. MAGNIY - kumushrang oq rangli yaltiroq metall, juda yorqin oq rangda yonadi... ... Rus tilidagi xorijiy so'zlar lug'ati
- (Magniy), Mg, davriy sistemaning II guruhining kimyoviy elementi, atom raqami 12, atom massasi 24,305; ishqoriy tuproq metallarini nazarda tutadi; erish harorati 650 shC. Xlorofilning bir qismi. Magniy qotishma, yorug'lik va yondiruvchi tarkibiy qismlardan biridir ... ... Zamonaviy ensiklopediya
- (ramz Mg), kumushsimon oq rangdagi metall element, İŞQORLI YER METALlaridan biri. Yer qobig'idagi sakkizinchi eng ko'p element. U birinchi marta 1808 yilda Xamfri DAVY tomonidan ajratilgan. Inson va hayvonlarning oziqlanishida muhim ahamiyatga ega. Magniy har doim ... Ilmiy-texnik entsiklopedik lug'at
Magniy- (Magniy), Mg, davriy sistemaning II guruhining kimyoviy elementi, atom raqami 12, atom massasi 24,305; ishqoriy tuproq metallarini nazarda tutadi; erish nuqtasi 650 ° C. Xlorofilning bir qismi. Magniy qotishma, yorug'lik va yondiruvchi tarkibiy qismlardan biridir ... ... Illustrated entsiklopedik lug'at
MAGNESIY, magnesiyaga qarang. Dahlning tushuntirish lug'ati. IN VA. Dahl. 1863 1866 ... Dahlning tushuntirish lug'ati
- (lat. Magniy) Mg, davriy tizimning II guruhining kimyoviy elementi, atom raqami 12, atom massasi 24,305. Bu nom yangi lotincha magnesiya magnesiyasidan olingan. Kumush metall, juda engil va bardoshli; zichligi 1,74 g/sm³, erish temperaturasi 650.C. Ustida… … Katta ensiklopedik lug'at
Mg (lot. Magniy * a. magniy; n. Magniy; f. magniy; ya'ni. magnesio), kimyoviy. davriy II guruh elementi. Mendeleyev tizimi, at. n. 12, da. m 24.312. Tabiiy M. barqaror izotoplar 24Mg (78,6%), 25Mg (10,11%) va ... ... aralashmasidan iborat. Geologik ensiklopediya
Magniy ikkinchi guruhning asosiy kichik guruhi elementi, kimyoviy elementlar davriy sistemasining uchinchi davri, atom raqami 12. Mg (lot. Magniy) belgisi bilan belgilanadi. Oddiy magniy moddasi (CAS raqami: 7439-95-4) kumush-oq rangdagi engil, egiluvchan metalldir. Tabiatda oʻrtacha tarqalgan. Yonish paytida ko'p miqdorda yorug'lik va issiqlik chiqariladi.
ismning kelib chiqishi
1695 yilda Angliyadagi Epsom bahorining mineral suvidan tuz achchiq ta'mga ega va laksatif ta'sirga ega bo'lgan mineral suvdan ajratilgan. Farmatsevtlar uni achchiq tuz, shuningdek, Epsom yoki Epsom tuzi deb atashgan. Mineral epsomit MgSO 4 · 7H 2 O tarkibiga ega. Elementning lotincha nomi Kichik Osiyodagi qadimgi Magnesiya shahri nomidan kelib chiqqan boʻlib, uning atrofida magnezit mineral konlari joylashgan.
U birinchi marta 1808 yilda ser Humphry Davy tomonidan sof shaklda ajratilgan.
Kvitansiya
Magniy metallini ishlab chiqarishning odatiy sanoat usuli suvsiz magniy xloridlari MgCl 2 (bisxofit), natriy NaCl va kaliy KCl aralashmasining eritmasini elektroliz qilishdir. Magniy xlorid eritmada elektrokimyoviy qaytarilishga uchraydi:
MgCl 2 (elektroliz) = Mg + Cl 2.
Eritilgan metall vaqti-vaqti bilan elektroliz vannasidan chiqariladi va unga magniy o'z ichiga olgan xom ashyoning yangi qismlari qo'shiladi. Shu tarzda olingan magniy tarkibida nisbatan ko'p (taxminan 0,1%) aralashmalar bo'lganligi sababli, agar kerak bo'lsa, "xom" magniy qo'shimcha tozalashga duchor bo'ladi. Buning uchun elektrolitik tozalash, maxsus qo'shimchalar yordamida vakuumda eritish - magniydan aralashmalarni "olib tashlaydigan" oqimlar yoki vakuumda metallni distillash (sublimatsiya) qo'llaniladi. Qayta qilingan magniyning tozaligi 99,999% va undan yuqori darajaga etadi.
Magniy olishning yana bir usuli ishlab chiqilgan - termal. Bunday holda, silikon yoki koks yuqori haroratlarda magniy oksidini kamaytirish uchun ishlatiladi:
MgO + C = Mg + CO
Kremniydan foydalanish dolomit CaCO 3 · MgCO 3 kabi xom ashyolardan magniy va kaltsiyni oldindan ajratmasdan magniy olish imkonini beradi. Dolomit ishtirokida quyidagi reaktsiyalar sodir bo'ladi:
CaCO 3 MgCO 3 = CaO + MgO + 2CO 2,
2MgO + CaO + Si = CaSiO 3 + 2Mg.
Termal usulning afzalligi shundaki, u yuqori tozalikdagi magniyni olish imkonini beradi. Magniy olish uchun nafaqat mineral xom ashyo, balki dengiz suvi ham ishlatiladi.
Jismoniy xususiyatlar
Magniy - olti burchakli panjarali kumush-oq metall, kosmik guruhi P 6 3 / mmc. Oddiy sharoitlarda magniy yuzasi magniy oksidi MgO ning bardoshli himoya plyonkasi bilan qoplangan, u havoda taxminan 600 ° C gacha qizdirilganda vayron bo'ladi, shundan so'ng metall magniy oksidi va nitridi Mg hosil qilish uchun ko'r oq olov bilan yonadi. 3 N 2. Magniyning 20 °C da zichligi 1,737 g/sm³, metallning erish nuqtasi t pl = 651 °C, qaynash nuqtasi t qaynash = 1103 °C, 20 °C da issiqlik o'tkazuvchanligi 156 Vt/ (m K). Yuqori sof magniy egiluvchan, oson bosilgan, o'ralgan va kesishga yaroqli.
Kimyoviy xossalari
Kukunli magniyning kaliy permanganat KMnO 4 bilan aralashmasi portlovchi moddadir.
Issiq magniy suv bilan reaksiyaga kirishadi:
Mg (e'lon qilingan) + H 2 O = MgO + H 2;
Ishqorlar magniyga ta'sir qilmaydi, u kislotalarda oson eriydi va vodorodni chiqaradi:
Mg + 2HCl = MgCl 2 + H 2;
Havoda qizdirilganda magniy oksid hosil qilish uchun yonadi; azot bilan oz miqdorda nitrid ham hosil bo'lishi mumkin:
2Mg + O 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
Magniy birikmalari insonga juda uzoq vaqtdan beri ma'lum. Magnezit (yunoncha Magnhsia oliqV) Fesaliyaning Magnesiya mintaqasida topilgan yumshoq, oq, sovunli mineral (sovuntosh yoki talk) edi. Ushbu mineral kalsinlanganda oq kukun olindi, u oq magnesiya deb nomlandi.
1695 yilda N. Gro Epsom bulog'ining (Angliya) mineral suvini bug'lantirib, achchiq ta'mga ega va laksatif ta'sirga ega (MgSO 4 · 7H 2 O) tuz oldi. Bir necha yil o'tgach, soda yoki kaliy bilan o'zaro ta'sirlashganda, bu tuz magnezit kaltsiylanganda hosil bo'lgan oq, bo'shashgan kukun hosil qiladi.
1808 yilda ingliz kimyogari va fizigi Xamfri Davi katod sifatida simob oksidi bilan ozgina namlangan oq magneziyani elektroliz qilish orqali oq magneziya hosil qila oladigan yangi metall amalgam oldi. U magniy deb ataldi. Davy ifloslangan metallni oldi va sof magniy faqat 1829 yilda frantsuz kimyogari Antuan Bussi (1794-1882) tomonidan ajratilgan.
Magniyning tabiatda tarqalishi va sanoatda olinishi.
Magniy kristall jinslarda erimaydigan karbonatlar yoki sulfatlar shaklida, shuningdek (kamroq mavjud bo'lgan shaklda) silikatlar shaklida mavjud. Uning umumiy tarkibini baholash sezilarli darajada ishlatiladigan geokimyoviy modelga, xususan, vulqon va cho'kindi jinslarning og'irlik nisbatlariga bog'liq. Hozirgi vaqtda 2 dan 13,3% gacha bo'lgan qiymatlar qo'llaniladi. Ehtimol, eng maqbul qiymat 2,76% ni tashkil etadi, bu magniyning ko'pligi bo'yicha kaltsiydan (4,66%) keyin va natriydan (2,27%) va kaliydan (1,84%) oldinda oltinchi o'rinda turadi.
Italiyadagi Dolomitlar kabi yirik er maydonlari asosan dolomit MgCa(CO 3) 2 mineralidan tashkil topgan. Magnezit MgCO 3, epsomit MgSO 4 · 7H 2 O, karnallit K 2 MgCl 4 · 6H 2 O, langbeynit K 2 Mg 2 (SO 4) 3 choʻkindi minerallari ham bor.
Dolomit konlari boshqa ko'plab hududlarda, shu jumladan Moskva va Leningrad viloyatlarida mavjud. Magnezitning boy konlari O'rta Uralda va Orenburg viloyatida topilgan. Solikamsk viloyatida eng yirik karnallit koni o'zlashtirilmoqda. Magniy silikatlari bazalt mineral olivin (Mg,Fe) 2 (SiO 4), sovuntoshi (talk) Mg 3 Si 4 O 10 (OH) 2, asbest (xrizotil) Mg 3 Si 2 O 5 (OH) 4 va slyuda. Spinel MgAl 2 O 4 qimmatbaho toshlarga tegishli.
Ko'p miqdorda magniy dengiz va okeanlar suvlarida va tabiiy sho'r suvlarda uchraydi ( sm. GIDROSFERA KIMYOSI). Ba'zi mamlakatlarda ular magniy ishlab chiqarish uchun xom ashyo hisoblanadi. Dengiz suvidagi metall elementlarning miqdori bo'yicha u natriydan keyin ikkinchi o'rinda turadi. Dengiz suvining har bir kubometrida taxminan 4 kg magniy mavjud. Magniy chuchuk suvda ham mavjud bo'lib, u kaltsiy bilan birga uning qattiqligini aniqlaydi.
Magniy har doim o'simliklarda mavjud, chunki u xlorofilllarning bir qismidir.
Oddiy moddalar va metall magniyning sanoat ishlab chiqarish xususiyatlari.
Magniy kumush-oq yaltiroq metall, nisbatan yumshoq, egiluvchan va egiluvchan. Uning mustahkamligi va qattiqligi quyma namunalar uchun minimal, presslanganlar uchun esa yuqori.
Oddiy sharoitlarda magniy kuchli oksidli plyonka hosil bo'lishi tufayli oksidlanishga chidamli. Biroq, u ko'pchilik metall bo'lmaganlar bilan faol reaksiyaga kirishadi, ayniqsa qizdirilganda. Magniy galogenlar ishtirokida (namlik borligida) yonib, tegishli galogenidlarni hosil qiladi va havoda ko'r-ko'rona yorqin alanga bilan yonib, MgO oksidi va Mg 3 N 2 nitridiga aylanadi:
2Mg (k) + O 2 (g) = 2MgO (k) ; DG° = –1128 kJ/mol
3Mg (k) + N 2 (t) = Mg 3 N 2 (k); DG° = –401 kJ/mol
Past erish nuqtasiga (650 ° C) qaramay, magniyni havoda eritib bo'lmaydi.
150 ° C da 200 atm bosim ostida vodorod ta'sirida magniy MgH 2 gidridini hosil qiladi. Magniy sovuq suv bilan reaksiyaga kirishmaydi, lekin qaynoq suvdan vodorodni siqib chiqaradi va Mg(OH) 2 gidroksidi hosil qiladi:
Mg + 2H 2 O = Mg(OH) 2 + H 2
Reaksiya oxirida hosil bo'lgan magniy gidroksidining to'yingan eritmasining pH qiymati (10,3) muvozanatga to'g'ri keladi:
Ikkinchi holda, uglerod oksidi va magniy bug'ining hosil bo'lgan aralashmasi teskari reaktsiyani oldini olish uchun tezda inert gaz bilan sovutilishi kerak.
Dunyoda magniy ishlab chiqarish yiliga 400 ming tonnaga yaqinlashmoqda. Asosiy ishlab chiqaruvchilar AQSH (43%), MDH davlatlari (26%) va Norvegiya (17%). So'nggi yillarda Xitoy magniy eksportini keskin oshirmoqda. Rossiyada magniyning eng yirik ishlab chiqaruvchilardan biri Berezniki (Perm viloyati)dagi titan-magniy zavodi va Solikamsk magniy zavodi hisoblanadi. Magniy ishlab chiqarish Asbest shahrida ham amalga oshirilmoqda.
Magniy sanoat miqyosida ishlatiladigan eng engil strukturaviy materialdir. Uning zichligi (1,7 g sm-3) alyuminiyning uchdan ikki qismidan kam. Magniy qotishmalarining og'irligi po'latdan to'rt baravar kam. Bundan tashqari, magniy yuqori darajada qayta ishlanadi va har qanday standart metallga ishlov berish usullari (prokatlash, shtamplash, chizish, zarb qilish, payvandlash, lehimlash, perchinlash) yordamida quyilishi va qayta ishlanishi mumkin. Shuning uchun uning asosiy qo'llanilishi engil strukturali metalldir.
Magniy qotishmalarida odatda 90% dan ortiq magniy, shuningdek 2-9% alyuminiy, 1-3% sink va 0,2-1% marganets mavjud. Yuqori haroratlarda (450 ° C gacha) mustahkamlikni saqlash noyob tuproq metallari (masalan, praseodimiyum va neodimiy) yoki toriy bilan qotishmalarda sezilarli darajada yaxshilanadi. Ushbu qotishmalar avtomobil dvigatellari korpuslari, shuningdek, samolyot fyuzelyajlari va qo'nish moslamalari uchun ishlatilishi mumkin. Magniy nafaqat aviatsiyada, balki zinapoyalar, dock yo'laklari, yuk platformalari, konveyerlar va liftlarni ishlab chiqarishda, shuningdek, foto va optik uskunalar ishlab chiqarishda ham qo'llaniladi.
Mexanik xususiyatlarni, payvandlash qobiliyatini va korroziyaga chidamliligini yaxshilash uchun sanoat alyuminiyiga 5% gacha magniy qo'shiladi. Magniy, shuningdek, boshqa metallarni korroziyadan katodli himoya qilish uchun, berilliy, titan, tsirkoniy, gafniy va uran ishlab chiqarishda kislorodni to'xtatuvchi va qaytaruvchi vosita sifatida ishlatiladi. Magniy kukunining oksidlovchi moddalar bilan aralashmasi pirotexnikada yorug'lik va yondiruvchi kompozitsiyalarni tayyorlash uchun ishlatiladi.
Magniy birikmalari.
Magniy uchun ustun oksidlanish darajasi (+2) uning elektron konfiguratsiyasi, ionlanish energiyasi va atom o'lchamlari bilan belgilanadi. Oksidlanish darajasi (+3) mumkin emas, chunki magniy uchun uchinchi ionlanish energiyasi 7733 kJ mol -1 ni tashkil qiladi. Bu energiya, garchi ular asosan kovalent bo'lsa ham, qo'shimcha aloqalar hosil bo'lishi bilan qoplanishi mumkin bo'lganidan ancha yuqori. Oksidlanish holatida (+1) magniy birikmalarining beqarorligi sabablari unchalik aniq emas. Bunday birikmalarning hosil bo'lish entalpiyasini baholash shuni ko'rsatadiki, ular tarkibidagi elementlarga nisbatan barqaror bo'lishi kerak. Magniy (I) birikmalarining barqaror emasligining sababi magniy (II) birikmalarining hosil bo'lishining ancha yuqori entalpiyasidir, bu tez va to'liq nomutanosiblikka olib kelishi kerak:
Mg (k) + Cl 2 (g) = MgCl 2 (k);
D N° arr = –642 kJ/(mol MgCl 2)
2Mg(k) + Cl 2 (g) = 2MgCl(k);
D N° arr = –250 kJ/(2 mol MgCl)
2MgCl(k) = Mg(k) + MgCl 2 (k);
D N° disprop = –392 kJ/(2 mol MgCl)
Agar nomutanosiblikni qiyinlashtiradigan sintetik yo'l topilsa, bunday birikmalarni olish mumkin. Magniy elektrodlarida elektroliz paytida magniy (I) zarralari hosil bo'lishi uchun ba'zi dalillar mavjud. Shunday qilib, magniy anodida NaCl elektrolizi paytida vodorod ajralib chiqadi va anod tomonidan yo'qolgan magniy miqdori +1,3 zaryadga to'g'ri keladi. Xuddi shunday, Na 2 SO 4 ning suvli eritmasini elektroliz qilish jarayonida ajraladigan vodorod miqdori suvning magniy ionlari bilan oksidlanishiga mos keladi, uning zaryadi +1,4 ga to'g'ri keladi.
Ko'pgina magniy tuzlari suvda yaxshi eriydi. Eritma jarayoni engil gidroliz bilan kechadi. Olingan eritmalar zaif kislotali muhitga ega:
2+ + H 2 O + + H 3 O +
Magniyning ko'plab nometallar, jumladan uglerod, azot, fosfor va oltingugurt bilan birikmalari suv bilan qaytarilmas gidrolizlanadi.
Magniy gidrid tarkibi MgH 2 - vodorod atomlari ko'prik bilan polimer. Undagi magniyning koordinatsion soni 4. Bu tuzilish birikmaning termal barqarorligining keskin pasayishiga olib keladi. Magniy gidrid atmosfera kislorodi va suv bilan oson oksidlanadi. Bu reaktsiyalar energiyaning katta chiqishi bilan birga keladi.
Magniy nitridi Mg 3 N 2. Sarg'ish rangli kristallar hosil qiladi. Magniy nitridining gidrolizi ammiak gidratini hosil qiladi:
Mg 3 N 2 + 8H 2 O = 3Mg(OH) 2 + 2NH 3 H 2 O
Agar magniy nitridining gidrolizi ishqoriy muhitda amalga oshirilsa, ammiak gidrat hosil bo'lmaydi, ammo ammiak gazi ajralib chiqadi. Kislotali muhitda gidroliz magniy va ammoniy kationlarining hosil bo'lishiga olib keladi:
Mg 3 N 2 + 8H 3 O + = 3Mg 2+ + 2NH 4 + + 8H 2 O
Magniy oksidi MgO kuygan magneziya deb ataladi. Magnezit, dolomit, asosiy magniy karbonat, magniy gidroksidi, shuningdek, bishofit MgCl 2 · 6H 2 O ni suv bug'lari atmosferasida kuydirish orqali olinadi.
Magniy oksidining reaktivligi u ishlab chiqarilgan haroratga bog'liq. 500-700 ° S da tayyorlangan magniy oksidi engil magneziya deb ataladi. U suyultirilgan kislotalar va suv bilan oson reaksiyaga kirishib, tegishli tuzlar yoki magniy gidroksidi hosil qiladi va havodan karbonat angidrid va namlikni yutadi. 1200-1600 ° S da olingan magniy oksidi og'ir magneziya deb ataladi. U kislota qarshiligi va suvga chidamliligi bilan ajralib turadi.
Magniy oksidi issiqlikka chidamli material sifatida keng qo'llaniladi. U yuqori issiqlik o'tkazuvchanligi va yaxshi elektr izolyatsiyasi xususiyatlari bilan ajralib turadi. Shuning uchun bu birikma mahalliy isitish uchun izolyatsiyalovchi radiatorlarda qo'llaniladi.
Magnesiyaning engil navlari magnezial tsement va uning asosidagi qurilish materiallarini tayyorlash uchun, shuningdek kauchuk sanoatida vulkanizatsiya qiluvchi vosita sifatida ishlatiladi.
Magniy gidroksidi Mg(OH) 2 rangsiz kristallar hosil qiladi. Bu birikmaning eruvchanligi past (20°C da 2·10 –4 mol/l). Ammoniy tuzlari ta'sirida uni eritmaga aylantirish mumkin:
Mg(OH) 2 + 2NH 4 Cl = MgCl 2 + 2NH 3 H 2 O
Magniy gidroksid termal jihatdan beqaror va qizdirilganda parchalanadi:
Mg(OH) 2 = MgO + H 2 O
Sanoat miqyosida magniy gidroksidi dengiz suvi va tabiiy sho'r suvlardan ohak bilan yog'ingarchilik natijasida hosil bo'ladi.
Magniy gidroksidi yumshoq asos bo'lib, u suvli eritma (magneziya suti) shaklida me'da shirasining kislotaliligini kamaytirish uchun keng qo'llaniladi. Bundan tashqari, Mg (OH) 2 yumshoqligiga qaramay, kislotalarni natriy gidroksid NaOH dan 1,37 marta va natriy bikarbonat NaHCO 3 dan 2,85 marta ko'proq neytrallaydi.
Bundan tashqari, magniy oksidi ishlab chiqarish, shakarni qayta ishlash, qozonxonalarda suvni tozalash va tish pastalarining tarkibiy qismi sifatida ishlatiladi.
Magniy karbonat MgCO 3 rangsiz kristallar hosil qiladi. U tabiiy ravishda suvsiz shaklda (magnezit) uchraydi. Bundan tashqari, magniy karbonatning penta-, tri- va monohidratlari ma'lum.
Magniy karbonatning karbonat angidrid yo'qligida eruvchanligi taxminan 0,5 mg / l ni tashkil qiladi. Ortiqcha karbonat angidrid va suv mavjud bo'lganda, magniy karbonat eruvchan bikarbonatga aylanadi va qaynatilganda teskari jarayon sodir bo'ladi. Karbonat va bikarbonat kislotalar bilan reaksiyaga kirishib, karbonat angidridni chiqaradi va tegishli tuzlarni hosil qiladi. Isitilganda magniy karbonat erimasdan parchalanadi:
MgCO 3 = MgO + CO 2
Bu jarayon magniy oksidi ishlab chiqarish uchun ishlatiladi. Bundan tashqari, tabiiy magniy karbonat metall magniy va uning birikmalarini ishlab chiqarish uchun boshlang'ich materialdir. Bundan tashqari, o'g'it sifatida va tuproqning kislotaliligini kamaytirish uchun ishlatiladi.
Suyuq kislorod saqlash tanklarining qo'sh devorlari orasiga bo'sh magniy karbonat kukuni quyiladi. Ushbu issiqlik izolatsiyasi arzon va ishonchli.
Magniy sulfat MgSO 4 suvsiz holatda, shuningdek, turli gidratlar shaklida ma'lum. Tabiatda kizerit MgSO 4 ·H 2 O, epsomit MgSO 4 ·7H 2 O va geksagidrat MgSO 4 ·6H 2 O mavjud.
Tibbiyotda magniy sulfat heptahidrat MgSO 4 · 7H 2 O ishlatiladi, odatda Epsom yoki achchiq tuz deb nomlanadi. Ushbu birikma laksatif ta'sirga ega. Mushak ichiga yoki tomir ichiga infuziyalar bilan magniy sulfat konvulsiv holatlarni engillashtiradi va tomirlarning spazmlarini kamaytiradi.
Magniy sulfat toʻqimachilik va qogʻoz sanoatida boʻyash uchun mordan sifatida, paxta va ipak uchun ogʻirlik beruvchi, qogʻoz toʻldiruvchi sifatida ishlatiladi. U magniy oksidi ishlab chiqarish uchun xom ashyo sifatida xizmat qiladi.
Magniy nitrat Mg(NO 3) 2 rangsiz gigroskopik kristallardir. 20°C da suvda eruvchanligi 100 g ga 73,3 g.Geksagidrat suvli eritmalardan kristallanadi. 90 ° C dan yuqori haroratda u suvsizlanib, monohidratga aylanadi. Keyin suv qisman gidroliz va magniy oksidiga parchalanishi bilan ajralib turadi. Bu jarayon yuqori tozalikdagi magniy oksidi sintezida qo'llaniladi. Magniy nitratdan boshqa metallarning nitratlari, shuningdek, turli xil magniy birikmalari olinadi. Bundan tashqari, magniy nitrat murakkab o'g'itlar va pirotexnik aralashmalarning bir qismidir.
Magniy perklorat Mg(ClO 4) 2 juda gigroskopik rangsiz kristallar hosil qiladi. Suvda (100 g ga 99,6 g) va organik erituvchilarda yaxshi eriydi. Geksagidrat suvli eritmalardan kristallanadi. Magniy perxloratning organik erituvchilardagi konsentrlangan eritmalari va uning qaytaruvchi molekulalar bilan solvatlari portlovchi hisoblanadi.
2-2,5 molekula suvni o'z ichiga olgan qisman gidratlangan magniy perklorat "anhidron" tijorat nomi ostida ishlab chiqariladi. Suvsiz magniy perkloratini olish uchun u vakuumda 200-300 ° S haroratda quritiladi. Bu gazni qurituvchi sifatida ishlatiladi. U nafaqat suv bug'ini, balki ammiak, spirtli bug', aseton va boshqa qutbli moddalarni ham o'zlashtiradi.
Magniy perklorat Fridel-Krafts reaktsiyasida asillanish katalizatori, shuningdek mikrotahlilda oksidlovchi vosita sifatida ishlatiladi.
Magniy ftorid MgF 2 suvda ozgina eriydi (25 ° C da 100 g uchun 0,013 g). Tabiatda selait minerali sifatida uchraydi. Magniy ftorid magniy sulfat yoki oksidni gidroflorik kislota yoki magniy xloridni kaliy yoki ammoniy ftorid bilan reaksiyaga kiritish orqali olinadi.
Magniy ftorid flukslar, stakanlar, keramika, emallar, katalizatorlar, sun'iy slyuda va asbest ishlab chiqarish uchun aralashmalarning bir qismidir. Bundan tashqari, u optik va lazerli materialdir.
Magniy xlorid MgCl 2 sanoat uchun eng muhim magniy tuzlaridan biridir. Uning eruvchanligi 20 ° S da 100 g suv uchun 54,5 g. Magniy xloridning konsentrlangan suvli eritmalari magniy oksidini eritadi. Olingan eritmalardan MgCl 2 mMg(OH) 2 nH 2 O kristallanadi.Bu birikmalar magneziotsementlar tarkibiga kiradi.
Magniy xlorid 1, 2, 4, 6, 8 va 12 ta suv molekulalari bo'lgan kristalli gidratlar hosil qiladi. Haroratning oshishi bilan kristallanish suvi molekulalari soni kamayadi.
Tabiatda magniy xlorid bisxofit MgCl 2 · 6H 2 O, magnezit xlorid MgCl 2 va karnallit minerallari shaklida uchraydi. Dengiz suvida, sho'r ko'llarning sho'r suvlarida va ba'zi er osti sho'rlarida uchraydi.
Suvsiz magniy xlorid metall magniy va magniy oksidi, geksagidrat esa magniy tsementlarini ishlab chiqarishda ishlatiladi. Magniy xloridning suvli eritmasi sovutish suvi va antifriz sifatida ishlatiladi. U aerodromlar, temir yo'llar va kalitlarda muzdan tozalash vositasi bo'lib xizmat qiladi, shuningdek, ko'mir va rudalarning muzlashiga qarshi. Yog'ochni yong'inga chidamli qilish uchun magniy xlorid eritmasi bilan singdirilgan.
Magniy bromid MgBr 2 suvda yaxshi eriydi (20°C da 100 g ga 101,5 g). Suvli eritmalardan -42,7 dan 0,83 ° C gacha dekagidrat shaklida, yuqori haroratlarda - geksagidrat shaklida kristallanadi. U MgB 2 6ROH (R = Me, Et, Pr), MgBr 2 6Me 2 CO, MgBr 2 3Et 2 O, shuningdek MgBr 2 aminlari kabi ko'plab kristall solvatlarni hosil qiladi. n NH 3 ( n = 2–6).
Kompleks magniy birikmalari. Suvli eritmalarda magniy ioni 2+ suv kompleksi shaklida mavjud. Suyuq ammiak kabi suvsiz erituvchilarda magniy ioni erituvchi molekulalari bilan komplekslar hosil qiladi. Bunday eritmalardan odatda magniy tuzlarining solvatlari kristallanadi. MX 4 2- tipidagi bir nechta galoid komplekslari ma'lum, bu erda X halid anionidir.
Murakkab magniy birikmalari orasida magniyning modifikatsiyalangan porfirin komplekslari bo'lgan xlorofillar alohida ahamiyatga ega. Ular yashil o'simliklarda fotosintez uchun juda muhimdir.
Organomagniy birikmalari. Magniy uchun metall-uglerod aloqalarini o'z ichiga olgan ko'plab birikmalar olingan. Ayniqsa Grignard reaktivlari RMgX (X = Cl, Br, I) bo'yicha ko'plab tadqiqotlar olib borilgan.
Grignard reagentlari eng muhim organometalik magniy birikmalari va, ehtimol, eng ko'p ishlatiladigan organometalik reagentlardir. Bu ularning ishlab chiqarish qulayligi va sintetik ko'p qirraliligi bilan bog'liq. Eritmada bu birikmalar harakatlanuvchi muvozanatda bo'lgan turli xil kimyoviy zarralarni o'z ichiga olishi mumkinligi aniqlandi.
Grignard reagentlari odatda kuchli aralashtirish va havo va namlikning to'liq yo'qligida tegishli erituvchida magniy burilishlari suspenziyasiga asta-sekin organik galogenid qo'shish orqali tayyorlanadi. Reaksiya odatda sekin boshlanadi. Uni metall yuzasida himoya qatlamini yo'q qiladigan kichik yod kristali boshlashi mumkin.
Grignard reagentlari spirtlar, aldegidlar, ketonlar, karboksilik kislotalar, esterlar va amidlarni sintez qilish uchun keng qo'llaniladi va uglerod-uglerod aloqalarini, shuningdek, uglerod atomlari va boshqa elementlar (azot, kislorod, oltingugurt va boshqalar) .d.).
R2Mg birikmalari odatda qizdirilganda parchalanadi. Kristal holatida ular alkil guruhlari ko'prikli chiziqli polimerlar tuzilishiga ega. MgMe 2 birikmasi uchuvchan bo'lmagan polimer bo'lib, ~250°C gacha barqaror, uglevodorodlarda erimaydi va efirda ozgina eriydi. MgEt 2 va undan yuqori gomologlar birikmasi MgMe 2 ga juda o'xshaydi, lekin ular past haroratlarda (175-200 ° C) parchalanib, ularning shakllanishiga qarama-qarshi reaktsiyada mos keladigan alken va MgH 2 ni hosil qiladi. MgPh 2 ham ularga o'xshaydi; u benzolda erimaydi, efirda eriydi va MgPh 2 · 2Et 2 O monomer kompleksini hosil qiladi va 280 ° C da parchalanib, Ph 2 va metall magniy hosil qiladi.
Magniyning biologik roli.
Yashil o'simlik barglarida fotosintezda ishtirok etadigan magniy o'z ichiga olgan porfirin komplekslari bo'lgan xlorofillar mavjud.
Magniy hayvonlar organizmidagi biokimyoviy jarayonlarda ham yaqindan ishtirok etadi. Magniy ionlari fosfatlarni konversiyalash, nerv impulslarini uzatish va uglevodlar almashinuvi uchun javob beradigan fermentlarni ishga tushirish uchun zarurdir. Ular kaltsiy ionlari tomonidan boshlangan mushaklar qisqarishida ham ishtirok etadilar.
Bir necha yil oldin AQSHning Minnesota universiteti olimlari tuxum qobig‘i tarkibida magniy qancha ko‘p bo‘lsa, shunchalik kuchliroq bo‘lishini aniqlashdi.
Og'irligi 65 kg bo'lgan kattalar tanasida taxminan 20 g magniy (asosan ionlar shaklida) mavjud. Uning ko'p qismi suyaklarda to'plangan. Hujayra ichidagi suyuqlikda ATP va ADP bilan magniy komplekslari mavjud.
Ushbu element uchun kunlik talab 0,35 g.Monotonli parhez, yashil sabzavotlar va mevalarning etishmasligi, shuningdek, alkogolizm bilan ko'pincha magniy etishmovchiligi paydo bo'ladi. Ayniqsa, o‘rik, shaftoli va gulkaram magniyga boy. U oddiy karam, kartoshka va pomidorda ham mavjud.
Statistik ma'lumotlar shuni ko'rsatadiki, issiq iqlimi bo'lgan hududlar aholisi shimoliylarga qaraganda kamroq tez-tez qon tomirlari spazmlarini boshdan kechirishadi. Buning sababi sovuq hududlarda ovqatlanish odatlari ekanligiga ishoniladi. Ular meva va sabzavotlarni kamroq iste'mol qiladilar, ya'ni ular kamroq magniy oladi.
Frantsuz biologlari tomonidan olib borilgan tadqiqotlar shuni ko'rsatdiki, charchagan odamlarning qonida dam olgan odamlarnikiga qaraganda kamroq magniy mavjud. Magniyga boy parhez shifokorlarga ortiqcha ish kabi jiddiy kasallikka qarshi kurashda yordam berishi kerak, deb ishoniladi.
Elena Savinkina