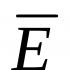Zákon exponenciální spolehlivosti v kinetice inaktivace enzymů. Obecné vlastnosti enzymů Vliv pH na aktivitu slinné amylázy
Relaxační metody jsou založeny na principu, že při rychlém vnějším působení na systém (změna teploty, tlaku atd.) závisí doba, kterou systém potřebuje k dosažení nové rovnováhy (neboli stacionárního stavu), na rychlosti chemické látky. reakce (a někdy na rychlosti difúze činidel .
Uvažujme nejjednodušší reakci komplexace aktivního centra enzymu s ligandem
Na začátku je systém v rovnováze, kterou charakterizuje rovnovážná konstanta K 0 =K(T 0) a podle toho i rovnovážné koncentrace  ,
, ,
, . Předpokládejme, že se teplota v systému prudce mění T->T 0 +T. To vede ke změně rovnovážné konstanty K->K 0 +K, který je určen vztahem
. Předpokládejme, že se teplota v systému prudce mění T->T 0 +T. To vede ke změně rovnovážné konstanty K->K 0 +K, který je určen vztahem
 (2.50)
(2.50)
kde H– standardní změna entalpie. Poté systém přejde do nového rovnovážného stavu:
 (2.51)
(2.51)
 (2.52)
(2.52)
Rovnice (2.51) je nelineární. Předpokládejme, že odchylka od rovnováhy je malá a potom
a rovnice (2.51) se převede na lineární diferenciální rovnici:
Řešení této diferenciální rovnice je:
Velikost
 (2.54)
(2.54)
tzv. relaxační čas.
2.5. Vliv teploty a pH na rychlost enzymatických reakcí
Vliv těchto faktorů na rychlost elementární chemické reakce byl diskutován v 1. kapitole. Zvláštností je, že enzymatické reakce jsou složité vícestupňové reakce (skládající se z mnoha elementárních reakcí). Kromě toho je stav molekul enzymu v roztoku charakterizován sadou konformerů, které se vzájemně reverzibilně transformují. Konformační přechody molekuly jsou dány do značné míry teplotou a pH roztoku.
2.6. Inhibice enzymatických reakcí
Látky, které inhibují katalytickou aktivitu enzymů, se nazývají inhibitory . Existují dvě hlavní třídy inhibitorů - reverzibilní
 (2.55)
(2.55)
(pesticidy, sarin, soman, aspirin atd.)
A nevratné (inaktivátory )
 (2.55)
(2.55)
(oxid uhelnatý, kyanidový iont, analgin atd.)
2.7. Inaktivace enzymů
Biopolymerní molekuly (enzymy) jsou termodynamicky nestabilní a zpravidla v průběhu času mění svou strukturu a vlastnosti. Ve většině případů lze proces inaktivace popsat jako přechod mezi dvěma stavy aktivního enzymu. E A a neaktivní E i :
 (2.56) Kinetiku procesu popisuje odpovídající diferenciální rovnice
(2.56) Kinetiku procesu popisuje odpovídající diferenciální rovnice
 (2.57)
(2.57)
a vyznačuje se časovou konstantou
 (2.58)
(2.58)
Proces inaktivace enzymů může mít různou fyzikálně-chemickou povahu. Nejběžnější je tepelná denaturace, což je výrazná restrukturalizace makromolekuly, změna terciární a částečně sekundární struktury.
Pro účely inaktivace lze použít kavitační ultrazvuk, radioaktivní záření atd.
Změna pH může také vést k denaturaci enzymu. Při každé hodnotě pH je protein charakterizován odpovídajícím rozložením náboje (ionogenní skupiny). Při velmi nízkém nebo velmi vysokém pH může distribuce náboje výrazně polarizovat molekulu, vést ke vzniku izomerů a nevratně ji přizpůsobit destrukci struktury aktivního centra. Například:

Denaturace enzymů je způsobena denaturační činidla ničení sekundární struktury proteinu (například močoviny), stejně jako oxidační procesy zahrnující kyslík.
Při studiu takových procesů se důležité informace získávají relaxačními metodami. Zpravidla jsou konformační změny doprovázeny změnami v prostředí aromatických aminokyselin - tyrosinu a tryptofanu (pásmo absorpce záření při 290 nm). To se projevuje změnami absorpčního a fluorescenčního spektra.
K reverzibilním konformačním změnám dochází obvykle po dobu 0,1-100 ms a nevratné - 1-1000 minut.
Příklad 1. Nejjednodušší kinetické schéma inaktivace s konformerovou rovnováhou:
 (2.59)
(2.59)
Kinetika procesu je popsána jedním charakteristickým časem
 (2.60)
(2.60)
Příklad 2 Oba konformery podléhají inaktivaci:
 (2.61)
(2.61)
 (2.62)
(2.62)
Příklad 3 Obecnější případ pro systém zahrnující n konformátoři:
Enzymy často tvoří dimery v roztoku a jsou stabilnější v dimerní formě. Pak se to pozoruje disociativní inaktivační mechanismus :
 (2.65)
(2.65)
Následující schéma odráží možné mechanismy inaktivace během reakce (monomolekulární inaktivace volné formy enzymu, monomolekulární inaktivace komplexu enzym-substrát, bimolekulární inaktivace enzymu substrátem, bimolekulární inaktivace enzymu produktem) :
 (2.66)
(2.66)
Rozlišení inaktivačních mechanismů a stanovení kinetických charakteristik reakce se obvykle provádí několika metodami:
analyzování závislosti výtěžku produktu na koncentraci enzymu;
stanovení vztahu mezi stupněm konverze substrátu a stupněm inaktivace enzymu;
provedení reakce při nízkém stupni konverze substrátu a nízkých koncentracích enzymu;
provedení reakce při vysokých koncentracích enzymu;
preinkubace enzymu s reakčními složkami;
použití integrálních reakčních rovnic.
Množství enzymu přítomného v tkáních v daném okamžiku je určeno relativní rychlostí jeho syntézy a rozpadu, stejně jako koncentracemi různých typů inhibitorů a aktivátorů. K rozkladu enzymů a poklesu jejich množství v médiu dochází zpravidla pomalu. Inhibice a aktivace enzymů může být provedena poměrně rychle - během několika sekund.
Existuje mnoho metod pro stanovení a vyjádření aktivity jednotlivých enzymů. Je to dáno rozmanitostí enzymů, přítomností a použitím různých substrátů pro stanovení jejich aktivity.
Mezinárodní biochemická unie navrhla následující definici enzymové jednotky: „ Za jednotku jakéhokoli enzymu se považuje množství, které za daných standardních podmínek katalyzuje přeměnu jednoho mikromolu substrátu za minutu. ». Počet mikromolů se bude rovnat počtu standardních jednotek . Mezinárodní komise navrhla, pokud je to možné, aby aktivita enzymu byla stanovena při 30 °C a při hodnotách pH a koncentracích substrátu, které jsou pro aktivitu enzymu optimální.
Jsou běžné vlastnosti enzymů vytékat ven z jejich bílkovinné povahy . Enzymy termolabilní, jejich aktivita závisí na pH a vlhkosti , ve kterém působí, jakož i od vliv aktivátorů a inhibitorů .
Když teplota stoupne na určité hranice, aktivita enzymů se zvýší. Když je dosaženo teploty optimální pro enzym, jeho katalytická aktivita je nejvyšší. Optimální teplota pro mnoho enzymů je nejčastěji v v rozmezí 40 až 50 °C (optimální pro rostlinné enzymy je 50 - 60 °C a pro enzymy živočišného původu - 40 - 50 °C). Optimální teplota však není striktně konstantní a závisí na mnoha důvodech, zejména na délce ohřevu. Čím delší je působení enzymu, tím nižší by měla být optimální teplota. .
V teplotním rozsahu od 0 do 50 °C, se zvýšením nebo snížením teploty o každých 10 °C, se aktivita enzymů zvýší, respektive sníží, 1,4–2krát. Při dalším zahřívání se aktivita enzymů snižuje a při 80 – 100 °C enzymy obvykle zcela ztrácejí své katalytické vlastnosti v důsledku denaturace bílkovin .
Teplota inaktivace (ztráta aktivity) je pro různé enzymy různá. K inaktivaci enzymu amylázy v roztoku tedy dochází při 70 °C, sacharázy - při 59, trypsinu a pepsinu - při 65 °C. V suchém stavu mohou enzymy tolerovat zahřívání na vyšší teploty. Ale při velmi vysokých teplotách dochází okamžitě k inaktivaci enzymů. Pasterizace, sterilizace, blanšírování a vaření ničí enzymy .
Po tepelné inaktivaci některé enzymy obnoví svou katalytickou aktivitu. Příkladem je peroxidáza, která ani při zahřátí po dobu 60 s na 150 °C zcela neztrácí své katalytické vlastnosti. Proto je peroxidáza považována za nejvíce termostabilní enzym.
Při teplotách pod 0 °C se katalytická aktivita enzymů prudce snižuje, ale zůstává zachována i při zmrazení potravin.
Reakce prostředí má významný vliv na katalytickou aktivitu enzymů. Enzymy mění svou rozpustnost, osmotický tlak, viskozitu a další vlastnosti pod vlivem pH prostředí. Věří se, že změny enzymatické aktivity v závislosti na pH prostředí jsou spojeny se změnami ionizace enzymy, substrát nebo komplex enzym-substrát .
Enzymy vykazují optimální aktivitu pouze v rámci určitých limitů pH, které jsou jim vlastní.. Pepsin, který se uvolňuje do vysoce kyselého prostředí žaludku, má tedy optimum aktivity při pH 1,5 a 2,5. Proteázy, které jsou secernovány slinivkou do duodena, mají přitom optimální aktivitu v zóně alkalického pH a optimální působení trypsinu leží v rozmezí pH 8–9. Při hodnotě pH nad nebo pod optimem se aktivita enzymu snižuje .
Většina enzymů je nejaktivnějších v neutrálním, mírně alkalickém nebo mírně kyselém prostředí. Jak se hodnota pH posouvá z optimálního na kyselé nebo zásadité, aktivita enzymů klesá.
Aktivátory a inhibitory(paralyzátory) enzymů mohou odpovídajícím způsobem posílit nebo oslabit a dokonce zastavit jejich činnost. Aktivátory enzymy jsou kovové ionty: Na +, K +, Rb +, Mg 2+, Ca 2+, Cu 2+, Fe 2+ a sloučeniny obsahující sulfhydrylové skupiny: SH, HCN, H 2 S . Přítomnost specifikovaných kovů nebo sloučenin v roztoku v určité koncentraci přispívá k projevu plné aktivity některých enzymů.
Všechny enzymy jsou náchylné k inhibici v důsledku denaturace nebo destrukce enzymového proteinu.
Podstata působení inhibitorů ve většině případů spočívá v tom, že se spojují s aktivními skupinami nebo aktivními centry molekuly enzymu. Rozlišovat obecné a specifické inhibitory . NA obecné inhibitory který inhibuje činnost všech enzymů , zahrnout soli těžkých kovů (olovo, stříbro, rtuť), kyseliny trichloroctové a taninu . Často je inhibice nebo zastavení působení enzymů pod vlivem těžkých kovů reverzibilní a pokud se do média přidají látky, které s těmito kovy tvoří sloučeniny, aktivita enzymů se obnoví.
Specifické inhibitory působí pouze na určité enzymy. Kyselina kyanovodíková tedy působí pouze na oxidační enzymy obsahující železo nebo měď v aktivním centru. Kyselina kyanovodíková se slučuje s kovy a enzym ztrácí aktivitu.
V živé buňce se regulace působení enzymů uskutečňuje nejen pomocí specifických aktivátorů a inhibitorů, ale také vazbou enzymů na různé koloidní struktury protoplazmy. Tato vazba enzymů vede k jejich ztrátě aktivity. Uvolněním enzymu ze sloučeniny se opět obnoví její katalytická aktivita.
Enzymy inaktivován při velmi vysokém tlaku . Po odstranění tlaku však enzymy obnoví svou katalytickou aktivitu.
Působení enzymů je v suchých potravinách značně zpomaleno, ale nezastaví se úplně. Výsledky enzymové aktivity se mohou projevit změnami kvality produktu – jeho ztmavnutím, zhoršením vůně, chuti, konzistence atd.
Rychlost většiny enzymatických reakcí je úměrná koncentraci enzymu, alespoň v nejranějších stádiích. Mimo počáteční fáze se rychlost enzymatických reakcí snižuje.
Enzym tvoří komplex se substrátem, který se disociuje na volný enzym a konečný reakční produkt:
kde E je enzym; S – substrát; ES – komplex enzym-substrát; P – finální produkt.
Množství substrátu je ve srovnání s množstvím enzymu velmi velké, a proto koncentrace substrátu značně ovlivňuje rychlost enzymatických reakcí. Pokud je substrát obsažen ve významném přebytku, je množství vytvořeného produktu úměrné času. S klesající koncentrací substrátu se snižuje množství konečného produktu (P) vytvořeného za jednotku času.
Přítomnost enzymu v roztoku se posuzuje podle jeho působení. Přítomnost amylázy ve slinách lze tedy posuzovat podle schopnosti slin zcukřovat škrob, přítomnosti žaludečního pepsinu – podle schopnosti rozpouštět vaječný bílek nebo fibrin dostatečnou rychlostí.
Regulací aktivity enzymů vytvořením vhodného reakčního prostředí můžete řídit rychlost reakcí, které katalyzují, stejně jako aktivitu enzymů obsažených v potravinářských výrobcích, což umožňuje provádět opatření pro skladování obilí, brambor , ovoce a zeleniny, výroba řady produktů (víno, čaj atd..).
Názvosloví a klasifikace enzymů
V počátečním období rozvoje studia enzymů dostávaly názvy bez specifického systému na základě náhodných charakteristik, názvu substrátu nebo typu katalyzované reakce. Enzym pepsin tedy dostal svůj název z řeckého slova „pepsis“ - trávím, papain - ze šťávy z rostliny papáje, bohaté na enzym. Stávalo se, že jednotliví autoři dali stejnému enzymu různá jména.
V souvislosti s rychlým rozvojem nauky o enzymech – fermentologie, v roce 1961 stálý výbor pro enzymy při Mezinárodní biochemické unii vypracoval moderní názvosloví a klasifikaci enzymů. V souladu s touto klasifikací byl název enzymu složen z chemického názvu substrátu a názvu reakce, kterou enzym provedl. K latinskému názvu kořene substrátu, na který enzym působí (sacharóza - sacharóza), nebo na název procesu katalyzovaného tímto enzymem (hydrolýza - hydrolázy), přidán konec"aza". Spolu s novými názvy mnoha enzymů se dochovaly staré, které se pevně usadily ve vědecké literatuře (pepsin, trypsin, papain atd.).
Podle moderní klasifikace se všechny enzymy dělí na šest třídy: oxidoreduktázy; transferázy; hydrolázy; lyázy; izomerázy; ligázy (syntetázy) . Klasifikace enzymů je založena na povaze jejich působení.
Každá třída je rozdělena do podtříd a každá podtřída je rozdělena do skupin.
Oxidoreduktázy
Jsou to enzymy, které katalyzují redoxních reakcí které se vyskytují v živých organismech. Oxidační reakce látek v organismech jsou vždy doprovázeny redukčními reakcemi. Oxidoreduktázy se dělí na 14 podtříd (nejrozsáhlejší třída enzymů).
Oxidace probíhá jako proces odstraňování vodíku (elektronů) ze substrátu a redukce nastává jako přidávání atomů vodíku (elektronů) k akceptoru. Tato reakce může být schematicky znázorněna následovně:
AN 2 + B = A + VN 2,
kde AN 2 je látka, která daruje svůj vodík a nazývá se donor; B je látka, která odebírá vodík a nazývá se akceptor.
Oxidací může procházet celá řada látek – sacharidy, tuky, bílkoviny, aminokyseliny, vitamíny atd.
Úlohu oxidoreduktáz v živých tkáních plní rozsáhlé skupiny dehydrogenázy A oxidázy , které jsou pojmenovány v závislosti na substrátu, který oxidují. Enzym, který dehydratuje kyselinu jablečnou, se tedy nazývá malátdehydrogenáza, enzym, který dehydrogenuje ethylalkohol, se nazývá alkoholdehydrogenáza atd.
Ve třídě oxidoreduktáz jsou hlavními dehydrogenázy, které provádějí dehydrogenační reakci. Všechny dehydrogenázy se dělí do dvou skupin : anaerobní a aerobní, které se nazývají oxidázy .
Anaerobní dehydrogenázy jsou specifické enzymy, které katalyzují abstrakce vodíku z určitých chemikálií a předáváním dalším enzymům – nosičům vodíku. Tyto dehydrogenázy jsou dvousložkové enzymy, ve kterých se koenzym snadno oddělí od proteinové části. Jako koenzym Anaerobní dehydrogenázy mohou obsahovat dvě látky – nikotin amid adenin nukleotid ( VÝŠE ) nebo nikotin amid adelin nukleotid fosfát ( NADP ). Obě tyto látky mají mimořádně vysoké reaktivní redoxní vlastnosti.
Existuje mnoho známých anaerobních dehydrogenáz, které katalyzují oxidaci různých organických sloučenin. Laktátdehydrogenáza tedy katalyzuje oxidaci kyseliny mléčné na kyselinu pyrohroznovou, isocitrátdehydrogenáza - oxidaci kyseliny isocitronové na kyselinu šťavelovou-jantarovou.
Do skupiny aerobní dehydrogenázy (oxidázy) zahrnují enzymy, které obsahují jako koenzym zahrnuta vitamín B2 , (riboflavin ), proto se takové enzymy nazývají flavin . Flavinové enzymy jsou schopny odstranit vodík z oxidované látky a přenést jej na jiné sloučeniny nebo vzdušný kyslík:
2H202 -> 2H20 + 02.
Odebíráním vodíku z oxidované látky a jejím převáděním na vzdušný kyslík může oxidáza tvořit vodu nebo peroxid vodíku (H 2 O nebo H 2 O 2). Tato skupina enzymů zahrnuje polyfenoloxidázu, askorbátoxidázu a glukózooxidázu.
Polyfenoloxidáza je aerobní dehydrogenáza, pro kterou Akceptorem vodíku je plynný kyslík .
Působí na o-difenoly, polyfenoly, taniny a tyrosin. Polyfenoloxidáza je široce distribuována v houbách a vyšších rostlinách, zejména v listech zeleného čaje. Působení polyfenoloxidázy vysvětluje tmavnutí nakrájené dužiny ovoce a zeleniny, brambor a také tmavnutí čerstvých čajových lístků při rolování. Polyfenoloxidáza hraje důležitou roli jako meziprodukt při dýchání rostlin.
Enzym peroxidáza spolu s polyfenoloxidázou a cytochromoxidázou se aktivně podílí na procesech dýchání rostlin a obranných reakcích rostlin proti rostlinným patogenním mikroorganismům.
Aktivní skupina peroxidázy obsahuje žehlička . Pomocí enzymu peroxidázy kvůli peroxidu vodíku a některých dalších organických peroxidů dochází k oxidaci organických sloučenin. Peroxidáza tvoří komplexní organickou sloučeninu, v důsledku čehož se peroxid aktivuje a získává schopnost působit jako akceptor vodíku:
Mnoho organických sloučenin reaguje se vzdušným kyslíkem a tvoří peroxidy. Peroxidy vznikají obzvláště snadno, když jsou sloučeniny s nenasycenými vazbami oxidovány vzdušným kyslíkem: karotenoidy, nenasycené mastné kyseliny a některé uhlovodíky.
Enzym kataláza katalyzuje proces štěpení peroxidu vodíku na vodu a kyslík:
Molekula katalázy, stejně jako peroxidáza, obsahuje žehlička . Hlavním účelem katalázy v těle je, že ničí peroxid vodíku, který je škodlivý pro buňky, vznikající při dýchání.
Enzym lipoxygenáza katalyzuje tvorbu peroxidů a hydroperoxidů při oxidativním kažení tuků.
Rychlost enzymatické reakce, jinými slovy, aktivita enzymu je také určena přítomností aktivátorů a inhibitorů v médiu: ty první zvyšují rychlost reakce a někdy ji modifikují, ty druhé inhibují reakci. Mezi chemické sloučeniny, které ovlivňují aktivitu enzymů, patří různé látky. HC1 tedy aktivuje působení pepsinu, žlučových kyselin – pankreatické lipázy; některé tkáňové enzymy (oxidoreduktázy, katepsiny, argináza), rostlinné proteinázy papain aj. jsou významně aktivovány sloučeninami obsahujícími volné SH skupiny (glutathion, cystein), některé také vitaminem C. Jako aktivátory často slouží ionty dvojmocné a někdy i monovalentní kovy . Mnoho enzymů není v nepřítomnosti kovů vůbec aktivních. Při odstraňování zinku tedy karboanhydráza prakticky postrádá enzymatickou aktivitu; Navíc při působení tohoto enzymu nelze zinek nahradit žádným jiným kovem. Jsou známy enzymy, jejichž působení je aktivováno řadou kovů, zejména enoláza (viz Metabolismus sacharidů) je aktivována Mg 2+, Mn 2+, K +. V tabulce 18 jsou uvedeny příklady účasti kovů na působení některých enzymů.
| Tabulka 18. Kovy v aktivaci určitých enzymů 1 (1 Obvykle je obtížné stanovit hranici mezi metaloenzymy (kov je komplexně vázaný a nenahraditelný) a enzymy aktivovanými kovy (ty druhé pouze urychlují reakci a snadno disociují).) | |||
| Enzym | Kov | Enzym | Kov |
| Cytochromy | Fe | Amylase | Ca |
| kataláza | Fe | Lipáza | Ca |
| peroxidáza | Fe | Karboanhydráza | Zn |
| Tryptofan oxidáza | Fe | Laktátdehydrogenáza | Zn |
| Homogentisikáza | Fe | Uricaza | Zn |
| askorbátoxidáza | Si | Karboxypeptidáza | Zn |
| tyrosináza | Si | Peptidázy | Mg |
| Fenoloxidáza | Si | Fosfatázy | Mg |
| Xanthin oxidáza | Mo | Fosfoglukokináza | Mg |
| nitrát reduktáza | Mo | argináza | Mn |
| Aldehydoxidáza | Mo | Fosfoglukomutáza | Mn |
| Peptidázy | spol | cholinesteráza | Mn |
Pokud jde o roli kovů v aktivačním působení enzymů, dostupné údaje naznačují, že v některých případech ionty kovů (Co 2+, Mg 2+, Zn 2+, Fe 2+) plní funkce prostetických skupin enzymů. V jiných případech přispívají k připojení substrátu k aktivnímu místu a tvorbě komplexu enzym-substrát. Například Mg 2+ ionty prostřednictvím negativně nabité fosfátové skupiny zajišťují adici monofosforových esterů organických látek do aktivního centra fosfatáz, které katalyzují hydrolýzu těchto sloučenin. V některých případech se kov spojí se substrátem a vytvoří skutečný substrát, na který enzym působí. Zejména Mg 2+ ionty aktivují kreatinfosfokinázu díky tvorbě pravého substrátu a hořečnaté soli ATP. Konečně existují experimentální důkazy o přímé účasti kovů (například Ca 2+ iontů v molekule slinné amylázy) na tvorbě a stabilizaci aktivního centra a celé terciární struktury molekuly enzymu. Je třeba také poznamenat, že kovy často hrají roli jako alosterické modulátory (viz obr. 59). Takový kov (modulátor) interakcí s alosterickým centrem podporuje tvorbu nejvýhodnější prostorové konfigurace enzymu a aktivního komplexu enzym-substrát.
Anionty ve fyziologických koncentracích jsou obvykle neúčinné nebo mají malý aktivační účinek na enzymy. Výjimkou je pepsin, některé oxidoreduktázy aktivované anionty, dále slinná amyláza, která katalyzuje hydrolýzu škrobu, jehož aktivitu zvyšují ionty chloru, a adenylátcykláza, která je aktivována halogenovými anionty.
Inhibitory Je zvykem nazývat látky, které způsobují částečnou nebo úplnou inhibici reakcí katalyzovaných enzymy. Protože enzymy jsou proteiny, jakákoli činidla, která způsobují denaturaci proteinů (teplo, kyseliny, zásady, soli těžkých kovů), vedou k inaktivaci enzymu. Taková inaktivace je však relativně nespecifická. Nesouvisí s mechanismem účinku enzymů. Mnohem větší skupinu tvoří tzv. specifické inhibitory, které působí na jeden enzym nebo skupinu příbuzných enzymů. Výzkum těchto inhibitorů je důležitý z mnoha důvodů.
Za prvé, inhibitory mohou poskytnout cenné informace o povaze aktivního místa enzymu a také o jeho funkčních skupinách a chemických vazbách, které zajišťují tvorbu komplexu enzym-substrát. Jsou známy látky, které specificky vážou jednu nebo druhou skupinu v molekule enzymu, čímž ji vylučují ze sféry chemické reakce. Zejména jodacetát ICH 2 -COOH, jeho amid a ethylester, parachlormerkuribenzoát ClHg - C 6 H 4 -COOH a další činidla poměrně snadno vstupují do chemických vazeb s některými SH skupinami enzymů. Pokud jsou takové skupiny nezbytné pro katalýzu, pak přidání takových inhibitorů vede k úplné ztrátě enzymové aktivity:
R-SH + ICH2-COOH --> HI + R-S-CH2-COOH
Řada dalších enzymů (cholinesteráza, trypsin a chymotrypsin) je silně inhibována určitými organofosforovými sloučeninami, zejména diisopropylfluorfosfátem (DFP), v důsledku blokování klíčové hydroxylové skupiny serinu v aktivním místě (viz výše).
Za druhé, inhibitory našly široké použití v enzymologii při studiu povahy více forem enzymů a izoenzymů, které se neliší ani tak v elektroforetické pohyblivosti, jako v rozdílech v reakcích na stejný inhibitor.
Pomocí inhibitorů, které selektivně vypínají jednotlivé fáze vícestupňového metabolického procesu, lze přesně určit sled chemických reakcí a povahu zúčastněných enzymů. Zejména tímto způsobem byla za použití jodoacetátu, fluoridu a dalších inhibitorů dešifrována glykolytická dráha redoxních přeměn glukózy na kyselinu mléčnou ve svalové tkáni (viz Metabolismus sacharidů), která má 11 stupňů zahrnujících 11 enzymů a 10 intermediárních metabolity.
Mechanismus působení mnoha toxinů a jedů na tělo je založen na inhibici enzymů. Je tedy známo, že v případech otravy kyselinou kyanovodíkovou nastává smrt v důsledku úplné inhibice respiračních enzymů (cytochromoxidázy), zejména mozkových buněk. Toxický účinek některých insekticidů na lidský a zvířecí organismus je způsoben inhibicí aktivity cholinesterázy, enzymu, který hraje primární roli v činnosti nervového systému.
Racionální chemoterapie – vědomé užívání léků v medicíně, by měla být založena na přesné znalosti mechanismu jejich účinku, biosyntézy enzymů nebo jejich práce v organismu. Někdy léčba lidských onemocnění zahrnuje použití selektivních inhibitorů. Inhibitor trypsinu, chymotrypsinu a kalikreinu, trasylol, je tedy široce používán při léčbě akutní pankreatitidy. Selektivní inhibiční účinek některých přírodních a syntetických sloučenin (tzv. antimetabolitů) na enzymy v současnosti slouží jako základ pro vývoj účinných metod syntézy chemoterapeutických léčiv. Tato cesta otevírá široké možnosti regulace jak syntézy enzymů, tak intenzity metabolismu.
Typy inhibice. Přestože mechanismus účinku většiny inhibitorů je nejasný, obvykle se rozlišuje mezi reverzibilní a ireverzibilní inhibicí. Pokud molekula inhibitoru způsobí trvalé změny nebo modifikace funkčních skupin enzymu, pak se tento typ inhibice nazývá ireverzibilní. Častěji však dochází k reverzibilní inhibici, kterou lze kvantitativně studovat na základě Michaelis-Mentenovy rovnice. Reverzibilní inhibice se zase dělí na kompetitivní a nekompetitivní podle toho, zda je možné či nikoli překonat inhibici enzymatické reakce zvýšením koncentrace substrátu. Ve druhém případě zvýšení koncentrace substrátu nemění stupeň inhibice enzymu.
Kompetitivní inhibici mohou způsobit látky, které mají strukturu podobnou substrátu, ale mírně odlišnou od struktury pravého substrátu. Klasickým příkladem tohoto typu inhibice je inhibice aktivity sukcinátdehydrogenázy kyselinou malonovou. Tento enzym katalyzuje oxidaci dehydrogenací kyseliny jantarové na kyselinu fumarovou podle schématu:
Pokud se do média přidá kyselina malonová (inhibitor), pak díky své strukturní podobnosti se skutečným substrátem kyselinou jantarovou (přítomnost dvou stejných ionizovaných karboxylových skupin) bude reagovat s aktivním centrem za vzniku enzymového inhibitoru. komplex (viz diagram), nicméně V tomto případě nedochází k přenosu vodíku z malonátu. Vzhledem k tomu, že struktury substrátu - kyseliny jantarové a inhibitoru - malonátu jsou stále poněkud odlišné, soutěží o vazbu na aktivní místo a stupeň inhibice bude určen poměrem koncentrací malonátu a sukcinátu, a nikoli absolutní koncentrace inhibitoru. Tento typ inhibice se někdy nazývá inhibice metabolického antagonismu (obr. 56).

V obecné formě může být reakce mezi inhibitorem a enzymem reprezentována následující rovnicí:
![]()
Výsledný komplex, nazývaný komplex enzym-inhibitor (EI), na rozdíl od ES, se nerozkládá za vzniku reakčních produktů. Disociační konstantu EI komplexu nebo inhibiční konstantu (K 1) lze podle Michaelis-Mentenovy teorie určit jako poměr konstant zpětných a dopředných reakcí:
![]()
tj. inhibiční konstanta je přímo úměrná součinu koncentrace enzymu a inhibitoru a nepřímo úměrná koncentraci EI komplexu.
Metoda kompetitivní inhibice našla široké uplatnění v lékařské praxi. Je například známo, že sulfonamidová léčiva se používají k léčbě některých infekčních onemocnění způsobených bakteriemi. Ukázalo se, že tyto léky jsou strukturou podobné kyselině para-aminobenzoové, kterou bakteriální buňka využívá k syntéze kyseliny listové, která je nedílnou součástí bakteriálních enzymů. Díky této strukturní podobnosti blokuje například sulfonamid působení enzymu vytěsněním kyseliny para-aminobenzoové z komplexu s enzymem, který syntetizuje kyselinu listovou, což vede k inhibici růstu bakterií.
Některé analogy vitaminu B6 a kyseliny listové, zejména deoxypyridoxin a aminopterin (viz Vitaminy), působí jako kompetitivní, tzv. inhibitory koenzymu (neboli antivitaminy), inhibující mnoho biochemických procesů v těle.
Nekonkurenční inhibice je způsobena látkami, které nemají žádnou strukturní podobnost se substráty a často se nevážou na aktivní centrum, ale jinde v molekule enzymu. Stupeň inhibice je v mnoha případech určen dobou trvání účinku inhibitoru na enzym. Při tomto typu inhibice v důsledku tvorby stabilní kovalentní vazby často dochází k úplné inaktivaci enzymu a poté se inhibice stává nevratnou. Příkladem nekompetitivní inhibice (inaktivace) je působení jodoacetátu, diisopropylfluorfosfátu, ale i diethyl-n-nitrofenylfosfátu a kyseliny kyanovodíkové, které spočívá ve vazbě a vypínání funkčních skupin nebo kovových iontů v molekule enzymu.
K objasnění otázky typu inhibice použijte Michaelis-Mentenovu rovnici, Lineweaver-Burkův graf a další pokročilejší rovnice, například rovnici Edie-Hofsteeho:
v = - Km (0/[S]) + V max
a odpovídající grafy v přímočarých souřadnicích. V níže uvedených grafech vynesených v souřadnicích v a [S] a také v souřadnicích 1/v a 1/[S] je V maximální reakční rychlost, V 1 je maximální rychlost v přítomnosti inhibitoru , K1 je inhibiční konstanta; všechny ostatní symboly byly uvedeny výše.

Je vidět, že u kompetitivního typu inhibice (obr. 57) zvyšuje inhibitor hodnotu K m (o množství rovnající se rozdílu délky segmentů odříznutých od osy x), aniž by to ovlivnilo maximální rychlost. To znamená, že při dostatečně vysoké koncentraci substrátu [S] je inhibitor vytěsněn molekulami substrátu z EI komplexu. Při nekompetitivní inhibici (obr. 58) snižuje inhibitor maximální rychlost. Pokud hodnota K m neklesá, pak hovoříme o zcela nekompetitivní inhibici. K podobnému typu inhibice dochází při tvorbě neaktivních, obtížně disociovatelných komplexů EI a (nebo) EIS. Často však existuje smíšený typ inhibice (někdy nazývaný částečně nekompetitivní typ), kdy je pokles Vmax kombinován se zvýšením Km. To znamená, že EI komplex si zachovává částečnou aktivitu, tj. schopnost tvořit intermediární ternární komplex EIS, ve kterém substrát prochází zpožděnou katalytickou transformací. Ve vzácných případech se může stupeň inhibice enzymové aktivity zvyšovat se zvyšující se koncentrací substrátu; Pro tento typ inhibice byl navržen dosti nepřesný termín nekonkurenční (z anglického uncompetitive). Jedním z mechanismů takové inhibice je možnost kombinace inhibitoru s komplexem ES za vzniku neaktivního nebo pomalu reagujícího ternárního komplexu ESI.
Grafickou analýzou rychlostí enzymatických reakcí jako funkce koncentrací substrátu lze tedy získat cenné informace o kinetice enzymatických reakcí, které osvětlují možný mechanismus enzymatické katalýzy.
Regulace aktivity enzymů
Výše bylo uvedeno, že jednou z jedinečných vlastností živých organismů je úžasná schopnost vyvažovat katabolické (biodegradativní) a anabolické (biosyntetické) procesy. Přestože v buňkách současně probíhají procesy syntézy, rozkladu a vzájemné přeměny stovek a tisíců různých látek, existuje mnoho regulačních mechanismů, které zajišťují stálost vnitřního prostředí těla. Některé z těchto regulačních mechanismů, mezi nimiž hrají důležitou roli mechanismy regulující aktivitu enzymů, budou diskutovány níže.
Vliv zákona hromadné akce. Při reverzibilní chemické reakci katalyzované enzymem, například A + B C + D, bude koncentrace reakčních složek a podle toho i směr reakce regulována vlivem zákona o působení hmoty. Zejména to lze ukázat na reverzibilní transaminační reakci katalyzované alaninaminotransferázou:
Alanin + α-ketoglutarát pyruvát + glutamát.
Tento typ regulace samozřejmě hraje pouze omezenou roli, protože v reálných podmínkách reakce obvykle probíhá jedním směrem, protože výsledné produkty se mohou ukázat jako substráty pro působení jiných enzymů a jsou odstraněny z reakce; v těchto případech je ustaven spíše stabilní (stacionární) stav než skutečná rovnováha.
Změna množství enzymu. U bakterií byl fenomén indukované syntézy enzymů dobře studován, když jsou pěstovány v médiu, kde jediným zdrojem uhlíku a energie je ten či onen sacharid, například glukóza. Nahrazení glukózy v médiu laktózou vede k indukované nebo adaptované (po krátkém období lag fáze) syntéze enzymu galaktosidázy (naprogramované genem pro laktózu, viz Syntéza bílkovin), která štěpí laktózu na glukózu a galaktózu. V živočišných tkáních je takto rychlá syntéza enzymů pozorována relativně méně často a mechanismus indukující syntézu byl studován pouze u malého počtu enzymů (tyrosintransaminázy, serin- a threonindehydratázy, tryptofanpyrroláza atd.). Když se však do těla dostanou některé jedy, karcinogenní látky, alkaloidy, insekticidy atd., je po pár dnech pozorováno prudké zvýšení aktivity (respektive kvantity) enzymů - hydroxyláz hladkého endoplazmatického retikula jaterních buněk; oxidace cizorodých látek na produkty, které jsou pro tělo netoxické. Na druhé straně byly popsány případy, kdy se působením takových hydroxyláz cizorodé látky v těle přeměňují na toxičtější sloučeniny. Tento jev, opak detoxikace, se nazývá smrtící syntéza.
Proenzymy. Proteolytické enzymy gastrointestinálního traktu a slinivky břišní jsou syntetizovány v neaktivní formě, ve formě proenzymů (zymogenů). Regulace v těchto případech spočívá v přeměně proenzymů na aktivní enzymy pod vlivem specifických činidel. Trypsin je tedy syntetizován ve slinivce břišní ve formě trypsinogenu. Ten se ve střevě působením dalšího proteinového enzymu – enterokinázy, poprvé objevené v laboratoři I. P. Pavlova, přeměňuje na aktivní trypsin. Bylo zjištěno, že aktivační účinek enterokinázy je redukován na odštěpení hexapeptidu z trypsinogenu, což vede k vytvoření přirozené terciární struktury trypsinu a jeho aktivního centra (viz výše); je také pozorována autokatalýza. Přeměna inaktivního pepsinogenu na aktivní pepsin probíhá autokatalyticky v důsledku omezené proteolýzy v přítomnosti HC1 a je také spojena se štěpením z prvního specifického inhibitoru polypeptidové povahy (viz Metabolismus jednoduchých proteinů). Syntéza proteináz v neaktivní formě a řady dalších neaktivních prekurzorových proteinů má zjevně určitý biologický význam, bránící destrukci orgánových buněk, ve kterých se tvoří proenzymy.
Chemická modifikace enzymu. Výše bylo naznačeno (viz Chemie proteinů), že řada proteinů podléhá postsyntetické modifikaci během tvorby jejich terciární struktury. Ukázalo se, že klíčové enzymy energetického metabolismu - fosforyláza, glykogensyntetáza atd. - jsou rovněž řízeny fosforylací a defosforylací prováděnou specifickými enzymy - proteinkinázou a proteinfosfatázou, jejichž úroveň aktivity je zase regulována hormony (viz Metabolismus sacharidů). Úroveň aktivity klíčových enzymů a tím i intenzita metabolických procesů bude určena poměrem fosforylovaných a defosforylovaných forem těchto enzymů.
Regulace enzymové aktivity podle principu zpětné vazby. V mnoha přísně biosyntetických reakcích je hlavním typem regulace rychlosti vícekrokového enzymatického procesu zpětná inhibice, kdy konečný produkt biosyntetického řetězce potlačuje aktivitu enzymu katalyzujícího první krok.
Předpokládejme, že v buňkách probíhá vícestupňový biosyntetický proces, jehož každý stupeň je katalyzován svým vlastním enzymem:

Rychlost takového celkového sledu reakcí je do značné míry určena koncentrací konečného produktu (P), jehož akumulace nad přípustnou úrovní má silný inhibiční účinek na první fázi procesu, respektive na enzym E. 1.
Existence takového mechanismu řízení enzymové aktivity metabolity byla poprvé prokázána u E. coli při studiu syntézy isoleucinu a cytidintrifosfátu (CTP). Ukázalo se, že isoleucin, který je finálním produktem, selektivně potlačuje aktivitu threonindehydratázy, která katalyzuje první krok v procesu přeměny threoninu na isoleucin, který zahrnuje pět enzymatických reakcí. Podobně CTP jako konečný produkt biosyntetické dráhy působí inhibičně na první enzym (aspartáttranskarbamoylázu), čímž reguluje vlastní syntézu. Tento typ inhibice se nazývá zpětnovazební inhibice nebo retroinhibice. Jeho existence byla prokázána ve všech živých organismech a v současnosti je považována za jeden z předních typů regulace enzymové aktivity a buněčného metabolismu obecně 1. (1 Je třeba zdůraznit, že rychlost reakce (stejně jako aktivita enzymů) v čistě biodegradativních (katabolických) procesech je regulována meziprodukty, které jsou indikátory energetického stavu buňky (purinové nukleotidy, pyrofosfát, anorganický fosfát atd.) .)
Na druhé straně u amfibolických procesů (viz Úvod do metabolismu a energie), které současně plní biosyntetické a biodegradační funkce 2, byla existence regulace prokázána jak typem retroinhibice, tak makroergy - indikátory energetického stavu buňka. (2 Amfibolické procesy zahrnují cesty, jako je glykolýza, glykogenolýza, cyklus trikarboxylových kyselin, hexózamonofosfátová cesta, transaminace aminokyselin (viz Metabolismus)). Pro amfibolické procesy je jedinečným typem regulace, který je vlastní pouze jim, navíc aktivace prekurzorem, kdy první metabolit ve vícestupňové dráze aktivuje enzym, který katalyzuje poslední fázi. Byl tedy prokázán aktivační účinek glukóza-6-fosfátu, který je prekurzorem glykogenu, na enzym glykogensyntetázu.
Podobné typy inhibice konečným produktem a aktivace prvním produktem jsou charakteristické pro alosterické (regulační) enzymy (viz výše), kdy se efektor, strukturálně odlišný od substrátu, váže na speciální (alosterické) centrum molekuly enzymu, kdy se efektor, strukturálně odlišný od substrátu, váže na speciální (alosterické) centrum molekuly enzymu. prostorově vzdálený od aktivního centra. Proto je běžné rozlišovat mezi alosterickým typem regulace, který zahrnuje jak alosterickou inhibici, tak alosterickou aktivaci. Vzájemné konverze aktivních a neaktivních alosterických enzymů ve zjednodušené formě, stejně jako konformační změny pozorované po připojení substrátu a efektorů, jsou uvedeny na Obr. 59.

Je vidět, že připojení negativního efektoru k alosterickému centru způsobí výrazné změny v konfiguraci aktivního centra molekuly enzymu a v důsledku toho ztrátu afinity enzymu k jeho substrátu (tvorba neaktivního komplexu) .
Allosterické interakce se projevují v charakteru křivek závislosti počáteční rychlosti reakce na koncentraci substrátu nebo efektoru, zejména ve tvaru S křivek (odchylka od hyperbolické Michaelis-Mentenovy křivky). To znamená, že vazba jedné molekuly substrátu usnadňuje vazbu druhé molekuly na alosterické centrum, čímž se zvyšuje rychlost reakce. Regulační (alosterické) enzymy se navíc vyznačují nelineární závislostí rychlosti reakce na koncentraci enzymu.
Jiné typy regulace enzymové aktivity. Existuje řada dalších mechanismů, které řídí rychlost metabolických procesů a aktivitu intracelulárních enzymů. Mezi takové mechanismy může patřit konkurence mezi enzymy o společný substrát, zastavení aktivity jednoho z enzymů (u více forem enzymů), vliv koncentrací kofaktorů a jejich formy (zejména kovových iontů) a fenomén kompartmentalizace. Významnou biologickou roli hraje zřejmě kompartmentalizační mechanismus, který prostorově odděluje enzymy od jejich substrátů přes biomembrány (například lysozomální enzymy: proteinázy, fosfatázy, ribonukleázy a další hydrolytické enzymy, od látek, na které působí v cytoplazmě) nebo jsou vzájemně nekompatibilní v metabolickém procesy ve stejnou dobu. Příkladem posledně jmenovaného mohou být cesty pro syntézu mastných kyselin, které se vyskytují především v rozpustné frakci cytoplazmy, a cesty pro odbourávání mastných kyselin, koncentrovaných v mitochondriích.
Stanovení aktivity enzymů
Stanovení kvantitativního obsahu enzymů v biologických objektech představuje určité potíže, protože až na vzácné výjimky jsou enzymy v tkáních přítomny v zanedbatelně malých koncentracích. Proto se množství enzymů posuzuje podle rychlosti katalyzované reakce za určitých dohodnutých podmínek měření. Za optimálních podmínek teploty, pH prostředí a úplného nasycení enzymu substrátem je rychlost úměrná koncentraci enzymu. Rychlost enzymatické reakce se posuzuje buď podle rychlosti ztráty substrátu nebo podle rychlosti tvorby reakčního produktu.
Pro vyjádření koncentrace enzymu doporučuje Komise pro enzymy Mezinárodní biochemické unie standardní jednotku (E). Za jednotku jakéhokoli enzymu se považuje množství, které za optimálních podmínek katalyzuje konverzi 1 umol substrátu za minutu (umol/min). Byla navržena nová definice mezinárodní jednotky enzymu katal (kat), která odpovídá množství enzymu schopného způsobit přeměnu 1 molu substrátu na produkt za 1 s (1 mol/s). Vztah mezinárodní jednotky (E) ke katal lze vyjádřit následovně:
nebo 1 E=1 umol · min-1 = (1/60) umol · s-1 = (1/60) ukat = 16,67 nkat. 1E enzymu tedy odpovídá 16,67 ncat.
Doporučuje se také měřit enzymové jednotky při 25 °C, optimální pH a koncentraci substrátu nad koncentrací nasycení. V těchto případech rychlost odpovídá reakci nultého řádu vzhledem k substrátu a bude záviset pouze na koncentraci enzymu.
Pro vyjádření aktivity enzymu se používá definice specifické a molekulární aktivity. Specifická aktivita enzymu se obvykle vyjadřuje jako počet jednotek enzymatické aktivity na 1 mg bílkoviny (nebo počet katalů na 1 kg aktivní bílkoviny). Počet molekul substrátu, které jsou přeměněny jednou molekulou enzymu za minutu, se obvykle nazývá počet otáček nebo molekulární aktivita. Jedna molekula erytrocytární katalázy je tedy schopna rozložit 5 · 10 6 molekul peroxidu vodíku 1 za 1 minutu. (1 Aby 1 atom anorganického železa, který také katalyzuje rozklad H 2 O 2, rozložil počet molekul H 2 O 2, které kataláza rozloží za 1 s, by trvalo více než 300 let. Tento příklad je jasným důkazem jedné z hlavních vlastností enzymů – jejich vysoké katalytické aktivity.)
Učitel:Ph.D.
Kuzněcovová Jekatěrina Igorevna Mechanismy inaktivace enzymů
1. Změna primární struktury:
1.1. Přetržení polypeptidového řetězce:
Těžké podmínky (dlouhodobý var v HCl) –
hydrolýza na jednotlivé aminokyseliny.
Při zahřátí na 100 °C (pH 7-8) hydrolýza
peptidové vazby jsou nevýznamné.
Nejcitlivější na
vysokoteplotní hydrolýzy jsou
peptidové vazby tvořené zbytky
kyselina asparagová.
Proteázy (bakteriální kontaminace, autolýza). Řešení:
inaktivované enzymy. 1.2.Oxidace funkčních skupin enzymů
SH skupiny cysteinových a indolových fragmentů
tryptofan při zvýšených teplotách může
oxidovat (sulfoxy-cysteinové sloučeniny
(SOH, SO2H) a vznikají produkty
otevření indolového kruhu tryptofanu. Řešení:
Znovu aktivujte výplňovými prostředky
činidla, zejména thioly s nízkou molekulovou hmotností
(například cystein nebo dithiothreitol).
Způsobeno: Thioly a jiné redukované
sloučeniny síry, například Na2SO3, Na2S2O3.
Produkt redukce disulfidových vazeb
(S-S) je:
1) thiolová forma (protein-SH)
2) smíšený disulfid thiolové formy proteinu s
například redukční činidlo
protein–S–SO3). 1.3. Štěpení disulfidových vazeb
Alkalická hydrolýza cysteinu→dehydroalanin→
Díky svým nukleofilním vlastnostem
interaguje s NH2 skupinami lysinu a SHcystein →lysinoalanin a lanthionin.
Pro úplné zničení všech vazeb S–S jsou vyžadovány poměrně přísné podmínky (0,1–1 M alkálie,
100 °C).
Nicméně zničení těch nejreaktivnějších
S–S vazby se mohou vyskytovat v poměrně měkkých
podmínkách - například při teplotách 60–80 ° C a
mírně alkalické hodnoty pH.
Je třeba vzít v úvahu při použití enzymů v
jako přísady do detergentů. Řešení:
Přidání thiolů do média povede k
štěpení směsného disulfidu a
následné vytvoření správné vazby S–S 1.4. Chemická modifikace katalytických SH skupin.
Kationty těžkých kovů (Hg, Pb a Cu)
vázat se na SH skupiny aktivního místa
enzym
↓
Tvorba odpovídajících merkaptidů
↓
Enzym je inaktivován
10.
1.5. Fosforylace proteinů in vivo.Pod vlivem fosforylázy a fosfatázy
obsažené v poločištěném enzymatickém
drogy ve formě nečistot
↓
Kyselina fosforečná se váže na OH skupiny
serin a threonin.
↓
Konformační změny v proteinu
molekula
↓
inaktivace enzymů.
11.
Řešení:V literatuře nejsou prakticky žádné příklady
hodně štěstí při opětovné aktivaci tímto způsobem
inaktivované enzymy.
12.
1.6. Deaminace zbytků asparaginu.Při teplotách (asi 100 °C) a pH (asi
4,0–5,0) dochází k deaminaci zbytků
asparagin.
↓
inaktivace enzymů.
13.
Řešení:V literatuře nejsou prakticky žádné příklady
hodně štěstí při opětovné aktivaci tímto způsobem
inaktivované enzymy.
14.
1.7. Radiační inaktivace enzymůγ-záření a UV světlo
Ovlivňují funkční skupiny
enzymy, peptidové vazby a SH skupiny
cysteinové zbytky.
15.
2. AgregacePozorováno při zvýšených teplotách, při
extrémní hodnoty pH, v přítomnosti
některé chemické sloučeniny.
Čím vyšší koncentrace, tím rychleji to jde
agregace.
Hydrofobní interakce a vodík
vazeb, je možný vznik disulfidových vazeb
můstky mezi jednotlivými proteiny
molekul
16.
Řešení:Je nutné zničit intermolekulární
kovalentní a nekovalentní kontakty c
pomocí koncentrovaných roztoků
močovina a guanidinchlorid, extrém
hodnoty pH.
Pokud agregace enzymů vede k tvorbě
do média se přidávají intermolekulární S-S můstky
relativně nízké koncentrace
(μmol/l) činidla obsahující thiol (např.
cystein nebo dithiothreitol).
Při takových koncentracích intramolekulární
S–S vazby v proteinu obvykle nejsou ovlivněny.
17.
3. Inaktivace enzymů povrchemnapětí
Povrchové napětí na rozhraní
mezi vzduchem a čistou vodou je 80
din/cm.
Pěnění způsobuje denaturaci
enzymy adsorbované na rozhraní
fáze
18.
Řešení:Přidání povrchově aktivní látky snižuje povrch
napětí až 1 dyne/cm.
19.
4. Sorpce bílkovin na stěnách reakceplavidlo
Sorpce v důsledku nekovalentních interakcí
vede ke snížení koncentrace enzymů v
řešení.
Je třeba vzít v úvahu při práci s
zředěné proteinové roztoky
(koncentrace 10-8–10-10 mol/l).
Pod vlivem denaturačních faktorů
schopnost proteinů adsorbovat se na stěnách
reakční nádoba se může zvětšit.
20.
Řešení:Desorpce enzymu ze stěn reakce
plavidla je dosaženo zničením
nespecifické interakce mezi
proteinová a sorpční centra na povrchu
plavidlo.
Lze použít extrémní hodnoty pH
koncentrované roztoky močoviny popř
guanidin chlorid.
21.
5. Disociace oligomerních proteinů napodjednotky
Způsobeno: Močovina, detergenty, kyseliny popř
topení.
Vést k:
konformační změny jedince
podjednotky;
agregace podjednotek;
disociace kofaktorů z aktivních center;
modifikace funkčních skupin, které
oligomerní proteiny byly chráněny před
kontaktu s rozpouštědlem.
22.
6. Desorpce kofaktoru z aktivního místaenzym
Příčiny: zahřívání, chelatační účinky, dialýza
Pokud je doprovázena disociace kofaktorů
výrazné konformační posuny popř
chemická úprava důležitých
funkční skupiny → enzym
je nevratně inaktivován.
Pokud žádný významný
změny v konformaci proteinu, pak přidání
v prostředí přebytku kofaktoru vede k
reaktivace enzymů.
23.
Regenerace kofaktorůZpůsoby regenerace:
Enzymatické (metody využívající konjugované substráty nebo enzymy)
Neenzymatické (chemické a
elektrochemické přístupy)
24.
Enzymatická metodaDo systému je zavedeno nadměrné množství.
konjugovaný substrát stejného enzymu:
Příklad: když funguje alkoholdehydrogenáza
NADH se spotřebovává.
25.
Enzymatická metoda1. Použití konjugovaných substrátů.
Nevýhoda:
používají se vysoké koncentrace
konjugovaný substrát, protože rovnováha
reakce jsou značně posunuty do strany
tvorba alkoholu;
komplikuje postup při identifikaci hlavního
produkt z reakční směsi.
26.
Enzymatická metoda2. Použití spárovaných
enzymatické reakce
Enzym 2 je navíc zaveden do systému,
jehož fungování je zajištěno
regeneraci koenzymu.
Enzymy používané v systému musí mít
odlišná substrátová specifita
27.
Neenzymatické metody1. Chemické metody.
Dithioničitan sodný a některé
pyridiniové soli:
+ Nízká cena.
- může inhibovat některé enzymy.
Flavinové koenzymy
28.
Neenzymatické metody2. Elektrochemické metody.
Přímá elektrochemická redukce popř
oxidace.
Během procesu regenerace se objeví „-“.
enzymaticky neaktivní formy koenzymu,
například v důsledku jeho dimerizace.
29. STABILIZACE ENZYMŮ V BIOTECHNOLOGICKÝCH SYSTÉMECH
30.
Problémy během používáníenzymy v biotechnologických procesech:
1. Zvýšené teploty
2. Extrémní hodnoty pH
3. Vysoké koncentrace organických látek
rozpouštědla nebo povrchově aktivní látky.
4. Nemožnost opětovného použití
enzym.
5. Obtížnost oddělování enzymu od
produkt.
31.
Základní přístupy ke stabilizacienzymy:
1. Přidání stabilizačních látek do média,
ve kterém je enzym uložen nebo prováděn
enzymatická reakce.
2. Chemická modifikace enzymu.
3. Imobilizace enzymu.
32.
1. Substráty nebo jejich analogy:
Komplex enzym-substrát je často více
stabilnější než volný enzym.
Příklad: Laktátdehydrogenáza v přítomnosti
laktát je tepelně stabilnější.
33.
Stabilizace enzymů pomocí:2. Organická rozpouštědla:
Vícesytné alkoholy stabilizují některé
enzymy zvýšením stability
intramolekulární proteinové vodíkové vazby.
Příklad: Chymotrypsin v přítomnosti 50–90 %
glycerol je odolnější vůči proteolýze
34.
Stabilizace enzymů pomocí:3. Soleil:
Při nízkých koncentracích soli (<0,1M) катионы
Ca2+, Zn2+, Mn2+, Fe2+ atd. mohou specificky
interagují s metaloproteiny.
Některé z nich jsou kofaktory.
Ca2+ je schopen stabilizovat terciární
struktura řady proteinů v důsledku tvorby
iontové vazby se dvěma různými
aminokyselinové zbytky.
Příklad: α-amyláza (z Bacillus caldolyticus)
Ca2+ výrazně zvyšuje termiku
udržitelnost.
35.
36.
Chemická modifikace enzymu1. Enzym se stává stabilnější
konformace.
2. Zavedení nových funkčních skupin do proteinu
vede k tvorbě přídavných
stabilizace vodíkových vazeb nebo soli
mosty.
3. Při použití nepolárních sloučenin
hydrofobní interakce jsou zesíleny.
4. Modifikace hydrofobních povrchů
protein hydrofilními sloučeninami snižuje
oblast nepříznivého vnějšího kontaktu
nepolární zbytky s vodou.
Příklad: glutaraldehyd
37.
Imobilizace enzymů umožňuje:Zvyšte stabilitu enzymů (teplo,
autolýza, vystavení agresivnímu prostředí atd.)
1. Znovu použijte enzym
2. Oddělte enzym od činidel a produktů
reakce.
3. Přerušte reakci ve správný okamžik.
38.
Imobilizované enzymy jsou lékyenzymy, jejichž molekuly jsou spojeny
nosič, při zachování zcela popř
částečně jeho katalytické vlastnosti.
Způsoby imobilizace:
1. Chemické
2. Fyzické
39.
Způsoby imobilizace:Lze použít následující média:
1) Organické materiály:
1.1) přírodní (polysacharidy, proteiny, lipidy)
1.2) syntetické polymerní nosiče
2) Anorganické materiály (matice na
na bázi silikagelu, hlíny, keramiky, přírodní
minerály atd.)
40.
1) adsorpce enzymu na nerozpustný nosič
jako výsledek elektrostatického, hydrofobního,
van der Waals a další interakce;
;
struktury;
4) Připojení k dvoufázové soustavě.
41.
Způsoby fyzické imobilizace:Dosahuje se kontaktem vodného roztoku
enzym s nosičem.
42.
Způsoby fyzické imobilizace:1) adsorpce enzymu na nerozpustný nosič
Faktory ovlivňující adsorpci:
1. Specifický povrch a poréznost nosiče
2. Hodnota pH (na neiontových měničích max. adsorpce
v izoelektrickém bodě proteinu)
3. Iontová síla roztoku (zvýšení iontové síly –
desorpce enzymů, ale někdy i opačná situace
"vysolit")
4. Koncentrace enzymů.
5. Teplota (na jedné straně denaturace, na druhé straně
další zrychlená difúze)
43.
Způsoby fyzické imobilizace:1) adsorpce enzymu na nerozpustný nosič
výhody:
2) Dostupnost médií
nedostatky:
1) Nedostatečná pevnost spoje
2) Mnoho médií je biologicky odbouratelných
44.
Způsoby fyzické imobilizace:2) zahrnutí enzymu do semipermeabilní
kapsle, v semipermeabilní membráně
45.
Způsoby fyzické imobilizace:2) zahrnutí enzymu do semipermeabilní
kapsle, v semipermeabilní membráně
výhody:
1) Relativní jednoduchost techniky
2) Ochrana proti mikroorganismům
3) Neexistují žádná omezení šíření (od
Poměr povrchu k ploše je vysoký a
tloušťka membrány je malá)
nedostatky:
1) Biologicky odbouratelné
2) Neplatí pro vysokou molekulovou hmotnost
46.
Způsoby fyzické imobilizace:3) mechanické začlenění enzymu do gelu
struktur
Enzym je součástí trojrozměrné sítě
polymerní řetězce, které tvoří gel.
47.
Způsoby fyzické imobilizace:3) mechanické začlenění enzymu do gelu
struktur
Je třeba zvážit:
1. Korespondence velikosti pórů s velikostí enzymu.
2. Povaha matice (protože vytváří
mikroprostředí pro enzym, možná
vytvořit pH odlišné od pH roztoku a
zvýšit afinitu substrátu k matrici, která
zvyšuje rychlost enzymatické reakce)
48.
Způsoby fyzické imobilizace:3) mechanické začlenění enzymu do gelu
struktur
výhody:
1) Relativní jednoduchost techniky
2) Zvýšené mechanické, chemické a
tepelný odpor matric.
3) Enzym je stabilizován
4) Enzym je chráněn před bakteriemi
poškození
nedostatky:
1) Neplatí pro vysokou molekulovou hmotnost
49.
Způsoby fyzické imobilizace:4) Připojení k dvoufázové soustavě
Enzym je rozpustný pouze v jedné z fází a
produkt - na jiný
Umožňuje pracovat s vysokou molekulovou hmotností
substráty.
50.
Metody chemické imobilizace:Vznik kovalentních vazeb mezi
enzym a nosič.
výhody:
1) Vysoká pevnost konjugátu
2) Stabilita enzymu může být zvýšena
51.
Při imobilizaci enzymů je to nutnédodržovat následující podmínky:
1. Aktivní skupiny matice by neměly
blokuje katalytické centrum enzymu.
2. Imobilizace by neměla vést ke ztrátě
enzymová aktivita.
52.
Velmi slibné je použití vjako imobilizované biokatalyzátory
buňky.
Protože lze se vyhnout:
1) nákladné kroky izolace a čištění
enzymy
2) nutnost jejich následné stabilizace
53.
TermozymyStabilní při vysokých teplotách,
vysoké koncentrace soli a extrémní
hodnoty pH.
Hypertermofilní mikroorganismy
nalezený mezi Archaea a Bakterie, živě
při teplotách 80–100 °C.
54.
Mechanismy odpovědné za tepelnou stabilituenzymy v termozymech:
Mezi mezofilním a termofilním
enzymové verze - vysoký stupeň homologie
sekvence a struktury.
Tedy sekvence termostabilní
dehydrogenázy z Pyrococcus a Thermotoga na 35 a
55 %, respektive totožné
mezofilní dehydrogenázové sekvence
z Clostridium.
55.
Bylo zjištěno, že dehydrogenáza z Pyrococcusfuriosus (Tm == 105 °C) obsahuje 35 isoleucinů,
zatímco dehydrogenázy z Thermotoga
maritima (Tm = 95 °C) a Clostridium symbiosum (Tm
= 55 °C) pouze 21 a 20 isoleucinů
respektive.
Tepelně stabilní enzymy obsahují méně
glycin: Cs dehydrogenáza obsahuje 48 zbytků
glycin a dehydrogenázy pouze z Tm a Pf
39 a 34 glycinů.
Více isoleucinu a méně glycinu.
56.
Zvýšená tepelná stabilita koreluje:1) se zvyšující se rigiditou proteinové struktury
snížením obsahu zbytků
glycin,
2) se zlepšením hydrofobních kontaktů v jádře
dehydrogenáza z Pf jako výsledek náhrady valinu
isoleucin. (V důsledku cílené na web
mutageneze vedoucí k nahrazení isoleucinu
mutanty termostability valinu
snížena).
57.
Stabilizační mechanismy:minimalizace dostupné hydrofobní plochy
proteinový povrch;
optimalizace balení atomů proteinu
molekul (minimalizace poměru
povrch/objem);
optimalizace distribuce poplatků (dosaženo
díky eliminaci odpudivého
interakce, stejně jako výsledek organizace
interakce mezi náboji do zvláštního
síť)
Snížení počtu depresí
58.
Aplikace enzymů z extremofilůModerní technologie molekulární biologie
a genetické inženýrství umožňuje:
1) získat dostatečné množství enzymů z
extrémofilů pro jejich následné
analýzy a praktické aplikace.
2) klonování a exprese těchto enzymů v
mezofilní organismy.
59.
Škrob se používá k výrobě cukrů.
Nejprve se proces provádí při (95–105 °C) a při hodnotách
pH 6–6,5.
V další fázi teplota klesne na 60°C a
pH = 4,5.
Použití termostabilních enzymů (αamyláza, glukoamyláza, xylózaizomeráza),
izolované od hypertermofilů umožní:
1) proveďte proces v jedné fázi a současně
stejné podmínky
2) opustit drahé iontoměniče
60.
Aplikace enzymů z extremofilů:Termostabilnější byly α-amylázy
nalezený v archaea Pyrococcus woesei,
Pyrococcus furiosus, Desulfurococcus mucosus,
Pyrodictium abyssi a Staphylothermus
marinus. Amylázové geny z Pyrococcus sp. byli
klonovány a exprimovány v E. coli a Bacillus
subtilis.
61.
Aplikace enzymů z extremofilů:Proteolytické enzymy
Serinové alkalické proteinázy jsou široce rozšířeny
používá se jako přísada do detergentů
prostředek.
Proteinázy z extremofilů zůstávají zachovány
nativní při vysokých teplotách, in
přítomnost vysokých koncentrací detergentů a
další denaturační činidla. Pyrococcus,
Thermococcus, Staphylothermus, Desulfurococcus a
Sulfolobus. Maximální aktivita těchto
enzymy se vyvíjejí při teplotách
od 90 do 110 °C a hodnoty pH od 2 do 10
62.
Aplikace enzymů z extremofilů:DNA polymerázy
Používají se termostabilní DNA polymerázy
v PCR a hrají důležitou roli v genetickém inženýrství.
Byly nalezeny termostabilní polymerázy
hypertermofilové Pyrococcus furiosus a Pyrococcus
litoralis, stejně jako u teplomilných Thermus aquaticus.