Vytvořte rovnici pro hydrolýzu solí k2s. Vypracování iontovo-molekulárních a molekulárních rovnic hydrolýzy solí
1.4. Hydrolýza solí
Hydrolýza je proces výměny interakcí solných iontů s vodou, což vede k tvorbě nízko disociovaných látek a je doprovázeno změnou reakce ( pH) životní prostředí.
Podstata hydrolýzy solí spočívá v tom, že se disociační rovnováha vody posune v důsledku vazby jednoho z jejích iontů za vzniku špatně disociované nebo těžko rozpustné látky. V důsledku hydrolýzy mohou vznikat molekuly slabých kyselin a zásad, anionty kyselých solí nebo kationty zásaditých solí. Ve většině případů je hydrolýza reverzibilní proces. S rostoucí teplotou a ředěním se zvyšuje hydrolýza. Hydrolýza probíhá různě v závislosti na síle kyseliny a zásady, které tvoří sůl. Uvažujme různé případy hydrolýzy solí.
a) Tvoří se sůl slabá kyselina a silnou základnu ( K 2 S).
Po rozpuštění ve vodě se K 2 S disociuje
K 2 S2K + + S 2-.
Při sestavování hydrolýzních rovnic je nejprve nutné určit ionty solí, které váží vodní ionty na sloučeniny s nízkou disociací, tj. ionty způsobující hydrolýzu.
PROTI tento případ ionty S 2- váží kation H +, tvoří ion HS -
S 2– + H 2 OHS - + OH -
Hydrolýzní rovnice v molekulární formě
K 2 S + H 2 OKHS + KOH.
V praxi je hydrolýza soli výhodně omezena na první stupeň za vzniku kyselé soli (v tomto případě KHS). Hydrolýza soli tvořené silnou zásadou a slabou kyselinou (jako je K2S) tedy probíhá na aniontu soli. Přebytek iontů OH v roztoku způsobuje alkalická reakce médium v roztoku (pH> 7).
b)Col je tvořen slabou zásadou a silnou kyselinou (CuCl 2, Al 2 ( TAK 4 ) 3).
Po rozpuštění ve vodě se CuCl 2 disociuje
СuCl 2 Cu 2+ + 2Cl -
Ionty Cu 2+ se spojují s ionty OH - za vzniku hydroxidů CuOH +. Hydrolýza soli je omezena na první stupeň a nedochází k tvorbě molekuly Cu (OH) 2. Iontová-molekulární rovnice má tvar
Cu 2+ + HOHCuOH + + H +.
V tomto případě jsou produkty hydrolýzy zásaditá sůl a kyselina. Hydrolýzní rovnice v molekulární formě je zapsána následovně
CuCl 2 + H 2 O CuOHCl + HCl.
Hydrolýza soli tvořené slabou zásadou a silnou kyselinou (v tomto případě CuCl2) probíhá prostřednictvím kationtu soli. Přebytek iontů H + v roztoku způsobuje kyselou reakci média v roztoku (pH<7).
Při rozpuštění ve vodě Al 2 (SO 4) 3 disociuje
Al 2 (SO 4) 3 2 Al 3+ + 3 SO 4 2-.
V tomto případě ionty Al 3+ kombinovat s OH - ionty za vzniku hydroxionů AlOH 2+ ... Hydrolýza soli je omezena na první stupeň a tvorbu molekuly Al (OH ) 3 se nestane. Iontová-molekulární rovnice má tvar
Al 3+ + H 2 O AlOH 2+ + H +.
Produkty elektrolýzy jsou zásadité soli a kyseliny.
Hydrolýzní rovnice v molekulární formě je zapsána následovně
Al 2 (SO 4) 3 + 2 H 2 O 2 AlOHSO 4 + H 2 SO 4.
c) Sůl je tvořena slabou kyselinou a slabou zásadou (CH 3 COONH 4).
CH 3 COO - + NH 4 + + H 2 O CH 3 COOH + NH 4 OH.
V tomto případě se vytvoří dvě špatně disociované sloučeniny a pH roztoku závisí na relativní síle kyseliny a zásady. Pokud mohou být produkty hydrolýzy odstraněny z roztoku, potom hydrolýza pokračuje až do konce. Například
Al 2 S 3 + 6 H 2 O = 2 Al (OH) 3↓ + 3H 2 S.
Jsou možné i jiné případy nevratné hydrolýzy, které není obtížné předvídat, protože aby byl proces nevratný, je nutné, aby alespoň jeden z produktů hydrolýzy opustil reakční sféru.
G) Soli tvořené silnou kyselinou a silnou zásadou ( NaCl, K 2 TAK 4 , RbBra další) nepodstupují hydrolýzu, od té doby jedinou sloučeninou s nízkou disociací je H20 (pH = 7). Roztoky těchto solí mají neutrální médium. Například
NaCl + H20 NaOH + HCl
Na + + Cl - + H20 Na + + OH - + H + + Cl -
H 2 O H + + OH -.
Reverzibilní reakce hydrolýzy zcela podléhají principu Le Chatelier. Proto lze zlepšit hydrolýzu soli (a dokonce jej učinit nevratným) následujícími způsoby:
1) přidejte vodu;
2) zahřejte roztok, přičemž se zvyšuje endotermická disociace vody, což znamená, že se zvyšuje počet iontů H + a OH -, které jsou nezbytné pro hydrolýzu soli;
3) navázat jeden z produktů hydrolýzy na špatně rozpustnou sloučeninu nebo odstranit jeden z produktů do plynné fáze; např. hydrolýza kyanidu amonného NH 4 CN bude významně posílen rozkladem hydrátu amoniaku za vzniku amoniaku NH 3 a voda:
NH4 + + CN - + H20 NH3 + H20 + HCN.
Hydrolýzu lze potlačit jedná takto:
1) zvýšit koncentraci rozpuštěné látky;
2) roztok ochlaďte (pro oslabení hydrolýzy by solné roztoky měly být skladovány koncentrované a při nízkých teplotách);
3) přidejte jeden z produktů hydrolýzy do roztoku; například okyselte roztok, pokud je jeho médium kyselé v důsledku hydrolýzy, nebo alkalizuje, pokud je zásadité.
Vzájemné vylepšení hydrolýzy Předpokládejme, že rovnováhy jsou vytvářeny v různých nádobách
CO 3 2– + H 2 O HCO 3 - + OH -
Al 3+ + H 2 O AlOH 2+ + H +
Obě soli jsou mírně hydrolyzovány, ale pokud jsou roztoky smíchány, dochází k vazbě iontů H + a OH -. V souladu s principem Le Chatelier se obě rovnováhy posouvají doprava, hydrolýza zesiluje a probíhá zcela
2 AlCl3 + 3 Na2CO3 + 3 H20 = 2 Al (OH) 3↓ + 3 CO 2 + 6 NaCl.
To se nazývá vzájemné zlepšení hydrolýzy ... Pokud tedy smícháte roztoky solí, z nichž jeden je hydrolyzován kationtem a druhý aniontem, hydrolýza se zlepší a pokračuje úplně.
O.A. Napilková, N. S. Dozortseva
Úkol 201.
Nakreslete iontově-molekulární a molekulární rovnice hydrolýzy, ke které dochází při míchání roztoků K 2 S a CrCl 3 ... Každá z přijatých solí se nevratně hydrolyzuje až do konce za vzniku odpovídající báze a kyseliny.
Řešení:
K 2 S - sůl silné zásady a slabé kyseliny je hydrolyzována aniontem a CrCl 3 - sůl slabé báze a silné kyseliny je hydrolyzována kationtem:
K 2 S ⇔ 2K + + S 2-; CrCl3 ⇔ Cr 3+ + 3Cl -;
a) S 2 - + H 2 O ⇔ HS - + OH -;
b) Cr 3+ + H 2 O ⇔ CrOH 2+ + H +.
Pokud jsou roztoky těchto solí v jedné nádobě, dochází ke vzájemnému posílení hydrolýzy každé z nich, protože ionty H + a OH-, které se navzájem váží, tvoří molekuly slabého elektrolytu H 2 O (H + + OH - ⇔ H20). S vytvořením dalšího množství vody se hydrolytická rovnováha obou solí posune doprava a hydrolýza každé soli dojde ke konci s tvorbou sraženiny a plynu:
3S 2- + 2Cr 3+ + 6H20- 2Cr (OH) 3 ↓ + 3H2S (iontová molekulární forma);
3K 2 S + 2CrCl 3 + 6H 2 O ⇔ 2Cr (OH) 3 ↓ + 3H 2 S + 6KCl (molekulární forma).
Úkol 202.
K roztoku FeCl3 byly přidány následující látky: a) HCl; b) KOH; c) ZnCl2; d) Na 2 CO 3. V jakých případech se zvýší hydrolýza chloridu železitého? Proč? Nakreslete iontově-molekulární rovnice pro hydrolýzu odpovídajících solí.
Řešení:
a) Sůl FeCl3 se hydrolyzuje kationtem a HCl se disociuje ve vodném roztoku:
FeCl 3 ⇔ Fe 3+ + 3Cl -;
HCl ⇔ H + + Cl -
Pokud jsou roztoky těchto látek v jedné nádobě, pak je hydrolýza soli FeCl3 inhibována, protože vzniká nadbytek vodíkových iontů H + a rovnováha hydrolýzy se posouvá doleva:
b) FeCl3 sůl se hydrolyzuje kationtem a KOH disociuje ve vodném roztoku za vzniku OH -:
FeCl 3 ⇔ Fe 3+ + 3Cl -;
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +;
KOH ⇔ K + + OH -
Pokud jsou roztoky těchto látek v jedné nádobě, dochází k hydrolýze soli FeCl3 a disociaci KOH, protože ionty H + a OH-, které se navzájem váží, tvoří molekuly slabého elektrolytu H 2 O (H + + OH - ⇔ H 2 O). V tomto případě se hydrolytická rovnováha soli FeCl3 a disociace KOH přesouvá doprava a hydrolýza soli a disociace báze přecházejí do konce s tvorbou sraženiny Fe (OH) 3. Ve skutečnosti, když jsou FeCl3 a KOH smíchány, dochází k výměně. Iontový
Fe 3+ + 3OH - ⇔ Fe (OH) 3 ↓;
Molekulární rovnice procesu:
FeCl 3 + 3KOH ⇔ Fr (OH) 3 ↓ + 3KCl.
c) Sůl FeCl 3 a sůl ZnCl 2 hydrolyzovaná kationtem:
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +;
Zn 2+ + H 2 O ⇔ ZnOH + + H +
Pokud jsou roztoky těchto solí v jedné nádobě, dochází k vzájemnému potlačení hydrolýzy každé z nich, protože přebytečné množství iontů H + způsobuje posun hydrolytické rovnováhy doleva, směrem ke snížení koncentrace vodíkové ionty H +.
d) Sůl FeCl3 je hydrolyzována kationtem a sůl Na2CO3 je hydrolyzována aniontem:
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +;
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -
Pokud jsou roztoky těchto solí v jedné nádobě, dochází k vzájemnému posílení hydrolýzy každé z nich, protože ionty H + a OH -, které se navzájem váží, tvoří molekuly slabého elektrolytu H 2 O (H + + OH - ⇔ H20). S vytvořením dalšího množství vody se hydrolytická rovnováha obou solí posune doprava a hydrolýza každé soli dojde ke konci s tvorbou sraženiny Fe (OH) 3 ↓, slabého elektrolytu H 2 CO 3:
2Fe 3+ + 3CO3 2- + 3H 2 O ⇔ 2Fe (OH) 3 ↓ + 3CO 2 (iontová molekulární forma);
2FeCl3 + 3Na 2 CO 3 + 3H 2 O ⇔ 2Fe (OH) 3 ↓ + 3CO 2 + 6NaCl (molekulární forma).
Úkol 203.
Které ze solí Al 2 (SO4) 3, K 2 S, Pb (NO 3) 2, KCl jsou hydrolyzovány? Nakreslete iontově-molekulární a molekulární rovnice pro hydrolýzu odpovídajících solí. Jaká je hodnota pH (> 7 <)
máte roztoky těchto solí?
Řešení:
a) Al 2 (SO 4) 3 je sůl slabé báze a silné kyseliny. V tomto případě kationty Al 3+ vážou ionty OH - vody a vytvářejí kationty zásadité soli AlOH 2+. K tvorbě Al (OH) 2+ a Al (OH) 3 nedochází, protože ionty AlOH 2+ disociují mnohem obtížněji než ionty Al (OH) 2+ a Al (OH) 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Al2 (SO 4) 3 ⇔ Al 3+ + 3SO 4 2-;
nebo v molekulární formě:
Al 2 (SO 4) 3 + 2Н 2 О ⇔ 2AlOHSO 4 + H 2 SO 4
V roztoku se objevuje nadbytek vodíkových iontů, které propůjčují kyselému prostředí roztok Al2 (SO4) 3, NS< 7 .
b) K 2 S - sůl silných monokyselinová báze KOH a slabý polybazic acid H 2 S. V tomto případě S2- anionty vážou vodíkové ionty H + vody a tvoří anionty kyselé soli HS-. K tvorbě H2S nedochází, protože ionty HS se disociují mnohem obtížněji než molekuly H2S. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
K 2 S ⇔ 2K + + S 2-;
S 2- + H 2 O ⇔ H S- + OH-
nebo v molekulární formě:
K 2 S + 2H 2 O ⇔ KHS + KOH
V roztoku se objevuje nadbytek hydroxidových iontů, které dávají roztoku K2S zásadité médium, pH> 7.
c) Pb (NO 3) 2 je sůl slabé báze a silné kyseliny. V tomto případě kationty Pb 2+ vážou OH- ionty vody a vytvářejí kationty zásadité soli PbOH +. Pb (OH) 2 se netvoří, protože ionty PbOH + disociují mnohem obtížněji než molekuly Pb (OH) 2. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Pb 2+ + H 2 O ⇔ PbOH + + H +
nebo v molekulární formě:
< 7.
d) KCl - sůl silné zásady a silné kyseliny nepodléhá hydrolýze, protože ionty K +, Cl - nejsou vázány vodními ionty H + a OH -. Ionty K +, Cl-, H + a OH - zůstanou v roztoku. Protože roztok soli obsahuje stejné množství iontů H + a OH -, má roztok neutrální médium, pH = 0.
Úkol 204.
Při míchání roztoků FeCl3 a Na2CO3 se každá z přijatých solí nevratně hydrolyzuje až do konce za vzniku odpovídající báze a kyseliny. Vyjádřete tuto společnou hydrolýzu pomocí iontových a molekulárních rovnic.
Řešení:
FeCl 3 je sůl slabé báze a silné kyseliny. V tomto případě kationty Fe 3+ vážou ionty OH - vody a tvoří kationty zásadité soli FeOH 2+. K tvorbě Fe (OH) 2+ a Fe (OH) 3 nedochází, protože ionty FeOH 2+ disociují mnohem obtížněji než ionty Fe (OH) 2+ a Fe (OH) 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
FeC l3 ⇔ Fe 3+ + 3Cl -
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +
Na 2 CO 3 je sůl silné báze a slabé kyseliny. V tomto případě váží anionty CO 3 2 vodíkové ionty H + voda za vzniku aniontů kyselé soli HCO 3 -. K tvorbě H 2 CO 3 nedochází, protože ionty HCO 3 se disociují mnohem obtížněji než molekuly H 2 CO 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
2Fe 3+ + 3CO3 2- + 3H 2 O 2Fe (OH) 3 + 3CO 2 (iontová molekulární forma);
2FeCl3 + 3Na 2 CO 3 + 3H 2 O ⇔ 2Fe (OH) 3 + + 3CO 2 + 6NaCl.
Úkol 205.
K roztoku Na2C03 byly přidány následující látky: a) HCl; b) NaOH; c) Cu (NO3) 2; d) K 2 S. V jakých případech zesílí hydrolýza uhličitanu sodného? Proč? Nakreslete iontově-molekulární rovnice pro hydrolýzu odpovídajících solí.
Řešení:
a) Sůl Na 2 CO 3 se hydrolyzuje aniontem a HCl se disociuje ve vodném roztoku:
Na2CO3-2Na + + CO3 2-;
CO 3 2 - + H 2 O ⇔ HCO 3 - + OH -;
HCl ⇔ H + + Cl -
Pokud jsou roztoky těchto látek v jedné nádobě, dochází k vzájemnému posílení hydrolýzy každé z nich, protože ionty H + a OH -, které se navzájem spojují, tvoří molekuly slabého elektrolytu H 2 O (H + + OH - ⇔ H20). V tomto případě se hydrolytická rovnováha soli Na 2 CO 3 a disociace HCl posouvá doprava a hydrolýza soli a disociace kyseliny končí tvorbou plynného oxidu uhličitého. Iontovo-molekulární rovnice procesu:
CO 3 2- + 2H + ⇔ CO 2 + H 2 O
Molekulární rovnice procesu:
Na2CO3 + 2HCl ⇔ 2NaCl + C02 + H20
b) Sůl Na 2 CO 3 se hydrolyzuje aniontem a NaOH se disociuje ve vodném roztoku:
NaOH ⇔ Na + + OH -.
Pokud se smísí roztoky těchto látek, pak se vytvoří nadbytek OH - iontů, které posunou rovnováhu hydrolýzy Na 2 CO 3 doleva a hydrolýza soli bude inhibována.
c) Sůl Na 2 CO 3 je hydrolyzována aniontem a sůl Cu (NO 3) 2 je hydrolyzována kationtem:
CO 3 2 - + H 2 O ⇔ HCO 3 - + OH -;
Cu 2+ + H 2 O ⇔ CuOH + + H +.
Pokud jsou roztoky těchto solí v jedné nádobě, dochází k vzájemnému posílení hydrolýzy každé z nich, protože ionty H + a OH -, které se navzájem váží, tvoří molekuly slabého elektrolytu H 2 O (H + + OH - ⇔ H20). S vytvořením dalšího množství vody se hydrolytická rovnováha obou solí posune doprava a hydrolýza každé soli dojde ke konci s tvorbou sraženiny a plynu:
Cu 2+ + CO 3 2- + H 2 O ⇔ Cu (OH) 2 ↓ + CO 2 (iontová molekulární forma);
Cu (NO 3) 2 + Na 2 CO 3 + H 2 O ⇔ Cu (OH) 2 ↓ + CO 2 + 2NaNO 3 (molekulární forma).
d) Na 2 CO 3 a K 2 S jsou soli silné báze a slabé kyseliny, proto jsou oba hydrolyzovány aniontem:
CO 3 2 - + H 2 O ⇔ HCO 3 - + OH -;
S 2- + H 2 O ⇔ HS - + OH -.
Pokud jsou roztoky těchto solí v jedné nádobě, pak dochází k vzájemnému potlačení hydrolýzy každé z nich, protože přebytek OH - iontů podle Le Chatelierova principu posouvá rovnováhu hydrolýzy obou solí doleva, směrem pokles koncentrace OH - iontů, tj. bude inhibována hydrolýza obou solí.
Úkol 206.
Jaká je hodnota pH (> 7<) имеют растворы солей Na 2 S, АlСl 3 , NiSO 4 ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Řešení:
a) Na 2 S - silná sůl monokyselinová báze NaOH a slabé polybazic acid H 2 S. V tomto případě S 2- anionty vážou vodíkové ionty H + vody a tvoří anionty kyselé soli HS-. K tvorbě H 2 S nedochází, protože ionty HS - disociují mnohem obtížněji než molekuly H2S. Hydrolýza probíhá za normálních podmínek podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
Na2S-2Na + + S 2-;
S 2- + H 2 O ⇔ НS - + ОH -
nebo v molekulární formě:
Na 2 S + 2H 2 O ⇔ NaHS + KOH
V roztoku se objevuje nadbytek hydroxidových iontů, což dává roztoku Na2S zásadité prostředí, pH> 7.
b) AlCl 3 je sůl slabé báze a silné kyseliny. V tomto případě kationty Al3 + vážou OH- ionty vody a vytvářejí kationty zásadité soli AlOH2 +. K tvorbě Al (OH) 2+ a Al (OH) 3 nedochází, protože ionty AlOH 2+ disociují mnohem obtížněji než ionty Al (OH) 2+ a Al (OH) 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
AlCl 3 ⇔ Al 3+ + 3Cl -;
Al 3+ + H 2 O ⇔ AlOH 2+ + H +
nebo v molekulární formě:
AlCl3 + H20 ⇔ 2AlOHCl2 + HCl
V roztoku se objevuje nadbytek vodíkových iontů, které dávají roztoku Al2 (SO4) 3 kyselé prostředí, pH< 7.
c) NiSO4 je sůl slabé polykyselinové báze Ni (OH) 2 a silné kyseliny dvojsytné H2SO4. V tomto případě kationty Ni2 + vážou OH- ionty vody a vytvářejí kationty zásadité soli NiOH +. Ni (OH) 2 nevzniká, protože ionty NiOH + disociují mnohem obtížněji než molekuly Ni (OH) 2. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Ni (NO 3) 2 ⇔ Ni 2+ + 2NO 3 -;
Ni 2+ + H 2 O ⇔ NiOH + + H +
nebo v molekulární formě:
2NiSO 4 + 2Н 2 О (NiOH) 2 SO 4 + H 2 SO 4
V roztoku se objevuje nadbytek vodíkových iontů, které dávají roztoku NiSO 4 kyselé prostředí, pH< 7.
Úkol 207.
Vytvořte iontově-molekulární a molekulární rovnice pro hydrolýzu solí Pb (NO 3) 2, Na 2 CO 3, Fe 2 (SO 4) 3. Jaká je hodnota pH (> 7<) имеют растворы этих солей?
Řešení:
a) Pb (NO 3) 2 je sůl slabé báze a silné kyseliny. V tomto případě kationty Pb 2+ vážou ionty OH - vody a vytvářejí kationty zásadité soli PbOH +. K tvorbě Pb (OH) 2 nedochází, protože ionty PbOH + disociují mnohem obtížněji než molekuly Pb (OH) 2. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Pb (NO 3) 2 ⇔ Pb 2+ + 2NO 3 -;
Pb 2+ + H 2 O ⇔ PbOH + + H +
nebo v molekulární formě:
Pb (NO 3) 2 + H 2 O ⇔ PbOHNO 3 + HNO 3
V roztoku se objevuje nadbytek vodíkových iontů, které dávají roztoku Pb (NO 3) 2 kyselé prostředí, pH< 7.
b) Na 2 CO 3 je sůl silné báze a slabé kyseliny. V tomto případě váží anionty CO 3 2 vodíkové ionty H + voda za vzniku aniontů kyselé soli HCO 3 -. K tvorbě H 2 CO 3 nedochází, protože ionty HCO 3 se disociují mnohem obtížněji než molekuly H 2 CO 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
Na2CO3-2Na + + CO3 2-;
CO 3 2- + H 2 O ⇔ HCO 3 - + ОH -
nebo v molekulární formě:
Na 2 CO 3 + H 2 O ⇔ C02 + 2 NaOH
V roztoku se objevuje nadbytek hydroxidových iontů, což dává roztoku Na2CO3 zásadité prostředí, pH> 7.
c) Fe 2 (SO 4) 3 je sůl slabé báze a silné kyseliny. V tomto případě kationty Fe 3+ vážou ionty OH - vody a tvoří kationty zásadité soli FeOH 2+. K tvorbě Fe (OH) 2+ a Fe (OH) 3 nedochází, protože ionty FeOH 2+ disociují mnohem obtížněji než ionty Fe (OH) 2+ a Fe (OH) 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Fe 2 (SO 4) 3 ⇔ 2Fe 3+ + 3SO 4 2 -
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +
Molekulární forma procesu:
Fe 2 (SO 4) 3 + 2H 2 O ⇔ 2 FeOHSO 4 + H 2 SO 4.
V roztoku se objevuje nadbytek vodíkových iontů, které dávají roztoku Fe2 (SO4) 3 kyselé prostředí, pH< 7.
Úkol 208.
Vytvořte iontově-molekulární a molekulární rovnice pro hydrolýzu solí NSOOK, ZnSO 4, Al (NO 3) 3. Jaká je hodnota pH (> 7<) имеют растворы этих солей?
Řešení:
a) NSOOK - sůl silných monokyselinová báze KOH a slabý jednosytná kyselina UNLO. V tomto případě НСОО - anionty vážou vodíkové ionty Н + vody a vytvářejí slabý НСООН elektrolyt. Rovnice iontové-molekulární hydrolýzy:
НСООК ⇔ К + + НСОО -;
НСОО - + H 2 O ⇔ НСООН + ОH -
nebo v molekulární formě:
NSOOK + H 2 O NSOOH + KOH
V roztoku se objevuje nadbytek hydroxidových iontů, které propůjčují roztoku HCOOK zásadité médium, pH> 7.
b) ZnSО 4 je sůl slabé polykyselinové báze Zn (OH) 2 a silné polybazické kyseliny. V tomto případě kationty Zn 2+ vážou ionty OH - vody a vytvářejí kationty zásadité soli ZnOH +. K tvorbě Zn (OH) 2 nedochází, protože ionty CoOH + disociují mnohem obtížněji než molekuly Zn (OH) 2. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
ZnSO 4 Zn 2+ + SO 4 2-;
Zn 2+ + H 2 O ZnOH + + H +
nebo v molekulární formě:
2ZnSО4 + 2Н2О (ZnOH) 2SO4 + H2SO4
V roztoku se objevuje nadbytek vodíkových iontů, které propůjčují kyselému prostředí roztok ZnSО 4, pH< 7.
c) Al (NO 3) 3 - sůl slabého polykyselý základ Al (OH) 3 a silný jednosytná kyselina HNO 3. V tomto případě kationty Al 3+ vážou ionty OH - vody a vytvářejí kationty zásadité soli AlOH2 +. K tvorbě Al (OH) 2+ a Al (OH) 3 nedochází, protože ionty AlOH 2+ disociují mnohem obtížněji než ionty Al (OH) 2+ a Al (OH) 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Al (NO3) 3 ⇔ Cr 3+ + 3NO 3 -
Al 3+ + H 2 O ⇔ AlOH 2+ + H +
Al (NO 3) 3 + H 2 O ⇔ AlOH (NO 3) 2 + HNO 3
< 7.
Úkol 209.
Jaká je hodnota pH (> 7<) имеют растворы солей Na 3 PO 4 , K 2 S, CuSO 4 ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Řešení:
a) Ortofosforečnan sodný Na 3 PO 4 je sůl slabé vícesytné kyseliny H 3 PO 4 a silné jednokyselinové báze. V tomto případě anionty РО 4 3- vážou vodíkové ionty Н + vody a tvoří anionty kyselé soli HРО 4 2-. K tvorbě H 2 PO 4 - a H 3 PO 4 nedochází, protože ionty HRO 4 2 - disociují mnohem obtížněji než ionty H 2 PO 4 - a molekuly H 3 PO 4. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
Na3P04 ~ 3Na + + PO4 3-;
PO 4 3- + H 2 O ⇔ HRO 4 2- + OH-
nebo v molekulární formě:
Na 3 PO 4 + H 2 O ⇔ Na 2 HPO 4 + NaOH
V roztoku se objevuje nadbytek hydroxidových iontů, což dává roztoku Na3P04 zásadité médium, pH> 7.
b) K2S je sůl silné jednokyselinové báze KOH a slabé vícesytné kyseliny H 2 S. V tomto případě S 2 anionty vážou vodíkové ionty H + vody a tvoří anionty kyselé soli HS-. K tvorbě H 2 S nedochází, protože ionty HS - disociují mnohem obtížněji než molekuly H2S. Hydrolýza probíhá za normálních podmínek podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
K 2 S ⇔ 2K + + S 2-;
S 2- + H 2 O ⇔ НS - + ОH -
nebo v molekulární formě:
K2S + 2H 2 O ⇔ KHS + KOH
V roztoku se objevuje nadbytek hydroxidových iontů, což dává roztoku K2S zásadité prostředí, pH> 7.
c) CuSO 4 je sůl slabé báze a silné kyseliny. V tomto případě kationty Cu 2+ vážou ionty OH - vody a vytvářejí kationty zásadité soli CuOH +. K tvorbě Cu (OH) 2 nedochází, protože ionty CuOH + disociují mnohem obtížněji než molekuly Cu (OH) 2. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
CuSO 4 ⇔ Cu 2+ + SO 4 2-;
Cu 2+ + H 2 O ⇔ CuOH + + H +
nebo v molekulární formě:
2CuSO 4 + 2Н 2 О ⇔ (CuOH) 2 SO 4 + H 2 SO 4
V roztoku se objevuje nadbytek vodíkových iontů, které dávají roztoku CuS04 kyselé prostředí, pH< 7.
Úkol 210.
Vytvořte iontově-molekulární a molekulární rovnice pro hydrolýzu solí CuCl 2, Cs 2 CO 3, Cr (NO 3) 3. Jaká je hodnota pH (> 7<) имеют растворы этих солей?
Řešení:
a) CuCl2 je sůl slabé polykyselinové báze Cu (OH) 2 a silné jednosytné kyseliny HCl. V tomto případě kationty Cu 2+ vážou ionty OH - vody a vytvářejí kationty zásadité soli CuOH +. K tvorbě Cu (OH) 2 nedochází, protože ionty CuOH + disociují mnohem obtížněji než molekuly Cu (OH) 2. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
CuCl 2 ⇔ Cu 2+ + 2Cl -;
Cu 2+ + H 2 O ⇔ CuOH + + H +
nebo v molekulární formě:
CuCl 2 + H 2 O ⇔ CuOHCl + HCl
V roztoku se objevuje nadbytek vodíkových iontů H +, které dávají roztoku CuCl2 kyselé prostředí, pH< 7.
b) Cs 2 CO 3 je sůl silné jednokyselinové báze CsOH a slabé dvojsytné kyseliny H 2 CO 3. V tomto případě váží anionty CO 3 2 vodíkové ionty H + voda za vzniku aniontů kyselé soli HCO 3 -. K tvorbě H 2 CO 3 nedochází, protože ionty HCO 3 se disociují mnohem obtížněji než molekuly H 2 CO 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se hydrolyzuje na aniontu. Rovnice iontové-molekulární hydrolýzy:
Cs 2 CO 3-2Cs + + CO 3 2-;
CO 3 2- + H 2 O ⇔ HCO 3 - + ОH -
nebo v molekulární formě:
Cs2CO 3 + Н 2 О ⇔ СО 2 + 2CsOH
V roztoku se objevuje nadbytek hydroxidových iontů, což dává roztoku Cs2CO3 zásadité prostředí, pH> 7.
c) Cr (NO 3) 3 je sůl slabé vícekyselinové báze Cr (OH) 3 a silné jednosytné kyseliny HNO 3. V tomto případě kationty Cr 3+ vážou ionty OH - vody a tvoří kationty zásadité soli CrOH 2+. K tvorbě Cr (OH) 2 + a Cr (OH) 3 nedochází, protože ionty CrOH 2+ disociují mnohem obtížněji než ionty Cr (OH) 2 + a Cr (OH) 3. Za normálních podmínek hydrolýza probíhá podle prvního stupně. Sůl se kationtově hydrolyzuje. Rovnice iontové-molekulární hydrolýzy:
Cr (NO 3) 3 ⇔ Cr 3+ + 3NO 3 -
Cr 3+ + H 2 O ⇔ CrOH 2+ + H +
Rovnice molekulární reakce:
Cr (NO 3) 3 + Н 2 О ⇔ CrOH (NO 3) 2 + HNO 3
V roztoku se objevuje nadbytek vodíkových iontů, které dávají roztoku Cr (NO 3) 3 kyselé prostředí, pH< 7.
DEFINICE
Sulfid draselný- střední sůl tvořená silnou zásadou - hydroxidem draselným (KOH) a slabou kyselinou - sirovodíkem (H 2 S). Formule - K 2 S.
Molární hmotnost je 110 g / mol. Představuje bezbarvé krychlové krystaly.
Hydrolýza sulfidu draselného
Aniont hydrolyzován. Povaha média je zásaditá. Rovnice hydrolýzy je následující:
První část:
K 2 S ↔ 2K + + S 2- (disociace soli);
S 2 - + HOH ↔ HS - + OH - (aniontová hydrolýza);
2K + + S 2- + HOH ↔ HS - + 2K + + OH - (rovnice v iontové formě);
K 2 S + H 2 O ↔ KHS + KOH (molekulární rovnice).
Druhá fáze:
KHS ↔ K + + HS - (disociace solí);
HS - + HOH ↔H 2 S + OH - (aniontová hydrolýza);
K + + 2HS - + HOH ↔ H 2 S + K + + OH - (rovnice v iontové formě);
KHS + H 2 O ↔ H 2 S + KOH (molekulární rovnice).
Příklady řešení problémů
PŘÍKLAD 1
| Cvičení | Sulfid draselný se získává zahříváním směsi draslíku a síry na teplotu 100-200 o C. Jaká hmotnost reakčního produktu se vytvoří, když reaguje 11 g draslíku a 16 g síry? |
| Řešení | Napíšeme rovnici pro reakci interakce síry a draslíku: Zjistíme počet molů výchozích látek pomocí údajů uvedených v prohlášení o problému. Molární hmotnost draslíku je –39 g / mol, síry - 32 g / mol. υ (K) = m (K) / M (K) = 11/39 = 0,28 mol; υ (S) = m (S) / M (S) = 16/32 = 0,5 mol. Nedostatek draslíku (υ (K)< υ(S)). Согласно уравнению υ (K 2 S) = 2 × υ (K) = 2 × 0,28 = 0,56 mol. Najděte hmotnost sulfidu draselného (molární hmotnost - 110 g / mol): m (K 2 S) = υ (K 2 S) × M (K 2 S) = 0,56 × 110 = 61,6 g. |
| Odpovědět | Hmotnost sulfidu draselného je 61,6 g. |
Hydrolýza solí je chemická interakce solných iontů s vodními ionty, což vede k tvorbě slabého elektrolytu.
Pokud budeme uvažovat sůl jako produkt neutralizace zásady kyselinou, pak soli lze rozdělit do čtyř skupin, pro každou z nich bude hydrolýza probíhat vlastním způsobem.
1). Hydrolýza není možná
Sůl tvořená silnou zásadou a silnou kyselinou ( KBr, NaCl, NaNO 3), nepodstoupí hydrolýzu, protože v tomto případě se nevytvoří slabý elektrolyt.
pH takovýchto roztoků = 7. Reakce média zůstává neutrální.
2). Hydrolýza kationtem (pouze kation reaguje s vodou)
V soli vytvořené se slabou zásadou a silnou kyselinou ( FeCl 2,NH 4 Cl, Al 2 (SO 4) 3, MgSO 4) kationt podléhá hydrolýze:
FeCl 2 + HOH<=>Fe (OH) Cl + HCl
Fe 2+ + 2Cl - + H + + OH -<=>FeOH + + 2Cl - +
H +
V důsledku hydrolýzy vzniká slabý elektrolyt, H + ion a další ionty.
pH roztoku< 7 (раствор приобретает кислую реакцию).
3).Aniontová hydrolýza (pouze anion reaguje s vodou)
Sůl tvořená silnou zásadou a slabou kyselinou ( KClO, K 2 SiO 3, Na 2 CO 3, CH 3 COONa) prochází hydrolýzou aniontem, což vede k tvorbě slabého elektrolytu, hydroxidového iontu OH - a dalších iontů.
K 2 SiO 3 + HOH<=>KHSiO 3 + KOH
2K + + SiO 3 2- + H + + OH -<=>HSiO 3 - + 2K + + OH -
Hodnota pH těchto roztoků je> 7 (roztok se stává zásaditým).
4). Společná hydrolýza (kation i anion reagují s vodou)
Sůl tvořená slabou zásadou a slabou kyselinou ( CH 3 COONH 4, (NH 4) 2 CO 3, Al 2 S 3), je hydrolyzován jak kationtem, tak aniontem. V důsledku toho se tvoří špatně disociující báze a kyselina. PH roztoků takových solí závisí na relativní síle kyseliny a zásady. Míra síly kyseliny a zásady je disociační konstanta odpovídajícího činidla.
Reakce média těchto roztoků může být neutrální, slabě kyselá nebo slabě zásaditá:
Al 2 S 3 + 6H 2 O => 2 Al (OH) 3 ↓ + 3H 2 S
Hydrolýza je reverzibilní proces.
Hydrolýza je nevratná, pokud reakce vede k tvorbě nerozpustné báze a / nebo těkavé kyseliny
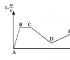
Algoritmus pro vypracování rovnic pro hydrolýzu solí
|
Řád úvah |
Příklad |
||||
|
1. Určete sílu elektrolytu - zásady a kyseliny, které tvoří dotyčnou sůl. Pamatovat si! Hydrolýza vždy probíhá přes slabý elektrolyt; silný elektrolyt je v roztoku ve formě iontů, které nejsou vázány vodou.
|
Na 2 CO 3 - uhličitan sodný, sůl tvořená silnou zásadou (NaOH) a slabá kyselina (H 2 CO 3 ) |
||||
|
2. Zapíšeme disociaci soli ve vodném roztoku, určíme slabý elektrolytový iont, který je součástí soli: |
2 Na + + CO 3 2- + H + ACH - ↔ Toto je aniontová hydrolýza Ze slabého elektrolytu je v soli přítomen aniontCO 3 2- , váže se s molekulami vody na slabý elektrolyt - dochází k hydrolýze aniontů. |
||||
|
3. Zapíšeme kompletní iontová rovnice hydrolýza - slabý elektrolytový iont je vázán molekulami vody |
2Na + + CO 3 2- + H + OH - ↔ (HCO 3) - + 2Na + + OH - V reakčních produktech jsou přítomny ionty OH - médium je proto zásaditépH>7 |
||||
|
4 ... Zápis molekulární hydrolýzy |
Na 2 CO 3 + HOH ↔ NaHCO 3 + NaOH |
Praktické použití.
V praxi se musí učitel vypořádat s hydrolýzou například při přípravě roztoků hydrolyzačních solí (například octan olovnatý). Obvyklá „technika“: do baňky se nalije voda, nalije se sůl, protřepe se. Zůstává bílá sraženina. Přidáme více vody, protřepeme, sediment nezmizí. Přidejte z konvice horká voda- sediment se zdá být ještě větší ... A důvodem je, že solná hydrolýza probíhá současně s rozpuštěním a bílý sediment, který vidíme, jsou již produkty hydrolýzy - špatně rozpustné zásadité soli. Všechny naše další akce, ředění, zahřívání, pouze zvyšují stupeň hydrolýzy. Jak potlačit hydrolýzu? Nezahřívejte, nepřipravujte příliš zředěné roztoky, a protože hydrolýza kationtem hlavně interferuje - přidejte kyseliny. Lepší než vhodné, tedy ocet.
V ostatních případech je žádoucí zvýšit stupeň hydrolýzy, a aby byl alkalický prací roztok lněné sody aktivnější, zahřejeme jej - stupeň hydrolýzy uhličitanu sodného se zvýší.
Důležitou roli hraje hydrolýza v procesu deferrizace vody provzdušňováním. Když je voda nasycena kyslíkem, hydrogenuhličitan železa (II) v něm obsažený se oxiduje na sůl železa (III), která podléhá hydrolýze mnohem silněji. V důsledku toho dochází k úplné hydrolýze a železo se oddělí ve formě sraženiny hydroxidu železitého.
Z toho také vychází použití solí hliníku jako koagulantů v procesech čištění vody. Soli hliníku přidávané do vody v přítomnosti hydrogenuhličitanových iontů jsou zcela hydrolyzovány a objemný hydroxid hlinitý koaguluje a vtahuje různé nečistoty do sedimentu.„Posílení hydrolýzy solí při zahřívání“
ÚKOLY PRO KOTVENÍ
№1.Zapište si rovnice hydrolýzy soli a určete médium vodní roztoky(pH) a typ hydrolýzy:
Na 2 SiO 3, AlCl 3, K 2 S.
Č. 2. Vytvořte rovnice pro hydrolýzu solí, určete typ hydrolýzy a roztokové médium:
Siřičitan draselný, chlorid sodný, bromid železitý
Č. 3. Vytvořte rovnice hydrolýzy, určete typ hydrolýzy a médium vodného roztoku soli pro následující látky:
Sulfid draselný - K 2 S, bromid hlinitý - AlBr 3, chlorid lithný - LiCl, fosforečnan sodný - Na 3 PO 4, síran draselný - K 2 SO 4, chlorid zinečnatý - ZnCl 2, siřičitan sodný - Na 2 SO 3, síran amonný - (NH 4) 2 SO 4, bromid barnatý - BaBr 2.