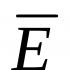Hořčík je důležitým kovem pro průmysl a lidský život. Hořčík
Síla, přitažlivost, síla - tak lidé starověkého Řecka interpretovali slovo „magnes“. V této zemi bylo město jménem Magnesia. V blízkosti těchto osad se těžila magnetická železná ruda, která, jak známo, má sílu přitahovat kovové předměty.
Ale, kovový hořčík pojmenovaný nikoli podle železité horniny, ale podle prášku „bílá magnézie“. Řekové jej získávali z nerostu, který byl k dispozici i poblíž starověkého osídlení. Po kalcinaci se kámen změnil na bílý prášek - oxid hořečnatý. Řekové nevěděli, že látka je kov, ale všimli si léčivých vlastností kompozice. Pomáhal při onemocněních jater a ledvin, plnil roli projímadla.
Droga nevyšla z používání po celá staletí a v roce 1808 z ní Geoffrey Davy během experimentů izoloval neznámý kov. Bez dlouhého přemýšlení pojmenoval vědec z Anglie objevený prvek hořčík. V Evropě se tomu tak říká dodnes. Říkají tomu Rusové kovový hořčík díky učebnici Hermanna Hesse. Navzdory svým německým kořenům je chemik Rus. V roce 1831 přeložil západní učebnici. Vědec přeměnil slovo „magnesium“ na „magnesium“. Tak získal prvek zvláštní jméno v ruské vědě.
V periodické tabulce chemických prvků Hořčík zaujímá 12. pozici. Nachází se v hlavní podskupině skupiny na čísle dvě. Prvek je bílý se stříbrnými odlesky. Tato barva je charakteristická pro všechny kovy alkalických zemin, které spolu se stronciem, radiem a bariem zahrnují také hořčík. Je to „chmýří“ mezi kovy. Například železo a měď jsou téměř 5krát těžší. I lehký hliník převáží prvek č. 12 na misce.

Lehkost hořčíku je prospěšná pro konstruktéry a výrobce letadel. Nemusí být těžké, aby měly dobré letové vlastnosti. Čistý kov č. 12 však nelze použít pro stejný letoun. Je příliš měkký a poddajný.
Musíme udělat slitiny s manganem, hliník nebo . Dodávají manganu pevnost, aniž by přidávali velkou váhu. Směsi se používají především k výrobě obkladů pro „železné ptactvo“. První letoun na bázi hořčíkových slitin byl mimochodem dílem domácích leteckých techniků. Loď byla vytvořena již v roce 1934 a pojmenována „Sergo Ordzhonekidze“.
Prvek hořčíku velmi těžké roztavit. Vyžaduje se pouze 650 stupňů Celsia. Již při 550 však kov vzplane a rozpustí se v atmosféře. Produkovaný plamen je velmi působivý, a tak kov našel uplatnění v pyrotechnickém průmyslu.
Bez ní se neobejde ani jeden ohňostroj nebo prskavka. Pokud je hořčík skladován doma, je lepší nerozlévat bělidlo v jeho blízkosti. V přítomnosti chlóru se 12. prvek rozsvítí i při teplotě 25 stupňů.

Produkty spalování hořčíku jsou ultrafialové paprsky a teplo. I pár gramů kovu stačí k uvaření 200 mililitrů vody. To je docela dost na pití čaje. Vědci z Varšavy se rozhodli „přinutit“ živel ohřívat jídlo. Fyzici je zabudovali do zavařovacích sklenic hořčíková páska. Při otevření nádoby se vložka zapálí a zahřeje obsah nádoby. Tady je hotový oběd.
Samoohřívací plechovky se vyrábějí tisíce let. Vklady hořčíku v hloubkách konkurují rezervám pouze 7 prvků. Je tam jen více křemíku, kyslíku, železa, hliníku a vápníku. Kov číslo 12 je součástí dvou set minerálů. Prvek je extrahován z karnalitu v průmyslovém měřítku.
Hořčík je také hlavní složkou magmatu, horké vrstvy mezi jádrem planety a jejím povrchem. V mořské vodě obsahuje prvek č. 12 4 kilogramy na metr krychlový.
Pokud se oceánská voda smíchá se skořápkami rozdrcenými na prášek, výsledek bude chlorid hořečnatý. Čistý kov z něj lze izolovat elektrolýzou. Ale tato metoda byla použita pouze během druhé světové války. Vytěžili jsme asi 100 tisíc tun prvku č. 12 a uklidnili jsme se, protože zpracování zdrojů moří v obrovských nádržích je obtížná záležitost.
Pro metalurgii, jednoho z hlavních spotřebitelů hořčíku, je dostatek zásob v zemské kůře. Kov je nezbytný při výrobě téměř všech slitin. Prvek č. 12 v nich snižuje obsah kyslíku, což prudce zhoršuje kvalitu produktu. Přimět hořčík, aby se stal součástí jakékoli slitiny, není snadné. Díky své lehkosti se netopí v jiných kovech. V důsledku „výbušné reakce“ na vzduch vzplane na povrchu směsí.

Hutníci musí rozmarný kov slisovat do briket, umístit do nich závaží a teprve potom je spustit do kompozice k přetavení.
Lehkost hořčíku přitahovala a. Přidávají prvek do drahých slitin, aby byly předměty lehčí. To je velmi užitečné, pokud je dekorace objemná a působivých rozměrů. Ne každý chce mít za šperk neuvěřitelnou váhu. Hořčík přichází na pomoc.
Ale pokud je výroba šperků bez hořčíku možná, pak život není. Kovový hořčík je součástí chlorofylu. Je součástí vegetace, látka zodpovědná za fotosyntézu. To znamená, že bez prvku č. 12 by proces přeměny oxidu uhličitého na kyslík nebyl možný. Atmosféra planety by byla jiná, takže by se lidstvo na Zemi sotva objevilo, kdyby na ní nebyl hořčík.
Tento kov také napomáhá bušení lidského srdce, a to nejen tím, že mu dodává kyslík. Hořčík je nezbytný pro stabilní činnost srdečního svalu. Podle statistik k infarktu dochází především u lidí, jejichž tělo nemá dostatek prvku č. 12. Proto neuškodí jíst dýňová semínka, otruby, pít kakao a čaj. Tyto potraviny obsahují nejvíce hořčíku.
Bohatá ložiska magnezitu se u nás nacházejí na Středním Uralu (Satkinskoye) a v oblasti Orenburgu (Khalilovskoye). A v oblasti města Solikamsk se vyvíjí největší světové ložisko karnallitu. Dolomit, nejběžnější z minerálů obsahujících hořčík, se nachází v oblasti Donbasu, Moskvy a Leningradu a na mnoha dalších místech.
Kovový hořčík se vyrábí dvěma způsoby – elektrotermickým (neboli metalotermickým) a elektrolytickým. Jak názvy napovídají, oba procesy zahrnují elektřinu. Ale v prvním případě se jeho role redukuje na zahřívání reakčního zařízení a oxid hořečnatý získaný z minerálů se redukuje nějakým redukčním činidlem, například uhlím, křemíkem, hliníkem. Tato metoda je poměrně slibná a v poslední době se stále více používá. Hlavní průmyslovou metodou výroby Mg je však druhá, elektrolytická.
Elektrolyt je tavenina bezvodých chloridů hořčíku, draslíku a sodíku; kovový hořčík se uvolňuje na železné katodě a ionty chloru se uvolňují na grafitové anodě. Proces probíhá ve speciálních elektrolyzérových lázních. Roztavený hořčík vyplave na hladinu lázně, odkud se čas od času odebírá vakuovou naběračkou a poté se nalévá do forem. Tím ale proces nekončí: v takovém hořčíku je stále příliš mnoho nečistot. Proto je nevyhnutelná druhá etapa - čištění Mg. Hořčík lze rafinovat dvěma způsoby – přetavením a tavidly nebo sublimací ve vakuu. Význam prvního způsobu je dobře znám: speciální přísady - tavidla - interagují s nečistotami a přeměňují je na sloučeniny, které lze z kovu snadno mechanicky oddělit. Druhý způsob – vakuová sublimace – vyžaduje složitější zařízení, ale s jeho pomocí se získá čistší hořčík. Sublimace se provádí ve speciálních vakuových zařízeních - ocelových válcových retortách. „Drsný“ kov se umístí na dno retorty, uzavře a vzduch se odčerpá. Poté je spodní část retorty ohřívána a horní část je neustále ochlazována venkovním vzduchem. Pod vlivem vysoké teploty hořčík sublimuje - přechází do plynného stavu a obchází kapalný stav. Jeho pára stoupá a kondenzuje na studených stěnách horní části retorty. Tímto způsobem je možné získat velmi čistý kov obsahující přes 99,99 % hořčíku.
Z království Neptun
Ale nejen zemská kůra je bohatá na hořčík - prakticky nevyčerpatelné a neustále doplňované zásoby jsou uloženy v modrých spížích oceánů a moří. Každý metr krychlový mořské vody obsahuje asi 4 kg hořčíku. Celkem je ve vodách světových oceánů rozpuštěno více než 64 016 tun tohoto prvku.
Těžba hořčíku
Jak se hořčík získává z moře? Mořská voda se v obrovských nádržích mísí s vápenným mlékem vyrobeným z mletých mořských lastur. Vzniká tak tzv. magnéziové mléko, které se suší a přeměňuje na chlorid hořečnatý. No a pak přicházejí na řadu elektrolytické procesy.
Zdrojem hořčíku může být nejen mořská voda, ale i voda ze slaných jezer obsahujících chlorid hořečnatý. V naší zemi máme taková jezera: na Krymu - Saki a Sasyk-Sivash, v oblasti Volhy - jezero Elton a mnoho dalších.
K jakým účelům slouží prvek č. 12 a jeho spoje?
Hořčík je extrémně lehký a tato vlastnost by z něj mohla udělat vynikající konstrukční materiál, ale, bohužel, čistý hořčík je měkký a křehký. Proto konstruktéři používají hořčík ve formě slitin s jinými kovy. Zvláště široce používané jsou slitiny hořčíku s hliníkem, zinkem a manganem. Každá z komponent přispívá svým vlastním příspěvkem k celkovým vlastnostem: hliník a zinek zvyšují pevnost slitiny, mangan zvyšuje její antikorozní odolnost. No a co hořčík? Hořčík dělá slitinu lehkou - díly vyrobené z hořčíkové slitiny jsou o 20-30% lehčí než hliník a 50-75% lehčí než litina a ocel... Existuje mnoho prvků, které zlepšují slitiny hořčíku, zvyšují jejich tepelnou odolnost a tažnost a aby byly odolnější vůči oxidaci. Jedná se o lithium, berylium, vápník, cer, kadmium, titan a další.
Hořčíková raketa nevzlétne, ale...
Ale bohužel existují také „nepřátelé“ - železo, křemík, nikl; zhoršují mechanické vlastnosti slitin a snižují jejich korozní odolnost.
Slitiny hořčíku jsou široce používány. Letecká a proudová technika, jaderné reaktory, díly motorů, benzínové a olejové nádrže, přístroje, karoserie, autobusy, auta, kola, olejová čerpadla, sbíječky, pneumatické vrtačky, fotoaparáty a filmové kamery, dalekohledy – toto není úplný seznam aplikací slitiny hořčíku.
Hořčík hraje významnou roli v metalurgii. Používá se jako redukční činidlo při výrobě některých cenných kovů – vanadu, chrómu, titanu, zirkonu. Hořčík zaváděný do roztavené litiny ji upravuje, to znamená, že zlepšuje její strukturu a zvyšuje její mechanické vlastnosti. Upravené litinové odlitky úspěšně nahrazují ocelové výkovky. Kromě toho metalurgové používají hořčík k deoxidaci oceli a slitin.
Vlastnost hořčíku (ve formě prášku, drátu nebo pásky) - hořet bílým, oslnivým plamenem - se široce používá ve vojenském vybavení pro výrobu osvětlovacích a signálních světlic, sledovacích kulek a granátů a zápalných bomb. Fotografové hořčík znají: „Uklidněte se! Já natáčím!" - a jasný záblesk hořčíku vás na okamžik oslepí. Hořčík však tuto roli hraje stále méně často - téměř všude ho nahradila elektrická lampa „blitz“.
Aplikace hořčíku
A hořčík se podílí na dalším grandiózním díle – akumulaci sluneční energie. Je součástí chlorofylu, který pohlcuje sluneční energii a s její pomocí přeměňuje oxid uhličitý a vodu na složité organické látky (cukr, škrob aj.) nezbytné pro výživu lidí a zvířat. Bez chlorofylu by nebyl život a bez hořčíku by nebyl chlorofyl – obsahuje 2 % tohoto prvku. Je to příliš? Posuďte sami: celkové množství hořčíku v chlorofylu všech rostlin na Zemi je asi 100 miliard tun! Prvek č. 12 se také nachází téměř ve všech živých organismech.
Pokud vážíte 60 kg, přibližně 25 g z toho je hořčík. Služby hořčíku jsou široce využívány v medicíně: každý zná „epsomskou sůl“ MgSO 4 -7H 2 O. Při perorálním podání slouží jako spolehlivé a rychle působící projímadlo a při intramuskulární nebo intravenózní aplikaci ulevuje konvulzivní stavy a snižuje cévní křeče. Čistý oxid hořečnatý (hořčík spálený) se používá při zvýšené kyselosti žaludeční šťávy, pálení žáhy a otravách kyselinami. Peroxid hořečnatý slouží jako dezinfekční prostředek při žaludečních potížích.
Medicína se však neomezuje pouze na oblasti použití sloučenin hořčíku. Oxid hořečnatý se tedy používá při výrobě cementů, žáruvzdorných cihel a v gumárenském průmyslu. Peroxid hořečnatý (“Novozon”) se používá k bělení tkanin. Síran hořečnatý se používá v textilním a papírenském průmyslu jako mořidlo k barvení, vodný roztok chloridu hořečnatého se používá k přípravě hořečnatého cementu, xylolitu a dalších syntetických materiálů. Uhličitan hořečnatý MgCO 3 se používá při výrobě tepelně izolačních materiálů.
A konečně další širokou oblastí činnosti hořčíku je organická chemie. Hořčíkový prášek se používá k dehydrataci důležitých organických látek, jako je alkohol a anilin. Organohořečnaté sloučeniny jsou široce používány při syntéze mnoha organických látek.
Činnost hořčíku v přírodě a národním hospodářství je tedy velmi mnohostranná. Ale ti, kdo si myslí: „už udělal všechno, co mohl“, mají stěží pravdu. Existují všechny důvody se domnívat, že nejlepší role hořčíku teprve přijde.
 Výrobky obsahující hořčík
Výrobky obsahující hořčík - SUROVINY NA DLAŽBĚ. Na přání lze hořčík extrahovat i z... jednoduchých dlažebních kostek: vždyť každý kilogram kamene použitého na dláždění silnic obsahuje přibližně 20 g hořčíku. Takový postup však zatím není potřeba - hořčík ze silničního kamene by byl příliš drahý.
- HOŘČÍK, DRUHÁ A ÉRA. Kolik hořčíku je v oceánu? Představme si, že od prvních dnů našeho letopočtu lidé začali jednotně a intenzivně získávat hořčík z mořské vody a do dnešního dne vyčerpali všechny vodní zásoby tohoto prvku. Jaká by podle vás měla být „intenzita“ těžby? Ukazuje se, že každou vteřinu po dobu téměř 2000 let by bylo nutné těžit. milionů tun! Ale ještě za druhé světové války, kdy byla produkce tohoto kovu na maximu, se z mořské vody získávalo jen 80 tisíc tun hořčíku ročně (!).
- CHUTNÉ LÉKY. Statistiky ukazují, že obyvatelé oblastí s teplejším podnebím pociťují křeče krevních cév méně často než seveřané. Medicína to vysvětluje nutričními charakteristikami obou. Koneckonců, je známo, že intravenózní a intramuskulární infuze roztoků určitých hořečnatých solí uvolňují křeče a křeče. Ovoce a zelenina napomáhají akumulaci potřebné zásoby těchto solí v těle. Na hořčík jsou bohaté zejména meruňky, broskve a květák. Nachází se také v běžném zelí, bramborách a rajčatech.
- POZOR NEPOŠKOZIT. Práce s hořčíkovými slitinami někdy způsobuje nemalé potíže – hořčík snadno oxiduje. Tavení a odlévání těchto slitin musí být prováděno pod vrstvou strusky - jinak může dojít ke vznícení roztaveného kovu při kontaktu se vzduchem.
Při broušení nebo leštění hořčíkových výrobků musí být nad strojem instalováno zařízení na odsávání prachu, protože drobné částečky hořčíku rozptýlené ve vzduchu vytvářejí výbušnou směs.
To však neznamená, že jakákoli práce s hořčíkem je zatížena nebezpečím požáru nebo výbuchu. Hořčík můžete zapálit pouze roztavením, a to za normálních podmínek není tak snadné - vysoká tepelná vodivost slitiny nedovolí, aby zápalka nebo dokonce pochodeň proměnily lité výrobky na prášek bílého oxidu. S hoblinami nebo hořčíkovou topnou páskou je ale potřeba zacházet opravdu velmi opatrně.
- NEMUSÍTE ČEKAT. Běžné rádiové elektronky začnou normálně fungovat až poté, co se jejich mřížky zahřejí na 800 °C. Pokaždé, když zapnete rádio nebo televizi, musíte chvíli počkat, než začne proudit hudba nebo se rozbliká modrá obrazovka. Aby se odstranila tato nevýhoda rádiových trubic, polští vědci z katedry elektrotechniky Technické univerzity ve Vratislavi navrhli pokrýt katody výbojek MgO: takové výbojky začnou fungovat ihned po zapnutí.
- PROBLÉM VEJCE. Před několika lety si vědci z University of Minnesota v USA vybrali vaječné skořápky jako předmět vědeckého výzkumu. Podařilo se jim zjistit, že čím více hořčíku obsahuje, tím silnější je skořápka. To znamená, že změnou složení krmiva pro nosnice lze zvýšit pevnost skořápky. Důležitost tohoto závěru pro zemědělství lze posoudit podle následujících čísel: jen v Minnesotě přesahují roční ztráty v důsledku boje s vejci milion dolarů. Nikdo zde neřekne, že tato práce vědců „nestojí za sakra“.
- HOŘČÍK A... SRDCE. Pokusy provedené maďarskými vědci na zvířatech ukázaly, že nedostatek Mg v těle zvyšuje náchylnost k infarktu. Někteří psi dostali jídlo bohaté na soli tohoto prvku, jiní - chudí. Na konci experimentu utrpěli ti psi, jejichž strava měla nízký obsah hořčíku, infarkt myokardu.
- PÉČE O HOŘČÍK! Francouzští biologové věří, že hořčík lékařům pomůže v boji s tak závažným onemocněním 20. století, jako je přepracování. Studie ukazují, že krev unavených lidí obsahuje méně hořčíku než krev zdravých lidí a dokonce i ty nejnepatrnější odchylky „hořčíkové krve“ od normy neprojdou beze stopy.
Je důležité si uvědomit, že v případech, kdy je člověk z jakéhokoli důvodu často podrážděný, hořčík obsažený v těle „shoří“. To je důvod, proč u nervózních, snadno vznětlivých lidí jsou mnohem častěji pozorovány poruchy fungování srdečních svalů.
- HORČÍK Uhličitý A KAPALNÝ KYSLÍK. Velké nádoby na uchovávání kapalného kyslíku se obvykle vyrábějí ve tvaru válce nebo koule, aby se snížily tepelné ztráty. Dobře zvolená forma uložení ale není všechno. Je nutná spolehlivá tepelná izolace. Pro tyto účely můžete použít hluboké vakuum (jako v Dewarově baňce), můžete použít minerální vlnu, ale často se mezi vnitřní a vnější stěnu skladu nasype sypký prášek uhličitanu hořečnatého. Tato tepelná izolace je levná a spolehlivá.
Hořčík
HOŘČÍK-I; m[lat. magnium] Chemický prvek (Mg), lehký, tvárný kov stříbřitě bílé barvy, který hoří jasně bílým plamenem. Oxid hořečnatý. Vzplanutí hořčíku.
◁ Hořčík, oh, oh. M rudy. M. slitina.
hořčík(lat. Hořčík), chemický prvek II. skupiny periodického systému. Jméno od novolat. magnesia - magnesia. Stříbrný kov, velmi lehký a odolný; hustota 1,74 g/cm3, t pl 650 °C. Na vzduchu se pokryje ochranným oxidovým filmem; zapálené jemné hobliny a hořčíkový prášek hoří jasně bílým plamenem. Z hlediska rozšíření v zemské kůře se řadí na 8. místo mezi prvky (minerály magnezit, dolomit, karnallit). Používá se zejména při výrobě lehkých slitin, k dezoxidaci a odsiřování některých kovů, k redukci Hf, Ti, U, Zr a dalších kovů ze sloučenin (metalotermie), jako součást osvětlovacích a zápalných směsí pro střely a rakety.
HOŘČÍKMAGNESIUM (lat. Magnesium), Mg (čti „hořčík“), chemický prvek skupiny IIA třetího období periodického systému Mendělejeva (cm. MENDELEEVŮV PERIODICKÝ SYSTÉM PRVKŮ), atomové číslo 12, atomová hmotnost 24,305. Přírodní hořčík se skládá ze tří stabilních nuklidů (cm. NUKLID): 24 Mg (78,60 % hmotn.), 25 Mg (10,11 %) a 26 Mg (11,29 %). Elektronová konfigurace neutrálního atomu 1s 2
2s 2
p 6
3s 2
, podle kterého je hořčík ve stabilních sloučeninách dvojmocný (oxidační stav +2). Jednoduchá látka hořčík je lehký, stříbřitě bílý, lesklý kov.
Historie objevů
Sloučeniny hořčíku jsou člověku známy již dlouhou dobu. Latinský název prvku pochází z názvu starověkého města Magnesia v Malé Asii, v jehož blízkosti se nacházejí ložiska nerostu magnezitu (cm. magnezit). Kovový hořčík poprvé získal v roce 1808 anglický chemik G. Davy (cm. DAVY Humphrey). Stejně jako v případě ostatních aktivních kovů – sodíku, draslíku, vápníku, Davy použil k získání kovového hořčíku elektrolýzu. Elektrolýzu podrobil navlhčené směsi bílé magnézie (její složení zřejmě zahrnovalo oxid hořečnatý MgO a hydroxid hořečnatý Mg(OH) 2) a oxid rtuťnatý HgO. V důsledku toho dostal Davy amalgám - slitinu nového kovu se rtutí. Po oddestilování rtuti zůstal prášek nového kovu, který Davy nazval hořčík.
Hořčík získaný Davym byl značně špinavý, čistý kovový hořčík poprvé získal v roce 1828 francouzský chemik A. Bussy.
Být v přírodě
Hořčík je jedním z deseti nejběžnějších prvků v zemské kůře. Obsahuje 2,35 % hmotnostních hořčíku. Hořčík se pro svou vysokou chemickou aktivitu nevyskytuje ve volné formě, ale je obsažen v mnoha minerálech – silikáty, hlinitokřemičitany, uhličitany, chloridy, sírany atd. Hořčík je tedy obsažen v rozšířených olivínosilikátech (cm. OLIVINE)(Mg,Fe)2 a serpentin (cm. SERPENTINE) Mg6(OH)8. Praktický význam mají minerály obsahující hořčík, jako je azbest (cm. AZBEST (minerální)), magnezit (cm. magnezit), dolomit (cm. DOLOMIT) MgC03 CaC03, bischofit (cm. BISCHOFIT) MgCl2 6H20, karnallit (cm. KARNALIT) KCl MgCl2 6H20, epsomit (cm. EPSOMIT) MgS04 7H20, kainit (cm. KAINIT) KCl·MgSO 4 · 3H 2 O, astrachanit Na 2 SO 4 · MgSO 4 · 4H 2 O atd. Hořčík se nachází v mořské vodě (4 % Mg v suchém zbytku), v přírodních solných roztokech a v mnoha podzemních vodách.
Účtenka
Obvyklou průmyslovou metodou výroby kovového hořčíku je elektrolýza taveniny směsi bezvodých chloridů hořečnatých MgCl 2, NaCl sodného a KCl draselného. V této tavenině prochází chlorid hořečnatý elektrochemickou redukcí:
MgCl2 (elektrolýza) = Mg + Cl2.
Roztavený kov se periodicky odstraňuje z elektrolytické lázně a přidávají se do ní nové podíly surovin obsahujících hořčík. Protože takto získaný hořčík obsahuje relativně mnoho nečistot - asi 0,1 %, je v případě potřeby „surový“ hořčík podroben dodatečnému čištění. K tomuto účelu se používá elektrolytická rafinace, tavení ve vakuu pomocí speciálních přísad - tavidel, která „odstraňují“ nečistoty z hořčíku, nebo destilace (sublimace) kovu ve vakuu. Čistota rafinovaného hořčíku dosahuje 99,999 % a vyšší.
Byl vyvinut další způsob získávání hořčíku – termální. V tomto případě se koks používá k redukci oxidu hořečnatého při vysoké teplotě:
MgO + C = Mg + CO
nebo křemíku. Použití křemíku umožňuje získat hořčík ze surovin, jako je dolomit CaC03 ·MgC03, bez předběžné separace hořčíku a vápníku. Za účasti dolomitu dochází k následujícím reakcím:
CaCO 3 MgCO 3 = CaO + MgO + 2CO 2,
2MgO + 2CaO + Si = Ca2Si04 + 2Mg.
Výhodou tepelné metody je, že umožňuje získat hořčík vyšší čistoty. K získávání hořčíku se používají nejen minerální suroviny, ale také mořská voda.
Fyzikální a chemické vlastnosti
Kovový hořčík má hexagonální krystalovou mřížku. Bod tání 650°C, bod varu 1105°C, hustota 1,74 g/cm 3 (hořčík je velmi lehký kov, lehčí je pouze vápník a alkalické kovy (cm. ALKALICKÉ KOVY)). Standardní elektrodový potenciál hořčíku Mg/Mg 2+ je –2,37 V. V řadě standardních potenciálů je umístěn za sodíkem a před hliníkem.
Povrch hořčíku je pokryt hustým filmem oxidu MgO, který za normálních podmínek spolehlivě chrání kov před další destrukcí. Teprve při zahřátí kovu na teplotu nad cca 600°C dojde k jeho vznícení na vzduchu. Hořčík hoří při emisi jasného světla, jehož spektrální složení je blízké slunečnímu. Fotografové proto v minulosti za špatných světelných podmínek fotografovali ve světle hořící hořčíkové pásky. Když hořčík hoří na vzduchu, tvoří se sypký bílý prášek oxidu hořečnatého MgO:
2Mg + 02 = 2MgO.
Současně s oxidem vzniká také nitrid hořečnatý Mg 3 N 2:
3Mg + N2 = Mg3N2.
Hořčík nereaguje se studenou vodou (nebo přesněji reaguje, ale extrémně pomalu), ale s horkou vodou reaguje a vzniká sypká bílá sraženina hydroxidu hořečnatého Mg(OH) 2:
Mg + 2H20 = Mg(OH)2 + H2.
Pokud se zapálí proužek hořčíku a vloží se do sklenice s vodou, kov nadále hoří. V tomto případě se vodík uvolněný při interakci hořčíku s vodou na vzduchu okamžitě vznítí. Spalování hořčíku pokračuje v atmosféře oxidu uhličitého:
2Mg + C02 = 2MgO + C.
Schopnost hořčíku hořet jak ve vodě, tak v atmosféře oxidu uhličitého výrazně komplikuje hašení požárů, při kterých hoří konstrukce z hořčíku nebo jeho slitin. (cm. OXID HOŘEČNATÝ)
Oxid hořečnatý (cm. OXID HOŘEČNATÝ) MgO je bílý drobivý prášek, který nereaguje s vodou. Dříve se tomu říkalo spálená magnézie nebo prostě magnézie. Tento oxid má základní vlastnosti, reaguje s různými kyselinami, např.
MgO + 2HN03 = Mg(N03)2 + H20.
Báze odpovídající tomuto oxidu, Mg(OH) 2, je středně silná, ale je prakticky nerozpustná ve vodě. Lze jej získat například přidáním alkálie do roztoku jakékoli hořečnaté soli:
2NaOH + MgS04 = Mg(OH)2 + Na2S04.
Protože oxid hořečnatý MgO netvoří alkálie při interakci s vodou a hořčíková báze Mg(OH) 2 nemá alkalické vlastnosti, hořčík, na rozdíl od svých „soudruhů“ - vápníku, stroncia a barya, není kovem alkalických zemin.
Kovový hořčík reaguje při pokojové teplotě s halogeny, například s bromem:
Mg + Br2 = MgBr2.
Při zahřátí hořčík reaguje se sírou za vzniku sulfidu hořečnatého:
Mg + S = MgS.
Pokud se směs hořčíku a koksu kalcinuje v inertní atmosféře, vzniká karbid hořčíku o složení Mg 2 C 3 (je třeba poznamenat, že nejbližší soused hořčíku ve skupině - vápník - tvoří za podobných podmínek karbid tzv. složení CaC 2). Když se karbid hořčíku rozkládá vodou, vzniká homolog acetylenu - propin C 3 H 4:
Mg2C3 + 4H20 = 2Mg(OH)2 + C3H4.
Proto lze Mg 2 C 3 nazývat magnesium propylen.
Chování hořčíku je podobné chování lithia alkalického kovu (cm. LITHIUM)(příklad diagonální podobnosti prvků v periodické tabulce). Hořčík, stejně jako lithium, tedy reaguje s dusíkem (při zahřívání dochází k reakci hořčíku s dusíkem), což vede k tvorbě nitridu hořečnatého:
3Mg + N2 = Mg3N2.
Stejně jako nitrid lithný se nitrid hořečnatý snadno rozkládá vodou:
Mg3N2 + 6H20 = 3Mg(OH)2 + 2NH3.
Hořčík je podobný lithiu v tom, že jeho uhličitan MgCO 3 a fosforečnan Mg 3 (PO 4) 2 jsou špatně rozpustné ve vodě, stejně jako odpovídající lithné soli.
Hořčík je podobný vápníku v tom, že přítomnost rozpustných uhlovodíků těchto prvků ve vodě určuje tvrdost vody (cm. TVRDOST VODY). Stejně jako v případě hydrogenuhličitanu vápenatého (viz čl. NA alcium (cm. VÁPNÍK)), tvrdost způsobená hydrogenuhličitanem hořečnatým Mg(HCO 3) 2 je dočasná. Při varu se hydrogenuhličitan hořečnatý Mg(HCO 3) 2 rozkládá a jeho hlavní uhličitan, hydroxyuhličitan hořečnatý (MgOH) 2 CO 3, se vysráží:
2Mg(HC03)2 = (MgOH)2C03 + 3C02 + H20.
V praxi se stále používá chloristan hořečnatý Mg(ClO 4) 2, který energeticky interaguje s vodní párou a dobře suší vzduch nebo jiný plyn procházející její vrstvou. V tomto případě vzniká silný krystalický hydrát Mg(ClO 4) 2 6H 2 O. Tuto látku lze opět dehydratovat zahříváním ve vakuu při teplotě asi 300°C. Chloristan hořečnatý se pro své vysoušecí vlastnosti nazývá anhydron.
Organohořečnaté sloučeniny mají velký význam v organické chemii. (cm. ORGANOMAGNESIOVÉ SLOUČENINY) obsahující vazbu Mg-C. Zvláště důležitou roli mezi nimi hraje tzv. Grignardovo činidlo - sloučeniny hořčíku obecného vzorce RMgHal, kde R je organický radikál a Hal = Cl, Br nebo I. Tyto sloučeniny vznikají v éterických roztocích interakcí hořčíku a odpovídajícího organického halogenu RHal a používají se pro nejrůznější syntézy.
aplikace
Převážná část vytěženého hořčíku se používá k výrobě různých lehkých slitin hořčíku. Složení těchto slitin kromě hořčíku obvykle zahrnuje hliník, zinek a zirkonium. Takové slitiny jsou poměrně pevné a používají se při výrobě letadel, přístrojů a pro jiné účely.
Vysoká chemická aktivita kovového hořčíku umožňuje jeho využití při hořčíkové tepelné výrobě kovů jako je titan, zirkonium, vanad, uran atd. Hořčík v tomto případě reaguje s oxidem nebo fluoridem výsledného kovu, např. :
2Mg + Ti02 = 2MgO + Ti.
2Mg + UF4 = 2MgF2 + U.
Mnoho sloučenin hořčíku je široce používáno, zejména jeho oxid, uhličitan a síran.
Biologická role hořčíku
Hořčík je biogenní prvek (cm. BIOGENNÍ PRVKY), neustále přítomné v tkáních všech organismů. Je součástí molekuly zeleného barviva rostlin – chlorofylu. (cm. CHLOROFYL), podílí se na metabolismu minerálů, aktivuje enzymatické procesy v těle, zvyšuje odolnost rostlin vůči suchu. Bioluminiscence probíhá za účasti Mg + iontů (cm. BIOLUMINESCENCE) a řada dalších biologických procesů. Hořečnatá hnojiva – dolomitová mouka, hořčík pálený atd. – jsou v praxi hojně využívána.
Hořčík se do těla zvířat a lidí dostává s potravou. Denní potřeba hořčíku u člověka je 0,3-0,5 g. Tělo průměrného člověka (tělesná hmotnost 70 kg) obsahuje asi 19 g hořčíku. Poruchy metabolismu hořčíku vedou k různým onemocněním. V lékařství se používají přípravky hořčíku - jeho síran, uhličitan, hořčík pálený.
encyklopedický slovník. 2009 .
Synonyma:Podívejte se, co je „magnesium“ v jiných slovnících:
- (nové lat. magnium, z lat. magnesia). Stříbřitý kov, který tvoří základ magnézie. Slovník cizích slov obsažených v ruském jazyce. Chudinov A.N., 1910. HOŘČÍK je lesklý kov stříbřitě bílé barvy, hoří velmi jasně bílou... ... Slovník cizích slov ruského jazyka
- (hořčík), Mg, chemický prvek skupiny II periodické tabulky, atomové číslo 12, atomová hmotnost 24,305; odkazuje na kovy alkalických zemin; teplota tání 650 shC. Část chlorofylu. Hořčík je součástí slitin, osvětlení a zápalných... ... Moderní encyklopedie
- (symbol Mg), kovový prvek stříbřitě bílé barvy, jeden z KOVŮ ALKALICKÝCH ZEMÍ. Osmý nejrozšířenější prvek v zemské kůře. Poprvé byl izolován v roce 1808 Humphrey DAVY. Nezbytný ve výživě lidí a zvířat. Hořčík je vždy... Vědeckotechnický encyklopedický slovník
Hořčík- (hořčík), Mg, chemický prvek skupiny II periodické tabulky, atomové číslo 12, atomová hmotnost 24,305; odkazuje na kovy alkalických zemin; bod tání 650 °C. Část chlorofylu. Hořčík je součástí slitin, osvětlení a zápalných... ... Ilustrovaný encyklopedický slovník
MAGNESIUM, viz magnesia. Dahlův vysvětlující slovník. V A. Dahl. 1863 1866… Dahlův vysvětlující slovník
- (lat. Hořčík) Mg, chemický prvek II. skupiny periodického systému, atomové číslo 12, atomová hmotnost 24,305. Název je z novolatinského magnesia magnesia. Stříbrný kov, velmi lehký a odolný; hustota 1,74 g/cm3, teplota tání 650 °C. Na… … Velký encyklopedický slovník
Mg (lat. Magnesium * a. magnesium; n. Magnesium; f. magnesium; i. magnesio), chem. prvek skupiny II periodický. Mendělejevův systém, at. n. 12, v. m. 24,312. Natural M. se skládá ze směsi stabilních izotopů 24Mg (78,6 %), 25Mg (10,11 %) a ... ... Geologická encyklopedie
Hořčík je prvkem hlavní podskupiny druhé skupiny, třetí periody periodické tabulky chemických prvků, s atomovým číslem 12. Označuje se symbolem Mg (lat. Hořčík). Jednoduchá látka hořčík (číslo CAS: 7439-95-4) je lehký, tvárný kov stříbrno-bílé barvy. V přírodě středně rozšířený. Při hoření se uvolňuje velké množství světla a tepla.
původ jména
V roce 1695 byla z minerální vody Epsom Spring v Anglii izolována sůl, která měla hořkou chuť a projímavé účinky. Lékárníci ji nazývali hořká sůl, stejně jako epsomská nebo epsomská sůl. Minerál epsomit má složení MgSO 4 · 7H 2 O. Latinský název prvku pochází z názvu starověkého města Magnesia v Malé Asii, v jehož okolí se nacházejí ložiska nerostu magnezitu.
Poprvé byl izolován ve své čisté formě sirem Humphry Davy v roce 1808.
Účtenka
Obvyklou průmyslovou metodou výroby kovového hořčíku je elektrolýza taveniny směsi bezvodých chloridů hořečnatých MgCl 2 (bischofite), NaCl sodného a KCl draselného. Chlorid hořečnatý podléhá elektrochemické redukci v tavenině:
MgCl2 (elektrolýza) = Mg + Cl2.
Roztavený kov se periodicky odstraňuje z elektrolytické lázně a přidávají se do ní nové podíly surovin obsahujících hořčík. Protože hořčík získaný tímto způsobem obsahuje relativně mnoho (asi 0,1 %) nečistot, je v případě potřeby „surový“ hořčík podroben dodatečnému čištění. K tomuto účelu se používá elektrolytická rafinace, tavení ve vakuu pomocí speciálních přísad - tavidel, která „odstraňují“ nečistoty z hořčíku, nebo destilace (sublimace) kovu ve vakuu. Čistota rafinovaného hořčíku dosahuje 99,999 % a vyšší.
Byl vyvinut další způsob získávání hořčíku – termální. V tomto případě se ke snížení oxidu hořečnatého při vysokých teplotách používá křemík nebo koks:
MgO + C = Mg + CO
Použití křemíku umožňuje získat hořčík ze surovin, jako je dolomit CaC03 ·MgC03, bez předběžné separace hořčíku a vápníku. Za účasti dolomitu dochází k následujícím reakcím:
CaCO 3 MgCO 3 = CaO + MgO + 2CO 2,
2MgO + CaO + Si = CaSi03 + 2Mg.
Výhodou tepelné metody je, že umožňuje získat hořčík vyšší čistoty. K získávání hořčíku se používají nejen minerální suroviny, ale také mořská voda.
Fyzikální vlastnosti
Hořčík je stříbrnobílý kov s šestihrannou mřížkou, prostorová grupa P 6 3 /mmc. Za normálních podmínek je povrch hořčíku pokryt odolným ochranným filmem oxidu hořečnatého MgO, který je zničen při zahřátí na vzduchu na teplotu přibližně 600 °C, načež kov hoří oslepujícím bílým plamenem za vzniku oxidu hořečnatého a nitridu Mg 3 N 2. Hustota hořčíku při 20 °C je 1,737 g/cm³, bod tání kovu je t pl = 651 °C, bod varu je t var = 1103 °C, tepelná vodivost při 20 °C je 156 W/ (m K). Vysoce čistý hořčík je tažný, snadno lisovatelný, válcovaný a vhodný pro řezání.
Chemické vlastnosti
Směs práškového hořčíku s manganistanem draselným KMnO 4 je výbušnina.
Horký hořčík reaguje s vodou:
Mg (deklarováno) + H20 = MgO + H2;
Zásady neovlivňují hořčík, snadno se rozpouští v kyselinách a uvolňuje vodík:
Mg + 2HCl = MgCl2 + H2;
Při zahřátí na vzduchu hoří hořčík za vzniku oxidu; malé množství nitridu se může vytvořit také s dusíkem:
2Mg + 02 = 2MgO;
3Mg + N2 = Mg3N2
Sloučeniny hořčíku jsou člověku známy již velmi dlouho. Magnezit (v řečtině Magnhsia oliqV) byl měkký, bílý, mýdlový minerál (mýdlový kámen nebo mastek) nalezený v oblasti Magnesia v Thesálii. Když byl tento minerál kalcinován, získal se bílý prášek, který se stal známým jako bílá magnézie.
V roce 1695 N. Gro odpařováním minerální vody z pramene Epsom (Anglie) získal sůl, která měla hořkou chuť a projímavý účinek (MgSO 4 · 7H 2 O). O několik let později se ukázalo, že při interakci se sodou nebo potaší tato sůl tvoří bílý sypký prášek, stejný jako ten, který vzniká při kalcinaci magnezitu.
V roce 1808 anglický chemik a fyzik Humphry Davy elektrolýzou mírně navlhčené bílé magnézie s oxidem rtuťnatým jako katodou získal amalgám nového kovu schopného tvořit bílou magnézii. Říkalo se tomu hořčík. Davy získal kontaminovaný kov a čistý hořčík izoloval až v roce 1829 francouzský chemik Antoine Bussy (1794–1882).
Distribuce hořčíku v přírodě a jeho průmyslová těžba.
Hořčík se nachází v krystalických horninách ve formě nerozpustných uhličitanů nebo síranů a také (v hůře dostupné formě) ve formě silikátů. Odhad jeho celkového obsahu výrazně závisí na použitém geochemickém modelu, zejména na hmotnostních poměrech vulkanických a sedimentárních hornin. V současnosti se používají hodnoty od 2 do 13,3 %. Snad nejrozumnější hodnota je 2,76 %, což řadí hořčík na šesté místo v množství po vápníku (4,66 %) a před sodíkem (2,27 %) a draslíkem (1,84 %).
Velké pevninské oblasti, jako jsou Dolomity v Itálii, jsou složeny převážně z minerálního dolomitu MgCa(CO 3) 2 . Dále se vyskytují sedimentární minerály magnezit MgCO 3, epsomit MgSO 4 · 7H 2 O, karnallit K 2 MgCl 4 · 6H 2 O, langbeinit K 2 Mg 2 (SO 4) 3.
Ložiska dolomitu jsou v mnoha dalších oblastech, včetně moskevské a Leningradské oblasti. Bohatá ložiska magnezitu byla nalezena na Středním Uralu a v oblasti Orenburgu. Největší ložisko karnallitu se vyvíjí v oblasti Solikamsk. Hořčíkové silikáty jsou zastoupeny čedičovým minerálem olivínem (Mg,Fe) 2 (SiO 4), mastkem (talc) Mg 3 Si 4 O 10 (OH) 2, azbestem (chrysotilem) Mg 3 Si 2 O 5 (OH) 4 a slída. Spinel MgAl 2 O 4 patří mezi drahé kameny.
Velké množství hořčíku se nachází ve vodách moří a oceánů a v přírodních slaných vodách ( cm. CHEMIE HYDROSFÉRY). V některých zemích jsou surovinou pro výrobu hořčíku. Pokud jde o obsah kovových prvků v mořské vodě, je na druhém místě za sodíkem. Každý metr krychlový mořské vody obsahuje asi 4 kg hořčíku. Hořčík se nachází i ve sladké vodě, který spolu s vápníkem určuje její tvrdost.
Hořčík se vždy nachází v rostlinách, protože je součástí chlorofylu.
Charakteristika jednoduchých látek a průmyslová výroba kovového hořčíku.
Hořčík je stříbřitě bílý lesklý kov, poměrně měkký, tažný a kujný. Jeho pevnost a tvrdost je minimální u odlévaných vzorků, vyšší u lisovaných.
Za normálních podmínek je hořčík odolný vůči oxidaci v důsledku tvorby silného oxidového filmu. Aktivně však reaguje s většinou nekovů, zejména při zahřátí. Hořčík se vznítí v přítomnosti halogenů (v přítomnosti vlhkosti), tvoří odpovídající halogenidy a hoří oslnivě jasným plamenem na vzduchu, přičemž se mění na oxid MgO a nitrid Mg3N2:
2Mg (k) + 02 (g) = 2MgO (k); DG° = –1128 kJ/mol
3Mg (k) + N2 (t) = Mg3N2 (k); DG° = –401 kJ/mol
Navzdory nízkému bodu tání (650 °C) je nemožné roztavit hořčík na vzduchu.
Při vystavení vodíku pod tlakem 200 atm při 150 °C tvoří hořčík hydrid MgH2. Hořčík nereaguje se studenou vodou, ale vytěsňuje vodík z vařící vody a tvoří hydroxid Mg(OH) 2:
Mg + 2H20 = Mg(OH)2 + H2
Na konci reakce odpovídá hodnota pH (10,3) výsledného nasyceného roztoku hydroxidu hořečnatého rovnováze:
V druhém případě musí být výsledná směs oxidu uhelnatého a par hořčíku rychle ochlazena inertním plynem, aby se zabránilo reverzní reakci.
Světová produkce hořčíku se blíží 400 tisícům tun ročně. Hlavními producenty jsou USA (43 %), země SNS (26 %) a Norsko (17 %). Čína v posledních letech prudce zvyšuje vývoz hořčíku. V Rusku je jedním z největších výrobců hořčíku závod na výrobu titanu a hořčíku v Bereznikách (oblast Perm) a závod na výrobu hořčíku v Solikamsku. Výroba hořčíku probíhá také ve městě Asbest.
Hořčík je nejlehčí konstrukční materiál používaný v průmyslovém měřítku. Jeho hustota (1,7 g cm–3) je méně než dvě třetiny hustoty hliníku. Slitiny hořčíku váží čtyřikrát méně než ocel. Hořčík je navíc vysoce obrobitelný a lze jej odlévat a přepracovávat pomocí jakýchkoli standardních metod zpracování kovů (válcování, lisování, tažení, kování, svařování, pájení, nýtování). Proto je jeho hlavní použití jako lehký konstrukční kov.
Slitiny hořčíku obvykle obsahují více než 90 % hořčíku, stejně jako 2–9 % hliníku, 1–3 % zinku a 0,2–1 % manganu. Zachování pevnosti při vysokých teplotách (až 450 °C) se znatelně zlepší, když se leguje s kovy vzácných zemin (např. praseodym a neodym) nebo thorium. Tyto slitiny lze použít pro skříně motorů automobilů, ale i trupy letadel a přistávací zařízení. Hořčík se používá nejen v letectví, ale také při výrobě schodišť, přístavních lávek, nákladních plošin, dopravníků a výtahů a také při výrobě fotografických a optických zařízení.
Do průmyslového hliníku se přidává až 5 % hořčíku pro zlepšení mechanických vlastností, svařitelnosti a odolnosti proti korozi. Hořčík se také používá pro katodickou ochranu jiných kovů proti korozi, jako lapač kyslíku a redukční činidlo při výrobě berylia, titanu, zirkonia, hafnia a uranu. Směsi hořčíkového prášku s oxidačními činidly se používají v pyrotechnice k přípravě osvětlovacích a zápalných složek.
Sloučeniny hořčíku.
Převládající oxidační stav (+2) hořčíku je určen jeho elektronovou konfigurací, ionizační energií a velikostí atomů. Oxidační stav (+3) je nemožný, protože třetí ionizační energie pro hořčík je 7733 kJ mol –1. Tato energie je mnohem vyšší, než může být kompenzováno tvorbou dalších vazeb, i když jsou převážně kovalentní. Důvody nestability sloučenin hořčíku v oxidačním stavu (+1) jsou méně zřejmé. Hodnocení entalpie tvorby takových sloučenin ukazuje, že musí být stabilní s ohledem na jejich základní prvky. Důvodem, že sloučeniny hořčíku (I) nejsou stabilní, je mnohem vyšší entalpie tvorby sloučenin hořčíku (II), což by mělo vést k rychlé a úplné disproporcionaci:
Mg(k) + Cl2(g) = MgCl2(k);
D N° arr = –642 kJ/(mol MgCl 2)
2Mg(k) + Cl2(g) = 2MgCl(k);
D N° arr = –250 kJ/(2 mol MgCl)
2MgCl(k) = Mg(k) + MgCl2(k);
D N° disprop = –392 kJ/(2 mol MgCl)
Pokud lze nalézt syntetickou cestu, která činí disproporcionaci obtížnou, lze takové sloučeniny získat. Existují určité důkazy o tvorbě částic hořčíku (I) během elektrolýzy na hořčíkových elektrodách. Při elektrolýze NaCl na hořčíkové anodě se tedy uvolňuje vodík a množství hořčíku ztracené anodou odpovídá náboji +1,3. Podobně při elektrolýze vodného roztoku Na 2 SO 4 množství uvolněného vodíku odpovídá oxidaci vody hořčíkovými ionty, jejichž náboj odpovídá +1,4.
Většina hořečnatých solí je vysoce rozpustná ve vodě. Proces rozpouštění je doprovázen mírnou hydrolýzou. Výsledné roztoky mají slabě kyselé prostředí:
2+ + H20 + + H30 +
Sloučeniny hořčíku s mnoha nekovy, včetně uhlíku, dusíku, fosforu a síry, jsou vodou nevratně hydrolyzovány.
Hydrid hořečnatý složení MgH 2 je polymer s přemostěním atomů vodíku. Koordinační číslo hořčíku v něm je 4. Tato struktura vede k prudkému poklesu tepelné stability sloučeniny. Hydrid hořečnatý se snadno oxiduje vzdušným kyslíkem a vodou. Tyto reakce jsou doprovázeny velkým uvolněním energie.
Nitrid hořečnatý Mg3N2. Tvoří nažloutlé krystaly. Hydrolýzou nitridu hořečnatého vzniká hydrát amoniaku:
Mg3N2 + 8H20 = 3Mg(OH)2 + 2NH3H20
Pokud se hydrolýza nitridu hořečnatého provádí v alkalickém prostředí, nevzniká hydrát amoniaku, ale uvolňuje se plynný amoniak. Hydrolýza v kyselém prostředí vede k tvorbě hořečnatých a amonných kationtů:
Mg3N2 + 8H30 + = 3Mg2+ + 2NH4+ + 8H20
Oxid hořečnatý MgO se nazývá spálená magnézie. Získává se vypalováním magnezitu, dolomitu, zásaditého uhličitanu hořečnatého, hydroxidu hořečnatého a také kalcinací bischofitu MgCl 2 · 6H 2 O v atmosféře vodní páry.
Reaktivita oxidu hořečnatého závisí na teplotě, při které vzniká. Oxid hořečnatý připravený při 500–700 °C se nazývá lehká magnézie. Snadno reaguje se zředěnými kyselinami a vodou za vzniku odpovídajících solí nebo hydroxidu hořečnatého a absorbuje oxid uhličitý a vlhkost ze vzduchu. Oxid hořečnatý získaný při 1200–1600 °C se nazývá těžká magnézie. Vyznačuje se odolností vůči kyselinám a voděodolností.
Oxid hořečnatý je široce používán jako tepelně odolný materiál. Vyznačuje se jak vysokou tepelnou vodivostí, tak dobrými elektroizolačními vlastnostmi. Proto se tato sloučenina používá v izolačních radiátorech pro lokální vytápění.
Lehčí druhy magnézie se používají pro přípravu magnéziového cementu a stavebních materiálů na jeho bázi a také jako vulkanizační činidlo v gumárenském průmyslu.
Hydroxid hořečnatý Mg(OH) 2 tvoří bezbarvé krystaly. Rozpustnost této sloučeniny je nízká (2·10 –4 mol/l při 20°C). Může být přeměněn na roztok působením amonných solí:
Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH3H20
Hydroxid hořečnatý je tepelně nestabilní a při zahřívání se rozkládá:
Mg(OH)2 = MgO + H20
V průmyslovém měřítku se hydroxid hořečnatý vyrábí srážením vápnem z mořské vody a přírodních solných roztoků.
Hydroxid hořečnatý je mírná zásada, která se ve formě vodného roztoku (hořčíkové mléko) široce používá ke snížení kyselosti žaludeční šťávy. Navíc, navzdory své měkkosti, Mg(OH) 2 neutralizuje kyseliny 1,37krát více než hydroxid sodný NaOH a 2,85krát více než hydrogenuhličitan sodný NaHCO3.
Používá se také k výrobě oxidu hořečnatého, rafinaci cukru, čištění vody v kotelnách a jako součást zubních past.
Uhličitan hořečnatý MgCO 3 tvoří bezbarvé krystaly. Přirozeně se vyskytuje v bezvodé formě (magnezit). Kromě toho jsou známy penta-, tri- a monohydráty uhličitanu hořečnatého.
Rozpustnost uhličitanu hořečnatého v nepřítomnosti oxidu uhličitého je asi 0,5 mg/l. V přítomnosti přebytku oxidu uhličitého a vody se uhličitan hořečnatý přeměňuje na rozpustný hydrogenuhličitan a při varu dochází k opačnému procesu. Uhličitan a hydrogenuhličitan reagují s kyselinami za uvolňování oxidu uhličitého a tvorby odpovídajících solí. Při zahřívání se uhličitan hořečnatý bez tání rozkládá:
MgC03 = MgO + C02
Tento proces se používá k výrobě oxidu hořečnatého. Přírodní uhličitan hořečnatý je navíc výchozí surovinou pro výrobu kovového hořčíku a jeho sloučenin. Používá se také jako hnojivo a ke snížení kyselosti půdy.
Sypký prášek uhličitanu hořečnatého se nasype mezi dvojité stěny zásobníků kapalného kyslíku. Tato tepelná izolace je levná a spolehlivá.
Síran hořečnatý MgS04 je známý v bezvodém stavu, stejně jako ve formě různých hydrátů. Kieserit MgS04.H20, epsomit MgS04.7H20 a hexahydrát MgS04.6H20 se nacházejí v přírodě.
V lékařství se používá heptahydrát síranu hořečnatého MgSO 4 · 7H 2 O, běžně známý jako Epsom nebo hořká sůl. Tato sloučenina má laxativní účinek. Při intramuskulárních nebo intravenózních infuzích síran hořečnatý zmírňuje křečové stavy a snižuje cévní křeče.
Síran hořečnatý se používá v textilním a papírenském průmyslu jako barvicí mořidlo, jako zatěžovací činidlo pro bavlnu a hedvábí a jako plnivo do papíru. Slouží jako surovina pro výrobu oxidu hořečnatého.
Dusičnan hořečnatý Mg(NO 3) 2 jsou bezbarvé hygroskopické krystaly. Rozpustnost ve vodě při 20 °C je 73,3 g na 100 g. Hexahydrát krystalizuje z vodných roztoků. Nad 90°C se dehydratuje na monohydrát. Poté se voda oddělí částečnou hydrolýzou a rozkladem na oxid hořečnatý. Tento proces se používá při syntéze vysoce čistého oxidu hořečnatého. Z dusičnanu hořečnatého se získávají dusičnany jiných kovů a také různé sloučeniny hořčíku. Kromě toho je dusičnan hořečnatý součástí komplexních hnojiv a pyrotechnických směsí.
Chloristan hořečnatý Mg(ClO 4) 2 tvoří velmi hygroskopické bezbarvé krystaly. Je vysoce rozpustný ve vodě (99,6 g na 100 g) a organických rozpouštědlech. Hexahydrát krystalizuje z vodných roztoků. Koncentrované roztoky chloristanu hořečnatého v organických rozpouštědlech a jeho solváty s molekulami redukčního činidla jsou výbušné.
Částečně hydratovaný chloristan hořečnatý, obsahující 2–2,5 molekuly vody, se vyrábí pod obchodním názvem „anhydron“. Pro získání bezvodého chloristanu hořečnatého se suší ve vakuu při 200–300 °C. Používá se jako vysoušedlo plynů. Absorbuje nejen vodní páru, ale také čpavek, alkoholové páry, aceton a další polární látky.
Chloristan hořečnatý se používá jako acylační katalyzátor při Friedel-Craftsově reakci a také jako oxidační činidlo v mikroanalýze.
Fluorid hořečnatý MgF2 je mírně rozpustný ve vodě (0,013 g na 100 g při 25 °C). Vyskytuje se přirozeně jako minerál selait. Fluorid hořečnatý se získává reakcí síranu nebo oxidu hořečnatého s kyselinou fluorovodíkovou nebo chloridem hořečnatým s fluoridem draselným nebo amonným.
Fluorid hořečnatý je součástí tavidel, skel, keramiky, smaltů, katalyzátorů, směsí pro výrobu umělé slídy a azbestu. Navíc jde o optický a laserový materiál.
Chlorid hořečnatý MgCl 2 je jedna z průmyslově nejdůležitějších hořečnatých solí. Jeho rozpustnost je 54,5 g na 100 g vody při 20 °C. Koncentrované vodné roztoky chloridu hořečnatého rozpouštějí oxid hořečnatý. Ze vzniklých roztoků krystalizuje MgCl 2 mMg(OH) 2 nH 2 O. Tyto sloučeniny jsou součástí magnéziových cementů.
Chlorid hořečnatý tvoří krystalické hydráty s 1, 2, 4, 6, 8 a 12 molekulami vody. S rostoucí teplotou klesá počet molekul krystalické vody.
V přírodě se chlorid hořečnatý nachází ve formě minerálů bischofite MgCl 2 · 6H 2 O, magnezitchloridu MgCl 2 a karnalitu. Nachází se v mořské vodě, solném roztoku ze slaných jezer a některých podzemních solných roztokech.
Bezvodý chlorid hořečnatý se používá při výrobě kovového hořčíku a oxidu hořečnatého a hexahydrát se používá k výrobě hořčíkových cementů. Jako chladivo a nemrznoucí směs se používá vodný roztok chloridu hořečnatého. Slouží jako odmrazovací prostředek na letištích, železničních tratích a výhybkách, dále proti zamrzání uhlí a rud. Dřevo je impregnováno roztokem chloridu hořečnatého, aby bylo ohnivzdorné.
bromid hořečnatý MgBr 2 je vysoce rozpustný ve vodě (101,5 g na 100 g při 20 °C). Z vodných roztoků krystalizuje od –42,7 do 0,83 °C ve formě dekahydrátu, při vyšších teplotách ve formě hexahydrátu. Tvoří četné krystalové solváty, jako je MgB26ROH (R = Me, Et, Pr), MgBr26Me2CO, MgBr23Et20, stejně jako aminy MgBr2 n NH 3 ( n = 2–6).
Komplexní sloučeniny hořčíku. Ve vodných roztocích existuje iont hořčíku ve formě akvakomplexu 2+. V nevodných rozpouštědlech, jako je kapalný amoniak, tvoří ionty hořčíku komplexy s molekulami rozpouštědla. Z takových roztoků obvykle krystalizují solváty hořečnatých solí. Je známo několik halogenidových komplexů typu MX 4 2–, kde X je halogenidový anion.
Z komplexních sloučenin hořčíku mají zvláštní význam chlorofyly, což jsou modifikované porfyrinové komplexy hořčíku. Jsou životně důležité pro fotosyntézu v zelených rostlinách.
Organohořečnaté sloučeniny. Pro hořčík byla získána řada sloučenin obsahujících vazby kov-uhlík. Zvláště mnoho výzkumů je věnováno Grignardovým činidlům RMgX (X = Cl, Br, I).
Grignardova činidla jsou nejdůležitější organokovové sloučeniny hořčíku a pravděpodobně nejpoužívanější organokovová činidla. To je způsobeno jejich snadnou výrobou a syntetickou všestranností. Bylo zjištěno, že v roztoku mohou tyto sloučeniny obsahovat různé chemické částice, které jsou v mobilní rovnováze.
Grignardova činidla se obvykle připravují pomalým přidáváním organického halogenidu k suspenzi hořčíkových hoblin ve vhodném rozpouštědle za intenzivního míchání a za úplné nepřítomnosti vzduchu a vlhkosti. Reakce obvykle začíná pomalu. Může být iniciován malým krystalem jódu, který naruší ochrannou vrstvu na kovovém povrchu.
Grignardova činidla jsou široce používána pro syntézu alkoholů, aldehydů, ketonů, karboxylových kyselin, esterů a amidů a jsou pravděpodobně nejdůležitějšími činidly pro vytváření vazeb uhlík-uhlík, jakož i vazeb mezi atomy uhlíku a dalšími prvky (dusík, kyslík, síra atd.) .d.).
Sloučeniny R2Mg se při zahřívání obvykle rozkládají. V krystalickém stavu mají strukturu lineárních polymerů s můstkovými alkylovými skupinami. Sloučenina MgMe2 je netěkavý polymer, stabilní do ~250 °C, nerozpustný v uhlovodících a jen málo rozpustný v etheru. Sloučenina MgEt 2 a vyšší homology jsou velmi podobné MgMe 2, ale při nižších teplotách (175–200 °C) se rozkládají za vzniku odpovídajícího alkenu a MgH 2 v opačné reakci, než je jejich tvorba. MgPh 2 je jim také podobný; je nerozpustný v benzenu, rozpouští se v etheru za vzniku monomerního komplexu MgPh 2 · 2Et 2 O a při 280 °C se rozkládá za vzniku Ph 2 a kovového hořčíku.
Biologická role hořčíku.
Zelené listy rostlin obsahují chlorofyly, což jsou porfyrinové komplexy obsahující hořčík, které se podílejí na fotosyntéze.
Hořčík se také úzce podílí na biochemických procesech v tělech zvířat. Ionty hořčíku jsou nezbytné pro iniciaci enzymů odpovědných za přeměnu fosfátů, pro přenos nervových vzruchů a pro metabolismus sacharidů. Podílejí se také na svalové kontrakci, která je iniciována ionty vápníku.
Před několika lety vědci z University of Minnesota v USA zjistili, že vaječné skořápky jsou tím silnější, čím více hořčíku obsahují.
Tělo dospělého člověka vážícího 65 kg obsahuje asi 20 g hořčíku (převážně ve formě iontů). Většina je koncentrována v kostech. V intracelulární tekutině jsou přítomny komplexy hořčíku s ATP a ADP.
Denní potřeba tohoto prvku je 0,35 g. Při jednotvárné stravě, nedostatku zelené zeleniny a ovoce a také při alkoholismu se často objevuje nedostatek hořčíku. Na hořčík jsou bohaté zejména meruňky, broskve a květák. Nachází se také v běžném zelí, bramborách a rajčatech.
Statistiky ukazují, že obyvatelé oblastí s teplejším podnebím pociťují křeče krevních cév méně často než seveřané. Předpokládá se, že důvodem jsou stravovací návyky v chladných oblastech. Jedí méně ovoce a zeleniny, což znamená, že přijímají méně hořčíku.
Výzkum francouzských biologů ukázal, že krev unavených lidí obsahuje méně hořčíku než krev odpočatých lidí. Předpokládá se, že strava bohatá na hořčík by měla lékařům pomoci v boji s tak závažným onemocněním, jako je přepracování.
Elena Savinkina