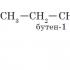Arten chemischer Reaktionen in Beispielen der anorganischen Chemie. Klassifizierung chemischer Reaktionen
Klassifizierung chemischer Reaktionen in der anorganischen und organischen Chemie
Chemische Reaktionen oder chemische Phänomene sind Prozesse, bei denen aus einigen Stoffen andere entstehen, die sich in Zusammensetzung und (oder) Struktur von ihnen unterscheiden.
Bei chemischen Reaktionen kommt es zwangsläufig zu einer Stoffveränderung, bei der alte Bindungen aufgebrochen und neue Bindungen zwischen Atomen gebildet werden.
Von chemischen Reaktionen ist abzugrenzen Kernreaktionen. Durch eine chemische Reaktion ändern sich die Gesamtzahl der Atome jedes chemischen Elements und seine Isotopenzusammensetzung nicht. Eine andere Sache sind Kernreaktionen – Prozesse der Umwandlung von Atomkernen infolge ihrer Wechselwirkung mit anderen Kernen oder Elementarteilchen, zum Beispiel die Umwandlung von Aluminium in Magnesium:
$↙(13)↖(27)(Al)+ ()↙(1)↖(1)(H)=()↙(12)↖(24)(Mg)+()↙(2)↖(4 )(Er)$
Die Klassifizierung chemischer Reaktionen ist vielfältig, d.h. es kann auf verschiedenen Merkmalen basieren. Aber jedes dieser Merkmale kann Reaktionen zwischen anorganischen und organischen Substanzen umfassen.
Betrachten wir die Klassifizierung chemischer Reaktionen nach verschiedenen Kriterien.
Klassifizierung chemischer Reaktionen nach Anzahl und Zusammensetzung der Reaktanten. Reaktionen, die ablaufen, ohne die Zusammensetzung des Stoffes zu verändern
In der anorganischen Chemie umfassen solche Reaktionen Prozesse zur Erzielung allotroper Modifikationen eines chemischen Elements, zum Beispiel:
$С_((Graphit))⇄С_((Diamant))$
$S_((rhombisch))⇄S_((monoklin))$
$Р_((weiß))⇄Р_((rot))$
$Sn_((weißes Zinn))⇄Sn_((graues Zinn))$
$3О_(2(Sauerstoff))⇄2О_(3(Ozon))$.
In der organischen Chemie kann diese Art von Reaktion Isomerisierungsreaktionen umfassen, die ablaufen, ohne dass sich nicht nur die qualitative, sondern auch die quantitative Zusammensetzung der Stoffmoleküle ändert, zum Beispiel:
1. Isomerisierung von Alkanen.
Die Isomerisierungsreaktion von Alkanen ist von großer praktischer Bedeutung, weil Kohlenwasserstoffe mit Isostruktur haben eine geringere Detonationsfähigkeit.
2. Isomerisierung von Alkenen.

3. Alkin-Isomerisierung(Reaktion von A.E. Favorsky).
4. Isomerisierung von Halogenalkanen(A. E. Favorsky).
5. Isomerisierung von Ammoniumcyanat durch Erhitzen.

Harnstoff wurde erstmals 1882 von F. Wöhler durch Isomerisierung von Ammoniumcyanat beim Erhitzen synthetisiert.
Reaktionen, die bei einer Änderung der Zusammensetzung eines Stoffes auftreten
Man kann vier Arten solcher Reaktionen unterscheiden: Kombination, Zersetzung, Substitution und Austausch.
1. Zusammengesetzte Reaktionen- Dabei handelt es sich um Reaktionen, bei denen aus zwei oder mehreren Stoffen ein komplexer Stoff entsteht.
In der anorganischen Chemie lässt sich die ganze Vielfalt an Verbindungsreaktionen am Beispiel der Reaktionen zur Herstellung von Schwefelsäure aus Schwefel betrachten:
1) Gewinnung von Schwefeloxid (IV):
$S+O_2=SO_2$ – ein komplexer Stoff entsteht aus zwei einfachen Stoffen;
2) Gewinnung von Schwefeloxid (VI):
$2SO_2+O_2(⇄)↖(t,p,cat.)2SO_3$ – ein komplexer Stoff wird aus einfachen und komplexen Stoffen gebildet;
3) Gewinnung von Schwefelsäure:
$SO_3+H_2O=H_2SO_4$ – zwei komplexe Stoffe bilden einen komplexen Stoff.
Ein Beispiel für eine Verbundreaktion, bei der aus mehr als zwei Ausgangsstoffen ein komplexer Stoff entsteht, ist die Endstufe der Salpetersäureherstellung:
$4NO_2+O_2+2H_2O=4HNO_3$.
In der organischen Chemie werden Verbindungsreaktionen üblicherweise als Additionsreaktionen bezeichnet. Die ganze Vielfalt solcher Reaktionen lässt sich am Beispiel eines Reaktionsblocks betrachten, der die Eigenschaften ungesättigter Stoffe, beispielsweise Ethylen, charakterisiert:
1) Hydrierungsreaktion – Zugabe von Wasserstoff:
$CH_2(=)↙(Ethen)CH_2+H_2(→)↖(Ni,t°)CH_3(-)↙(Ethan)CH_3;$
2) Hydratationsreaktion – Zugabe von Wasser:
$CH_2(=)↙(Ethen)CH_2+H_2O(→)↖(H_3PO_4,t°)(C_2H_5OH)↙(Ethanol);$
3) Polymerisationsreaktion:
$(nCH_2=CH_2)↙(Ethylen)(→)↖(p,cat.,t°)((-CH_2-CH_2-)_n)↙(Polyethylen)$
2. Zersetzungsreaktionen- Hierbei handelt es sich um Reaktionen, bei denen aus einem komplexen Stoff mehrere neue Stoffe entstehen.
In der anorganischen Chemie kann die ganze Vielfalt solcher Reaktionen am Beispiel eines Reaktionsblocks zur Herstellung von Sauerstoff im Labor betrachtet werden:
1) Zersetzung von Quecksilber(II)-oxid:
$2HgO(→)↖(t°)2Hg+O_2$ – zwei einfache werden aus einer komplexen Substanz gebildet;
2) Zersetzung von Kaliumnitrat:
$2KNO_3(→)↖(t°)2KNO_2+O_2$ – aus einer komplexen Substanz entstehen eine einfache und eine komplexe;
3) Zersetzung von Kaliumpermanganat:
$2KMnO_4(→)↖(t°)K_2MnO_4+MnO_2+O_2$ – aus einer komplexen Substanz entstehen zwei komplexe und eine einfache, d.h. drei neue Substanzen.
In der organischen Chemie können Zersetzungsreaktionen am Beispiel eines Reaktionsblocks zur Herstellung von Ethylen in Labor und Industrie betrachtet werden:
1) Dehydratisierungsreaktion (Wasserabspaltung) von Ethanol:
$C_2H_5OH(→)↖(H_2SO_4,t°)CH_2=CH_2+H_2O;$
2) Dehydrierungsreaktion (Abspaltung von Wasserstoff) von Ethan:
$CH_3 – CH_3(→)↖(Cr_2O_3.500°C)CH_2=CH_2+H_2;$
3) Propan-Crackreaktion:
$CH_3-CH_2CH_3(→)↖(t°)CH_2=CH_2+CH_4.$
3. Substitutionsreaktionen- Dies sind Reaktionen, bei denen Atome einer einfachen Substanz Atome eines Elements in einer komplexen Substanz ersetzen.
Ein Beispiel für solche Prozesse in der anorganischen Chemie ist ein Reaktionsblock, der die Eigenschaften beispielsweise von Metallen charakterisiert:
1) Wechselwirkung von Alkali- und Erdalkalimetallen mit Wasser:
$2Na+2H_2O=2NaOH+H_2$
2) Wechselwirkung von Metallen mit Säuren in Lösung:
$Zn+2HCl=ZnCl_2+H_2$;
3) Wechselwirkung von Metallen mit Salzen in Lösung:
$Fe+CuSO_4=FeSO_4+Cu;$
4) Metallothermie:
$2Al+Cr_2O_3(→)↖(t°)Al_2O_3+2Cr$.
Gegenstand des Studiums der organischen Chemie sind nicht einfache Stoffe, sondern nur Verbindungen. Als Beispiel für eine Substitutionsreaktion stellen wir daher die charakteristischste Eigenschaft gesättigter Verbindungen, insbesondere Methan, vor, die Fähigkeit seiner Wasserstoffatome, durch Halogenatome ersetzt zu werden:
$CH_4+Cl_2(→)↖(hν)(CH_3Cl)↙(Chlormethan)+HCl$,
$CH_3Cl+Cl_2→(CH_2Cl_2)↙(Dichlormethan)+HCl$,
$CH_2Cl_2+Cl_2→(CHCl_3)↙(Trichlormethan)+HCl$,
$CHCl_3+Cl_2→(CCl_4)↙(Tetrachlorkohlenstoff)+HCl$.
Ein weiteres Beispiel ist die Bromierung einer aromatischen Verbindung (Benzol, Toluol, Anilin):
Achten wir auf die Besonderheit von Substitutionsreaktionen in organischen Stoffen: Bei solchen Reaktionen entstehen nicht wie in der anorganischen Chemie ein einfacher und ein komplexer Stoff, sondern zwei komplexe Stoffe.
Zu den Substitutionsreaktionen zählen in der organischen Chemie auch einige Reaktionen zwischen zwei komplexen Stoffen, beispielsweise die Nitrierung von Benzol:
$C_6H_6+(HNO_3)↙(Benzol)(→)↖(H_2SO_4(conc.),t°)(C_6H_5NO_2)↙(Nitrobenzol)+H_2O$
Es handelt sich formal um eine Austauschreaktion. Dass es sich hierbei um eine Substitutionsreaktion handelt, wird erst deutlich, wenn man ihren Mechanismus betrachtet.
4. Austauschreaktionen- Dabei handelt es sich um Reaktionen, bei denen zwei komplexe Stoffe ihre Bestandteile austauschen.
Diese Reaktionen charakterisieren die Eigenschaften von Elektrolyten und verlaufen in Lösungen nach der Berthollet-Regel, d. h. nur wenn das Ergebnis die Bildung eines Niederschlags, Gases oder einer leicht dissoziierenden Substanz (z. B. $H_2O$) ist.
In der anorganischen Chemie kann es sich dabei um einen Reaktionsblock handeln, der beispielsweise die Eigenschaften von Alkalien charakterisiert:
1) Neutralisationsreaktion, die unter Bildung von Salz und Wasser auftritt:
$NaOH+HNO_3=NaNO_3+H_2O$
oder in ionischer Form:
$OH^(-)+H^(+)=H_2O$;
2) die Reaktion zwischen Alkali und Salz, die unter Gasbildung auftritt:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3+2H_2O$
oder in ionischer Form:
$NH_4^(+)+OH^(-)=NH_3+H_2O$;
3) die Reaktion zwischen Alkali und Salz, die unter Bildung eines Niederschlags auftritt:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
oder in ionischer Form:
$Cu^(2+)+2OH^(-)=Cu(OH)_2↓$
In der organischen Chemie können wir einen Reaktionsblock betrachten, der beispielsweise die Eigenschaften von Essigsäure charakterisiert:
1) Reaktion, die unter Bildung eines schwachen Elektrolyten auftritt – $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
$CH_3COOH+OH^(-)⇄CH_3COO^(-)+H_2O$;
2) Reaktion, die unter Gasbildung auftritt:
$2CH_3COOH+CaCO_3=2CH_3COO^(-)+Ca^(2+)+CO_2+H_2O$;
3) Reaktion, die unter Bildung eines Niederschlags abläuft:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
$2CH_3COOH+SiO_3^(−)=2CH_3COO^(−)+H_2SiO_3↓$.
Klassifizierung chemischer Reaktionen nach Änderungen der Oxidationsstufen chemischer Elemente, die Stoffe bilden
Reaktionen, die mit einer Änderung der Oxidationsstufen von Elementen ablaufen, oder Redoxreaktionen.
Dazu gehören viele Reaktionen, darunter alle Substitutionsreaktionen, aber auch solche Kombinations- und Zersetzungsreaktionen, an denen mindestens ein einfacher Stoff beteiligt ist, zum Beispiel:
1.$(Mg)↖(0)+(2H)↖(+1)+SO_4^(-2)=(Mg)↖(+2)SO_4+(H_2)↖(0)$
$((Mg)↖(0)-2(e)↖(-))↙(Reduktionsmittel)(→)↖(Oxidation)(Mg)↖(+2)$
$((2H)↖(+1)+2(e)↖(-))↙(Oxidationsmittel)(→)↖(Reduktion)(H_2)↖(0)$
2.$(2Mg)↖(0)+(O_2)↖(0)=(2Mg)↖(+2)(O)↖(-2)$
$((Mg)↖(0)-2(e)↖(-))↙(Reduktionsmittel)(→)↖(Oxidation)(Mg)↖(+2)|4|2$
$((O_2)↖(0)+4(e)↖(-))↙(Oxidationsmittel)(→)↖(Reduktion)(2O)↖(-2)|2|1$
Wie Sie sich erinnern, werden komplexe Redoxreaktionen mit der Elektronenbilanzmethode zusammengestellt:
$(2Fe)↖(0)+6H_2(S)↖(+6)O_(4(k))=(Fe_2)↖(+3)(SO_4)_3+3(S)↖(+4)O_2+ 6H_2O $
$((Fe)↖(0)-3(e)↖(-))↙(Reduktionsmittel)(→)↖(Oxidation)(Fe)↖(+3)|2$
$((S)↖(+6)+2(e)↖(-))↙(Oxidationsmittel)(→)↖(Reduktion)(S)↖(+4)|3$
Ein markantes Beispiel für Redoxreaktionen in der organischen Chemie sind die Eigenschaften von Aldehyden:
1. Aldehyde werden zu den entsprechenden Alkoholen reduziert:
$(CH_3-(C)↖(+1) ()↖(O↖(-2))↙(H↖(+1))+(H_2)↖(0))↙(\text"Essigaldehyd") ( →)↖(Ni,t°)(CH_3-(C)↖(-1)(H_2)↖(+1)(O)↖(-2)(H)↖(+1))↙(\text " Ethylalkohol")$
$((C)↖(+1)+2(e)↖(-))↙(Oxidationsmittel)(→)↖(Reduktion)(C)↖(-1)|1$
$((H_2)↖(0)-2(e)↖(-))↙(Reduktionsmittel)(→)↖(Oxidation)2(H)↖(+1)|1$
2. Aldehyde werden zu den entsprechenden Säuren oxidiert:
$(CH_3-(C)↖(+1) ()↖(O↖(-2))↙(H↖(+1))+(Ag_2)↖(+1)(O)↖(-2)) ↙(\text"Essigaldehyd"))(→)↖(t°)(CH_3-(Ag)↖(0)(C)↖(+3)(O)↖(-2)(OH)↖(-2 +1)+2(Ag)↖(0)↓)↙(\text"Ethylalkohol")$
$((C)↖(+1)-2(e)↖(-))↙(Reduktionsmittel)(→)↖(Oxidation)(C)↖(+3)|1$
$(2(Ag)↖(+1)+2(e)↖(-))↙(Oxidationsmittel)(→)↖(Reduktion)2(Ag)↖(0)|1$
Reaktionen, die ablaufen, ohne dass sich die Oxidationsstufen chemischer Elemente ändern.
Hierzu zählen beispielsweise alle Ionenaustauschreaktionen sowie:
- viele zusammengesetzte Reaktionen:
$Li_2O+H_2O=2LiOH;$
- viele Zersetzungsreaktionen:
$2Fe(OH)_3(→)↖(t°)Fe_2O_3+3H_2O;$
- Veresterungsreaktionen:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Klassifizierung chemischer Reaktionen nach thermischer Wirkung
Basierend auf dem thermischen Effekt werden Reaktionen in exotherme und endotherme Reaktionen unterteilt.
Exotherme Reaktionen.
Diese Reaktionen erfolgen unter Freisetzung von Energie.
Dazu gehören fast alle zusammengesetzten Reaktionen. Eine seltene Ausnahme ist die endotherme Reaktion der Synthese von Stickoxid (II) aus Stickstoff und Sauerstoff und die Reaktion von Wasserstoffgas mit festem Jod:
$N_2+O_2=2NO - Q$,
$H_(2(g))+I(2(t))=2HI - Q$.
Exotherme Reaktionen, die unter Lichtfreisetzung ablaufen, werden als Verbrennungsreaktionen klassifiziert, zum Beispiel:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Die Hydrierung von Ethylen ist ein Beispiel für eine exotherme Reaktion:
$CH_2=CH_2+H_2(→)↖(Pt)CH_3-CH_3+Q$
Es läuft bei Raumtemperatur.
Endotherme Reaktionen
Diese Reaktionen erfolgen unter Aufnahme von Energie.
Dazu gehören natürlich fast alle Zersetzungsreaktionen, zum Beispiel:
a) Kalzinierung von Kalkstein:
$CaCO_3(→)↖(t°)CaO+CO_2-Q;$
b) Butan-Cracken:
Als Energiemenge bezeichnet man die Menge an Energie, die bei einer Reaktion freigesetzt oder absorbiert wird thermischer Effekt der Reaktion, und die Gleichung einer chemischen Reaktion, die diesen Effekt anzeigt, wird aufgerufen thermochemische Gleichung, Zum Beispiel:
$H_(2(g))+Cl_(2(g))=2HCl_((g))+92,3 kJ,$
$N_(2(g))+O_(2(g))=2NO_((g)) - 90,4 kJ$.
Einteilung chemischer Reaktionen nach dem Aggregatzustand der reagierenden Stoffe (Phasenzusammensetzung)
Heterogene Reaktionen.
Dabei handelt es sich um Reaktionen, bei denen sich die Reaktanten und Reaktionsprodukte in unterschiedlichen Aggregatzuständen (in unterschiedlichen Phasen) befinden:
$2Al_((t))+3CuCl_(2(sol))=3Cu_((t))+2AlCl_(3(sol))$,
$CaC_(2(t))+2H_2O_((l))=C_2H_2+Ca(OH)_(2(Lösung))$.
Homogene Reaktionen.
Dabei handelt es sich um Reaktionen, bei denen sich die Reaktanten und Reaktionsprodukte im gleichen Aggregatzustand (in der gleichen Phase) befinden:
Klassifizierung chemischer Reaktionen nach der Beteiligung eines Katalysators
Nichtkatalytische Reaktionen.
Es treten nichtkatalytische Reaktionen auf ohne Beteiligung eines Katalysators:
$2HgO(→)↖(t°)2Hg+O_2$,
$C_2H_4+3O_2(→)↖(t°)2CO_2+2H_2O$.
Katalytische Reaktionen.
Katalytische Reaktionen sind im Gange unter Beteiligung eines Katalysators:
$2KClO_3(→)↖(MnO_2,t°)2KCl+3O_2,$
$(C_2H_5OH)↙(Ethanol)(→)↖(H_2SO-4,t°)(CH_2=CH_2)↙(Ethen)+H_2O$
Da alle biologischen Reaktionen, die in den Zellen lebender Organismen ablaufen, unter Beteiligung spezieller biologischer Katalysatoren mit Proteincharakter – Enzymen – ablaufen, sind sie alle katalytisch oder genauer gesagt enzymatisch.
Es ist zu beachten, dass mehr als 70 % der chemischen Industrie Katalysatoren verwenden.
Klassifizierung chemischer Reaktionen nach Richtung
Irreversible Reaktionen.
Irreversible Reaktionen fließen unter diesen Bedingungen nur in eine Richtung.
Dazu gehören alle Austauschreaktionen, die mit der Bildung eines Niederschlags, Gases oder leicht dissoziierenden Stoffes (Wasser) einhergehen, sowie alle Verbrennungsreaktionen.
Reversible Reaktionen.
Reversible Reaktionen laufen unter diesen Bedingungen gleichzeitig in zwei entgegengesetzten Richtungen ab.
Die überwiegende Mehrheit dieser Reaktionen ist.
In der organischen Chemie spiegelt sich das Zeichen der Reversibilität in den Antonymen der Prozesse wider:
- Hydrierung – Dehydrierung;
- Flüssigkeitszufuhr - Dehydrierung;
- Polymerisation - Depolymerisation.
Alle Reaktionen der Veresterung (der umgekehrte Prozess wird bekanntlich Hydrolyse genannt) und der Hydrolyse von Proteinen, Estern, Kohlenhydraten und Polynukleotiden sind reversibel. Reversibilität liegt dem wichtigsten Prozess in einem lebenden Organismus zugrunde – dem Stoffwechsel.
Die Klassifizierung chemischer Reaktionen in der anorganischen und organischen Chemie erfolgt anhand verschiedener Klassifizierungsmerkmale, die in der folgenden Tabelle aufgeführt sind.
Durch Änderung des Oxidationszustands von Elementen
Das erste Anzeichen einer Klassifizierung basiert auf der Änderung des Oxidationszustands der Elemente, die die Reaktanten und Produkte bilden.
a) Redox
b) ohne Änderung der Oxidationsstufe
Redox werden Reaktionen genannt, die mit einer Änderung der Oxidationsstufen der chemischen Elemente einhergehen, aus denen die Reagenzien bestehen. Zu den Redoxreaktionen in der anorganischen Chemie zählen alle Substitutionsreaktionen sowie solche Zersetzungs- und Kombinationsreaktionen, an denen mindestens ein einfacher Stoff beteiligt ist. Zu den Reaktionen, die ablaufen, ohne dass sich die Oxidationsstufen der Elemente ändern, aus denen die Reaktanten und Reaktionsprodukte bestehen, gehören alle Austauschreaktionen.

Je nach Anzahl und Zusammensetzung der Reagenzien und Produkte
Chemische Reaktionen werden nach der Art des Prozesses klassifiziert, d. h. nach der Anzahl und Zusammensetzung der Reagenzien und Produkte.
Zusammengesetzte Reaktionen sind chemische Reaktionen, bei denen aus mehreren einfacheren komplexe Moleküle entstehen, zum Beispiel:
4Li + O 2 = 2Li 2 O
Zersetzungsreaktionen nennt man chemische Reaktionen, bei denen aus komplexeren einfache Moleküle entstehen, zum Beispiel:
CaCO 3 = CaO + CO 2
Zersetzungsreaktionen können als umgekehrte Kombinationsprozesse betrachtet werden.
Substitutionsreaktionen sind chemische Reaktionen, bei denen ein Atom oder eine Atomgruppe in einem Molekül eines Stoffes durch ein anderes Atom oder eine andere Atomgruppe ersetzt wird, zum Beispiel:
Fe + 2HCl = FeCl 2 + H 2
Ihr Unterscheidungsmerkmal ist die Wechselwirkung einer einfachen Substanz mit einer komplexen. Solche Reaktionen gibt es auch in der organischen Chemie.
Allerdings ist der Begriff „Substitution“ in der organischen Chemie weiter gefasst als in der anorganischen Chemie. Wenn im Molekül der Ausgangssubstanz ein Atom oder eine funktionelle Gruppe durch ein anderes Atom oder eine andere Gruppe ersetzt wird, handelt es sich ebenfalls um Substitutionsreaktionen, obwohl der Vorgang aus Sicht der anorganischen Chemie wie eine Austauschreaktion aussieht.
- Austausch (einschließlich Neutralisierung).
Austauschreaktionen sind chemische Reaktionen, die ohne Veränderung der Oxidationsstufen von Elementen ablaufen und zum Austausch von Bestandteilen der Reaktanten führen, zum Beispiel:
AgNO 3 + KBr = AgBr + KNO 3

Wenn möglich, strömen Sie in die entgegengesetzte Richtung
Wenn möglich, fließen Sie in die entgegengesetzte Richtung – reversibel und irreversibel.
Reversibel sind chemische Reaktionen, die bei einer bestimmten Temperatur gleichzeitig in zwei entgegengesetzten Richtungen mit vergleichbarer Geschwindigkeit ablaufen. Beim Schreiben von Gleichungen für solche Reaktionen wird das Gleichheitszeichen durch entgegengesetzt gerichtete Pfeile ersetzt. Das einfachste Beispiel einer reversiblen Reaktion ist die Synthese von Ammoniak durch die Wechselwirkung von Stickstoff und Wasserstoff:
N 2 +3H 2 ↔2NH 3
Irreversibel sind Reaktionen, die nur in Vorwärtsrichtung ablaufen und zur Bildung von Produkten führen, die nicht miteinander interagieren. Zu den irreversiblen Reaktionen zählen chemische Reaktionen, die zur Bildung leicht dissoziierter Verbindungen und zur Freisetzung großer Energiemengen führen, sowie solche, bei denen die Endprodukte beispielsweise in gasförmiger Form oder in Form eines Niederschlags die Reaktionssphäre verlassen :
HCl + NaOH = NaCl + H2O
2Ca + O2 = 2CaO
BaBr 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaBr

Durch thermische Wirkung
Exotherm nennt man chemische Reaktionen, die unter Freisetzung von Wärme ablaufen. Symbol für die Änderung der Enthalpie (Wärmeinhalt) ΔH und den thermischen Effekt der Reaktion Q. Für exotherme Reaktionen gilt Q > 0 und ΔH< 0.
Endothermisch sind chemische Reaktionen, bei denen Wärme absorbiert wird. Für endotherme Reaktionen Q< 0, а ΔH > 0.
Verbindungsreaktionen sind im Allgemeinen exotherme Reaktionen und Zersetzungsreaktionen sind endotherm. Eine seltene Ausnahme ist die Reaktion von Stickstoff mit Sauerstoff – endotherm:
N2 + O2 → 2NO – Q

Nach Phase
Homogen nennt man Reaktionen, die in einem homogenen Medium ablaufen (homogene Stoffe in einer Phase, zum Beispiel g-g, Reaktionen in Lösungen).
Heterogen sind Reaktionen, die in einem heterogenen Medium an der Kontaktfläche reagierender Stoffe in unterschiedlichen Phasen, beispielsweise fest und gasförmig, flüssig und gasförmig, in zwei nicht mischbaren Flüssigkeiten, ablaufen.
Je nach Katalysatoreinsatz
Ein Katalysator ist eine Substanz, die eine chemische Reaktion beschleunigt.
Katalytische Reaktionen treten nur in Gegenwart eines Katalysators (einschließlich enzymatischer) auf.
Nichtkatalytische Reaktionen gehen in Abwesenheit eines Katalysators.
Nach Art der Abfindung
Homolytische und heterolytische Reaktionen werden anhand der Art der chemischen Bindungsspaltung im Ausgangsmolekül unterschieden.
Homolytisch nennt man Reaktionen, bei denen durch das Aufbrechen von Bindungen Teilchen entstehen, die ein ungepaartes Elektron besitzen – freie Radikale.
Heterolytisch sind Reaktionen, die durch die Bildung ionischer Teilchen – Kationen und Anionen – ablaufen.
- homolytisch (gleiche Lücke, jedes Atom erhält 1 Elektron)
- heterolytisch (ungleiche Lücke – man erhält ein Elektronenpaar)
Radikale(Kette) sind chemische Reaktionen, an denen Radikale beteiligt sind, zum Beispiel:
CH 4 + Cl 2 hv →CH 3 Cl + HCl
Ionisch sind chemische Reaktionen, die unter Beteiligung von Ionen ablaufen, zum Beispiel:
KCl + AgNO 3 = KNO 3 + AgCl↓
Elektrophile Reaktionen sind heterolytische Reaktionen organischer Verbindungen mit Elektrophilen – Partikeln, die eine vollständige oder teilweise positive Ladung tragen. Sie werden in elektrophile Substitutions- und elektrophile Additionsreaktionen unterteilt, zum Beispiel:
C 6 H 6 + Cl 2 FeCl3 → C 6 H 5 Cl + HCl
H 2 C =CH 2 + Br 2 → BrCH 2 –CH 2 Br
Nukleophile Reaktionen sind heterolytische Reaktionen organischer Verbindungen mit Nukleophilen – Partikeln, die eine ganze oder teilweise negative Ladung tragen. Sie werden in nukleophile Substitutions- und nukleophile Additionsreaktionen unterteilt, zum Beispiel:
CH 3 Br + NaOH → CH 3 OH + NaBr
CH 3 C(O)H + C 2 H 5 OH → CH 3 CH(OC 2 H 5) 2 + H 2 O
Klassifizierung organischer Reaktionen
Die Klassifizierung organischer Reaktionen ist in der Tabelle angegeben:

Chemische Reaktionen- Hierbei handelt es sich um Prozesse, bei denen aus einigen Stoffen andere entstehen, die sich in Zusammensetzung und (oder) Struktur von ihnen unterscheiden.
Klassifizierung der Reaktionen:
ICH. Je nach Anzahl und Zusammensetzung der Reaktanten und Reaktionsprodukte:
1) Reaktionen, die ablaufen, ohne die Zusammensetzung des Stoffes zu verändern:
In der anorganischen Chemie sind dies Reaktionen der Umwandlung einiger allotroper Modifikationen in andere:
C (Graphit) → C (Diamant); P (weiß) → P (rot).
In der organischen Chemie handelt es sich dabei um Isomerisierungsreaktionen – Reaktionen, die zur Bildung von Molekülen anderer Stoffe gleicher qualitativer und quantitativer Zusammensetzung aus Molekülen eines Stoffes führen, d.h. mit der gleichen Summenformel, aber unterschiedlicher Struktur.
CH 2 -CH 2 -CH 3 → CH 3 -CH-CH 3
n-Butan 2-Methylpropan (Isobutan)
2) Reaktionen, die bei einer Änderung der Stoffzusammensetzung auftreten:
a) Verbindungsreaktionen (in der organischen Chemie der Addition) – Reaktionen, bei denen zwei oder mehr Stoffe einen komplexeren bilden: S + O 2 → SO 2
In der organischen Chemie sind dies Reaktionen der Hydrierung, Halogenierung, Hydrohalogenierung, Hydratation, Polymerisation.
CH 2 = CH 2 + HOH → CH 3 – CH 2 OH
b) Zersetzungsreaktionen (in der organischen Chemie Eliminierung, Eliminierung) – Reaktionen, bei denen aus einem komplexen Stoff mehrere neue Stoffe entstehen:
CH 3 – CH 2 OH → CH 2 = CH 2 + H 2 O
2KNO 3 →2KNO 2 + O 2
Beispiele für Eliminierungsreaktionen in der organischen Chemie sind Dehydrierung, Dehydratisierung, Dehydrohalogenierung und Cracken.
c) Substitutionsreaktionen – Reaktionen, bei denen Atome einer einfachen Substanz Atome eines Elements in einer komplexen Substanz ersetzen (in der organischen Chemie sind die Reaktanten und Produkte einer Reaktion oft zwei komplexe Substanzen).
CH 4 + Cl 2 → CH 3 Cl + HCl; 2Na+ 2H 2 O→ 2NaOH + H 2
Es gibt nur äußerst wenige Beispiele für Substitutionsreaktionen, die nicht mit einer Änderung der Oxidationsstufen von Atomen einhergehen. Zu beachten ist die Reaktion von Siliziumoxid mit Salzen sauerstoffhaltiger Säuren, die gasförmigen oder flüchtigen Oxiden entsprechen:
CaCO 3 + SiO 2 = CaSiO 3 + CO 2
Ca 3 (PO 4) 2 + 3SiO 2 = 3СаSiO 3 + P 2 O 5
d) Austauschreaktionen – Reaktionen, bei denen zwei komplexe Stoffe ihre Bestandteile austauschen:
NaOH + HCl → NaCl + H 2 O,
2CH 3 COOH + CaCO 3 → (CH 3 COO) 2 Ca + CO 2 + H 2 O
II. Durch Änderung der Oxidationsstufen chemischer Elemente bildender Stoffe
1) Reaktionen, die mit einer Änderung der Oxidationsstufen oder ORR ablaufen:
∙2| N +5 + 3e – → N +2 (Reduktionsprozess, Element – Oxidationsmittel),
∙3| Cu 0 – 2e – → Cu +2 (Oxidationsprozess, Element – Reduktionsmittel),
8HNO 3 + 3Cu → 3Cu(NO 3) 2 + 2NO + 4H 2 O.
Anorganische Chemie:
C 2 H 4 + 2KMnO 4 + 2H 2 O → CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
2) Reaktionen, die ablaufen, ohne die Oxidationsstufen chemischer Elemente zu ändern:
Li 2 O + H 2 O → 2LiOH,
HCOOH + CH 3 OH → HCOOCH 3 + H 2 O
III. Durch thermische Wirkung
1) Exotherme Reaktionen treten unter Energiefreisetzung auf:
C + O 2 → CO 2 + Q,
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
2) Endotherme Reaktionen treten unter Energieaufnahme auf:
СaCO 3 → CaO + CO 2 - Q
C 12 H 26 → C 6 H 14 + C 6 H 12 - Q
IV. Je nach Aggregatzustand der reagierenden Stoffe
1) Heterogene Reaktionen – Reaktionen, bei denen sich die Reaktanten und Reaktionsprodukte in unterschiedlichen Aggregatzuständen befinden:
Fe(sol) + CuSO 4 (sol) → Cu(sol) + FeSO 4 (sol),
CaC 2 (fest) + 2H 2 O (l) → Ca(OH) 2 (Lösung) + C 2 H 2 (g)
2) Homogene Reaktionen – Reaktionen, bei denen sich die Reaktanten und Reaktionsprodukte im gleichen Aggregatzustand befinden:
H 2 (g) + Cl 2 (g) → 2HCl (g),
2C 2 H 2 (g) + 5O 2 (g) → 4CO 2 (g) + 2H 2 O (g)
V. Durch Katalysatorbeteiligung
1) Nichtkatalytische Reaktionen, die ohne Beteiligung eines Katalysators ablaufen:
2H 2 + O 2 → 2H 2 O, C 2 H 4 + 3O 2 → 2CO 2 + 2H 2 O
2) Katalytische Reaktionen mit Katalysatoren:
2H 2 O 2 → 2H 2 O + O 2
VI. In Richtung
1) Irreversible Reaktionen laufen unter bestimmten Bedingungen nur in eine Richtung ab:
C 2 H 4 + 3O 2 → 2CO 2 + 2H 2 O
2) Reversible Reaktionen unter diesen Bedingungen laufen gleichzeitig in zwei entgegengesetzten Richtungen ab: N 2 + 3H 2 ↔2NH 3
VII. Nach dem Strömungsmechanismus
1) Radikaler Mechanismus.
A: B → A· + ·B
Es kommt zu einer homolytischen (gleichen) Bindungsspaltung. Bei der hämolytischen Spaltung wird das die Bindung bildende Elektronenpaar so aufgeteilt, dass jedes der entstehenden Teilchen ein Elektron erhält. Dabei entstehen Radikale – ungeladene Teilchen mit ungepaarten Elektronen. Radikale sind sehr reaktive Teilchen; Reaktionen mit ihnen laufen in der Gasphase mit hoher Geschwindigkeit und oft unter Explosion ab.
Zwischen den bei der Reaktion entstehenden Radikalen und Molekülen kommt es zu Radikalreaktionen:
2H 2 O 2 → 2H 2 O + O 2
CH 4 + Cl 2 → CH 3 Cl +HCl
Beispiele: Verbrennungsreaktionen organischer und anorganischer Stoffe, Synthese von Wasser, Ammoniak, Halogenierungs- und Nitrierungsreaktionen von Alkanen, Isomerisierung und Aromatisierung von Alkanen, katalytische Oxidation von Alkanen, Polymerisation von Alkenen, Vinylchlorid usw.
2) Ionenmechanismus.
A: B → :A - + B +
Es kommt zu einer heterolytischen (ungleichen) Bindungsspaltung, wobei beide Bindungselektronen bei einem der zuvor gebundenen Teilchen verbleiben. Es entstehen geladene Teilchen (Kationen und Anionen).
Ionische Reaktionen treten in Lösungen zwischen Ionen auf, die bereits vorhanden sind oder während der Reaktion gebildet werden.
In der anorganischen Chemie handelt es sich beispielsweise um die Wechselwirkung von Elektrolyten in Lösung, in der organischen Chemie um Additionsreaktionen an Alkene, Oxidation und Dehydrierung von Alkoholen, Substitution einer Alkoholgruppe und andere Reaktionen, die die Eigenschaften von Aldehyden und Carbonsäuren charakterisieren.
VIII. Abhängig von der Art der Energie, die die Reaktion auslöst:
1) Photochemische Reaktionen treten auf, wenn Lichtquanten ausgesetzt werden. Zum Beispiel die Synthese von Chlorwasserstoff, die Wechselwirkung von Methan mit Chlor, die Produktion von Ozon in der Natur, Photosyntheseprozesse usw.
2) Strahlungsreaktionen werden durch energiereiche Strahlung (Röntgenstrahlung, γ-Strahlung) ausgelöst.
3) Elektrochemische Reaktionen werden beispielsweise bei der Elektrolyse durch elektrischen Strom ausgelöst.
4) Thermochemische Reaktionen werden durch thermische Energie initiiert. Dazu gehören alle endothermen Reaktionen und viele exotherme Reaktionen, deren Auslösung Wärme erfordert.
Themen des Einheitlichen Staatsexamen-Kodifizierers: Klassifikation chemischer Reaktionen in der organischen und anorganischen Chemie.
Chemische Reaktionen - Dies ist eine Art Wechselwirkung von Partikeln, bei der eine chemische Substanz andere erzeugt, die sich in Eigenschaften und Struktur von ihnen unterscheiden. Substanzen, die eingeben als Reaktion - Reagenzien. Substanzen, die sind geformt während einer chemischen Reaktion - Produkte.
Bei einer chemischen Reaktion werden chemische Bindungen aufgebrochen und neue gebildet.
Bei chemischen Reaktionen verändern sich die an der Reaktion beteiligten Atome nicht. Lediglich die Reihenfolge der Atomverbindungen in Molekülen ändert sich. Daher, Die Anzahl der Atome desselben Stoffes ändert sich während einer chemischen Reaktion nicht.
Chemische Reaktionen werden nach verschiedenen Kriterien klassifiziert. Betrachten wir die wichtigsten Arten der Klassifizierung chemischer Reaktionen.
Einteilung nach Anzahl und Zusammensetzung der reagierenden Stoffe
Basierend auf der Zusammensetzung und Anzahl der reagierenden Stoffe werden Reaktionen, die ohne Änderung der Zusammensetzung der Stoffe ablaufen, in Reaktionen unterteilt, die mit einer Änderung der Zusammensetzung der Stoffe ablaufen:
1. Reaktionen, die ablaufen, ohne die Zusammensetzung von Stoffen zu verändern (A → B)
Auf solche Reaktionen in der anorganischen Chemie Zu den allotropen Übergängen einfacher Stoffe von einer Modifikation zur anderen gehören:
S orthorhombisch → S monoklin.
IN organische Chemie Zu diesen Reaktionen gehören: Isomerisierungsreaktionen , wenn aus einem Isomer unter dem Einfluss eines Katalysators und äußerer Faktoren ein anderes (normalerweise ein Strukturisomer) entsteht.
Zum Beispiel, Isomerisierung von Butan zu 2-Methylpropan (Isobutan):
CH 3 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH 3)-CH 3.
2. Reaktionen, die bei einer Änderung der Zusammensetzung auftreten
- Zusammengesetzte Reaktionen (A + B + ... → D)- Dabei handelt es sich um Reaktionen, bei denen aus zwei oder mehreren Stoffen ein neuer komplexer Stoff entsteht. IN Anorganische Chemie Zu den Verbundreaktionen zählen Verbrennungsreaktionen einfacher Stoffe, die Wechselwirkung basischer Oxide mit sauren Oxiden usw. Anorganische Chemie Solche Reaktionen werden Reaktionen genannt Beitritte Additionsreaktionen — Hierbei handelt es sich um Reaktionen, bei denen dem betreffenden organischen Molekül ein weiteres Molekül hinzugefügt wird. Additionsreaktionen umfassen Reaktionen Hydrierung(Wechselwirkung mit Wasserstoff), Flüssigkeitszufuhr(Wasserverbindung), Hydrohalogenierung(Zugabe von Halogenwasserstoff), Polymerisation(Anbindung von Molekülen aneinander zu einer langen Kette) usw.
Zum Beispiel, Flüssigkeitszufuhr:
CH 2 =CH 2 + H 2 O → CH 3 -CH 2 -OH
- Zersetzungsreaktionen (A → B+C+…)- Dabei handelt es sich um Reaktionen, bei denen aus einem komplexen Molekül mehrere weniger komplexe oder einfache Stoffe entstehen. Dabei können sowohl einfache als auch komplexe Stoffe gebildet werden.

Zum Beispiel, während der Zersetzung Wasserstoffperoxid:
2H2O2→ 2H 2 O + O 2 .
Anorganische Chemie getrennte Zersetzungsreaktionen und Eliminierungsreaktionen . Eliminationsreaktionen — Hierbei handelt es sich um Reaktionen, bei denen Atome oder Atomgruppen vom ursprünglichen Molekül abgetrennt werden, während das Kohlenstoffgerüst erhalten bleibt.
Zum Beispiel, die Reaktion der Wasserstoffabstraktion (Dehydrierung). Propan:
C 3 H 8 → C 3 H 6 + H 2
Der Name solcher Reaktionen enthält in der Regel das Präfix „de“. Bei Zersetzungsreaktionen in der organischen Chemie kommt es üblicherweise zum Aufbrechen einer Kohlenstoffkette.
Zum Beispiel, Reaktion Butan-Cracking(Aufspaltung in einfachere Moleküle durch Erhitzen oder unter Einfluss eines Katalysators):
C 4 H 10 → C 2 H 4 + C 2 H 6
- Substitutionsreaktionen - Dabei handelt es sich um Reaktionen, bei denen Atome oder Atomgruppen eines Stoffes durch Atome oder Atomgruppen eines anderen Stoffes ersetzt werden. In der anorganischen Chemie Diese Reaktionen laufen nach folgendem Schema ab:
AB + C = AC + B.
Zum Beispiel, aktiver Halogene verdrängen weniger aktive aus Verbindungen. Interaktion Kaliumiodid Mit Chlor:
2KI + Cl 2 → 2KCl + I 2.
Sowohl einzelne Atome als auch Moleküle können ersetzt werden.
Zum Beispiel, bei der Fusion weniger flüchtige Oxide verdrängen sich volatiler aus Salzen. Ja, nichtflüchtig Siliziumoxid verdrängt Kohlenmonoxid aus Natriumcarbonat wenn verschmolzen:
Na 2 CO 3 + SiO 2 → Na 2 SiO 3 + CO 2
IN organische Chemie Substitutionsreaktionen sind Reaktionen, bei denen Teil eines organischen Moleküls ersetzt zu anderen Teilchen. Dabei verbindet sich das substituierte Teilchen in der Regel mit einem Teil des Substituentenmoleküls.
Zum Beispiel, Reaktion Methanchlorierung:
CH 4 + Cl 2 → CH 3 Cl + HCl
Hinsichtlich der Anzahl der Teilchen und der Zusammensetzung der Wechselwirkungsprodukte ähnelt diese Reaktion eher einer Austauschreaktion. Dennoch, durch Mechanismus Eine solche Reaktion ist eine Ersatzreaktion.
- Austauschreaktionen - das sind Reaktionen, bei denen zwei komplexe Stoffe ihre Bestandteile austauschen:
AB + CD = AC + BD

Austauschreaktionen umfassen Ionenaustauschreaktionen in Lösungen fließen; Reaktionen, die die Säure-Base-Eigenschaften von Substanzen und anderen veranschaulichen.
Beispiel Austauschreaktionen in der anorganischen Chemie - Neutralisation Salzsäure-Alkali:
NaOH + HCl = NaCl + H2O
Beispiel Austauschreaktionen in der organischen Chemie - alkalische Hydrolyse von Chlorethan:
CH 3 -CH 2 -Cl + KOH = CH 3 -CH 2 -OH + KCl
Klassifizierung chemischer Reaktionen nach Änderungen im Oxidationszustand der Elemente, die Stoffe bilden
Durch Änderung des Oxidationszustands von Elementen chemische Reaktionen werden unterteilt in Redoxreaktionen, und die Reaktionen, die es gibt ohne die Oxidationsstufen zu verändern chemische Elemente.
- Redoxreaktionen (ORR) sind Reaktionen, bei denen Oxidationsstufen Substanzen ändern. In diesem Fall findet ein Austausch statt Elektronen.
IN Anorganische Chemie Zu diesen Reaktionen gehören üblicherweise Zersetzungs-, Substitutions- und Kombinationsreaktionen sowie alle Reaktionen, an denen einfache Substanzen beteiligt sind. Um die ORR auszugleichen, wird die Methode verwendet elektronische Balance(Die Anzahl der abgegebenen Elektronen muss gleich der Anzahl der empfangenen sein) oder Methode des Elektronen-Ionen-Gleichgewichts.
IN organische Chemie getrennte Oxidations- und Reduktionsreaktionen, je nachdem, was mit dem organischen Molekül passiert.
Oxidationsreaktionen Anorganische Chemie sind Reaktionen, bei denen die Zahl der Wasserstoffatome nimmt ab oder die Anzahl der Sauerstoffatome im ursprünglichen organischen Molekül nimmt zu.
Zum Beispiel, Oxidation von Ethanol unter Einwirkung von Kupferoxid:
CH 3 -CH 2 -OH + CuO → CH 3 -CH=O + H 2 O + Cu
Erholungsreaktionen In der organischen Chemie sind dies Reaktionen, bei denen die Zahl der Wasserstoffatome nimmt zu oder die Zahl der Sauerstoffatome nimmt ab in einem organischen Molekül.
Zum Beispiel, Erholung Acetaldehyd Wasserstoff:
CH 3 -CH=O + H 2 → CH 3 -CH 2 -OH
- Protolytische und metabolische Reaktionen - Dabei handelt es sich um Reaktionen, bei denen sich die Oxidationsstufen von Atomen nicht ändern.
Zum Beispiel, Neutralisierung Ätznatron Salpetersäure:
NaOH + HNO 3 = H 2 O + NaNO 3
Klassifizierung von Reaktionen nach thermischem Effekt
Je nach thermischer Wirkung werden Reaktionen unterteilt in exotherm Und endothermisch.
Exotherme Reaktionen - Dies sind Reaktionen, die mit der Freisetzung von Energie in Form von Wärme einhergehen (+ Q). Solche Reaktionen umfassen fast alle zusammengesetzten Reaktionen.
Ausnahmen- Reaktion Stickstoff Mit Sauerstoff mit Bildung Stickoxid (II) - endothermisch:
N 2 + O 2 = 2NO – Q
Gasförmige Reaktion Wasserstoff mit hart Jod Auch endothermisch:
H 2 + I 2 = 2HI – Q
Exotherme Reaktionen, die Licht erzeugen, werden Reaktionen genannt Verbrennung.
Zum Beispiel, Methanverbrennung:
CH 4 + O 2 = CO 2 + H 2 O

Auch exotherm Sind:

Endotherme Reaktionen sind Reaktionen, die von begleitet werden Energieabsorption in Form von Wärme ( -Q ). In der Regel laufen die meisten Reaktionen unter Wärmeaufnahme ab Zersetzung(Reaktionen, die längeres Erhitzen erfordern).
Zum Beispiel, Zersetzung Kalkstein:
CaCO 3 → CaO + CO 2 – Q
Auch endothermisch Sind:
- Hydrolysereaktionen;
- Reaktionen, die nur beim Erhitzen auftreten;
- Reaktionen, die nur auftretenbei sehr hohen Temperaturen oder unter dem Einfluss einer elektrischen Entladung.
Zum Beispiel, Umwandlung von Sauerstoff in Ozon:
3O 2 = 2O 3 - Q
IN organische Chemie Bei der Aufnahme von Wärme kommt es zu Zersetzungsreaktionen. Zum Beispiel, knackend Pentan:
C 5 H 12 → C 3 H 6 + C 2 H 6 – Q.
Einteilung chemischer Reaktionen nach dem Aggregatzustand der reagierenden Stoffe (nach Phasenzusammensetzung)
Stoffe können in drei Hauptaggregatzuständen existieren: hart, flüssig Und gasförmig. Nach Phasenzustand Reaktionen teilen homogen Und heterogen.
- Homogene Reaktionen - Dies sind Reaktionen, bei denen die Reaktanten und Produkte vorhanden sind in einer Phase, und die Kollision der reagierenden Partikel erfolgt im gesamten Volumen der Reaktionsmischung. Zu den homogenen Reaktionen gehören Wechselwirkungen flüssig-flüssig Und Gas-Gas.
Zum Beispiel, Oxidation Schwefeldioxid:
2SO 2 (g) + O 2 (g) = 2SO 3 (g)
- Heterogene Reaktionen - Dies sind Reaktionen, bei denen die Reaktanten und Produkte vorhanden sind in verschiedenen Phasen. In diesem Fall kommt es lediglich zur Kollision reagierender Teilchen an der Phasenkontaktgrenze. Zu solchen Reaktionen gehören Wechselwirkungen Gas-Flüssigkeit, Gas-Feststoff, Fest-Feststoff und Fest-Flüssigkeit.
Zum Beispiel, Interaktion Kohlendioxid Und Kalziumhydroxid:
CO 2 (g) + Ca (OH) 2 (Lösung) = CaCO 3 (tv) + H 2 O
Um Reaktionen nach Phasenzustand zu klassifizieren, ist es hilfreich, bestimmen zu können Phasenzustände von Stoffen. Dies lässt sich ganz einfach mit Kenntnissen über die Struktur der Materie, insbesondere über, bewerkstelligen.
Stoffe mit ionisch, atomar oder Metallkristallgitter, allgemein hart unter normalen Bedingungen; Substanzen mit Molekülgitter, allgemein, Flüssigkeiten oder Gase unter normalen Bedingungen.
Bitte beachten Sie, dass Stoffe beim Erhitzen oder Abkühlen von einem Phasenzustand in einen anderen wechseln können. In diesem Fall ist es notwendig, sich auf die Bedingungen einer bestimmten Reaktion und die physikalischen Eigenschaften des Stoffes zu konzentrieren.
Zum Beispiel, Empfangen Synthesegas tritt bei sehr hohen Temperaturen auf, bei denen Wasser - Dampf:
CH 4 (g) + H2O (g) = CO (g) + 3H 2 (g)
Also Dampfreform Methan — homogene Reaktion.
Klassifizierung chemischer Reaktionen nach der Beteiligung eines Katalysators
Ein Katalysator ist ein Stoff, der eine Reaktion beschleunigt, aber nicht Teil der Reaktionsprodukte ist. Der Katalysator nimmt an der Reaktion teil, wird jedoch während der Reaktion praktisch nicht verbraucht. Herkömmlicherweise ist das Katalysatorwirkungsdiagramm ZU wenn Stoffe interagieren A+B lässt sich wie folgt darstellen: A + K = AK; AK + B = AB + K.
Abhängig vom Vorhandensein eines Katalysators werden katalytische und nichtkatalytische Reaktionen unterschieden.
- Katalytische Reaktionen - Dies sind Reaktionen, die unter Beteiligung von Katalysatoren ablaufen. Zum Beispiel die Zersetzung von Berthollet-Salz: 2KClO 3 → 2KCl + 3O 2.
- Nichtkatalytische Reaktionen - Dies sind Reaktionen, die ohne Beteiligung eines Katalysators ablaufen. Zum Beispiel Ethanverbrennung: 2C 2 H 6 + 5O 2 = 2CO 2 + 6H 2 O.
Alle in den Zellen lebender Organismen ablaufenden Reaktionen erfolgen unter Beteiligung spezieller Proteinkatalysatoren – Enzyme. Solche Reaktionen werden als enzymatisch bezeichnet.
Auf den Wirkmechanismus und die Funktionen von Katalysatoren wird in einem separaten Artikel näher eingegangen.
Klassifizierung der Reaktionen nach Richtung
Reversible Reaktionen - Dies sind Reaktionen, die sowohl in Vorwärts- als auch in Rückwärtsrichtung auftreten können, d. h. wenn unter bestimmten Bedingungen Reaktionsprodukte miteinander interagieren können. Reversible Reaktionen umfassen die meisten homogenen Reaktionen, Veresterung; Hydrolysereaktionen; Hydrierung-Dehydrierung, Hydratation-Dehydratisierung; Herstellung von Ammoniak aus einfachen Stoffen, Oxidation von Schwefeldioxid, Herstellung von Halogenwasserstoffen (außer Fluorwasserstoff) und Schwefelwasserstoff; Methanolsynthese; Produktion und Abbau von Carbonaten und Bicarbonaten usw.
Irreversible Reaktionen - das sind Reaktionen, die überwiegend in eine Richtung ablaufen, d.h. Unter diesen Bedingungen können die Reaktionsprodukte nicht miteinander reagieren. Beispiele für irreversible Reaktionen: Verbrennung; explosive Reaktionen; Reaktionen, die unter Bildung von Gas, Niederschlag oder Wasser in Lösungen auftreten; Auflösung von Alkalimetallen in Wasser; usw.
Die chemischen Eigenschaften von Stoffen offenbaren sich in einer Vielzahl chemischer Reaktionen.
Als Umwandlungen von Stoffen werden Veränderungen ihrer Zusammensetzung und (oder) Struktur bezeichnet chemische Reaktionen. Die folgende Definition findet sich häufig: chemische Reaktion ist der Prozess der Umwandlung von Ausgangsstoffen (Reagenzien) in Endstoffe (Produkte).
Chemische Reaktionen werden mithilfe chemischer Gleichungen und Diagramme beschrieben, die die Formeln der Ausgangsstoffe und Reaktionsprodukte enthalten. In chemischen Gleichungen ist im Gegensatz zu Diagrammen die Anzahl der Atome jedes Elements auf der linken und rechten Seite gleich, was das Gesetz der Massenerhaltung widerspiegelt.
Auf der linken Seite der Gleichung stehen die Formeln der Ausgangsstoffe (Reagenzien), auf der rechten Seite die durch die chemische Reaktion entstehenden Stoffe (Reaktionsprodukte, Endstoffe). Das Gleichheitszeichen, das die linke und rechte Seite verbindet, zeigt an, dass die Gesamtzahl der Atome der an der Reaktion beteiligten Stoffe konstant bleibt. Dies wird erreicht, indem den Formeln ganzzahlige stöchiometrische Koeffizienten vorangestellt werden, die die quantitativen Beziehungen zwischen den Reaktanten und Reaktionsprodukten zeigen.
Chemische Gleichungen können zusätzliche Informationen über die Eigenschaften der Reaktion enthalten. Kommt es unter dem Einfluss äußerer Einflüsse (Temperatur, Druck, Strahlung usw.) zu einer chemischen Reaktion, wird dies durch das entsprechende Symbol, meist über (oder „unter“) dem Gleichheitszeichen, angezeigt.
Eine Vielzahl chemischer Reaktionen kann in verschiedene Reaktionstypen eingeteilt werden, die sehr spezifische Eigenschaften aufweisen.
Als Klassifizierungsmerkmale Folgendes kann ausgewählt werden:
1. Anzahl und Zusammensetzung der Ausgangsstoffe und Reaktionsprodukte.
2. Physischer Zustand der Reagenzien und Reaktionsprodukte.
3. Die Anzahl der Phasen, in denen sich die Reaktionsteilnehmer befinden.
4. Die Art der übertragenen Partikel.
5. Möglichkeit, dass die Reaktion in Vorwärts- und Rückwärtsrichtung abläuft.
6. Das Vorzeichen des thermischen Effekts unterteilt alle Reaktionen in: exotherm Reaktionen mit Exo-Effekt – Freisetzung von Energie in Form von Wärme (Q>0, ∆H<0):
C + O 2 = CO 2 + Q
Und endothermisch Reaktionen, die beim Endo-Effekt auftreten – der Aufnahme von Energie in Form von Wärme (Q<0, ∆H >0):
N 2 + O 2 = 2NO - Q.
Solche Reaktionen werden als bezeichnet thermochemisch.
Schauen wir uns jede Art von Reaktion genauer an.
Einteilung nach Anzahl und Zusammensetzung der Reagenzien und Endstoffe
1. Zusammengesetzte Reaktionen
Wenn eine Verbindung aus mehreren reagierenden Stoffen relativ einfacher Zusammensetzung reagiert, entsteht ein Stoff komplexerer Zusammensetzung:
In der Regel gehen diese Reaktionen mit der Freisetzung von Wärme einher, d.h. zur Bildung stabilerer und weniger energiereicher Verbindungen führen.
Reaktionen von Verbindungen einfacher Stoffe sind immer redoxischer Natur. Verbundreaktionen zwischen komplexen Stoffen können ohne Änderung der Wertigkeit ablaufen:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2,
und auch als Redox klassifiziert werden:
2FeCl 2 + Cl 2 = 2FeCl 3.
2. Zersetzungsreaktionen
Zersetzungsreaktionen führen zur Bildung mehrerer Verbindungen aus einem komplexen Stoff:
A = B + C + D.
Die Zersetzungsprodukte eines komplexen Stoffes können sowohl einfache als auch komplexe Stoffe sein.
Unter den Zersetzungsreaktionen, die ohne Änderung der Wertigkeitszustände ablaufen, ist die Zersetzung von kristallinen Hydraten, Basen, Säuren und Salzen sauerstoffhaltiger Säuren hervorzuheben:
| Zu | ||
| 4HNO3 | = | 2H 2 O + 4NO 2 O + O 2 O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O.
Redoxzersetzungsreaktionen sind besonders charakteristisch für Salpetersäuresalze.
Zersetzungsreaktionen werden in der organischen Chemie als Cracken bezeichnet:
C 18 H 38 = C 9 H 18 + C 9 H 20,
oder Dehydrierung
C4H10 = C4H6 + 2H2.
3. Substitutionsreaktionen
Bei Substitutionsreaktionen reagiert normalerweise ein einfacher Stoff mit einem komplexen Stoff und bildet einen weiteren einfachen Stoff und einen weiteren komplexen Stoff:
A + BC = AB + C.
Diese Reaktionen gehören überwiegend zu Redoxreaktionen:
2Al + Fe 2 O 3 = 2Fe + Al 2 O 3,
Zn + 2HCl = ZnСl 2 + H 2,
2KBr + Cl 2 = 2KCl + Br 2,
2KlO 3 + l 2 = 2KlO 3 + Cl 2.
Es gibt nur äußerst wenige Beispiele für Substitutionsreaktionen, die nicht mit einer Änderung der Valenzzustände von Atomen einhergehen. Zu beachten ist die Reaktion von Siliziumdioxid mit Salzen sauerstoffhaltiger Säuren, die gasförmigen oder flüchtigen Anhydriden entsprechen:
CaCO 3 + SiO 2 = CaSiO 3 + CO 2,
Ca 3 (PO 4) 2 + 3SiO 2 \u003d 3СаSiO 3 + P 2 O 5,
Manchmal werden diese Reaktionen als Austauschreaktionen betrachtet:
CH 4 + Cl 2 = CH 3 Cl + HCl.
4. Austauschreaktionen
Austauschreaktionen sind Reaktionen zwischen zwei Verbindungen, die ihre Bestandteile untereinander austauschen:
AB + CD = AD + CB.
Treten bei Substitutionsreaktionen Redoxprozesse auf, so laufen Austauschreaktionen immer ab, ohne dass sich der Wertigkeitszustand der Atome ändert. Dies ist die häufigste Gruppe von Reaktionen zwischen komplexen Substanzen – Oxiden, Basen, Säuren und Salzen:
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O,
AgNO 3 + KBr = AgBr + KNO 3,
CrCl 3 + ZNaON = Cr(OH) 3 + ZNaCl.
Ein Sonderfall dieser Austauschreaktionen ist Neutralisationsreaktionen:
HCl + KOH = KCl + H 2 O.
Typischerweise gehorchen diese Reaktionen den Gesetzen des chemischen Gleichgewichts und verlaufen in der Richtung, in der mindestens einer der Stoffe in Form eines gasförmigen, flüchtigen Stoffes, Niederschlags oder einer (für Lösungen) schwach dissoziierenden Verbindung aus der Reaktionssphäre entfernt wird:
NaHCO 3 + HCl = NaCl + H 2 O + CO 2,
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 ↓ + 2H 2 O,
CH 3 COONa + H 3 PO 4 = CH 3 COOH + NaH 2 PO 4.
5. Transferreaktionen.
Bei Transferreaktionen bewegt sich ein Atom oder eine Atomgruppe von einer Struktureinheit zur anderen:
AB + BC = A + B 2 C,
A 2 B + 2CB 2 = DIA 2 + DIA 3.
Zum Beispiel:
2AgCl + SnCl 2 = 2Ag + SnCl 4,
H 2 O + 2NO 2 = HNO 2 + HNO 3.
Klassifizierung von Reaktionen nach Phaseneigenschaften
Je nach Aggregatzustand der reagierenden Stoffe werden folgende Reaktionen unterschieden:
1. Gasreaktionen
| H2+Cl2 | 2HCl. |
2. Reaktionen in Lösungen
NaOH(Lösung) + HCl(p-p) = NaCl(p-p) + H 2 O(l)
3. Reaktionen zwischen Feststoffen
| Zu | ||
| CaO(tv) + SiO 2 (tv) | = | CaSiO 3 (sol) |
Klassifizierung der Reaktionen nach der Anzahl der Phasen.
Unter einer Phase versteht man eine Menge homogener Teile eines Systems mit gleichen physikalischen und chemischen Eigenschaften, die durch eine Grenzfläche voneinander getrennt sind.
Unter diesem Gesichtspunkt lässt sich die gesamte Reaktionsvielfalt in zwei Klassen einteilen:
1. Homogene (einphasige) Reaktionen. Dazu gehören Reaktionen, die in der Gasphase ablaufen, und eine Reihe von Reaktionen, die in Lösungen ablaufen.
2. Heterogene (mehrphasige) Reaktionen. Dazu gehören Reaktionen, bei denen sich die Reaktanten und Reaktionsprodukte in unterschiedlichen Phasen befinden. Zum Beispiel:
Gas-Flüssigphasen-Reaktionen
CO 2 (g) + NaOH(p-p) = NaHCO 3 (p-p).
Gas-Festphasen-Reaktionen
CO 2 (g) + CaO (tv) = CaCO 3 (tv).
Flüssig-Festphasen-Reaktionen
Na 2 SO 4 (Lösung) + BaCl 3 (Lösung) = BaSO 4 (tv) ↓ + 2NaCl (p-p).
Flüssig-Gas-Festphasenreaktionen
Ca(HCO 3) 2 (Lösung) + H 2 SO 4 (Lösung) = CO 2 (r) + H 2 O (l) + CaSO 4 (Sol)↓.
Klassifizierung der Reaktionen nach der Art der übertragenen Partikel
1. Protolytische Reaktionen.
ZU protolytische Reaktionen Dazu gehören chemische Prozesse, deren Kern die Übertragung eines Protons von einem reagierenden Stoff auf einen anderen ist.
Diese Klassifizierung basiert auf der protolytischen Theorie der Säuren und Basen, wonach eine Säure jede Substanz ist, die ein Proton abgibt, und eine Base eine Substanz ist, die ein Proton aufnehmen kann, zum Beispiel:
Zu den protolytischen Reaktionen gehören Neutralisations- und Hydrolysereaktionen.
2. Redoxreaktionen.
Dazu gehören Reaktionen, bei denen reagierende Stoffe Elektronen austauschen und dadurch die Oxidationsstufen der Atome der Elemente ändern, aus denen die reagierenden Stoffe bestehen. Zum Beispiel:
Zn + 2H + → Zn 2 + + H 2,
FeS 2 + 8HNO 3 (konz.) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O,
Die allermeisten chemischen Reaktionen sind Redoxreaktionen, sie spielen eine äußerst wichtige Rolle.
3. Ligandenaustauschreaktionen.
Dazu gehören Reaktionen, bei denen die Übertragung eines Elektronenpaares unter Bildung einer kovalenten Bindung über einen Donor-Akzeptor-Mechanismus erfolgt. Zum Beispiel:
Cu(NO 3) 2 + 4NH 3 = (NO 3) 2,
Fe + 5CO = ,
Al(OH) 3 + NaOH = .
Ein charakteristisches Merkmal von Ligandenaustauschreaktionen ist, dass die Bildung neuer Verbindungen, sogenannte Komplexe, ohne Änderung der Oxidationsstufe erfolgt.
4. Reaktionen des atomar-molekularen Austauschs.
Dieser Reaktionstyp umfasst viele der in der organischen Chemie untersuchten Substitutionsreaktionen, die über einen radikalischen, elektrophilen oder nukleophilen Mechanismus ablaufen.
Reversible und irreversible chemische Reaktionen
Reversible chemische Prozesse sind solche, deren Produkte unter den gleichen Bedingungen, unter denen sie gewonnen wurden, miteinander zu den Ausgangsstoffen reagieren können.
Für reversible Reaktionen wird die Gleichung normalerweise wie folgt geschrieben:
Zwei entgegengesetzt gerichtete Pfeile zeigen an, dass unter gleichen Bedingungen sowohl Hin- als auch Rückreaktionen gleichzeitig ablaufen, zum Beispiel:
CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O.
Irreversible chemische Prozesse sind solche, deren Produkte nicht miteinander zu den Ausgangsstoffen reagieren können. Beispiele für irreversible Reaktionen sind die Zersetzung von Berthollet-Salz beim Erhitzen:
2КlО 3 → 2Кl + ЗО 2,
oder Oxidation von Glucose durch Luftsauerstoff:
C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O.