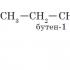چه خواصی را شیمیایی می نامند. خواص شیمیایی طبقات اصلی ترکیبات معدنی
خداوند به انسان آهن داد، اما شیطان به او زنگ زد.
ضرب المثل
تغییرات در خواص در طول چند دهه.از آنجایی که عناصر d با مثبت st.ok. سپس به شکل مواد ساده خاصیت کاهشی از خود نشان می دهند که در محلول های آبی با مقدار پتانسیل ردوکس E مشخص می شود. 0 در چند دهه از چپ به راست، مقدار آن، با مقدار I 1 مرتبط است، در حال رشد، اما هنگام حرکت به سمت منگنز و زیرگروه روی، علیرغم افزایش شدید I 1، به دلیل کاهش مقدار I 2 و کاهش انرژی شبکه کریستالی هنگام حرکت به این فلزات (از فلزات واقع شده) کاهش می یابد. در سمت چپ آنها در جدول تناوبی).
در حالت فشرده در دور. حتی M دهه اول با مقادیر منفی E (0 از Sc تا Mn E 0< −0,90 B), с водой не реагируют вследствие образованияمنفعل کنندهلایه های اکسید روی سطح آنها. با این حال، در دمای حرارت قرمز، فلزات کمتر فعال (آهن، نیکل، آنالوگ های وانادیوم و تیتانیوم) هیدروژن را از آب جابجا می کنند. واکنش پذیری M نیز هنگامی که به تبدیل می شوند به شدت افزایش می یابد خوببه عنوان مثال، پودرهای منگنز و کروم با آب در r.b برهم کنش دارند. (با تشکیل MnO 2 و Cr 2 O 3 ).
تمام فلزات دهه اول که برای آنها E 0 هیدروژن را از محلول های اسید رقیق جابجا می کند< 0, кроме ванадия. Наиболее активные М: цинк и марганец – растворяются даже в уксусной кислоте, а медь (в ряду напряжений стоит правее водорода) лишь в т.н. кислотах-окислителях. При указанных взаимодействиях только Sc и Тi образуют соединения в ст.ок. (+3), остальные – в (+2), хотя хром(II) и (гораздо медленнее) железо(II) на воздухе затем окисляются до (+3).
انفعال غیرعادی وانادیوم (E0 = -1.20 V) در اسیدهای رقیق توضیح داده شده است. چگالی خاصفیلم اکسید آن فقط در HF یا HNO3 غلیظ حل می شود که این فلز با آن واکنش نشان می دهد:
V + HNO 3 = HVO 3 + NO.
دیگر فعال M بسته به انحلال پذیریفیلم اکسید آنها در اسید نیتریک غلیظ یا با آن واکنش می دهد و نیتروژن را به (3-) کاهش می دهد (این زیر گروه روی، منگنز و اسکاندیم است)، یا به دلیل ضخیم شدن لایه اکسید مانند Cr 124 توسط آن غیرفعال می شود.
غیرفعال سازی را می توان به صورت مصنوعی نیز انجام داد. بنابراین، تیمار کروم (که در محدوده ولتاژ بین روی و آهن قرار دارد) با اسید نیتریک غلیظ، پتانسیل آن را از -0.56 V به +1.2 V افزایش می دهد، یعنی. Cr را تقریباً به اندازه Pt نجیب می کند. (کروم موجود در فولاد ضد زنگ و سایر آلیاژهای 125 به ویژه به راحتی غیرفعال می شود.) H 2 SO 4 غلیظ و HNO 3 نیز آهن را غیرفعال می کنند.
کبالت و نیکل به دلیل نزدیکی شعاع اتمی از نظر فعالیت شیمیایی شبیه آهن هستند (بنابراین آنها در خانوادهغده). با این حال، اگر آهن با HCl رقیق و H 2 SO 4 در شرایط محیطی واکنش نشان دهد، Co و Ni با گرم شدن واکنش می دهند. علاوه بر این، به دلیل حلالیت بیشتر اکسیدهای آنها در این اسید، به میزان کمتری نسبت به آهن توسط اسید نیتریک غیرفعال می شوند.
توجه داشته باشید که برای عناصر دهه دوم و سوم ماهیت تغییر در مقدار E 0 تقریباً مانند اول باقی می ماند.
تغییرات در خواص در زیر گروه هامقدار I 1 در زیرگروه های d عمدتاً می باشد رشد می کند وقدرت افزایش می یابدپیوندها در شبکه M (مقایسه m.p.). در نتیجه (بر خلاف زیر گروه های اصلی و زیر گروه Sc)، مقدار E 0 مثبت تر می شود و واکنش پذیری فلزات کاهش می دهد.
بنابراین، در زیر گروه IB، اگر مس در اسید سولفوریک غلیظ در r.v حل شود، نقره فقط در دمای 0 > 160 درجه سانتیگراد. با این حال، نقره، مانند مس، در اتاقدرجه حرارتبا اسید نیتریک، و طلا فقط با آکوا رژیا (و همچنین با اسید سلنیک (نگاه کنید به بالا) و با آب کلر در حضور HCl برهمکنش دارد.
در زیرگروه IIB، روی حتی در اسید استیک محلول است، کادمیوم در HCl محلول است و جیوه (E 0 > 0) فقط در HNO (3 با کمبود اسید، اکسیداسیون به جیوه، 2 2 + و با بیش از حد - ادامه می یابد. به جیوه). 2 +
به طور مشابه، در زیر گروه VIIB - منگنز با CH COOH 3، و Tc و Re (مقادیر آنها واکنش می دهد.
E 0: 0.47 V و 0.37 V، به ترتیب، در r.u. فقط در اسیدهای اکسید کننده، به عنوان مثال، اسید نیتریک (محصولات NO و HEO 4) حل می شود.
در زیر گروه VIIIB، فلزات خانواده آهن همگی با اسیدهای رقیق برهم کنش دارند. و آنالوگ های آنها، یعنی. فلزات پلاتین (E 0 > 0) فقط در آن اکسید می شوند سخت استشرایط، و نزدیکی شعاع آنها تعیین کننده بزرگی است شباهتدر رفتار شیمیایی، اما وجود دارد تفاوت.
بنابراین، فعال ترین آنها، پالادیوم، اسیدی است، مانند نقره. و رودیوم و ایریدیوم بر خلاف بقیه حتی در ودکای 126 حل نمی شوند. آنها با محلول سدیم کلرید اشباع شده با کلر در دمای قرمز گرم به دلیل تشکیل واکنش می دهند. پایدارمجتمع های Na 3 [ECl6]. اما به شکل سیاه این فلزات به راحتی با اسید سولفوریک داغ و حتی با اسید کلریدریک در حضور اکسیژن واکنش می دهند. توجه داشته باشید که در این شرایط، اسمیم به دلیل تمایل زیاد به اکسیژن (؟)، به صورت فشرده حل می شود.
در زیرگروه های جانبی IV، V و VI در M دهه دوم و سوم E 0< 0 , но за счет влиянияمتراکملایه اکسید روی سطح آنها، آنها تنها در شرایط سخت با اسیدها واکنش می دهند. بنابراین، Zr و Hf فقط در اسیدهای کمپلکس محلول هستند: در اسید سولفوریک داغ (محصول - H 2 [E(SO 4) ] 3) و در اسید هیدروفلوئوریک (H 4 [EF 8 ]). مولیبدن تنها با اسیدهای اکسید کننده هنگام گرم شدن، و تنگستن، نیوبیم و تانتالیوم فقط با مخلوطی از HF و HNO (به ترتیب 3 محصول NO و H2 WF 8 یا H2 EF 7) برهمکنش میکنند.
بنابراین، صرف نظر از تحمیل یک عامل جنبشی (فیلم غیرفعال) یا خیر، فعالیت فلزات d نسبت به اسیدهای زیر گروه ها کاهش می یابد. استثناهمانطور که قبلا ذکر شد، است زیر گروه scandium، که در آن هیچ تأثیری از فشرده سازی f و ماهیت تغییر در مقادیر شعاع اتمی وجود ندارد، I 1 و E 0 مانند زیر گروه های اصلی است. در نتیجه، لانتانیم (برخلاف اسکاندیم و ایتریم که در r.b فقط در اسیدها محلول هستند) حتی با آب نیز برهم کنش می کند:
La + H 2 O → La(OH) 3 + H 2 .
نسبت d-فلزات به قلیایی.نقره 127 بیشترین مقاومت را در برابر قلیایی دارد و روی کمترین مقاومت را دارد: حتی راه حلقلیایی، کاهش هیدروژن آب و تشکیل کمپلکس 128 -. فلزات d باقیمانده، اگر به شکل آنیونی وجود داشته باشند، با مواد قلیایی (یا سودا) واکنش نشان می دهند. در طول همجوشی، مثلا:
Ti⎫ ⎧Na 2 TiO 3 ⎬ + NaOH → H 2 + ⎨ .
⎭ ⎩ Na 3 VO 4
در مورد دیگران هم داشتن لازم است عامل اکسید کننده:
Cr + NaNO 3 + NaOH → Na 2 CrO 4 + NaNO 2،
O 2 + Na 2 CO 3 → Na 2 WO 4 + CO 2 .
علاوه بر این، W و Mo با قلیایی فعال تر از Cr تعامل دارند، زیرا در طول واکنش، سطح آنها با اکسید اسیدی (EO) 3 بیشتر از کروم (Cr 2 O 3) پوشیده شده است.
برهمکنش d-فلزات با مواد ساده. خوردگی.در شرایط اتاق، فقط فلوئور اکثر فلزات d را اکسید می کند، به جز فلزات نجیب (اما واکنش با مس، نیکل، آهن (و همچنین با سرب، آل) به تشکیل لایه های محافظ فلوراید محدود می شود. علاوه بر این، در ob.u. طلا با برم و جیوه با ید و گوگرد به دلیل تشکیل مواد ترمودینامیکی بسیار برهم کنش می کند. پایدارمحصولات: AuBr، 3 HgI 2 و HgS (به بخش "هالوژن ها" مراجعه کنید).
در هوا، در حالت پراکنده ریز، فلزات نسبتاً فعال (Ti, Cr, Mn, Fe, Co, Ni) پیروفورها 2 (یعنی وقتی در معرض هوا قرار می گیرند روشن می شوند)، اما در فرم فشرده اکثر M به دلیل غیرفعال شدن پایدار هستند. بخصوص متراکمفیلم های سطحی توسط فلزات زیرگروه وانادیوم و تیتانیوم تشکیل می شوند، بنابراین آنها مقاومت به خوردگی بالایی دارند (حتی در آب دریا).
سایر فلزات به این اندازه پایدار نیستند. تحت تأثیر اجزای هوا (کدام یک؟)، خوردگی روی و مس به آرامی رخ می دهد (با تشکیل E 2 (OH) 2 CO 3). حتی نقره تیره می شود و با سولفید پوشیده می شود (تحت تأثیر ترکیبی O 2 ، H 2 O و H 2 S؛ نقش هر یک از آنها چیست؟).
آهن به ویژه به سرعت خورده می شود. درست است، در یک جو خشک، اکسیداسیون آن فقط قبل از تشکیل اتفاق می افتد متراکمفیلم غیرفعال کننده FeO. اما در صورت وجود رطوبت، محصول حاصل از واکنش:
Fe + H 2 O → FeO + H 2،
اکسید شده توسط اکسیژن، فعال شده توسط مولکول های H 2 O، به Fe 2 O 3 می رسد. در این حالت، آب توسط سطح فلز جذب می شود و تا حدی محصولات اکسیداسیون را در خود حل می کند. جلوگیری می کندتشکیل متراکمساختار اکسیدی که در نتیجه آن خوردگی آهن رخ می دهد در اعماق وجود.
افزودن قلیایی پتانسیل اکسیداسیون اکسیژن را کاهش می دهد و بنابراین روند به میزان کمتری پیش می رود. توجه داشته باشید که خیلیخالصآهن که هیدروژن را به خوبی جذب می کند و در نتیجه سطح آن را غیرفعال می کند، اکسید نمی شود.
برای محافظت در برابر خوردگی، آهن صنعتی رنگ می شود یا در معرض قلع کاری، گالوانیزه، آبکاری کروم، آبکاری نیکل، نیتریدینگ (پوشش Fe 4 N)، سیمان کاری (Fe C 3) و سایر روش های فرآوری قرار می گیرد. به خصوص، شیشه ای شدندرمان سطح فلز با لیزر مقاومت به خوردگی را 12 برابر افزایش می دهد، اما وقتی M بالای 200 درجه سانتیگراد گرم شود، این اثر از بین می رود. یک راه مطمئن تر، اما گران قیمت برای مبارزه با اکسیداسیون آهن در هوا، تولید فولاد ضد زنگ (18٪ کروم و 9٪ نیکل) است.
با این حال، خوردگی یک فرآیند کند و کاملاً است سریع d-فلزات فقط با نافلزات واکنش نشان می دهند هنگام گرم شدن، حتی فعال ترین زیر گروه های M اسکاندیم (اکسید کننده تا (3)). (با این حال، از Sc تا La، فعالیت متقابل افزایش می یابد (؟)، و برای مثال، لانتانیم در کلر مشتعل می شود. در ob.u.)
در مورد فلزات کمتر واکنش پذیر (؟) زیر گروه تیتانیوم، لازم است بیشترگرمایش (بالای 150 0 C). در این حالت، Hf به Hf + 4 تبدیل میشود و Ti و Zr میتوانند محصولات را در آن تشکیل دهند پست تر st.ok.: Ti 2 O 3، ZrCl 2 و غیره. با این حال، آنها عوامل کاهنده قوی هستند، به خصوص در مورد Zr (؟) - آنها در هوا اکسید می شوند یا تغییر شکل می دهند:
ZrCl 2 → Zr+ ZrCl 4 .
با فلزات حتی کمتر فعال زیرگروه وانادیوم، واکنش ها در t> 400 0 C، و با تشکیل محصولات تنها در بالاترین درجه رخ می دهد. (+5).
هنگام انتقال به زیر گروه کروم، واکنش پذیری M در حال رشد(به دلیل فراریت بیشتر اکسیدها)، اما از کروم به W (؟) کاهش می یابد. بنابراین، کروم با تمام Г2، مولیبدن با I2 و تنگستن با Br2 واکنش نمی دهد. علاوه بر این، اکسیداسیون کروم به (+3) و آنالوگ های آن - تا (+6) می رسد. (توجه داشته باشید که WF ششمین گاز سنگین در سطح صفر است)
الگوهای مشابهی در زیرگروه های دیگر d-metals مشاهده می شود. بنابراین، تکنسیوم و رنیوم با ید و با سایر هالوژن ها تعامل ندارند - فقط در دمای 400 0 درجه سانتیگراد، EG 7 را تشکیل می دهند. در همان زمان، منگنز با حرارت کمی اکسید می شود
حتی خاکستری و تا st.ok. (+2).
مس با مرطوبکلر در r.p.c، نقره - با حرارت ملایم، و طلا - فقط در T> 200 0 C. هنگامی که گرم می شود، اکسیژن فقط روی مس (محصول CuO، در دماهای بالاتر - Cu 2 O (?)) و نقره اکسید شده (برخلاف مشابه) عمل می کند. طلا) توسط ازن (به AgO).
روی همچنین در CO 2 و جیوه در شرایط محیطی می سوزد. حتی با یک فیلم اکسید پوشیده نشده است. هنگامی که تا 300 درجه سانتیگراد گرم می شود، مخلوطی از اکسیدهای HgO و Hg 2 O تشکیل می دهد که در t> 400 0 C O از O جدا می شود و به جیوه تبدیل می شود، در حالی که دمای تجزیه اکسید کادمیوم 1813 0 C و ZnO 1950 است. 0 C.
از نظر شیمیایی پایدارترین فلزات پلاتین و طلا هستند، اما با گرمایش کافی تقریباً با تمام غیرفلزها (G 2, O 2, S, P, As) واکنش می دهند اگرچه با فعالیت و فعالیت متفاوت گزینش پذیری; یعنی: در دوره های از چپ به راست، مقاومت در برابر O 2 و F 2 افزایش می یابد و نسبت به Cl 2 و S کاهش می یابد (مطابق با ساختار الکترونیکی اتم های عناصر (؟)).
بنابراین، اگر فلوئور با پلاتین فقط در دمای T> 400 0 C واکنش دهد، کلر در 250 0 C (محصول PtCl 2) واکنش می دهد. یا اگر برهمکنش با اکسیژن را در نظر بگیریم: اسمیم به شکل سیاه در هوا در r.b اکسید می شود. (تا OsO 4)، روتنیوم - با حرارت کمی، و بقیه - در دمای حرارت قرمز. محصولات: IrO 2، PdO، PtO 2، Rh 2 O 3.
(با حرارت دادن قوی تر، این اکسیدها تجزیه می شوند و اگر واکنش:
PtO 2 → Pt + O 2
در 500 0 C رخ می دهد، سپس تجزیه می شود:
RuO 2 → Ru+ O 2
فقط زمانی رخ می دهد که t> 1300 0 C).
افزایش مشابهی در مقاومت فلز در برابر اکسیژن هنگام حرکت از آهن به نیکل مشاهده می شود (جدول 14 را ببینید).
جدول 14.ویژگی های برهمکنش فلزات خانواده آهن با اکسیژن
تشکیل محلول های جامد.یکی از ویژگی های d-metals تمایل آنها به دلیل تنوع گسترده st.ok است. و حالت های ظرفیت برای تشکیل ترکیبات غیر استوکیومتریترکیب: ترکیبات بین فلزی (AlNi و غیره) یا فلزات (Fe S 3، VN، LaB، ZrC 6، و غیره). و محلول های جامدبه ویژه راه حل ها پیاده سازیگازها بنابراین، فلزات زیر گروه اسکاندیم و تیتانیوم هیدروژن را در r.p.a جذب می کنند. به ترکیب: EH 2 و EH (3 هنگام گرم شدن، حلالیت H 2 کاهش می یابد).
نیکل و پالادیوم تمایل خاصی به هیدروژن دارند (1 V Pd 1000 V H 2 را حل می کند) که بنابراین کاتالیزورهای واکنش هستند. هیدروژناسیون. و به عنوان مثال، پلاتین عمدتاً O2 را جذب می کند (تا 700 ولت) و بنابراین به عنوان یک کاتالیزور برای فرآیندهای حاوی اکسیژن استفاده می شود: اکسیداسیون NH 3 به NO، SO 2 به SO، 3 برای گازهای خروجی اگزوز خودرو پس از سوزاندن (به ویژه در این مورد، NO به N 2 و CO به CO 2 تبدیل می شود) و غیره.
مکانیسم عمل کاتالیزوری این فلزات به این صورت است که، همانطور که فرض می شود، گازها در M حل می شوند. اتمیزه شده. بنابراین، هیدروژن آزاد شده هنگامی که محلول آن در یک فلز گرم می شود، یک عامل احیا کننده قوی تر از مولکولی است.
علاوه بر این، به عنوان مثال، پالادیوم، زمانی که H 2 را تا حد معینی جذب می کند، خواص فلزی خود را حفظ می کند، اما پارامغناطیس را از دست می دهد. این بدان معنی است که حداقل برخی از اتم های هیدروژن الکترون های ظرفیت خود را به نوار رسانایی فلز می دهند.
همچنین شواهدی از تشکیل جزئی یون های هیدرید وجود دارد، به عنوان مثال، زمانی که هیدروژن در آهن حل می شود. دریافت شده و غیره هیدریدهای غیر متعارف که در آن مولکول های H2 به عنوان یک کل روی اتم d-فلز هماهنگ شده اند. (آنها به عنوان مدلی برای مطالعه واسطه هایی هستند که در طول کاتالیز به وجود می آیند.)
امروزه حدود 2.5 میلیون ترکیب مختلف وجود دارد که هم به طور طبیعی و هم به طور مصنوعی توسط انسان سنتز می شوند. همه آنها بسیار متفاوت هستند، برخی از آنها شرکت کنندگان غیرقابل جایگزینی در فرآیندهای بیولوژیکی هستند که در موجودات زنده اتفاق می افتد. ترکیبات با خواص مواد از یکدیگر متمایز می شوند. ما بیشتر ویژگی ها را در نظر خواهیم گرفت و چه چیز دیگری به ما امکان می دهد یک مولکول شیمیایی خاص را شناسایی کنیم.
ماده چیست؟
اگر این مفهوم را تعریف کنیم، باید به ارتباط آن با اجسام فیزیکی اشاره کنیم. به هر حال، ماده دقیقاً همان چیزی است که این اجسام از آن ساخته شده اند. پس شیشه، آهن، گوگرد، چوب مواد هستند. می توان بی نهایت مثال زد. درک موارد زیر آسانتر است: اصطلاح مورد بحث به کل تنوع ترکیبات مختلف مولکولهای موجود در جهان و همچنین ذرات تک اتمی ساده اشاره دارد.
بنابراین، آب، الکل، اسیدها، قلیاها، پروتئین ها، کربوهیدرات ها، نمک، شکر، ماسه، خاک رس، الماس، گازها، و غیره - اینها همه مواد هستند. مثالها به ما اجازه میدهند تا ماهیت این مفهوم را با وضوح بیشتری درک کنیم.
کالبد فیزیکی محصولی است که توسط طبیعت یا انسان بر اساس ترکیبات مختلف ایجاد می شود. به عنوان مثال، لیوان بدنه ای است که از شیشه ساخته شده است و ورق کاغذ بدنه ای است که از سلولز یا چوب فراوری شده است.
البته همه مولکول ها متفاوت هستند. آنچه زمینه ساز تفاوت آنهاست، خواص فیزیکی، ارگانولپتیکی و شیمیایی آنها نامیده می شود. آنها با استفاده از روش های خاصی تعیین می شوند که هر علمی مختص به خود را دارد. اینها می توانند روش های ریاضی، تحلیلی، تجربی، ابزاری و بسیاری روش های متنوع دیگر باشند. مثلاً علم شیمی برای هر ماده یا بهتر بگوییم برای شناسایی آن از معرف مخصوص به خود استفاده می کند. بر اساس ویژگی های ساختاری مولکول و پیش بینی خواص شیمیایی انتخاب می شود. سپس به صورت تجربی مورد آزمایش قرار گرفته، تایید و به صورت نظری تجمیع می شود.

طبقه بندی مواد
تقسیم ترکیبات به گروه ها را می توان بر اساس بسیاری از ویژگی های مختلف انجام داد. مثلا حالت تجمع. همه آنها با توجه به این عامل می توانند چهار نوع باشند:
- پلاسما؛
- مایع؛
- ماده کریستالی (جامد).
اگر یک ویژگی "عمیق تر" را به عنوان پایه در نظر بگیریم، تمام مواد را می توان به موارد زیر تقسیم کرد:
- آلی - بر اساس زنجیره ها و چرخه های اتم های کربن و هیدروژن؛
- غیر آلی - بقیه.
با توجه به ترکیب عنصری که توسط فرمول مواد منعکس می شود، همه آنها عبارتند از:
- ساده - از یک نوع اتم شیمیایی؛
- پیچیده - دو یا چند نوع مختلف از عناصر.
به نوبه خود، ساده ها به فلزات و غیر فلزات تقسیم می شوند. ترکیبات پیچیده دارای طبقات زیادی هستند: نمک ها، بازها، اسیدها، اکسیدها، استرها، هیدروکربن ها، الکل ها، اسیدهای نوکلئیک و غیره.
انواع مختلف فرمول های ترکیبی
بصری، یعنی گرافیکی، نمایش اتصالات چیست؟ البته اینها فرمول مواد هستند. آنها متفاوتند. بسته به نوع، اطلاعات مربوط به مولکول موجود در آنها نیز متفاوت است. بنابراین، گزینه های زیر وجود دارد:
- تجربی یا مولکولی. منعکس کننده ترکیب کمی و کیفی یک ماده است. این شامل نمادهای عناصر تشکیل دهنده و یک شاخص در گوشه سمت چپ پایین آن است که میزان یک اتم معین را در مولکول نشان می دهد. به عنوان مثال، H 2 O، Na 2 SO 4، AL 2 (SO 4) 3.
- گرافیک الکترونیک. این فرمول تعداد الکترون های ظرفیت را برای هر عنصری که بخشی از ترکیب است نشان می دهد. بنابراین، با استفاده از این گزینه می توان برخی از مواد شیمیایی و مواد را پیش بینی کرد.
- در شیمی آلی، مرسوم است که از کامل و مخفف استفاده می شود. آنها ترتیب پیوند اتم ها را در مولکول ها منعکس می کنند، علاوه بر این، آنها به وضوح نشان می دهند که یک ماده به یک کلاس خاص از ترکیبات تعلق دارد. و این به شما امکان می دهد نوع خاصی از مولکول را دقیقاً تعیین کنید و تمام برهمکنش های مشخصه آن را پیش بینی کنید.
بنابراین، نمادهای شیمیایی و فرمول های درست ترکیب شده از ترکیبات مهم ترین بخش کار با تمام مواد شناخته شده است. اینها چیزی است که هر دانشجوی شیمی باید بداند.

مشخصات فیزیکی
یک ویژگی بسیار مهم، خواص فیزیکی آشکار مواد است. دقیقا چه چیزی برای این گروه اعمال می شود؟
- وضعیت فیزیکی تحت شرایط مختلف، از جمله شرایط استاندارد.
- دمای جوش، ذوب، انجماد، تبخیر.
- ویژگی های ارگانولپتیک: رنگ، بو، طعم.
- حلالیت در آب و سایر حلالها (به عنوان مثال آلی).
- چگالی و سیالیت، ویسکوزیته.
- هدایت الکتریکی و حرارتی، ظرفیت گرمایی.
- نفوذپذیری الکتریکی
- رادیواکتیویته
- جذب و انتشار.
- اندوکتانس
همچنین تعدادی شاخص وجود دارد که برای فهرست کاملی که خواص مواد را منعکس می کند بسیار مهم هستند. با این حال، آنها بین فیزیکی و شیمیایی هستند. این:
- نوع شبکه کریستالی؛
- الکترونگاتیوی؛
- سختی و شکنندگی؛
- چکش خواری و شکل پذیری؛
- نوسانات یا نوسانات؛
- اثرات بیولوژیکی بر موجودات زنده (سمی، خفگی، فلج کننده عصبی، خنثی، مفید و غیره).
اغلب این شاخص ها دقیقاً زمانی ذکر می شوند که خواص شیمیایی مواد به طور مستقیم در نظر گرفته شوند. البته می توانید در قسمت فیزیکی نیز آنها را نشان دهید که خطا نخواهد بود.

خواص شیمیایی مواد
این گروه شامل تمام انواع احتمالی برهمکنش های مولکول مورد نظر با سایر مواد ساده و پیچیده است. یعنی اینها واکنش های شیمیایی مستقیم هستند. آنها برای هر نوع اتصال کاملاً خاص هستند. با این حال، ویژگی های گروه کلی برای یک کلاس کامل از مواد مشخص شده است.
به عنوان مثال، تمام اسیدها با توجه به موقعیت خود در سری ولتاژ الکتروشیمیایی فلزات، قادر به واکنش با فلزات هستند. همچنین، همه با واکنش های خنثی سازی با قلیاها و برهمکنش با بازهای نامحلول مشخص می شوند. با این حال، اسیدهای سولفوریک و نیتریک غلیظ خاص هستند، زیرا محصولات حاصل از برهمکنش آنها با فلزات با محصولاتی که در نتیجه واکنش با سایر نمایندگان کلاس به دست می آیند متفاوت است.
هر ماده دارای خواص شیمیایی زیادی است. مقدار آنها توسط فعالیت ترکیب، یعنی توانایی واکنش با سایر اجزا تعیین می شود. برخی از آنها بسیار واکنش پذیر هستند، برخی عملاً بی اثر هستند. این یک شاخص کاملاً فردی است.

مواد ساده
اینها شامل آنهایی است که از یک نوع اتم، اما از اعداد متفاوت تشکیل شده اند. به عنوان مثال، S 8، O 2، O 3، Au، N 2، P 4، CL 2، Ar و دیگران.
خواص شیمیایی مواد ساده به تعامل با:
- فلزات؛
- غیر فلزات؛
- اب؛
- اسیدها؛
- قلیاها و هیدروکسیدهای آمفوتریک؛
- ترکیبات آلی؛
- نمک ها؛
- اکسیدها
- پراکسیدها و انیدریدها و سایر مولکولها.
مجدداً باید اشاره کرد که این یک ویژگی بسیار خاص برای هر مورد خاص است. بنابراین، خواص فیزیکی و شیمیایی مواد ساده به صورت جداگانه در نظر گرفته می شود.
مواد پیچیده
این گروه شامل ترکیباتی است که مولکول های آنها توسط دو یا چند عنصر شیمیایی مختلف تشکیل شده است. مقدار هر کدام ممکن است متفاوت باشد. برای درک، در اینجا چند مثال ساده آورده شده است:
- H3PO4;
- K 3;
- مس (OH) 2;
- AL 2 O 3 و دیگران.
از آنجایی که همه آنها به کلاس های مختلفی از مواد تعلق دارند، شناسایی ویژگی های فیزیکی و شیمیایی مشترک برای همه غیرممکن است. اینها خواص خاص، منحصر به فرد و در هر مورد خاص هستند.

مواد معدنی
امروزه بیش از 500 هزار نفر از آنها وجود دارد. هم ساده و هم پیچیده وجود دارد. در مجموع، می توانیم چندین مورد اصلی را برجسته کنیم که نشان دهنده همه تنوع آنها است.
- مواد ساده فلزات
- اکسیدها
- مواد ساده غیر فلزی هستند.
- گازهای نجیب یا بی اثر.
- پراکسیدها
- انیدریدها
- ترکیبات هیدروژنی فرار
- هیدریدها
- نمک.
- اسیدها
- زمینه.
- ترکیبات آمفوتریک
هر نماینده ای از هر طبقه دارای مجموعه ای از خواص فیزیکوشیمیایی خاص خود است که به آن اجازه می دهد تا از سایر ترکیبات متمایز و شناسایی شود.
خواص مواد آلی
آلی شاخه ای از شیمی است که به مطالعه ترکیبات غیر از مواد معدنی و خواص آنها می پردازد. ساختار آنها بر اساس اتم های کربن است که می توانند با یکدیگر ترکیب شوند و ساختارهای مختلفی را تشکیل دهند:
- زنجیره های خطی و شاخه ای؛
- چرخه ها
- حلقه های معطر؛
- هتروسیکل ها
موجودات زنده دقیقاً از چنین ترکیباتی تشکیل شده اند، زیرا اساس زندگی پروتئین ها، چربی ها و کربوهیدرات ها است. همه آنها نماینده هستند؛ بنابراین خواص آنها خاص است. با این حال، در هر صورت، مهم نیست که در مورد چه نوع مولکولی صحبت می کنیم، باز هم با مجموعه خاصی از خواص فیزیکوشیمیایی مشخص می شود که قبلاً ذکر کردیم.

ماده زنده چیست؟
ماده ای که تمام زیست توده سیاره ما از آن تشکیل شده است، زنده نامیده می شود. یعنی آن موجوداتی که روی آن حیات می سازند:
- باکتری ها و ویروس ها؛
- تک یاخته;
- گیاهان؛
- حیوانات؛
- قارچ؛
- مردم.
از آنجایی که بخش اصلی ترکیبات موجود در یک موجود زنده آلی است، می توان آنها را به عنوان ماده زنده طبقه بندی کرد. با این حال، نه همه. فقط آنهایی که بدون آنها وجود نمایندگان بیوسفر زنده غیرممکن است. اینها پروتئین ها، اسیدهای نوکلئیک، هورمون ها، ویتامین ها، چربی ها، کربوهیدرات ها، اسیدهای آمینه و غیره هستند. اصطلاح "ماده زنده" توسط ورنادسکی، بنیانگذار دکترین زیست کره سیاره معرفی شد.
خواص ماده زنده:
- داشتن انرژی با توانایی تبدیل آن؛
- خود تنظیمی؛
- حرکت داوطلبانه؛
- تناوب نسل ها؛
- تنوع شدید
کریستال ها و مواد فلزی
به تمام ترکیباتی که نوع خاصی از ساختار شبکه فضایی دارند کریستالی می گویند. ترکیباتی با شبکه کریستالی اتمی، مولکولی یا فلزی وجود دارد. بسته به نوع، خواص نیز متفاوت است.ترکیبات جامد معمولی که شکل بلورهای ریز یا درشت دارند، نمک های مختلف هستند.
همچنین مواد ساده ای با ساختار مشابه وجود دارد، به عنوان مثال، الماس یا گرافیت، سنگ های قیمتی و نیمه قیمتی، مواد معدنی و سنگ ها. خواص اصلی آنها:
- سختی؛
- تردی؛
- متوسط دمای ذوب و جوش
با این حال، مثل همیشه، هر ویژگی ممکن است برای همه مناسب نباشد.
مواد فلزات و آلیاژهای آنها را آشکار می کنند. مجموعه ای از ویژگی های مشترک را می توان برای آنها شناسایی کرد:
- چکش خواری و شکل پذیری؛
- نقطه جوش و ذوب بالا؛
- هدایت الکتریکی و حرارتی؛
- درخشش فلزی
ذرات اولیه ماده فیزیکی در سیاره ما اتم هستند. آنها می توانند به صورت آزاد فقط در دماهای بسیار بالا وجود داشته باشند. در شرایط عادی، ذرات بنیادی تمایل دارند با استفاده از پیوندهای شیمیایی با یکدیگر متحد شوند: یونی، فلزی، قطبی کووالانسی یا غیرقطبی. به این ترتیب موادی تشکیل می شوند که در مقاله خود به نمونه هایی از آنها خواهیم پرداخت.
مواد ساده
فرآیندهای برهمکنش بین اتم های یک عنصر شیمیایی منجر به تشکیل مواد شیمیایی به نام مواد ساده می شود. بنابراین، زغال سنگ تنها توسط اتم های کربن، گاز هیدروژن توسط اتم های هیدروژن و جیوه مایع از ذرات جیوه تشکیل می شود. مفهوم یک ماده ساده نیازی به شناسایی با مفهوم یک عنصر شیمیایی ندارد. به عنوان مثال، دی اکسید کربن از مواد ساده کربن و اکسیژن تشکیل نمی شود، بلکه از عناصر کربن و اکسیژن تشکیل شده است. به طور معمول، ترکیبات متشکل از اتم های یک عنصر را می توان به فلزات و غیر فلزات تقسیم کرد. بیایید به چند نمونه از خواص شیمیایی چنین مواد ساده ای نگاه کنیم.
فلزات
بر اساس موقعیت عنصر فلزی در جدول تناوبی، گروه های زیر را می توان تشخیص داد: فلزات فعال، عناصر زیر گروه های اصلی گروه های سوم - هشتم، فلزات زیر گروه های فرعی گروه های چهارم - هفتم، و همچنین لانتانیدها و اکتینیدها. فلزات - مواد ساده ای که نمونه هایی از آنها را در زیر خواهیم آورد، دارای خواص کلی زیر هستند: هدایت حرارتی و الکتریکی، درخشندگی فلزی، شکل پذیری و چکش خواری. چنین ویژگی هایی در آهن، آلومینیوم، مس و دیگران ذاتی هستند. با افزایش شماره سریال در دوره ها، دمای جوش و ذوب و همچنین سختی عناصر فلزی افزایش می یابد. این با فشرده سازی اتم های آنها، یعنی کاهش شعاع و همچنین تجمع الکترون ها توضیح داده می شود. تمام پارامترهای فلزات توسط ساختار داخلی شبکه کریستالی این ترکیبات تعیین می شود. در زیر واکنش های شیمیایی را در نظر خواهیم گرفت و همچنین نمونه هایی از خواص مواد مرتبط با فلزات را بیان می کنیم.
ویژگی های واکنش های شیمیایی
تمام فلزات با حالت اکسیداسیون 0 فقط خواص کاهشی از خود نشان می دهند. عناصر قلیایی و قلیایی خاکی با آب واکنش می دهند و پایه های شیمیایی تهاجمی ایجاد می کنند - قلیایی:
- 2Na+2H20=2NaOH+H2
یک واکنش معمولی فلزات اکسیداسیون است. در نتیجه ترکیب با اتم های اکسیژن، موادی از کلاس اکسید بوجود می آیند:
- Zn+O 2 = ZnO
اینها ترکیبات دوتایی مربوط به مواد پیچیده هستند. نمونه هایی از اکسیدهای بازی اکسیدهای سدیم Na 2 O، مس CuO و کلسیم CaO هستند. آنها قادر به تعامل با اسیدها هستند، در نتیجه نمک و آب در محصولات یافت می شود:
- MgO+2HCl=MgCl2+H2O

موادی از طبقات اسیدها، بازها و نمک ها متعلق به ترکیبات پیچیده هستند و خواص شیمیایی متنوعی از خود نشان می دهند. به عنوان مثال، یک واکنش خنثی سازی بین هیدروکسیدها و اسیدها رخ می دهد که منجر به ظاهر شدن نمک و آب می شود. ترکیب نمک ها به غلظت معرف ها بستگی دارد: به عنوان مثال، هنگامی که اسید اضافی در مخلوط واکنش وجود دارد، نمک های اسیدی به دست می آیند، به عنوان مثال، NaHCO 3 - بی کربنات سدیم، و غلظت بالای عوامل قلیایی. تشکیل نمک های اساسی مانند Al(OH) 2 Cl - دی هیدروکسی کلرید آلومینیوم.
غیر فلزات
مهمترین عناصر غیرفلزی در زیرگروه های نیتروژن و کربن یافت می شوند و همچنین به گروه هالوژن و کالکوژن جدول تناوبی تعلق دارند. اجازه دهید نمونه هایی از مواد مربوط به غیر فلزات را بیاوریم: گوگرد، اکسیژن، نیتروژن، کلر. تمام خواص فیزیکی آنها برخلاف خواص فلزات است. آنها رسانای الکتریسیته نیستند، پرتوهای گرما را به خوبی منتقل نمی کنند و سختی کمی دارند. هنگام تعامل با اکسیژن، غیر فلزات ترکیبات پیچیده ای را تشکیل می دهند - اکسیدهای اسیدی. دومی، در واکنش با اسیدها، اسیدها را می دهد:
- H 2 O + CO 2 → H 2 CO 3
یک مشخصه واکنش معمولی اکسیدهای اسیدی برهمکنش با مواد قلیایی است که منجر به ظهور نمک و آب می شود.
فعالیت شیمیایی غیر فلزات در طول دوره افزایش می یابد، این به دلیل افزایش توانایی اتم های آنها برای جذب الکترون از سایر عناصر شیمیایی است. در گروهها پدیده معکوس را مشاهده میکنیم: خواص غیرفلزی به دلیل تورم حجم اتم به دلیل افزودن سطوح انرژی جدید ضعیف میشود.

بنابراین، ما به انواع مواد شیمیایی، مثالهایی که خواص آنها را نشان میدهند و موقعیت آنها در جدول تناوبی را بررسی کردیم.
بازها (هیدروکسیدها)- مواد پیچیده ای که مولکول های آنها حاوی یک یا چند گروه هیدروکسی OH است. اغلب، بازها از یک اتم فلز و یک گروه OH تشکیل شده اند. به عنوان مثال، NaOH هیدروکسید سدیم است، Ca(OH) 2 هیدروکسید کلسیم و غیره است.
یک پایه - هیدروکسید آمونیوم وجود دارد که در آن گروه هیدروکسی نه به فلز، بلکه به یون NH 4 + (کاتیون آمونیوم) متصل است. هنگامی که آمونیاک در آب حل می شود، هیدروکسید آمونیوم تشکیل می شود (واکنش اضافه کردن آب به آمونیاک):
NH 3 + H 2 O = NH 4 OH (هیدروکسید آمونیوم).
ظرفیت گروه هیدروکسی 1 است. تعداد گروه های هیدروکسیل در مولکول پایه به ظرفیت فلز بستگی دارد و با آن برابر است. به عنوان مثال، NaOH، LiOH، Al (OH) 3، Ca(OH) 2، Fe(OH) 3، و غیره.
همه دلایل -جامداتی که رنگ های متفاوتی دارند. برخی از بازها در آب بسیار محلول هستند (NaOH، KOH و غیره). با این حال، اکثر آنها در آب محلول نیستند.
به بازهای محلول در آب قلیایی می گویند.محلول های قلیایی "صابونی"، لغزنده در لمس و کاملا سوزاننده هستند. قلیاها عبارتند از هیدروکسیدهای فلزات قلیایی و قلیایی خاکی (KOH، LiOH، RbOH، NaOH، CsOH، Ca(OH) 2، Sr(OH) 2، Ba(OH) 2 و غیره). بقیه غیر قابل حل هستند.
پایه های نامحلول- اینها هیدروکسیدهای آمفوتریک هستند که در تعامل با اسیدها به عنوان باز عمل می کنند و مانند اسیدها با قلیایی رفتار می کنند.
پایه های مختلف توانایی های متفاوتی برای حذف گروه های هیدروکسی دارند، بنابراین به بازهای قوی و ضعیف تقسیم می شوند.
بازهای قوی در محلول های آبی به راحتی گروه های هیدروکسی خود را ترک می کنند، اما بازهای ضعیف این کار را نمی کنند.
 خواص شیمیایی پایه ها
خواص شیمیایی پایه ها
خواص شیمیایی بازها با ارتباط آنها با اسیدها، انیدریدهای اسید و نمک مشخص می شود.
1. بر اساس شاخص ها عمل کنید. اندیکاتورها بسته به برهمکنش با مواد شیمیایی مختلف رنگ تغییر می کنند. در محلول های خنثی یک رنگ و در محلول های اسیدی رنگ دیگری دارند. هنگام تعامل با بازها، رنگ آنها تغییر می کند: نشانگر متیل نارنجی زرد می شود، نشانگر تورنسل آبی می شود و فنل فتالئین تبدیل به فوشیا می شود.
2. تعامل با اکسیدهای اسیدی باتشکیل نمک و آب:
2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O.
3. با اسیدها واکنش نشان دهید،تشکیل نمک و آب واکنش یک باز با اسید را واکنش خنثی سازی می نامند، زیرا پس از اتمام آن، محیط خنثی می شود:
2KOH + H 2 SO 4 → K 2 SO 4 + 2H 2 O.
4. با نمک ها واکنش نشان می دهدتشکیل یک نمک و پایه جدید:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4.
5. وقتی گرم می شوند، می توانند به آب و اکسید اصلی تجزیه شوند:
Cu(OH) 2 = CuO + H 2 O.
هنوز سوالی دارید؟ آیا می خواهید در مورد پایه ها بیشتر بدانید؟
برای کمک گرفتن از استاد راهنما، ثبت نام کنید.
درس اول رایگان است
وب سایت، هنگام کپی کردن مطالب به طور کامل یا جزئی، پیوند به منبع مورد نیاز است.
برای آخرین 200 سال بشریتخواص مواد را بهتر از کل تاریخ توسعه شیمی مطالعه کرد. طبیعتاً تعداد مواد نیز به سرعت در حال رشد است؛ این امر قبل از هر چیز به دلیل توسعه روش های مختلف برای به دست آوردن مواد است.
در زندگی روزمره با مواد زیادی مواجه می شویم. از جمله آنها می توان به آب، آهن، آلومینیوم، پلاستیک، سودا، نمک و بسیاری دیگر اشاره کرد. موادی که در طبیعت وجود دارند، مانند اکسیژن و نیتروژن موجود در هوا، مواد محلول در آب و منشاء طبیعی، مواد طبیعی نامیده می شوند. آلومینیوم، روی، استون، آهک، صابون، آسپرین، پلی اتیلن و بسیاری از مواد دیگر در طبیعت وجود ندارند.
آنها در آزمایشگاه به دست می آیند و توسط صنعت تولید می شوند. مواد مصنوعی در طبیعت یافت نمی شوند، بلکه از مواد طبیعی ایجاد می شوند. برخی از موادی که در طبیعت وجود دارند را می توان در آزمایشگاه شیمیایی نیز به دست آورد.
بنابراین، هنگامی که پرمنگنات پتاسیم گرم می شود، اکسیژن آزاد می شود و هنگامی که گچ گرم می شود، اکسیژن آزاد می شود. دی اکسید کربن.دانشمندان یاد گرفته اند که گرافیت را به الماس تبدیل کنند؛ آنها در حال رشد کریستال هایی از یاقوت، یاقوت کبود و مالاکیت هستند. بنابراین، در کنار مواد با منشاء طبیعی، تعداد زیادی از مواد مصنوعی ایجاد شده است که در طبیعت یافت نمی شوند.
موادی که در طبیعت یافت نمی شوند در شرکت های مختلف تولید می شوند: کارخانه ها، کارخانه ها، کمباین ها و غیره
در زمینه کاهش منابع طبیعی سیاره ما، شیمیدانان اکنون با یک وظیفه مهم روبرو هستند: توسعه و اجرای روش هایی که به وسیله آنها می توان به طور مصنوعی، در یک تولید آزمایشگاهی یا صنعتی، موادی را به دست آورد که مشابه مواد طبیعی هستند. به عنوان مثال، ذخایر سوخت های فسیلی در طبیعت رو به اتمام است.
ممکن است زمانی برسد که نفت و گاز طبیعی تمام شود. در حال حاضر، انواع جدیدی از سوخت در حال توسعه هستند که به همان اندازه کارآمد هستند، اما محیط زیست را آلوده نمی کنند. امروزه بشریت آموخته است که به طور مصنوعی انواع سنگ های قیمتی مانند الماس، زمرد و بریل را بدست آورد.
حالت ماده
مواد می توانند در چندین حالت تجمع وجود داشته باشند که سه مورد از آنها برای شما شناخته شده است: جامد، مایع، گاز. به عنوان مثال، آب در طبیعت در هر سه حالت تجمع وجود دارد: جامد (به شکل یخ و برف)، مایع (آب مایع) و گاز (بخار آب).مواد شناخته شده ای وجود دارد که در شرایط عادی در هر سه حالت تجمع نمی توانند وجود داشته باشند. به عنوان مثال، چنین ماده ای دی اکسید کربن است. در دمای اتاق یک گاز بی بو و بی رنگ است. در دمای -79 درجه سانتیگراداین ماده "یخ می زند" و به حالت جامد تجمع تبدیل می شود. نام روزمره (بی اهمیت) چنین ماده ای "یخ خشک" است. این نام به این ماده داده شده است زیرا "یخ خشک" بدون ذوب شدن به دی اکسید کربن تبدیل می شود ، یعنی بدون انتقال به حالت مایع تجمع ، که مثلاً در آب وجود دارد.
بنابراین، می توان یک نتیجه مهم گرفت.یک ماده، هنگام انتقال از یک حالت تجمع به حالت دیگر، به مواد دیگر تبدیل نمی شود. فرآیند یک تغییر معین، دگرگونی، پدیده نامیده می شود.
پدیده های فیزیکی خواص فیزیکی مواد.
به پدیده هایی که در آنها مواد حالت تجمع خود را تغییر می دهند، اما به مواد دیگر تبدیل نمی شوند، فیزیکی می گویند. هر ماده فردی دارای خواص خاصی است. خواص مواد ممکن است متفاوت یا مشابه یکدیگر باشد. هر ماده با استفاده از مجموعه ای از خواص فیزیکی و شیمیایی توصیف می شود. بیایید آب را به عنوان مثال در نظر بگیریم. آب در دمای 0 درجه سانتی گراد یخ می زند و به یخ تبدیل می شود و در دمای 100+ درجه سانتی گراد می جوشد و به بخار تبدیل می شود. این پدیده ها فیزیکی در نظر گرفته می شوند، زیرا آب به مواد دیگر تبدیل نشده است، تنها تغییر در حالت تجمع رخ می دهد. این نقاط انجماد و جوش خواص فیزیکی مخصوص آب هستند.
خواص موادی که با اندازه گیری ها یا به صورت بصری در صورت عدم تبدیل برخی از مواد به مواد دیگر مشخص می شوند، فیزیکی نامیده می شوند.
تبخیر الکل، مانند تبخیر آب- پدیده های فیزیکی، مواد در این حالت حالت تجمع خود را تغییر می دهند. پس از آزمایش، می توانید مطمئن باشید که الکل سریعتر از آب تبخیر می شود - اینها خواص فیزیکی این مواد هستند.
خواص فیزیکی اصلی مواد شامل موارد زیر است: حالت تجمع، رنگ، بو، حلالیت در آب، چگالی، نقطه جوش، نقطه ذوب، هدایت حرارتی، هدایت الکتریکی. خواص فیزیکی مانند رنگ، بو، طعم، شکل کریستال را می توان با استفاده از حواس به صورت بصری تعیین کرد و چگالی، هدایت الکتریکی، نقطه ذوب و جوش را با اندازه گیری تعیین می کند. اطلاعات در مورد خواص فیزیکی بسیاری از مواد در ادبیات تخصصی، به عنوان مثال، در کتاب های مرجع جمع آوری شده است. خواص فیزیکی یک ماده به حالت تجمع آن بستگی دارد. به عنوان مثال، چگالی یخ، آب و بخار آب متفاوت است.
اکسیژن گازی بی رنگ است، اما اکسیژن مایع آبی است.آگاهی از خواص فیزیکی به "شناخت" بسیاری از مواد کمک می کند. مثلا، فلز مس- تنها فلزی که به رنگ قرمز است. فقط نمک خوراکی طعم شور دارد. ید- یک جامد تقریباً سیاه رنگ که با حرارت دادن به بخار بنفش تبدیل می شود. در بیشتر موارد، برای شناسایی یک ماده، باید چندین ویژگی آن را در نظر بگیرید. به عنوان مثال، اجازه دهید خواص فیزیکی آب را مشخص کنیم:
- رنگ – بی رنگ (در حجم کم)
- بو - بدون بو
- حالت تجمع - مایع در شرایط عادی
- چگالی - 1 گرم در میلی لیتر،
- نقطه جوش - +100 درجه سانتیگراد
- نقطه ذوب - 0 درجه سانتیگراد
- هدایت حرارتی - کم
- هدایت الکتریکی - آب خالص جریان الکتریکی را هدایت نمی کند
مواد کریستالی و بی شکل
هنگام توصیف خواص فیزیکی جامدات، معمولاً ساختار ماده توصیف می شود. اگر نمونه ای از نمک خوراکی را زیر ذره بین بررسی کنید، متوجه خواهید شد که نمک از کریستال های بسیار ریز تشکیل شده است. در رسوبات نمک نیز می توانید کریستال های بسیار بزرگی پیدا کنید. بلورها جامداتی به شکل چندوجهی منظم هستند.کریستال ها می توانند اشکال و اندازه های مختلفی داشته باشند. بلورهای برخی از مواد مانند نمک خوراکی نمک – شکننده و آسان برای شکستن. کریستال هایی وجود دارند که بسیار سخت هستند. به عنوان مثال، الماس یکی از سخت ترین مواد معدنی محسوب می شود. اگر بلورهای نمک خوراکی را زیر میکروسکوپ بررسی کنید، متوجه خواهید شد که همه آنها ساختار مشابهی دارند. به عنوان مثال، اگر ذرات شیشه را در نظر بگیریم، همه آنها ساختار متفاوتی خواهند داشت - به چنین موادی آمورف می گویند. مواد آمورف شامل شیشه، نشاسته، کهربا و موم زنبور عسل است. مواد آمورف موادی هستند که ساختار کریستالی ندارند
پدیده های شیمیایی واکنش شیمیایی.
اگر در طول پدیده های فیزیکی مواد، به عنوان یک قاعده، فقط حالت تجمع خود را تغییر دهند، در طی پدیده های شیمیایی تبدیل برخی از مواد به مواد دیگر رخ می دهد. در اینجا چند مثال ساده آورده شده است:سوزاندن کبریت با زغال شدن چوب و آزاد شدن مواد گازی همراه است، یعنی تبدیل غیرقابل برگشت چوب به مواد دیگر رخ می دهد. مثالی دیگر:با گذشت زمان، مجسمه های برنزی با یک پوشش سبز پوشیده می شوند. واقعیت این است که برنز حاوی مس است. این فلز به آرامی با اکسیژن، دی اکسید کربن و رطوبت هوا تعامل می کند و در نتیجه مواد سبز رنگ جدیدی بر روی سطح مجسمه ایجاد می شود. پدیده های شیمیایی - پدیده های تبدیل یک ماده به ماده دیگرفرآیند برهمکنش مواد با تشکیل مواد جدید واکنش شیمیایی نامیده می شود. واکنش های شیمیایی در اطراف ما اتفاق می افتد. واکنش های شیمیایی نیز در درون ما رخ می دهد. در بدن ما، دگرگونی های بسیاری از مواد به طور پیوسته رخ می دهد؛ مواد با یکدیگر واکنش می دهند و محصولات واکنش را تشکیل می دهند. بنابراین، در یک واکنش شیمیایی همیشه مواد واکنش دهنده و موادی در نتیجه واکنش تشکیل می شوند.
- واکنش شیمیایی- فرآیند برهمکنش مواد که در نتیجه آن مواد جدید با خواص جدید تشکیل می شود
- معرف ها- موادی که وارد یک واکنش شیمیایی می شوند
- محصولات- موادی که در نتیجه یک واکنش شیمیایی ایجاد می شوند
یک واکنش شیمیایی به صورت کلی با یک نمودار واکنش نشان داده می شود معرفها -> محصولات
- معرف ها- مواد اولیه گرفته شده برای انجام واکنش؛
- محصولات- مواد جدیدی که در نتیجه یک واکنش تشکیل می شوند.
هر پدیده شیمیایی (واکنش) با علائم خاصی همراه است که به کمک آنها می توان پدیده های شیمیایی را از فیزیکی تشخیص داد. چنین علائمی شامل تغییر رنگ مواد، انتشار گاز، تشکیل رسوب، انتشار گرما و انتشار نور است.
بسیاری از واکنش های شیمیایی با آزاد شدن انرژی به صورت گرما و نور همراه است. به عنوان یک قاعده، چنین پدیده هایی با واکنش های احتراق همراه هستند. در واکنش های احتراق در هوا، مواد با اکسیژن موجود در هوا واکنش می دهند. برای مثال، فلز منیزیم شعله ور می شود و در هوا با شعله ای درخشان و کورکننده می سوزد. به همین دلیل است که از فلاش منیزیم برای ایجاد عکس در نیمه اول قرن بیستم استفاده شد. در برخی موارد ممکن است انرژی به صورت نور آزاد شود، اما بدون انتشار گرما.یکی از انواع پلانکتون های اقیانوس آرام قادر به ساطع نور آبی روشن است که به وضوح در تاریکی قابل مشاهده است. آزاد شدن انرژی به صورت نور نتیجه یک واکنش شیمیایی است که در موجودات این نوع پلانکتون ها رخ می دهد.
خلاصه مقاله:
- دو گروه بزرگ از مواد وجود دارد: مواد با منشاء طبیعی و مصنوعی.
- در شرایط عادی، مواد می توانند در سه حالت تجمع وجود داشته باشند
- خواص موادی که با اندازه گیری ها یا به صورت بصری در صورت عدم تبدیل برخی از مواد به مواد دیگر مشخص می شوند، فیزیکی نامیده می شوند.
- بلورها جامداتی به شکل چندوجهی منظم هستند.
- مواد آمورف موادی هستند که ساختار کریستالی ندارند
- پدیده های شیمیایی - پدیده های تبدیل یک ماده به ماده دیگر
- معرف ها موادی هستند که وارد یک واکنش شیمیایی می شوند.
- محصولات موادی هستند که در نتیجه یک واکنش شیمیایی تشکیل می شوند
- واکنش های شیمیایی می تواند با انتشار گاز، رسوب، گرما، نور همراه باشد. تغییر رنگ مواد
- احتراق یک فرآیند پیچیده فیزیکوشیمیایی برای تبدیل مواد اولیه به محصولات احتراق در طی یک واکنش شیمیایی است که با انتشار شدید گرما و نور (شعله) همراه است.