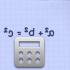원자핵: 구조, 질량, 구성. 원자핵의 구조 물리학에서 원자핵이란?
1920년대에 물리학자들은 1911년 Rutherford가 발견한 원자핵 구조의 복잡성에 대해 더 이상 의심하지 않았습니다. 에 주어진 사실다음과 같이 그 당시에 완료된 수많은 다양한 실험을 나타냈습니다.
- 방사능 현상의 발견,
- 원자의 핵 모델에 대한 실험적 증명,
- 전자, α-입자 및 수소 원자의 핵인 H-입자에 대한 비 e m의 측정,
- 인공 방사능과 핵반응의 발견,
- 원자핵 및 기타 많은 전하의 측정.
원자핵을 구성하는 입자는? 우리 시대에는 다양한 원소의 원자핵이 두 종류의 입자, 즉 중성자와 양성자로 구성되어 있는 것이 사실입니다. 두 번째 입자는 전자를 잃은 수소 원자입니다. 이러한 입자는 1907년 J. Thomson의 실험에서 이미 발견되었습니다. 과학자는 그녀의 전자 비율을 측정할 수 있었습니다.
정의 1
E. Rutherford는 1919년에 상당한 수의 원소로 이루어진 원자핵의 분열 생성물에서 수소 원자핵을 발견했습니다. 발견된 입자에 이름을 붙인 물리학자 양성자. 그는 원자핵의 구성이 양성자를 포함한다고 제안했습니다.
Rutherford의 실험 계획은 그림 6에 나와 있습니다. 5 . 하나 .
그림 6. 5 . 하나 . 핵분열 생성물에서 양성자 검출에 대한 Rutherford의 실험 계획. K는 α-입자의 방사성 소스가 있는 납 용기, F는 금속 호일, E는 황화아연으로 코팅된 스크린, M은 현미경입니다.
Rutherford의 장치는 용기가 있는 진공 챔버로 구성되었습니다. 에게출처가 어디였더라 α - 입자. 다음과 같이 표시된 금속 호일 에프, 카메라 창을 겹쳤습니다. 호일의 두께는 관통을 방지하는 방식으로 선택되었습니다. α - 입자. 창 밖에는 이미지 6에서 황화아연으로 코팅된 스크린이 있었습니다. 5 . 1은 문자 E로 표시되어 있습니다. 현미경을 사용하여 중, 무거운 하전 입자가 부딪히는 화면의 지점에서 빛의 섬광 또는 소위 말하는 섬광을 관찰하는 것이 가능했습니다.
챔버를 저압에서 질소로 채우는 과정에서 화면에서 섬광이 감지되었습니다. 이 현상실험 조건에서 거의 완전히 흐름을 차단하는 관통 능력을 가진 알려지지 않은 입자의 흐름이 있다는 사실을 지적했습니다. α -파티클 포일 에프. 시간이 지남에 따라 카메라 창에서 화면을 제거한 E. Rutherford는 공기 중에서 관찰된 입자의 평균 자유 경로를 측정할 수 있었습니다. 얻은 값은 J. Thomson이 이전에 관찰한 H-입자의 경로 길이 추정치와 일치하는 대략 28cm로 밝혀졌습니다.
질소 핵에서 녹아웃 된 입자에 대한 전기장 및 자기장의 영향에 대한 연구의 도움으로 기본 전하의 양에 대한 데이터를 얻었습니다. 또한 그러한 입자의 질량은 수소 원자 핵의 질량과 동일하다는 것이 증명되었습니다.
그 후, 여러 다른 기체 물질로 실험을 수행했습니다. 수행된 모든 실험에서 그들의 핵에서 α -입자는 H-입자 또는 양성자를 녹아웃시킵니다.
현대 측정에 따르면 양성자의 양전하는 기본 전하 e = 1.60217733 10 - 19 K l과 절대적으로 동일합니다. 즉, 모듈로 전자의 음전하와 같습니다. 우리 시대에는 양성자와 전자의 전하 평등이 10-22의 정확도로 확인되었습니다. 이와 같이 크게 다른 두 입자의 전하가 일치한다는 사실은 진심으로 당혹감을 불러일으키며 오늘날까지 현대 물리학의 근본적인 신비 중 하나로 남아 있습니다.
정의 2
현대 측정에 따르면 양성자의 질량은 m p = 1, 67262 10 - 27 kg과 같다고 말할 수 있습니다. 핵 물리학의 조건에서 입자에 속하는 질량은 종종 원자 질량 단위(a.m.u.)로 표시되며, 질량 번호가 12인 탄소 원자의 질량과 같습니다.
1 가. e.m. = 1.66057 10 - 27kg
따라서 mp \u003d 1, 007276 a. 먹다.
종종 입자의 질량에 대한 표현은 다음 공식에 따라 등가 에너지 값을 사용할 때 가장 편리합니다. E = m c 2 . 1 e V \u003d 1.60218 10 - 19 J라는 사실 때문에 에너지 단위에서 양성자 질량은 938.272331 M e V입니다.
결과적으로 빠른 α 입자의 충돌 조건에서 질소 핵과 주기율표의 다른 요소가 분리되는 현상을 발견한 Rutherford의 실험에서도 양성자가 원자핵의 일부임을 보여주었습니다.
양성자 발견의 결과로 일부 물리학자들은 새로운 입자가 원자핵의 일부가 아니라 유일하게 가능한 요소라는 가정을 내놓았습니다. 그러나 핵의 구성에 양성자만 포함된 경우와 같이 핵의 질량에 대한 전하의 비율이 다른 핵에 대해 일정하게 유지되지 않는다는 사실 때문에 이 가정은 지지할 수 없는 것으로 인식되었습니다. 더 무거운 핵의 경우, 이 비율은 가벼운 것보다 작은 것으로 밝혀졌으며, 그 결과 더 무거운 핵으로 갈 수록 핵의 질량이 전하보다 빠르게 증가합니다.
1920년에 E. Rutherford는 전자와 양성자로 구성된 단단하게 결합된 특정 쌍의 핵 구성에 존재한다는 가설을 제시했습니다. 과학자의 이해에서, 이 다발은 실질적으로 양성자 질량과 같은 질량을 가진 입자로서 전기적으로 중성인 형성물이었습니다. 그는 또한 이 가상 입자의 이름을 생각해 냈고 Rutherford는 그것을 중성자라고 부르기를 원했습니다. 불행히도 이 아이디어는 그 아름다움에도 불구하고 잘못된 것이었습니다. 전자는 핵의 일부가 될 수 없다는 것이 밝혀졌습니다. 불확정성 관계에 기초한 양자역학적 계산은 핵에 국한된 전자, 즉 크기 R ≈ 10–13 cm의 영역이 의 결합 에너지보다 수십 배 더 큰 놀라운 운동 에너지를 가져야 함을 보여줍니다. 입자당 핵.
핵에 무거운 중성 전하를 띤 입자가 존재한다는 아이디어는 Rutherford에게 매우 매력적이었습니다. 그 과학자는 즉시 그녀를 찾자고 제안하면서 J. Chadwick이 이끄는 그의 학생 그룹에게 눈을 돌렸습니다. 12년 후인 1932년 채드윅은 파일럿 연구α 입자로 베릴륨을 조사하는 조건에서 발생하는 방사선. 그 과정에서 그는 이 방사선이 양성자와 거의 같은 질량을 가진 중성 입자의 흐름이라는 것을 발견했습니다. 따라서 중성자가 발견되었습니다. 그림 6. 5 . 2는 중성자를 검출하기 위한 설정의 단순화된 다이어그램을 예시합니다.

그림 6. 5 . 2. 중성자 검출을 위한 설치 계획.
방사성 폴로늄에서 방출되는 α 입자로 베릴륨을 폭격하는 과정에서 10-20cm의 납 층 형태로 장애물을 통과할 수 있는 강력한 투과 방사선이 나타납니다. 이 방사선은 마리 퀴리와 피에르 퀴리, 아이린과 프레드릭 졸리오 퀴리의 딸인 채드윅과 거의 같은 시기에 발견되었지만, 이들은 이것이 고에너지의 γ선이라고 제안했습니다. 그들은 베릴륨 방사선의 경로에 파라핀 판을 설치하면 이 방사선의 이온화 능력이 급격히 증가한다는 사실을 알아냈습니다. 이 부부는 베릴륨 방사선이 주어진 수소 함유 물질에 다량으로 존재하는 양성자를 파라핀으로부터 제거한다는 것을 증명했습니다. 과학자들은 공기 중 양성자의 평균 자유 경로 값을 사용하여 충돌 조건에서 양성자에게 원하는 속도를 부여할 수 있는 γ-양자 에너지를 추정했습니다. 평가 결과 얻은 에너지 값은 약 50 MeV로 엄청났습니다.
1932년 J. Chadwick은 베릴륨에 α 입자를 조사할 때 발생하는 방사선의 특성에 대한 포괄적인 연구를 목표로 일련의 실험을 수행했습니다. 그의 실험에서 채드윅은 이온화 방사선을 연구하기 위해 다양한 방법을 사용했습니다.
정의 3
그림 6. 5 . 2 그림 가이거 계수관, 하전 입자를 감지하는 데 사용되는 도구.
이 장치는 내부에 금속층으로 코팅된 유리관(음극)과 관의 축을 따라 흐르는 가는 실(음극)으로 구성됩니다. 튜브는 저압에서 불활성 가스, 일반적으로 아르곤으로 채워져 있습니다. 기체 속에서 이동하는 과정에서 하전 입자는 분자의 이온화를 일으킵니다.
정의 4
이온화의 결과로 발생하는 자유 전자는 충격 이온화 현상이 시작되는 에너지로 양극과 음극 사이의 전기장에 의해 가속됩니다. 이온의 눈사태가 나타나고 짧은 방전 전류 펄스가 카운터를 통과합니다.
정의 5
입자 연구에 매우 중요한 또 다른 도구는 클라우드 챔버, 빠르게 하전된 입자가 흔적을 남기거나 트랙이라고도 합니다.
입자 궤적을 사진으로 직접 촬영하거나 관찰할 수 있습니다. 1912년에 만들어진 구름 챔버의 작용의 기초는 하전 입자의 궤적을 따라 챔버의 작업 부피에 형성되는 이온에 과포화 증기가 응축되는 현상입니다. 클라우드 챔버를 사용하면 전기장과 자기장에서 하전 입자의 궤적의 곡률을 관찰할 수 있습니다.
증거 1
그의 실험에서 J. Chadwick은 구름 챔버에서 베릴륨 방사선과 충돌한 미량의 질소 핵을 관찰했습니다. 이러한 실험을 기반으로 과학자는 실험에서 관찰된 속도를 질소 핵에 알릴 수 있는 γ-양자의 에너지를 추정했습니다. 얻은 값은 100 - 150 MeV였으며 베릴륨에서 방출되는 γ-양자는 그렇게 큰 에너지를 가질 수 없었습니다. 이 사실을 바탕으로 채드윅은 베릴륨에서 α-입자의 영향으로 질량이 없는 γ-양자가 날아가는 것이 아니라 무거운 입자가 날아간다고 결론지었습니다. 이 입자들은 상당한 투과력을 가지고 있었고 가이거 계수기의 가스를 직접 이온화하지 않았기 때문에 전기적으로 중성이었습니다. 이로써 채드윅의 실험보다 10년 이상 앞서 러더퍼드가 예측한 입자인 중성자의 존재가 증명됐다.
정의 6
중성자소립자이다. Rutherford가 처음에 가정한 것처럼 조밀한 양성자-전자 쌍으로 표현하는 것은 잘못된 것입니다.
현대 측정 결과를 바탕으로 중성자 질량 m n = 1.67493 10 - 27 kg g = 1.008665 a.u라고 말할 수 있습니다. 먹다.
에너지 단위에서 중성자의 질량은 939.56563 MeV에 해당합니다. 중성자의 질량은 양성자의 질량보다 약 2개의 전자 질량이 더 큽니다.
중성자 발견 직후 러시아 과학자 D. D. Ivanenko는 독일 물리학자 W. Heisenberg와 함께 원자핵의 양성자-중성자 구조에 대한 가설을 제시했으며 이는 후속 연구에서 완전히 확인되었습니다.
정의 7
양성자와 중성자를 부른다 핵자.
원자핵을 특성화하기 위해 많은 표기법이 도입되었습니다.
정의 8
원자핵을 구성하는 양성자의 수는 기호 Z로 표시되며 청구 번호 또는 원자 번호(이것은 멘델레예프 주기율표의 일련 번호입니다).
핵 전하는 Z e 이며, 여기서 e는 기본 전하입니다. 중성자의 수는 기호 N으로 표시됩니다.
정의 9
핵자(즉, 양성자와 중성자)의 총 수를 핵 질량 수 A라고 합니다.
동위원소 개념의 정의
핵 화학 원소기호 X Z A 로 표시되며, 여기서 X는 원소의 화학 기호입니다. 예를 들어,
H 1 1 - 수소, He 2 4 - 헬륨, C 6 12 - 탄소, O 8 16 - 산소, U 92 238 - 우라늄.
정의 10
동일한 화학 원소의 핵에 있는 중성자의 수는 다를 수 있습니다. 이러한 핵을 동위원소.
대부분의 화학 원소에는 여러 동위 원소가 있습니다. 예를 들어, 수소에는 H 1 1 - 일반 수소, H 1 2 - 중수소 및 H 1 3 - 삼중수소의 세 가지가 있습니다. 탄소에는 6개의 동위 원소가 있고 산소에는 3개의 동위 원소가 있습니다.
화학 원소 자연 조건대부분 동위원소의 혼합물입니다. 동위 원소의 존재는 자연 원소의 원자 질량 값을 결정합니다. 주기율표멘델레예프. 예를 들어, 천연 탄소의 상대 원자 질량은 12.011입니다.
텍스트에서 실수를 발견하면 강조 표시하고 Ctrl+Enter를 누르십시오.
원자핵의 구성과 특성.
가장 단순한 원자의 핵인 수소 원자는 양성자라고 하는 하나의 기본 입자로 구성됩니다. 다른 모든 원자의 핵은 양성자와 중성자의 두 가지 유형의 기본 입자로 구성됩니다. 이러한 입자를 핵자라고 합니다.
양성자 . 양성자(p)는 +전하와 질량을 가집니다.
m p = 938.28 MeV
비교를 위해 전자의 질량은 다음과 같습니다.
m e = 0.511MeV
m p = 1836m e
양성자는 1/2(s= )에 해당하는 스핀과 자체 자기 모멘트를 가지고 있습니다.


핵자기라고 하는 자기 모멘트의 단위. 양성자와 전자 질량을 비교하면 μ i는 보어 마그네톤 μ b보다 1836배 작습니다. 결과적으로, 양성자의 고유 자기 모멘트는 전자의 자기 모멘트보다 약 660배 작습니다.
중성자 . 중성자(n)는 1932년 영국의 물리학자에 의해 발견되었습니다.
D. 채드윅. 이 입자의 전하는 0이고 질량은
m n = 939.57 MeV
양성자의 질량에 매우 가깝습니다. 중성자와 양성자 질량 차이(m n –m p)
1.3 MeV, 즉 2.5 나.
중성자는 스핀이 절반(s= )이고 (전하가 없음에도 불구하고) 자체 자기 모멘트를 가지고 있습니다.
μ n = - 1.91μ 나는
(마이너스 기호는 고유한 기계적 모멘트와 자기 모멘트의 방향이 반대임을 나타냅니다.) 이에 대한 설명 놀라운 사실나중에 주어집니다.
정확도가 높은 μ p와 μn의 실험 값의 비율은 -3/2와 같습니다. 이는 이론적으로 그러한 값을 얻은 후에야 알 수 있었습니다.
자유 상태에서 중성자는 불안정합니다(방사성) - 자발적으로 붕괴하여 양성자로 바뀌고 전자(e -)와 반중성미자라는 또 다른 입자를 방출합니다  . 반감기(즉, 원래 중성자 수의 절반이 붕괴하는 데 걸리는 시간)는 약 12분입니다. 소멸 계획은 다음과 같이 작성할 수 있습니다.
. 반감기(즉, 원래 중성자 수의 절반이 붕괴하는 데 걸리는 시간)는 약 12분입니다. 소멸 계획은 다음과 같이 작성할 수 있습니다.

반중성미자의 나머지 질량은 0입니다. 중성자의 질량은 양성자의 질량보다 2.5m e 더 큽니다. 결과적으로 중성자의 질량은 방정식의 오른쪽에 나타나는 입자의 총 질량을 1.5m e, 즉 1.5m 초과합니다. 0.77 MeV. 이 에너지는 생성된 입자의 운동 에너지 형태로 중성자가 붕괴하는 동안 방출됩니다.
원자핵의 특성 . 원자핵의 가장 중요한 특성 중 하나는 전하 수 Z입니다. 그것은 핵을 구성하는 양성자의 수와 같으며 + Z e 와 같은 전하를 결정합니다. 숫자 Z는 멘델레예프 주기율표에서 화학 원소의 서수를 결정합니다. 따라서 핵의 원자 번호라고도합니다.
핵의 핵자 수(즉, 양성자와 중성자의 총 수)는 문자 A로 표시되며 핵의 질량수라고 합니다. 핵의 중성자 수는 N=A–Z입니다.
핵을 나타내는 기호

여기서 X는 원소의 화학 기호입니다. 왼쪽 상단에는 질량 번호가 있고 왼쪽 하단에는 원자 번호가 있습니다(마지막 아이콘은 종종 생략됨). 때때로 질량 번호는 화학 원소 기호의 왼쪽이 아니라 오른쪽에 기록됩니다. 
Z는 같지만 A가 다른 핵을 동위원소. 대부분의 화학 원소에는 몇 가지 안정 동위 원소가 있습니다. 예를 들어, 산소에는 세 가지 안정 동위 원소가 있습니다.
 , 주석에는 10개가 있습니다.
, 주석에는 10개가 있습니다.
수소에는 세 가지 동위 원소가 있습니다.
 - 일반 수소 또는 프로튬(Z=1, N=0),
- 일반 수소 또는 프로튬(Z=1, N=0),
 - 중수소 또는 중수소(Z=1, N=1),
- 중수소 또는 중수소(Z=1, N=1),
 – 삼중수소(Z=1, N=2).
– 삼중수소(Z=1, N=2).
Protium과 Deuterium은 안정적이고 tritium은 방사성입니다.
질량수 A가 같은 원자핵을 등압선. 예는  그리고
그리고  . 동일한 수의 중성자를 가진 핵 N = A – Z 이온
(
. 동일한 수의 중성자를 가진 핵 N = A – Z 이온
( ,
, ) 마지막으로 반감기가 다른 동일한 Z와 A를 갖는 방사성 핵이 있습니다. 그들은 불려 이성질체. 예를 들어, 핵에는 두 개의 이성질체가 있습니다.
) 마지막으로 반감기가 다른 동일한 Z와 A를 갖는 방사성 핵이 있습니다. 그들은 불려 이성질체. 예를 들어, 핵에는 두 개의 이성질체가 있습니다.  , 그들 중 하나는 반감기가 18분이고 다른 하나는 4.4시간입니다.
, 그들 중 하나는 반감기가 18분이고 다른 하나는 4.4시간입니다.
Z 또는 A 또는 둘 다에서 다른 약 1500개의 핵이 알려져 있습니다. 이 핵의 약 1/5은 안정적이고 나머지는 방사성입니다. 많은 핵이 핵반응을 이용하여 인위적으로 얻어졌다.
테크네튬(Tc, Z = 43)과 프로메튬(Pm, Z = 61)을 제외하고 원자 번호 Z가 1에서 92까지인 원소는 자연에서 발견됩니다. 인공적으로 얻은 플루토늄(Pu, Z = 94)은 천연 광물-수지 혼합물에서 무시할 수 있는 양으로 발견되었습니다. 나머지 초우라늄(즉, 초우라늄) 원소(cZ 93에서 107)는 다양한 핵반응을 통해 인위적으로 얻었다.
초우라늄 원소인 큐륨(96 Cm), 아인슈타이늄(99 Es), 페르뮴(100 Fm) 및 멘델레븀(101 Md)은 저명한 과학자 II를 기리기 위해 명명되었습니다. 및 M. Curie, A. Einstein, Z. Fermi 및 D.I. 멘델레예프. Lawrencium(103 Lw)은 사이클로트론의 발명가인 E. Lawrence의 이름을 따서 명명되었습니다. Kurchatovy (104 Ku)는 뛰어난 물리학자 I.V. 쿠르차토프.
쿠르차토븀과 106번과 107번 원소를 포함한 일부 초우라늄 원소는 합동 연구소의 핵 반응 연구소에서 입수했습니다. 핵 연구두브나의 과학자들
N.N. Flerov와 그의 직원.
코어 크기 . 첫 번째 근사에서 핵은 구로 간주될 수 있으며, 그 반경은 공식에 의해 매우 정확하게 결정됩니다
(페르미는 핵물리학에서 사용되는 길이 단위의 이름이며,
10-13cm). 핵의 부피는 핵의 핵자 수에 비례한다는 공식을 따릅니다. 따라서 모든 핵의 물질 밀도는 거의 같습니다.
핵의 회전 . 핵자의 스핀은 핵의 결과 스핀에 합산됩니다. 핵자의 스핀은 1/2입니다. 따라서 핵스핀의 양자수는 에서 반정수가 될 것이다. 홀수핵자 A 및 짝수 A에 대한 정수 또는 0. 핵의 스핀은 몇 단위를 초과하지 않습니다. 이것은 핵에 있는 대부분의 핵자의 스핀이 서로 상쇄되어 역평행임을 나타냅니다. 모든 짝수 짝수 핵(즉, 짝수 개의 양성자와 짝수개의 중성자를 가진 핵)은 스핀이 0입니다.
전자 껍질의 모멘트에 핵 M J의 기계적 모멘트가 더해진다.  원자의 총 각운동량 MF , 양자 수 F에 의해 결정됩니다.
원자의 총 각운동량 MF , 양자 수 F에 의해 결정됩니다.
전자와 핵의 자기 모멘트의 상호 작용은 서로 다른 상호 방향에 해당하는 원자의 상태 M J 및  (즉, 다른 F)는 약간 다른 에너지를 가지고 있습니다. 모멘트 μL과 μS의 상호 작용은 스펙트럼의 미세 구조를 결정합니다. 상호 작용μ J 및
(즉, 다른 F)는 약간 다른 에너지를 가지고 있습니다. 모멘트 μL과 μS의 상호 작용은 스펙트럼의 미세 구조를 결정합니다. 상호 작용μ J 및  원자 스펙트럼의 초미세 구조가 결정됩니다. 초미세 구조에 해당하는 스펙트럼 선의 분할은 매우 작아서(수백분의 1옹스트롬 정도) 가장 높은 분해능을 가진 기기에서만 관찰할 수 있습니다.
원자 스펙트럼의 초미세 구조가 결정됩니다. 초미세 구조에 해당하는 스펙트럼 선의 분할은 매우 작아서(수백분의 1옹스트롬 정도) 가장 높은 분해능을 가진 기기에서만 관찰할 수 있습니다.
방사성 오염의 특징은 다른 오염물질에 의한 오염과 달리 인체와 환경물체에 유해한 영향을 미치는 것은 방사성핵종(오염물질)이 아니라 그 근원인 방사선이라는 점입니다.
그러나 방사성핵종이 유독물질인 경우가 있다. 예를 들어 사고 후 체르노빌 원자력 발전소안에 환경플루토늄 239, 242 Pu가 핵연료 입자와 함께 버려졌습니다. 플루토늄이 알파 방출체이고 체내에 들어갈 때 심각한 위험을 초래한다는 사실 외에도 플루토늄 자체는 독성 요소입니다.
이러한 이유로 두 그룹의 정량적 지표가 사용됩니다. 1) 방사성핵종의 함량을 평가하는 것과 2) 방사선이 물체에 미치는 영향을 평가하는 것입니다.
활동- 분석 대상의 방사성 핵종의 함량에 대한 정량적 측정. 활동도는 단위 시간당 원자의 방사성 붕괴 횟수에 의해 결정됩니다. 활동의 SI 단위는 베크렐(Bq)이며 초당 1회 분해(1Bq = 1 감쇠/초)와 같습니다. 때때로 오프 시스템 활동 측정 단위가 사용됩니다 - 퀴리(Ci); 1Ci = 3.7 × 1010 Bq.
방사선량물체에 대한 방사선의 영향을 정량적으로 측정한 것입니다.
물체에 대한 방사선의 영향은 물리적, 화학적, 생물학적; 개별 분자, 세포, 조직 또는 유기체 등의 수준에서 흡수, 유효 등가, 노출과 같은 여러 유형의 복용량이 사용됩니다.
시간 경과에 따른 방사선량의 변화를 평가하기 위해 "선량률" 지표가 사용됩니다. 선량률시간에 대한 복용량의 비율입니다. 예를 들어, 러시아의 자연 방사선원에서 외부 피폭의 선량률은 4-20μR/h입니다.
인체에 대한 주요 기준인 주요선량한도(1mSv/년)는 유효등가선량 단위로 도입된다. 활동 단위, 토양 오염 수준, VDU, GWP, SanPiN 등의 기준이 있습니다.
원자핵의 구조.
원자는 모든 특성을 유지하는 화학 원소의 가장 작은 입자입니다. 그 구조에서 원자는 원자의 중심에 위치한 매우 작은 크기(10-13cm)의 양전하를 띤 핵과 다양한 궤도에서 핵 주위를 회전하는 음전하를 띤 전자로 구성된 복잡한 시스템입니다. 전자의 음전하는 핵의 양전하와 같지만 일반적으로 전기적으로 중성인 것으로 판명되었습니다.
원자핵은 다음으로 구성됩니다. 핵자 -핵 양성자( 지-양성자 수) 및 핵 중성자(N은 중성자 수). "핵" 양성자와 중성자는 자유 상태의 입자와 다릅니다. 예를 들어 자유 중성자는 핵에 묶인 중성자와 달리 불안정하여 양성자와 전자로 변합니다.
핵자 수 Am(질량 수)는 양성자와 중성자의 수의 합입니다. Am = Z + N.
양성자 -모든 원자의 소립자로서 전자의 전하와 같은 양전하를 띤다. 원자의 껍질에 있는 전자의 수는 핵에 있는 양성자의 수에 의해 결정됩니다.
중성자 -모든 원소의 또 다른 종류의 핵 입자. 그것은 하나의 양성자로 구성된 가벼운 수소의 핵에만 존재하지 않습니다. 전하가 없으며 전기적으로 중성입니다. 원자핵에서 중성자는 안정적이지만 자유 상태에서는 불안정합니다. 동일한 원소의 원자핵에 있는 중성자의 수는 변동할 수 있으므로 핵에 있는 중성자의 수는 그 원소를 특징짓지 않습니다.
핵자(양성자 + 중성자)는 인력의 핵력에 의해 원자핵 내부에 유지됩니다. 핵력전자기력보다 100배 더 강력하므로 핵 내부에 유사한 전하를 띤 양성자를 보유합니다. 핵력은 매우 작은 거리(10-13cm)에서만 나타나며, 핵의 잠재적 결합 에너지를 구성하며, 이는 일부 변형 중에 부분적으로 방출되어 운동 에너지로 전달됩니다.
핵 구성이 다른 원자의 경우 "핵종"이라는 이름이 사용되며 방사성 원자의 경우 "방사성 핵종"이 사용됩니다.
핵종주어진 수의 핵자와 주어진 핵 전하를 가진 원자 또는 핵을 호출합니다(핵종 지정 A X).
같은 수의 핵자(Am = const)를 갖는 핵종을 등압선.예를 들어, 핵종 96 Sr, 96 Y, 96 Zr은 핵자 Am = 96인 일련의 등압선에 속합니다.
양성자 수가 같은 핵종 (Z= const)가 호출됩니다. 동위원소.그들은 중성자 수만 다르므로 동일한 요소에 속합니다. 234 U , 235U, 236U , 238유 .
동위원소- 중성자 수가 같은 핵종(N = Am -Z = const). 핵종: 36 S, 37 Cl, 38 Ar, 39 K, 40 Ca는 20개의 중성자를 포함하는 동위 원소 시리즈에 속합니다.
동위 원소는 일반적으로 Z X M으로 표시되며, 여기서 X는 화학 원소의 기호입니다. M은 핵의 양성자와 중성자의 수의 합과 같은 질량 수입니다. Z는 원자 번호 또는 핵의 전하이며 핵의 양성자 수와 같습니다. 각 화학 원소에는 고유한 영구 원자 번호가 있기 때문에 일반적으로 생략되고 질량 번호만 쓰는 것으로 제한됩니다(예: 3 H, 14 C, 137 Cs, 90 Sr 등).
질량 수는 같지만 전하가 다르고 결과적으로 특성이 다른 핵의 원자를 "동위원소"라고 합니다. 예를 들어 인 동위 원소 중 하나는 황 동위 원소 중 하나인 32 - 15 P32의 질량 수를 갖습니다. 동일한 질량 번호를 가집니다 - 16 S 32 .
핵종은 안정하거나(핵이 안정하고 붕괴하지 않는 경우) 불안정할 수 있습니다(핵이 불안정하고 결국 핵의 안정성을 증가시키는 변화를 겪는 경우). 자발적으로 붕괴할 수 있는 불안정한 원자핵을 방사성 핵종.입자의 방출과 함께 원자핵의 자발적 붕괴 현상 및 (또는) 전자기 방사선, 라고 한다 방사능.
방사성 붕괴의 결과로 안정 동위 원소와 방사성 동위 원소가 모두 형성되고 차례로 자발적으로 붕괴됩니다. 일련의 핵 변환으로 연결된 이러한 방사성 원소 사슬을 방사능 가족.
현재 IUPAC(International Union of Pure and Applied Chemistry)는 공식적으로 109개의 화학 원소를 명명했습니다. 이들 중 81개만이 안정 동위 원소를 가지고 있으며 가장 무거운 것은 비스무트입니다. (지= 83). 나머지 28개 요소에 대해서만 방사성 동위원소, 그리고 우라늄 (유~ 92) 자연에서 발견되는 가장 무거운 원소입니다. 자연 핵종 중 가장 큰 핵종은 238개입니다. 총 109개의 원소 중 약 1700개의 핵종의 존재가 입증되었으며, 개별 원소에 대해 알려진 동위원소의 수는 3(수소의 경우)에서 29(백금의 경우)까지입니다.
.
드문 경우지만 다른 입자가 핵자 대신 핵 역할을 하는 수명이 짧은 외래 원자가 형성될 수 있습니다.
핵에 있는 양성자의 수를 전하수라고 합니다. Z(\디스플레이스타일 Z)- 이 숫자는 멘델레예프의 표 (원소 주기율표)에서 원자가 속한 원소의 서수와 같습니다. 핵에 있는 양성자의 수는 중성 원자의 전자 껍질 구조를 결정하고 따라서 해당 원소의 화학적 특성을 결정합니다. 핵에 있는 중성자의 수를 그것의 동위 원소 번호 N(\디스플레이 스타일 N). 같은 수의 양성자와 다른 수의 중성자를 가진 핵을 동위원소라고 합니다. 중성자의 수는 같지만 양성자의 수가 다른 핵을 동위체(isotones)라고 합니다. 동위 원소 및 동위 원소라는 용어는 표시된 핵을 포함하는 원자와 관련하여 사용되며, 한 화학 원소의 비화학적 변종을 특성화하는 데에도 사용됩니다. 핵에 있는 핵자의 총 개수를 질량수라고 합니다. A(\디스플레이스타일 A) (A = N + Z (\displaystyle A=N+Z))이며 주기율표에 표시된 원자의 평균 질량과 거의 같습니다. 질량수는 같지만 양성자-중성자 조성이 다른 핵종을 등압체(isobars)라고 합니다.
다른 양자 시스템과 마찬가지로 핵은 준안정 여기 상태에 있을 수 있으며 경우에 따라 이러한 상태의 수명은 몇 년으로 계산됩니다. 이러한 핵의 들뜬 상태를 핵이성체라고 합니다.
백과사전 YouTube
1 / 5
✪ 원자핵의 구조. 핵력
✪ 핵력 핵 내 입자의 결합 에너지 우라늄 핵분열 연쇄 반응
✪ 핵반응
✪ 핵물리학 - 원자핵의 구조 v1
✪ 원자 폭탄 "지방"의 작동 원리
자막
이야기
하전 입자의 산란은 한 지점에 집중된 중심 전하로 구성되고 동일한 크기의 반대 전기의 균일한 구형 분포로 둘러싸인 원자를 가정하여 설명할 수 있습니다. 이러한 원자 구조에서 α-와 β-입자는 원자의 중심에서 가까운 거리를 지나갈 때 비록 그러한 편차의 확률은 작지만 큰 편차를 경험합니다.
그리하여 러더퍼드는 원자핵을 발견한 그 순간부터 원자핵의 구조와 성질을 연구하면서 핵물리학이 시작되었습니다.
원소의 안정 동위원소가 발견된 후 가장 가벼운 원자의 핵이 모든 핵의 구조적 입자의 역할을 맡게 되었습니다. 1920년부터 수소 원자의 핵은 공식 용어인 양성자를 사용했습니다. 1921년 Lisa Meitner는 양성자, 전자 및 알파 입자로 구성된 원자핵 구조의 최초의 양성자-전자 모델을 제안했습니다. 96 . 그러나 1929년에 "질소 재앙"이 있었습니다. W. Heitler와 G. Herzberg는 질소 원자의 핵이 Bose - 아인슈타인 통계를 따르고 Fermi - Dirac 통계를 따르지 않는다는 것을 확인했습니다. 양성자-전자 모델: 374 . 따라서 이 모델은 핵의 스핀 및 자기 모멘트 측정의 실험 결과와 충돌하게 되었습니다. 1932년 James Chadwick은 중성자라고 하는 새로운 전기적으로 중성인 입자를 발견했습니다. 같은 해에 Ivanenko와 Heisenberg는 독립적으로 핵의 양성자-중성자 구조에 대한 가설을 제시했습니다. 이후 핵물리학의 발달과 응용으로 이 가설은 완전히 확인되었다.
원자핵의 구조 이론
물리학의 발전 과정에서 원자핵의 구조에 대한 다양한 가설이 제시되었습니다. 그러나 그들 각각은 제한된 핵 특성만을 기술할 수 있습니다. 일부 모델은 상호 배타적일 수 있습니다.
가장 유명한 것은 다음과 같습니다.
- Drop model 핵 - Niels Bohr가 1936년에 제안했습니다.
- Shell model 핵 - XX 세기의 30 년대에 제안되었습니다.
- 일반화된 보어-모텔슨 모델
- 클러스터 커널 모델
- 핵자 협회 모델
- 초유체 코어 모델
- 핵의 통계 모델
핵 물리학
원자핵의 전하량은 1913년 Henry Moseley에 의해 처음으로 결정되었습니다. 과학자는 특정 상수에 대한 X선 파장의 의존성에 의해 그의 실험적 관찰을 해석했습니다. Z(\디스플레이스타일 Z), 원소에서 원소로 1씩 변경하고 수소의 경우 1과 같습니다.
1 / λ = a Z − b (\displaystyle (\sqrt (1/\lambda ))=aZ-b), 어디A (\displaystyle a)그리고 b (\디스플레이스타일 b)- 영구적 인.
이로부터 Moseley는 특성 X선 복사의 파장을 결정하고 원소의 일련번호와 일치하는 그의 실험에서 발견된 원자 상수는 다음과 같이 알려지게 된 원자핵의 전하만이 될 수 있다고 결론지었습니다. 법 모즐리 .
무게
중성자 수의 차이로 인해 A − Z (\displaystyle A-Z)원소의 동위원소는 질량이 다르다 M (A , Z) (\displaystyle M(A,Z)), 이는 커널의 중요한 특성입니다. 핵물리학에서 핵의 질량은 일반적으로 원자 단위 질량으로 측정됩니다. ㅏ. 먹다.), 하나에 대해 a. 예를 들어 12C 핵종의 질량의 1/12를 취합니다. 일반적으로 핵종에 대해 주어지는 표준 질량은 중성 원자의 질량이라는 점에 유의해야 합니다. 핵의 질량을 결정하려면 원자의 질량에서 모든 전자의 질량의 합을 빼야합니다 (전자와 핵의 결합 에너지도 고려하면 더 정확한 값을 얻을 수 있습니다) .
또한 핵물리학에서는 에너지 등가 질량을 자주 사용합니다. 아인슈타인 관계식에 따르면 각 질량 값은 M(\디스플레이 스타일 M)총 에너지에 해당합니다.
E = M c 2 (\displaystyle E=Mc^(2)), 어디 c(\디스플레이스타일 c)는 진공에서 빛의 속도입니다.사이의 비율. e.m 및 줄 단위의 에너지 등가:
E 1 = 1 . 660539 ⋅ 10 − 27 ⋅ (2 . 997925 ⋅ 10 8) 2 = 1 . 492418 ⋅ 10 − 10 (\displaystyle E_(1)=1.660539\cdot(1)=1.660539\cdot(7).20^(-) cdot 10^(8))^(2)=1.492418\cdot 10^(-10)), E 1 = 931, 494(\디스플레이 스타일 E_(1)=931,494).반지름
무거운 핵의 붕괴에 대한 분석은 Rutherford의 추정치를 정제하고 핵의 반지름을 다음과 같은 간단한 관계로 질량수와 연관시켰습니다.
R = r 0 A 1 / 3 (\displaystyle R=r_(0)A^(1/3)),는 상수입니다.
핵의 반경은 순수한 기하학적 특성이 아니며 주로 핵력의 작용 반경과 관련이 있기 때문에 값은 r 0 (\디스플레이 스타일 r_(0))값을 얻는 분석 프로세스에 따라 다릅니다. R(\디스플레이스타일 R), 평균값 r 0 = 1 , 23 ⋅ 10 − 15 (\displaystyle r_(0)=1.23\cdot 10^(-15)) m, 따라서 미터 단위의 코어 반경:
R = 1 , 23 ⋅ 10 − 15 A 1 / 3 (\displaystyle R=1,23\cdot 10^(-15)A^(1/3)).
커널 모멘트
그것을 구성하는 핵자처럼 핵에도 고유한 순간이 있습니다.
회전
핵자 자체의 기계적 모멘트 또는 스핀이 다음과 같기 때문에 1 / 2 (\디스플레이 스타일 1/2), 그러면 핵에는 기계적 모멘트도 있어야 합니다. 또한, 핵자는 궤도 운동에서 핵에 참여하며, 이는 각 핵자의 특정 운동량 모멘트도 특징입니다. 궤도 모멘트는 정수 값만 사용합니다. ℏ (\displaystyle \hbar )(상수 Dirac). 핵자의 모든 기계적 모멘트(스핀과 궤도)는 대수적으로 합산되어 핵의 스핀을 구성합니다.
핵의 핵자 수가 매우 많을 수 있다는 사실에도 불구하고 핵의 스핀은 일반적으로 작고 몇 개 이하입니다. ℏ (\displaystyle \hbar ), 이는 같은 이름의 핵자 상호 작용의 특성으로 설명됩니다. 쌍을 이루는 모든 양성자와 중성자는 스핀이 서로 상쇄되는 방식으로만 상호 작용합니다. 즉, 쌍은 항상 역평행 스핀과 상호 작용합니다. 쌍의 총 궤도 운동량도 항상 0입니다. 결과적으로 짝수 개의 양성자와 짝수개의 중성자로 구성된 핵은 기계적 운동량을 갖지 않습니다. 0이 아닌 스핀은 구성에 짝을 이루지 않은 핵자를 가진 핵에만 존재하며, 그러한 핵자의 스핀은 자체 궤도 운동량에 추가되고 반정수 값(1/2, 3/2, 5/2)을 갖습니다. 홀수-홀수 조성의 핵은 정수 스핀을 갖습니다: 1, 2, 3 등 .
자기 모멘트
스핀 측정은 스핀과 직접 관련된 자기 모멘트의 존재로 인해 가능해졌습니다. 그들은 마그네톤으로 측정되며 다른 핵의 경우 -2에서 +5 핵 마그네트입니다. 핵자의 상대적으로 큰 질량으로 인해 핵의 자기 모멘트는 전자에 비해 매우 작아 측정이 훨씬 어렵습니다. 스핀과 마찬가지로 자기 모멘트는 분광법으로 측정되며 가장 정확한 것은 핵 자기 공명법입니다.
스핀과 같은 짝수 쌍의 자기 모멘트는 0과 같습니다. 짝을 이루지 않은 핵자를 가진 핵의 자기 모멘트는 이러한 핵자의 고유 모멘트와 짝을 이루지 않은 양성자의 궤도 운동과 관련된 모멘트에 의해 형성됩니다.
전기 사중극자 모멘트
1보다 크거나 같은 스핀을 가진 원자핵은 0이 아닌 사중극자 모멘트를 가지므로 정확히 구형이 아님을 나타냅니다. 사중극자 모멘트는 핵이 스핀 축을 따라 확장된 경우 플러스 기호(방추형 몸체)이고 핵이 스핀 축에 수직인 평면에서 늘어나면 마이너스 기호(렌티큘러 몸체)입니다. 양의 사중극자 모멘트와 음의 사중극자 모멘트가 있는 핵이 알려져 있습니다. 0이 아닌 사중극자 모멘트를 갖는 핵에 의해 생성된 전기장에서 구형 대칭이 없으면 원자 전자의 추가 에너지 준위가 형성되고 원자 스펙트럼에서 초미세 구조 선이 나타나며, 그 사이의 거리는 사중극자에 따라 달라집니다 순간.
결합 에너지
코어 안정성
질량수가 50~60보다 크거나 작은 핵종의 경우 평균 결합 에너지가 감소한다는 사실로부터 A(\디스플레이스타일 A)핵융합 과정은 에너지적으로 유리하다 - 열핵 핵융합으로 질량 수가 증가하고 핵이 큰 경우 A(\디스플레이스타일 A)- 분할의 과정. 현재 이 두 과정이 모두 에너지를 방출하는 과정으로 이루어지고 있는데, 후자는 현대 원자력의 기초가 되고 전자는 개발이 진행되고 있다.
상세한 연구에 따르면 핵의 안정성도 매개변수에 크게 좌우된다는 것이 밝혀졌습니다. N/Z(\displaystyle N/Z)- 중성자와 양성자의 수의 비율. 가장 안정적인 핵의 평균 N / Z ≈ 1 + 0.015A 2 / 3(\디스플레이 스타일 N/Z\약 1+0.015A^(2/3))따라서 가벼운 핵종의 핵은 다음에서 가장 안정적입니다. N ≈ Z (\displaystyle N\대략 Z), 그리고 질량수가 증가함에 따라 양성자 사이의 정전기적 반발이 점점 더 두드러지고 안정 영역이 다음 방향으로 이동합니다. N > Z(\displaystyle N>Z)(설명도 참조).
자연에서 발견되는 안정한 핵종의 표를 고려하면 짝수 및 홀수 값으로 분포에주의를 기울일 수 있습니다. Z(\디스플레이스타일 Z)그리고 N(\디스플레이 스타일 N). 이 양의 홀수 값을 가진 모든 핵은 가벼운 핵종의 핵입니다 1 2 H (\displaystyle ()_(1)^(2)(\textrm (H))), 3 6 Li (\displaystyle ()_(3)^(6)(\textrm (Li))), 5 10 B (\displaystyle ()_(5)^(10)(\textrm (B))), 7 14 N (\displaystyle ()_(7)^(14)(\textrm (N))). 홀수 A를 가진 등압선 중에서 원칙적으로 하나만 안정적입니다. 짝수의 경우 A(\디스플레이스타일 A)종종 두 개, 세 개 또는 그 이상의 안정적인 등압선이 있으므로 가장 안정적인 것은 짝수-짝수, 최소-홀수입니다. 이 현상은 중성자와 양성자가 역평행 스핀과 쌍을 이루는 경향이 있음을 나타내며, 이는 위의 결합 에너지 의존성의 평활도를 위반하게 됩니다. A(\디스플레이스타일 A) .
따라서 양성자 또는 중성자의 수의 패리티는 일정한 안정성 여유를 만들어 동위 원소의 중성자 수와 동위 원소의 양성자 수에서 각각 다른 여러 안정 핵종의 존재 가능성으로 이어집니다. 또한 무거운 핵 구성에서 중성자 수의 패리티는 중성자의 영향으로 핵분열 능력을 결정합니다.
핵력
핵력은 핵에 핵자를 유지하는 힘으로, 작은 거리에서만 작용하는 큰 인력입니다. 그들은 핵력에 교환 특성이 할당되는 포화 특성을 가지고 있습니다 (파이 중간자의 도움으로). 핵력은 전하와 무관하고 스핀 의존적이며 중심력이 아닙니다.
커널 레벨
에너지가 어떤 값을 취할 수 있는 자유 입자(소위 연속 스펙트럼)와 달리 결합 입자(즉, 운동 에너지포텐셜의 절대값보다 작음)은 양자 역학에 따라 소위 이산 스펙트럼이라고 하는 특정 이산 에너지 값을 가진 상태에만 있을 수 있습니다. 핵은 결합된 핵자 시스템이기 때문에 불연속적인 에너지 스펙트럼을 갖는다. 그것은 일반적으로 가장 낮은 에너지 상태에 있습니다. 기본. 에너지가 핵으로 전달되면 들뜬 상태.
첫 번째 근사에서 핵의 에너지 준위의 위치:
D = a e − b E * (\displaystyle D=ae^(-b(\sqrt (E^(*)))))), 어디:D(\디스플레이 스타일 D)- 레벨 간의 평균 거리,
E * (\displaystyle E^(*))는 핵의 여기 에너지이고,
A (\displaystyle a)그리고 b (\디스플레이스타일 b)- 주어진 커널에 대한 계수 상수:
A (\displaystyle a)- 첫 번째 여기 준위 사이의 평균 거리(가벼운 핵의 경우 약 1 MeV, 무거운 핵의 경우 0.1 MeV)
원자핵의 구성. 양성자와 중성자의 계산
에 따르면 현대적인 아이디어원자는 핵과 그 주위의 전자로 구성됩니다. 원자의 핵은 차례로 더 작은 기본 입자로 구성됩니다. 양성자와 중성자(일반적인 이름은 핵자임), 핵력으로 상호 연결됩니다.
양성자의 수핵에서 원자의 전자 껍질의 구조를 결정합니다. 그리고 전자 껍질은 물질의 물리 화학적 특성을 결정합니다. 양성자의 수는 전하 수, 원자 번호, 원자 번호라고도 하는 멘델레예프의 주기율표 화학 원소 시스템에서 원자의 일련 번호에 해당합니다. 예를 들어, 헬륨 원자의 양성자 수는 2입니다. 주기율표에서 2번이고 He 2로 지정됩니다. 양성자 수의 기호는 라틴 문자 Z입니다. 공식을 작성할 때 종종 양성자 수를 나타내는 숫자는 원소 기호 아래 또는 오른쪽 또는 왼쪽에 있습니다: He 2 / 2 He.
중성자 수원소의 특정 동위 원소에 해당합니다. 동위 원소는 원자 번호(양성자와 전자의 수는 동일)는 같지만 질량수가 다른 원소입니다. 질량수- 원자 핵에 있는 중성자와 양성자의 총 수(라틴 문자 A로 표시). 공식을 작성할 때 질량 번호는 측면 중 하나의 원소 기호 상단에 표시됩니다. He 4 2 / 4 2 He (헬륨 동위원소 - 헬륨 - 4)
따라서 특정 동위 원소의 중성자 수를 알아내려면 전체 질량 수에서 양성자 수를 빼야 합니다. 예를 들어, 우리는 동위 원소의 질량 수가 4이기 때문에 헬륨-4 He 4 2 원자가 4개의 기본 입자를 포함한다는 것을 알고 있습니다. 동시에 우리는 He 4 2 에 2개의 양성자가 있다는 것을 압니다. 4(총 질량 수) 2(양성자 수)에서 빼면 2 - 헬륨-4 핵의 중성자 수입니다.
원자의 핵에 있는 Phantomic PO 입자의 수를 계산하는 과정. 예를 들어, 우리는 의도적으로 2개의 양성자와 2개의 중성자로 구성된 핵인 헬륨-4(He 4 2)를 고려했습니다. 알파 입자(α 입자)라고 불리는 헬륨-4 핵은 핵반응에서 가장 높은 효율을 가지므로 이 방향의 실험에 자주 사용됩니다. 핵 반응의 공식에서 기호 α는 종종 He 4 2 대신 사용된다는 점에 유의해야 합니다.
E. Rutherford가 처음으로 수행한 것은 알파 입자의 참여와 함께였습니다. 공식 역사물리 반응 핵 변형. 반응 동안 α-입자(He 4 2)는 질소 동위원소(N 14 7)의 핵을 "폭격"하여 산소 동위원소(O 17 8)와 하나의 양성자(p 1 1)를 형성합니다.
이 핵 반응은 다음과 같습니다.
![]()
이 변환 전후에 팬텀 Po 입자의 수를 계산해 보겠습니다.
팬텀 입자의 수를 계산하려면 다음이 필요합니다.
1단계. 각 핵의 중성자와 양성자의 수를 계산합니다.
- 양성자의 수는 아래쪽 표시기에 표시됩니다.
- 우리는 총 질량 수(상단 표시기)에서 양성자 수(하단 표시기)를 빼서 중성자 수를 찾습니다.
2단계. 원자핵에 있는 팬텀 Po 입자의 수를 계산합니다.
- 양성자 수에 양성자 1개에 포함된 팬텀 Po 입자 수를 곱합니다.
- 중성자 수에 중성자 1개에 포함된 팬텀 Po 입자 수를 곱합니다.
3단계. 팬텀 입자 수 추가:
- 반응 전에 핵의 중성자에 수용된 양과 함께 양성자에 수용된 팬텀 Po 입자의 양을 추가합니다.
- 반응 후 핵의 중성자에 수용된 양과 함께 양성자에 수용된 팬텀 Po 입자의 양을 추가합니다.
- 반응 전의 팬텀 Po 입자의 수와 반응 후의 팬텀 Po 입자의 수를 비교합니다.
원자핵에서 Phantomic PO 입자의 수에 대한 상세한 계산의 예.
(α-입자(He 4 2)를 포함하는 핵반응, 1919년 E. Rutherford에 의해 수행됨)
![]()
반응 전 (N 14 7 + He 4 2)
N 14 7
양성자 수: 7
중성자 수: 14-7 = 7
1 양성자 - 12 Po, 즉 7 양성자 : (12 x 7) \u003d 84;
1개의 중성자 - 33 Po, 즉 7개의 중성자에서: (33 x 7) = 231;
핵에 있는 팬텀 Po 입자의 총 수: 84+231 = 315
그는 4 2
양성자 수 - 2
중성자 수 4-2 = 2
팬텀 입자 수 기준:
1개의 양성자 - 12 Po, 즉 2개의 양성자에서: (12 x 2) \u003d 24
1개의 중성자 - 33 Po, 즉 2개의 중성자에서: (33 x 2) \u003d 66
핵에 있는 팬텀 Po 입자의 총 수: 24+66 = 90
반응 전 팬텀 Po 입자의 총 수
N 14 7 + 그 4 2
315 + 90 = 405
반응 후(O 17 8) 및 하나의 양성자(p 1 1):
오 17 8
양성자 수: 8
중성자 수: 17-8 = 9
팬텀 입자 수 기준:
1개의 양성자 - 12 Po, 즉 8개의 양성자: (12 x 8) \u003d 96
1개의 중성자 - 33 Po, 즉 9개의 중성자에서: (9 x 33) = 297
핵에 있는 팬텀 Po 입자의 총 수: 96+297 = 393
페이지 1 1
양성자 수: 1
중성자 수: 1-1=0
팬텀 입자 수 기준:
1 양성자에서 - 12 Po
중성자는 없습니다.
핵에 있는 팬텀 Po 입자의 총 수: 12
반응 후 팬텀 입자 Po의 총 수
(O 17 8 + p 1 1):
393 + 12 = 405
반응 전후의 팬텀 Po 입자의 수를 비교해 보겠습니다.
핵 반응에서 Phantomic PO 입자의 수 계산의 축소된 형태의 예.
유명한 핵반응중성자가 처음 발견된 베릴륨 동위 원소와 α 입자의 상호 작용 반응으로 핵 변형의 결과 독립 입자로 나타납니다. 이 반응은 1932년 영국 물리학자 James Chadwick에 의해 수행되었습니다. 반응식:
![]()
213 + 90 → 270 + 33 - 각 핵의 팬텀 Po 입자 수
303 = 303 - 총액반응 전후의 팬텀 Po 입자
반응 전후의 팬텀 Po 입자의 수는 동일합니다.