Acolo unde se aplica legea mariotelor boilies. Legile gazelor
Legea Boyle-Mariotte este următoarea:
În formă matematică, această afirmație este scrisă sub forma formulei
Unde - presiunea gazului; - volumul de gaz și - valoare constanta in conditiile convenite. În general, valoarea este determinată de natura chimică, masa și temperatura gazului.
Evident, dacă indicele 1 notează cantitățile legate de starea inițială a gazului și indicele 2 - la final, apoi formula dată se poate scrie sub formă
.
Din formulele de mai sus și din formulele de mai sus, urmează forma dependenței presiunii gazului de volumul său în procesul izoterm:
Această dependență este o altă expresie, echivalentă cu prima, a conținutului legii Boyle - Mariotte. Înseamnă că
Presiunea unei mase de gaz la o temperatură constantă este invers proporțională cu volumul acestuia.
Atunci relația dintre stările inițiale și finale ale gazului care participă la procesul izoterm poate fi exprimată astfel:
Trebuie remarcat faptul că aplicabilitatea acestei formule și a formulei de mai sus care conectează presiunile inițiale și finale și volumele de gaz între ele nu se limitează la cazul proceselor izoterme. Formulele rămân valabile în acele cazuri când temperatura se modifică în timpul procesului, dar ca urmare a procesului, temperatura finală se dovedește a fi egală cu cea inițială.
Este important de precizat că această lege este valabilă doar în cazurile în care gazul în cauză poate fi considerat ideal. În special, legea Boyle - Mariotte este îndeplinită cu mare precizie în raport cu gazele rarefiate. Dacă gazul este puternic comprimat, atunci se observă abateri semnificative de la această lege.
Consecințe
Legea lui Boyle - Mariotte afirmă că presiunea unui gaz într-un proces izoterm este invers proporțională cu volumul ocupat de gaz. Dacă luăm în considerare că densitatea unui gaz este, de asemenea, invers proporțională cu volumul pe care îl ocupă, atunci ajungem la concluzia:
Într-un proces izoterm, presiunea gazului se modifică direct proporțional cu densitatea acestuia.
Astfel, ajungem la concluzia:
Coeficientul izotermic de compresibilitate al unui gaz ideal este egal cu inversul presiunii acestuia.
Vezi si
Scrieți o recenzie despre articolul „Legea Boyle-Mariotte”
Note (editare)
- Petruşevski F.F.// Dicţionar enciclopedic al lui Brockhaus şi Efron
- // Enciclopedie fizică / Ch. ed. A.M. Prohorov. - M .: Enciclopedia Sovietică, 1988 .-- T. 1. - S. 221-222. - 704 p. - 100.000 de exemplare
- Sivukhin D.V. Curs general de fizică. - Moscova: Fizmatlit, 2005 .-- T. II. Termodinamică și fizică moleculară. - S. 21-22. - 544 p. - ISBN 5-9221-0601-5.
- Manual elementar de fizică / Ed. G. S. Landsberg. - M .: Stiinta, 1985. - T. I. Mecanica. Căldură. Fizica moleculară. - S. 430 .-- 608 p.
- Kikoin A.K., Kikoin I.K. Fizica moleculară. - M .: Nauka, 1976 .-- S. 35-36.
- La masa constanta.
- Livshits L.D.// Enciclopedie fizică / Ch. ed. A.M. Prohorov. - M .: Marea Enciclopedie Rusă, 1994 .-- T. 4. - S. 492-493. - 704 p. - 40.000 de exemplare - ISBN 5-85270-087-8.
Literatură
- Petruşevski F.F.// Dicționar enciclopedic al lui Brockhaus și Efron: în 86 de volume (82 de volume și 4 suplimentare). - SPb. , 1890-1907.
Extras din Legea lui Boyle - Mariotte
„Ea este cea”, s-a auzit ca răspuns o voce aspră de femeie, iar după aceea Marya Dmitrievna a intrat în cameră.Toate domnișoarele și chiar și doamnele, cu excepția celor mai în vârstă, s-au ridicat în picioare. Marya Dmitrievna s-a oprit în prag și, din înălțimea corpului ei corpulent, ținându-și capul de cincizeci de ani sus cu bucle cenușii, se uită la oaspeți și, parcă s-ar sufleca, își îndreptă fără grabă mânecile largi ale rochiei. Marya Dmitrievna a vorbit întotdeauna rusă.
„Dragă ziua de naștere cu copiii”, a spus ea cu vocea ei tare și groasă, copleșind toate celelalte sunete. - Ce ești tu, bătrână păcătoasă, - se întoarse ea către conte, care îi sărută mâna, - ceai, ți-e dor de Moscova? Nu există unde să urmărească câinii? Dar ce, tată, să faci, așa cresc păsările astea... - Arătă ea spre fete. - Dacă vrei sau nu, trebuie să cauți pețitori.
- Păi, ce, cazacul meu? (Maria Dmitrievna a numit-o pe Natasha cazac) - a spus ea, mângâindu-l cu mâna pe Natasha, care s-a apropiat de mâna ei fără teamă și veselă. - Știu că poțiunea este o fată, dar o ador.
Ea a scos cercei de iaht cu pere dintr-un reticul imens și, dându-i-i Natasha, care strălucea și roșea de ziua ei, s-a întors imediat de la ea și s-a întors către Pierre.
- Eh, eh! drăguț! vino aici”, a spus ea cu o voce joasă și subțire. - Hai, draga mea...
Și ea și-a suflecat mânecile în mod amenințător și mai sus.
Pierre se apropie, privind-o naiv prin ochelari.
- Hai, vino, dragă! Numai tatălui tău i-am spus adevărul, când a fost în caz, și atunci Dumnezeu îți poruncește.
Ea făcu o pauză. Toată lumea a tăcut, așteaptă ce se va întâmpla și simțind că există doar o prefață.
- Bine, nu e nimic de spus! băiat bun!... Tatăl se întinde pe pat, și se distrează, îl pune pe urs pe urs. Rușine, părinte, rușine! Ar fi mai bine dacă ar merge la război.
Ea se întoarse și întinse mâna către conte, care cu greu se putea abține să nu râdă.
- Ei bine, la masă, am ceai, e timpul? – spuse Maria Dmitrievna.
Contele a mers înainte cu Maria Dmitrievna; apoi contesa, care era condusă de colonelul husar, persoana potrivită cu care Nikolai trebuia să ajungă din urmă regimentul. Anna Mikhailovna - cu Shinshin. Berg îi dădu mâna Verei. Zâmbitoare Julie Karagina s-a dus cu Nikolai la masă. Alte cupluri i-au urmat, întinzându-se pe hol, iar în spatele lor, unul câte unul, copii, tutori și guvernante. Chelnerii s-au agitat, scaunele zdrăngăneau, muzică în cor, iar oaspeții s-au așezat. Sunetele muzicii de acasă a contelui au fost înlocuite de sunetele de cuțite și furculițe, oaspeții vorbind, pașii liniștiți ai chelnilor.
Contesa stătea la un capăt al mesei. În dreapta este Marya Dmitrievna, în stânga este Anna Mikhailovna și alți oaspeți. La celălalt capăt stăteau contele, în stânga un colonel de husar, în dreapta Shinshin și alți oaspeți bărbați. Pe o parte a mesei lungi sunt tineri mai în vârstă: Vera lângă Berg, Pierre lângă Boris; pe de altă parte, copiii, tutorele și guvernantele. Din spatele cristalelor, sticlelor și vaselor cu fructe, contele s-a uitat la soția sa și la șapca ei înaltă cu panglici albastre și a turnat cu sârguință vin vecinilor, fără a uita de sine. De asemenea, Contesa, din cauza ananasului, fără a uita de îndatoririle gazdei, a aruncat priviri semnificative către soțul ei, a cărui chelie și față, i se păreau, erau mai puternic diferite de părul cărunt în roșeața lor. Din partea doamnelor se auzi chiar un bolborosit; pe cea bărbătească se auzeau din ce în ce mai tare voci, mai ales ale colonelului husar, care a mâncat și a băut atât de mult, roșindu-se din ce în ce mai mult, încât contele îl dădea deja ca exemplu celorlalți oaspeți. Berg a vorbit cu Vera cu un zâmbet blând că dragostea nu este un sentiment pământesc, ci unul ceresc. Boris l-a sunat pe noul său prieten Pierre oaspeții de la masă și a schimbat priviri cu Natasha, care stătea în fața lui. Pierre vorbea puțin, se uită în jur la fețe noi și mânca mult. Pornind de la două supe, dintre care a ales a la tortue, [coaja țestoasă] și kulebyaki, până la cocoși de alun, nu a lipsit nici măcar un fel de mâncare sau un singur vin, pe care majordomul le-a scos în mod misterios de pe umărul unui vecin într-o sticlă învelită. într-un șervețel, spunând sau „dray Madeira, sau maghiară, sau Rin. A înlocuit primul dintre cele patru pahare de cristal cu monograma contelui în picioare în fața fiecărui aparat și a băut cu plăcere, privind pe oaspeți cu un aer din ce în ce mai plăcut. Natasha, așezată în fața lui, îl privea pe Boris ca fetele de treisprezece ani se uită la băiatul cu care tocmai s-au sărutat pentru prima dată și de care sunt îndrăgostiți. Chiar această privire a ei se întorcea uneori către Pierre și, sub privirea acestei fete amuzante și pline de viață, voia să râdă el însuși, fără să știe de ce.
Nikolay stătea departe de Sonya, lângă Julie Karagina și, din nou, cu același zâmbet involuntar, îi vorbea. Sonya a zâmbit ceremonios, dar, se pare, era chinuită de gelozie: a devenit palidă, apoi a înroșit și a ascultat cu toată puterea ce spuneau între ei Nikolai și Julie. Guvernanta se uită neliniștită în jur, parcă s-ar fi pregătit pentru o respingere, dacă cineva s-ar fi gândit să jignească copiii. Guvernatorul german a încercat să memoreze tot felul de mâncare, deserturi și vinuri pentru a descrie totul în detaliu într-o scrisoare adresată familiei sale din Germania și a fost foarte jignit că majordomul, cu o sticlă înfășurată într-un șervețel, l-a cărat în jur. Germanul s-a încruntat, a încercat să se prefacă că nu vrea să-și ia acest vin, dar s-a jignit pentru că nimeni nu a vrut să înțeleagă că are nevoie de vin să nu-și potolească setea, nu din lăcomie, ci din curiozitate conștiincioasă.
La capătul masculin al mesei, conversația devenea din ce în ce mai animată. Colonelul a spus că manifestul cu privire la declarația de război a fost deja publicat la Sankt Petersburg și că exemplarul pe care îl văzuse el însuși fusese acum predat prin curier comandantului șef.
22. Legea lui Boyle-Mariotte
Una dintre legile gazelor ideale este legea lui Boyle-Mariotte, care scrie: produsul presiunii P după volum V gaz cu masă de gaz constantă și temperatură constantă. Această egalitate se numește ecuații izoterme... Izoterma este reprezentată pe diagrama PV a stării gazului sub forma unei hiperbole și, în funcție de temperatura gazului, ocupă una sau alta poziție. Procesul care are loc la T= se numește const izotermă. Gaz la T= const are energie internă constantă U. Dacă gazul se dilată izotermic, atunci toată căldura merge să funcționeze. Lucrul pe care îl face gazul, extinzându-se izotermic, este egal cu cantitatea de căldură care trebuie să fie transmisă gazului pentru a-l efectua:
dА= dQ= PdV,
unde D A- munca elementara;
dV- volum elementar;
P- presiune. Dacă V 1> V 2 și P 1< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие T= const a fost îndeplinită, este necesar să se considere modificările de presiune și volum ca fiind infinit de lente. Există și o cerință pentru mediul în care se află gazul: acesta trebuie să aibă o capacitate termică suficient de mare. Formulele de calcul sunt potrivite și în cazul furnizării energiei termice a sistemului. Compresibilitatea gazul se numește proprietatea sa de a modifica volumul atunci când se schimbă presiunea. Fiecare substanță are factor de compresibilitate, si este egal cu:
c = 1 / VО (dV / CP) T,
aici derivata este luată la T= const.
Factorul de compresibilitate este introdus pentru a caracteriza modificarea volumului cu o schimbare a presiunii. Pentru un gaz ideal, acesta este egal cu:
c = -1 / P.
În SI, factorul de compresibilitate are următoarea dimensiune: [c] = m 2 / N.
Acest text este un fragment introductiv. Din cartea Creativitatea ca știință exactă [Teoria rezolvării inventive a problemelor] autorul Altshuller Genrikh Saulovich1. Legea completității părților unui sistem O condiție necesară pentru viabilitatea fundamentală a unui sistem tehnic este prezența și performanța minimă a părților principale ale sistemului. Fiecare sistem tehnic trebuie să includă patru părți principale: motorul,
Din cartea Interfață: noi direcții în proiectarea sistemelor informatice autorul Ruskin Jeff2. Legea „conductivității energetice” a unui sistem O condiție necesară pentru viabilitatea fundamentală a unui sistem tehnic este trecerea prin intermediul energiei prin toate părțile sistemului. Orice sistem tehnic este un convertor de energie. De aici evident
Din cartea Instrumentatie autor Babaev MA6. Legea trecerii la supersistem După ce au epuizat posibilitățile de dezvoltare, sistemul este inclus în supersistem ca una dintre părțile sale; în acest caz, dezvoltarea ulterioară are loc la nivelul supersistemului. Am vorbit deja despre această lege. Să trecem la „dinamică”. Include legi care reflectă
Din cartea Inginer termic autorul Burkhanova Natalia7. Legea trecerii de la macronivel la micronivel Dezvoltarea organelor de lucru ale sistemului merge mai întâi la nivel macro - și apoi la nivel micro. În majoritatea sistemelor tehnice moderne, corpurile de lucru sunt „bucăți de fier”, de exemplu, elice de avioane, roți de mașini, tăietoare.
Din cartea Computational Linguistics for All: Myths. Algoritmi. Limba autorul Anisimov Anatoli Vasilievici8. Legea creșterii gradului de su-câmp Dezvoltarea sistemelor tehnice merge în direcția creșterii gradului de su-câmp. Sensul acestei legi constă în faptul că sistemele non-câmp tind să devină su-câmp, iar în sistemele su-câmp, dezvoltarea merge în direcția
Din cartea Fenomenul științei [Abordarea cibernetică a evoluției] autorul Turchin Valentin Fedorovich Din cartea Nanotehnologie [știință, inovație și oportunitate] de Foster Lynn4.4.1. Legea lui Fitts Imaginați-vă că mutați cursorul pe un buton de pe ecran. Butonul este ținta acestei mișcări. Lungimea liniei drepte care leagă poziția de pornire a cursorului și cel mai apropiat punct al țintei este definită în Legea lui Fitts ca o distanță. Pe
Din cartea Istoria descoperirilor și invențiilor remarcabile (Inginerie electrică, Inginerie electrică, Electronică radio) autorul Schneiberg Jan Abramovici4.4.2. Legea lui Hick Înainte de a muta cursorul la o țintă sau de a efectua orice altă acțiune dintr-un set de mai multe opțiuni, utilizatorul trebuie să selecteze acest obiect sau acțiune. Legea lui Hick spune că atunci când este necesar să faceți o alegere dintre n opțiuni, timpul pentru a alege
Din cartea autorului9. Legea distribuției Poisson și Gauss Legea lui Poisson. Celălalt nume al său este legea definiției ra-rare a evenimentelor rare. Legea lui Poisson (Z.P) se aplică în cazurile în care este puțin probabilă și, prin urmare, utilizarea lui B / Z / R este impracticabilă. Avantajele legii sunt: comoditatea cu
Din cartea autorului23. Legea lui Gay-Lussac Legea lui Gay-Lussac spune: raportul dintre volumul gazului și temperatura lui la presiunea și masa constantă a gazului este constant.V / T = m / MO R / P = const la P = const, m = const. Această egalitate este denumirea ecuației izobare.Isobara este reprezentată pe diagrama PV a unei linii drepte,
Din cartea autorului24. Legea lui Charles Legea lui Charles spune că raportul dintre presiunea gazului și temperatura acestuia este constant dacă volumul și masa gazului sunt neschimbate: P / T = m / MO R / V = const at V = const, m = const. Această egalitate se numește ecuația izocoră .Isochora este reprezentată pe diagrama PV printr-o linie dreaptă paralelă cu axa P și
Din cartea autorului30. Legea conservării și transformării energiei Prima lege a termodinamicii se bazează pe legea universală a conservării și transformării energiei, care afirmă că energia nu se creează și nu dispare Corpurile care participă la procesul termodinamic interacționează între ele.
Din cartea autoruluiTSAREVNA-BROSCĂ ȘI LEGEA STABILITĂȚII După cum am subliniat deja mai devreme (legea abstractizării), gândirea primitivă analizează cu pricepere fenomenele concrete și sintetizează noi sisteme abstracte. Deoarece orice obiect construit de conștiință era perceput ca fiind viu și viu
Din cartea autorului1.1. Legea fundamentală a evoluției În procesul evoluției vieții, din câte știm, a existat întotdeauna o creștere a masei totale a materiei vii și complicarea organizării acesteia. Prin complicarea organizării formaţiunilor biologice, natura acţionează prin metoda probelor şi
Din cartea autorului4.2. Legea lui Moore În forma sa cea mai simplă, Legea lui Moore se rezumă la a afirma că densitatea cablajelor circuitelor tranzistoare se dublează la fiecare 18 luni. Dreptul de autor al legii este atribuit unuia dintre fondatorii cunoscutei companii Intel, Gordon Moore. Strict vorbind, în
DEFINIȚIE
Se numesc procesele în care unul dintre parametrii stării gazului rămâne constant izoprocese.
DEFINIȚIE
Legile gazelor sunt legile care descriu izoprocesele dintr-un gaz ideal.
Legile gazelor au fost descoperite experimental, dar toate pot fi obținute din ecuația Mendeleev-Clapeyron.
Să luăm în considerare fiecare dintre ele.
Legea lui Boyle-Mariotte (proces izoterm)
Proces izotermic se numește schimbarea stării unui gaz în care temperatura acestuia rămâne constantă.
Pentru o masă constantă de gaz la o temperatură constantă, produsul dintre presiunea și volumul gazului este o valoare constantă:
Aceeași lege poate fi rescrisă într-o formă diferită (pentru două stări ale unui gaz ideal):
Această lege rezultă din ecuația Mendeleev - Clapeyron:
![]()
Evident, la o masă de gaz constantă și la o temperatură constantă, partea dreaptă a ecuației rămâne constantă.
Se numesc graficele dependenței parametrilor gazului la temperatură constantă izoterme.
Notând constanta printr-o literă, notăm dependența funcțională a presiunii de volum într-un proces izoterm:
Se poate observa că presiunea gazului este invers proporțională cu volumul acestuia. Graficul de proporționalitate inversă și, în consecință, graficul izotermei în coordonate este hiperbola(Fig. 1, a). Figurile 1 b) și c) prezintă izoterme în coordonate și, respectiv.

Fig. 1. Grafice ale proceselor izoterme în diferite coordonate
Legea lui Gay-Lussac (proces izobar)
Procesul izobaric se numește schimbarea stării unui gaz în care presiunea acestuia rămâne constantă.
Pentru o masă constantă de gaz la presiune constantă, raportul dintre volumul gazului și temperatură este o valoare constantă:
Această lege rezultă și din ecuația Mendeleev - Clapeyron:
![]()
izobare.
Luați în considerare două procese izobare cu presiuni și titlu = "(! LANG: Redat de QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Să definim forma graficului în coordonate.Notând constanta printr-o literă, notăm dependența funcțională a volumului de temperatură în procesul izobar:
Se poate observa că la presiune constantă, volumul gazului este direct proporțional cu temperatura acestuia. Graficul proporționalității directe și, prin urmare, un grafic izobar în coordonate este o linie dreaptă care trece prin origine(Fig. 2, c). În realitate, la temperaturi suficient de scăzute, toate gazele se transformă în lichide, cărora legile gazelor nu mai sunt aplicabile. Prin urmare, lângă originea coordonatelor, izobarele din Fig. 2, c) sunt prezentate cu o linie punctată.

Fig. 2. Grafice ale proceselor izobare în diferite coordonate
legea lui Charles (procesul izocor)
Procesul izocor se numește schimbarea stării unui gaz, în care volumul acestuia rămâne constant.
Pentru o masă constantă de gaz la un volum constant, raportul dintre presiunea gazului și temperatura sa este o valoare constantă:
Pentru două stări de gaz, această lege se va scrie sub forma:
Această lege poate fi obținută și din ecuația Mendeleev - Clapeyron:
![]()
Se numesc graficele dependenței parametrilor gazului la presiune constantă izocori.
Luați în considerare două procese izocorice cu volume și titlu = "(! LANG: Redat de QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
Pentru a determina tipul de grafic al procesului izocor în coordonate, notăm o constantă din legea lui Charles printr-o literă, obținem:
Astfel, dependența funcțională a presiunii de temperatură la un volum constant este o proporționalitate directă, graficul unei astfel de dependențe este o linie dreaptă care trece prin originea coordonatelor (Fig. 3, c).

Fig. 3. Grafice ale proceselor izocorice în diferite coordonate
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | La ce temperatură ar trebui să fie răcită izobar o anumită masă de gaz cu o temperatură inițială, astfel încât volumul de gaz să scadă cu un sfert? |
| Soluţie | Procesul izobar este descris de legea Gay-Lussac: În funcție de starea problemei, volumul de gaz datorat răcirii izobare scade cu un sfert, prin urmare: de unde temperatura finală a gazului: Să convertim unitățile în sistemul SI: temperatura inițială a gazului. Să calculăm:
|
| Răspuns | Gazul trebuie răcit la temperatură. |
EXEMPLUL 2
| Exercițiu | Un vas închis conține gaz la o presiune de 200 kPa. Care va fi presiunea gazului dacă temperatura crește cu 30%? |
| Soluţie | Deoarece recipientul cu gaz este închis, volumul de gaz nu se modifică. Procesul izocor este descris de legea lui Charles: În funcție de starea problemei, temperatura gazului a crescut cu 30%, așa că puteți scrie: Înlocuind ultimul raport din legea lui Charles, obținem: Să convertim unitățile în sistemul SI: presiunea inițială a gazului kPa = Pa. Să calculăm: |
| Răspuns | Presiunea gazului devine 260 kPa. |
EXEMPLUL 3
| Exercițiu | Sistemul de oxigen cu care este echipată aeronava conține |
| Soluţie | Procesul izoterm este descris de legea Boyle-Mariotte: |
Legea lui Boyle - Mariotte
Legea lui Boyle - Mariott este una dintre legile de bază ale gazelor, descoperită în 1662 de Robert Boyle și redescoperită independent de Edm Marriott în 1676. Descrie comportamentul unui gaz într-un proces izoterm. Legea este o consecință a ecuației Clapeyron.
- 1 Formulări
- 2 Consecințe
- 3 Vezi de asemenea
- 4 Note
- 5 Literatură
Formularea
Legea Boyle-Mariotte este următoarea:
La temperatură constantă și masa gazului, produsul dintre presiunea gazului și volumul acestuia este constant.
În formă matematică, această afirmație este scrisă sub forma formulei
unde este presiunea gazului; este volumul de gaz și este o valoare constantă în condițiile convenite. În general, valoarea este determinată de natura chimică, masa și temperatura gazului.
Evident, dacă indicele 1 indică cantitățile legate de starea inițială a gazului, iar indicele 2 - la starea finală, atunci formula de mai sus poate fi scrisă sub forma
.
Din formulele de mai sus și din formulele de mai sus, urmează forma dependenței presiunii gazului de volumul său în procesul izoterm:
Această dependență este o altă expresie, echivalentă cu prima, a conținutului legii Boyle - Mariotte. Înseamnă că
Presiunea unei mase de gaz la o temperatură constantă este invers proporțională cu volumul acestuia.
Atunci relația dintre stările inițiale și finale ale gazului care participă la procesul izoterm poate fi exprimată astfel:
Trebuie remarcat faptul că aplicabilitatea acestei formule și a formulei de mai sus care conectează presiunile inițiale și finale și volumele de gaz între ele nu se limitează la cazul proceselor izoterme. Formulele rămân valabile în acele cazuri când temperatura se modifică în timpul procesului, dar ca urmare a procesului, temperatura finală se dovedește a fi egală cu cea inițială.
Este important de precizat că această lege este valabilă doar în cazurile în care gazul în cauză poate fi considerat ideal. În special, legea Boyle - Mariotte este îndeplinită cu mare precizie în raport cu gazele rarefiate. Dacă gazul este puternic comprimat, atunci se observă abateri semnificative de la această lege.
Legea lui Boyle - Mariotte, legea lui Charles și legea lui Gay-Lussac, completate de legea lui Avogadro, sunt o bază suficientă pentru obținerea ecuației de stare pentru un gaz ideal.
Consecințe
Legea lui Boyle - Mariotte afirmă că presiunea unui gaz într-un proces izoterm este invers proporțională cu volumul ocupat de gaz. Dacă luăm în considerare că densitatea unui gaz este, de asemenea, invers proporțională cu volumul pe care îl ocupă, atunci ajungem la concluzia:
Într-un proces izoterm, presiunea gazului se modifică direct proporțional cu densitatea acestuia.
Se știe că compresibilitatea, adică capacitatea unui gaz de a-și modifica volumul sub influența presiunii, este caracterizată de coeficientul de compresibilitate. În cazul unui proces izoterm, se vorbește de coeficientul de compresibilitate izotermă, care este determinat de formula
unde indicele T înseamnă că derivata parțială este luată la temperatură constantă. Înlocuind în această formulă expresia pentru relația dintre presiune și volum din legea Boyle - Mariotte, obținem:Astfel, ajungem la concluzia:
Coeficientul izotermic de compresibilitate al unui gaz ideal este egal cu inversul presiunii acestuia.
Vezi si
- Legea lui Gay Lussac
- Legea lui Charles
- legea lui Avogadro
- Gaz ideal
- Ecuația de stare a gazelor ideale
Note (editare)
- Boyle - legea lui Mariotte // Enciclopedie fizică / Cap. ed. A.M. Prohorov. - M .: Enciclopedia sovietică, 1988 .-- T. 1. - S. 221-222. - 704 p. - 100.000 de exemplare
- Sivukhin D.V. Curs general de fizică. - M .: Fizmatlit, 2005 .-- T. II. Termodinamică și fizică moleculară. - S. 21-22. - 544 p. - ISBN 5-9221-0601-5.
- 1 2 Manual elementar de fizică / Ed. G. S. Landsberg. - Moscova: Nauka, 1985. - T. I. Mecanica. Căldură. Fizica moleculară. - S. 430 .-- 608 p.
- 1 2 3 Kikoin A.K., Kikoin I.K., Fizica moleculară. - M .: Nauka, 1976 .-- S. 35-36.
- La masa constanta.
- Livshits L. D. Compresibilitate // Enciclopedie fizică / Ch. ed. A.M. Prohorov. - M .: Marea Enciclopedie Rusă, 1994 .-- T. 4. - S. 492-493. - 704 p. - 40.000 de exemplare
ISBN 5-85270-087-8.
Literatură
- Petrușevski F.F. Legea Boyle-Mariotte // Dicționar enciclopedic Brockhaus și Efron: în 86 de volume (82 de volume și 4 suplimentare). - SPb., 1890-1907.
Legea lui Boyle - Informații despre Marriott
Legea lui Boyle - Mariotte
Legea lui Boyle - Mariotte
Legea lui Boyle - Mariotte Căutați subiectul
Legea lui Boyle - Mariotte ce, legea lui Boyle - Mariotte cine, legea lui Boyle - Descrierea lui Mariotte
Există fragmente din wikipedia despre acest articol și videoclip
Site-ul nostru are un sistem în funcție de motor de căutare. Mai sus: „ce căutați?” Puteți interoga totul în sistem cu caseta. Bine ați venit la motorul nostru de căutare simplu, elegant și rapid, pe care l-am pregătit pentru a vă oferi cele mai exacte și mai actualizate informații.
Un motor de căutare conceput pentru dvs. vă oferă cele mai relevante și precise informații cu un design simplu și sistem de funcționare rapidă. Puteți găsi aproape orice informație pe care o căutați pe site-ul nostru.
Momentan servim doar în engleză, turcă, rusă, ucraineană, kazahă și belarusă.
Noi limbi vor fi adăugate sistemului foarte curând.
Viețile oamenilor celebri vă oferă informații, imagini și videoclipuri pe sute de subiecte, cum ar fi politicieni, oficiali guvernamentali, medici, site-uri web, fabrici, vehicule tehnologice, mașini și multe altele.
Legea Boyle-Mariotte

Relația cantitativă dintre volumul și presiunea unui gaz a fost stabilită pentru prima dată de Robert Boyle în 1662 * Legea lui Boyle-Mariotte afirmă că la o temperatură constantă, volumul unui gaz este invers proporțional cu presiunea acestuia.
Această lege se aplică oricărei cantități fixe de gaz. După cum se poate observa din Fig. 3.2, reprezentarea sa grafică poate fi diferită. Graficul din stânga arată că la presiune scăzută, volumul unei cantități fixe de gaz este mare.
Volumul gazului scade odată cu creșterea presiunii. Din punct de vedere matematic, este scris astfel:
Cu toate acestea, de obicei legea Boyle-Mariotte este scrisă sub formă
O astfel de înregistrare permite, de exemplu, cunoscând volumul inițial de gaz V1 și presiunea acestuia p, să se calculeze presiunea p2 în noul volum V2.
Legea lui Gay Lussac (Legea lui Charles)
În 1787 Charles a arătat că la presiune constantă volumul gazului se modifică (proporțional cu temperatura acestuia. Această dependență este prezentată grafic în Fig. 3.3, care arată că volumul gazului este liniar legat de temperatura acestuia. În formă matematică, această dependență se exprimă astfel:
Legea lui Charles este adesea scrisă într-o formă diferită:
V1IT1 = V2T1 (2)
Legea lui Charles a fost îmbunătățită de J. Gay-Lussac, care în 1802 a stabilit că volumul unui gaz atunci când temperatura acestuia se modifică cu 1 ° С se modifică cu 1/273 din volumul pe care l-a ocupat la 0 ° С.
Prin urmare, dacă luăm un volum arbitrar de orice gaz la 0 ° С și la presiune constantă îi reducem temperatura cu 273 ° С, atunci volumul final va fi egal cu zero. Aceasta corespunde unei temperaturi de -273 ° C, sau 0 K. Această temperatură se numește zero absolut. În realitate, nu se poate realiza. În fig.
3.3 arată cum extrapolarea volumului gazului în funcție de graficele de temperatură duce la volum zero la 0 K.
Zero absolut este, strict vorbind, de neatins. Cu toate acestea, în condiții de laborator, este posibil să se ajungă la temperaturi care diferă de zero absolut cu doar 0,001 K. La astfel de temperaturi, mișcările aleatorii ale moleculelor practic încetează. Acest lucru duce la proprietăți uimitoare.
De exemplu, metalele răcite la temperaturi apropiate de zero absolut își pierd aproape complet rezistența electrică și devin supraconductoare *. Un exemplu de substanțe cu alte proprietăți neobișnuite la temperaturi scăzute este heliul.
La temperaturi apropiate de zero absolut, vâscozitatea heliului dispare și devine superfluid.* În 1987 s-au descoperit substanţe (ceramica sinterizată din oxizi ai elementelor lantanide, bariu şi cupru) care devin supraconductoare la temperaturi relativ ridicate, de ordinul a 100 K (- 173°C). Acești supraconductori „de înaltă temperatură” deschid perspective mari în tehnologie. transl.
Principalul echipament de laborator este desktopul pe care se desfășoară toată munca experimentală.
Fiecare laborator trebuie să aibă o ventilație bună. Este necesară o hotă, în care toate lucrările sunt efectuate folosind compuși urât mirositori sau otrăvitori, precum și arderea substanțelor organice în creuzete.
Substanțe foarte volatile, nocive sau urât mirositoare (brom lichid, acizi concentrați azotic și clorhidric etc.)
), precum și substanțe inflamabile (disulfură de carbon, eter, benzen etc.).
Laboratorul necesită instalații sanitare, canalizare, curent tehnic, dispozitive de încălzire cu gaz și apă. De asemenea, este de dorit să existe o alimentare cu aer comprimat, o linie de vid, o alimentare cu apă caldă și abur.
Dacă nu există o conexiune specială, pentru a obține apă caldă se folosesc încălzitoare de apă din diferite sisteme.
Cu aceste dispozitive, încălzite cu electricitate sau gaz, puteți obține rapid un jet de apă caldă cu o temperatură de aproape 100 ° C.
Laboratorul trebuie să aibă instalații pentru distilarea (sau demineralizarea) apei, deoarece este imposibil să lucrezi într-un laborator fără apă distilată sau demineralizată. În cazurile în care este dificil sau imposibil să se obțină apă distilată, se folosește apă distilată din comerț.
In apropierea meselor de lucru si a chiuvetelor cu apa trebuie sa existe borcane de lut cu o capacitate de 10-15 litri pentru scurgerea solutiilor inutile, reactivilor etc., precum si cosuri pentru sticla sparta, hartie si alte deseuri uscate.
Pe lângă birouri, laboratorul ar trebui să aibă un birou unde sunt păstrate toate caietele și notițele și, dacă este necesar, un tabel cu titluri. Ar trebui să existe scaune sau scaune înalte lângă mesele de lucru.
Balanțele analitice și instrumentele care necesită instalare staționară (electrometrice, optice etc.) sunt amplasate într-o cameră separată asociată cu laboratorul, iar pentru balanța analitică trebuie alocată o cameră specială de cântărire. Este de dorit ca cântarul să fie amplasat cu ferestre spre nord. Acest lucru este important deoarece balanța nu trebuie expusă la lumina soarelui („Cântar și cântărire”).
În laborator, trebuie să aveți și cele mai necesare cărți de referință, manuale și manuale, deoarece adesea în timpul lucrului este nevoie de un ton sau de altă referință.
Vezi si
Pagina 3
Sticla chimică utilizată în laboratoare poate fi împărțită în mai multe grupuri. În funcție de scop, vasele pot fi împărțite în vase de uz general, de destinație specială și vase volumetrice. După material - pentru vase din sticlă simplă, sticlă specială, cuarț.
Pentru grup. scop general sunt acele articole care ar trebui să fie întotdeauna în laboratoare și fără de care majoritatea lucrărilor nu pot fi efectuate. Acestea sunt: eprubete, pâlnii, simple și separatoare, pahare, baloane cu fund plat, cristalizatoare, baloane conice (Erlenmeyer), baloane Bunsen, frigidere, retorte, baloane pentru apă distilată, tees, robinete.
Grupul cu destinații speciale include acele articole care sunt utilizate în orice scop, de exemplu: aparatul Kipp, aparatul Sok-rally, aparatul Kjeldahl, condensatoarele de reflux, baloanele Wul-fa, baloanele Tishchenko, picnometrele, hidrometrele, baloanele Drexel , aparat de potasiu, analizor de dioxid de carbon, baloane cu fund rotund, frigidere speciale, instrument de greutate moleculară, instrumente pentru punctul de topire și de fierbere etc.
Instrumentele volumetrice includ: cilindri gradați și pahare, pipete, biurete și baloane volumetrice.Pentru început, vă sugerăm să vizionați următorul videoclip, în care principalele tipuri de sticlă chimică sunt luate în considerare pe scurt și ușor.
Vezi si:
Vase de gătit de uz general
Eprubetele (Fig. 18) sunt vase cilindrice înguste, cu fundul rotunjit; vin în diferite dimensiuni și diametre și sunt fabricate din sticlă diferită. „Eprubetele de testare de laborator obișnuite sunt fabricate din sticlă cu topire scăzută, dar pentru lucrări speciale, când este necesară încălzirea la temperaturi ridicate, eprubetele sunt din sticlă cu topire ridicată sau cuarț.
Pe lângă tuburile obișnuite, simple, se mai folosesc tuburi conice gradate și centrifuge.
Rafturi speciale din lemn, plastic sau metal sunt folosite pentru depozitarea eprubetelor în funcțiune (Fig. 19).
Orez. 18. Tuburi simple si gradate
Orez. 20. Introducerea unei etichete de substanțe sub formă de pulbere în eprubetă.
Eprubetele sunt utilizate în principal pentru lucrări analitice sau microchimice. Când se efectuează reacții într-o eprubetă, reactivii nu trebuie utilizați în cantități prea mari. Este absolut inacceptabil ca eprubeta să fie umplută până la refuz.
Reacția se realizează cu cantități mici de substanțe; 1/4 sau chiar 1/8 din capacitatea eprubetei este suficient. Uneori, o substanță solidă (pulberi, cristale etc.) trebuie injectată în eprubetă.
), pentru aceasta, o bandă de hârtie cu o lățime puțin mai mică decât diametrul eprubetei este pliată în jumătate pe lungimea sa și cantitatea necesară de solid este turnată în cupa rezultată. Eprubeta este ținută în mâna stângă, înclinând-o orizontal, iar cupa este introdusă în ea aproape până în jos (Fig. 20).
Apoi eprubeta este așezată vertical, dar și ușor lovită de ea. Când toate solidele s-au vărsat, scoateți cupa de hârtie.
Pentru a amesteca reactivii turnați, eprubeta este ținută de capătul superior cu degetul mare și arătătorul mâinii stângi și sprijinită cu degetul mijlociu, iar partea inferioară a tubului este lovită cu degetul arătător al mâinii drepte. Acest lucru este suficient pentru ca conținutul său să fie bine amestecat.
Este absolut inacceptabil să închideți eprubeta cu degetul și să o agitați astfel; în acest caz, nu numai că puteți introduce ceva străin în lichidul din eprubetă, dar uneori puteți deteriora pielea degetului, puteți obține o arsură etc.
Dacă tubul este plin mai mult de jumătate cu lichid, amestecați conținutul cu o tijă de sticlă.
Dacă tubul trebuie încălzit, acesta trebuie prins în suport.
Odată cu încălzirea ineptă și puternică a eprubetei, lichidul fierbe rapid și stropește din el, așa că trebuie să îl încălziți cu atenție. Când încep să apară bule, eprubeta trebuie lăsată deoparte și, ținând-o nu în flacăra arzătorului. , dar lângă sau deasupra acestuia, continuați încălzirea cu aer cald. Când este încălzit, capătul deschis al eprubetei trebuie îndreptat departe de lucrător și de vecinii de pe masă.Când nu este necesară o încălzire puternică, este mai bine să scufundați tubul cu lichidul încălzit în apă fierbinte. Dacă se lucrează cu eprubete mici (pentru semi-microanaliza), acestea sunt încălzite numai în apă fierbinte turnată într-un pahar de sticlă de dimensiunea corespunzătoare (cu o capacitate care nu depășește 100 ml).
Pâlnii sunt folosite pentru turnare - lichide, pentru filtrare etc. Pâlniile chimice sunt produse în diferite dimensiuni, diametrele lor superioare sunt 35, 55, 70, 100, 150, 200, 250 și 300 mm.
Pâlniile convenționale au un perete interior neted, dar pâlniile cu o suprafață interioară nervură sunt uneori folosite pentru o filtrare mai rapidă.
Pâlniile de filtrare au întotdeauna un unghi de 60 ° și un capăt lung tăiat.
În timpul funcționării, pâlniile sunt instalate fie într-un trepied special, fie într-un inel pe un trepied obișnuit de laborator (Fig. 21).
Pentru filtrarea într-un pahar, este util să se realizeze un suport simplu pentru o pâlnie (Fig. 22) Pentru aceasta, se decupează o bandă de 70-80 lsh lungime și 20 mm lățime din tablă de aluminiu cu o grosime de aproximativ 2 mm. .
O gaură cu un diametru de 12-13 mm este găurită la unul dintre capetele benzii și banda este îndoită așa cum se arată în Fig. 22, a. Modul de fixare a pâlniei pe sticlă este prezentat în fig. 22, b.
Când turnați lichid într-o sticlă sau balon, nu umpleți pâlnia până la refuz.
Dacă pâlnia se potrivește perfect pe gâtul vasului în care este turnat lichidul, atunci transferul devine dificil, deoarece se creează o presiune crescută în interiorul vasului. Prin urmare, pâlnia trebuie ridicată din când în când.
Este chiar mai bine să faceți un spațiu între pâlnie și gâtul vasului punând, de exemplu, o bucată de hârtie între ele. În acest caz, trebuie avut grijă ca garnitura să nu intre în vas. Este mai indicat să folosiți un triunghi de sârmă, pe care îl puteți realiza singur.Acest triunghi este plasat pe gâtul vasului și apoi se introduce pâlnia.
Pe gâtul vaselor există atașamente speciale din cauciuc sau plastic, care asigură comunicarea interiorului balonului cu atmosfera exterioară (Fig. 23).
Orez. 21. Consolidarea pâlniei chimice sticloase
Orez. 22. Dispozitiv pentru fixarea pâlniei pe un pahar, în trepied.
Pentru lucrările analitice la filtrare, este mai bine să folosiți pâlnii analitice (Fig. 24). Particularitatea acestor pâlnii este că au un capăt tăiat alungit, al cărui diametru interior este mai mic în partea superioară decât în partea inferioară; acest design accelerează filtrarea.
În plus, există pâlnii analitice cu o suprafață interioară nervură care susține filtrul și cu o expansiune sferică în punctul în care pâlnia trece în tub. Pâlniile cu acest design accelerează procesul de filtrare de până la trei ori în comparație cu pâlniile convenționale.
Orez. 23. Duze pentru gâturile sticlei. Orez. 24. Pâlnie analitică.
Pâlnii de separare(fig. 25) sunt folosite pentru separarea lichidelor nemiscibile (ex. apă și ulei). Sunt fie cilindrice, fie în formă de pară și în cele mai multe cazuri sunt echipate cu dop de sticlă.
Există un robinet de sticlă în partea superioară a conductei de ramificație. Capacitatea pâlniilor de separare este diferită (de la 50 ml la câțiva litri), în funcție de capacitate se modifică și grosimea peretelui.
Cu cât capacitatea pâlniei este mai mică, cu atât pereții îi sunt mai subțiri și invers.
În timpul funcționării, pâlniile de separare sunt întărite în diferite moduri, în funcție de capacitate și formă. Pâlnia cilindrică de capacitate mică poate fi pur și simplu atașată la picior. Pâlniile mari sunt plasate între două inele.
Partea inferioară a pâlniei cilindrice ar trebui să se sprijine pe un inel, al cărui diametru este puțin mai mic decât diametrul pâlniei, inelul superior are un diametru puțin mai mare.
Dacă pâlnia se balansează în același timp, între inel și pâlnie trebuie plasată o farfurie din dop.
O pâlnie de despărțire în formă de pară este fixată pe un inel, gâtul este prins cu o labă. Fixați întotdeauna pâlnia mai întâi și abia apoi turnați lichidele care trebuie separate în ea.Pâlniile de picurare (Fig. 26) diferă de pâlniile de separare prin faptul că sunt mai ușoare, cu pereți subțiri și
Orez. 25. Pâlnii de separare. orez. 26. Pâlnii de picurare.
În cele mai multe cazuri, cu un capăt lung. Aceste pâlnii sunt folosite în multe lucrări, atunci când o substanță este adăugată la masa de reacție în porțiuni mici sau prin picurare. Prin urmare, de obicei fac parte din dispozitiv. Pâlniile sunt fixate în gâtul balonului pe o secțiune subțire sau cu un dop de plută sau cauciuc.
Înainte de a lucra cu o pâlnie de separare sau de picurare, secțiunea de robinet din sticlă trebuie lubrifiată cu atenție cu vaselin sau unsoare specială.
Acest lucru face posibilă deschiderea robinetului cu ușurință și fără efort, ceea ce este foarte important, deoarece dacă robinetul se deschide etanș, îl poate rupe la deschidere sau poate deteriora întregul dispozitiv.
Unsoarea trebuie aplicată într-un strat foarte subțire, astfel încât la întoarcerea supapei, aceasta să nu cadă în tubul pâlniei sau în interiorul deschiderii supapei.
Pentru o curgere mai uniformă a picăturilor de lichid din pâlnia de picurare și pentru a monitoriza debitul de lichid, se folosesc pâlnii de picurare cu duză (Fig. 27). Astfel de pâlnii au o parte extinsă imediat după robinet, care se transformă într-un tub. Lichidul curge prin robinet în această expansiune printr-un tub scurt și apoi în tubul pâlniei.
Orez. 27. Pâlnie de picurare cu duză
Orez. 28. Pahare.
Orez. 29. Pâlnie plată cu duză
VASOARE DE STICLĂ 1 2 3
Vezi si
Lecția 25. Legea lui Boyle-Mariotte - HIMI4KA

Arhiva de lecții ›Legile de bază ale chimiei
Lecția 25 „ Legea Boyle-Mariotte"De la curs" Chimie pentru manechine» Luați în considerare legea referitoare la presiunea și volumul gazului, precum și graficele dependenței presiunii de volum și volumului de presiune. Permiteți-mi să vă reamintesc că în ultima lecție „Presiunea gazului” am examinat dispozitivul și principiul de funcționare al unui barometru cu mercur, am dat, de asemenea, o definiție a presiunii și am luat în considerare unitățile sale de măsură.
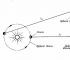
Robert Boyle(1627-1691), caruia ii datoram prima definitie practic corecta a unui element chimic (aflam in capitolul 6), s-a interesat si de fenomenele care au loc in vasele cu aer rarefiat.
În timp ce inventa pompe de vid pentru pomparea aerului din vasele închise, el a atras atenția asupra unei proprietăți familiare tuturor celor care s-a întâmplat să pompeze o cameră de minge de fotbal sau să stoarcă cu grijă un balon: cu cât aerul este mai comprimat într-un vas închis, cu atât mai mult este comprimat. rezistă la compresiune.
Boyle a numit această proprietate „ elasticitate»Aer și măsurat-o cu un aparat simplu prezentat în fig. 3.2, a și b.
Boyle a blocat puțin aer cu mercur la capătul închis al tubului curbat (Figura 3-2, a) și apoi a stors acest aer, adăugând treptat mercur la capătul deschis al tubului (Figura 3-2, b).
Presiunea experimentată de aer în partea închisă a tubului este egală cu suma presiunii atmosferice și a presiunii unei coloane de mercur cu înălțimea h (h este înălțimea la care nivelul de mercur la capătul deschis al tubul depășește nivelul de mercur la capătul închis). Măsurătorile de presiune și volum obținute de Boyle sunt prezentate în Tabelul 1. 3-1.
Deși Boyle nu a luat măsuri speciale pentru a menține o temperatură constantă a gazului, se pare că în experimentele sale aceasta s-a schimbat doar puțin. Cu toate acestea, Boyle a observat că căldura de la flacăra lumânării a provocat modificări semnificative în proprietățile aerului.
Analiza datelor privind presiunea și volumul aerului în timpul comprimării acestuia
Tabelul 3-1, care conține datele experimentale ale lui Boyle privind relația dintre presiune și volum pentru aerul atmosferic, este situat sub spoiler.
După ce cercetătorul primește date similare cu cele prezentate în tabel. 3-1, el încearcă să găsească o ecuație matematică care leagă cele două mărimi dependente pe care le-a măsurat.
O modalitate de a obține o astfel de ecuație este reprezentarea grafică a dependenței diferitelor grade ale unei mărimi față de alta, în speranța de a obține un grafic în linie dreaptă.
Ecuația generală a unei drepte este:
unde x și y sunt variabile înrudite, iar a și b sunt numere constante. Dacă b este zero, o dreaptă trece prin origine.
În fig. 3-3 arată diferite moduri de reprezentare grafică a datelor pentru presiunea P și volumul V, prezentate în tabel. 3-1.Graficele de P versus 1 / K și V față de 1 / P sunt linii drepte care trec prin origine.
Graficul dependenței logaritmului lui P de logaritmul lui V este, de asemenea, o dreaptă cu o pantă negativă, a cărei tangentă este -1. Toate aceste trei diagrame conduc la ecuații echivalente:
- P = a / V (3-3a)
- V = a / P (3-3b)
- lg V = lg a - lg P (3-3v)
Fiecare dintre aceste ecuații reprezintă una dintre opțiuni Legea Boyle-Mariotte, care se formulează de obicei astfel: pentru un număr dat de moli de gaz, presiunea acestuia este proporțională cu volumul, cu condiția ca temperatura gazului să rămână constantă.
Apropo, probabil vă întrebați de ce legea Boyle-Mariotte este numită cu un nume dublu. Acest lucru s-a întâmplat deoarece această lege, independent de Robert Boyle, care a descoperit-o în 1662, a fost redescoperită de Edm Mariotte în 1676. Deci asta este.
Când relația dintre două mărimi măsurate este simplă în măsura în care este în acest caz, se poate stabili și numeric.
Dacă fiecare valoare a presiunii P este înmulțită cu valoarea corespunzătoare a volumului V, este ușor să vă asigurați că toate produsele pentru o anumită probă de gaz la temperatură constantă sunt aproximativ aceleași (vezi Tabelul 3-1). Astfel, putem scrie asta
Ecuația (З-Зг) descrie relația hiperbolică dintre valorile lui P și V (a se vedea Fig. 3-3, a). Pentru a verifica dacă graficul dependenței lui P de V construit din datele experimentale corespunde cu adevărat hiperbolei, vom construi un grafic suplimentar al dependenței produsului PV de P și ne vom asigura că este o linie dreaptă orizontală (vezi Fig. 3-3, e) ...
Boyle a descoperit că pentru o cantitate dată de orice gaz la o temperatură constantă, relația dintre presiunea P și volumul V este descrisă destul de satisfăcător de relația
- P V = const (la constanta T și n) (3-4)
Formula Boyle-Mariotte
Pentru a compara volumele și presiunile aceleiași probe de gaz în condiții diferite (dar temperatură constantă), este convenabil să se reprezinte Legea Boyle-Mariotteîn următoarea formulă:
unde indicii 1 și 2 corespund la două condiții diferite.
Exemplul 4. Pungile de plastic cu alimente livrate pe platoul Colorado (vezi exemplul 3) explodează adesea, deoarece aerul din ele, la ridicarea de la nivelul mării la o înălțime de 2500 m, în condiții de presiune atmosferică redusă, se extinde.
Dacă presupunem că în interiorul pungii există 100 cm3 de aer la presiunea atmosferică corespunzătoare nivelului mării, cât volum ar trebui să ocupe acest aer la aceeași temperatură pe Platoul Colorado? (Să presupunem că pungile micșorate sunt folosite pentru a livra produse care nu restricționează expansiunea aerului; datele lipsă ar trebui luate din Exemplul 3.)Soluţie
Să folosim legea lui Boyle sub forma ecuației (3-5), unde indicele 1 se va referi la condițiile de la nivelul mării, iar indicele 2 - la condițiile de la o altitudine de 2500 m deasupra nivelului mării. Atunci Р1 = 1.000 atm, V1 = 100 cm3, Р2 = 0,750 atm și V2 trebuie calculat. Asa de,
Studiul relației dintre parametrii care caracterizează starea unei mase date de gaz, începem cu studiul proceselor gazoase care au loc atunci când unul dintre parametri rămâne neschimbat. om de știință englez Boyle(în 1669) și un om de știință francez Marriott(în 1676) a descoperit o lege care exprimă dependența modificării presiunii de modificarea volumului gazului la o temperatură constantă. Să realizăm următorul experiment.
Prin rotirea mânerului, vom modifica volumul de gaz (aer) din cilindrul A (Fig. 11, a). Conform citirii manometrului, observăm că se modifică și presiunea gazului. Vom modifica volumul de gaz din vas (volumul este determinat pe scara B) si, observand presiunea, le vom nota in tabel. 1. Din aceasta se poate observa că produsul volumului gazului prin presiunea sa a fost aproape constant: de câte ori „a scăzut volumul gazului, în același timp când i-a crescut presiunea.

În urma unor experimente similare, mai precise, s-a descoperit: pentru o masă dată de gaz la o temperatură constantă, presiunea gazului se modifică invers cu modificarea volumului gazului. Aceasta este formularea legii Boyle-Mariotte. Din punct de vedere matematic, se va scrie pentru două stări, după cum urmează:
![]()
Procesul de schimbare a stării unui gaz la o temperatură constantă se numește izotermă. Formula Boyle-Mariotte este ecuația pentru starea izotermă a unui gaz. La o temperatură constantă, viteza medie de mișcare a moleculelor nu se modifică. O modificare a volumului de gaz determină o modificare a numărului de impacturi ale moleculelor pe pereții vasului. Acesta este motivul modificării presiunii gazului.
Să descriem acest proces grafic, de exemplu, pentru acest caz V = 12 litri, p = 1 at.... Vom reprezenta grafic volumul gazului pe axa absciselor și presiunea acestuia pe axa ordonatelor (Fig. 11, b). Găsim punctele corespunzătoare fiecărei perechi de valori ale lui V și p și, conectându-le între ele, obținem un grafic al procesului izoterm. Linia care arată relația dintre volumul și presiunea unui gaz la temperatură constantă se numește izotermă. Procesele izoterme pure nu au loc. Dar nu este neobișnuit ca temperatura gazului să se schimbe puțin, de exemplu, atunci când compresorul pompează aer în cilindri, când amestecul combustibil este injectat în cilindrul unui motor cu ardere internă. În astfel de cazuri, volumul și presiunea gazului sunt calculate conform legii Boyle-Mariotte *.