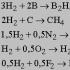Що входить до складу водню. Водень
ВОДОРОД
Н (Лат. Hydrogenium),
найлегший газоподібний хімічний елемент - член підгрупи IA періодичної системи елементів, іноді його відносять до VIIA підгрупи. У земній атмосфері водень у незв'язаному стані існує лише частки хвилини, його кількість становить 1-2 частини на 1500000 частин повітря. Він виділяється зазвичай коїться з іншими газами при виверженнях вулканів, з нафтових свердловин й у місцях розкладання великих кількостей органічних речовин. Водень з'єднується з вуглецем та (або) киснем в органічній речовині типу вуглеводів, вуглеводнів, жирів та тварин білків. У гідросфері водень входить до складу води - найбільш поширеної сполуки Землі. У породах, ґрунтах, ґрунтах та інших частинах земної кори водень з'єднується з киснем, утворюючи воду та гідроксид-іон OH-. Водень становить 16% всіх атомів земної кори, але за масою лише близько 1%, оскільки він у 16 разів легший за кисень. Маса Сонця та зірок на 70% складається з водневої плазми: у космосі це найпоширеніший елемент. Концентрація водню в атмосфері Землі зростає з висотою завдяки його низькій щільності та здатності підніматися на великі висоти. Виявлені на Землі метеорити містять 6-10 атомів водню на 100 атомів кремнію.
Історична довідка.Ще німецький лікар та природознавець Парацельс у 16 ст. встановив горючість водню. У 1700 р. Н.Лемері виявив, що газ, що виділяється при дії сірчаної кислоти на залізо, вибухає на повітрі. Водень як елемент ідентифікував Г.Кавендіш у 1766 р. і назвав його "горючим повітрям", а в 1781 р. він довів, що вода - це продукт його взаємодії з киснем. Латинське hydrogenium, яке походить від грецького поєднання "що народжує воду", було присвоєно цьому елементу А. Лавуазьє.
Загальна характеристика водню.Водень - це перший елемент у періодичній системі елементів; його атом складається з одного протона і одного електрона, що обертається навколо нього.
(Див. також ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ).
Один із 5000 атомів водню відрізняється наявністю в ядрі одного нейтрону, що збільшує масу ядра з 1 до 2. Цей ізотоп водню називають дейтерієм 21H або 21D. Інший, більш рідкісний ізотоп водню містить два нейтрони в ядрі і називається тритієм 31H або 31T. Тритій радіоактивний і розпадається з виділенням гелію та електронів. Ядра різних ізотопів водню відрізняються спинами протонів. Водень може бути отриманий а) дією активного металу на воду; б) дією кислот на певні метали; в) дією основ на кремній та деякі амфотерні метали; г) дією перегрітої пари на вугілля та метан, а також на залізо; води та термічним розкладанням вуглеводнів. Хімічна активність водню визначається його здатністю віддавати електрон іншому атому або узагальнювати його майже порівну з іншим елементами при утворенні хімічного зв'язку або приєднувати електрон іншого елемента в хімічній сполукі, яка називається гідридом. Водень, що виробляється промисловістю, у величезних кількостях витрачають на синтез аміаку, азотної кислоти, гідридів металів. Харчова промисловість застосовує водень для гідрування рідкої рослинної олії в тверді жири (наприклад, маргарин). При гідруванні насичені органічні олії, що містять подвійні зв'язки між вуглецевими атомами, перетворюються на насичені, що мають одинарні вуглець-вуглецеві зв'язки. Високочистий (99,9998%) рідкий водень використовується в космічних ракетах як високоефективне паливо.
Фізичні властивості.Для зрідження та затвердіння водню потрібні дуже низькі температури та високий тиск (див. таблицю властивостей). У нормальних умовах водень - безбарвний газ, без запаху та смаку, дуже легкий: 1 л водню при 0° C та атмосферному тиску має масу 0,08987 г (пор. щільність повітря та гелію 1,2929 та 0,1785 г/л відповідно тому повітряна куля, наповнена гелієм і має таку ж підйомну силу, як і повітряна куля з воднем, повинна мати на 8% більший об'єм). У таблиці наведено деякі фізичні та термодинамічні властивості водню. ВЛАСТИВОСТІ ЗВИЧАЙНОГО ВОДОРОДУ
(При 273,16 К, або 0 ° С)
Атомний номер 1 Атомна маса 11Н 1,00797 Щільність, г/л
при нормальному тиску 0,08987 при 2,5*10 5 атм 0,66 при 2,7*10 18 атм 1,12*10 7
Ковалентний радіус, 0,74 Температура плавлення, °С -259,14 Температура кипіння, °С -252,5 Критична температура, °С -239,92 (33,24 K) Критичний тиск, атм 12,8 (12,80 K) Теплоємність, Дж/(мольЧK) 28,8 (H2) Розчинність
у воді, об'єм/100 об'ємів H2O (за стандартних умов) 2,148 в бензолі, мл/г (35,2° С, 150,2 атм) 11,77 в аміаку, мл/г (25° С) при 50 атм 4 ,47 при 1000 атм 79,25
Ступені окиснення -1, +1
Будова атома.Звичайний водневий атом (протий) складається з двох фундаментальних частинок (протону та електрона) і має атомну масу 1. Через величезну швидкість руху електрона (2,25 км/с або 7*1015 об./с) та його дуалістичної корпускулярно- хвильової природи неможливо точно встановити координату (положення) електрона в будь-який момент часу, але є деякі області високої ймовірності знаходження електрона, і вони визначають розміри атома. Більшість хімічних і фізичних властивостей водню, що особливо відносяться до збудження (поглинання енергії), точно передбачаються математично (див. СПЕКТРОСКОПІЯ). Водень подібний до лужних металів у тому, що всі ці елементи здатні віддавати електрон атому-акцептору для утворення хімічного зв'язку, який може змінюватися від частково іонного (перехід електрона) до ковалентного (загальна електронна пара). З сильним акцептором електронів водень утворює іон позитивний Н+, тобто. протон. На електронній орбіті атома водню можуть бути 2 електрони, тому водень здатний також приймати електрон, утворюючи негативний іон Н-, гідрид-іон, і це ріднить водень з галогенами, для яких характерно прийняття електрона з утворенням негативного галогенід-іона типу Cl-. Дуалізм водню знаходить свій відбиток у цьому, що у періодичної таблиці елементів його мають у IA підгрупі (лужні метали), котрий іноді - у VIIA підгрупі (галогени) (див. також ХІМІЯ).
Хімічні властивості.Хімічні властивості водню визначаються єдиним електроном. Кількість енергії, необхідне відриву цього електрона, більше, ніж може надати будь-який відомий хімічний окислювач. Тому хімічний зв'язок водню з іншими атомами ближчий до ковалентного, ніж до іонного. Чисто ковалентний зв'язок виникає при освіті молекули водню: H + H H2
При утворенні одного моля (тобто 2 г) H2 виділяється 434 кДж. Навіть при 3000 K ступінь дисоціації водню дуже невелика і дорівнює 9,03%, при 5000 K досягає 94% і лише за 10000 K дисоціація стає повною. При утворенні двох молей (36 г) води з атомарного водню і кисню (4H + O2 -> 2H2O) виділяється більше 1250 кДж і температура досягає 3000-4000 ° C, тоді як при згорянні молекулярного водню (2H2 + O2 -> 2H2O) виділяється всього 285,8 кДж і температура полум'я досягає лише 2500 ° C. При кімнатній температурі водень менш реакційний. Для ініціювання більшості реакцій необхідно розірвати або послабити міцний зв'язок H-H, витративши багато енергії. Швидкість реакцій водню зростає з використанням каталізатора (метали платинової групи, оксиди перехідних або важких металів) та методів збудження молекули (світло, електричний розряд, електрична дуга, високі температури). У таких умовах водень реагує практично з будь-яким елементом, окрім шляхетних газів. Активні лужні та лужноземельні елементи (наприклад, літій та кальцій) реагують з воднем, будучи донорами електронів і утворюючи сполуки, які називаються сольовими гідридами (2Li + H2 -> 2LiH; Ca + H2 -> CaH2).
Взагалі гідридами називаються сполуки, що містять водень. Широке розмаїття властивостей таких сполук (залежно від атома, що з воднем) пояснюється можливостями водню виявляти заряд від -1 до практично +1. Це виразно проявляється у подібності LiH і CaH2 і солей типу NaCl і CaCl2. Вважається, що у гідридах водень заряджений негативно (Н-); такий іон є відновником у кислому водному середовищі: 2H-H2 + 2e- + 2,25B. Іон H- здатний відновлювати протон води H+ до газоподібного водню: H- + H2O (r) H2 + OH-.
Сполуки водню з бором - бороводні (борогідриди) - являють собою незвичайний клас речовин, званих боранами. Найпростішим представником їх є BH3, що існує лише у стійкій формі діборану B2H6. З'єднання з великою кількістю атомів бору одержують різними способами. Відомі, наприклад, тетраборан B4H10, пентаборан стабільний B5H9 і нестабільний пентаборан B5H11, гексаборан B6H10, декаборан B10H14. Диборан може бути отриманий з H2 і BCl3 через проміжне з'єднання B2H5Cl, яке при 0° C диспропорціонує до B2H6, а також взаємодією LiH або літійалюмінійгідриду LiAlH4 c BCl3. У літійалюмінійгідриді (комплексному з'єднанні - сольовому гідриді) чотири атоми водню утворюють ковалентні зв'язки з Al, але є іонний зв'язок Li+ з []-. Іншим прикладом водневмісного іона є борогідрид-іон BH4-. Нижче наведено приблизну класифікацію гідридів за їх властивостями відповідно до положення елементів у періодичній системі елементів. Гідриди перехідних металів називаються металевими чи проміжними і часто не утворюють стехіометричних сполук, тобто. відношення атомів водню до металу не виражається цілим числом, наприклад, гідрид ванадію VH0,6 і гідридторію ThH3,1. Метали платинової групи (Ru, Rh, Pd, Os, Ir та Pt) активно поглинають водень і служать ефективними каталізаторами реакцій гідрування (наприклад, гідрогенізації рідких олій з утворенням жирів, конверсії азоту в аміак, синтезу метанолу CH3OH з CO). Гідриди Be, Mg, Al та підгруп Cu, Zn, Ga – полярні, термічно нестабільні.
Неметали утворюють леткі гідриди загальної формули MHx (х - ціле число) із відносно низькою температурою кипіння та високим тиском парів. Ці гідриди суттєво відрізняються від сольових гідридів, у яких водень має негативніший заряд. У летких гідридів (наприклад, вуглеводнів) переважає ковалентний зв'язок між неметалами та воднем. У міру посилення неметалічного характеру утворюються сполуки з частково іонним зв'язком, наприклад, H+Cl-, (H2)2+O2-, N3-(H3)3+. Окремі приклади утворення різних гідридів наведені нижче (у дужках вказано теплоту утворення гідриду):

Ізомерія та ізотопи водню. Атоми ізотопів водню несхожі. Звичайний водень, протий, завжди є протон, навколо якого обертається один електрон, що знаходиться від протона на великій відстані (щодо розмірів протона). Обидві частинки мають спином, тому атоми водню можуть відрізнятися або спином електрона, або спином протона, або тим, і іншим. Водневі атоми, що відрізняються спином протона чи електрона, називаються ізомерами. Комбінація двох атомів із паралельними спинами призводить до утворення молекули "ортоводороду", а з протилежними спинами протонів - до молекули "параводню". Хімічно обидві молекули ідентичні. Ортоводень має дуже слабкий магнітний момент. При кімнатній або підвищеній температурі обидва ізомери, ортоводород і параводень, зазвичай знаходяться в рівновазі у співвідношенні 3:1. При охолодженні до 20 K (-253° C) вміст параводню зростає до 99%, оскільки він більш стабільний. При зрідженні методами промислового очищення ортоформа перетворюється на параформу із теплоти, що спричиняє втрат водню від випаровування. Швидкість конверсії ортоформи параформу зростає в присутності каталізатора, наприклад деревного вугілля, оксиду нікелю, оксиду хрому, нанесеного на глинозем. Протий – незвичайний елемент, тому що в ядрі його немає нейтронів. Якщо в ядрі з'являється нейтрон, такий водень називається дейтерій 21D. Елементи з однаковою кількістю протонів та електронів та різною кількістю нейтронів називаються ізотопами. Природний водень містить невелику частку HD та D2. Аналогічно, природна вода містить у малій концентрації (менше 0,1%) DOH та D2O. Тяжка вода D2O, що має масу більше, ніж у H2O, відрізняється за фізичними та хімічними властивостями, наприклад, щільність звичайної води 0,9982 г/мл (20° С), а важкої - 1,105 г/мл, температура плавлення звичайної води 0, 0° С, а важкої - 3,82° С, температура кипіння - відповідно 100° С і 101,42° С. Реакції за участю D2O протікають з меншою швидкістю (наприклад, електроліз природної води, що містить домішок D2O, з добавкою лугу NaOH ). Швидкість електролітичного розкладання оксиду протию H2O більше, ніж D2O (з урахуванням постійного зростання частки D2O, що піддається електролізу). Завдяки близькості властивостей протию та дейтерію можна замінювати протий на дейтерій. Такі сполуки відносяться до так званих міток. Змішуючи сполуки дейтерію із звичайною водневмісною речовиною, можна вивчати шляхи, природу та механізм багатьох реакцій. Таким методом користуються вивчення біологічних і біохімічних реакцій, наприклад процесів травлення. Третій ізотоп водню, тритій (31T), присутній у природі у кількостях. На відміну від стабільного дейтерію тритій радіоактивний та має період напіврозпаду 12,26 років. Тритій розпадається до гелію (32He) із виділенням b-частки (електрона). Тритій та тритиди металів використовують для отримання ядерної енергії; наприклад, у водневій бомбі відбувається наступна реакція термоядерного синтезу: 21H + 31H -> 42He + 10n + 17,6 МеВ
Одержання водню.Найчастіше подальше застосування водню визначається характером виробництва. У деяких випадках, наприклад, при синтезі аміаку, невеликі кількості азоту у вихідному водні, звичайно, не є шкідливою домішкою. Домішка оксиду вуглецю(II) також не буде на заваді, якщо водень використовують як відновник. 1. Найбільше виробництво водню засноване на каталітичній конверсії вуглеводнів з водяною парою за схемою CnH2n+2+nH2O(r)nCO+(2n+1)H2 та CnH2n+2+2nH2O(r)nCO2+(3n+1)H2. Температура процесу залежить від складу каталізатора. Відомо, що температуру реакції з пропаном можна знизити до 370° З, використовуючи як каталізатор боксит. До 95% виробленого при цьому CO витрачається при подальшій реакції з парами води: H2O + CO -> CO2 + H2
2. Метод водяного газу дає значну частину загального виробництва водню. Сутність методу полягає в реакції водяної пари з коксом з утворенням суміші CO і H2. Реакція ендотермічна (DH° = 121,8 кДж/моль) і її проводять при 1000° С. Нагрітий кокс обробляють парою; очищена газова суміш, що виділяється, містить деяку кількість водню, великий відсоток CO і невелику домішок CO2. Для підвищення виходу H2 монооксид CO видаляють подальшої парової обробки при 370° C, при цьому виходить більше CO2. Вуглекислий газ досить легко видалити, пропускаючи газову суміш через скрубер, зрошуваний водою протитечією. 3. Електроліз. У електролітичному процесі водень є практично побічним продуктом виробництва основних продуктів - хлору та лугу (NaOH). Електроліз проводять у слаболужному водному середовищі при 80° C і напрузі близько 2В, використовуючи залізний катод та нікелевий анод:
4. Залізо-паровий метод, яким пар при 500-1000° C пропускають над залізом: 3Fe + 4H2O Fe3O4 + 4H2 + 160,67 кДж. Отриманий цим методом водень зазвичай використовують для гідрогенізації жирів та олій. Склад оксиду заліза залежить від температури процесу; при nC+(n+1)H2
6. Наступним за обсягом виробництва є метанол-паровий метод: CH3OH + H2O -> 3H2 + CO2. Реакція ендотермічна та її проводять при ВОДОРОД260° C у звичайних сталевих реакторах при тиску до 20 атм. 7. Каталітичне розкладання аміаку: 2NH3 -> Реакція оборотна.За невеликих потреб у водні цей процес неекономічний. Існують також різноманітні способи одержання водню, які, хоч і не мають великого промислового значення, в деяких випадках можуть виявитися економічно найбільш вигідними. Дуже чистий водень виходить за гідролізу очищених гідридів лужних металів; при цьому з малої кількості гідриду утворюється багато водню: LiH + H2O -> LiOH + H2
(Цей метод зручний при безпосередньому застосуванні водню, що отримується.) При взаємодії кислот з активними металами також виділяється водень, проте при цьому він зазвичай забруднений парами кислоти або іншим газоподібним продуктом, наприклад фосфіном PH3, сірководнем H2S, арсином AsH3. Найбільш активні метали, реагуючи з водою, витісняють водень і утворюють лужний розчин: 2H2O + 2Na -> H2 + 2NaOH Поширений лабораторний метод отримання H2 в апараті Кіппа за реакцією цинку із соляною або сірчаною кислотою:
Zn + 2HCl -> ZnCl2 + H2. Гіридиди лужноземельних металів (наприклад, CaH2), комплексні сольові гідриди (наприклад, LiAlH4 або NaBH4) та деякі бороводні (наприклад, B2H6) при реакції з водою або в процесі термічної дисоціації виділяють водень. Буре вугілля та пара при високій температурі також взаємодіють з виділенням водню.
Очищення водню.Ступінь необхідної чистоти водню визначається його сферою застосування. Домішку вуглекислого газу видаляють виморожуванням або зрідженням (наприклад, пропускаючи газоподібну суміш через рідкий азот). Цю домішку можна повністю видалити барботуванням через воду. CO може бути видалений каталітичним перетворенням на CH4 або CO2 або зрідженням при обробці рідким азотом. Домішка кисню, що утворюється у процесі електролізу, видаляється як води після іскрового розряду.
Застосування водню.Водень застосовується головним чином у хімічній промисловості для виробництва хлороводню, аміаку, метанолу та інших органічних сполук. Він використовується при гідрогенізації олій, а також вугілля та нафти (для перетворення низькосортних видів палив у високоякісні). У металургії за допомогою водню відновлюють деякі кольорові метали з оксидів. Водень використовують для охолодження потужних електрогенераторів. Ізотопи водню знаходять застосування в атомній енергетиці. Воднево-кисневе полум'я застосовується для різання та зварювання металів.
ЛІТЕРАТУРА
Некрасов Б.В. Основи загальної хімії. М., 1973 Рідкий водень. М., 1980 Водень у металах. М., 1981
Енциклопедія Кольєра. - Відкрите суспільство. 2000 .
Синоніми:Дивитись що таке "ВОДОРОД" в інших словниках:
Таблиця нуклідів Загальні відомості Назва, символ Водень 4, 4H Нейтронів 3 Протонів 1 Властивості нукліду Атомна маса 4,027810(110) … Вікіпедія
Таблиця нуклідів Загальні відомості Назва, символ Водень 5, 5H Нейтронів 4 Протонів 1 Властивості нукліду Атомна маса 5,035310(110) … Вікіпедія
Таблиця нуклідів Загальні відомості Назва, символ Водень 6, 6H Нейтронів 5 Протонів 1 Властивості нукліду Атомна маса 6,044940(280) … Вікіпедія
Таблиця нуклідів Загальні відомості Назва, символ Водень 7, 7H Нейтронів 6 Протонів 1 Властивості нукліду Атомна маса 7,052750(1080) … Вікіпедія
Водень (Hydrogenium) був відкритий у першій половині XVI століття німецьким лікарем та природознавцем Парацельсом. У 1776 р. Г. Кавендіш (Англія) встановив його властивості та вказав відмінності від інших газів. Лавуазьє перший отримав водень із води та довів, що вода є хімічною сполукою водню з киснем (1783 р.).
Водень має три ізотопи: протий, дейтерій або D і тритій або Т. Їх масові числа дорівнюють 1, 2 і 3. Протий і дейтерій стабільні, тритій - радіоактивний (період напіврозпаду 12,5 років). У природних сполуках дейтерій та протий у середньому містяться щодо 1:6800 (за кількістю атомів). Тритій перебуває у природі у мізерно малих кількостях.
Ядро атома водню містить один протон. Ядра дейтерію і тритію включають крім протона відповідно один і два нейтрони.
Молекула водню і двох атомів. Наведемо деякі властивості, що характеризують атом та молекулу водню:
Енергія іонізації атома, еВ 13,60
Спорідненість атома до електрона, еВ 0,75
Відносна електронегативність 2,1
Радіус атома, нм 0,046
Міжядерна відстань у молекулі, нм 0,0741
Стандартна еітальпія дисоціації молекул при 436,1
115. Водень у природі. Одержання водню.
Водень у вільному стані зустрічається Землі лише у незначних кількостях. Іноді він виділяється разом з іншими газами при вулканічних виверженнях, а також із свердловин при добуванні нафти. Але як сполук водень дуже поширений. Це вже з того, що він становить дев'яту частину маси води. Водень входить до складу всіх рослинних та тваринних організмів, нафти, кам'яного та бурого вугілля, природних газів та ряду мінералів. На частку водню з усієї маси земної кори, рахуючи воду та повітря, припадає близько 1%. Однак при перерахунку на відсотки від загальної кількості атомів вміст водню у земній корі дорівнює 17%.Водень - найпоширеніший елемент космосу. На його частку припадає близько половини маси Сонця та більшості інших зірок. Він міститься у газових туманностях, у міжзоряному газі, входить до складу зірок. У надрах зірок відбувається перетворення ядер атомів водню на ядра атомів гелію. Цей процес протікає з виділенням енергії, для багатьох зірок, у тому числі для Сонця, він є основним джерелом енергії. Швидкість процесу, тобто кількість ядер водню, що перетворюються на ядра гелію в одному кубічному метрі за одну секунду, мала. Тому і кількість енергії, що виділяється за одиницю часу в одиниці обсягу, замало. Однак, внаслідок величезності маси Сонця, загальна кількість енергії, що генерується та випромінюється Сонцем, дуже велика. Воно відповідає зменшенню маси Сонця приблизно на секунду.
У промисловості водень отримують головним чином природного газу. Цей газ, що складається в основному з метану, змішують з водяною парою та з киснем. При нагріванні суміші газів до при каталізатора відбувається реакція, яку схематично можна зобразити рівнянням:
Отриману суміш газів поділяють. Водень очищають і використовують лібро на місці отримання, або транспортують в сталеві балонах під підвищеним тиском.
Важливим промисловим способом отримання водню є його виділення з коксового газу чи з газів переробки нафти. Воно здійснюється глибоким охолодженням, коли всі гази, крім водню скраплюються.
У лабораторіях водень отримують переважно електролізом водних розчинів. Концентрація цих розчинів вибирається такою, що відповідає їх максимальній електричній провідності. Електроди зазвичай виготовляють із листового нікелю. Цей метал не піддається корозії у розчинах лугів, навіть будучи анодом. У разі потреби водень, що виходить, очищають від парів води і від слідів кисню. З інших лабораторних методів найбільш поширений метод виділення водню з розчинів сірчаної чи соляної кислот дією на них цинку. Реакцію зазвичай проводять в апараті Кіппа (рис. 105).
Історія відкриття:
Починаючи з XV століття багато дослідників відзначали виділення пального газу при взаємодії кислот з металами. Перший докладний опис водню під назвою "горюче повітря" та "дефлогістоване повітря" дав англійський хімік Генрі Кавендіш у 1766 році. В 1783 Антуан Лавуазьє довів що водень входить до складу води і включив його в свою таблицю хімічних елементів під назвою hydrogen (що породжує воду). Російську назву "водень" запропонував хімік М. Ф. Соловйов в 1824 - за аналогією з "киснем" М.В. Ломоносова.
Знаходження в природі та отримання:
Перед водню припадає близько 92% всіх атомів Всесвіту. Він основна складова речовини зірок і міжзоряного газу, як сполук утворює атмосферу багатьох планет. На Землі частка атомів водню 17%, він входить до складу найпоширенішої речовини - води, до складу сполук, що утворюють живі організми, де частка його атомів близько 50%. У той самий час масова частка водню Землі (земна кора + гидросфера) близько 1,5%
p align="justify"> Основним методом отримання водню в лабораторії є взаємодія металів (Zn, Fe) з розведеними кислотами, а також електроліз розчинів лугів. У промисловості водень одержують при електролізі розчинів солей (NaCl), конверсією або каталітичним окисненням метану, при крекінгу або риформінгу вуглеводнів (нафтопереробка).
Конверсія метану: CH 4 + H 2 O CO + 3H 2
Фізичні властивості:
Водень зустрічається у вигляді трьох ізотопів, які мають індивідуальні назви та символи: 1 H – протий (Н), 2 Н – дейтерій (D), 3 Н – тритій (T). Природний водень містить 99,99% протию та 0,01% - дейтерію. Тритій міститься у природі у дуже малих кількостях, він радіоактивний із періодом напіврозпаду 12,32 років.
Проста речовина H 2 найлегший газ, без кольору, запаху і смаку, температура плавлення -259,1, кипіння -252,8°C, малорозчинний у воді - 18,8 мл/л. Водень добре розчинний у багатьох металах (850 об'ємів на 1 об'єм Pd), здатний легко дифундувати через металеві мембрани.
Важкий водень D 2 має вдвічі більшу щільність і дещо вищі температури плавлення та кипіння (-254,5°C та -249,5°C)
Хімічні властивості:
При нормальних температурах водень реагує лише з дуже активними металами (напр. з кальцієм) і неметалами: фтором (без освітлення, з вибухом), хлором (на світлі, з вибухом). З більшістю неметалів реагує при нагріванні (з киснем реакція протікає під час запалювання миттєво). Суміш кисню з воднем 1:2 називається "гримким газом". Має яскраво виражені відновлювальні властивості, відновлюючи оксиди металів: заліза, міді, свинцю, вольфраму і т.д. У присутності каталізаторів (Pt, Ni) приєднується по зв'язках кратних органічних сполук (реакція гідрування).
Найважливіші сполуки:
Оксид водню, H 2 O- вода – безбарвна рідина, без кольору, без запаху, без смаку. Аномальні фізичні властивості води (Тпл = 0 ° С, Ткіп = 100 ° С) обумовлені утворенням міжмолекулярних водневих зв'язків. Є амфолітом, дисоціюючи з утворенням іонів гідроксонію та гідроксид-іонів, проте ступінь дисоціації 1,8*10 -16 , тому чиста вода майже не проводить електричний струм.
Вода - дуже реакційна речовина. Основні реакції:
- реакції з'єднання з оксидами активних металів та неметалів, з утворенням відповідних гідроксидів основного чи кислотного характеру;
- реакції гідролізу (оборотного та незворотного) багатьох неорганічних та органічних речовин;
- Реакції гідратації - Приєднання води по кратним зв'язкам органічних сполук.
Пероксид водню - H 2 O 2- Безбарвна сиропоподібна рідина, без кольору, без запаху, з неприємним металевим смаком. У максимальній концентрації - рідина (з щільністю близько 1,5 г/см3), Тпл -0,43°C, Ткіп 150°C. У воді, етиловому спирті, етиловому ефірі розчиняється у будь-яких співвідношеннях.
У концентрованих розчинах пероксид водню нестійкий, розкладається на воду та кисень із вибухом. Викликає сильні опіки.
Зазвичай застосовується як розведених (3%-30%) розчинів. Окислювач? на чому використано його застосування як відбілювача, дезінфікуючого засобу тощо. У природі зустрічається у нижніх шарах атмосфери, в атмосферних опадах.
Іонні гідриди - MH x- з'єднання водню з лужними та лужноземельними металами, де водень має ступінь окислення -1. Солеподібні тверді речовини. Відновлювачі. Водою та кислотами розкладаються з виділенням водню: NaH + H 2 O → NaOH + H 2
Гіридиди ковалентні - H x X- з'єднання водню з неметалами, де водень має ступінь окиснення +1. Гази, багато отруйних. Відновлювачі за рахунок неметалу. Властивості змінюються від інертних (метан) до кислотних (галогенводні). Аміак NH 3 і, слабше, фосфін PH 3 виявляють основні властивості. За винятком галогенводнів горючи з утворенням відповідних оксидів.
Застосування:
Одне з перших застосувань водню – літальні апарати легші за повітря: повітряні кулі та дирижаблі. Через високу пожежну небезпеку водню це застосування було припинено, за винятком метеозондів.
Атомарний водень використовується для атомно-водневого зварювання. Рідкий водень - один із видів ракетного палива. У воднево-кисневих паливних елементах водень використовується для безпосереднього перетворення енергії хімічної реакції на електричну.
Як відновник при отриманні деяких металів для отримання твердих жирів гідруванням рослинних масел. У хімічній промисловості - одержання аміаку, хлороводню та ін.
Пероксид водню: 3% розчин застосовують в медицині, косметології, в промисловості для відбілювання соломи, пір'я, клею, хутра, шкіри і т.д., 60% розчин застосовують для відбілювання жирів і масел. Сильно концентровані розчини (85-90%) у суміші з деякими горючими речовинами застосовуються для отримання вибухових сумішей, як окислювач у ракетних та торпедних двигунах.
Дейтерид літію-6: як джерело дейтерію та тритію в термоядерній зброї (воднева бомба).
Новікова О., Пасюк О.
ТюмДУ, 502 група, 2013 р.
Джерела:
Водень // Вікіпедія. URL: http://ua.wikipedia.org/?oldid=55655584
Водень // Онлайн Енциклопедія Навколишній світ. URL: http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/VODOROD.html (дата звернення: 23.05.2013).
Бджолкіна Г.В. Урок №24. Водень// ХіМуЛя.com URL: https://sites.google.com/site/himulacom/ (дата звернення: 23.05.2013).
ВОДОРОД, Н (лат. hydrogenium; а. hydrogen; н. Wasserstoff; ф. hydrogene; і. hidrogeno), - хімічний елемент періодичної системи елементів Менделєєва, який відносять одночасно до I і VII груп, атомний номер 1, атомна маса 1, 0079. Природний водень має стабільні ізотопи - протий (1 Н), дейтерій (2 Н або D) і радіоактивний - тритій (3 Н або Т). Для природних сполук середнє відношення D/Н = (158±2).10 -6 Рівноважний вміст 3 Н Землі ~5.10 27 атомів.
Фізичні властивості водню
Водень вперше описав у 1766 англійський вчений Г. Кавендіш. За звичайних умов водень - газ без кольору, запаху та смаку. У природі у вільному стані перебуває у формі молекул Н2. Енергія дисоціації молекули Н 2 - 4,776 еВ; потенціал іонізації атома водню 13,595 еВ. Водень - найлегша речовина з усіх відомих, при 0°С та 0,1 МПа 0,0899 кг/м 3 ; t кипіння-252,6 ° С, t плавлення - 259,1 ° С; критичні параметри: t - 240 ° С, тиск 1,28 МПа, щільність 31,2 кг / м 3 . Найбільш теплопровідний із усіх газів - 0,174 Вт/(м.К) при 0°С і 1 МПа, питома теплоємність 14,208.10 3 Дж(кг.К).
Хімічні властивості водню
Рідкий водень дуже легкий (щільність при -253°С 70,8 кг/м 3 ) і текучий (при -253°С дорівнює 13,8 сП). У більшості сполук водень виявляє ступінь окислення +1 (подібний до лужних металів), рідше -1 (подібний до гідридів металів). За звичайних умов молекулярний водень малоактивний; розчинність у воді при 20°З 1 МПа 0,0182 мл/г; добре розчинний у металах - Ni, Pt, Pd та ін. З киснем утворює воду з виділенням тепла 143,3 МДж/кг (при 25 ° С і 0,1 МПа); при 550°З вище реакція супроводжується вибухом. При взаємодії з фтором та хлором реакції йдуть також із вибухом. Основні сполуки водню: Н 2 Про, аміак NH 3 , сірководень Н 2 S, CH 4 , гідриди металів і галогенів CaH 2 , HBr, Hl, а також органічні сполуки С 2 Н 4 , HCHO, CH 3 OH та ін.
Водень у природі
Водень - широко поширений у природі елемент, вміст його в 1% (за масою). Головний резервуар водню Землі — вода (11,19%, за масою). Водень є одним з основних компонентів усіх природних органічних сполук. У вільному стані присутній у вулканічних та інших природних газах, (0,0001%, за кількістю атомів). Складає основну частину маси Сонця, зірок, міжзоряного газу, газових туманностей. В атмосферах планет присутній у формі Н2, CH4, NH3, Н2О, CH, NHOH та ін. Входить до складу корпускулярного випромінювання Сонця (потоки протонів) та космічних променів (потоки електронів).
Отримання та застосування водню
Сировина для промислового отримання водню - гази нафтопереробки, продукти газифікації та ін. Основні способи отримання водню: реакція вуглеводнів з водяною парою, неповне окислення вуглеводнів, конверсія окису, електроліз води. Водень застосовують для виробництва аміаку, спиртів, синтетичного бензину, соляної кислоти, гідроочищення нафтопродуктів, різання металів воднево-кисневим полум'ям.
Водень - перспективне газоподібне пальне. Дейтерій та тритій знайшли застосування в атомній енергетиці.
У періодичної системі має певне місце становища, яке відбиває проявляемые їм властивості і свідчить про його електронному будову. Однак є серед усіх один особливий атом, який займає одразу два осередки. Він розташовується у двох абсолютно протилежних по властивостях групах елементів. Це водень. Такі особливості роблять його унікальним.
Водень - це не просто елемент, а й проста речовина, а також складова частина багатьох складних сполук, біогенний та органогенний елемент. Тому розглянемо його характеристики та властивості докладніше.
Водень як хімічний елемент
Водень - це елемент першої групи головної підгрупи, а також сьомої групи головної підгрупи у першому малому періоді. Цей період складається з двох атомів: гелію і аналізованого нами елемента. Опишемо основні особливості становища водню в періодичній системі.
- Порядковий номер водню - 1, кількість електронів така ж, відповідно, протонів стільки ж. Атомна маса – 1,00795. Існує три ізотопи даного елемента з масовими числами 1, 2, 3. Однак властивості кожного з них дуже різняться, так як збільшення маси навіть на одиницю саме для водню є відразу подвійним.
- Те, що на зовнішньому він містить лише один електрон, дозволяє успішно виявляти йому як окисні, так і відновлювальні властивості. Крім того, після віддачі електрона у нього залишається вільна орбіталь, яка бере участь в утворенні хімічних зв'язків донорно-акцепторного механізму.
- Водень – це сильний відновник. Тому основним місцем його вважається перша група головної підгрупи, де він очолює найактивніші метали – лужні.
- Однак при взаємодії з сильними відновниками, такими як, наприклад, метали, він може бути окислювачем, приймаючи електрон. Ці сполуки отримали назву гідридів. За цією ознакою він очолює підгрупу галогенів, з якими схожим.
- Завдяки зовсім невеликій атомній масі, водень вважається найлегшим елементом. Крім того, його щільність також дуже мала, тому він є еталоном легкості.
Таким чином, очевидно, що атом водню - це унікальний, несхожий на всі інші елемент. Отже, властивості його теж особливі, а прості і складні речовини, що утворюються, дуже важливі. Розгляньмо їх далі.

Проста речовина
Якщо говорити про цей елемент як про молекулу, треба сказати, що вона двоатомна. Тобто водень (проста речовина) – це газ. Формула його емпірична записуватиметься як Н 2 , а графічна - через одинарну сигма-зв'язок Н-Н. Механізм утворення зв'язку між атомами – ковалентний неполярний.
- Парова конверсія метану.
- Газифікація вугілля - процес передбачає нагрівання вугілля до 1000 0 З, у результаті утворюється водень і високовуглецеве вугілля.
- Електроліз. Даний метод може використовуватися тільки для водних розчинів різних солей, оскільки розплави не призводять до розряджання води на катоді.
Лабораторні способи одержання водню:
- Гідроліз гідридів металів.
- Дія розведених кислот на активні метали та середню активність.
- Взаємодія лужних та лужноземельних металів з водою.
Щоб зібрати водень, що утворюється, необхідно тримати пробірку перевернутої вгору дном. Адже цей газ не можна зібрати так, як, наприклад, вуглекислий газ. Це водень, він набагато легший за повітря. Швидко випаровується, а у великих кількостях при змішуванні з повітрям вибухає. Тому слід перевертати пробірку. Після заповнення її потрібно закрити гумовою пробкою.
Щоб перевірити чистоту зібраного водню, слід піднести до шийки запалений сірник. Якщо бавовна глуха і тиха - значить газ чистий, з мінімальними домішками повітря. Якщо ж гучний і свистячий – брудний, з великою часткою сторонніх компонентів.

Області використання
При згорянні водню виділяється настільки велика кількість енергії (теплоти), що цей газ вважається найвигіднішим паливом. До того ж, екологічно чистим. Однак на сьогоднішній день його застосування в цій галузі обмежене. Це пов'язано з непродуманими до кінця та не вирішеними проблемами синтезу чистого водню, який був би придатний для використання як паливо в реакторах, двигунах та портативних пристроях, а також опалювальних котлах житлових будинків.
Адже способи отримання даного газу є досить дорогими, тому насамперед необхідно розробити особливий метод синтезу. Такий, який дозволить отримувати продукт у великому обсязі та з мінімальними витратами.
Можна виділити кілька основних областей, у яких знаходить застосування аналізований нами газ.
- Хімічні синтези. З гідрування отримують мила, маргарини, пластмаси. За участю водню синтезується метанол та аміак, а також інші сполуки.
- У харчовій промисловості – як добавка Е949.
- Авіаційна промисловість (ракетобудування, літакобудування).
- Електроенергетика
- Метеорологія.
- Паливо екологічно чистий.
Очевидно, що водень так само важливий, як і поширений у природі. Ще більшу роль відіграють різні сполуки, що утворюються ним.

З'єднання водню
Це складні речовини, що містять атоми водню. Можна виділити кілька основних типів подібних речовин.
- Галогеноводні. Загальна формула – HHal. Особливе значення у тому числі має хлорид водню. Це газ, що розчиняється у воді з утворенням розчину соляної кислоти. Ця кислота знаходить широке застосування практично у всіх хімічних синтезах. Причому як органічних, і неорганічних. Хлорид водню - це з'єднання, що має емпіричну формулу HCL і є одним із найбільших за обсягами виробництва в нашій країні щорічно. Також до галогеноводів відносяться йодоводород, фтороводород і бромоводень. Усі вони утворюють відповідні кислоти.
- Практично всі вони досить отруйні гази. Наприклад, сірководень, метан, силан, фосфін та інші. При цьому дуже горючі.
- Гідриди – з'єднання з металами. Належать до класу солей.
- Гідроксиди: основи, кислоти та амфотерні сполуки. До їхнього складу обов'язково входять атоми водню, один або кілька. Приклад: NaOH, K 2 , H 2 SO 4 та інші.
- Гідроксид водню. Це з'єднання більше відоме як вода. Інша назва оксид водню. Емпірична формула виглядає так - Н2О.
- Перекис водню. Це найсильніший окислювач, формула якого має вигляд Н2О2.
- Численні органічні сполуки: вуглеводні, білки, жири, ліпіди, вітаміни, гормони, ефірні олії та інші.
Очевидно, що розмаїття сполук елемента, що розглядається, дуже велике. Це ще раз підтверджує його високе значення для природи та людини, а також для всіх живих істот.
- це найкращий розчинник
Як згадувалося вище, простонародна назва даної речовини - вода. Складається з двох атомів водню та одного кисню, з'єднаних між собою ковалентними полярними зв'язками. Молекула води є диполем, це пояснює багато властивостей. Зокрема, те, що вона є універсальним розчинником.
Саме у водному середовищі відбуваються практично всі хімічні процеси. Внутрішні реакції пластичного та енергетичного обміну у живих організмах також здійснюються за допомогою оксиду водню.
Вода по праву вважається найважливішою речовиною планети. Відомо, що без неї не зможе жити жоден живий організм. На Землі вона здатна існувати у трьох агрегатних станах:
- рідина;
- газ (пар);
- тверде (лід).
Залежно від ізотопу водню, що входить до складу молекули, розрізняють три види води.
- Легка чи протиєва. Ізотоп з масовим числом 1. Формула – Н 2 О. Це звична форма, яку використовують усі організми.
- Дейтерієва чи важка, її формула - D 2 O. Містить ізотоп 2 Н.
- Надважка чи тритієва. Формула виглядає як Т3О, ізотоп - 3Н.
Дуже важливими є запаси прісної протиєвої води на планеті. Вже зараз у багатьох країнах відчувається її нестача. Розробляються способи обробки солоної води з одержання питної.

Пероксид водню – це універсальний засіб
Дане з'єднання, як згадувалося вище, прекрасний окислювач. Однак із сильними представниками може поводитися і як відновник теж. Крім того, має виражений бактерицидний ефект.
Інша назва цієї сполуки - перекис. Саме у такому вигляді його використовують у медицині. 3% розчин кристалогідрату цієї сполуки - це медичні ліки, які застосовують для обробки невеликих ран з метою їх знезараження. Однак доведено, що при цьому загоєння поранення за часом збільшується.
Також пероксид водню використовується в ракетному паливі, в промисловості для дезінфекції та відбілювання, як піноутворювач для отримання відповідних матеріалів (пінопласту, наприклад). Крім того, перекис допомагає очищати акваріуми, знебарвлювати волосся та відбілювати зуби. Однак при цьому завдає шкоди тканинам, тому фахівцями з цією метою не рекомендується.