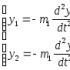«Отримання, збирання та розпізнавання газів».
Представлені розробки практичних робіт для 11 класу
«Практична робота №2 – 11 кл»
Практична робота №2
Ідентифікація неорганічних речовин.
Мета роботи : за допомогою характерних реакцій розпізнати запропоновані
неорганічні речовини, визначити якісний склад ґрунту.
Устаткування :
Реактиви :
Хід роботи :
Приготувати таблицю для запису виконання роботи за формою:
| Що робили | Спостереження | Рівняння реакцій | |
2. Виконати досліди
3. Заповнити таблицю.
4. Зробити загальний висновок.
Правила техніки безпеки
Працювати з кислотами та лугами обережно. Концентровані кислоти акуратно вносити у пробірку над лотком. Якщо кислота потрапила на шкіру чи одяг, швидко змити велику кількість води.
Нічого не куштувати на смак.
У пробірку наливати трохи більше 1 мл речовин.
Нюхати леткі речовини обережно, спрямовуючи повітря рукою від пробірки до себе.
Не закривати пробірку пальцем при збовтуванні рідини. Збовтувати вміст слід тримаючи пробірку за верхню частину і злегка похитуючи.
Не нахилятися над пробіркою, тому що бризки можуть потрапити у вічі.
Пробірку з рідиною, що нагрівається, тримати отвором у бік від себе і від товаришів, так як рідина іноді може виплеснутися з пробірки.
При нагріванні пробірки не торкатися гніт спиртування, так як гніт холодний і пробірка може луснути.
Гаряче спиртування не можна переносити зі столу на стіл.
Запалювати спиртування тільки сірниками.
Гасити спиртування тільки ковпачком.
Після роботи упорядкувати своє робоче місце.
Досвід. Якісні реакції на неорганічні речовини.
Завдання: у трьох пронумерованих пробірках (1, 2, 3) дано речовини:
ХЛОРИД АМОНІЮ
СОЛЯНА КИСЛОТА
СУЛЬФАТ НАТРІЮ
За допомогою характерних реакцій розпізнати, в якій із пробірок є дані речовини.
Для виконання цього досвіду, вміст кожної пронумерованої пробірки розділити на три проби.
1. Для визначення хлориду амонію – у пробірку з хлоридом амонію долити розчин гідроксиду натрію, нагріти в полум'ї спиртування.
Що спостерігаєте?
2. Для визначення соляної кислоти – в пробірку із соляною кислотою долити розчин нітрату срібла.
Що спостерігаєте?
Написати рівняння реакції у молекулярній, повній іонній, скороченій іонній формах.
3. Для визначення сульфату натрію - в пробірку із сульфатом натрію долити розчин хлориду барію.
Що спостерігаєте?
4. Написати рівняння реакції у молекулярній, повній іонній, скороченій іонній формах.
Перегляд вмісту документа
«Практична робота №1-1»
Практична робота №1
Мета роботи :
Обладнання та реактиви:прилад для отримання газів, пробірки (2 шт.), штатив для пробірок, шпатель, хімічний стакан, лучинка, сірники, мармур (СаСО 3), вапняна вода (Са(ОН) 2), HCl (1:2).

Техніка безпеки: 


Хід роботи :
| Дії | Спостереження | Рівняння реакцій. Висновки |
| Одержання вуглекислого газу  | CaCO 3 + HCl → |
|
|
Перенесіть кінець газовідвідної трубки в пробірку з 1 мл вапняної води та пропускайте вуглекислий газ. Запишіть рівняння відповідних реакцій. | Ca(OH) 2 + CO 2 → |
Висновок :
Перегляд вмісту документа
«Практична робота №1-2»
Практична робота №1
«Отримання, збирання та розпізнавання газів»
Мета роботи :
Обладнання та реактивиКабіна: пробірки (3 шт.), спиртовка, сірники, штатив, газовідвідна трубка, хлорид амонію (кристалічний), гідроксид кальцію (кристалічний), стаканчик з водою, індикаторний папір, вата.


Техніка безпеки
: 




Хід роботи :
| Дії | Спостереження | Рівняння реакцій. Висновки |
|
| NH 4 Cl + Ca (OH ) 2 → NH 4 OH↔ |
Висновок :
Перегляд вмісту документа
«Практична робота №1-3»
Практична робота №1
«Отримання, збирання та розпізнавання газів»
Мета роботи :
Обладнання та реактиви:пробірки (2 шт.), штатив для пробірок, шпатель, лучинка, сірники, перманганат калію (KMnO 4), індикаторний папір.





Техніка безпеки: 
Хід роботи :
| Дії | Спостереження | Рівняння реакцій. Висновки |
| Отримання кисню Одержання кисню.  | KMnO 4 → |
|
| Збирання та розпізнавання вуглекислого газу Наповнювати газом пробірку протягом 1 хв. Внести палаючу лучинку в склянку. Спостерігати зміни. | CxHy+O 2 → |
Висновок :
Перегляд вмісту документа
«Практична робота №1»
Практична робота №1.
«Отримання, збирання та розпізнавання газів».
Цілі уроку:перевірити правильність засвоєння знань про газоподібні речовини, способи їх отримання та розпізнавання; продовжити формувати вміння проводити експеримент, спостерігати та робити висновки з побаченого.
Обладнання:комп'ютер, презентація уроку, пробірки, спиртування, сірники, лучинки, скляні трубки; розчини: соляної кислоти, оцтової кислоти, пероксиду водню, вапняної води; цинк, мармур,
Хід уроку.
I. Підготовка до уроку(Перевірити готовність до уроку груп учнів, обладнання, класу; відзначити в журналі відсутніх учнів; повідомити тему та цілі уроку).
ІІ. Інструктаж з техніки безпеки.
1. Який вплив на шкіру людини та тканину чинять кислоти? (При попаданні на шкіру людини або тканину кислоти руйнують їх).
2. Який вплив на шкіру людини та тканину чинять луги? (При попаданні на шкіру людини чи тканину, луги руйнують їх).
3. Отже, як необхідно поводитися з кислотами та лугами? (Кислоти та луги необхідно брати трубкою і лише у потрібній кількості).
4. Від чиєї спиртівки можна запалити свою? (Спиртівку не можна запалювати від іншого спиртування. Її можна запалювати тільки сірником).
Нагадую, що поводитися зі скляним посудом потрібно дуже обережно, щоб не розчавити чи розбити його. Сколи при руйнуванні скляного посуду є дуже гострими і можуть викликати дуже глибокі порізи.
ІІІ. Інструктаж роботи.
Практичну роботу ви виконуватимете за інструкцією.
Відповідно до вашого варіанта, дайте назву практичної роботі, сформулюйте мету, визначте обладнання та реактиви. При оформленні роботи обов'язково описуєте свої дії та спостереження, записуєте рівняння хімічних реакцій, робите малюнок установки для отримання зазначеного газу, записуєте висновок по роботі.
Після закінчення роботи навести лад на робочому місці.
IV. Виконання роботи.
«Отримання, збирання та розпізнавання кисню».
«Отримання, збирання та розпізнавання вуглекислого газу».
«Отримання аміаку»
Повторіть правила безпечної роботи з лугами. Дотримуйтесь цих правил у процесі проведення хімічного експерименту.
Отримання, збирання та розпізнавання аміаку
1) Помістіть у ступку по дві ложки-дозатора хлорид амонію та гідроксиду кальцію кожного. Розітріть суміш маточкою. Що відчуваєте?
2) Зберіть прилад для одержання аміаку: наберіть у суху пробірку не більше ¼ її висоти приготовленої суміші, закрийте пробірку пробкою з газовідвідною трубкою, зміцніть пробірку в лапці штатива з невеликим нахилом до пробки. Надягніть суху пробірку для збирання аміаку на газовідвідну трубку, спрямовану вгору. 
3) Нагрівайте пробірку із сумішшю.
4) Піднесіть вологий індикаторний папірець до отвору пробірки з аміаком. 
5) Припиніть нагрівання. Зніміть пробірку з аміаком, не перевертаючи її, опустіть отвором вниз у склянку з водою. Закрийте кінець газовідвідної трубки вологим тампоном.
Перегляд вмісту документа
«Практичні роботи 11 клас обладнання та реактиви»
Практичні роботи 11 клас
| Назва роботи | Обладнання та реактиви |
|
| Отримання та розпізнавання газів | Обладнання:штатив з пробірками, спиртування, сірники, лучинки, скляні газовідвідні трубки, вата, шпатель. Реактиви:розчини: соляної кислоти, оцтової кислоти, пероксиду водню, вапняної води; цинк, мармур., хлорид амонію, гідроксид кальцію кристалічний, індикаторний папір, перманганат калію. |
|
| Ідентифікація неорганічних речовин | Устаткування : штатив з пробірками, спиртування, сірники, тримач для пробірок. Реактиви : розчини: хлориду амонію, сульфату натрію, гідроксиду натрію, хлориду барію, соляної кислоти; синій лакмусовий папір, цинк, нітрат срібла. |
«Практичні роботи з курсу органічної хімії 11 класу»
Практична робота № 1
«Визначення якісного складу органічної речовини»
Мета роботи : навчитися визначати наявність вуглецю та водню у складі органічних речовин.
Обладнання та реактиви Кабіна: лабораторний штатив з лапкою, пробірка, пробка з газовідвідною трубкою, додаткова пробірка, скляна трубочка, спиртовка, сірники, парафін, оксид міді (II), безводний сульфат міді (II), гідроксид кальцію (вапняна вода).
Хід роботи.
Опис досвіду
Спостереження
Висновки та рівняння реакцій
Досвід №1 «Окислення парафіну
У суху пробірку поклали 0,5 г парафіну та 1 г оксиду міді (II). Зміцнили пробірку в лапці штатива у горизонтальному положенні. Поклали неподалік отвору пробірки трохи безводного сульфату міді (II ) за допомогою скляної трубочки. Закрили пробірку пробкою із газовідвідною трубкою, кінець якої занурили в іншу пробірку з 1, 5 – 2 мл вапняної води.
Вміст пробірки із сумішшю нагріли в полум'ї спиртування, попередньо розплавивши парафін.
оксидом
міді ( II)»
Висновок:
C 18 H 38 + CuO →
Досвід №2 «Визначення вуглецю»
Газоподібні продукти розкладання парафіну пропустили через розчин вапняної води.
Висновок:
CO 2 + Ca(OH) 2 →
Досвід №3 «Визначення водню»
Продукти розкладання парафіну пропустили через безводний сульфат міді (II).
Висновок:
H 2 O + CuSO 4 →
Загальний висновок:
Практична робота № 2
«Отримання та вивчення властивостей етилену»
Мета роботи : отримати етилен та вивчити його властивості, провести якісні реакції на подвійний зв'язок.
Обладнання та реактиви : лабораторний штатив з лапкою, пробірка, пробка з газовідвідною трубкою, дві додаткові пробірки, спиртовка, сірники, осколки порцелянового посуду, етиловий спирт C 2 H 5 OH , сірчана кислота H 2 SO 4 ,
бромна вода Br2, розчин перманганату калію KMnO4.
Хід роботи
Опис досвіду
Спостереження
Висновки та рівняння реакцій
Досвід № 1 «Отримання етилену
У суху пробірку налили 1 мл спирту етилового і додали 3 мл конц.сірчаної кислоти. Поклали в суміш кілька шматочків битої порцеляни для рівномірного кипіння. Закрили пробірку пробкою з газовідвідною трубкою та зміцнили пробірку в лапці штатива в горизонтальному положенні.
Вміст пробірки із сумішшю обережно нагріли в полум'ї спиртування до кипіння.
дегідратацією
етилового спирту»
Висновок:
Досвід №2 «Взаємодія етилену
Не припиняючи нагрівання суміші, опустили кінець газовідвідної трубки пробірку з бромною водою і пропустили через неї етилен.
з бромною
водою»
Висновок:
Досвід №3 «Взаємодія етилену
Не припиняючи нагрівання суміші, опустили кінець газовідвідної трубки пробірку з підкисленим розчином перманганату калію малинового кольору і пропустили через нього етилен.
з розчином
перманганату калію»
Висновок:
Досвід № 4 «Горіння етилену»
Не припиняючи нагрівання суміші, повернули газовідвідну трубку вгору і підпалили етилен, що виділяється, за допомогою сірника.
Висновок:
Загальний висновок:
Практична робота № 3
«Рішення розрахункових та якісних завдань на тему «Генетичний зв'язок між вуглеводнями, спиртами, альдегідами, карбоновими кислотами»
Мета роботи : на основі знання хімічних властивостей вуглеводнів та їх кисневмісних похідних навчитися вирішувати розрахункові та якісні завдання на здійснення генетичного зв'язку органічних речовин.
Обладнання та реактиви Кабіна: штатив для пробірок, пробірки, промивалка, склянка для зливання, спиртовка, сірники, пробіркотримач, CuSO 4 , NaOH , мідний дріт, метанол, етанол, формалін.
Хід роботи:
Опис дослідів
Спостереження
Висновки та рівняння реакцій
Досвід №1«Отримання альдегідів з
а) Змочили етиловим спиртом стінки сухої пробірки. Нагріли в полум'ї мідний дріт до появи чорного нальоту. Розжарений дріт опустили у підготовлену пробірку. Повторили.
спиртів»
Висновок:
б) Змочили метиловим спиртом стінки сухої пробірки. Нагріли в полум'ї мідний дріт до появи чорного нальоту. Розжарений дріт опустили у підготовлену пробірку. Повторили.
Висновок:
Досвід № 2 « Одержання карбонових
У пробірку внесли 8 крапель формаліну, додали до нього 8 крапель NaOH і при струшуванні по краплях CuSO 4 до появи осаду, що не зникає. Нагріли до кипіння.
кислот з
альдегідів»
Висновок:
Загальний висновок:
Практична робота № 4
«Якісні реакції на кисневмісні органічні речовини»
Мета роботи : з урахуванням знання якісних реакцій навчитися вирішувати експериментальні завдання розпізнавання органічних речовин.
Обладнання та реактиви Кабіна: штатив для пробірок, пробірки, колба з водою, склянка для зливання, спиртовка, сірники, пробіркотримач, CuSO 4 , NaOH , мідний дріт, метилоранж, органічні речовини в пробірках.
Завдання:У чотирьох пронумерованих пробірках видано розчини: етанолу, формаліну, гліцерину та оцтової кислоти. Досвідченим шляхом визначте кожну з виданих речовин.
Хід роботи:
Опис досвіду
Спостереження
Висновки та рівняння реакцій
Досвід №1" Взаємодія з У чотирьох пробірках отримали гідроксид міді (II) при взаємодії сульфату
міді ( II ) з гідроксидом натрію та прилили до нього речовини № 1, 2, 3, 4. Перемішали.
гідроксидом
міді ( II)»
Висновок:
Досвід № 2 « Взаємодія з
Пробірки з речовинами №? та №? і гідроксидом міді (II ) з досвіду № 1 зміцнили в пробіркотримачі та нагріли в полум'ї спиртування.
гідроксидом
міді ( II ) при нагріванні »
Висновок:
Досвід № 3 « Визначення
У пробірку налили 1 мл розчину речовини № ? і додали 1 краплю метилоранжу.
оцтовий
кислоти»
Висновок:
Досвід № 4 « Визначення
У пробірку налили 1 мл розчину речовини № ? Мідний дріт прогріли в полум'ї спиртування до появи чорного нальоту і опустили в досліджувану речовину.
етанолу»
Висновок:
Практична робота «Розпізнавання органічних речовин».
Ціль:повторити якісні реакції, притаманні органічних речовин, закріпити навички хімічного експерименту.
Реактиви та обладнання:досліджувані речовини (гліцерин, крохмаль, лимонна кислота, глюкоза), вода, аміачний розчин оксиду срібла, сульфат міді, гідроксид натрію, йод, спиртування, сірники, пробірки, тримач для пробірок.
Хід роботи
Завдання №1.Визначте видані вам речовини шляхом якісних реакцій.Оформіть результати та сформулюйте висновки.
| Визначається речовина | Результати якісної реакції |
|
| 1. Гліцерин CH 2 -CH-CH 2 / / / OH OH OH | Cu(OH) 2 | Яскраво-синій розчин гліцерату міді |
| 2.Крахмал (C 6 H 10 O 5 )n | Розчин йоду | Розчин синього кольору |
| 3.Лімонна кислота | а) Універсальний індикатор. Б) Метал В)Na 2CO 3 | A )Універсальний індикатор стає червоним Б) Виділяється газ В)Виділяється газ |
| 4.Глюкоза C 6 H 12 O 6 | Cu(OH) 2 Ag 2 O | Червоний осад Відновлення срібла з оксиду |
Завдання №2.Відповідайте на запропоновані питання.
1.Які речовини утворюються в результаті гідролізу крохмалю?
2.Як довести досвідченим шляхом, що видана вам речовина-це оцтова кислота?
3.Чому сахароза не дає реакцію срібного дзеркала?
Висновки:
«Практична робота №2»
Практична робота
«Реакція іонного обміну. Гідроліз солей»
Мета роботи:закріпити навички складання реакцій іонного обміну, повторити ознаки перебігу реакцій іонного обміну остаточно. Закріпити поняття «гідроліз солей». Досвідченим шляхом досліджувати РН розчинів солей. Закріпити навички хімічного експерименту, повторити правила техніки безпеки.
Хід роботи
Завдання №1.Проведіть експеримент між розчинами електролітів. Позначте явища, що спостерігаються.
А)Na 2 CO 3 та H 2 SO 4 (газ)
Б)BaCl 2 і H 2SO 4 (осад б.ц.)
В)NaOH та CuSO 4 (осад г.ц.)
Г) NaOH та H 2SO 4(вода)
Складіть рівняння у молекулярному та іонному вигляді.
Завдання №2.Гідроліз розчинів солей.
Випробуйте розчини солей універсальним індикатором. Визначте РН розчину солі, середовище зміни кольору універсального індикатора.
Гідроліз розчинів солей.
А) Na 2CO 3
Б) NH 4Cl
В) FeCl 3
Результати оформіть у таблицю.
| Na 2 CO 3 | NH 4 Cl | FeCl 3 |
|
| Заснування | |||
| Універсальний індикатор |
Складіть рівняння реакцій гідролізу та запишіть висновок.
Наведіть своє робоче місце в порядок.
Висновки:
Перегляд вмісту документа
«Практична робота №3»
Практична робота «Якісний аналіз органічних сполук»
Інструкція до роботи
Мета роботи:виробити навички щодо якісного визначення вуглецю, водню та хлору в органічних сполуках
Обладнання, матеріали:парафінова свічка, тримач для пробірок, пробірки, хімічна склянка, мідна спіраль, спиртування, дихлоретан.
Завдання №1 Якісне визначення вуглецю в органічних сполуках.
Засвітіть парафінову свічку. Внесіть чисту пробірку в полум'я свічки. Що ви спостерігаєте? Поясніть результати досвіду.
Завдання №2 Якісне визначення водню в органічних сполуках.Накрийте чистою сухою склянкою свічку, що горить. Що ви спостерігаєте? Поясніть результати досвіду.
Завдання №3 Якісне визначення хлору в органічних сполуках.
Мідну спіраль прожарити на полум'ї спиртівки та внести до хлоропохідного алкану.
Потім знову внести у полум'я спиртування. Що ви спостерігаєте?
Результати дослідів запишіть до таблиці. Сформулюйте та запишіть висновок.
| Що робили? | Що спостерігали? | ||
Практичні роботи з хімії
8 клас
Практична робота №1 «Прийоми поводження з лабораторним обладнанням»
Інструктаж з техніки безпеки.
Лабораторне обладнання
1. Пристрій та принцип роботи лабораторного штатива (намалювати штатив, позначити його складові)
2. Пристрій та принцип роботи спиртування (намалювати спиртування, позначити його складові)
3.Посуд (намалювати пробірки, колби, хімічну склянку)
4.Фільтрування:
1. приготувати фільтрувальний папір;
2. змочити фільтрувальний папір;
3. вкласти у вирву;
4. рідину наливають, по скляній паличці, спрямовуючи її на стінку вирви;
5. фільтрат, стікає по стінці склянки, а не в центр, щоб не виплескувався.
Знайти у тексті визначення фільтрату, осаду та процесу фільтрування.
Практична робота № 2«Спостереження за свічкою, що горить»
Досвід 1 . Фізичні явища при горінні свічки
Засвітіть свічку. Ви побачите, як починає танути парафін біля ґнота, утворюючи круглу калюжку. Який процес (фізичний чи хімічний) тут має місце?
Візьміть щипцями тигельними зігнуту під прямим кутом скляну трубку, один кінець її внесіть в середню частину полум'я, а інший опустіть в пробірку. Що ви спостерігаєте?
1. Парафін тане. Це плавлення – фізичний процес.
2. Стінки пробірки пітніють – це конденсація – фізичний процес.
Досвід 2 . Виявлення продуктів горіння у полум'ї
Візьміть щипцями тигельними шматочок жерсті (2x2 см) від консервної банки або предметне скло, внесіть в зону темного конуса палаючої свічки і потримайте 3-5 с. Швидко підніміть жерсть (скло), подивіться на нижню площину. Поясніть, що з'явилося.
Суху пробірку закріпіть у тримачі, переверніть дном догори і потримайте над полум'ям до запотівання. Поясніть явище, що спостерігається.
У ту ж пробірку швидко налийте 2-3 мл вапняної води. Що спостерігаєте? Дайте пояснення.
1. З'явилася темна (чорна) пляма - це сажа (вуглець), що утворився при горінні парафіну.
2. На стінках пробірки конденсується волога. Це конденсується вода, один із продуктів горіння парафіну.
3. При приливанні пробірку вапняної води вона каламутніє:
Це свідчить, що другим продуктом горіння парафіну є вуглекислий газ.
Досвід 3 . Вплив повітря на горіння свічки
Вставте скляну трубку з відтягнутим кінцем у гумову грушу, стискаючи її рукою, продуйте в полум'я свічки повітря. Як змінилася яскравість полум'я?
Прикріпіть дві свічки за допомогою розплавленого парафіну до картону (фанера, оргаліт). Засвітіть їх і накрийте одну півлітровою банкою, іншу – дволітровою (можна взяти хімічні склянки різної місткості). У якому разі свічка горить довше? Чому?
Запишіть рівняння реакцій горіння, якщо речовини, з яких складається свічка, мають формули С 16 Н 34 і 17 H 36 .
1. Яскравість полум'я збільшилася, оскільки збільшився потік кисню.
2. Свічка у більшій банці горить довше, тому що в ній більше кисню.
Практична робота № 3«Аналіз ґрунту та води»
Досвід 1. Механічний аналіз ґрунту
У пробірку помістіть ґрунт (стовпчик ґрунту має бути 2-3 см). Прилийте дистильовану воду, об'єм якої повинен бути в 3 рази більший за об'єм грунту.
Закрийте пробкою пробірку і ретельно струшуйте 1-2 хв, а потім озброїться лупою і спостерігайте за осадженням частинок грунту і структурою опадів. Опишіть та поясніть свої спостереження.
Спочатку осідатимуть більші та важкі частинки піску та глини, потім дрібніші, але розчин ще дуже довго буде каламутним – найдрібніші частинки знаходяться у зваженому стані.
Досвід 2. Отримання ґрунтового розчину та досліди з ним
Приготуйте паперовий фільтр, вставте його у вирву, закріплену в кільці штатива. Підставте під вирву чисту суху пробірку і профільтруйте отриману в першому досвіді суміш ґрунту та води. Перед фільтруванням суміш не слід струшувати. Грунт залишиться на фільтрі, а зібраний у пробірці фільтрат є ґрунтовою витяжкою (ґрунтовий розчин).
Декілька крапель цього розчину помістіть на скляну пластинку і за допомогою пінцету потримайте її над пальником до випаровування води. Що спостерігаєте? Поясніть.
Візьміть два лакмусові папірці (червоний і синій), нанесіть на них скляною паличкою ґрунтовий розчин. Зробіть висновок щодо результатів своїх спостережень.
1. Після випаровування води на склі залишиться білий наліт, це суміш речовин, що розчинилися у воді під час перемішування.
2. Універсальний лакмусовий папірець не змінить свій колір якщо розчин нейтральний, стане червоним, якщо він кислий, і синім якщо він лужним.
Досвід 3. Визначення прозорості води
Для досвіду потрібен прозорий скляний плоскодонний циліндр діаметром 2-2,5 см, висотою 30-35 см Можна використовувати мірний циліндр на 250 мл без пластмасової підставки.
Рекомендується провести досвід спочатку з дистильованою водою, а потім із водою з водойми і порівняти результати. Встановіть циліндр на друкований текст і вливайте воду, що досліджується, стежачи за тим, щоб можна було читати через воду текст. Позначте, на якій висоті ви не бачитимете шрифт. Виміряйте висоти стовпів води лінійкою. Зробіть висновки.
Виміряна висота називається рівнем видимості.
Якщо рівень видимості малий, значить водоймище сильно забруднене.
Досвід 4. Визначення інтенсивності запаху води
Конічну колбу наповніть на 2
/
3
об'єму досліджуваної водою, щільно закрийте пробкою (бажано скляною) і сильно струсіть. Потім відкрийте колбу та відзначте характер та інтенсивність запаху. Дайте оцінку інтенсивності запаху води у балах, користуючись таблицею 8.
Скористайся таблицею № 8 (стор. 183).
Практична робота № 4"Ознаки хімічних реакцій"
Досвід 1. Прожарювання мідного дроту та взаємодія оксиду міді (II) із сірчаною кислотою
Спаліть спиртовку. Візьміть тигельними щипцями мідний дріт і внесіть його в полум'я. Через деякий час вийміть дріт із полум'я і зчистіть з нього чорний наліт, що утворився, на аркуш паперу. Досвід повторіть кілька разів. Помістіть отриманий чорний наліт у пробірку і прилийте розчин сірчаної кислоти. Підігрійте суміш. Що спостерігаєте?
Чи утворилася нова речовина під час розжарювання міді? Запишіть рівняння хімічної реакції та визначте її тип за ознакою числа та складу вихідних речовин та продуктів реакції. Які ознаки хімічної реакції ви спостерігали? Чи утворилася нова речовина при взаємодії оксиду міді (II) із сірчаною кислотою? Визначте тип реакції за ознакою числа та складу вихідних речовин та продуктів реакції та запишіть її рівняння.
1. При прожарюванні мідного дроту мідь окисляться та утворюється чорний оксид міді (II). Це реакція сполуки.
2. Оксид міді (II), що утворився, розчиняється в сірчаній кислоті, розчин стає блакитного кольору, утворюється сульфат міді (II):
Це реакція обміну.
Досвід 2. Взаємодія мармуру із кислотою
Покладіть у невелику склянку 1-2 шматочки мармуру. Прилийте в склянку стільки соляної кислоти, щоб нею вкрилися шматочки. Запаліть лучинку і внесіть її в склянку.
Чи утворилися нові речовини під час взаємодії мармуру з кислотою? Які ознаки хімічних реакцій ви спостерігали? Запишіть рівняння хімічної реакції та вкажіть її тип за ознакою числа та складу вихідних речовин та продуктів реакції.
1. Мармур розчинився в соляній кислоті, відбулася хімічна реакція:
Досвід 3. Взаємодія хлориду заліза (III) з роданідом калію
У пробірку налийте 2 мл розчину хлориду заліза (III), а потім кілька крапель розчину роданіду калію KSCN - солі кислоти HSCN з кислотним залишком SCN-
.
Якими ознаками супроводжується ця реакція? Запишіть її рівняння та тип реакції за ознакою числа та складу вихідних речовин та продуктів реакції.
Розчин став яскраво-червоним, утворився роданід заліза (III).Це реакція обміну.
Досвід 4. Взаємодія карбонату натрію із хлоридом кальцію
У пробірку налийте 2 мл карбонату розчину натрію. Потім додайте кілька крапель розчину кальцію хлориду. Що спостерігаєте? Запишіть рівняння хімічної реакції та вкажіть її тип за ознакою числа та складу вихідних речовин та продуктів реакції.
Спостерігається виділення білого кристалічного осаду барію сульфату. Це реакція обміну.
Практична робота № 5«Приготування розчину цукру та визначення масової частки його в розчині»
Відміряйте мірним циліндром 50 мл дистильованої води і влийте її в конічну колбочку ємністю 100 мл.
Чайну ложку цукрового піску (або два шматочки) зважте на лабораторних вагах, потім помістіть в колбочку з водою і перемішуйте скляною паличкою до повного розчинення.
Тепер приступайте до розрахункової частини. Спочатку розрахуйте масову частку цукру у розчині. Необхідні дані у вас є: маса цукру, об'єм води, щільність води прийміть 1 г/мл.
9 клас
Практична робота №1«Здійснення ланцюжка хімічних перетворень»
Проведіть реакції, у яких здійснюються запропоновані нижче хімічні перетворення (за варіантами).
Складіть рівняння відповідних реакцій. Реакцію іонного обміну запишіть також у іонній формі.
Варіант 1.
Проведемо такі перетворення:
Варіант 2.
Варіант 3.
Варіант 3.
Практична робота № 2«Отримання та властивості сполук металів»
Завдання 1
У математиці діє правило - «від зміни місць доданків сума не змінюється». Чи справедливо воно для хімії? Перевірте це з прикладу наступного досвіду.
Отримайте гідроксид алюмінію за реакцією обміну та доведіть його амфотерний характер. Для цього ви можете використовувати реакцію, рівняння якої
Проведіть цю реакцію у двох варіантах, використовуючи у кожному варіанті однакові обсяги вихідних речовин: спочатку до розчину однієї з вихідних речовин (реагенту) додайте по краплях розчин іншого реагенту, потім поміняйте послідовність введення реакцію. Спостерігайте, у якому разі випаде осад, а в якому – ні.
Поясніть результати та запишіть рівняння проведених реакцій у молекулярній та іонній формах.
Завдання 2
Проведіть реакції, що підтверджують якісний склад кальцію хлориду. Запишіть рівняння реакцій у молекулярній та іонній формах.
Завдання 3
Здійсніть перетворення згідно з наступною схемою 1
:
1
Для здійснення другого перетворення використовуйте хлорну воду.
Напишіть рівняння відповідних реакцій та розгляньте їх з позицій окислення-відновлення. Проведіть якісні реакції, які б підтверджували наявність продуктів реакцій. Запишіть рівняння реакцій у молекулярній та іонній формах.
Завдання 4
Отримайте сульфат заліза (II) щонайменше трьома способами. Рівняння реакцій іонного обміну запишіть у іонній та молекулярній формах, а реакції заміщення розгляньте з позицій окислення-відновлення.
Завдання 5
Проведіть реакції, що підтверджують якісний склад сульфату заліза (ІІ). Запишіть рівняння відповідних реакцій у молекулярній та іонній формах.
Практична робота № 3«Експериментальні завдання з розпізнавання та отримання речовин»
У виданих три пробірках (варіанти 1, 2 або 3) містяться тверді речовини, а в трьох інших (варіант 4) розчини речовин.
Досвідченим шляхом визначте, в якій пробірці є кожна з виданих вам речовин. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Після цієї частини роботи виконайте одну-дві експериментальні завдання з наступного переліку (за вказівкою вчителя).
Варіант 1
а) гідроксид натрію;
б) карбонат калію;
в) хлорид барію.
Варіант 2
а) карбонат кальцію;
б) сульфат натрію;
в) хлорид калію.
Варіант 3
а) нітрат барію;
б) сульфат натрію;
в) карбонат кальцію.
Варіант 4
а) хлорид натрію;
б) хлорид алюмінію;
в) хлорид заліза (ІІІ).
Завдання 1. Доведіть досвідченим шляхом, що залізний купорос, зразок якого вам виданий, містить домішок сульфату заліза (III). Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 2. Отримайте оксид заліза (III), виходячи із хлориду заліза (III). Напишіть рівняння відповідних реакцій, а рівняння реакції за участю електроліту та в іонному вигляді.
Завдання 3. Отримайте розчин натрію алюмінію, виходячи з хлориду алюмінію. Запишіть рівняння виконаних реакцій у молекулярному та іонному видах.
Завдання 4. Отримайте сульфат заліза (II), виходячи із заліза. Запишіть рівняння виконаних реакцій і розберіть окисно-відновні процеси.
Практична робота № 4Експериментальні завдання на тему «Підгрупа кисню»
Завдання 1.Проведіть реакції, що підтверджують якісний склад сірчаної кислоти. Напишіть рівняння реакцій.
Завдання 2. У пробірку помістіть 1-2 гранули цинку і прилийте до неї близько 1 мл розведеної сірчаної кислоти. Що ви спостерігаєте? Напишіть рівняння реакції та розгляньте окислювально-відновні процеси.
Завдання 3. Налийте у дві пробірки розчин сульфіду натрію. Прилийте в одну з них хлорну воду, а в іншу – бромну воду. Що ви спостерігаєте? Поясніть свої спостереження. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Хлорна та бромна вода – окислювачі, тому в обох пробірках сульфід окислиться до сірки. Розчини знебарвлюються.
Завдання 4. Вам видано три пробірки із розчинами. Визначте, в якій із них знаходиться соляна кислота, сірчана кислота та гідроксид натрію. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 5. Визначте, чи містить кухонна сіль домішка сульфатів. Напишіть рівняння реакцій у молекулярному та іонному видах.
Завдання 6. За допомогою характерних реакцій встановіть, чи є видана вам сіль сульфатом, йодидом або хлоридом. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 7. Виходячи з оксиду міді (II), отримайте розчин сульфату міді (II) і виділіть із нього кристалічний мідний купорос. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 8. Вам видано три пробірки з розчинами сульфату, сульфіту та сульфіду натрію. Визначте за допомогою лише одного реактиву, в якій пробірці знаходиться кожна речовина. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Практична робота № 5Експериментальні завдання на тему «Підгрупи азоту та вуглецю»
Завдання 1.Проведіть реакції, за допомогою яких можна довести, що видана вам у закритих судинах речовина є:
а) хлоридом амонію;
б) карбонатом натрію;
в) нітратом амонію;
г) нашатирним спиртом;
д) карбонатом кальцію;
е) силікатом натрію.
Завдання 2. Доведіть досвідченим шляхом, що сульфат амонію та нітрат амонію не можна змішувати з вапном перед внесенням цих добрив у ґрунт, і поясніть чому. Напишіть рівняння реакцій.
Завдання 3. Доведіть досвідченим шляхом, що:
а) до складу хлориду амонію входять іони NH 4 + і Cl -;
б) до складу сульфату амонію входять іони NH 4 + та SO 4 2- .
Напишіть рівняння проведених реакцій у молекулярному та іонному видах.
Завдання 4. Отримайте аміак з наступних солей:
а) хлориду амонію;
б) сульфату амонію;
в) нітрат амонію.
Напишіть рівняння проведених реакцій у молекулярному та іонному видах.
Завдання 5. Проведіть реакції, що виражаються скороченими іонними рівняннями.Напишіть рівняння проведених реакцій у молекулярному та іонному видах.
Завдання 6. У чотирьох пробірках вам видано кристалічні речовини: сульфат натрію, хлорид цинку, карбонат калію, силікат натрію. Визначте, яка речовина знаходиться у кожній пробірці. Складіть рівняння реакцій у молекулярному та іонному видах.
Практична робота № 6
Варіант 1.
Досвід 1. Отримання, збирання та розпізнавання водню
Зберіть прилад для отримання газів та перевірте його на герметичність. У пробірку покладіть 1-2 гранули цинку і прилийте до неї 1-2 мл соляної кислоти. Закрийте пробірку пробкою з газовідвідною трубкою (див. мал. 43) і надягніть на кінчик трубки ще одну пробірку. Зачекайте деякий час, щоб пробірка заповнилася газом, що виділяється.
Зніміть пробірку з воднем і, не перевертаючи її, піднесіть до гарячої спиртівки. Якщо водень вибухає з глухою бавовною, то він чистий, а якщо з звуком, що «гавкає», значить, водень зібраний у суміші з повітрям («гримучий газ»).
Запитання та завдання
1. Що відбувається при взаємодії цинку із соляною кислотою? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Розгляньте записану реакцію з погляду процесів окислення-відновлення.
3. Опишіть фізичні властивості водню, які безпосередньо спостерігаються при проведенні досвіду.
4. Опишіть, як можна розпізнати водень.
Досвід 2. Отримання, збирання та розпізнавання аміаку
Зберіть прилад, як показано на малюнку 113, та перевірте його на герметичність.
У фарфорову чашку насипте хлорид амонію та гідроксид кальцію об'ємом по одній ложці для спалювання речовин. Суміш перемішайте скляною паличкою та висипте в суху пробірку. Закрийте її пробкою і зміцніть в лапці штатива (зверніть увагу на нахил пробірки щодо отвору!). На газовідвідну трубку надягніть суху пробірку для збирання аміаку.
Пробірку із сумішшю хлориду амонію та гідроксиду кальцію прогрійте спочатку всю (2-3 рухи полум'я), а потім у тому місці, де знаходиться суміш.
Для виявлення аміаку піднесіть до отвору перевернутої вгору дном пробірки вологий фенолфталеїновий папірець.
Припиніть нагрівання суміші. Пробірку, в якій зібрано аміак, зніміть із труби з газовідвідом. Кінець газовідвідної трубки відразу ж закрийте шматочком мокрої вати.
Негайно закрийте отвір знятої пробірки великим пальцем і опустіть у посудину з водою. Палець відніміть лише під водою. Що ви спостерігаєте? Чому вода піднялася у пробірці? Закрийте пальцем отвір пробірки під водою і вийміть з посудини. Додайте в пробірку 2-3 краплі розчину фенолфталеїну. Що спостерігаєте?
Проведіть аналогічну реакцію між розчинами лугу та солі амонію при нагріванні. Піднесіть до отвору пробірки вологий індикаторний папірець. Що спостерігаєте?
Запитання та завдання
1. Що відбувається при взаємодії хлориду амонію та гідроксиду кальцію? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Опишіть фізичні властивості аміаку, які безпосередньо спостерігаються в досвіді.
3. Опишіть щонайменше два способи розпізнавання аміаку.
Варіант 2.
Досвід 1. Отримання, збирання та розпізнавання кисню
Зберіть прилад, як показано на малюнку 114, та перевірте його на герметичність. У пробірку насипте приблизно на ¼ її об'єму перманганату калію KMnO 4 і біля отвору пробірки покладіть пухку грудочку вати. Закрийте пробірку пробкою із газовідвідною трубкою. Зміцніть пробірку в лапці штатива так, щоб кінець газовідвідної трубки доходив майже до дна судини, в якій збиратиметься кисень. Наявність кисню в посудині перевірте тліючою лучинкою.
Запитання та завдання
1. Що відбувається при нагріванні перманганату калію? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Розгляньте записану реакцію з погляду процесів окислення-відновлення.
3. Опишіть фізичні властивості кисню, які безпосередньо спостерігаються в досвіді.
4. Опишіть, як ви розпізнавали кисень.
Досвід 2. Отримання, збирання та розпізнавання оксиду вуглецю (IV)
У пробірку помістіть кілька шматочків крейди або мармуру і налийте 1-2 мл розведеної соляної кислоти. Швидко закрийте пробірку пробкою із газовідвідною трубкою. Кінець трубки опустіть в іншу пробірку, де знаходиться 2-3 мл вапняної води.
Декілька хвилин спостерігайте, як через вапняну воду проходять бульбашки газу.
Запитання та завдання
1. Що відбувається при взаємодії крейди чи мармуру із соляною кислотою? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Розгляньте проведену реакцію у світлі теорії електролітичної дисоціації.
3. Опишіть фізичні властивості оксиду вуглецю (IV), які безпосередньо спостерігаються в досвіді.
4. Напишіть, як ви розпізнавали оксид вуглецю (IV).
Ця реакція є якісною на вуглекислий газ.
11 клас
Практична робота №1«Отримання, збирання та розпізнавання газів»
Варіант 1. Отримання, збирання та розпізнавання водню
Отримайте, зберіть, розпізнайте водень і зробіть досліди, що характеризують його властивості. Складіть рівняння відповідних реакцій.
У пробірку налили трохи соляної кислоти та опустили гранулу цинку. Пробірку закрили пробкою з газовідвідною трубкою, кінець якої опустили в іншу пробірку, перевернуту вгору дном. Спостерігаємо виділення бульбашок газу водню. Через деякий час другу пробірку перевернули і піднесли обережно палаючу скіпку. Водень згоряє, на стінках пробірки конденсується вода.
Варіант 2. Отримання, збирання та розпізнавання кисню
Отримайте, зберіть, розпізнайте кисень і зробіть досліди, що підтверджують його хімічні властивості. Запишіть рівняння відповідних реакцій.
У пробірку насипали трохи перманганату калію, усередину поклали грудочку вати та закрили її пробкою із газовідвідною трубкою. Потім зміцнили пробірку на штативі так, щоб кінець трубки доходив до дна склянки, в якій збиратиметься кисень. Нагріли пробірку, зібрали повну склянку кисню (повноту склянки перевіряємо по тліючій лучині, вона спалахує) і закрили склянку картоном.
Варіант 3. Отримання, збирання та розпізнавання вуглекислого газу
Отримайте, зберіть, розпізнайте вуглекислий газ і зробіть досліди, що підтверджують його хімічні властивості. Запишіть рівняння відповідних реакцій.Взяли шматок вугілля, розжарили його в полум'ї пальника і опустили його в посудину з киснем, він спалахнув жовто-синім полум'ям.
Варіант 4. Отримання, збирання та розпізнавання етилену
У пробірку, з газовідвідною трубкою, помістили суміш, що складається з однієї частини безводного ацетату натрію і двох частин гідроксиду натрію (безводного). Пробірку закріпили на штативі горизонтально та нагріли. Газ, що виділяється, пропустили в окремі пробірки з бромом і розчином перманганату калію. Розчини не змінюють свого забарвлення. Підпалили газ, що виділяється з трубки, він горить синім полум'ям, що не світиться. У пробірку помістили трохи концентрованої сірчаної кислоти