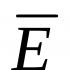Магній - важливий метал для промисловості та життя людини. Магній
Сила, тяжіння, влада так трактував слово «магнес» народ стародавньої Греції. У цій країні було місто під назвою Магнезія. Біля цих населених пунктів видобували магнітний залізняк, який, як відомо, має силу притягувати металеві предмети.
Але, метал магнійназваний над честь залізовмісної породи, а честь порошку «біла магнезія». Його греки отримували з мінералу, який також був біля стародавнього поселення. Після прожарювання камінь перетворювався на білий порошок. окис магнію. Про те, що речовині метал греки не знали, зате помітили лікувальні властивості складу. Він допомагав при хворобах печінки, нирок, грав роль проносного.
Препарат не виходив з ужитку століттями і, в 1808 році Гефрі Деві виділив з нього в ході дослідів невідомий метал. Довго не думаючи, вчений із Англії назвав відкритий елемент магнезій. Так його й досі називають у Європі. Росіяни ж називають метал магніємзавдяки підручнику Герману Гессу. Незважаючи на німецьке коріння, хімік російський. 1831-го він перекладав західний підручник. Слово "магнезій" вчений перетворив на "магній". Так, у вітчизняній науці елемент і отримав особливу назву.
У періодичній таблиці хімічних елементів Магнійзаймає 12 позицію. Він знаходиться в основній підгрупі групи під номером два. Білий елемент з сріблястими відблисками. Таке забарвлення характерне для всіх лужно - земельних металів, до яких поряд зі стронцієм, радієм і барієм, відноситься і магній. Він "пушинка" серед металів. Наприклад, залізо і мідь майже вп'ятеро важче. Навіть легкий алюміній перетягне елемент №12 на чаші.

Легкість магнію на руку конструкторам та виробникам літальних апаратів. Вони не повинні бути великоваговими, щоб мати гарні літальні властивості. Проте використовувати для тих самих літаків чистий метал №12 не можна. Він надто м'який, податливий.
Доводиться виготовляти сплави з марганцем, алюмінієм або. Вони надають марганцю міцність, при цьому не сильно обтяжуючи. Суміші йдуть переважно на виробництво обшивки «залізних птахів». Перший літак на основі магнієвих сплавів, до речі, справа рук вітчизняних авіатехніків. Судно створили ще 1934-го року і назвали «Серго Орджонекідзе».
Елемент магнійдуже проблематично переплавити. Потрібно лише 650 градусів Цельсія. Однак, вже при 550 метал спалахує і розчиняється в атмосфері. Виділяється полум'я дуже ефектно, тому метал знайшов застосування в піротехнічній промисловості.
Без нього не обходиться жоден феєрверк чи бенгальський вогонь. Якщо вдома зберігається магній, краще не проливати поряд із ним хлорку. У присутності хлору 12-ий елемент спалахує навіть при температурі 25 градусів.

Продуктами горіння магнію є промені ультрафіолетового спектру та тепло. Навіть кілька грамів металу вистачить, щоб закип'ятити 200 мілілітрів води. Цього цілком достатньо, щоб попити чаю. Вчені ж із Варшави вирішили «примусити» елемент підігрівати їжу. У банки для консервів фізики вбудували магнієву стрічку. При відкритті тари, вставка спалахує, нагріваючи вміст банки. Ось такий готовий обід.
Виробляти самонагрівані консервні банки можна тисячоліттями. Поклади магніюу надрах змагаються із запасами лише 7-ми елементів. Більше тільки кремнію, кисню, заліза, алюмінію та кальцію. Метал №12 входить до складу двох сотень мінералів. З карналіту елемент видобувають у промислових масштабах.
Магній також є основною складовою магми – розпеченого шару між ядром планети та її поверхнею. У морській воді елемента №12 і зовсім 4 кілограми на кожен кубометр.
Якщо воду океанів змішати з раковинами, потовченими на порошок, вийде хлорид магнію. З нього методом електролізу можна виділити чистий метал. Але користувалися цим методом тільки під час другої світової. Видобули близько 100 тисяч тонн елемента №12 та заспокоїлися, адже переробляти ресурси морів у величезних баках справа клопітна.
Для металургії – одного з основних споживачів магнію, вистачає та його запасів у земній корі. Метал необхідний під час виробництва практично всіх сплавів. Елемент №12 зменшує вміст кисню, який різко погіршує якість продукції. Змусити магній стати частиною якогось сплаву нелегко. Через легкість він не тоне в інших металах. Через «вибухову реакцію» на повітря, спалахує на поверхні сумішей.

Металургам доводиться пресувати примхливий метал у брикети, поміщати всередину них грузила і, тільки після цього, опускати до складу для переплавки.
Легкість магнію привабила і . Вони додають елемент у дорогоцінні метали, щоб полегшити вироби. Це дуже до речі, якщо прикраса об'ємна, значних габаритів. Носити на собі неймовірний для ювелірного виробу вага хоче не кожен. Магнійприходить на допомогу.
Але, якщо ювелірна справа без магнію можлива, то життя немає. Метал магнійвходить до складу хлорофілу. Він – частина рослинності, речовина, яка відповідає за фотосинтез. Тобто, без елемента №12 було б неможливим процес перетворення вуглекислого газу на кисень. Атмосфера планети була б іншою, так що людство на Землі навряд чи з'явилося б, якби не було на ній магнію.
Цей метал і людському серцю допомагає битися не лише за рахунок постачання йому кисню. Магній необхіднийдля стабільної роботи серцевого м'яза. За статистикою, інфаркти відбуваються в основному у людей, в організмі яких недостатньо елемента №12. Тому, не завадить їсти насіння гарбуза, висівки, пити какао та чай. У цих продуктах магнію найбільше.
У нашій країні багаті родовища магнезиту розташовані на Середньому Уралі (Саткінське) та в Оренбурзькій області (Халілівське). А в районі міста Солікамська розробляється найбільше у світі родовище карналіту. Доломіт - найпоширеніший з магнійсодержащих мінералів - зустрічається в Донбасі, Московській та Ленінградській областях та багатьох інших місцях.
Отримують металевий магній двома способами - електротермічним (або металотермічним) та електролітичним. Як випливає з назв, в обох процесах бере участь електрика. Але в першому випадку його роль зводиться до обігріву реакційних апаратів, а відновлюють окис магнію, отриману з мінералів, будь-яким відновником, наприклад, вугіллям, кремнієм, алюмінієм. Цей спосіб досить перспективний, останнім часом він знаходить все більшого застосування. Однак основний промисловий спосіб отримання Mg – другий, електролітичний.
Електролітом служить розплав безводних хлоридів магнію, калію та натрію; металевий магній виділяється на залізному катоді, але в графітовому аноді розряджаються іони хлору. Процес іде у спеціальних ваннах-електролізерах. Розплавлений магній спливає на поверхню ванни, звідки його іноді вибирають вакуум-ковшем і потім розливу гот за формами. Але на цьому процес не закінчується: у такому магнії ще надто багато домішок. Тому неминучий другий етап – очищення Mg. Рафінувати магній можна двома шляхами - переплавленням і флюсами або сублімацією у вакуумі. Сенс першого методу загальновідомий: спеціальні добавки - флюси - взаємодіють з домішками і перетворюють їх на сполуки, які легко відокремити від металу механічним нут ем. Другий метод - вакуумне сублімація - вимагає більш складної апаратури, але з його допомогою отримують більш чистий магній. Лікування ведуть у спеціальних вакуум-апаратах - сталевих циліндричних ретортах. «Чорновий» метал поміщають на дно реторти, закривають її та викачують повітря. Потім нижню частину реторти нагрівають, а верхня постійно охолоджується зовнішнім повітрям. Під дією високої температури магній виганяється - переходить у газоподібний стан, минаючи рідкий. Пари його піднімаються та конденсуються на холодних стінках верхньої частини реторти. Таким шляхом можна одержувати дуже чистий метал, що містить понад 99,99% магнію.
З царства Нептуна
Але не тільки земна кора багата магнієм - практично невичерпні запаси, що постійно поповнюються, його зберігають блакитні комори океанів і морів. У кожному кубометрі морської води міститься близько 4 кг магнію. Усього ж у водах світового океану розчинено понад 64 016 т цього елемента.
Видобуток магнію
Як видобувають магній із моря? Морську воду змішують у величезних баках із вапняним молоком, приготованим із перемелених морських раковин. При цьому утворюється так зване магнезіальне молоко, яке висушується і перетворюється на хлорид магнію. Ну, а далі йдуть електролітичні процеси.
Джерелом магнію може бути не лише морська вода, а й вода солоних озер, що містить хлористий магній. У нас в країні такі озера є: у Криму – Сакське та Сасик-Сиваське, у Поволжі – озеро Ельтон та багато інших.
Для яких цілей використовують елемент №12 та його сполуки?
Магній надзвичайно легкий, і ця властивість могла б зробити його прекрасним конструкційним матеріалом, але, на жаль - чистий магнію м'який і неміцний. Тому конструктори використовують магній як сплавів його коїться з іншими металами. Особливо широко застосовуються сплави магнію з алюмінієм, цинком та марганцем. Кожен із компонентів вносить свій «пай» у загальні властивості: алюміній та цинк збільшують міцність сплаву, марганець підвищує його антикорозійну стійкість. Ну а магній? Магній надає сплаву легкість - деталі з магнієвого сплаву на 20-30% легші від алюмінієвих і на 50-75% - чавунних і сталевих... Є чимало елементів, які покращують магнієві сплави, підвищують їх жаростійкість і пластичність, роблять стійкішими до окислення. Це літій, берилій, кальцій, церій, кадмій, титан та інші.
Магнієва ракета не злетить, але...
Але є, на жаль, і «вороги» - залізо, кремній, нікель; вони погіршують механічні властивості сплавів, зменшують їх опір корозії.
Магнієві сплави знаходять широке застосування. Авіація та реактивна техніка, ядерні реактори, деталі моторів, баки для бензину та масла, прилади, корпуси вагонів, автобусів, легкових автомобілів, колеса, масляні насоси, відбійні молотки, пневмобури, фото та кіноапарати, біноклі – ось далеко не повний перелік областей застосування магнієвих сплавів.
Чималу роль грає магній у металургії. Він застосовується як відновник у виробництві деяких цінних металів - ванадію, хрому, титану, цирконію. Магній, введений у розплавлений чавун, модифікує його, тобто покращує його структуру та підвищує механічні властивості. Виливки з модифікованого чавуну успішно замінюють сталеві поковки. Крім того, металурги використовують магній для розкислення сталі та сплавів.
Властивість магнію (у вигляді порошку, дроту або стрічки) - горіти білим сліпучим полум'ям - широко використовується у військовій техніці для виготовлення освітлювальних та сигнальних ракет, трасуючих куль і снарядів, запальних бомб. Добре знайомі з магнієм фотографи: «Спокійно! Знімаю! - і яскравий спалах магнію на мить засліплює вас. Втім, у цій ролі магній виступає дедалі рідше - електрична лампа «бліц» витіснила його практично повсюдно.
Застосування магнію
І ще в одній грандіозній роботі – акумуляції сонячної енергії – бере участь магній. Він входить до складу хлорофілу, який поглинає сонячну енергію та з її допомогою перетворює вуглекислий газ та воду на складні органічні речовини (цукор, крохмаль та ін.), необхідні для харчування людини та тварин. Без хлорофілу не було б життя, а без магнію не було б хлорофілу – у ньому міститься 2% цього елемента. Чи це багато? Міркуйте самі: загальна кількість магнію в хлорофілі всіх рослин Землі становить близько 100 млрд. т! Елемент № 12 входить до складу практично всіх живих організмів.
Якщо ви важите 60 кг, то приблизно 25 г їх припадає на магній. Послугами магнію широко користується медицина: всім добре знайома «англійська сіль» MgSO 4 -7H 2 O. При прийомі внутрішньо вона служить надійним і швидкодіючим проносним, а при внутрішньом'язових або внутрішньовенних вливаннях знімає судомний стан, зменшує спазми судин. Чистий окис магнію (палена магнезія) застосовується при підвищеній кислотності шлункового соку, печії, отруєнні кислотами. Перекис магнію служить дезінфікуючим засобом при шлункових розладах.
Але медициною не обмежуються сфери застосування сполук магнію. Так, окис магнію використовують у виробництві цементів, вогнетривкої цегли, у гумовій промисловості. Перекис магнію («новозон») застосовують для відбілювання тканин. Сірчанокислий магній використовують у текстильній та паперовій промисловості, як протраву при фарбуванні, водний розчин хлориду магнію – для приготування магнезіального цементу, ксилоліту та інших синтетичних матеріалів. Карбонат магнію MgCO 3 знаходить застосування у виробництві теплоізоляційних матеріалів.
І, нарешті, ще одне широке поле діяльності магнію - органічна хімія. Магнієвий порошок використовують для зневоднення таких важливих органічних речовин, як спирт і анілін. Магнійорганічні сполуки широко застосовують при синтезі багатьох органічних речовин.
Отже, діяльність магнію у природі та народному господарстві дуже багатогранна. Але навряд чи мають рацію ті, хто думає: «все, що міг, він уже зробив». Є всі підстави вважати, що найкраща роль магнію – попереду.
 Продукти, що містять магній
Продукти, що містять магній - СИРОВИНА НА МОСТОВІЙ. За бажання магній можна видобувати навіть із... простого каменя: адже в кожному кілограмі каменю, який використовується для мощення доріг, міститься приблизно 20 г магнію. У такому процесі, щоправда, поки що немає необхідності - магній із дорожнього каменю був би надто дорогим задоволенням.
- МАГНІЙ, СЕКУНДА ТА ЕРА. Скільки містить магнію в океані? Уявімо, що з перших днів нашої ери люди почали рівномірно і інтенсивно добувати магній з морської води і до сьогодні вичерпали всі водні запаси цього елемента. Як ви вважаєте, якою має бути «інтенсивність» видобутку? Виявляється, кожну секунду протягом майже 2000 років треба було б видобувати. мільйону тонн! Адже навіть під час Другої світової війни, коли виробництво цього металу було максимальним, з морської води отримували щорічно (!) лише по 80 тис. т магнію.
- СМАЧНІ ЛІКИ. Статистика стверджує, що у жителів районів із теплішим кліматом спазми кровоносних судин трапляються рідше, ніж у жителів півночі. Медицина пояснює це особливостями харчування тих та інших. Адже відомо, що внутрішньовенні та внутрішньом'язові вливання розчинів деяких солей магнію знімають спазми та судоми. Нагромадити в організмі необхідний запас цих солей допомагають фрукти та овочі. Особливо багаті магнієм абрикоси, персики та цвітна капуста. Є він і у звичайній капусті, картоплі, помідорах.
- ОБЕРЕЖНІСТЬ HE ПОШКОДЖИТЬ. Робота зі сплавами магнію іноді завдає чимало клопоту – магній легко окислюється. Плавку та лиття цих сплавів доводиться вести під шаром шлаку - інакше розплавлений метал може спалахнути від зіткнення з повітрям.
При шліфуванні або поліруванні магнієвих виробів над верстатом обов'язково встановлюється розтруб пиловідсмоктуючого пристрою, тому що розпорошені в повітрі дрібні частинки магнію створюють вибухонебезпечну суміш.
Однак це не означає, що будь-яка робота з магнієм загрожує небезпекою пожежі або вибуху. Підпалити магній можна, тільки розплавивши його, а зробити це в звичайних умовах не так просто - велика теплопровідність сплаву не дозволить сірнику або навіть смолоскипу перетворити литі вироби на білий порошок окису. А ось зі стружкою або топкою стрічкою з магнію потрібно поводитися дуже обережно.
- ЧЕКАТИ HE ПРИДЕТЬСЯ. Звичайні радіолампи починають нормально працювати лише після того, як їхні сітки нагріються до 800°С. Щоразу, коли ви вмикаєте радіо або телевізор, доводиться деякий час чекати, перш ніж поллються звуки музики або замерехтить блакитний екран. Щоб усунути цю нестачу радіоламп, польські вчені з кафедри електротехніки Вроцлавського політехнічного інституту запропонували покривати катоди ламп MgO: такі лампи починають працювати відразу після включення.
- ПРОБЛЕМА ЯЄЧНОЇ СКОРЛУПИ. Декілька років тому вчені Міннесотського університету в США обрали об'єктом наукового дослідження яєчну шкаралупу. Їм вдалося встановити, що шкаралупа тим міцніша, що більше містить магнію. Отже, змінюючи склад корму для несучок, можна підвищити міцність шкаралупи. Про те, наскільки важливим є цей висновок для сільського господарства, можна судити хоча б за такими цифрами: тільки в штаті Міннесота щорічні втрати через бій яєць перевищують мільйон доларів. Тут ніхто не скаже, що ця робота вчених «яйця виїденого не варта».
- МАГНІЙ І... ІНФАРКТ. Досліди, проведені угорськими вченими на тваринах, показали, що нестача Mg в організмі підвищує схильність до інфарктів. Одним собакам давали їжу, багату на солями цього елемента, іншим - бідну. До кінця експерименту ті собаки, в раціоні яких мало магнію, «заробили» інфаркт міокарда.
- Бережіть МАГНІЙ! Французькі біологи вважають, що магній допоможе медикам у боротьбі з такою серйозною недугою XX ст., як перевтома. Дослідження показують, що в крові втомлених людей міститься менше магнію, ніж у здорових, а навіть найменші відхилення «магнієвої крові» від норми не проходять безвісти.
Важливо пам'ятати, що у тих випадках, коли людина часто і з будь-якого приводу дратується, магній, що міститься в організмі, «згоряє». Ось чому у нервових, легко збудливих людей, порушення роботи серцевих м'язів спостерігаються значно частіше.
- ВУГЛЕКИСЛИЙ МАГНІЙ І РІДКИЙ КИСНЕ. Великі ємності для зберігання рідкого кисню, як правило, виготовляються у формі циліндра або кулі - щоб менше втрати тепла. Але вдало обрана форма сховища – це ще не все. Потрібна надійна теплоізоляція. Можна з цією метою скористатися глибоким вакуумом (як у посудині Дьюара), можна мінеральною ватою, але часто між внутрішньою до зовнішньої стінкою сховища засипають пухкий порошок вуглекислого магнію. Ця теплоізоляція і дешева, і надійна.
Магній
МАГНІЙ-я; м.[Лат. magnium] Хімічний елемент (Mg), легкий кування метал сріблясто-білого кольору, що горить яскравим білим полум'ям. Окис магнію. Спалах магнію.
◁ Магнієвий, -а, -ое. М-ті руди. М. сплав.
магній(Лат. Magnesium), хімічний елемент II групи періодичної системи. Назва від новолат. magnesia – магнезія. Сріблястий метал, дуже легкий та міцний; щільність 1,74 г/см 3 tпл 650°C. На повітрі покривається захисною плівкою; підпалена тонка стружка та порошок магнію горять яскравим білим полум'ям. За поширеністю в земній корі посідає серед елементів 8 місце (мінерали магнезит, доломіт, карналіт). Застосовується головним чином у виробництві легких сплавів, для розкислення та обессерювання деяких металів, для відновлення Hf, Ti, U, Zr та інших металів із сполук (металотермія), як компонент освітлювальних та запальних складів для снарядів та ракет.
МАГНІЙМАГНІЙ (лат. Magnesium), Mg (читається «магній»), хімічний елемент ІІА групи третього періоду періодичної системи Менделєєва (див.ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ МЕНДЕЛЄЄВА), Атомний номер 12, атомна маса 24,305. Природний магній складається із трьох стабільних нуклідів. (див.НУКЛІД): 24 Mg (78,60% за масою), 25 Mg (10,11%) та 26 Mg (11,29%). Електронна конфігурація нейтрального атома 1s 2
2s 2
p 6
3s 2
, згідно з якою магній у стабільних з'єднаннях двовалентний (ступінь окислення +2). Проста речовина магній – легкий, сріблясто-білий блискучий метал.
Історія відкриття
З'єднання магнію були відомі людині з давніх-давен. Латинська назва елемента походить від назви древнього міста Магнезія в Малій Азії, на околицях якого є поклади мінералу магнезиту (див.МАГНЕЗИТ). Металевий магній вперше отримав у 1808 англійський хімік Г. Деві (див.Деві Гемфрі). Як і у разі інших активних металів – натрію, калію, кальцію, для отримання металевого магнію Деві використовував електроліз. Електроліз він піддав зволожену суміш білої магнезії (до її складу, судячи з усього, входили оксид магнію MgO і гідроксид магнію Mg(OH) 2) і оксиду ртуті HgO. В результаті Деві отримав амальгаму – сплав нового металу з ртуттю. Після відгону ртуті залишився порошок нового металу, який Деві назвав магнієм.
Магній, отриманий Деві, був досить брудним, чистий металевий магній отриманий вперше у 1828 р. французьким хіміком А. Бюссі.
Знаходження у природі
Магній - один із десяти найпоширеніших елементів земної кори. У ній міститься 2,35% магнію масою. Через високу хімічну активність у вільному вигляді магній не зустрічається, а входить до складу безлічі мінералів - силікатів, алюмосилікатів, карбонатів, хлоридів, сульфатів та ін. Так, магній містять широко поширені силікати оливин (див.ОЛІВІН)(Mg,Fe) 2 та серпентин (див.СЕРПЕНТИН) Mg 6 (OH) 8 . Важливе практичне значення мають такі магнійсодержащие мінерали, як азбест (див.АСБЕСТ (мінерал)), магнезит (див.МАГНЕЗИТ), доломіт (див.ДОЛОМІТЬ) MgCO 3 · CaCO 3 , бішофіт (див.БІШОФІТ) MgCl 2 ·6H 2 O, карналіт (див.Карналіт) KCl·MgCl 2 ·6H 2 O, епсоміт (див.ЕПСОМІТ) MgSO 4 ·7H 2 O, каїніт (див.Каїніт) KCl·MgSO 4 ·3H 2 O, астраханіт Na 2 SO 4 ·MgSO 4 ·4H 2 O та ін. Магній міститься в морській воді (4% Mg у сухому залишку), в природних розсолах, у багатьох підземних водах.
Отримання
Звичайний промисловий метод отримання металевого магнію - це електроліз розплаву суміші безводних хлоридів магнію MgCl 2 натрію NaCl і калію KCl. У цьому розплаві електрохімічному відновленню піддається хлорид магнію:
MgCl 2 (електроліз) = Mg + Cl 2 .
Розплавлений метал періодично відбирають з електролізної ванни, а до неї додають нові порції магнійсодержащей сировини. Так як отриманий таким способом магній містить порівняно багато - близько 0,1% домішок, при необхідності "сировий" магній піддають додатковому очищенню. З цією метою використовують електролітичне рафінування, переплавлення у вакуумі з використанням спеціальних добавок - флюсів, які «забирають» домішки від магнію, або перегонку (сублімацію) металу у вакуумі. Чистота рафінованого магнію сягає 99,999% і від.
Розроблено й інший спосіб отримання магнію – термічний. У цьому випадку для відновлення оксиду магнію за високої температури використовують кокс:
MgO + C = Mg + CO
чи кремній. Застосування кремнію дозволяє отримувати магній з такої сировини, як доломіт CaCO 3 ·MgCO 3 не проводячи попереднього поділу магнію і кальцію. За участю доломіту протікають реакції:
CaCO 3 · MgCO 3 = CaO + MgO + 2CO 2
2MgO + 2CaO + Si = Ca 2 SiO 4 + 2Mg.
Перевага термічного способу у тому, що дозволяє отримувати магній вищої чистоти. Для отримання магнію використовують як мінеральну сировину, а й морську воду.
Фізичні та хімічні властивості
Металевий магній має гексагональні кристалічні грати. Температура плавлення 650°C, температура кипіння 1105°C, щільність 1,74 г/см 3 (магній - дуже легкий метал, легше лише кальцій та лужні метали (див.ЛУЖНІ МЕТАЛИ)). Стандартний електродний потенціал магнію Mg/Mg 2+ -2,37В. Серед стандартних потенціалів він розташований за натрієм перед алюмінієм.
Поверхня магнію покрита щільною плівкою оксиду MgO, яка за звичайних умов надійно захищає метал від подальшого руйнування. Тільки при нагріванні металу до температури вище приблизно 600°C він спалахує на повітрі. Горить магній з випромінюванням яскравого світла, за спектральним складом, близьким до сонячного. Тому раніше фотографи при недостатній освітленості проводили зйомку у світлі стрічки магнію, що горить. При горінні магнію на повітрі утворюється пухкий білий порошок оксиду магнію MgO:
2Mg + O2 = 2MgO.
Одночасно з оксидом утворюється і нітрид магнію Mg 3 N 2:
3Mg + N2 = Mg3N2.
З холодною водою магній не реагує (або, точніше, реагує, але вкрай повільно), а з гарячою водою він вступає у взаємодію, причому утворюється пухкий білий осад гідроксиду магнію Mg(OH) 2:
Mg + 2H 2 O = Mg(OH) 2 + H 2 .
Якщо стрічку магнію підпалити та опустити у склянку з водою, то горіння металу продовжується. При цьому водень, що виділяється при взаємодії магнію з водою, негайно спалахує на повітрі. Горіння магнію продовжується і в атмосфері вуглекислого газу:
2Mg+CO2=2MgO+C.
Здатність магнію горіти як у воді, так і в атмосфері вуглекислого газу істотно ускладнює гасіння пожеж, при яких горять конструкції магнію або його сплавів. (див.МАГНІЯ ОКСІД)
Оксид магнію (див.МАГНІЯ ОКСІД) MgO є білим пухким порошком, що не реагує з водою. Раніше його називали паленою магнезією чи просто магнезією. Цей оксид має основні властивості, він реагує з різними кислотами, наприклад:
MgO + 2HNO 3 = Mg(NO 3) 2 + H 2 O.
Основа Mg(OH) 2 - середньої сили, що відповідає цьому оксиду, але у воді практично нерозчинна. Його можна отримати, наприклад, додаючи луг до розчину будь-якої солі магнію:
2NaOH + MgSO 4 = Mg(OH) 2 + Na 2 SO 4 .
Так як оксид магнію MgO при взаємодії з водою лугів не утворює, а основа магнію Mg(OH) 2 лужними властивостями не володіє, магній, на відміну від своїх «співгрупників» - кальцію, стронцію і барію, не належить до лужноземельних металів.
Металевий магній реагує при кімнатній температурі з галогенами, наприклад, з бромом:
Mg + Br2 = MgBr2.
При нагріванні магній вступає у взаємодію із сіркою, даючи сульфід магнію:
Mg+S=MgS.
Якщо в інертній атмосфері прожарювати суміш магнію і коксу, то утворюється карбід магнію складу Mg 2 C 3 (слід зазначити, що найближчий сусід магнію по групі - кальцій - в аналогічних умовах утворює карбід складу СаС 2). При розкладі магнію карбіду водою утворюється гомолог ацетилену - пропин С 3 Н 4:
Mg 2 C 3 + 4Н 2 О = 2Mg(OH) 2 + С 3 Н 4 .
Тому Mg 2 C 3 можна назвати пропіленідом магнію.
У поведінці магнію є риси схожості з поведінкою лужного металу літію (див.ЛІТІЙ)(Приклад діагональної подібності елементів у таблиці Менделєєва). Так, магній, як і літій, реагує з азотом (реакція магнію з азотом протікає при нагріванні), у результаті утворюється нітрид магнію:
3Mg + N2 = Mg3N2.
Як і нітрид літію, нітрид магнію легко розкладається водою:
Mg 3 N 2 + 6Н 2 О = 3Mg(ОН) 2 + 2NН 3 .
Подібність до літію проявляється у магнію і в тому, що його карбонат MgCO 3 і фосфат Mg 3 (PO 4) 2 у воді погано розчиняються, як і відповідні солі літію.
З кальцієм магній зближує те, що присутність у воді розчинних гідрокарбонатів цих елементів зумовлює жорсткість води (див.ЖОРСТКІСТЬ ВОДИ). Як і у випадку гідрокарбонату кальцію (див. ст. Доальцій (див.КАЛЬЦІЙ)), жорсткість, викликана гідрокарбонатом магнію Mg(HCO 3) 2 - тимчасова. При кип'ятінні гідрокарбонат магнію Mg(HCO 3) 2 розкладається і в осад випадає його основний карбонат - гідроксокарбонат магнію (MgOH) 2 CO 3:
2Mg(HCO 3) 2 = (MgOH) 2 CO 3 + 3CO 2 + Н 2 О.
Практичне застосування досі має перхлорат магнію Mg(ClO 4) 2 , що енергійно взаємодіє з парами води, добре осушує повітря або інший газ, що проходить через його шар. При цьому утворюється міцний кристалогідрат Mg(ClO 4) 2 ·6Н 2 О. Цю речовину можна знову обезводити, нагріваючи у вакуумі при температурі близько 300°C. За властивості осушувача перхлорат магнію отримав назву «ангідрон».
Велике значення в органічній хімії мають магнійорганічні сполуки. (див.МАГНІЙОРГАНІЧНІ СПОЛУКИ, Що містять зв'язок Mg-C. Особливо важливу роль серед них відіграє так званий реактив Гриньяра - сполуки магнію загальної формули RMgHal, де R - органічний радикал, а Hal = Cl, Br або I. Ці сполуки утворюються в ефірних розчинах при взаємодії магнію та відповідного органічного галоїду RHal і використовуються для самих різноманітних синтезів.
Застосування
Основна частина магнію, що видобувається, використовується для отримання різних легких магнієвих сплавів. До складу цих сплавів, крім магнію, входять зазвичай алюміній, цинк, цирконій. Такі сплави досить міцні і знаходять застосування в літакобудуванні, приладобудуванні та інших цілей.
Висока хімічна активність металевого магнію дозволяє використовувати його при магнієтермічному одержанні таких металів, як титан, цирконій, ванадій, уран та ін.
2Mg + TiO 2 = 2MgO + Ti.
2Mg + UF 4 = 2MgF 2 + U.
Широке застосування знаходять багато сполук магнію, особливо його оксид, карбонат і сульфат.
Біологічна роль магнію
Магній – біогенний елемент (див.БІОГЕННІ ЕЛЕМЕНТИ), постійно присутній у тканинах всіх організмів Він входить до складу молекули зеленого пігменту рослин – хлорофілу (див.ХЛОРОФІЛ)бере участь у мінеральному обміні, активує ферментні процеси в організмі, підвищує посухостійкість рослин. За участю іонів Mg+ здійснюється біолюмінесценція (див.БІОЛЮМІНЕСЦЕНЦІЯ)та низку інших біологічних процесів. Широке практичне застосування знаходять магнієві добрива - доломітове борошно, палена магнезія та ін.
В організм тварин і людини надходить магній з їжею. Добова потреба людини в магнії – 0,3-0,5 г. В організмі середньої людини (маса тіла 70 кг) міститься близько 19 г магнію. Порушення обміну магнію призводять до різних захворювань. У медицині застосовують препарати магнію – його сульфат, карбонат, палену магнезію.
Енциклопедичний словник. 2009 .
Синоніми:Дивитись що таке "магній" в інших словниках:
- (Ново лат. Magnium, від лат. Magnesia). Сріблястий метал, що становить основу магнезії. Словник іншомовних слів, що увійшли до складу російської мови. Чудінов А.Н., 1910. МАГНІЙ блискучий метал сріблясто білого кольору, горить дуже яскравим білим. Словник іноземних слів російської мови
– (Magnesium), Mg, хімічний елемент II групи періодичної системи, атомний номер 12, атомна маса 24,305; відноситься до лужноземельних металів; tпл 650шC. Входить до складу хлорофілу. Магній компонент сплавів, освітлювальних та запальних… Сучасна енциклопедія
- (Символ Mg), металевий елемент сріблясто білого кольору, один з лужноземельних металів. Восьмий за поширеністю елемент земної кори. Вперше був виділений у 1808 р. Хемфрі ДЕВІ. Необхідний у харчуванні людини та тварин. Магній завжди… Науково-технічний енциклопедичний словник
Магній– (Magnesium), Mg, хімічний елемент II групи періодичної системи, атомний номер 12, атомна маса 24,305; відноситься до лужноземельних металів; tпл 650°C. Входить до складу хлорофілу. Магній компонент сплавів, освітлювальних та запальних… Ілюстрований енциклопедичний словник
МАГНІЙ, див. Магнезія. Тлумачний словник Даля. В.І. Даль. 1863 1866 … Тлумачний словник Даля
- (Лат. Magnesium) Mg, хімічний елемент II групи періодичної системи, атомний номер 12, атомна маса 24,305. Назва від новолатинської магнезії magnesia. Сріблястий метал, дуже легкий та міцний; щільність 1,74 г/см³, tпл 650 .С. На… … Великий Енциклопедичний словник
Mg (лат. Magnesium * a. magnesium; н. Magnesium; ф. magnesium; і. magnesio), хім. елемент II групи періодич. системи Менделєєва, ат. н. 12, ат. м. 24,312. Природний M. складається з суміші стабільних ізотопів 24Mg (78,6%), 25Mg (10,11%) та… Геологічна енциклопедія
Магній - елемент головної підгрупи другої групи, третього періоду періодичної системи хімічних елементів, з атомним номером 12. Позначається символом Mg (лат. Magnesium). Проста речовина магній (CAS-номер: 7439-95-4) – легкий, ковкий метал сріблясто-білого кольору. Середньо поширений у природі. При горінні виділяється велика кількість світла та тепла.
походження назви
У 1695 році з мінеральної води Епсомського джерела в Англії виділили сіль, що мала гіркий смак і проносну дію. Аптекарі називали її гіркою сіллю, а також англійською або епсомською сіллю. Мінерал епсоміт має склад MgSO 4 · 7H 2 O. Латинська назва елемента походить від назви древнього міста Магнезія в Малій Азії, в околицях якого є поклади мінералу магнезиту.
Вперше був виділений у чистому вигляді сером Хемфрі Деві у 1808 році.
Отримання
Звичайний промисловий метод одержання металевого магнію - це електроліз розплаву суміші безводних хлоридів магнію MgCl 2 (бішофіт), натрію NaCl та калію KCl. У розплаві електрохімічного відновлення піддається хлорид магнію:
MgCl 2 (електроліз) = Mg + Cl 2 .
Розплавлений метал періодично відбирають з електролізної ванни, а до неї додають нові порції магнійсодержащей сировини. Так як отриманий таким способом магній містить порівняно багато (близько 0,1%) домішок, при необхідності "сирий" магній піддають додатковому очищенню. З цією метою використовують електролітичне рафінування, переплавлення у вакуумі з використанням спеціальних добавок - флюсів, які «забирають» домішки від магнію або перегонку (сублімацію) металу у вакуумі. Чистота рафінованого магнію досягає 99999% і вище.
Розроблено й інший спосіб отримання магнію – термічний. У цьому випадку для відновлення оксиду магнію за високої температури використовують кремній або кокс:
MgO + C = Mg + CO
Застосування кремнію дозволяє отримувати магній з такої сировини, як доломіт CaCO 3 ·MgCO 3 не проводячи попереднього поділу магнію і кальцію. За участю доломіту протікають реакції:
CaCO 3 · MgCO 3 = CaO + MgO + 2CO 2
2MgO + CaO + Si = CaSiO 3 + 2Mg.
Перевага термічного способу у тому, що дозволяє отримувати магній вищої чистоти. Для отримання магнію використовують як мінеральну сировину, а й морську воду.
Фізичні властивості
Магній – метал сріблясто-білого кольору з гексагональними гратами, просторова група P 6 3 /mmc. За звичайних умов поверхня магнію покрита міцною захисною плівкою оксиду магнію MgO, яка руйнується при нагріванні на повітрі приблизно до 600 °C, після чого метал згоряє з сліпуче білим полум'ям з утворенням оксиду і нітриду магнію Mg 3 N 2 . Щільність магнію при 20 °C - 1,737 г/см³, температура плавлення металу t пл = 651 °C, температура кипіння - t кип = 1103 °C, теплопровідність при 20 °C - 156 Вт/(м·К). Магній високої чистоти пластичний, добре пресується, прокочується та піддається обробці різанням.
Хімічні властивості
Суміш порошкового магнію з перманганатом калію KMnO 4 – вибухова речовина.
Розпечений магній реагує з водою:
Mg (розкл.) + Н 2 О = MgO + H 2;
Луги на магній не діють, в кислотах він легко розчиняється з виділенням водню:
Mg + 2HCl = MgCl 2 + H 2;
При нагріванні на повітрі магній згоряє, з утворенням оксиду, а також з азотом може утворюватися невелика кількість нітриду:
2Mg + Про 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
З'єднання магнію були відомі людині дуже давно. Магнезитом (грецькою Magnhsia oliqV) називали м'який білий, милий на дотик мінерал (мильний камінь, або тальк), який знаходили в районі Магнезії у Фессалії. При прожарюванні цього мінералу отримували білий порошок, який почали називати білою магнезією.
У 1695 Н.Гро, випаровуючи мінеральну воду Епсомського джерела (Англія), отримав сіль, що мала гіркий смак і проносну дію (MgSO 4 ·7H 2 O). Через кілька років з'ясувалося, що при взаємодії з содою або поташом ця сіль утворює пухкий білий порошок, такий же, який утворюється при прожарюванні магнезиту.
У 1808 англійський хімік і фізик Гемфрі Деві при електролізі злегка зволоженої білої магнезії з окисом ртуті як катод отримав амальгаму нового металу, здатного утворювати білу магнезію. Його назвали магнієм. Деві отримав забруднений метал, а чистий магній був виділений лише у 1829 році французьким хіміком Антуаном Бюссі (Bussy Antoine) (1794–1882).
Розповсюдження магнію в природі та його промислове вилучення.
Магній є в кристалічних гірських породах у вигляді нерозчинних карбонатів або сульфатів, а також у менш доступній формі у вигляді силікатів. Оцінка його загального змісту істотно залежить від геохімічної моделі, що використовується, зокрема, від вагових відносин вулканічних і осадових гірських порід. Наразі використовуються значення від 2 до 13,3%. Можливо, найбільш прийнятним є значення 2,76%, яке за поширеністю ставить магній шостим після кальцію (4,66%) перед натрієм (2,27%) та калієм (1,84%).
Великі області суші, такі як Доломітові Альпи в Італії, складаються переважно з мінералу доломіту MgCa(CO 3 ) 2 . Там зустрічаються і осадові мінерали магнезит MgCO 3 , епсоміт MgSO 4 · 7H 2 O, карналіт K 2 MgCl 4 · 6H 2 O, лангбейніт K 2 Mg 2 (SO 4) 3 .
Поклади доломіту є у багатьох інших районах, у тому числі в Московській та Ленінградській областях. Багаті родовища магнезиту знайдені на Середньому Уралі та в Оренбурзькій області. У районі Солікамська розробляється найбільше родовище карналіту. Силікати магнію представлені базальтовим мінералом олівіном (Mg, Fe) 2 (SiO 4), мильним каменем (тальк) Mg 3 Si 4 O 10 (OH) 2 , азбестом (хризотил) Mg 3 Si 2 O 5 (OH) 4 і слюдою. Шпінель MgAl 2 O 4 відноситься до дорогоцінного каміння.
Велика кількість магнію міститься у водах морів та океанів та в природних розсолах ( см. ХІМІЯ ГІДРОСФЕРИ). У деяких країнах вони є сировиною для отримання магнію. За вмістом у морській воді з металевих елементів він поступається лише натрію. У кожному кубометрі морської води міститься близько 4 кг магнію. Магній є й у прісній воді, обумовлюючи, поряд із кальцієм, її жорсткість.
Магній завжди міститься у рослинах, оскільки входить до складу хлорофілів.
Характеристика простої речовини та промислове отримання металевого магнію.
Магній – сріблясто-білий блискучий метал, порівняно м'який, пластичний та ковкий. Його міцність та твердість мінімальні за поширеністю для литих зразків, вище – для пресованих.
У звичайних умовах магній стійкий до окиснення за рахунок утворення міцної оксидної плівки. Водночас він активно реагує з більшістю неметалів, особливо при нагріванні. Магній спалахує в присутності галогенів (за наявності вологи), утворюючи відповідні галогеніди, і горить сліпуче яскравим полум'ям на повітрі, перетворюючись на оксид MgO і нітрид Mg 3 N 2:
2Mg(к) + O 2(г) = 2MgO(к); DG° = –1128 кДж/моль
3Mg (к) + N 2(т) = Mg 3 N 2(к); DG° = –401 кДж/моль
Незважаючи на невисоку температуру плавлення (650 ° С), магнію розплавити на повітрі неможливо.
При дії водню під тиском 200 атм при 150° магній утворює гідрид MgH 2 . З холодною водою магній не реагує, але з окропу витісняє водень і утворює гідроксид Mg(OH) 2:
Mg + 2H 2 O = Mg(OH) 2 + H 2
Після закінчення реакції величина рН (10,3) насиченого розчину гідроксиду магнію, що утворився, відповідає рівновазі:
В останньому випадку утворювальну суміш монооксиду вуглецю та парів магнію необхідно швидко охолоджувати інертним газом для запобігання зворотній реакції.
Світове виробництво магнію наближається до 400 тис. т на рік. Головними виробниками є США (43%), країни СНД (26%) та Норвегія (17%). Останніми роками різко збільшує експорт магнію Китай. У Росії одним з найбільших виробників магнію є титано-магнієвий комбінат у Березниках (Пермська обл.) і Солікамський магнієвий завод. Виробництво магнію розгортається також у р. Азбест.
Магній – найлегший конструкційний матеріал, що використовується у промислових масштабах. Його густина (1,7 г см -3) становить менше двох третин густини алюмінію. Сплави магнію важать вчетверо менше від сталі. Крім того, магній чудово обробляється і може бути відлитий і перероблений будь-якими стандартними методами металообробки (прокатка, штампування, волочіння, кування, зварювання, паяння, клепка). Тому його основна сфера застосування – як легкий конструкційний метал.
Магнієві сплави зазвичай містять понад 90% магнію, а також 2–9% алюмінію, 1–3% цинку та 0,2–1% марганцю. Збереження міцності за високої температури (до 450° З) помітно поліпшується при сплавленні з рідкісноземельними металами (наприклад, празеодимом і неодимом) чи торієм. Ці сплави можна використовувати для корпусів автомобільних двигунів, а також фюзеляжів та шасі літаків. Магній застосовують не тільки в авіації, а й для виготовлення сходів, містків у доках, вантажних платформ, транспортерів та підйомників, а також у виробництві фотографічного та оптичного обладнання.
У промисловий алюміній додають до 5% магнію для покращення механічних властивостей, зварюваності та стійкості до корозії. Магній також застосовують для катодного захисту інших металів від корозії, як поглинач кисню та відновник при виробництві берилію, титану, цирконію, гафнію та урану. Суміші магнію порошку з окислювачами використовують у піротехніці для приготування освітлювальних і запальних складів.
З'єднання магнію.
Переважна ступінь окислення (+2) для магнію обумовлена його електронною конфігурацією, енергіями іонізації та розмірами атома. Ступінь окислення (+3) неможлива, тому що третя енергія іонізації становить для магнію 7733 кДж моль -1. Ця енергія набагато вища, ніж можна компенсувати утворенням додаткових зв'язків, навіть якщо вони будуть переважно ковалентними. Причини нестійкості сполук магнію в ступені окислення (+1) менш очевидні. Оцінка ентальпії утворення таких сполук показує, що вони повинні бути стійкими по відношенню до їх складових елементів. Причиною того, що сполуки магнію(I) не стійкі, є набагато більш високе значення ентальпії утворення сполук магнію(II), що повинно призвести до швидкого та повного диспропорціювання:
Mg(к) + Cl 2 (г) = MgCl 2 (к);
D Н° обр = -642 кДж / (моль MgCl 2)
2Mg(к) + Cl 2 (г) = 2MgCl(к);
D Н° обр = -250 кДж / (2 моль MgCl)
2MgCl(к) = Mg(к) + MgCl 2(к);
D Н° диспроп = -392 кДж / (2 моль MgCl)
Якщо буде знайдено шлях синтезу, який ускладнить диспропорціонування, такі сполуки, можливо, будуть отримані. Є деякі докази утворення частинок магнію(I) при електролізі на магнієвих електродах. Так, при електролізі NaCl на магнієвому аноді виділяється водень, а кількість магнію, втрачена анодом, відповідає заряду +1,3. Аналогічно при електролізі водного розчину Na 2 SO 4 кількість водню, що виділився відповідає окисленню води іонами магнію, заряд яких відповідає +1,4.
Більшість солей магнію добре розчиняються у воді. Процес розчинення супроводжується незначним гідролізом. Отримані розчини мають слабокислотне середовище:
2+ + H 2 O + + H 3 O +
З'єднання магнію з багатьма неметалами, у тому числі з вуглецем, азотом, фосфором, сіркою незворотно гідролізуються водою.
Гідрид магніюскладу МgН 2 являє собою полімер з містковими атомами водню. Координаційне число магнію у ньому дорівнює 4. Така будова призводить до різкого зниження термічної стійкості сполуки. Гідрид магнію легко окислюється киснем повітря та водою. Ці реакції супроводжуються великим виділенням енергії.
Нітрід магнію Mg 3 N 2 . Утворює жовтуваті кристали. При гідролізі нітриду магнію утворюється гідрат аміаку:
Mg 3 N 2 + 8H 2 O = 3Mg(OH) 2 + 2NH 3 ·H 2 O
Якщо гідроліз нітриду магнію проводити у лужному середовищі, гідрат аміаку не утворюється, а виділяється газоподібний аміак. Гідроліз у кислотному середовищі призводить до утворення катіонів магнію та амонію:
Mg 3 N 2 + 8H 3 O + = 3Mg 2+ + 2NH 4 + + 8H 2 O
Магнію оксид MgO називають паленою магнезією. Його одержують випалом магнезиту, доломіту, основного карбонату магнію, гідроксиду магнію, а також прожарюванням бішофіту MgCl 2 ·6H 2 O в атмосфері водяної пари.
Реакційна здатність оксиду магнію залежить від температури отримання. Оксид магнію, приготований при 500-700 ° С, називають легкою магнезією. Він легко реагує з розведеними кислотами та водою з утворенням відповідних солей або гідроксиду магнію, поглинає діоксид вуглецю та вологу з повітря. Оксид магнію, отриманий при 1200-1600 ° С носить назву важкої магнезії. Він характеризується кислотостійкістю та водостійкістю.
Оксид магнію широко використовується як жаростійкий матеріал. Він відрізняється одночасно високою теплопровідністю та хорошими електроізолюючими властивостями. Тому ця сполука застосовується в ізолюючих радіаторах для місцевого нагріву.
Більш легкі сорти магнезій використовують для приготування магнезіального цементу та будівельних матеріалів на його основі, а також як вулканізуючий агент у гумовій промисловості.
Гідроксид магнію Mg(OH) 2 утворює безбарвні кристали. Розчинність цієї сполуки невелика (210 -4 моль/л при 20° С). Його можна перевести в розчин дією солей амонію:
Mg(OH) 2 + 2NH 4 Cl = MgCl 2 + 2NH 3 ·H 2 O
Гідроксид магнію термічно нестійкий і при нагріванні розкладається:
Mg(OH) 2 = MgO + H 2 O
У промислових масштабах гідроксид магнію одержують осадженням вапном з морської води та природних розсолів.
Гідроксид магнію є м'якою основою, яка у вигляді водного розчину (магнезіальне молоко) широко використовується для зниження кислотності шлункового соку. При цьому, незважаючи на м'якість, Mg(OH) 2 нейтралізує кислоти у 1,37 разів більше, ніж гідроксид натрію NaOH та у 2,85 разів більше, ніж гідрокарбонат натрію NaHCO 3 .
Його використовують також для отримання оксиду магнію, рафінування цукру, очищення води в котельних установках як компонент зубних паст.
Карбонат магнію MgCO 3 утворює безбарвні кристали. Він зустрічається у природі у безводному вигляді (магнезит). Крім того, відомі пента-, три-і моногідрати карбонату магнію.
Розчинність карбонату магнію без діоксиду вуглецю становить близько 0,5 мг/л. У присутності надлишку діоксиду вуглецю та води карбонат магнію перетворюється на розчинний гідрокарбонат, а при кип'ятінні відбувається зворотний процес. З кислотами карбонат та гідрокарбонат взаємодіють з виділенням діоксиду вуглецю та утворенням відповідних солей. При нагріванні карбонат магнію, не плавлячись, розкладається:
MgCO 3 = MgO + CO 2
Цей процес використовують для одержання оксиду магнію. Крім того, природний карбонат магнію є вихідною сировиною для отримання металевого магнію та його сполук. Його використовують також як добрива і зниження кислотності грунтів.
Пухкий порошок карбонату магнію засипають між подвійними стінками сховищ для рідкого кисню. Ця теплоізоляція дешева та надійна.
Сульфат магнію MgSO 4 відомий у безводному стані, а також у вигляді різних гідратів. У природі зустрічаються кізерит MgSO 4 · H 2 O, епсоміт MgSO 4 · 7H 2 O та гексагідрат MgSO 4 · 6H 2 O.
У медицині використовується гептагідрат сульфату магнію MgSO 4 ·7H 2 O, широко відомий під назвами англійська або гірка сіль. Ця сполука має проносну дію. При внутрішньом'язових або внутрішньовенних вливаннях сульфат магнію знімає судомний стан, зменшує спазми судин.
Сульфат магнію застосовують у текстильній та паперовій промисловості як протраву при фарбуванні, а також як обтяжувач бавовни та шовку та наповнювача паперу. Він є сировиною для отримання оксиду магнію.
Нітрат магнію Mg(NO 3) 2 являють собою безбарвні гігроскопічні кристали. Розчинність у воді при 20 ° С становить 73,3 г на 100 г. З водних розчинів кристалізується гексагідрат. Вище 90 ° З він зневоднюється до моногідрату. Потім відбувається відщеплення води з частковим гідролізом та розкладання до оксиду магнію. Цей процес використовується для синтезу оксиду магнію особливої чистоти. З нітрату магнію одержують нітрати інших металів, а також різні сполуки магнію. Крім того, нітрат магнію входить до складу складних добрив та піротехнічних сумішей.
Перхлорат магнію Mg(ClO 4) 2 утворює дуже гігроскопічні безбарвні кристали. Він добре розчинний у воді (99,6 г на 100 г) та органічних розчинниках. З водних розчинів кристалізується гексагідрат. Концентровані розчини перхлорату магнію в органічних розчинниках та його сольвати з молекулами відновників вибухонебезпечні.
Частково гідратований перхлорат магнію, що містить 2–2,5 молекули води, випускають під комерційною назвою «ангідрон». Для отримання безводного перхлорату магнію його сушать у вакуумі при 200-300 ° С. Його використовують як осушувач газів. Він поглинає як пари води, а й аміак, пари спиртів, ацетону та інших полярних речовин.
Перхлорат магнію застосовують як каталізатор ацилювання за реакцією Фріделя – Крафтса, а також як окислювач у мікроаналізі.
Фторид магнію MgF 2 мало розчинний у воді (0,013 г 100 г при 25° С). Він зустрічається у природі у вигляді мінералу селаїту. Отримують фторид магнію взаємодією сульфату або оксиду магнію з фтороводородною кислотою або магнію хлориду з фторидом калію або амонію.
Фторид магнію входить до складу флюсів, скла, кераміки, емалей, каталізаторів, сумішей для отримання штучної слюди та азбесту. Крім того, він є оптичним та лазерним матеріалом.
Хлорид магнію MgCl 2 є одним із найбільш промислово важливих солей магнію. Його розчинність становить 54,5 г на 100 г води при 20 ° С. Концентровані водні розчини магнію хлориду розчиняють оксид магнію. З отриманих розчинів кристалізуються MgCl 2 ·mMg(OH) 2 ·nH 2 O. Ці сполуки входять до складу магнезіальних цементів.
Хлорид магнію утворює кристалогідрати з 1, 2, 4, 6, 8 і 12 молекулами води. Зі зростанням температури число молекул кристалізаційної води зменшується.
У природі хлорид магнію зустрічається у вигляді мінералів бішофіту MgCl 2 ·6H 2 O, хлормагнезиту MgCl 2 а також карналіту. Він міститься у морській воді, рапі соляних озер, деяких підземних розсолах.
Безводний хлорид магнію використовують у виробництві металевого магнію та оксиду магнію, гексагідрат – для одержання магнезіальних цементів. Водний розчин магнію хлориду застосовують як холодоагент і антифриз. Він служить засобом проти зледеніння льотних полів аеродромів, залізничних рейок та стрілок, а також проти змерзання вугілля та руд. Розчином магнію хлориду просочують деревину для надання їй вогнестійкості.
Бромід магнію MgBr 2 добре розчинний у воді (101,5 г на 100 г при 20 ° С). З водних розчинів кристалізується від -42,7 до 0,83 ° С у вигляді декагідрату, при вищій температурі - у вигляді гексагідрату. Він утворює численні кристалосольвати, такі як MgB 2 ·6ROH (R = Me, Et, Pr), MgBr 2 ·6Me 2 CO, MgBr 2 ·3Et 2 O, а також аміни MgBr 2 · n NH 3 ( n = 2–6).
Комплексні сполуки магнію. У водних розчинах іон магнію існує у вигляді аквакомплексу 2+. У неводних розчинниках, наприклад в рідкому аміаку, іон магнію утворює комплекси з молекулами розчинника. З таких розчинів зазвичай кристалізуються сольвати солей магнію. Відомо кілька галогенідних комплексів типу MX 4 2-, де Х - галогенід-аніон.
Серед комплексних сполук магнію особливе значення мають хлорофіли, модифіковані порфіриновими комплексами магнію. Вони є життєво важливими для фотосинтезу у зелених рослинах.
Магнійорганічні сполуки. Для магнію отримані численні сполуки, що містять зв'язок метал – вуглець. Особливо багато досліджень присвячено реактивам Гриньяра RMgX (X=Cl, Br, I).
Реактиви Гриньяра – найважливіші металоорганічні сполуки магнію і, мабуть, найбільш використовувані металоорганічні реагенти. Це з легкістю їх отримання і синтетичної різнобічності. Встановлено, що у розчині ці сполуки можуть містити різноманітні хімічні частки, що у рухливому рівновазі.
Реактиви Гриньяра зазвичай отримують повільним додаванням органічного галогеніду до суспензії магнієвих стружок у відповідному розчиннику при інтенсивному перемішуванні та повній відсутності повітря та вологи. Реакція зазвичай починається повільно. Вона може бути ініційована маленьким кристалом йоду, який руйнує захисний шар на поверхні металу.
Реактиви Гриньяра широко застосовуються для синтезу спиртів, альдегідів, кетонів, карбонових кислот, ефірів і амідів і, ймовірно, є найважливішими реагентами для створення зв'язків вуглець-вуглець, а також зв'язків між атомами вуглецю та інших елементів (азот, кисень, сірка тощо) .д.).
З'єднання R 2 Mg зазвичай розкладаються під час нагрівання. У кристалічному стані вони мають структуру лінійних полімерів з містковими алкільними групами. З'єднання MgMe 2 являє собою нелетючий полімер, стійкий до ~250° С, не розчинний у вуглеводнях і лише розчинний в ефірі. З'єднання MgEt 2 і більш високі гомологи дуже схожі на MgMe 2 але вони розкладаються при більш низькій температурі (175-200 ° С), утворюючи відповідний алкен і MgH 2 по реакції, зворотній їх отриманню. Схожий на них і MgPh 2; він не розчинний у бензолі, розчиняється в ефірі з утворенням мономерного комплексу MgPh 2 ·2Et 2 O і розкладається при 280° З утворенням Ph 2 і металевого магнію.
Біологічна роль магнію.
Зелене листя рослин містить хлорофіли, які являють собою магнійвмісні порфіринові комплекси, що беруть участь у фотосинтезі.
Магній також тісно залучений до біохімічних процесів в організмах тварин. Іони магнію необхідні для ініціювання ферментів, що відповідають за перетворення фосфатів, для перенесення нервового імпульсу та для метаболізму вуглеводів. Вони також беруть участь у скороченні м'язів, що ініціюється іонами кальцію.
Декілька років тому вчені Міннесотського університету в США встановили, що яєчна шкаралупа тим міцніша, чим більше вона містить магнію.
В організмі дорослої людини масою 65 кг міститься близько 20 г магнію (переважно у вигляді іонів). Більшість його зосереджена в кістках. У внутрішньоклітинній рідині присутні комплекси магнію з АТФ та AДФ.
Добова потреба у цьому елементі становить 0,35 г. При одноманітному харчуванні, нестачі зелених овочів та фруктів, а також при алкоголізмі нерідко виникає дефіцит магнію. Особливо багаті на магній абрикоси, персики і цвітна капуста. Є він і у звичайній капусті, картоплі, помідорах.
Статистика стверджує, що у жителів районів із теплішим кліматом спазми кровоносних судин трапляються рідше, ніж у жителів півночі. Вважають, що причиною цього є особливості харчування у холодних краях. Вони їдять менше фруктів і овочів, отже, отримують менше магнію.
Дослідження французьких біологів показали, що у крові втомлених людей міститься менше магнію, ніж відпочивших. Вважають, що дієта, багата на магній повинна допомогти медикам у боротьбі з такою серйозною недугою, як перевтома.
Олена Савінкіна