Etilen sanoatda ishlab chiqarish uchun ishlatiladi. L.I. popova, kimyo o'qituvchisi (
Javob: Etilen bir juft bog'langan ko'p to'yinmagan uglevodorodlarning eng muhim vakili: formulasi -  Gaz deyarli hidsiz, suvda yaxshi erimaydi. U havoda porlab turgan olov bilan yonadi. Borligi uchun rahmat
Gaz deyarli hidsiz, suvda yaxshi erimaydi. U havoda porlab turgan olov bilan yonadi. Borligi uchun rahmat
- etilen bog‘lanishi qo‘shimcha reaksiyalarga oson kiradi:
(dibromoetan)
(etil spirti) Er -xotin bog'lanish tufayli etilen molekulalari bir -biri bilan birlashib, katta uzunlikdagi zanjirlar hosil qilishi mumkin (ko'p minglab original molekulalardan). Bu reaktsiya polimerlanish reaktsiyasi deb ataladi:
Polietilen sanoatda va kundalik hayotda keng qo'llaniladi. Bu juda faol emas, buzilmaydi va yaxshi qayta ishlanadi. Misollar: quvurlar, idishlar (bochkalar, qutilar), izolyatsion material, qadoqlash uchun plyonka, shisha, o'yinchoqlar va boshqalar. Yana bir to'yinmagan uglevodorod polipropilendir:
Polimerlanish jarayonida polipropilen hosil bo'ladi - polimer. Polimer umumiy xususiyatlariga va polietilenga qo'llanilishiga o'xshash.  Polipropilen polietilendan ancha bardoshli, shuning uchun undan turli xil mashinalar uchun ko'plab detallar, shuningdek, eskalatorlar uchun juda nozik qismlar tayyorlanadi. Taxminan 40% polipropilen tolalarga qayta ishlanadi.
Polipropilen polietilendan ancha bardoshli, shuning uchun undan turli xil mashinalar uchun ko'plab detallar, shuningdek, eskalatorlar uchun juda nozik qismlar tayyorlanadi. Taxminan 40% polipropilen tolalarga qayta ishlanadi.
Etilenning texnik qo'llanilishi va uni ishlab chiqarish ko'lami
Samara 2013 yil
Intizom testi
Ishlatilgan manbalar ro'yxati
1. Soliq kodeksi Rossiya Federatsiyasi(ikkinchi qism) 2000 yil 5 avgustdagi N 117-FZ (03.11.2010 y. tahrirda).
2. Mehnat hisobi va mehnatga haq to'lash bo'yicha birlamchi buxgalteriya hujjatlarining yagona shakllarini tasdiqlash to'g'risida: Rossiya Federatsiyasi Davlat statistika qo'mitasining 05.01.2004 y. N 1 qarori.
3. Veshunova N.L., Fomina L.F. Buxgalteriya hisobi va soliq hisobi bo'yicha mustaqil ish kitobi - SPb.: Prospekt, 2010. - 560 p.
4. Radchenko M.G. 1C: Korxona 8.1. Amaliy ishlab chiquvchilar uchun qo'llanma - SPb.: Piter, 2007. - 512 p.
5. 1C: Enterprise 8.1. Konfiguratsiya va boshqaruv. - M.: Firma "1C", 2008. - 430 b.
"Organik sintezning kimyoviy jarayonlari nazariyasi"
Variant raqami 10
Talaba tomonidan amalga oshiriladi
3 kurs, 2 guruh ……………………………
_______________________
(imzo)
Nazoratchi
professor Nesterova T.N.
_______________________
(imzo)
Ish himoyalangan
"___" ____________ 2013 yil
________ sinf
Uchun topshiriq sinov
"Etilen ishlab chiqarish jarayonining nazariy tahlili"
1. Etilenni texnik qo'llanilish sohalari va uni ishlab chiqarish ko'lami haqidagi adabiyotlarni ko'rib chiqish.
2. Etilenni ishlab chiqarish usullari, uni aloqa gazidan ajratish usullari va texnologiyalarni rivojlantirish istiqbollari haqidagi adabiyotlarni ko'rib chiqish.
3. To'liq ishga tushirish nazariy tahlil Tanlangan etilen ishlab chiqarish jarayoni:
§ Stokiyometriya va materiallarni hisoblash.
§ individual transformatsiya va umuman jarayon uchun termokimyoviy tahlil.
§ individual transformatsiya va umuman jarayon uchun sifatli va miqdoriy termodinamik tahlil.
§ individual transformatsiya va umuman jarayon uchun sifatli va miqdoriy kinetik tahlil.
1. Adabiyotlarni ko'rib chiqish ………………………………… 3
1.1. Etilenning texnik qo'llanilishi va uni ishlab chiqarish ko'lami. …………………………………………… ... ......................... 3
2. Etilenni ishlab chiqarish usullari, uni reaktsiya aralashmalaridan ajratish usullari va texnologiyalarni rivojlantirish istiqbollari ………………………………………………………………………………………. ……………………………… 5
3. Propan pirolizi bilan etilen ishlab chiqarish jarayonining to'liq nazariy tahlili ... ............................... ................................................. 16
3.1. Stokiyometriya va moddiy hisob -kitoblar …………………… 16
3.2. Shaxsiy o'zgarish va umuman jarayon uchun termokimyoviy tahlil ………………………………… 16
3.3. Etilen ishlab chiqarishning to'liq termodinamik tahlili ... 23
3.4. Jarayonning to'liq kinetik tahlili …………………… 32
Adabiyotlar ………………………………………………… 38
Etilen(IUPAC ma'lumotlariga ko'ra: eten) - organik kimyoviy birikma C 2 H 4 formulasi bilan tasvirlangan. Bu eng oddiy alken ( olefin). Etilen tabiatda deyarli uchramaydi, oddiy sharoitda u rangsiz yonuvchi gaz bo'lib, u ozgina hidli. Uning qaynash harorati -103,8 ° C, muzlash nuqtasi -169,5 ° S. Havoda u engil nurli olov bilan yonadi. Qisman suvda (0 ° C da 100 ml suvda 25,6 ml), etanolda (bir xil sharoitda 359 ml) eriymiz. U dietil efir va uglevodorodlarda yaxshi eriydi. Ikki tomonlama aloqani o'z ichiga oladi va shuning uchun to'yinmagan yoki to'yinmagan uglevodorodlarni nazarda tutadi.
Etilen juda muhim sanoat rolini o'ynaydi, shuningdek fitohormon hisoblanadi.
Etilen bir qator sintetik mahsulotlar, ayniqsa etil spirti, etilen oksidi (etilen oksidi), etilen glikol (antifriz) va boshqalarni ishlab chiqarish uchun juda muhim xom ashyo bo'lib, qisman asetilen o'rniga avtogen payvandlashda ishlatiladi.
1957 yilda Italiyada 100 ming tonna etilen ishlab chiqarildi. Ikkinchi jahon urushidan oldin Germaniyada etilen ishlab chiqarish oziq -ovqat xom ashyosi va ko'mirni qayta ishlash mahsulotlariga asoslangan edi. 1943 yilda Germaniyada 90 ming tonnaga yaqin etilen ishlab chiqarildi. 1957 yilda FRG 100 ming tonna etilen ishlab chiqargan. Shu bilan birga, neft xomashyosiga o'tish tendentsiyasi kuzatildi. 1957 yilda Angliyada 250 ming tonnaga yaqin etilen ishlab chiqarish xom neftni qayta ishlashga asoslangan. 1957 yilda Frantsiya 32 ming tonna etilen oldi; xom ashyo - koks gazlari va og'ir neft mahsulotlari. 1957 yilda Yaponiyada xom neftdan 40 ming tonnaga yaqin etilen ishlab chiqarildi.
2005 yilda jahonda etilenning umumiy ishlab chiqarilishi 107 million tonnani tashkil etdi va yiliga 4-6 foizga o'sishda davom etmoqda. Etilenni sanoat ishlab chiqarish manbai - bu turli uglevodorodli xom ashyolarning pirolizi, masalan, neft ishlab chiqarish bilan bog'liq gazlar tarkibidagi etan, propan, butan; suyuq uglevodorodlardan - neftni to'g'ridan -to'g'ri distillashning past oktanli fraktsiyalari. Shuningdek, 2008 yilda etilenning umumiy jahon ishlab chiqarilishi 113 million tonnani tashkil etdi va yiliga 2-3% o'sishda davom etmoqda.
Jadval 1. Rossiyaning yirik kompaniyalari - etilen va propilen ishlab chiqaruvchilari.
Og'ir organik sintez sanoatida etilenni kimyoviy qayta ishlashning quyidagi jarayonlari eng keng tarqalgan: polimerlanish, oksidlanish, oksosintez, xlorlanish, nitratlanish, gidratlanish, telomerizatsiya va alkillanish.
Etilenni birinchi marta nemis kimyogari Yoxann Becher 1680 yilda vitriol moyining sharob spirtiga ta'siri natijasida olgan. Avvaliga u "yonuvchi havo" bilan aniqlandi, ya'ni. vodorod bilan. Keyinchalik, 1795 yilda Gollandiyalik kimyogarlar Deyman, Pots-van-Trestvik, Bond va Lauerenburg etilenni shunga o'xshash tarzda olishdi va uni "yog'li gaz" nomi bilan ta'riflashdi, chunki ular etilenning xlor qo'shib, yog'li hosil qilish qobiliyatini aniqladilar. suyuqlik - etilen xlor ("Gollandiyalik kimyogarlar").
Sanoatda etilen ishlab chiqarish uchun turli jarayonlar qo'llaniladi: engil va og'ir parafinli va naftenli uglevodorodlarning pirolizi, asetilenning gidrogenlanishi va etil spirtining suvsizlanishi. Bundan tashqari, etilen yonilg'i sifatida qattiq yoqilg'ini issiqlik bilan qayta ishlashda, yog'ni termal va katalitik yorilishida va hokazo.
2.1 To'yingan uglevodorodlarning pirolizi
Etilen ishlab chiqarishning asosiy sanoat usuli-to'yingan uglevodorodlarning yuqori haroratli termal bo'linishi (piroliz).
Issiqlik bilan ta'minlash usuliga qarab quyidagi jarayonlar ajratiladi: a) quvurli pechlarda piroliz; b) bir hil piroliz; v) ototermik piroliz; d) qattiq sovutish suvi ishlatilganda.
C 2 H 6 ↔C 2 H 4 + H 2 (III.1)
C 3 H 8 ↔C 2 H 4 + CH 4 (III.2b)
C 4 H 10 ↔2C 2 H 4 + H 2 (III.3b)
C 4 H 10 ↔C 2 H 4 + C 2 H 6 (III.3d)
Jadvalda turli piroliz jarayonlarining sxematik sxemalari va usullari ko'rsatilgan.

2.2 Asetilenni etilenga katalitik gidrogenlash
Sanoatda asetilenni gidrogenlash orqali etilen ishlab chiqarish jarayoni ishlab chiqilgan.
S 2 H 2 + H 2 ↔C 2 H 4 + Qp
Jarayonning optimal harorati katalizator faolligiga qarab 180-320 °.
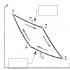
O'rnatishning sxematik diagrammasi rasmda ko'rsatilgan. 1

Kaltsiy karbididan olingan asetilen (tozaligi 98-99%) 1 dan 1,5-2 atmgacha kompressorda siqiladi, 2-muzlatgichda sovutiladi va 3-adsorberda qattiq adsorbent (alumogel) bilan tozalanadi, chunki bu katalizator uchun zaharli hisoblanadi. . Gaz ajratish birligidan olingan vodorod (tozaligi 96-98%) 4-kompressorda siqiladi, 5-muzlatgichda sovutiladi, 6-adsorberda yog 'bug'laridan quritiladi va tozalanadi. 7 -reaktorda yoki uzoqdan issiqlik almashinuvchilarda. Reaktordagi tegmaslik harorat, reaktorning quvurli issiqlik almashtirgichiga doimiy ravishda sovutish suvi etkazib berish orqali avtomatik ravishda saqlanadi.
Gidrogenlash jarayoni vodorodning sezilarli darajada oshishi bilan amalga oshiriladi. Asetilenni gidrogenlash jarayoni deyarli yakunlandi. Katalizator sifatida silika jeli bilan ishlangan palladiy ishlatiladi. Katalizatorda palladiy miqdori oshmaydi
0,01% Katalizatorning uzluksiz ishlash muddati taxminan bir yil.
2.3 Etil spirti suvsizlanishi
Nisbatan oz miqdorda etilen olish uchun (yiliga 3000-5000 t gacha) etil spirti suvsizlantirish usulidan foydalanish mumkin. 1955 yilda AQShda shu usul bilan 15 ming tonnaga yaqin etilen olingan.
Etanolning suvsizlanish reaktsiyasini quyidagi tenglama bilan ifodalash mumkin:

Katalizator sifatida faol alumina va alumosilikon birikmalari ishlatiladi. Jarayon 300-400 ° da amalga oshiriladi.

Suvsizlantirish qurilmasining texnologik sxemasi ilgari berilgan.
Issiqlik almashtirgich 3 orqali 2 -nasos orqali 1 -tankdan etil spirti 4 -reaktorga etkazib beriladi. Kerakli issiqlik reaktor devori orqali dowtherm yoki tutun gazlari bilan ta'minlanadi. Etilen, dietil efir, etanol va suvdan tashkil topgan reaktsiya mahsulotlari issiqlik almashtirgich 3 va kondensator 5 orqali o'tadi, ularda suv, etanol va dietil efir kondensatsiyalanadi.
6 -ustunda aralash gaz va suyuq fazalarga bo'linadi; asosan etilendan tashkil topgan gaz fazasi iste'molchiga qattiq sorbentli quritish va tozalash tizimlari orqali yuboriladi. Suyuqlik refluks kondensator 8 bilan 7 -ustunga beriladi, u yuqori mahsulotga (etanol va dietil efir aralashmasi) va pastroq mahsulotga (suv) bo'linadi. Yuqori mahsulot 4 -reaktorga, quyi mahsulot esa nasos 9 orqali absorber 6 ga uzatiladi. Bunday holda etanolni etilenga deyarli to'liq aylantirishga erishiladi.
Bosim ostida etanolni suvsizlantirish orqali etilen ishlab chiqarish jarayoni eksperimental tarzda o'rganildi. Etanol faol alumina bilan to'ldirilgan reaktor orqali 33 atm bosim ostida nasos bilan tajriba zavodiga yuborildi. Yuqori qon bosimi haroratni 425 ° ga ko'tarish zarurati tufayli. Etilen rentabelligi 95% ga etdi, olingan mahsulotning sofligi 99%.
2.4 Qayta ishlash gazlaridan etilen ishlab chiqarish
Yog 'termal va katalitik yorilish gazlarida 2 - 2,5% etilen mavjud. Termal yorilish natijasida olingan etilen miqdori og'irligi 0,15% dan oshmaydi. qayta ishlangan xom ashyo va katalitik yorilish uchun - 0,45%. Shuning uchun, etilen ishlab chiqarishning gaz ajratish birligi odatda bir xil yorilish gazining ba'zi tarkibiy qismlarining (etan, propan, propilen va ba'zan butan) yorilish gazi va piroliz gazlari aralashmasidan iborat ozuqada ishlaydi. Bunday gazlardan etilen olish sxemasi quyida blok diagrammada ko'rsatilgan, b. Qayta ishlash gazlari tozalash tizimidan o'tadi va siqish va oldindan quritish uchun yuboriladi. Siqilishdan oldin, hajmiga 30-35% gacha bo'lgan piroliz gazlari bu oqimga biriktiriladi. Etilen. Siqishdan, og'ir uglevodorodlarni oldindan ajratishdan va chuqur quritgandan so'ng, aralash gaz ajratishga yuboriladi. Gazni ajratishning maqsadli mahsuloti etilen, ba'zida propilen va butan -butilen aralashmalari bo'lib, to'yingan uglevodorodlar - etan propan piroliz qurilmasiga qaytariladi.
Etilen ishlab chiqarish uchun asosiy xom ashyo manbalaridan biri hisoblanadi tabiiy gazlar.
Tabiiy gazlardan etilen ishlab chiqarish jarayonining blok-diagrammasi A-diagrammada ko'rsatilgan:

Ma'lumki, Britaniya orollari aholisi qaram bo'lib qolgan. Bir vaqtning o'zida dunyoning yarmini o'z nazorati ostiga qo'yib, ular hayotning oddiy quvonchlarini unutishmadi. Masalan, olma haqida. 19-asrning o'rtalari va 20-yillarning boshlarida olma etishtirish o'zining eng yuqori cho'qqisiga chiqdi, lekin biluvchi uchun naslchilik va navlar yagona nav emas. Biluvchi bo'lish - bu nafaqat o'zingiz yoqtirgan navni maydalash va boshqalarni bilish, balki pishishi va saqlanishi davomida har bir olma uchun ta'mi va tuzilishi rivojlanishini kuzatish demakdir. Biz ko'pincha meva murakkab biokimyo va o'z gormonlariga ega bo'lgan tirik organizm deb o'ylamaymiz. Hatto mevalar ham allaqachon o'simlikdan uzilgan. Tuzilishi bo'yicha eng oddiy gormonlardan biri, eng muhimlaridan biri va shuning uchun ham eng ko'p o'rganilgani - etilen (C 2 H 4) o'simlik kamolot gormoni. Etilen barcha mevalarni tarqatishda asosiy ishtirokchidir. Siz bananni qattiq va tashish oson bo'lgan paytda tanlaysiz, lekin yashil, biriktiruvchi va yemaydigan xom, ularni dunyoning istalgan nuqtasiga o'n ming kilometrga yuboring. Keyin kuting, tabiiy ravishda ajralib chiqadigan etuklik gormoni ta'siri ostida ular pishib, yumshoq va xushbo'y bo'ladi, yoki agar siz ularni hozir sotishingiz kerak bo'lsa, siz sun'iy etilen atmosferasini yaratasiz.
Etilen, aslida, o'simlik gormoni, keng ta'sirga ega, u o'simliklarning o'sishini, barglarning tushishini, gul ochilishini tartibga soladi. Ammo bu biz uchun meva pishadigan gormon sifatida qiziq.
Meva - tabiat tomonidan oziq -ovqat sifatida mo'ljallangan yagona oziq -ovqat. Bu o'simlikning urug'ini keng maydonga tarqatish usuli. Urug'lar unib chiqishga tayyor bo'lganda, mevani distribyutorlar yeyish sharti bilan. Va o'simlik buni pishib etish orqali tartibga soladi. Bu jarayonning biokimyosi murakkab, lekin aniq. Xlorofillning antosiyaninlar va karotenoidlarning rangli pigmentlariga bo'linishi, ta'msiz polisaxaridlarning shirin shakarlarga bo'linishi, aromatik birikmalar to'planishi, meva yumshashi bilan hujayra devori pektinlarining parchalanishi natijasida rang o'zgarishi.
O'simliklarning keng guruhida bu jarayonlar mevadan, hatto o'simlikdan olinib, ozuqa moddalari etkazib berishni to'xtatgandan keyin ham sodir bo'lishi mumkin. Bu mevalarda pishishni boshlash uchun etarlicha boshlang'ich moddalar to'plangan. Va bu kamolotga etilen gormoni sabab bo'ladi. Ilmiy adabiyotda bunday mevalar klimakterik deb ataladi, bular olma, banan, pomidor va boshqalar.
Boshqa mevalar guruhi uchun faqat novdaga kirganda pishishi mumkin ozuqa moddalari o'simliklar. Bu guruhga ananas, sitrus mevalari kiradi. Olib tashlanganidan keyin ular endi pishmaydi.
Etilen - bu o'ziga xos hidga ega ko'rinmas gaz, shuning uchun uyda pishib etish jarayonlari biroz sirli ko'rinadi - siz bananni javonga qo'yasiz va pishishini bir hafta kutib, muhrlangan sumkaga solasiz va sizga kerak bo'ladi. kamroq kutish. Buning sababi shundaki, etilen ijobiy teskari aloqa printsipi asosida ishlaydi - u mevaning o'zi tomonidan chiqariladi va o'sha mevada gormon vazifasini bajaradi, banan ko'p etilen chiqaradi, bunda ular deyarli chempionlar. Zarar bo'lsa, suv etishmasligi va boshqa stresslar bo'lsa, etilenning chiqishi oshadi. Aytishlaricha, bu haqiqat avvaldan ma'lum bo'lgan Qadimgi Misr anjir pishishi uchun novdalarga bir nechta mevalar kesilganda.
Kimyoviy tuzilishi bo'yicha etilen eng oddiy alken va eng keng tarqalganlaridan biridir kimyoviy moddalar Odatda oltingugurt kislotasi bilan raqobatlashadigan dunyoda ishlab chiqariladi. Albatta, mevaning pishishi uchun emas. Masalan, polietilen monomer sifatida.
Ta'rif
Etilen (eten)- alkenlar turkumining birinchi vakili - bitta juft bog'langan to'yinmagan uglevodorodlar.
Formula - C 2 H 4 (CH 2 = CH 2). Molekulyar og'irligi (bir mol massasi) - 28 g / mol.
Etilendan olingan uglevodorod radikaliga vinil (-CH = CH 2) deyiladi. Etilen molekulasidagi uglerod atomlari sp 2 -gibridlanish holatidadir.
Etilenning kimyoviy xususiyatlari
Etilen elektrofil, qo'shilish, radikal almashtirish, oksidlanish, qaytarilish va polimerlanish reaktsiyalari mexanizmi orqali o'tadigan reaktsiyalar bilan tavsiflanadi.
Galogenlash(elektrofil qo'shimchalar) - etilenning galogenlar bilan o'zaro ta'siri, masalan, bromli suv rangsizlangan brom bilan:
CH 2 = CH 2 + Br 2 = Br -CH 2 -CH 2 Br.
Etilenni halogenlash ham (300C) qizdirilganda mumkin, bu holda er -xotin aloqa uzilmaydi - reaktsiya radikal almashtirish mexanizmiga muvofiq davom etadi:
CH 2 = CH 2 + Cl 2 → CH 2 = CH-Cl + HCl.
Gidrohalogenatsiya- etilenning vodorod galogenidlari (HCl, HBr) bilan galogenlangan alkanlar hosil bo'lishi bilan o'zaro ta'siri:
CH 2 = CH 2 + HCl → CH 3 -CH 2 -Cl.
Gidratatsiya- etilenning mineral kislotalar (sulfat, fosfor) ishtirokida suv bilan o'zaro ta'siri, to'yingan monohidrik spirt - etanol hosil bo'lishi bilan:
CH 2 = CH 2 + H 2 O → CH 3 -CH 2 -OH.
Elektrofil qo'shilish reaktsiyalari orasida qo'shimcha gipoxlor kislotasi(1), reaktsiyalar gidroksi- va alkoksimerkuratsiya(2, 3) (organomerkur birikmalarini olish) va gidroizolyatsiya (4):
CH 2 = CH 2 + HClO → CH 2 (OH) -CH 2 -Cl (1);
CH 2 = CH 2 + (CH 3 COO) 2 Hg + H 2 O → CH 2 (OH) -CH 2 -Hg -OCOCH 3 + CH 3 COOH (2);
CH 2 = CH 2 + (CH 3 COO) 2 Hg + R-OH → R-CH 2 (OCH 3) -CH 2 -Hg-OCOCH 3 + CH 3 COOH (3);
CH 2 = CH 2 + BH 3 → CH 3 -CH 2 -BH 2 (4).
Nukleofil qo'shilish reaktsiyalari elektron chiqaruvchi o'rinbosarlarni o'z ichiga olgan etilen hosilalariga xosdir. Nukleofil qo'shilish reaktsiyalari orasida gidrosiyan kislotasi, ammiak, etanolning qo'shilish reaktsiyalari alohida o'rin tutadi. Masalan,
2 ON -CH = CH 2 + HCN → 2 ON -CH 2 -CH 2 -CN.
Davomida oksidlanish reaktsiyalari etilen, turli xil mahsulotlarning hosil bo'lishi mumkin va tarkibi oksidlanish shartlari bilan belgilanadi. Shunday qilib, etilen oksidlanish jarayonida engil sharoitda(oksidlovchi vosita - kaliy permanganat), bond aloqasi uziladi va dihidrik spirt - etilen glikol hosil bo'ladi:
3CH 2 = CH 2 + 2KMnO 4 + 4H 2 O = 3CH 2 (OH) -CH 2 (OH) + 2MnO 2 + 2KOH.
Da kuchli oksidlanish etilen kislotali muhitda kaliy permanganatning qaynab turgan eritmasi bilan, formik kislota va karbonat angidrid hosil bo'lishi bilan aloqaning to'liq uzilishi (d-bog) sodir bo'ladi:
![]()
Oksidlanish etilen kislorod 200C da CuCl 2 va PdCl 2 ishtirokida asetaldegid hosil bo'lishiga olib keladi:
CH 2 = CH 2 + 1 / 2O 2 = CH 3 -CH = O.
Da qayta qurish etilen, alkan sinfining vakili etan hosil bo'ladi. Etilenning qaytarilish reaktsiyasi (gidrogenlanish reaktsiyasi) radikal mexanizm orqali davom etadi. Reaktsiya sharti - bu katalizatorlarning (Ni, Pd, Pt) mavjudligi, shuningdek reaktsiya aralashmasini qizdirish:
CH 2 = CH 2 + H 2 = CH 3 -CH 3.
Etilen kiradi polimerlanish reaktsiyasi... Polimerizatsiya - bu yuqori molekulyar birikma - polimer hosil bo'lish jarayoni, boshlang'ich past molekulyar modda - monomer molekulalarining asosiy valentliklari yordamida bog'lanish orqali. Etilen polimerizatsiyasi kislotalar (kationik mexanizm) yoki radikallar (radikal mexanizm) ta'sirida sodir bo'ladi:
n CH 2 = CH 2 = -( -CH 2 -CH 2 -) n -.
Etilenning fizik xususiyatlari
Etilen - rangsiz gaz, hidsiz, suvda oz eriydi, spirtda eriydi, dietil efirda yaxshi eriydi. Havo bilan aralashganda portlovchi aralashma hosil qiladi
Etilen olish
Etilen ishlab chiqarishning asosiy usullari:
- gidroksidi alkogolli eritmalari ta'sirida galogenli alkanlar dehidrohalogenatsiyasi
CH 3 -CH 2 -Br + KOH → CH 2 = CH 2 + KBr + H 2 O;
- faol metallar ta'sirida dihalogenli alkan hosilalarini dehalogenlash
Cl -CH 2 -CH 2 -Cl + Zn → ZnCl 2 + CH 2 = CH 2;
- etilenni sulfat kislota (t> 150 C) bilan qizdirish yoki bug'ini katalizator orqali o'tkazib suvsizlantirish.
CH 3 -CH 2 -OH → CH 2 = CH 2 + H 2 O;
- etanni katalizator (Ni, Pt, Pd) ishtirokida (500S) qizdirish orqali suvsizlantirish.
CH 3 -CH 3 → CH 2 = CH 2 + H 2.
Etilenni qo'llash
Etilen ulkan sanoat miqyosida ishlab chiqariladigan eng muhim birikmalardan biridir. U turli xil organik birikmalar (etanol, etilen glikol, sirka kislotasi va boshqalar) ni ishlab chiqarish uchun xom ashyo sifatida ishlatiladi. Etilen polimerlar (polietilen va boshqalar) ishlab chiqarish uchun xom ashyo sifatida ishlatiladi. Sabzavot va mevalarning o'sishi va pishishini tezlashtiruvchi modda sifatida ishlatiladi.
Muammolarni hal qilishga misollar
MISOL 1
| Mashq qilish | Bir qator o'zgarishlarni amalga oshiring etan → eten (etilen) → etanol → eten → xloretan → butan. |
| Yechim | Etandan etan (etilen) olish uchun katalizator (Ni, Pd, Pt) ishtirokida va qizdirilganda sodir bo'ladigan etan dehidrogenlash reaktsiyasidan foydalanish kerak: C 2 H 6 → C 2 H 4 + H 2. Etandan etanol olish gidratlanish reaktsiyasi bo'yicha, suv oqimi mineral kislotalar (sulfat, fosfor) ishtirokida amalga oshiriladi: C 2 H 4 + H 2 O = C 2 H 5 OH. Etanoldan etin olish uchun suvsizlanish reaktsiyasi qo'llaniladi: Xloroetan etaldan gidrohalogenlash reaktsiyasi orqali olinadi: C 2 H 4 + HCl → C 2 H 5 Cl. Xloretandan butan olish uchun Vurtts reaktsiyasi qo'llaniladi: 2C 2 H 5 Cl + 2Na → C 4 H 10 + 2NaCl. |
MISOL 2
| Mashq qilish | Zichligi 0,8 g / ml bo'lgan 160 ml etanoldan necha litr va gramm etilen olish mumkinligini hisoblang. |
| Yechim | Etilenni suvsizlantirish reaktsiyasi orqali etanoldan olish mumkin, uning sharti mineral kislotalarning (sulfat, fosfor) mavjudligi. Etanoldan etilen olish reaktsiyasining tenglamasini yozamiz: C 2 H 5 OH → (t, H2SO4) → C 2 H 4 + H 2 O. Etanolning massasini topamiz: m (C 2 H 5 OH) = V (C 2 H 5 OH) × ρ (C 2 H 5 OH); m (C 2 H 5 OH) = 160 × 0,8 = 128 g. Jadval yordamida hisoblangan etanolning molyar massasi (bir molning molekulyar og'irligi) kimyoviy elementlar DI. Mendeleyev - 46 g / mol. Keling, etanol moddasining miqdorini topaylik: v (C 2 H 5 OH) = m (C 2 H 5 OH) / M (C 2 H 5 OH); v (C 2 H 5 OH) = 128/46 = 2.78 mol. V (C 2 H 5 OH) reaktsiya tenglamasiga ko'ra: v (C 2 H 4) = 1: 1, shuning uchun v (C 2 H 4) = v (C 2 H 5 OH) = 2.78 mol. D.I. kimyoviy elementlari jadvali yordamida hisoblangan etilenning molyar massasi (bir molning molekulyar og'irligi). Mendeleyev - 28 g / mol. Etilenning massasi va hajmini topaylik: m (C 2 H 4) = v (C 2 H 4) × M (C 2 H 4); V (C 2 H 4) = v (C 2 H 4) × V m; m (C 2 H 4) = 2,78 x 28 = 77,84 g; V (C 2 H 4) = 2,78 × 22,4 = 62,272 litr. |
| Javob | Etilen massasi 77,84 g, etilen hajmi 62,272 litr. |
Etilen(boshqa ism - eten) - C 2 H 4 formulasi bilan tasvirlangan kimyoviy birikma. Etilen tabiatda deyarli topilmaydi. Bu rangsiz, past hidli gaz. Qisman suvda eriydi(0 ° C da 100 ml suvda 25,6 ml), etanol (bir xil sharoitda 359 ml). U dietil efir va uglevodorodlarda yaxshi eriydi.
Etilen - bu eng oddiy alken(olefin). U er -xotin bog'lanishni o'z ichiga oladi va shuning uchun to'yinmagan birikmalarga tegishli. Sanoatda juda muhim rol o'ynaydi, shuningdek fitohormon hisoblanadi.
Polietilen uchun xom ashyo va nafaqat
Etilen - dunyodagi eng ko'p ishlab chiqariladigan organik birikma; 2005 yilda jahon etilenining umumiy ishlab chiqarish hajmi 107 million tonnani tashkil etdi va yiliga 4-6 foizga o'sishda davom etmoqda. Etilenni sanoat ishlab chiqarishining manbai - bu turli uglevodorodli xom ashyolarning pirolizi, masalan, neft ishlab chiqarish bilan bog'liq gazlar tarkibidagi etan, propan, butan; suyuq uglevodorodlardan - yog'ni to'g'ridan -to'g'ri distillashning past oktanli fraktsiyalari. Etilen rentabelligi taxminan 30%ni tashkil qiladi. Shu bilan birga, propilen va bir qator suyuq mahsulotlar (shu jumladan aromatik uglevodorodlar) hosil bo'ladi.
Etilen xlorlanganda 1,2-dikloroetan olinadi, gidratlanish etil spirti, HCl bilan o'zaro ta'sir etilxloridga olib keladi. Atilenni kislorod bilan katalizator ishtirokida oksidlanish natijasida etilen oksidi hosil bo'ladi. Kislorod bilan suyuq fazali katalitik oksidlanish bilan, xuddi shu sharoitda sirka kislotasi - vinilatsetat ishtirokida asetaldegid olinadi. Etilen-alkillovchi vosita, masalan, Fridel-Krafts reaktsiyasi sharoitida u benzol va boshqa aromatik birikmalarni alkillashga qodir. Etilen har xil xususiyatlarga ega bo'lgan polimerlarning keng assortimentini hosil qilib, mustaqil ravishda ham, komonomer sifatida ham katalizatorlar ishtirokida polimerlanish imkoniyatiga ega.
Ilova
Etilen sanoat kimyosining asosiy mahsulotlaridan biri bo'lib, bir qator sintez zanjirlarining asosini tashkil etadi. Etilenning asosiy ishlatilishi polietilen ishlab chiqarishda monomer sifatida(dunyodagi eng yirik polimer). Polimerlanish shartlariga qarab past bosimli polietilen va yuqori bosimli polietilen olinadi.
Bundan tashqari, polietilen ishlatiladi bir qator kopolimerlar ishlab chiqarish shu jumladan propilen, stirol, vinilatsetat va boshqalar. Etilen - etilen oksidi ishlab chiqarish uchun xom ashyo; etilbenzol, dietilbenzol, trietilbenzol ishlab chiqarishda alkillovchi vosita sifatida.
Etilen boshlang'ich material sifatida ishlatiladi asetaldegid va sintetik etil spirti ishlab chiqarish... Bundan tashqari, etilatsetat, stirol, vinilatsetat, vinilxlorid sintezi uchun ishlatiladi; 1,2-dikloroetan, etilxlorid ishlab chiqarishda.
Buning uchun etilen ishlatiladi meva pishib etishining tezlashishi- masalan, pomidor, qovun, apelsin, mandarin, limon, banan; o'simliklarni defoliatsiya qilish, mevalarning yig'im-terim oldidan tushishini kamaytirish, mevalarni ona o'simliklarga yopishtirish kuchini kamaytirish, bu esa mexanizatsiyalashtirilgan yig'im-terim ishlarini osonlashtiradi.
Etilen odamlarda va hayvonlarda yuqori konsentratsiyaga ega. giyohvandlik ta'siri.