Където се прилага законът за бойли мариотите. Закони за газа
Законът на Бойл-Мариот е както следва:
В математическа форма това твърдение се записва под формата на формулата
където - налягане на газа; - обем на газа, и - постоянна стойност при договорените условия. Като цяло, стойността се определя от химическата природа, масата и температурата на газа.
Очевидно, ако индексът 1 обозначават количествата, свързани с първоначалното състояние на газа, и индекса 2 - до крайния, тогава дадената формула може да бъде записана във формата
.
От горните и горните формули следва формата на зависимостта на налягането на газа от неговия обем в изотермичния процес:
Тази зависимост е друг, еквивалентен на първия, израз на съдържанието на закона на Бойл – Мариот. Означава, че
Налягането на маса газ при постоянна температура е обратно пропорционално на неговия обем.
Тогава връзката между началното и крайното състояние на газа, участващ в изотермичния процес, може да се изрази като:
Трябва да се отбележи, че приложимостта на тази и горната формула, която свързва първоначалното и крайното налягане и обемите на газа помежду си, не се ограничава до случая на изотермични процеси. Формулите остават валидни в случаите, когато температурата се променя по време на процеса, но в резултат на процеса крайната температура се оказва равна на първоначалната.
Важно е да се уточни, че този закон е валиден само в случаите, когато въпросният газ може да се счита за идеален. По-специално, законът на Бойл - Мариот се изпълнява с висока точност по отношение на разредените газове. Ако газът е силно компресиран, тогава се наблюдават значителни отклонения от този закон.
Последствия
Законът на Бойл - Мариот гласи, че налягането на газ в изотермичен процес е обратно пропорционално на обема, зает от газа. Ако вземем предвид, че плътността на газа също е обратно пропорционална на обема, който заема, тогава стигаме до заключението:
При изотермичен процес налягането на газа се променя право пропорционално на неговата плътност.
Така стигаме до извода:
Изотермичният коефициент на свиваемост на идеалния газ е равен на обратното на неговото налягане.
Вижте също
Напишете отзив за Закона на Бойл - Мариот
Бележки (редактиране)
- Петрушевски Ф.Ф.// Енциклопедичен речник на Брокхаус и Ефрон
- // Физическа енциклопедия / гл. изд. А. М. Прохоров. - М .: Съветска енциклопедия, 1988 .-- Т. 1. - С. 221-222. - 704 стр. - 100 000 копия
- Сивухин Д.В.Общ курс по физика. - М .: Физматлит, 2005. - Т. II. Термодинамика и молекулярна физика. - С. 21-22. - 544 стр. - ISBN 5-9221-0601-5.
- Начален учебник по физика / Изд. Г. С. Ландсберг. - М .: Наука, 1985. - T.I. Механика. Топлина. Молекулярна физика. - С. 430 .-- 608 с.
- Кикоин А.К., Кикоин И.К.Молекулярна физика. - М .: Наука, 1976 .-- С. 35-36.
- При постоянна маса.
- Лившиц Л.Д.// Физическа енциклопедия / гл. изд. А. М. Прохоров. - М .: Голяма руска енциклопедия, 1994 .-- Т. 4. - С. 492-493. - 704 стр. - 40 000 екземпляра - ISBN 5-85270-087-8.
литература
- Петрушевски Ф.Ф.// Енциклопедичен речник на Брокхаус и Ефрон: в 86 тома (82 тома и 4 допълнителни). - SPb. , 1890-1907.
Откъс от Закона на Бойл – Мариот
„Тя е тази“, чу се груб женски глас в отговор и след това в стаята влезе Маря Дмитриевна.Всички млади дами и дори дами, с изключение на най-възрастната, се изправиха. Мария Дмитриевна спря на прага и от височината на тлъстото си тяло, вдигнала високо петдесетгодишната си глава със сиви къдрици, погледна гостите и, сякаш се навиваше, оправи безропотно широките ръкави на роклята си. Мария Дмитриевна винаги говореше руски.
„Скъпа рожденичка с децата“, каза тя със своя силен, плътен глас, който потиска всички останали звуци. „Какво си, стар грешник“, обърна се тя към графа, който й целуваше ръка, „чай, липсва ли ти Москва? Няма къде да гоним кучетата? Но какво, татко, да правиш, така растат тези птици... - Тя посочи момичетата. - Искаш ли или не, трябва да търсиш ухажори.
- Е, какво, казаче мой? (Мария Дмитриевна нарече Наташа казак) - каза тя, като погали Наташа с ръка, която се приближи до ръката й без страх и весело. - Знам, че отварата е момичешка, но я обичам.
Тя извади обеци за яхта с круши от огромен ретикул и, като ги подари на Наташа, която блестеше и се изчерви за рождения си ден, веднага се обърна от нея и се обърна към Пиер.
- Ех, ех! мил! ела тук - каза тя с престорен нисък и тънък глас. - Хайде, скъпа моя...
И тя зловещо запретна ръкави още по-високо.
Пиер се приближи, гледайки я невинно през очилата си.
- Ела, ела, мила! Казах истината на баща ти сам, когато той беше в случая и тогава Бог ти заповядва.
Тя направи пауза. Всички мълчаха, очакваха какво ще се случи и чувстваха, че има само предговор.
- Браво, няма какво да се каже! добро момче!... Бащата ляга на леглото, а той се забавлява, слага тримесечника на мечката на кон. Срам, татко, срам! Би било по-добре да отиде на война.
Тя се обърна и протегна ръка към графа, който едва се сдържаше да не се разсмее.
- Добре, добре, на масата, имам чай, време ли е? - каза Мария Дмитриевна.
Графът тръгна напред с Мария Дмитриевна; после графинята, която беше водена от хусарския полковник, точният човек, с когото Николай трябваше да настигне полка. Анна Михайловна - с Шиншин. Берг подаде ръка на Вера. Усмихната Джули Карагина отиде с Николай на масата. Следват други двойки, простиращи се през залата, а зад всички, едно по едно, деца, възпитатели и гувернантки. Сервитьорите се размърдаха, столовете затракаха, в хора заигра музика и гостите се настаниха. Звуците на домашната музика на графа бяха заменени от звуците на ножове и вилици, разговорите на гостите, тихите стъпки на сервитьорите.
Графинята седеше в единия край на масата. Вдясно е Мария Дмитриевна, вляво е Анна Михайловна и други гости. На другия край седеше графът, отляво един хусарски полковник, отдясно Шиншин и други гости от мъжки пол. От едната страна на дългата маса има по-възрастни младежи: Вера до Берг, Пиер до Борис; от друга страна, деца, възпитатели и гувернантки. Иззад кристалите, бутилките и фруктиерите графът гледаше жена си и нейната висока шапка със сини панделки и усърдно наливаше вино на съседите си, без да забравя себе си. Графинята също заради ананасите, без да забравя задълженията на домакинята, хвърли значителни погледи към съпруга си, чиято плешива глава и лице, както й се струваше, с червенината си се различаваха по-рязко от сивата коса. От страна на дамите имаше равно бърборене; на мъжкия се чуха гласове все по-силно и по-силно, особено на хусарския полковник, който толкова яде и пи, все повече се изчервяваше, че графът вече го поставяше за пример на другите гости. Берг говори с Вера с нежна усмивка, че любовта не е земно чувство, а небесно. Борис повика новия си приятел Пиер гостите на масата и размени погледи с Наташа, която седеше срещу него. Пиер говореше малко, оглеждаше нови лица и ядеше много. Започвайки от две супи, от които избра торта, [костенурки] и кулебяки, и до лешник, не пропусна нито едно ястие, нито едно вино, което икономът мистериозно избута от рамото на съседа в бутилка увити в салфетка, казвайки или „драй Мадейра, или унгарски, или рейн. Той замени първата от четирите кристални чаши с графски монограм, стоящ пред всяко устройство, и отпи с удоволствие, гледайки гостите с все по-приятен въздух. Наташа, която седеше срещу него, гледаше Борис, както момичета на тринадесет години гледат момчето, с което току-що се целунаха за първи път и в което са влюбени. Този неин поглед понякога се обръщаше към Пиер и под погледа на това забавно, жизнено момиче той сам искаше да се смее, без да знае защо.
Николай седеше далеч от Соня, до Джули Карагина и отново със същата неволна усмивка говореше с нея. Соня се усмихна церемониално, но очевидно беше измъчвана от ревност: пребледня, после се изчерви и с всичка сила слушаше какво си говорят Николай и Джули. Гувернантката се огледа неспокойно, сякаш се подготвяше за отпор, ако някой се е сетил да обиди децата. Германският губернатор се опитал да запомни всякакви храни, десерти и вина, за да опише всичко подробно в писмо до семейството си в Германия и много се обидил, че икономът с бутилка, увита в салфетка, го носи наоколо. Германецът се намръщи, опита се да се преструва, че не иска да получи това вино, но се обиди, защото никой не искаше да разбере, че виното му трябва не за да утоли жаждата си, не от алчност, а от съвестно любопитство.
В мъжкия край на масата разговорът ставаше все по-оживен. Полковникът каза, че манифестът за обявяването на войната вече е публикуван в Санкт Петербург и че екземплярът, който той сам е видял, сега е доставен по куриер на главнокомандващия.
22. Законът на Бойл-Мариот
Един от законите на идеалния газ е Законът на Бойл-Мариот,което гласи: произведението на налягането Ппо обем Vгаз при постоянна газова маса и постоянна температура. Това равенство се нарича изотермични уравнения... Изотермата е изобразена на PV-диаграмата на газовото състояние под формата на хипербола и в зависимост от температурата на газа заема една или друга позиция. Процесът, протичащ при T= const се извиква изотермичен.Газ при T= const има постоянна вътрешна енергия U. Ако газът се разширява изотермично, тогава цялата топлина отива на работа. Работата, която газът извършва, разширявайки се изотермично, е равна на количеството топлина, което трябва да бъде предадено на газа, за да го извърши:
dА= dQ= PdV,
къде А- елементарна работа;
dV-елементарен обем;
П- налягане. Ако V 1> V 2 и P 1< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие T= const е изпълнено, е необходимо промените в налягането и обема да се считат за безкрайно бавни. Съществува и изискване за средата, в която се намира газът: той трябва да има достатъчно висок топлинен капацитет. Формулите за изчисление са подходящи и в случай на подаване на топлинна енергия към системата. Свиваемостгаз се нарича неговото свойство да променя обема си при промяна на налягането. Всяко вещество има фактор на свиваемост,и е равно на:
c = 1 / VО (dV / CP) T,
тук производната е взета в T= const.
Коефициентът на свиваемост се въвежда, за да характеризира промяната в обема с промяна в налягането. За идеален газ той е равен на:
c = -1 / П.
В SI коефициентът на свиваемост има следното измерение: [c] = m 2 / N.
Този текст е уводен фрагмент.От книгата Творчеството като точна наука [Теория за решаване на изобретателски проблеми] автора Алтшулер Генрих Саулович1. Законът за пълнотата на частите на системата Необходимо условие за фундаменталната жизнеспособност на техническата система е наличието и минималната производителност на основните части на системата. Всяка техническа система трябва да включва четири основни части: двигател,
От книгата Интерфейс: Нови насоки в проектирането на компютърни системи автор Ръскин Джеф2. Законът за "енергийната проводимост" на системата Необходимо условие за фундаменталната жизнеспособност на техническата система е преминаването на енергия през всички части на системата. Всяка техническа система е преобразувател на енергия. Оттук и очевидното
От книгата Instrumentation автор Бабаев М.А6. Законът за прехода към суперсистемата След като са изчерпани възможностите за развитие, системата се включва в суперсистемата като една от нейните части; в този случай по-нататъшното развитие се извършва на ниво суперсистема. Вече говорихме за този закон. Да преминем към "динамиката". Тя включва закони, отразяващи
От книгата Топлоинженер автора Бурханова Наталия7. Законът за прехода от макрониво към микрониво Развитието на работещите органи на системата върви първо към макро – и след това към микрониво. В повечето съвременни технически системи работните органи са "парчета желязо", например самолетни витла, автомобилни колела, фрези
От книгата Компютърна лингвистика за всички: митове. Алгоритми. език автора Анисимов Анатолий Василиевич8. Законът за увеличаване на степента на su-поле Развитието на техническите системи върви в посока на увеличаване на степента на su-поле. Смисълът на този закон е, че системите без поле са склонни да се превръщат в su-поле, а в системите на su-поле развитието върви в посока
От книгата Феноменът на науката [Кибернетичен подход към еволюцията] автора Турчин Валентин Федорович От книгата Нанотехнологии [Наука, иновации и възможности] от Фостър Лин4.4.1. Законът на Фитс Представете си, че премествате курсора върху бутон на екрана. Бутонът е целта на това движение. Дължината на правата линия, която свързва началната позиция на курсора и най-близката точка на целта, се дефинира в закона на Фитс като разстояние. На
От книгата История на изключителни открития и изобретения (Електротехника, Електроенергетика, Радиоелектроника) автора Шнайберг Ян Абрамович4.4.2. Закон на Хик Преди да премести курсора към цел или да извърши друго действие от набор от много опции, потребителят трябва да избере този обект или действие. Законът на Хик гласи, че когато е необходимо да се направи избор от n опции, времето за избор
От книгата на автора9. Закон за разпределението на Поасон и Гаус Закон на Поасон. Другото му име е законът за ra-дефиниция на редки събития. Законът на Поасон (Z.P) се прилага в случаите, когато е малко вероятно и поради това използването на B / Z / R е непрактично Предимствата на закона са: удобство при
От книгата на автора23. Законът на Гей-Люсак Законът на Гей-Люсак казва: съотношението на обема на газа към неговата температура при постоянно налягане на газа и масата е постоянно. V / T = m / MO R / P = const при P = const, m = const. Това равенство е името на уравнението на изобара. Изобарът е изобразен на PV-диаграмата на права линия,
От книгата на автора24. Законът на Чарлз Законът на Чарлз гласи, че съотношението на налягането на газа към неговата температура е постоянно, ако обемът и масата на газа са непроменени: P / T = m / MO R / V = const при V = const, m = конст.. Това равенство се нарича уравнение на изохора. Изохора е изобразена на PV-диаграмата чрез права линия, успоредна на оста P, и
От книгата на автора30. Законът за запазване и преобразуване на енергията Първият закон на термодинамиката се основава на универсалния закон за запазване и преобразуване на енергията, който гласи, че енергията не се създава и не изчезва.Тела, участващи в термодинамичния процес, взаимодействат помежду си
От книгата на автораЦАРЕВНА-ЖАБА И ЗАКОНЪТ ЗА СТАБИЛНОСТ Както вече беше подчертано по-рано (законът на абстракцията), примитивното мислене умело анализира конкретни явления и синтезира нови абстрактни системи. Тъй като всеки обект, конструиран от съзнанието, се възприемаше жив и жив
От книгата на автора1.1. Основният закон на еволюцията В процеса на еволюцията на живота, доколкото ни е известно, винаги е имало нарастване на общата маса на живата материя и усложняване на нейната организация. Усложнявайки организацията на биологичните образувания, природата действа по метода на пробите и
От книгата на автора4.2. Законът на Мур В най-простата си форма Законът на Мур се свежда до заявяването, че плътността на окабеляването на транзисторните вериги се удвоява на всеки 18 месеца. Авторството на закона се приписва на един от основателите на известната компания Intel, Гордън Мур. Строго погледнато, в
ОПРЕДЕЛЕНИЕ
Наричат се процеси, при които един от параметрите на газовото състояние остава постоянен изопроцеси.
ОПРЕДЕЛЕНИЕ
Закони за газаса законите, описващи изопроцесите в идеален газ.
Газовите закони са открити експериментално, но всички те могат да бъдат получени от уравнението на Менделеев-Клапейрон.
Нека разгледаме всеки един от тях.
Законът на Бойл-Мариот (изотермичен процес)
Изотермичен процессе нарича промяна в състоянието на газ, при която температурата му остава постоянна.
За постоянна маса газ при постоянна температура, произведението на налягането на газа и обема е постоянна стойност:
Същият закон може да бъде пренаписан в различна форма (за две състояния на идеален газ):
Този закон следва от уравнението на Менделеев-Клапейрон:
![]()
Очевидно при постоянна газова маса и постоянна температура дясната страна на уравнението остава постоянна.
Наричат се графиките на зависимостта на параметрите на газа при постоянна температура изотерми.
Означавайки константата с буква, ние записваме функционалната зависимост на налягането от обема в изотермичен процес:
Вижда се, че налягането на газа е обратно пропорционално на неговия обем. Графиката на обратната пропорционалност и, следователно, графиката на изотермата в координати е хиперболата(фиг. 1, а). Фигури 1 б) и в) показват изотерми в координати и съответно.

Фиг. 1. Графики на изотермични процеси в различни координати
Законът на Гей Лусак (изобарен процес)
Изобарен процессе нарича промяна в състоянието на газ, при което налягането му остава постоянно.
За постоянна маса газ при постоянно налягане съотношението на обема на газа към температурата е постоянна стойност:
Този закон също следва от уравнението на Менделеев-Клапейрон:
![]()
изобари.
Помислете за два изобарни процеса с натиск и заглавие = "(! LANG: Rendered by QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Нека дефинираме формата на графиката в координати.Означавайки константата с буква, записваме функционалната зависимост на обема от температурата в изобарния процес:
Може да се види, че при постоянно налягане обемът на газа е правопропорционален на неговата температура. Графиката на пряката пропорционалност и, следователно, изобарната диаграма в координати е права линия, минаваща през началото(фиг. 2, в). В действителност при достатъчно ниски температури всички газове се превръщат в течности, за които законите за газа вече не са приложими. Следователно, близо до началото на координатите, изобарите на фиг. 2, в) са показани с пунктирана линия.

Фиг. 2. Графики на изобарни процеси в различни координати
Законът на Чарлз (изохориен процес)
Изохоричен процессе нарича промяна в състоянието на газ, при което обемът му остава постоянен.
За постоянна маса газ при постоянен обем, съотношението на налягането на газа към неговата температура е постоянна стойност:
За две състояния на газ този закон ще бъде написан във формата:
Този закон може да се получи и от уравнението на Менделеев - Клапейрон:
![]()
Наричат се графиките на зависимостта на параметрите на газа при постоянно налягане изохори.
Помислете за два изохорни процеса с томове и заглавие = "(! LANG: Rendered by QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
За да определим вида на графиката на изохорния процес в координати, обозначаваме константа в закона на Чарлз с буква, получаваме:
По този начин функционалната зависимост на налягането от температурата при постоянен обем е пряко пропорционална, графиката на такава зависимост е права линия, минаваща през началото (фиг. 3, в).

Фиг. 3. Графики на изохорни процеси в различни координати
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | До каква температура трябва да се охлади изобарно определена маса газ с начална температура, така че обемът на газа да намалее с една четвърт? |
| Решение | Изобарният процес се описва от закона на Гей-Люсак: Според условието на задачата обемът на газа поради изобарно охлаждане намалява с една четвърт, следователно: откъдето е крайната температура на газа: Нека преобразуваме единиците в SI система: начална температура на газа. Да изчислим:
|
| Отговор | Газът трябва да се охлади до температура. |
ПРИМЕР 2
| Упражнение | Затворен съд съдържа газ под налягане 200 kPa. Какво ще бъде налягането на газа, ако температурата се увеличи с 30%? |
| Решение | Тъй като контейнерът с газ е затворен, обемът на газа не се променя. Изохорният процес се описва от закона на Чарлз: Според условието на проблема температурата на газа се е увеличила с 30%, така че можете да напишете: Замествайки последното съотношение в закона на Чарлз, получаваме: Нека преобразуваме единиците в SI система: първоначално налягане на газа kPa = Pa. Да изчислим: |
| Отговор | Налягането на газа става 260 kPa. |
ПРИМЕР 3
| Упражнение | Кислородната система, с която е оборудван самолетът, съдържа |
| Решение | Изотермичният процес се описва от закона на Бойл-Мариот: |
Закон на Бойл - Мариот
Закон на Бойл - Мариъте един от основните газови закони, открит през 1662 г. от Робърт Бойл и независимо преоткрит от Едм Мариот през 1676 г. Описва поведението на газ в изотермичен процес. Законът е следствие от уравнението на Клапейрон.
- 1 Формулировки
- 2 Последици
- 3 Вижте също
- 4 Бележки
- 5 Литература
Формулировката
Законът на Бойл-Мариот е както следва:
При постоянна температура и маса на газа произведението на налягането на газа и неговия обем е постоянен.
В математическа форма това твърдение се записва под формата на формулата
където е налягането на газа; е обемът на газа и е постоянна стойност при договорените условия. Като цяло стойността се определя от химическата природа, масата и температурата на газа.
Очевидно, ако индексът 1 означава количествата, свързани с първоначалното състояние на газа, а индексът 2 - до крайното състояние, тогава горната формула може да бъде записана във формата
.
От горните и горните формули следва формата на зависимостта на налягането на газа от неговия обем в изотермичния процес:
Тази зависимост е друг, еквивалентен на първия, израз на съдържанието на закона на Бойл – Мариот. Означава, че
Налягането на маса газ при постоянна температура е обратно пропорционално на неговия обем.
Тогава връзката между началното и крайното състояние на газа, участващ в изотермичния процес, може да се изрази като:
Трябва да се отбележи, че приложимостта на тази и горната формула, която свързва първоначалното и крайното налягане и обемите на газа помежду си, не се ограничава до случая на изотермични процеси. Формулите остават валидни в случаите, когато температурата се променя по време на процеса, но в резултат на процеса крайната температура се оказва равна на първоначалната.
Важно е да се уточни, че този закон е валиден само в случаите, когато въпросният газ може да се счита за идеален. По-специално, законът на Бойл - Мариот се изпълнява с висока точност по отношение на разредените газове. Ако газът е силно компресиран, тогава се наблюдават значителни отклонения от този закон.
Законът на Бойл – Мариот, законът на Чарлз и законът на Гей-Люсак, допълнени от закона на Авогадро, са достатъчна основа за получаване на уравнението на състоянието за идеален газ.
Последствия
Законът на Бойл - Мариот гласи, че налягането на газ в изотермичен процес е обратно пропорционално на обема, зает от газа. Ако вземем предвид, че плътността на газа също е обратно пропорционална на обема, който заема, тогава стигаме до заключението:
При изотермичен процес налягането на газа се променя право пропорционално на неговата плътност.
Известно е, че свиваемостта, тоест способността на газа да променя обема си под въздействието на налягането, се характеризира с коефициента на свиваемост. В случай на изотермичен процес се говори за коефициент на изотермична свиваемост, който се определя от формулата
където индексът T означава, че частната производна е взета при постоянна температура. Замествайки в тази формула израза за връзката между налягане и обем от закона на Бойл - Мариот, получаваме:Така стигаме до извода:
Изотермичният коефициент на свиваемост на идеалния газ е равен на обратното на неговото налягане.
Вижте също
- Законът на Гей Лусак
- закон на Чарлз
- Законът на Авогадро
- Идеален газ
- Уравнение на състоянието на идеалния газ
Бележки (редактиране)
- Бойл - Законът на Мариот // Физическа енциклопедия / гл. изд. А. М. Прохоров. - М .: Съветска енциклопедия, 1988 .-- Т. 1. - С. 221-222. - 704 стр. - 100 000 копия
- Сивухин Д. В. Общ курс по физика. - М .: Физматлит, 2005. - Т. II. Термодинамика и молекулярна физика. - С. 21-22. - 544 стр. - ISBN 5-9221-0601-5.
- 1 2 Начален учебник по физика / Изд. Г. С. Ландсберг. - М .: Наука, 1985. - T.I. Механика. Топлина. Молекулярна физика. - С. 430 .-- 608 с.
- 1 2 3 Кикоин А.К., Кикоин И.К., Молекулярна физика. - М .: Наука, 1976 .-- С. 35-36.
- При постоянна маса.
- Лившиц Л. Д. Свиваемост // Физическа енциклопедия / гл. изд. А. М. Прохоров. - М .: Велика руска енциклопедия, 1994 .-- Т. 4. - С. 492-493. - 704 стр. - 40 000 екземпляра
ISBN 5-85270-087-8.
литература
- Петрушевски F.F. Закон на Бойл-Мариот // Енциклопедичен речник на Брокхаус и Ефрон: в 86 тома (82 тома и 4 допълнителни). - СПб., 1890-1907.
Законът на Бойл - Информация за Marriott
Закон на Бойл - Мариот
Закон на Бойл - Мариот
Закон на Бойл - МариотВие разглеждате темата
Законът на Бойл - Мариот какво, Законът на Бойл - Мариот кой, Законът на Бойл - Мариот описание
В тази статия и видео има извадки от уикипедия
Нашият сайт разполага със система във функция на търсачка. По-горе: „какво търсехте?“ Можете да направите заявка за всичко в системата с полето. Добре дошли в нашата проста, стилна и бърза търсачка, която сме подготвили да ви предостави най-точната и актуална информация.
Търсачката, създадена за вас, ви предоставя най-подходящата и точна информация с опростен дизайн и бързо функционираща система. Можете да намерите почти всяка информация, която търсите в нашия сайт.
В момента обслужваме само на английски, турски, руски, украински, казахски и беларуски език.
Съвсем скоро към системата ще бъдат добавени нови езици.
Животът на известни хора ви предоставя информация, изображения и видеоклипове по стотици теми като политици, държавни служители, лекари, уебсайтове, растения, технологични превозни средства, автомобили и др.
Законът на Бойл-Мариот

Количествената връзка между обема и налягането на газа е установена за първи път от Робърт Бойл през 1662 г. * Законът на Бойл-Мариот гласи, че при постоянна температура обемът на газа е обратно пропорционален на неговото налягане.
Този закон се прилага за всяко фиксирано количество газ. Както се вижда от фиг. 3.2, графичното му представяне може да бъде различно. Графиката вляво показва, че при ниско налягане обемът на фиксирано количество газ е голям.
Обемът на газа намалява с увеличаване на налягането. Математически се пише така:
Обикновено обаче законът на Бойл-Мариот е написан във формата
Такъв запис позволява например, като се знае първоначалния обем на газа V1 и неговото налягане p, да се изчисли налягането p2 в новия обем V2.
Законът на Гей Лусак (Законът на Чарлз)
През 1787 г. Чарлз показа, че при постоянно налягане обемът на газа се променя (пропорционално на неговата температура. Тази зависимост е показана в графичен вид на фиг. 3.3, от която се вижда, че обемът на газа е линейно свързан с температурата му. В математическа форма тази зависимост се изразява като:
Законът на Чарлз често се пише в различна форма:
V1IT1 = V2T1 (2)
Законът на Чарлз е подобрен от Дж. Гей-Люсак, който през 1802 г. установява, че обемът на газа, когато температурата му се промени с 1°С, се променя с 1/273 от обема, който той заема при 0°С.
Оттук следва, че ако вземем произволен обем на всеки газ при 0 ° С и при постоянно налягане намалим температурата му с 273 ° С, тогава крайният обем ще бъде равен на нула. Това съответства на температура от -273 ° C, или 0 K. Тази температура се нарича абсолютна нула. В действителност това не може да бъде постигнато. На фиг.
3.3 показва как екстраполацията на диаграмите на обема на газа спрямо температурата води до нулев обем при 0 K.
Строго погледнато, абсолютната нула е недостижима. При лабораторни условия обаче е възможно да се достигнат температури, които се различават от абсолютната нула само с 0,001 К. При такива температури произволните движения на молекулите практически спират. Това води до невероятни свойства.
Например, метали, охладени до температури, близки до абсолютната нула, почти напълно губят електрическото си съпротивление и стават свръхпроводящи *. Пример за вещества с други необичайни свойства при ниска температура е хелият.
При температури, близки до абсолютната нула, вискозитетът на хелия изчезва и той става свръхтечен.* През 1987 г. са открити вещества (керамика, синтерована от оксиди на лантанидни елементи, барий и мед), които стават свръхпроводящи при относително високи температури, от порядъка на 100 К (- 173 ° C). Тези "високотемпературни" свръхпроводници отварят големи перспективи в технологиите. превод
Основното лабораторно оборудванее работният плот, на който се извършва цялата експериментална работа.
Всяка лаборатория трябва да има добра вентилация. Необходима е качулка, в която цялата работа се извършва с помощта на миришещи или отровни съединения, както и изгаряне на органични вещества в тигели.
Силно летливи, вредни или миришещи вещества (течен бром, концентрирана азотна и солна киселина и др.) се съхраняват в специален димогарен шкаф, в който не се извършват дейности, свързани с отоплението.
), както и запалими вещества (въглероден дисулфид, етер, бензол и др.).
Лабораторията изисква ВиК, канализация, технически ток, газови и водонагревателни устройства. Желателно е също така да има захранване със сгъстен въздух, вакуумна линия, захранване с топла вода и пара.
Ако няма специална връзка, за получаване на топла вода се използват бойлери от различни системи.
С помощта на тези устройства, нагрявани с електричество или газ, можете бързо да получите струя гореща вода с температура от почти 100 ° C.
Лабораторията трябва да има инсталации за дестилация (или деминерализация) на вода, тъй като е невъзможно да се работи в лаборатория без дестилирана или деминерализирана вода. В случаите, когато е трудно или невъзможно да се получи дестилирана вода, се използва търговска дестилирана вода.
В близост до работни маси и мивки за вода трябва да има глинени буркани с вместимост 10-15 литра за източване на ненужни разтвори, реактиви и др., както и кошове за счупено стъкло, хартия и други сухи отпадъци.
Освен бюра, лабораторията трябва да разполага с бюро, където се съхраняват всички тетрадки и бележки, а при необходимост и заглавна таблица. В близост до работните маси трябва да има високи табуретки или столове.
Аналитичните везни и уредите, изискващи стационарна инсталация (електрометрични, оптични и др.), се поставят в отделно помещение, свързано с лабораторията, като за аналитичната везна трябва да се обособи специално помещение за претегляне. Желателно е везната за претегляне да е разположена с прозорци на север. Това е важно, защото везната не трябва да се излага на слънчева светлина („Везни и претегляне“).
В лабораторията също трябва да имате най-необходимите справочници, ръководства и учебници, тъй като често по време на работа има нужда от тон или друга справка.
Вижте също
Страница 3
Химическите стъклени съдове, използвани в лабораториите, могат да бъдат разделени на няколко групи. По предназначение съдовете могат да се разделят на универсални, със специално предназначение и обемни. По материал - за съдове от обикновено стъкло, специално стъкло, кварц.
Към групата. общо предназначение са тези предмети, които винаги трябва да бъдат в лабораториите и без които не може да се извърши по-голямата част от работата. Това са: епруветки, фунии прости и сепариращи, чаши, плоскодънни колби, кристализатори, конични колби (Ерленмайер), колби на Бунзен, хладилници, реторти, колби за дестилирана вода, тройници, кранове.
Групата със специално предназначение включва тези артикули, които се използват за всяка една цел, например: апаратът на Кип, апаратът Сок-рали, апаратът на Келдал, рефлуксни кондензатори, колби Wul-fa, колби Тишченко, пикнометри, хидрометри, колби Drexel , калиев апарат , уред за определяне на въглероден диоксид, облодънни колби, специални хладилници, уред за определяне на молекулно тегло, уреди за определяне на точките на топене и кипене и др.
Обемните инструменти включват: градуирани цилиндри и чаши, пипети, бюрети и мерни колби.Като начало предлагаме да гледате следното видео, където накратко и лесно са разгледани основните видове химически стъклени съдове.
Вижте също:
Съдове с общо предназначение
Епруветките (фиг. 18) са тесни цилиндрични съдове със заоблено дъно; те се предлагат в различни размери и диаметри и са изработени от различно стъкло. Обикновените "лабораторни епруветки са изработени от нискотопимо стъкло, но за специална работа, когато е необходимо нагряване до високи температури, епруветките са изработени от високотопимо стъкло или кварц.
В допълнение към обикновените, прости тръби, се използват също градуирани и центрофужни конични тръби.
За съхранение на епруветки в експлоатация се използват специални дървени, пластмасови или метални стелажи (фиг. 19).
Ориз. 18. Прости и градуирани тръби
Ориз. 20. Поставяне на етикет с прахообразни вещества в епруветката.
Епруветките се използват главно за аналитична или микрохимична работа. При провеждане на реакции в епруветка, реагентите не трябва да се използват в твърде големи количества. Напълно неприемливо е епруветката да се напълни до ръба.
Реакцията се провежда с малки количества вещества; 1/4 или дори 1/8 от капацитета на епруветката е достатъчна. Понякога е необходимо твърдо вещество (прахове, кристали и др.) да се инжектира в епруветка.
), за това лента хартия с ширина малко по-малка от диаметъра на епруветката се сгъва наполовина по дължината й и необходимото количество твърдо вещество се излива в получената лъжичка. Епруветката се държи в лявата ръка, като се накланя хоризонтално и лъжичката се вкарва в нея почти до дъното (фиг. 20).
След това епруветката се поставя вертикално, "но също така леко се удря върху нея. Когато всички твърди частици се разлеят, извадете лъжичката.
За смесване на излятите реактиви епруветката се държи за горния край с палеца и показалеца на лявата ръка и се поддържа със среден пръст, а дъното на епруветката се удря с показалеца на дясната ръка. Това е достатъчно, за да се смеси добре съдържанието му.
Напълно неприемливо е да затваряте епруветката с пръст и да я разклащате по този начин; в този случай можете не само да въведете нещо чуждо в течността в епруветката, но понякога да повредите кожата на пръста, да получите изгаряне и т.н.
Ако епруветката е повече от половината пълна с течност, разбъркайте съдържанието със стъклена пръчка.
Ако тръбата трябва да се нагрее, тя трябва да бъде захваната в държача.
При неумело и силно нагряване на епруветката течността бързо кипи и изпръсква от нея, така че трябва да я загреете внимателно. Когато започнат да се появяват мехурчета, епруветката трябва да се остави настрана и, като не се държи в пламъка на горелката , но близо до или над него, продължете да загрявате с горещ въздух. При нагряване отвореният край на епруветката трябва да бъде насочен далеч от работника и от съседите на масата.Когато не е необходимо силно нагряване, по-добре е тръбата с нагрятата течност да се потопи в гореща вода. Ако работите с малки епруветки (за полумикроанализ), тогава те се нагряват само в гореща вода, излята в стъклена чаша с подходящ размер (с вместимост не повече от 100 ml).
фуниисе използват за изливане - течности, за филтриране и др. Химическите фунии се произвеждат в различни размери, горните им диаметри са 35, 55, 70, 100, 150, 200, 250 и 300 мм.
Конвенционалните фунии имат гладка вътрешна стена, но понякога се използват фунии с оребрена вътрешна повърхност за по-бързо филтриране.
Филтърните фунии винаги имат ъгъл от 60° и отрязан дълъг край.
По време на работа фуниите се монтират или в специален статив, или в пръстен на обикновен лабораторен статив (фиг. 21).
За филтриране в чаша е полезно да се направи обикновен държач за фуния (фиг. 22) За целта от алуминиев лист с дебелина около 2 мм се изрязва лента с дължина 70-80 lsh и ширина 20 мм. .
В един от краищата на лентата се пробива отвор с диаметър 12-13 mm и лентата се огъва, както е показано на фиг. 22, а. Как да фиксирате фунията върху стъкло е показано на фиг. 22, б.
Когато наливате течност в бутилка или колба, не препълвайте фунията.
Ако фунията приляга плътно към гърлото на съда, в който се излива течността, тогава прехвърлянето става трудно, тъй като вътре в съда се създава повишено налягане. Следователно фунията трябва да се повдига от време на време.
Още по-добре е да направите празнина между фунията и гърлото на съда, като поставите между тях например лист хартия. В този случай трябва да се внимава уплътнението да не попадне в съда. По-препоръчително е да използвате теленен триъгълник, който можете да направите сами.Този триъгълник се поставя на гърлото на съда и след това се вкарва фунията.
На гърлото на съдовете има специални гумени или пластмасови приставки, които осигуряват комуникацията на вътрешността на колбата с външната атмосфера (фиг. 23).
Ориз. 21. Укрепване на стъклената химическа фуния
Ориз. 22. Устройство за закрепване на фунията към чаша, в статив.
За аналитична работа при филтриране е по-добре да използвате аналитични фунии (фиг. 24). Особеността на тези фунии е, че имат удължен отрязан край, чийто вътрешен диаметър е по-малък в горната част, отколкото в долната част; този дизайн ускорява филтрирането.
Освен това има аналитични фунии с оребрена вътрешна повърхност, поддържаща филтъра и със сферично разширение в точката, където фунията преминава в тръбата. Фуниите с този дизайн ускоряват процеса на филтриране до три пъти в сравнение с конвенционалните фунии.
Ориз. 23. Дюзи за гърла на бутилки. Ориз. 24. Аналитична фуния.
Разделителни фунии(фиг. 25) се използват за разделяне на несмесващи се течности (напр. вода и масло). Те са или цилиндрични, или крушовидни и в повечето случаи са оборудвани със стъклена запушалка.
В горната част на разклонителя има стъклен кран. Капацитетът на разделителните фунии е различен (от 50 ml до няколко литра), в зависимост от капацитета се променя и дебелината на стената.
Колкото по-малък е капацитетът на фунията, толкова по-тънки са стените й и обратно.
По време на работа разделителните фунии се укрепват по различни начини в зависимост от капацитета и формата. Цилиндрична фуния с малък капацитет може просто да се прикрепи към крака. Между два пръстена се поставят големи фунии.
Долната част на цилиндричната фуния трябва да лежи върху пръстен, чийто диаметър е малко по-малък от диаметъра на фунията, горният пръстен има малко по-голям диаметър.
Ако фунията се люлее едновременно, трябва да се постави коркова плоча между пръстена и фунията.
Крушовидна делителна фуния е фиксирана върху пръстен, шията й е захваната с лапа. Винаги първо фиксирайте фунията и едва след това изсипвайте в нея течностите, които трябва да се отделят.Капковите фунии (фиг. 26) се различават от разделителните по това, че са по-леки, по-тънки и
Ориз. 25. Разделителни фунии. ориз. 26. Капкови фунии.
В повечето случаи с дълъг край. Тези фунии се използват в много работи, когато веществото се добавя към реакционната маса на малки порции или на капки. Следователно те обикновено са част от устройството. Фуниите се фиксират в гърлото на колбата върху тънък профил или с коркова или гумена запушалка.
Преди да работите с разделителна или капкова фуния, стъклената секция на крана трябва внимателно да се смазва с вазелин или специална грес.
Това прави възможно отварянето на крана лесно и без усилие, което е много важно, тъй като ако кранът се отвори плътно, той може да го счупи при отваряне или да повреди цялото устройство.
Смазката трябва да се нанася на много тънък слой, така че при завъртане на клапана да не попадне в тръбата на фунията или вътре в отвора на клапана.
За по-равномерно изтичане на течни капчици от капкова фуния и за следене на скоростта на подаване на течност се използват капкови фунии с дюза (фиг. 27). Такива фунии имат разширена част непосредствено след крана, която се превръща в тръба. Течността преминава през крана в това разширение през къса тръба и след това в тръбата на фунията.
Ориз. 27. Капкова фуния с накрайник
Ориз. 28. Чашеви чаши.
Ориз. 29. Самолетна фуния с накрайник
Стъклени прибори за маса 1 2 3
Вижте също
Урок 25. Законът на Бойл-Мариот - HIMI4KA

Архив на уроците ›Основни закони на химията
В урок 25" Законът на Бойл-Мариот"От курса" Химия за манекени»Разгледайте закона за налягането и обема на газа, както и графиките на зависимостта на налягането от обема и обема от налягането. Нека ви напомня, че в последния урок "Налягане на газа" разгледахме устройството и принципа на работа на живачен барометър, а също така дадохме определение за налягането и разгледахме неговите мерни единици.
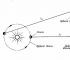
Робърт Бойл(1627-1691), на когото дължим първото практически правилно определение на химичен елемент (научаваме в глава 6), се интересуваше и от явленията, които се случват в съдове с разреден въздух.
Докато изобретява вакуумни помпи за изпомпване на въздух от затворени съдове, той обръща внимание на свойството, познато на всеки, който случайно изпомпва камера за футболна топка или внимателно изстисква балон: колкото повече въздухът се компресира в затворен съд, толкова повече се съпротивлява компресия.
Бойл нарече този имот „ еластичност»Въздух и го измерих с помощта на просто устройство, показано на фиг. 3.2, а и б.
Бойл блокира малко въздух в затворения край на извитата тръба с живак (Фигура 3-2, а) и след това изстиска този въздух, като постепенно добавя живак към отворения край на тръбата (Фигура 3-2, б).
Налягането на въздуха в затворената част на тръбата е равно на сумата от атмосферното налягане и налягането на живачен стълб с височина h (h е височината, на която нивото на живак в отворения край на тръба надвишава нивото на живак в затворения край). Получените от Boyle измервания на налягането и обема са показани в таблица 1. 3-1.
Въпреки че Бойл не е предприел специални мерки за поддържане на постоянна температура на газа, изглежда, че в неговите експерименти тя се е променила само леко. Въпреки това Бойл забелязал, че топлината от пламъка на свещта причинява значителни промени в свойствата на въздуха.
Анализ на данните за налягането и обема на въздуха по време на неговото компресиране
Таблица 3-1, който съдържа експерименталните данни на Boyle за връзката между налягането и обема на околния въздух, се намира под спойлера.
След като изследователят получи данни, подобни на показаните в табл. 3-1, той се опитва да намери математическо уравнение, което свързва двете зависими величини, които е измервал.
Един от начините да се получи такова уравнение е графично да се начертае зависимостта на различни степени на една величина от друга, с надеждата да се получи линейна графика.
Общото уравнение на права линия е:
където x и y са свързани променливи, а a и b са постоянни числа. Ако b е нула, права линия минава през началото.
На фиг. 3-3 показват различни начини за графично изобразяване на данни за налягане P и обем V, показани в табл. 3-1.Графиките на P спрямо 1 / K и V срещу 1 / P са прави линии, минаващи през началото.
Графикът на зависимостта на логаритъма на P от логаритъма на V също е права линия с отрицателен наклон, чиято тангенс е - 1. Всички тези три графика водят до еквивалентни уравнения:
- P = a / V (3-3a)
- V = a / P (3-3b)
- lg V = lg a - lg P (3-3v)
Всяко от тези уравнения представлява една от опциите Законът на Бойл-Мариот, който обикновено се формулира по следния начин: за даден брой молове газ неговото налягане е пропорционално на обема, при условие че температурата на газа остава постоянна.
Между другото, сигурно се чудите защо законът на Бойл-Мариот се нарича с двойно име. Това се случи, защото този закон, независимо от Робърт Бойл, който го открива през 1662 г., е преоткрит от Едм Мариот през 1676 г. Значи това е.
Когато връзката между две измерени величини е проста до степен, в която е в този случай, тя може да бъде установена и числено.
Ако всяка стойност на налягането P се умножи по съответната стойност на обема V, лесно е да се уверите, че всички продукти за дадена газова проба при постоянна температура са приблизително еднакви (вижте таблица 3-1). Така можем да го напишем
Уравнение (З-Зг) описва хиперболичната връзка между стойностите на P и V (виж фиг. 3-3, а). За да проверим дали графиката на зависимостта на P от V, изградена от експерименталните данни, наистина съответства на хиперболата, ще построим допълнителен график на зависимостта на произведението PV от P и ще се уверим, че е хоризонтална права линия (вж. Фиг. 3-3, д) ...
Бойл открива, че за дадено количество газ при постоянна температура, връзката между налягането P и обема V се описва доста задоволително чрез съотношението
- P V = const (при постоянни T и n) (3-4)
Формула на Бойл-Мариот
За да се сравнят обемите и наляганията на една и съща газова проба при различни условия (но постоянна температура), е удобно да се представи Законът на Бойл-Мариотв следната формула:
където индекси 1 и 2 съответстват на две различни условия.
Пример 4. Найлоновите торбички с хранителни продукти, доставени на платото Колорадо (виж пример 3), често се спукват, тъй като въздухът в тях при издигане от морското равнище до 2500 m височина при условия на понижено атмосферно налягане се разширява.
Ако приемем, че вътре в торбата има 100 cm3 въздух при атмосферно налягане, съответстващо на морското равнище, колко обем трябва да заема този въздух при същата температура на платото Колорадо? (Да приемем, че свиващите се торбички се използват за доставяне на хранителни стоки, които не ограничават разширяването на въздуха; липсващите данни трябва да бъдат взети от пример 3.)Решение
Нека използваме закона на Бойл под формата на уравнение (3-5), където индекс 1 ще се отнася за условия на морското равнище, а индекс 2 - за условия на височина от 2500 m над морското равнище. След това трябва да се изчисли Р1 = 1000 атм, V1 = 100 cm3, Р2 = 0,750 атм и V2. Така,
Изследването на връзката между параметрите, характеризиращи състоянието на дадена маса газ, започваме с изследването на газовите процеси, които възникват, когато един от параметрите остава непроменен. английски учен Бойл(през 1669 г.) и френски учен Мариот(през 1676 г.) открива закон, който изразява зависимостта на промяната в налягането от промяната в обема на газа при постоянна температура. Нека проведем следния експеримент.
Чрез завъртане на дръжката ще променим обема газ (въздух) в цилиндър А (фиг. 11, а). Според показанията на манометъра отбелязваме, че налягането на газа се променя едновременно. Ще променим обема на газа в съда (обемът се определя по скалата B) и, като забележим налягането, ще ги запишем в табл. 1. От него се вижда, че произведението на обема на газа от неговото налягане е почти постоянно: колко пъти „обемът на газа е намалял, в същото време се е увеличило налягането му.

В резултат на подобни, по-точни експерименти беше открито: за дадена маса газ при постоянна температура налягането на газа се променя обратно пропорционално на промяната в обема на газа. Това е формулировката на закона на Бойл-Мариот. Математически той ще бъде записан за две състояния, както следва:
![]()
Процесът на промяна на състоянието на газ при постоянна температура се нарича изотермичен.Формулата на Бойл-Мариот е уравнението за изотермичното състояние на газ. При постоянна температура средната скорост на движение на молекулите не се променя. Промяната в обема на газа причинява промяна в броя на ударите на молекулите върху стените на съда. Това е причината за промяната в налягането на газа.
Нека изобразим този процес графично, например, за случая V = 12 литра, p = 1 ат.... Ще нанесем обема на газа по оста на абсцисата, а налягането му върху оста на ординатата (фиг. 11, б). Намираме точките, съответстващи на всяка двойка стойности на V и p, и, свързвайки ги заедно, получаваме графика на изотермичния процес. Линията, изобразяваща връзката между обема и налягането на газ при постоянна температура, се нарича изотерма. Чисти изотермични процеси не протичат. Но често има случаи, когато температурата на газа се променя малко, например, когато компресорът изпомпва въздух в цилиндрите, когато горимата смес се впръсква в цилиндъра на двигател с вътрешно горене. В такива случаи обемът и налягането на газа се изчисляват съгласно закона на Бойл-Мариот *.