Kde platí zákon o boilie mariotte. Zákony o plynu
Boyle-Mariottův zákon je následující:
V matematické formě je tento výrok zapsán ve formě vzorce
kde - tlak plynu; - objem plynu a - stálá hodnota za dohodnutých podmínek. Obecně platí, že hodnota je určena chemickou povahou, hmotností a teplotou plynu.
Je zřejmé, že pokud index 1 označují množství vztahující se k počátečnímu stavu plynu a dolní index 2 - do finále, pak lze daný vzorec zapsat do tvaru
.
Z výše uvedeného a výše uvedených vzorců vyplývá tvar závislosti tlaku plynu na jeho objemu v izotermickém procesu:
Tato závislost je dalším, ekvivalentním prvnímu, vyjádřením obsahu Boyle - Mariotteova zákona. Znamená to, že
Tlak hmoty plynu při konstantní teplotě je nepřímo úměrný jejímu objemu.
Potom lze vztah mezi počátečním a konečným stavem plynu účastnícího se izotermického procesu vyjádřit jako:
Je třeba poznamenat, že použitelnost tohoto a výše uvedeného vzorce, který spojuje počáteční a konečný tlak a objem plynu mezi sebou, není omezena na případ izotermických procesů. Vzorce zůstávají platné v těch případech, kdy se teplota během procesu změní, ale v důsledku procesu se konečná teplota ukáže jako rovna počáteční.
Je důležité upřesnit, že tento zákon platí pouze v případech, kdy lze daný plyn považovat za ideální. Zejména Boyleův - Mariottův zákon je splněn s vysokou přesností ve vztahu ke zředěným plynům. Pokud je plyn silně stlačen, jsou pozorovány významné odchylky od tohoto zákona.
Důsledky
Boyleův zákon - Mariotte říká, že tlak plynu v izotermickém procesu je nepřímo úměrný objemu, který plyn zabírá. Pokud vezmeme v úvahu, že hustota plynu je také nepřímo úměrná objemu, který zaujímá, pak dojdeme k závěru:
Při izotermickém procesu se tlak plynu mění přímo úměrně jeho hustotě.
Dostáváme se tedy k závěru:
Izotermický koeficient stlačitelnosti ideálního plynu se rovná převrácené hodnotě jeho tlaku.
viz také
Napište recenzi na Boylův zákon - Mariotte
Poznámky (upravit)
- Petruševskij F.F.// Encyklopedický slovník Brockhause a Efrona
- // Fyzická encyklopedie / Ch. vyd. A.M. Prochorov. - M .: Sovětská encyklopedie, 1988 .-- T. 1. - S. 221-222. - 704 s. - 100 000 výtisků
- Sivukhin D.V. Obecný kurz fyziky. - M .: Fizmatlit, 2005. - T. II. Termodynamika a molekulární fyzika. - S. 21-22. - 544 str. - ISBN 5-9221-0601-5.
- Elementární učebnice fyziky / Ed. G. S. Landsberg. - M .: Science, 1985. - T. I. Mechanika. Teplo. Molekulární fyzika. - S. 430 .-- 608 s.
- Kikoin A.K., Kikoin I.K. Molekulární fyzika. - M .: Nauka, 1976 .-- S. 35-36.
- Při konstantní hmotnosti.
- Livshits L. D.// Fyzická encyklopedie / Ch. vyd. A.M. Prochorov. - M .: Velká ruská encyklopedie, 1994 .-- T. 4. - S. 492-493. - 704 s. - 40 000 výtisků - ISBN 5-85270-087-8.
Literatura
- Petruševskij F.F.// Encyklopedický slovník Brockhause a Efrona: v 86 svazcích (82 svazcích a 4 dodatečné). - SPb. , 1890-1907.
Výňatek z Boyleova zákona - Mariotte
"To je ona," ozval se hrubý ženský hlas jako odpověď a poté do místnosti vstoupila Marya Dmitrievna.Všechny slečny a dokonce i dámy, kromě nejstarší, vstaly. Marya Dmitrievna se zastavila ve dveřích a z výšky svého korpulentního těla, držíc svou padesátiletou hlavu vysoko s šedými kadeřemi, pohlédla na hosty a jako by se vyhrnula, beze spěchu si narovnala široké rukávy šatů. Marya Dmitrievna vždy mluvila rusky.
"Milá oslavenkyně s dětmi," řekla svým hlasitým, hustým hlasem, který přehlušil všechny ostatní zvuky. „Co jsi, starý hříšník,“ obrátila se k hraběti, který jí líbal ruku, „čaj, chybí ti Moskva? Nemáte kde honit psy? Ale co, otče, dělat, takhle tito ptáci vyrůstají... - Ukázala na dívky. - Jestli chceš nebo ne, musíš si hledat nápadníky.
- No, co, můj kozáku? (Marja Dmitrievna nazvala Natašu kozákem) - řekla a pohladila Natašu rukou, která se beze strachu a vesele přiblížila k její ruce. - Vím, že ten lektvar je dívka, ale miluji ho.
Z obrovské síťovky vyndala jachtové náušnice s hruškami a dala je Nataše, která se k narozeninám leskla a červenala, okamžitě se od ní odvrátila a obrátila se k Pierrovi.
- Eh, eh! druh! pojď sem,“ řekla předstíraným nízkým a tenkým hlasem. - No tak, má drahá...
A zlověstně si vyhrnula rukávy ještě výš.
Pierre přistoupil a nevinně se na ni podíval přes brýle.
- Pojď, pojď, drahá! Řekl jsem tvému otci pravdu sám, když byl v případu, a pak ti Bůh přikazuje.
Odmlčela se. Všichni mlčeli, očekávali, co se stane, a měli pocit, že existuje pouze předmluva.
- Dobře, není co říct! hodný chlapče!... Otec leží na posteli a baví se, posadí čtvrtletník na medvěda na koni. Stydíme se, otče, stydíme se! Bylo by lepší, kdyby šel do války.
Odvrátila se a natáhla ruku k hraběti, který se jen stěží dokázal ubránit smíchu.
- Dobře, dobře, ke stolu, mám čaj, je čas? - řekla Marya Dmitrievna.
Hrabě pokračoval s Maryou Dmitrievnou; pak hraběnka, kterou vedl husarský plukovník, ta pravá osoba, se kterou musel Nikolaj dohnat pluk. Anna Mikhailovna - se Shinshinem. Berg podal Veru ruku. Usměvavá Julie Karagina šla s Nikolajem ke stolu. Následovaly další páry, které se táhly přes chodbu, a za nimi všechny, jeden po druhém, děti, učitelé a vychovatelky. Číšníci se pohnuli, židle zarachotily, ve sboru hrála hudba a hosté se usadili. Zvuky hraběcí domácí hudby vystřídaly zvuky nožů a vidliček, mluvení hostů, tiché kroky číšníků.
Hraběnka seděla na jednom konci stolu. Vpravo je Marya Dmitrievna, vlevo Anna Mikhailovna a další hosté. Na druhém konci seděl hrabě, vlevo husarský plukovník, vpravo Shinshin a další mužští hosté. Na jedné straně dlouhého stolu je starší mládež: Vera vedle Berga, Pierre vedle Borise; na druhé straně děti, vychovatelky a vychovatelky. Zpoza krystalů, lahví a mís s ovocem se hrabě díval na svou ženu a její vysokou čepici s modrými stuhami a pilně naléval víno sousedům, nezapomínaje ani na sebe. Hraběnka také kvůli ananasům, nezapomínaje na povinnosti hostitelky, vrhla významné pohledy na svého manžela, jehož plešatá hlava a obličej se jí, jak se jí zdálo, svou rudostí výrazněji lišily od šedých vlasů. Na ženském konci se ozvalo rovnoměrné blábolení; na té mužské se ozývaly stále hlasitější hlasy, zvláště husarský plukovník, který tolik jedl a pil, červenal se čím dál víc, že už ho hrabě dával za příklad ostatním hostům. Berg mluvil s Verou s jemným úsměvem, že láska není pozemský cit, ale nebeský. Boris zavolal svého nového přítele Pierra mezi hosty u stolu a vyměnil si pohledy s Natašou, která seděla naproti němu. Pierre málo mluvil, rozhlížel se po nových tvářích a hodně jedl. Počínaje dvěma polévkami, z nichž si vybral á la tortue, [želvovina] a kulebyaki, a až po lískové tetřevy, nevynechal jediné jídlo ani jediné víno, které majordomus záhadně vystrčil ze sousedova ramene v láhvi. zabalené v ubrousku, říkajíc nebo „dray Madeira, nebo maďarština, nebo Rýn. První ze čtyř křišťálových sklenic nahradil hraběcím monogramem stojícím před každým zařízením as potěšením popíjel a díval se na hosty stále příjemnějším vzduchem. Natasha, která seděla naproti němu, se na Borise dívala jako třináctileté dívky na chlapce, se kterým se právě poprvé políbili a do kterého jsou zamilované. Právě tento její pohled se někdy obrátil k Pierrovi a pod pohledem této legrační, živé dívky se chtěl sám smát, aniž by věděl proč.
Nikolay seděl daleko od Sonyi, vedle Julie Karaginy, a znovu se stejným bezděčným úsměvem mluvil s ní. Sonya se obřadně usmála, ale zjevně ji mučila žárlivost: zbledla, pak zčervenala a ze všech sil poslouchala, co si Nikolaj a Julie mezi sebou říkají. Vychovatelka se neklidně rozhlížela, jako by se připravovala na odmítnutí, kdyby někoho napadlo urazit děti. Německý guvernér se snažil zapamatovat všemožná jídla, zákusky a vína, aby vše podrobně popsal v dopise své rodině do Německa, a byl velmi uražen, že ho majordomus s lahví zabalenou v ubrousku nesl. Němec se zamračil, snažil se předstírat, že toto víno dostat nechce, ale urazil se, protože nikdo nechtěl pochopit, že víno nepotřebuje k uhašení žízně ne z lakoty, ale ze svědomité zvědavosti.
Na mužském konci stolu byla konverzace stále živější. Plukovník řekl, že manifest o vyhlášení války byl již zveřejněn v Petrohradě a že kopie, kterou sám viděl, byla nyní doručena kurýrem vrchnímu veliteli.
22. Boyle-Mariottův zákon
Jedním ze zákonů ideálního plynu je Boyle-Mariotteův zákon, který zní: součin tlaku P podle objemu PROTI plyn při konstantní hmotnosti plynu a konstantní teplotě. Tato rovnost se nazývá izotermické rovnice... Izoterma je znázorněna na PV-diagramu stavu plynu ve formě hyperboly a v závislosti na teplotě plynu zaujímá jednu nebo druhou polohu. Proces probíhající v T= nazývá se const izotermický. Plyn při T= konst má konstantní vnitřní energii U. Pokud se plyn izotermicky rozpíná, pak veškeré teplo přejde do práce. Práce, kterou plyn při izotermické expanzi vykoná, se rovná množství tepla, které je třeba předat plynu, aby to provedl:
dА= dQ= PdV,
kde d A- základní práce;
dV- elementární objem;
P- tlak. Pokud V 1 > V 2 a P 1< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие T= byla splněna konst, je nutné změny tlaku a objemu považovat za nekonečně pomalé. Dále je zde požadavek na médium, ve kterém se plyn nachází: musí mít dostatečně vysokou tepelnou kapacitu. Vzorce pro výpočet jsou vhodné i v případě dodávky tepelné energie do systému. Stlačitelnost plyn se nazývá jeho vlastnost měnit objem při změně tlaku. Každá látka má stlačitelný faktor, a rovná se:
c = 1 / PROTIО (dV / CP) T,
zde se bere derivace T= konst.
Pro charakterizaci změny objemu se změnou tlaku je zaveden faktor stlačitelnosti. Pro ideální plyn se rovná:
c = -1 / P.
V SI má faktor stlačitelnosti následující rozměr: [c] = m 2 / N.
Tento text je úvodním fragmentem. Z knihy Kreativita jako exaktní věda [Teorie vynalézavého řešení problémů] autor Altshuller Genrikh Saulovich1. Zákon úplnosti částí systému Nezbytnou podmínkou pro základní životaschopnost technického systému je přítomnost a minimální výkon hlavních částí systému. Každý technický systém musí obsahovat čtyři hlavní části: motor,
Z knihy Interface: New Directions in Design of Computer Systems autor Ruskin Jeff2. Zákon "vodivosti energie" systému Nezbytnou podmínkou pro základní životaschopnost technického systému je průchod energie všemi částmi systému. Jakýkoli technický systém je měnič energie. Proto je zřejmé
Z knihy Instrumentace autor Babaev MA6. Zákon přechodu k supersystému Po vyčerpání možností rozvoje je systém zařazen do supersystému jako jedna z jeho částí; v tomto případě se další vývoj odehrává na úrovni supersystému. O tomto zákonu jsme již mluvili. Přejděme k „dynamice“. Zahrnuje zákony, které reflektují
Z knihy Tepelný inženýr autor Burkhanová Natalia7. Zákon přechodu z makroúrovně na mikroúroveň Vývoj pracovních orgánů systému jde nejprve do makro - a poté do mikroúrovně. Ve většině moderních technických systémů jsou pracovními tělesy „kusy železa“, například letecké vrtule, kola automobilů, frézy
Z knihy Computational Linguistics for All: Myths. Algoritmy. Jazyk autor Anisimov Anatolij Vasilievič8. Zákon zvyšování stupně su-pole Vývoj technických systémů jde směrem ke zvyšování stupně su-pole. Smyslem tohoto zákona je, že nepolní systémy mají tendenci stát se su-polem a v su-polních systémech jde vývoj směrem
Z knihy Fenomén vědy [Kybernetický přístup k evoluci] autor Turchin Valentin Fedorovič Z knihy Nanotechnologie [Science, Innovation and Opportunity] od Fostera Lynna4.4.1. Fittsův zákon Představte si, že přesunete kurzor na tlačítko na obrazovce. Tlačítko je cílem tohoto pohybu. Délka přímky, která spojuje počáteční pozici kurzoru a nejbližší bod cíle, je definována ve Fittsově zákoně jako vzdálenost. Na
Z knihy Historie význačných objevů a vynálezů (elektrotechnika, elektroenergetika, radioelektronika) autor Schneiberg Jan Abramovič4.4.2. Hickův zákon Před přesunem kurzoru na cíl nebo provedením jakékoli jiné akce ze sady mnoha možností musí uživatel vybrat tento objekt nebo akci. Hickův zákon říká, že když je nutné provést výběr z n možností, čas na výběr
Z autorovy knihy9. Poissonův a Gaussův zákon rozdělení Poissonův zákon. Jeho další název je zákon ra-definice vzácných událostí. Poissonův zákon (Z.P) se aplikuje v případech, kdy je to nepravděpodobné, a proto je použití B/Z/R nepraktické.Výhody zákona jsou: pohodlí s
Z autorovy knihy23. Gay-Lussacův zákon Gay-Lussacův zákon říká: poměr objemu plynu k jeho teplotě při konstantním tlaku a hmotnosti plynu je konstantní V / T = m / MO R / P = konst při P = konst, m = konst. Tato rovnost je název rovnice izobary. Izobara je znázorněna na PV-diagramu přímky,
Z autorovy knihy24. Charlesův zákon Charlesův zákon říká, že poměr tlaku plynu k jeho teplotě je konstantní, pokud se objem a hmotnost plynu nemění: P / T = m / MO R / V = konst při V = konst, m = konst. Tato rovnost se nazývá izochorová rovnice.
Z autorovy knihy30. Zákon zachování a přeměny energie První termodynamický zákon je založen na univerzálním zákonu zachování a přeměny energie, který říká, že energie nevzniká a nezaniká Tělesa účastnící se termodynamického procesu se vzájemně ovlivňují.
Z autorovy knihyTSAREVNA-ŽÁBA A ZÁKON STABILITY Jak již bylo zdůrazněno dříve (zákon abstrakce), primitivní myšlení dovedně analyzuje konkrétní jevy a syntetizuje nové abstraktní systémy. Protože jakýkoli předmět zkonstruovaný vědomím byl vnímán jako živý a živý
Z autorovy knihy1.1. Základní zákon evoluce V procesu evoluce života, pokud víme, vždy docházelo k nárůstu celkové hmoty živé hmoty a ke komplikacím její organizace. Příroda si komplikuje organizaci biologických útvarů metodou vzorků a
Z autorovy knihy4.2. Moorův zákon Ve své nejjednodušší podobě se Moorův zákon scvrkává na tvrzení, že hustota zapojení tranzistorových obvodů se zdvojnásobí každých 18 měsíců. Autorství zákona je připisováno jednomu ze zakladatelů známé společnosti Intel Gordonu Mooreovi. Přísně vzato, v
DEFINICE
Nazývají se procesy, při kterých jeden z parametrů stavu plynu zůstává konstantní izoprocesy.
DEFINICE
Zákony o plynu jsou zákony popisující izoprocesy v ideálním plynu.
Zákony plynu byly objeveny experimentálně, ale všechny lze získat z Mendělejevovy-Clapeyronovy rovnice.
Podívejme se na každou z nich.
Boyle-Mariotteův zákon (izotermický proces)
Izotermický proces se nazývá změna skupenství plynu, ve kterém jeho teplota zůstává konstantní.
Pro konstantní hmotnost plynu při konstantní teplotě je součin tlaku a objemu plynu konstantní hodnotou:
Stejný zákon lze přepsat do jiné formy (pro dva stavy ideálního plynu):
Tento zákon vyplývá z Mendělejevovy-Clapeyronovy rovnice:
![]()
Je zřejmé, že při konstantní hmotnosti plynu a konstantní teplotě zůstává pravá strana rovnice konstantní.
Nazývají se grafy závislosti parametrů plynu při konstantní teplotě izotermy.
Konstantu označíme písmenem a zapíšeme funkční závislost tlaku na objemu v izotermickém procesu:
Je vidět, že tlak plynu je nepřímo úměrný jeho objemu. Graf nepřímé úměrnosti a následně graf izotermy v souřadnicích je hyperbola(obr. 1, a). Obrázky 1 b) a c) znázorňují izotermy v souřadnicích, resp.

Obr. 1. Grafy izotermických procesů v různých souřadnicích
Gay Lussacův zákon (izobarický proces)
Izobarický proces se nazývá změna skupenství plynu, při které jeho tlak zůstává konstantní.
Pro konstantní hmotnost plynu při konstantním tlaku je poměr objemu plynu k teplotě konstantní hodnotou:
Tento zákon také vyplývá z Mendělejevovy-Clapeyronovy rovnice:
![]()
izobary.
Zvažte dva izobarické procesy s tlaky a title = "(! LANG: Rendered by QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Definujme tvar grafu v souřadnicích Konstantu označíme písmenem a zapíšeme funkční závislost objemu na teplotě v izobarickém procesu:
Je vidět, že při konstantním tlaku je objem plynu přímo úměrný jeho teplotě. Graf přímé úměrnosti a následně izobarový graf v souřadnicích je přímka procházející počátkem(obr. 2, c). Ve skutečnosti se při dostatečně nízkých teplotách všechny plyny mění v kapaliny, na které již neplatí plynové zákony. Proto jsou v blízkosti počátku souřadnic izobary na obr. 2, c) znázorněny tečkovanou čarou.

Obr. Grafy izobarických procesů v různých souřadnicích
Karlův zákon (izochorický proces)
Izochorický proces se nazývá změna skupenství plynu, ve kterém jeho objem zůstává konstantní.
Pro konstantní hmotnost plynu při konstantním objemu je poměr tlaku plynu k jeho teplotě konstantní hodnotou:
Pro dva skupenství plynu bude tento zákon napsán ve tvaru:
Tento zákon lze také získat z Mendělejevovy - Clapeyronovy rovnice:
![]()
Nazývají se grafy závislosti parametrů plynu při konstantním tlaku izochory.
Zvažte dva izochorické procesy se svazky a názvem = "(! LANG: Rendered by QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
Pro určení typu grafu izochorického děje v souřadnicích označíme konstantu v Karlově zákoně písmenem, dostaneme:
Funkční závislost tlaku na teplotě při konstantním objemu je tedy přímou úměrností, grafem takové závislosti je přímka procházející počátkem (obr. 3, c).

Obr. Grafy izochorických procesů v různých souřadnicích
Příklady řešení problémů
PŘÍKLAD 1
| Cvičení | Na jakou teplotu je třeba izobaricky ochladit určité množství plynu s počáteční teplotou, aby se objem plynu zmenšil o jednu čtvrtinu? |
| Řešení | Izobarický proces je popsán Gay-Lussacovým zákonem: Podle stavu problému se objem plynu vlivem izobarického ochlazování sníží o jednu čtvrtinu, proto: odkud je konečná teplota plynu: Převeďme jednotky na soustavu SI: počáteční teplota plynu. Pojďme počítat:
|
| Odpovědět | Plyn musí být ochlazen na teplotu. |
PŘÍKLAD 2
| Cvičení | Uzavřená nádoba obsahuje plyn o tlaku 200 kPa. Jaký bude tlak plynu, když se teplota zvýší o 30 %? |
| Řešení | Jelikož je nádoba s plynem uzavřena, objem plynu se nemění. Izochorický proces popisuje Karlův zákon: Podle stavu problému se teplota plynu zvýšila o 30%, takže můžete napsat: Dosazením posledního poměru v Karlově zákoně dostaneme: Převeďme jednotky na soustavu SI: počáteční tlak plynu kPa = Pa. Pojďme počítat: |
| Odpovědět | Tlak plynu je 260 kPa. |
PŘÍKLAD 3
| Cvičení | Kyslíkový systém, kterým je letoun vybaven, obsahuje |
| Řešení | Izotermický proces je popsán Boyle-Mariottovým zákonem: |
Boyleův zákon - Mariotte
Boyleův zákon - Mariott je jedním ze základních plynových zákonů, který objevil v roce 1662 Robert Boyle a nezávisle znovu objevil Edm Mariotte v roce 1676. Popisuje chování plynu v izotermickém procesu. Zákon je důsledkem Clapeyronovy rovnice.
- 1 Formulace
- 2 Důsledky
- 3 Viz také
- 4 Poznámky
- 5 Literatura
Znění
Boyle-Mariottův zákon je následující:
Při konstantní teplotě a hmotnosti plynu je součin tlaku plynu a jeho objemu konstantní.
V matematické formě je tento výrok zapsán ve formě vzorce
kde je tlak plynu; je objem plynu a je konstantní hodnotou za dohodnutých podmínek. Obecně je hodnota určena chemickou povahou, hmotností a teplotou plynu.
Je zřejmé, že pokud index 1 označuje množství vztahující se k počátečnímu stavu plynu a index 2 - ke konečnému stavu, pak lze výše uvedený vzorec zapsat ve tvaru
.
Z výše uvedeného a výše uvedených vzorců vyplývá tvar závislosti tlaku plynu na jeho objemu v izotermickém procesu:
Tato závislost je dalším, ekvivalentním prvnímu, vyjádřením obsahu Boyle - Mariotteova zákona. Znamená to, že
Tlak hmoty plynu při konstantní teplotě je nepřímo úměrný jejímu objemu.
Potom lze vztah mezi počátečním a konečným stavem plynu účastnícího se izotermického procesu vyjádřit jako:
Je třeba poznamenat, že použitelnost tohoto a výše uvedeného vzorce, který spojuje počáteční a konečný tlak a objem plynu mezi sebou, není omezena na případ izotermických procesů. Vzorce zůstávají platné v těch případech, kdy se teplota během procesu změní, ale v důsledku procesu se konečná teplota ukáže jako rovna počáteční.
Je důležité upřesnit, že tento zákon platí pouze v případech, kdy lze daný plyn považovat za ideální. Zejména Boyleův - Mariottův zákon je splněn s vysokou přesností ve vztahu ke zředěným plynům. Pokud je plyn silně stlačen, jsou pozorovány významné odchylky od tohoto zákona.
Boylův zákon - Mariottův, Charlesův zákon a Gay-Lussacův zákon doplněné o Avogadrův zákon jsou dostatečným základem pro získání stavové rovnice pro ideální plyn.
Důsledky
Boyleův zákon - Mariotte říká, že tlak plynu v izotermickém procesu je nepřímo úměrný objemu, který plyn zabírá. Pokud vezmeme v úvahu, že hustota plynu je také nepřímo úměrná objemu, který zaujímá, pak dojdeme k závěru:
Při izotermickém procesu se tlak plynu mění přímo úměrně jeho hustotě.
Je známo, že stlačitelnost, tedy schopnost plynu měnit svůj objem vlivem tlaku, je charakterizována koeficientem stlačitelnosti. V případě izotermického procesu se hovoří o součiniteli izotermické stlačitelnosti, který je určen vzorcem
kde dolní index T znamená, že parciální derivace je brána při konstantní teplotě. Dosadíme-li do tohoto vzorce výraz pro vztah mezi tlakem a objemem z Boyle - Mariotteova zákona, dostaneme:Dostáváme se tedy k závěru:
Izotermický koeficient stlačitelnosti ideálního plynu se rovná převrácené hodnotě jeho tlaku.
viz také
- Gay Lussacův zákon
- Karlova práva
- Avogadrův zákon
- Ideální plyn
- Stavová rovnice ideálního plynu
Poznámky (upravit)
- Boyle - Mariottův zákon // Fyzikální encyklopedie / Ch. vyd. A.M. Prochorov. - M .: Sovětská encyklopedie, 1988 .-- T. 1. - S. 221-222. - 704 s. - 100 000 výtisků
- Sivukhin D.V. Obecný kurz fyziky. - M .: Fizmatlit, 2005. - T. II. Termodynamika a molekulární fyzika. - S. 21-22. - 544 str. - ISBN 5-9221-0601-5.
- 1 2 Elementární učebnice fyziky / Ed. G. S. Landsberg. - M .: Nauka, 1985. - T. I. Mechanika. Teplo. Molekulární fyzika. - S. 430 .-- 608 s.
- 1 2 3 Kikoin A.K., Kikoin I.K., Molecular Physics. - M .: Nauka, 1976 .-- S. 35-36.
- Při konstantní hmotnosti.
- Livshits L. D. Stlačitelnost // Fyzická encyklopedie / Ch. vyd. A.M. Prochorov. - M .: Velká ruská encyklopedie, 1994 .-- T. 4. - S. 492-493. - 704 s. - 40 000 výtisků
ISBN 5-85270-087-8.
Literatura
- Zákon Petruševského F.F. Boyle-Mariotte // Encyklopedický slovník Brockhaus a Efron: v 86 svazcích (82 svazcích a 4 dodatečné). - SPb., 1890-1907.
Boyleův zákon - Marriott informace o
Boyleův zákon - Mariotte
Boyleův zákon - Mariotte
Boyleův zákon - Mariotte Prohlížíte předmět
Boylův zákon - Mariotte co, Boylův zákon - Mariotte kdo, Boylův zákon - Mariottův popis
U tohoto článku a videa jsou úryvky z wikipedie
Naše stránky mají systém ve funkci vyhledávače. Nahoře: „co jste hledali?“ Pomocí pole se můžete dotázat na vše v systému. Vítejte v našem jednoduchém, stylovém a rychlém vyhledávači, který jsme připravili, abychom vám poskytli ty nejpřesnější a nejaktuálnější informace.
Vyhledávač navržený pro vás vám poskytne nejrelevantnější a nejpřesnější informace s jednoduchým designem a rychle fungujícím systémem. Na našich stránkách najdete téměř všechny informace, které hledáte.
V současné době podáváme pouze v angličtině, turečtině, ruštině, ukrajinštině, kazaštině a běloruštině.
Nové jazyky budou do systému přidány velmi brzy.
Životy slavných lidí vám poskytují informace, obrázky a videa o stovkách témat, jako jsou politici, vládní úředníci, lékaři, webové stránky, závody, technologická vozidla, auta a další.
Boyle-Mariottův zákon

Kvantitativní vztah mezi objemem a tlakem plynu byl poprvé založen Robertem Boylem v roce 1662. * Boyle-Mariotteův zákon říká, že při konstantní teplotě je objem plynu nepřímo úměrný jeho tlaku.
Tento zákon se vztahuje na jakékoli pevné množství plynu. Jak je vidět z Obr. 3.2, jeho grafické znázornění může být různé. Graf vlevo ukazuje, že při nízkém tlaku je objem pevného množství plynu velký.
S rostoucím tlakem se objem plynu zmenšuje. Matematicky se to píše takto:
Obvykle je však zákon Boyle-Mariotte psán ve formě
Takový záznam umožňuje například znát počáteční objem plynu V1 a jeho tlak p, vypočítat tlak p2 v novém objemu V2.
Gay Lussacův zákon (Karlův zákon)
V roce 1787 Karel ukázal, že při konstantním tlaku se objem plynu mění (úměrně jeho teplotě. Tato závislost je graficky znázorněna na obr. 3.3, z něhož je vidět, že objem plynu je lineárně úměrný její teplota. V matematické formě je tato závislost vyjádřena jako:
Karlův zákon je často psán v jiné podobě:
V1IT1 = V2T1 (2)
Charlesův zákon vylepšil J. Gay-Lussac, který v roce 1802 stanovil, že objem plynu, když se jeho teplota změní o 1 ° С, se změní o 1/273 objemu, který zabíral při 0 ° С.
Z toho plyne, že pokud vezmeme libovolný objem jakéhokoli plynu při 0 ° С a při konstantním tlaku snížíme jeho teplotu o 273 ° С, bude konečný objem roven nule. To odpovídá teplotě -273 °C, neboli 0 K. Tato teplota se nazývá absolutní nula. Ve skutečnosti toho nelze dosáhnout. Na Obr.
3.3 ukazuje, jak extrapolace grafu objemu plynu versus teplota vede k nulovému objemu při 0 K.
Absolutní nula je přísně vzato nedosažitelná. V laboratorních podmínkách je však možné dosáhnout teplot, které se od absolutní nuly liší pouze o 0,001 K. Při takových teplotách náhodné pohyby molekul prakticky ustávají. To vede k úžasným vlastnostem.
Například kovy ochlazené na teploty blízké absolutní nule téměř úplně ztratí svůj elektrický odpor a stanou se supravodivými *. Příkladem látek s jinými neobvyklými nízkoteplotními vlastnostmi je helium.
Při teplotách blízkých absolutní nule viskozita helia mizí a stává se supratekutým.* V roce 1987 byly objeveny látky (keramika slinutá z oxidů prvků lanthanoidů, barya a mědi), které se stávají supravodivými při relativně vysokých teplotách, řádově 100 K (- 173 °C). Tyto "vysokoteplotní" supravodiče otevírají velké vyhlídky v technologii. přel.
Hlavní laboratorní vybavení je pracovní plocha, na které se provádějí veškeré experimentální práce.
Každá laboratoř musí mít dobré větrání. Vyžaduje se digestoř, ve které se veškerá práce provádí pomocí páchnoucích nebo jedovatých sloučenin a také spalování organických látek v kelímcích.
Silně těkavé, zdraví škodlivé nebo zapáchající látky (tekutý brom, koncentrovaná kyselina dusičná a chlorovodíková atd.) jsou uloženy ve speciální digestoři, ve které se neprovádí práce související s vytápěním.
), stejně jako hořlavé látky (sulfid uhličitý, éter, benzen atd.).
Laboratoř vyžaduje instalatérské, kanalizační, technické proudy, plynové a vodní ohřívače. Žádoucí je také přívod stlačeného vzduchu, podtlakové vedení, přívod horké vody a páry.
Pokud neexistuje žádné speciální připojení, k získání teplé vody se používají ohřívače vody různých systémů.
Pomocí těchto zařízení, vyhřívaných elektřinou nebo plynem, můžete rychle získat proud horké vody o teplotě téměř 100 °C.
Laboratoř musí mít zařízení pro destilaci (nebo demineralizaci) vody, protože bez destilované nebo demineralizované vody není možné v laboratoři pracovat. V případech, kdy je obtížné nebo nemožné získat destilovanou vodu, se používá komerční destilovaná voda.
V blízkosti pracovních stolů a dřezů na vodu nesmí chybět hliněné nádoby o objemu 10-15 litrů na vypouštění nepotřebných roztoků, činidel apod., stejně jako koše na rozbité sklo, papír a jiný suchý odpad.
Laboratoř by měla mít kromě stolů také stůl, kde jsou uloženy všechny sešity a poznámky, a v případě potřeby i titulní tabulku. U pracovních stolů by měly být vysoké stoličky nebo židle.
Analytické váhy a přístroje vyžadující stacionární instalaci (elektrometrické, optické atd.) jsou umístěny v oddělené místnosti spojené s laboratoří a pro analytické váhy by měla být vyhrazena speciální vážicí místnost. Je žádoucí, aby váha byla umístěna s okny na sever. To je důležité, protože váha nesmí být vystavena slunečnímu záření („Váhy a vážení“).
V laboratoři také potřebujete nejnutnější referenční knihy, manuály a učebnice, protože často během práce je potřeba tón nebo jiný odkaz.
viz také
Strana 3
Chemické sklo používané v laboratořích lze rozdělit do několika skupin. Podle účelu lze nádobí rozdělit na nádobí všeobecné, speciální a objemové. Podle materiálu - pro nádobí z jednoduchého skla, speciálního skla, křemene.
Do skupiny. pro všeobecné použití jsou předměty, které by měly být vždy v laboratořích a bez kterých nelze většinu práce provést. Jsou to: zkumavky, nálevky jednoduché a oddělovací, kádinky, baňky s plochým dnem, krystalizátory, kónické baňky (Erlenmeyerovy), Bunsenovy baňky, ledničky, retorty, baňky na destilovanou vodu, odpaliště, kohoutky.
Speciální skupina zahrnuje položky, které se používají k jakémukoli účelu, například: Kippův přístroj, Sok-rallyův přístroj, Kjeldahlův přístroj, zpětné chladiče, Wul-fa baňky, Tishčenkovy baňky, pyknometry, hustoměry, Drexelovy baňky , draselná aparatura , zařízení na stanovení oxidu uhličitého, baňky s kulatým dnem, speciální chladničky, zařízení na stanovení molekulové hmotnosti, zařízení na stanovení bodů tání a varu atd.
Mezi odměrné přístroje patří: odměrné válce a kádinky, pipety, byrety a odměrné baňky.Pro začátek vám doporučujeme zhlédnout následující video, kde jsou stručně a snadno zváženy hlavní typy chemického skla.
viz také:
Nádobí pro všeobecné použití
Zkumavky (obr. 18) jsou úzké válcovité nádobky se zaobleným dnem; dodávají se v různých velikostech a průměrech a jsou vyrobeny z různého skla. Běžné „laboratorní zkumavky jsou vyrobeny z nízkotavitelného skla, ale pro speciální práce, kdy je vyžadován ohřev na vysoké teploty, jsou zkumavky vyrobeny z vysokotavitelného skla nebo křemene.
Kromě obyčejných, jednoduchých zkumavek se používají i odměrné a odstředivé kónické zkumavky.
Pro skladování zkumavek v provozu se používají speciální dřevěné, plastové nebo kovové stojany (obr. 19).
Rýže. 18. Jednoduché a dělené trubky
Rýže. 20. Vložení štítku s práškovými látkami do zkumavky.
Zkumavky se používají především pro analytické nebo mikrochemické práce. Při provádění reakcí ve zkumavce by činidla neměla být používána v příliš velkém množství. Je zcela nepřijatelné, aby byla zkumavka naplněna až po okraj.
Reakce se provádí s malým množstvím látek; Stačí 1/4 nebo i 1/8 kapacity zkumavky. Někdy je třeba do zkumavky vstříknout pevnou látku (prášky, krystaly atd.).
), za tímto účelem se proužek papíru o šířce o něco menší, než je průměr zkumavky, přehne po své délce na polovinu a do výsledné odměrky se nalije požadované množství pevné látky. Zkumavku držíme v levé ruce, nakláníme ji vodorovně a zasuneme do ní odměrku téměř až na dno (obr. 20).
Poté se zkumavka umístí svisle, ale také na ni lehce udeří. Když se všechny pevné látky vysypou, vyjměte naběračku.
K promíchání nalitých činidel se zkumavka přidrží za horní konec palcem a ukazováčkem levé ruky a podepře se prostředníčkem a ukazováčkem pravé ruky se udeří na dno zkumavky. To stačí k tomu, aby se jeho obsah dobře promíchal.
Je zcela nepřípustné uzavřít zkumavku prstem a takto s ní třepat; v tomto případě můžete do kapaliny ve zkumavce nejen vložit něco cizího, ale někdy poškodit pokožku prstu, popálit se atd.
Pokud je zkumavka více než z poloviny plná kapaliny, promíchejte obsah skleněnou tyčinkou.
Pokud je potřeba trubku zahřát, je nutné ji upnout do držáku.
Při nešikovném a silném zahřívání zkumavky se kapalina rychle vaří a vystřikuje z ní, takže ji musíte zahřívat opatrně. Když se začnou objevovat bubliny, zkumavku odložte stranou a nedržte ji v plameni hořáku. , ale v jeho blízkosti nebo nad ním pokračujte v zahřívání horkým vzduchem. Při zahřívání by měl být otevřený konec zkumavky nasměrován směrem od pracovníka a od sousedů na stole.Když není potřeba silné zahřívání, je lepší trubici s ohřátou kapalinou ponořit do horké vody. Pokud pracujete s malými zkumavkami (pro semimikroanalýzu), pak se ohřívají pouze v horké vodě nalité do skleněné kádinky vhodné velikosti (o objemu nepřesahujícím 100 ml).
Nálevky se používají k nalévání - kapalin, k filtrování atd. Chemické nálevky se vyrábí v různých velikostech, jejich horní průměry jsou 35, 55, 70, 100, 150, 200, 250 a 300 mm.
Běžné nálevky mají hladkou vnitřní stěnu, ale pro rychlejší filtraci se někdy používají nálevky s žebrovaným vnitřním povrchem.
Filtrační nálevky mají vždy úhel 60° a odříznutý dlouhý konec.
Za provozu se nálevky instalují buď do speciálního stativu nebo do prstence na běžném laboratorním stativu (obr. 21).
Pro filtraci do sklenice je účelné vyrobit jednoduchý držák na nálevku (obr. 22), k tomu se z hliníkového plechu o tloušťce cca 2 mm vyřízne pásek 70-80 lsh dlouhý a 20 mm široký. .
Na jednom z konců pásu se vyvrtá otvor o průměru 12-13 mm a pás se ohne, jak je znázorněno na Obr. 22, a. Jak upevnit nálevku na sklenici je znázorněno na obr. 22, nar.
Při nalévání tekutiny do láhve nebo baňky nepřeplňujte nálevku.
Pokud nálevka těsně přiléhá k hrdlu nádoby, do které se nalévá kapalina, pak se přenos ztíží, protože uvnitř nádoby vzniká zvýšený tlak. Proto je třeba trychtýř čas od času zvednout.
Ještě lepší je udělat mezeru mezi nálevkou a hrdlem nádoby tak, že mezi ně vložíte například kus papíru. V tomto případě je třeba dávat pozor, aby se těsnění nedostalo do nádoby. Vhodnější je použít drátěný trojúhelník, který si můžete vyrobit sami.Tento trojúhelník se umístí na hrdlo nádoby a poté se zasune nálevka.
Na hrdle misek jsou speciální pryžové nebo plastové nástavce, které zajišťují komunikaci vnitřku baňky s venkovní atmosférou (obr. 23).
Rýže. 21. Posílení sklovitého chemického trychtýře
Rýže. 22. Zařízení pro připevnění trychtýře na sklenici, ve stativu.
Pro analytickou práci při filtrování je vhodnější použít analytické nálevky (obr. 24). Zvláštností těchto trychtýřů je, že mají podlouhlý seříznutý konec, jehož vnitřní průměr je v horní části menší než ve spodní části; tato konstrukce urychluje filtraci.
Kromě toho existují analytické nálevky s žebrovaným vnitřním povrchem nesoucím filtr a s kulovým rozšířením v místě, kde nálevka prochází do trubice. Nálevky této konstrukce urychlují proces filtrace až trojnásobně ve srovnání s konvenčními nálevkami.
Rýže. 23. Trysky pro hrdla lahví. Rýže. 24. Analytický trychtýř.
Oddělovací nálevky(obr. 25) se používají k oddělení nemísitelných kapalin (např. vody a oleje). Jsou buď válcového nebo hruškovitého tvaru a ve většině případů jsou opatřeny skleněnou zátkou.
V horní části odbočky je skleněný kohoutek. Kapacita dělicích nálevek je různá (od 50 ml do několika litrů), v závislosti na kapacitě se mění i tloušťka stěny.
Čím menší je kapacita trychtýře, tím tenčí jsou jeho stěny a naopak.
Během provozu se dělicí nálevky zpevňují různými způsoby v závislosti na kapacitě a tvaru. Válcový trychtýř s malou kapacitou lze jednoduše připevnit k noze. Velké trychtýře jsou umístěny mezi dvěma prstenci.
Spodní část válcové nálevky by měla spočívat na prstenci, jehož průměr je o něco menší než průměr nálevky, horní prstenec má o něco větší průměr.
Pokud se nálevka současně kýve, měla by být mezi kroužek a nálevka umístěna korková deska.
Dělicí nálevka ve tvaru hrušky je upevněna na kroužku, její hrdlo je sevřeno tlapkou. Nálevku vždy nejprve upevněte a teprve potom do ní nalijte tekutiny, které se mají oddělit.Odkapávací nálevky (obr. 26) se liší od dělicích nálevek tím, že jsou lehčí, tenčí a
Rýže. 25. Separační nálevky. rýže. 26. Odkapávací nálevky.
Ve většině případů s dlouhým koncem. Tyto nálevky se používají v mnoha pracích, kdy se látka přidává do reakční hmoty po malých dávkách nebo po kapkách. Proto jsou obvykle součástí zařízení. Nálevky jsou upevněny v hrdle baňky na tenké části nebo korkovou nebo pryžovou zátkou.
Před prací s oddělovacím nebo kapacím trychtýřem je třeba sekci skleněného kohoutku pečlivě namazat vazelínou nebo speciálním tukem.
To umožňuje otevřít kohoutek snadno a bez námahy, což je velmi důležité, protože pokud se kohoutek otevře těsně, může jej při otevírání zlomit nebo poškodit celé zařízení.
Mazivo by mělo být nanášeno ve velmi tenké vrstvě, aby při otáčení ventilu nespadlo do nálevkové trubice nebo dovnitř otvoru ventilu.
Pro rovnoměrnější proudění kapiček kapaliny z kapací nálevky a pro sledování rychlosti přívodu kapaliny se používají kapací nálevky s tryskou (obr. 27). Takové nálevky mají bezprostředně za kohoutkem rozšířenou část, která se mění v trubici. Kapalina protéká kohoutem do této expanze krátkou trubičkou a následně do trubice nálevky.
Rýže. 27. Odkapávací nálevka s tryskou
Rýže. 28. Kádinky.
Rýže. 29. Rovinný trychtýř s tryskou
SKLENĚNÉ NÁDOBÍ 1 2 3
viz také
Lekce 25. Boyle-Mariottův zákon - HIMI4KA

Archiv lekcí ›Základní zákony chemie
V lekci 25" Boyle-Mariottův zákon"Z kurzu" Chemie pro figuríny»Zvažte zákon o tlaku a objemu plynu a také grafy závislosti tlaku na objemu a objemu na tlaku. Dovolte mi připomenout, že v poslední lekci „Tlak plynu“ jsme zkoumali zařízení a princip fungování rtuťového barometru a také jsme uvedli definici tlaku a zvážili jeho měrné jednotky.
Robert Boyle(1627-1691), jemuž vděčíme za první prakticky správnou definici chemického prvku (dozvíme se v 6. kapitole), se zajímal i o jevy, ke kterým dochází v nádobách se zředěným vzduchem.
Při vymýšlení vývěv pro čerpání vzduchu z uzavřených nádob upozornil na vlastnost známou každému, kdo náhodou pumpoval do komory fotbalového míče nebo opatrně mačkal balón: čím více je vzduch v uzavřené nádobě stlačen, tím více odolává komprese.
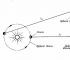
Boyle nazval tuto nemovitost „ pružnost»Provzdušněte a změřte jej pomocí jednoduchého zařízení znázorněného na obr. 3.2, a a b.
Boyle zablokoval trochu vzduchu v uzavřeném konci zakřivené trubice rtutí (obrázek 3-2, a) a poté tento vzduch vymáčkl a postupně přidával rtuť do otevřeného konce trubice (obrázek 3-2, b).
Tlak vzduchu v uzavřené části trubice se rovná součtu atmosférického tlaku a tlaku rtuťového sloupce o výšce h (h je výška, ve které je hladina rtuti na otevřeném konci trubice). trubice přesahuje hladinu rtuti na uzavřeném konci). Boyleova získaná měření tlaku a objemu jsou uvedena v tabulce 1. 3-1.
Boyle sice neudělal speciální opatření k udržení stálé teploty plynu, ale zdá se, že se při jeho experimentech měnila jen nepatrně. Přesto si Boyle všiml, že teplo z plamene svíčky způsobuje výrazné změny ve vlastnostech vzduchu.
Analýza údajů o tlaku a objemu vzduchu při jeho stlačování
Tabulka 3-1, který obsahuje Boyleovy experimentální údaje o vztahu mezi tlakem a objemem pro okolní vzduch, je umístěn pod spoilerem.
Poté, co výzkumník obdrží údaje podobné těm, které jsou uvedeny v tabulce. 3-1 se snaží najít matematickou rovnici, která dává do vztahu dvě závislé veličiny, které naměřil.
Jedním ze způsobů, jak získat takovou rovnici, je graficky vykreslit závislost různých stupňů jedné veličiny na druhé v naději, že získáme přímý graf.
Obecná rovnice přímky je:
kde x a y jsou příbuzné proměnné a a a b jsou konstantní čísla. Je-li b nula, počátkem prochází přímka.
Na Obr. 3-3 znázorňují různé způsoby grafu dat pro tlak P a objem V, uvedené v tabulce. 3-1.Grafy P versus 1 / K a V versus 1 / P jsou přímky procházející počátkem.
Graf závislosti logaritmu P na logaritmu V je také přímka se záporným sklonem, jejíž tangens je - 1. Všechny tyto tři grafy vedou k ekvivalentním rovnicím:
- P = a / V (3-3a)
- V = a / P (3-3b)
- lg V = lg a - lg P (3-3v)
Každá z těchto rovnic představuje jednu z možností Boyle-Mariottův zákon, který je obvykle formulován takto: pro daný počet molů plynu je jeho tlak úměrný objemu za předpokladu, že teplota plynu zůstává konstantní.
Mimochodem, asi se ptáte, proč se Boyle-Mariottův zákon nazývá dvojím jménem. Stalo se tak proto, že tento zákon, nezávisle na Robertu Boyleovi, který jej objevil v roce 1662, znovu objevil Edm Mariotte v roce 1676. Takže to je vše.
Když je vztah mezi dvěma měřenými veličinami jednoduchý do té míry, jako je tomu v tomto případě, lze jej stanovit i numericky.
Pokud se každá hodnota tlaku P vynásobí odpovídající hodnotou objemu V, je snadné se ujistit, že všechny produkty pro daný vzorek plynu při konstantní teplotě jsou přibližně stejné (viz tabulka 3-1). Tak to můžeme napsat
Rovnice (З-Зг) popisuje hyperbolický vztah mezi hodnotami P a V (viz obr. 3-3, a). Abychom ověřili, že graf závislosti P na V sestrojený z experimentálních dat skutečně odpovídá hyperbole, sestrojíme dodatečný graf závislosti součinu PV na P a ujistíme se, že jde o vodorovnou přímku (viz. Obr. 3-3, e) ...
Boyle zjistil, že pro dané množství jakéhokoli plynu při konstantní teplotě je vztah mezi tlakem P a objemem V celkem uspokojivě popsán vztahem
- P V = konst (při konstantní T an) (3-4)
Boyle-Mariotte vzorec
Pro porovnání objemů a tlaků stejného vzorku plynu za různých podmínek (ale konstantní teploty) je vhodné reprezentovat Boyle-Mariottův zákon v následujícím vzorci:
kde indexy 1 a 2 odpovídají dvěma různým podmínkám.
Příklad 4. Plastové sáčky s potravinami dodávanými na náhorní plošinu Colorado (viz příklad 3) často praskají, protože vzduch v nich při stoupání z hladiny moře do výšky 2500 m za podmínek sníženého atmosférického tlaku expanduje.
Pokud předpokládáme, že uvnitř vaku je 100 cm3 vzduchu při atmosférickém tlaku odpovídajícím hladině moře, jaký objem by měl tento vzduch zabírat při stejné teplotě na Coloradské plošině? (Předpokládejme, že smršťovací sáčky se používají k dodávání potravin, které neomezují expanzi vzduchu; chybějící údaje je třeba převzít z příkladu 3.)Řešení
Použijme Boylův zákon ve formě rovnice (3-5), kde index 1 se bude vztahovat k podmínkám na hladině moře a index 2 - k podmínkám ve výšce 2500 m nad mořem. Pak by se měly vypočítat Р1 = 1 000 atm, V1 = 100 cm3, Р2 = 0,750 atm a V2. Tak,
Studiem vztahu mezi parametry charakterizujícími stav dané hmotnosti plynu začínáme studiem plynových procesů, ke kterým dochází, když jeden z parametrů zůstává nezměněn. anglický vědec Boyle(v roce 1669) a francouzský vědec Marriott(v roce 1676) objevil zákon, který vyjadřuje závislost změny tlaku na změně objemu plynu při konstantní teplotě. Proveďme následující experiment.
Otáčením rukojetí změníme objem plynu (vzduchu) ve válci A (obr. 11, a). Podle údajů na manometru si všimneme, že se současně mění tlak plynu. Změníme objem plynu v nádobě (objem se určuje na stupnici B) a po zjištění tlaku je zapíšeme do tabulky. 1. Je z ní vidět, že součin objemu plynu jeho tlakem byl téměř konstantní: kolikrát „se objem plynu zmenšil, zároveň se jeho tlak zvýšil.

V důsledku podobných, přesnějších, experimentů bylo zjištěno: pro danou hmotnost plynu při konstantní teplotě se tlak plynu mění nepřímo se změnou objemu plynu. Toto je formulace zákona Boyle-Mariotte. Matematicky to bude zapsáno pro dva stavy takto:
![]()
Proces změny skupenství plynu při konstantní teplotě se nazývá izotermický. Boyle-Mariotteův vzorec je rovnicí pro izotermický stav plynu. Při konstantní teplotě se průměrná rychlost pohybu molekul nemění. Změna objemu plynu způsobí změnu v počtu dopadů molekul na stěny nádoby. To je důvod změny tlaku plynu.
Znázorněme tento proces graficky, například pro případ V = 12 litrů, p = 1 at.... Na vodorovnou osu vyneseme objem plynu a na souřadnicovou osu jeho tlak (obr. 11, b). Najdeme body odpovídající každé dvojici hodnot V a p a jejich spojením získáme graf izotermického procesu. Čára znázorňující vztah mezi objemem a tlakem plynu při konstantní teplotě se nazývá izoterma. Nedochází k čistě izotermickým procesům. Často se ale vyskytují případy, kdy se teplota plynu mění jen málo, například když kompresor čerpá vzduch do válců, kdy je hořlavá směs vstřikována do válce spalovacího motoru. V takových případech se objem a tlak plynu vypočítávají podle Boyle-Mariotteova zákona *.