कार्बन मोनोऑक्साइड 4 संरचना। कार्बन - तत्व विशेषता और रासायनिक गुण
भौतिक गुण:कार्बन कई एलोट्रोपिक संशोधन करता है: हीरा- सबसे कठोर पदार्थों में से एक ग्रेफाइट, कोयला, कालिख.
एक कार्बन परमाणु में 6 इलेक्ट्रॉन होते हैं: 1s 2 2s 2 2p 2 . अंतिम दो इलेक्ट्रॉन अलग-अलग p-कक्षकों पर स्थित होते हैं और अयुग्मित होते हैं। सिद्धांत रूप में, यह जोड़ी एक कक्षीय पर कब्जा कर सकती है, लेकिन इस मामले में इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बहुत बढ़ जाता है। इस कारण से, उनमें से एक 2p x लेता है, और दूसरा, या 2p y , या 2p z-कक्षक।
बाहरी परत के s- और p-उप-स्तरों की ऊर्जाओं में अंतर छोटा है; इसलिए, परमाणु आसानी से उत्तेजित अवस्था में चला जाता है, जिसमें 2s-कक्षक से दो इलेक्ट्रॉनों में से एक मुक्त में जाता है। 2पी.विन्यास 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . के साथ एक संयोजकता अवस्था . यह कार्बन परमाणु की यह अवस्था है जो हीरे की जाली की विशेषता है - हाइब्रिड ऑर्बिटल्स की टेट्राहेड्रल स्थानिक व्यवस्था, समान बंधन लंबाई और ऊर्जा।
इस घटना को कहा जाता है एसपी 3-संकरण,और उत्पन्न होने वाले फलन एसपी 3-हाइब्रिड . हैं . चार sp3 बंधों का निर्माण कार्बन परमाणु को तीन . से अधिक स्थिर अवस्था प्रदान करता है पी-पी-और एक एस-एस-लिंक। कार्बन परमाणु में एसपी 3 संकरण के अलावा, एसपी 2 और एसपी संकरण भी मनाया जाता है . पहले मामले में, आपसी ओवरलैप है एस-और दो पी-ऑर्बिटल्स। तीन समतुल्य एसपी 2 - हाइब्रिड ऑर्बिटल्स बनते हैं, जो एक विमान में एक दूसरे से 120 ° के कोण पर स्थित होते हैं। तीसरा कक्षीय p अपरिवर्तित है और विमान के लंबवत निर्देशित है सपा 2.

एसपी-संकरण के दौरान, एस और पी ऑर्बिटल्स ओवरलैप करते हैं। दो गठित समतुल्य संकर कक्षकों के बीच 180° का कोण उत्पन्न होता है, जबकि प्रत्येक परमाणु के लिए दो p-कक्षक अपरिवर्तित रहते हैं।

कार्बन की एलोट्रॉपी। हीरा और ग्रेफाइट
ग्रेफाइट क्रिस्टल में, कार्बन परमाणु समानांतर विमानों में स्थित होते हैं, उनमें शीर्षों पर कब्जा होता है नियमित षट्भुज... प्रत्येक कार्बन परमाणु तीन आसन्न एसपी 2-हाइब्रिड बंधों से बंधा होता है। समानांतर विमानों के बीच संबंध वैन डेर वाल्स बलों द्वारा किया जाता है। प्रत्येक परमाणु के मुक्त p-कक्षकों को सहसंयोजक बंधों के तलों के लंबवत निर्देशित किया जाता है। उनका अतिव्यापन कार्बन परमाणुओं के बीच अतिरिक्त -आबंध की व्याख्या करता है। तो से संयोजकता अवस्था जिसमें किसी पदार्थ में कार्बन परमाणु स्थित होते हैं, इस पदार्थ के गुण निर्भर करते हैं.
कार्बन के रासायनिक गुण
सबसे विशिष्ट ऑक्सीकरण अवस्थाएँ +4, +2 हैं।
कम तापमान पर, कार्बन निष्क्रिय होता है, लेकिन गर्म होने पर इसकी गतिविधि बढ़ जाती है।
एक कम करने वाले एजेंट के रूप में कार्बन:
- ऑक्सीजन के साथ
सी 0 + ओ 2 - टी डिग्री = सीओ 2 कार्बन डाइऑक्साइड
ऑक्सीजन की कमी के साथ - अधूरा दहन:
2C 0 + O 2 - t ° = 2C +2 O कार्बन मोनोऑक्साइड
- फ्लोरीन के साथ
सी + 2 एफ 2 = सीएफ 4
- जल वाष्प के साथ
सी 0 + एच 2 ओ - 1200 डिग्री = सी +2 ओ + एच 2 पानी गैस
- धातु आक्साइड के साथ। इस प्रकार, अयस्क से धातु को गलाया जाता है।
सी 0 + 2 क्यूओ - टी डिग्री = 2 सीयू + सी +4 ओ 2
- एसिड के साथ - ऑक्सीकरण एजेंट:
सी 0 + 2 एच 2 एसओ 4 (संक्षिप्त) = सी +4 ओ 2 + 2 एसओ 2 + 2 एच 2 ओ
सी 0 + 4 एचएनओ 3 (संक्षिप्त) = सी +4 ओ 2 + 4एनओ 2 + 2 एच 2 ओ
- सल्फर के साथ कार्बन डाइसल्फ़ाइड बनाता है:
सी + 2 एस 2 = सीएस 2।
ऑक्सीकरण एजेंट के रूप में कार्बन:
- कुछ धातुओं के साथ कार्बाइड बनाता है
4अल + 3सी 0 = अल 4 सी 3
सीए + 2सी 0 = सीएसी 2 -4
- हाइड्रोजन के साथ - मीथेन (साथ ही बड़ी मात्रा में कार्बनिक यौगिक)
सी 0 + 2 एच 2 = सीएच 4
- सिलिकॉन के साथ, कार्बोरंडम बनाता है (एक इलेक्ट्रिक भट्टी में 2000 डिग्री सेल्सियस पर):
प्रकृति में कार्बन ढूँढना
मुक्त कार्बन हीरे और ग्रेफाइट के रूप में होता है। यौगिकों के रूप में, कार्बन खनिजों की संरचना में है: चाक, संगमरमर, चूना पत्थर - CaCO 3, डोलोमाइट - MgCO 3 * CaCO 3; हाइड्रोकार्बन - एमजी (एचसीओ 3) 2 और सीए (एचसीओ 3) 2, सीओ 2 हवा का हिस्सा है; कार्बन प्राकृतिक कार्बनिक यौगिकों का मुख्य घटक है - गैस, तेल, कोयला, पीट, का एक हिस्सा है कार्बनिक पदार्थ, प्रोटीन, वसा, कार्बोहाइड्रेट, अमीनो एसिड जो जीवित जीवों को बनाते हैं।

अकार्बनिक कार्बन यौगिक
किसी भी सामान्य रासायनिक प्रक्रिया के तहत न तो C 4+ और न ही C 4- आयन बनते हैं: कार्बन यौगिकों में विभिन्न ध्रुवीयता के सहसंयोजक बंधन होते हैं।
कार्बन मोनोऑक्साइड (द्वितीय)सीओ
कार्बन मोनोआक्साइड; रंगहीन, गंधहीन, पानी में थोड़ा घुलनशील, कार्बनिक सॉल्वैंट्स में घुलनशील, जहरीला, गठरी तापमान = -192 डिग्री सेल्सियस; टी पीएल। = -205 डिग्री सेल्सियस।
प्राप्त
1) उद्योग में (गैस जनरेटर में):
सी + ओ 2 = सीओ 2
2) प्रयोगशाला में - एच 2 एसओ 4 (सांद्र) की उपस्थिति में फॉर्मिक या ऑक्सालिक एसिड के थर्मल अपघटन द्वारा:
एचसीओओएच = एच 2 ओ + सीओ
एच 2 सी 2 ओ 4 = सीओ + सीओ 2 + एच 2 ओ
रासायनिक गुण
सामान्य परिस्थितियों में CO निष्क्रिय है; गर्म होने पर - एक कम करने वाला एजेंट; गैर-नमक बनाने वाला ऑक्साइड।
1) ऑक्सीजन के साथ
2सी +2 ओ + ओ 2 = 2सी +4 ओ 2
2) धातु आक्साइड के साथ
सी +2 ओ + क्यूओ = क्यू + सी +4 ओ 2
3) क्लोरीन के साथ (प्रकाश में)
सीओ + सीएल 2 - एचएन = सीओसीएल 2 (फॉस्जीन)
4) क्षार गलन (दबाव में) के साथ प्रतिक्रिया करता है
CO + NaOH = HCOONa (सोडियम फॉर्मेट)
5) संक्रमण धातुओं के साथ कार्बोनिल बनाता है
नी + 4CO - टी ° = नी (CO) 4
Fe + 5CO - t ° = Fe (CO) 5
कार्बन मोनोऑक्साइड (IV) CO2
कार्बन डाइऑक्साइड, रंगहीन, गंधहीन, पानी में घुलनशीलता - 0.9V CO 2 1V H 2 O (सामान्य परिस्थितियों में) में घुल जाता है; हवा से भारी; t ° pl। = -78.5 ° C (ठोस CO 2 को "सूखी बर्फ" कहा जाता है); दहन का समर्थन नहीं करता है।
प्राप्त
- कार्बोनिक एसिड लवण (कार्बोनेट) का थर्मल अपघटन। चूना पत्थर भूनना:
CaCO 3 - t ° = CaO + CO 2
- कार्बोनेट्स और बाइकार्बोनेट पर मजबूत एसिड की क्रिया:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
रासायनिकगुणसीओ2
अम्लीय ऑक्साइड: कार्बोनिक एसिड लवण बनाने के लिए मूल ऑक्साइड और क्षार के साथ प्रतिक्रिया करता है
ना 2 ओ + सीओ 2 = ना 2 सीओ 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 = NaHCO 3
ऊंचे तापमान पर ऑक्सीकरण गुण प्रदर्शित कर सकते हैं
+4 ओ 2 + 2 एमजी - टी डिग्री = 2 एमजी +2 ओ + सी 0
गुणात्मक प्रतिक्रिया
चूने के पानी की मैलापन:
सीए (ओएच) 2 + सीओ 2 = सीएसीओ 3 (सफेद अवक्षेप) + एच 2 ओ
चूने के पानी के माध्यम से CO2 के लंबे समय तक गुजरने से यह गायब हो जाता है, क्योंकि अघुलनशील कैल्शियम कार्बोनेट घुलनशील बाइकार्बोनेट में बदल जाता है:
सीएसीओ 3 + एच 2 ओ + सीओ 2 = सीए (एचसीओ 3) 2
कार्बोनिक एसिड और उसकेनमक
एच 2सीओ 3 -एसिड कमजोर है, केवल जलीय घोल में मौजूद है:
सीओ 2 + एच 2 ओ ↔ एच 2 सीओ 3
दो-आधार:
एच 2 सीओ 3 ↔ एच + + एचसीओ 3 - एसिड लवण - बाइकार्बोनेट, हाइड्रोकार्बन
एचसीओ 3 - ↔ एच + + सीओ 3 2- मध्यम लवण - कार्बोनेट
अम्ल के सभी गुण अभिलक्षणिक होते हैं।
कार्बोनेट और हाइड्रोकार्बन को एक दूसरे में परिवर्तित किया जा सकता है:
2नाहको 3 - टी ° = ना 2 सीओ 3 + एच 2 ओ + सीओ 2
ना 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
धातु कार्बोनेट (छोड़कर क्षारीय धातु) गर्म होने पर, वे एक ऑक्साइड बनाने के लिए डीकार्बोक्सिलेट करते हैं:
CuCO 3 - t ° = CuO + CO 2
गुणात्मक प्रतिक्रिया- एक मजबूत एसिड की कार्रवाई के तहत "उबलते":
ना 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
सीओ 3 2- + 2 एच + = एच 2 ओ + सीओ 2
कार्बाइड
कैल्शियम कार्बाइड:
सीएओ + 3 सी = सीएसी 2 + सीओ
सीएसी 2 + 2 एच 2 ओ = सीए (ओएच) 2 + सी 2 एच 2।
जब जस्ता, कैडमियम, लैंथेनम और सेरियम कार्बाइड पानी के साथ प्रतिक्रिया करते हैं तो एसिटिलीन निकलता है:
2 एलएसी 2 + 6 एच 2 ओ = 2ला (ओएच) 3 + 2 सी 2 एच 2 + एच 2।
Be 2C और Al4C3 पानी के साथ अपघटित होकर मीथेन बनाती है:
अल 4 सी 3 + 12 एच 2 ओ = 4 अल (ओएच) 3 = 3 सीएच 4।
प्रौद्योगिकी में, टाइटेनियम कार्बाइड TiC, टंगस्टन W 2 C (हार्ड मिश्र धातु), सिलिकॉन SiC (कार्बोरंडम - एक अपघर्षक और हीटर के लिए एक सामग्री के रूप में) का उपयोग किया जाता है।
साइनाइड
अमोनिया और कार्बन मोनोऑक्साइड के वातावरण में सोडा को गर्म करने से प्राप्त होता है:
ना 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
हाइड्रोसायनिक एसिड एचसीएन रासायनिक उद्योग का एक महत्वपूर्ण उत्पाद है और व्यापक रूप से कार्बनिक संश्लेषण में उपयोग किया जाता है। इसका विश्व उत्पादन प्रति वर्ष 200 हजार टन तक पहुंचता है। साइनाइड आयन की इलेक्ट्रॉनिक संरचना कार्बन मोनोऑक्साइड (II) के समान है, ऐसे कणों को आइसोइलेक्ट्रोनिक कहा जाता है:
सी = ओ: [: सी = एन:] -
साइनाइड्स (0.1-0.2% पानी का घोल) सोने के खनन में उपयोग किया जाता है:
2 एयू + 4 केसीएन + एच 2 ओ + 0.5 ओ 2 = 2 के + 2 केओएच।
जब सायनाइड के घोल को सल्फर के साथ उबालते हैं या ठोस पदार्थों का संलयन करते हैं, थियोसाइनेट्स:
केसीएन + एस = केएससीएन।
जब कम सक्रियता वाली धातुओं के साइनाइड को गर्म किया जाता है, तो सायनोजेन प्राप्त होता है: एचजी (सीएन) 2 = एचजी + (सीएन) 2. सायनाइड विलयन का ऑक्सीकरण होता है साइनेट्स:
2 केसीएन + ओ 2 = 2 केओसीएन।
साइनिक एसिड दो रूपों में आता है:
एच-एन = सी = ओ; एच-ओ-सी = एन:
1828 में, फ्रेडरिक वोहलर (1800-1882) ने अमोनियम साइनेट से यूरिया प्राप्त किया: NH 4 OCN = CO (NH 2) 2 एक जलीय घोल के वाष्पीकरण द्वारा।
इस घटना को आमतौर पर "जीवनवादी सिद्धांत" पर सिंथेटिक रसायन विज्ञान की जीत के रूप में देखा जाता है।
सायनिक अम्ल का समावयवी होता है - ऑक्सीहाइड्रोजन
एच-ओ-एन = सी।
इसके लवण (विस्फोटक पारा एचजी (ONC) 2) का उपयोग इम्पैक्ट इग्निटर में किया जाता है।
संश्लेषण यूरिया(यूरिया):
सीओ 2 + 2 एनएच 3 = सीओ (एनएच 2) 2 + एच 2 ओ। 130 0 और 100 एटीएम पर।
यूरिया कार्बोनिक एसिड का एक एमाइड है, इसका "नाइट्रोजन एनालॉग" भी है - गुआनिडीन।
कार्बोनेट्स
सबसे महत्वपूर्ण अकार्बनिक यौगिककार्बन - कार्बोनिक एसिड (कार्बोनेट) के लवण। एच 2 सीओ 3 एक कमजोर एसिड है (के 1 = 1.3 · 10 -4; के 2 = 5 · 10 -11)। कार्बोनेट बफर का समर्थन करता है कार्बन डाइऑक्साइड संतुलनवातावरण में। महासागरों में एक विशाल बफर क्षमता होती है क्योंकि वे हैं खुली प्रणाली... मुख्य बफर प्रतिक्रिया कार्बोनिक एसिड के पृथक्करण में संतुलन है:
एच 2 सीओ 3 ↔ एच + + एचसीओ 3 -।
अम्लता में कमी के साथ, वातावरण से कार्बन डाइऑक्साइड का अतिरिक्त अवशोषण अम्ल के निर्माण के साथ होता है:
सीओ 2 + एच 2 ओ ↔ एच 2 सीओ 3।
अम्लता में वृद्धि के साथ, कार्बोनेट चट्टानों (गोले, चाक और समुद्र में चूना पत्थर जमा) का विघटन होता है; यह हाइड्रोकार्बोनेट आयनों के नुकसान की भरपाई करता है:
एच + + सीओ 3 2- ↔ एचसीओ 3 -
CaCO 3 (ठोस) Ca 2+ + CO 3 2-
ठोस कार्बोनेट घुलनशील हाइड्रोकार्बन में परिवर्तित हो जाते हैं। यह अतिरिक्त कार्बन डाइऑक्साइड के रासायनिक विघटन की प्रक्रिया है जो "ग्रीनहाउस प्रभाव" का प्रतिकार करती है - कार्बन डाइऑक्साइड के अवशोषण के कारण ग्लोबल वार्मिंग गर्मी विकिरणधरती। विश्व के सोडा उत्पादन का लगभग एक तिहाई (सोडियम कार्बोनेट Na 2 CO 3) कांच के उत्पादन में उपयोग किया जाता है।
कार्बन
मुक्त अवस्था में, कार्बन 3 एलोट्रोपिक संशोधन बनाता है: हीरा, ग्रेफाइट और कृत्रिम रूप से उत्पादित कार्बाइन।
हीरे के क्रिस्टल में, प्रत्येक कार्बन परमाणु अपने चारों ओर समान दूरी पर स्थित चार अन्य से कसकर सहसंयोजी रूप से बंधा होता है।
सभी कार्बन परमाणु एसपी 3-संकरण अवस्था में हैं। हीरे की परमाणु क्रिस्टल जाली में एक चतुष्फलकीय संरचना होती है।
हीरा एक रंगहीन, पारदर्शी पदार्थ है जो प्रकाश को दृढ़ता से अपवर्तित करता है। सभी ज्ञात पदार्थों में इसकी कठोरता सबसे अधिक है। हीरा नाजुक, दुर्दम्य, खराब गर्मी और विद्युत प्रवाह का संचालन करता है। आसन्न कार्बन परमाणुओं (0.154 एनएम) के बीच छोटी दूरी के परिणामस्वरूप हीरे का उच्च घनत्व (3.5 ग्राम / सेमी 3) होता है।
ग्रेफाइट के क्रिस्टल जाली में, प्रत्येक कार्बन परमाणु sp2 -संकरण की स्थिति में होता है और एक ही परत में स्थित कार्बन परमाणुओं के साथ तीन मजबूत सहसंयोजक बंधन बनाता है। प्रत्येक परमाणु के तीन इलेक्ट्रॉन, कार्बन, इन बंधों के निर्माण में भाग लेते हैं, और चौथे संयोजकता इलेक्ट्रॉन n-आबंध बनाते हैं और अपेक्षाकृत मुक्त (मोबाइल) होते हैं। वे ग्रेफाइट की विद्युत और तापीय चालकता निर्धारित करते हैं।
एक विमान में आसन्न कार्बन परमाणुओं के बीच सहसंयोजक बंधन की लंबाई 0.152 एनएम है, और विभिन्न परतों में सी परमाणुओं के बीच की दूरी 2.5 गुना अधिक है, इसलिए उनके बीच के बंधन कमजोर हैं।
ग्रेफाइट धात्विक चमक के साथ धूसर-काले रंग का स्पर्श करने के लिए एक अपारदर्शी, मुलायम, चिकना पदार्थ है; गर्मी और विद्युत प्रवाह को अच्छी तरह से संचालित करता है। हीरे की तुलना में ग्रेफाइट का घनत्व कम होता है और यह आसानी से पतले गुच्छे में विभाजित हो जाता है।
महीन-क्रिस्टलीय ग्रेफाइट की अव्यवस्थित संरचना संरचना का आधार है अलग - अलग रूपअनाकार कार्बन, जिनमें से सबसे महत्वपूर्ण हैं कोक, भूरा और बिटुमिनस कोयले, कालिख, सक्रिय (सक्रिय) कार्बन।
कार्बन का यह एलोट्रोपिक संशोधन एसिटिलीन के उत्प्रेरक ऑक्सीकरण (डीहाइड्रो-पॉलीकंडेंसेशन) द्वारा प्राप्त किया जाता है। कार्बाइन एक श्रृंखला बहुलक है जिसके दो रूप हैं:
सी = सी-सी = सी -... और ... = सी = सी = सी =
कार्बाइन में अर्धचालक गुण होते हैं।
सामान्य तापमान पर, कार्बन संशोधन (हीरा और ग्रेफाइट) दोनों रासायनिक रूप से निष्क्रिय होते हैं। ग्रेफाइट के महीन-क्रिस्टलीय रूप - कोक, कालिख, सक्रिय कार्बन - अधिक प्रतिक्रियाशील होते हैं, लेकिन, एक नियम के रूप में, उन्हें उच्च तापमान पर पहले से गरम करने के बाद।
1. ऑक्सीजन के साथ बातचीत
सी + ओ 2 = सीओ 2 + 393.5 केजे (ओ 2 से अधिक)
2C + O 2 = 2CO + 221 kJ (O 2 की कमी के साथ)
कोयला जलाना ऊर्जा के सबसे महत्वपूर्ण स्रोतों में से एक है।
2. फ्लोरीन और सल्फर के साथ बातचीत।
सी + 2 एफ 2 = सीएफ 4 कार्बन टेट्राफ्लोराइड
सी + 2 एस = सीएस 2 कार्बन डाइसल्फ़ाइड
3. कोक उद्योग में उपयोग किए जाने वाले सबसे महत्वपूर्ण कम करने वाले एजेंटों में से एक है। धातु विज्ञान में, इसका उपयोग ऑक्साइड से धातुओं के उत्पादन के लिए किया जाता है, उदाहरण के लिए:
+ Fe 2 O 3 = 2Fe +
सी + जेडएनओ = जेडएन + सीओ
4. जब कार्बन क्षार और क्षारीय पृथ्वी धातुओं के ऑक्साइड के साथ परस्पर क्रिया करता है, तो अपचित धातु कार्बन के साथ मिलकर कार्बाइड बनाती है। उदाहरण के लिए: ZC + CaO = CaC 2 + CO कैल्शियम कार्बाइड
5. कोक का उपयोग सिलिकॉन प्राप्त करने के लिए भी किया जाता है:
2С + SiO2 = Si + 2СО
6. कोक की अधिकता से सिलिकॉन कार्बाइड (कार्बोरंडम) SiC बनता है।
"वाटर गैस" प्राप्त करना (ठोस ईंधन का गैसीकरण)
गर्म कोयले के माध्यम से जल वाष्प गुजरने से सीओ और एच 2 का एक दहनशील मिश्रण बनता है, जिसे जल गैस कहा जाता है:
सी + एच 2 ओ = सीओ + एच 2
7. ऑक्सीकरण अम्लों के साथ अभिक्रियाएँ।
सक्रिय या चारकोल, गर्म होने पर, आयनों NO 3 - और SO 4 2- को कम कर देता है सांद्र अम्ल:
सी + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O
सी + 2 एच 2 एसओ 4 = सीओ 2 + 2 एसओ 2 + 2 एच 2 ओ
8. गलित क्षार धातु नाइट्रेट के साथ अभिक्रिया
KNO 3 और NaNO 3 पिघलते हैं, कुचला हुआ कोयला एक चमकदार लौ के निर्माण के साथ तीव्रता से जलता है:
5C + 4KNO 3 = 2K 2 CO 3 + 3CO 2 + 2N 2
1. सक्रिय धातुओं के साथ नमक जैसी कार्बाइड का बनना।
कार्बन के गैर-धातु गुणों का एक महत्वपूर्ण कमजोर होना इस तथ्य में व्यक्त किया जाता है कि ऑक्सीकरण एजेंट के रूप में इसके कार्य कम करने वाले कार्यों की तुलना में बहुत कम हद तक प्रकट होते हैं।
2. केवल सक्रिय धातुओं के साथ प्रतिक्रिया में, कार्बन परमाणु नकारात्मक रूप से आवेशित आयनों C -4 और (C = C) 2- में गुजरते हैं, जिससे नमक जैसी कार्बाइड बनती है:
+ 4Al = Аl 4 С 3 एल्युमिनियम कार्बाइड
2C + Ca = CaC 2 कैल्शियम कार्बाइड
3. आयनिक प्रकार के कार्बाइड बहुत अस्थिर यौगिक होते हैं, वे एसिड और पानी की क्रिया के तहत आसानी से विघटित हो जाते हैं, जो नकारात्मक रूप से चार्ज किए गए कार्बन आयनों की अस्थिरता को इंगित करता है:
अल 4 सी 3 + 12एच 2 ओ = 3सीएच 4 + 4एएल (ओएच) 3
सीएसी 2 + 2 एच 2 ओ = सी 2 एच 2 + सीए (ओएच) 2
4. धातुओं के साथ सहसंयोजक यौगिकों का निर्माण
संक्रमण धातुओं के साथ कार्बन के मिश्रण के पिघलने में, सहसंयोजक प्रकार के बंधन के साथ मुख्य रूप से कार्बाइड बनते हैं। उनके अणुओं में एक परिवर्तनशील संरचना होती है, और सामान्य रूप से पदार्थ मिश्र धातुओं के करीब होते हैं। ऐसे कार्बाइड अत्यधिक प्रतिरोधी होते हैं, वे पानी, एसिड, क्षार और कई अन्य अभिकर्मकों के प्रति रासायनिक रूप से निष्क्रिय होते हैं।
5. हाइड्रोजन के साथ बातचीत
उच्च टी और पी पर, निकल उत्प्रेरक की उपस्थिति में, कार्बन हाइड्रोजन के साथ जुड़ता है:
सी + 2 एच 2 → सीएच 4
प्रतिक्रिया बहुत प्रतिवर्ती है और व्यावहारिक नहीं है।
कार्बन मोनोऑक्साइड (द्वितीय)- सीओ
(कार्बन मोनोआक्साइड, कार्बन मोनोआक्साइड, कार्बन मोनोआक्साइड)
भौतिक गुण:रंगहीन जहरीली गैस, स्वादहीन और गंधहीन, नीली लौ से जलती है, हवा से हल्की होती है, पानी में खराब घुलनशील होती है। हवा में कार्बन मोनोऑक्साइड की सांद्रता 12.5-74% विस्फोटक है।
प्राप्त करना:
1) उद्योग में
सी + ओ 2 = सीओ 2 + 402 केजे
सीओ 2 + सी = 2सीओ - 175 केजे
गैस जनरेटर में, जल वाष्प को कभी-कभी गर्म कोयले से उड़ाया जाता है:
सी + एच 2 ओ = सीओ + एच 2 - क्यू,
मिश्रण + 2 - संश्लेषण गैस कहलाता है.
2) प्रयोगशाला में- एच 2 एसओ 4 (सांद्रिक) की उपस्थिति में फॉर्मिक या ऑक्सालिक एसिड का थर्मल अपघटन:
एचसीओओएच t˚C, H2SO4 →एच 2 ओ + सीओ
एच 2 सी 2 ओ 4 t˚C, H2SO4 →सीओ + सीओ 2 + एच 2 ओ
रासायनिक गुण:
सामान्य परिस्थितियों में CO निष्क्रिय है;गर्म होने पर - एक कम करने वाला एजेंट;
सीओ - गैर-नमक बनाने वाला ऑक्साइड.
1) ऑक्सीजन के साथ
2सी +2 ओ + ओ 2 टी ˚ सी → 2सी +4 ओ 2
2) धातु आक्साइड के साथ सीओ + मी एक्स ओ वाई = सीओ 2 + मी
सी +2 ओ + क्यूओ टी ˚ सी → क्यू + सी +4 ओ 2
3) क्लोरीन के साथ (प्रकाश में)
CO + Cl 2 प्रकाश → COCl 2 (फॉसजीन एक जहरीली गैस है)
4) * क्षार गलनांक (दबाव में) के साथ अभिक्रिया करता है
CO + NaOH P → HCOONA (सोडियम फॉर्मेट)
जीवों पर कार्बन मोनोऑक्साइड का प्रभाव:
कार्बन मोनोऑक्साइड खतरनाक है क्योंकि यह रक्त के लिए हृदय और मस्तिष्क जैसे महत्वपूर्ण अंगों तक ऑक्सीजन ले जाना असंभव बना देता है। कार्बन मोनोऑक्साइड हीमोग्लोबिन के साथ जुड़ता है, जो शरीर की कोशिकाओं तक ऑक्सीजन पहुंचाता है, जिससे यह ऑक्सीजन के परिवहन के लिए अनुपयुक्त हो जाता है। साँस की मात्रा के आधार पर, कार्बन मोनोऑक्साइड समन्वय को बाधित करता है, हृदय रोगों को बढ़ाता है और थकान, सिरदर्द, कमजोरी का कारण बनता है। मानव स्वास्थ्य पर कार्बन मोनोऑक्साइड का प्रभाव इसकी एकाग्रता और शरीर के संपर्क के समय पर निर्भर करता है। हवा में 0.1% से अधिक कार्बन मोनोऑक्साइड की सांद्रता एक घंटे के भीतर मृत्यु की ओर ले जाती है, और तीन मिनट के भीतर 1.2% से अधिक की सांद्रता।
कार्बन मोनोऑक्साइड का अनुप्रयोग:
कार्बन मोनोऑक्साइड मुख्य रूप से नाइट्रोजन के साथ मिश्रित दहनशील गैस के रूप में प्रयोग किया जाता है, तथाकथित जनरेटर गैस या वायु गैस, या हाइड्रोजन के साथ मिश्रित जल गैस। धातु विज्ञान में अपने अयस्कों से धातुओं की प्राप्ति के लिए। कार्बोनिल्स के अपघटन द्वारा उच्च शुद्धता की धातुएँ प्राप्त करने के लिए।
कार्बन मोनोऑक्साइड (IV) O2 - कार्बन डाइऑक्साइड
भौतिक गुण:कार्बन डाइऑक्साइड, रंगहीन, गंधहीन, पानी में घुलनशीलता - 0.9V CO 2 1V H 2 O (सामान्य परिस्थितियों में) में घुल जाता है; हवा से भारी; t ° pl। = -78.5 ° C (ठोस CO 2 को "सूखी बर्फ" कहा जाता है); दहन का समर्थन नहीं करता है।
अणु संरचना:
कार्बन डाइऑक्साइड के निम्नलिखित इलेक्ट्रॉनिक और संरचनात्मक सूत्र हैं -
3. कार्बनयुक्त पदार्थों का दहन:
सीएच 4 + 2ओ 2 → 2एच 2 ओ + सीओ 2
4. जैव रासायनिक प्रक्रियाओं (श्वसन, क्षय, किण्वन) में धीमी ऑक्सीकरण के साथ
रासायनिक गुण:
कार्बन ऑक्साइड (II) और (IV)
रसायन विज्ञान और जीव विज्ञान में एकीकृत पाठ
कार्य:कार्बन ऑक्साइड (II) और (IV) के बारे में ज्ञान का अध्ययन और व्यवस्थित करना; जीवित और निर्जीव प्रकृति के बीच संबंध को प्रकट करने के लिए; मानव शरीर पर कार्बन ऑक्साइड के प्रभाव के बारे में ज्ञान को समेकित करना; प्रयोगशाला उपकरणों के साथ काम करने के लिए कौशल को मजबूत करना।
उपकरण:एचसीएल समाधान, लिटमस, सीए (ओएच) 2, सीएसीओ 3, कांच की छड़, घर का बना टेबल, पोर्टेबल बोर्ड, बॉल-एंड-स्टिक मॉडल।
कक्षाओं के दौरान
जीव विज्ञान शिक्षकपाठ के विषय और उद्देश्यों को संप्रेषित करता है।
रसायन विज्ञान शिक्षक।सहसंयोजक बंधन के सिद्धांत के आधार पर, कार्बन ऑक्साइड (II) और (IV) के इलेक्ट्रॉनिक और संरचनात्मक सूत्र बनाएं।
कार्बन मोनोऑक्साइड (II) का रासायनिक सूत्र CO है, कार्बन परमाणु अपनी सामान्य अवस्था में है।
अयुग्मित इलेक्ट्रॉनों के युग्म के कारण दो सहसंयोजी ध्रुवीय बंध बनते हैं, और तीसरा सहसंयोजक बंधनदाता-स्वीकर्ता तंत्र द्वारा बनता है। दाता एक ऑक्सीजन परमाणु है, क्योंकि यह इलेक्ट्रॉनों की एक मुक्त जोड़ी प्रदान करता है; स्वीकर्ता एक कार्बन परमाणु है, क्योंकि एक मुक्त कक्षीय प्रदान करता है।
उद्योग में, कार्बन मोनोऑक्साइड (II) उच्च तापमान पर गर्म कोयले के ऊपर CO2 पास करके प्राप्त किया जाता है। यह ऑक्सीजन की कमी के साथ कोयले के दहन के दौरान भी बनता है। ( ब्लैकबोर्ड पर प्रतिक्रिया समीकरण लिख रहा छात्र)

प्रयोगशाला में फार्मिक अम्ल पर सांद्र H2SO4 की क्रिया द्वारा CO प्राप्त की जाती है। ( शिक्षक प्रतिक्रिया समीकरण लिखता है.)
![]()
जीव विज्ञान शिक्षक।तो, आप कार्बन मोनोऑक्साइड (II) के उत्पादन से परिचित हो गए। और क्या भौतिक गुणकार्बन मोनोऑक्साइड (II) है?
विद्यार्थी।यह एक रंगहीन गैस है, जहरीली, गंधहीन, हवा से हल्की, पानी में खराब घुलनशील, क्वथनांक -191.5 डिग्री सेल्सियस, -205 डिग्री सेल्सियस पर जम जाती है।
रसायन विज्ञान शिक्षक।खतरनाक मात्रा में कार्बन मोनोऑक्साइड मानव जीवनकारों की निकास गैसों में निहित। इसलिए, गैरेज अच्छी तरह हवादार होना चाहिए, खासकर इंजन शुरू करते समय।
जीव विज्ञान शिक्षक।मानव शरीर पर कार्बन मोनोऑक्साइड का क्या प्रभाव पड़ता है?
विद्यार्थी।कार्बन मोनोऑक्साइड मनुष्यों के लिए अत्यंत विषैला होता है - यह इस तथ्य के कारण है कि यह कार्बोक्सीहीमोग्लोबिन बनाता है। कार्बोक्सीहीमोग्लोबिन एक बहुत मजबूत यौगिक है। इसके गठन के परिणामस्वरूप, रक्त हीमोग्लोबिन ऑक्सीजन के साथ बातचीत नहीं करता है, और गंभीर विषाक्तता के मामले में, एक व्यक्ति ऑक्सीजन भुखमरी से मर सकता है।
जीव विज्ञान शिक्षक।कार्बन मोनोऑक्साइड विषाक्तता के मामले में किसी व्यक्ति को क्या प्राथमिक उपचार दिया जाना चाहिए?
छात्र।एंबुलेंस बुलाना जरूरी है, पीड़ित को बाहर गली में ले जाना चाहिए, कृत्रिम सांस देनी चाहिए, कमरा अच्छी तरह हवादार होना चाहिए।
रसायन विज्ञान शिक्षक।कार्बन मोनोऑक्साइड (IV) का रासायनिक सूत्र लिखिए और बॉल-एंड-स्टिक मॉडल का उपयोग करके इसकी संरचना बनाइए।
कार्बन परमाणु उत्तेजित अवस्था में है। सभी चार सहसंयोजक ध्रुवीय बंध अयुग्मित इलेक्ट्रॉनों को जोड़कर बनते हैं। हालांकि, इसकी रैखिक संरचना के कारण, इसका अणु आमतौर पर गैर-ध्रुवीय होता है।
उद्योग में, चूने के उत्पादन में कैल्शियम कार्बोनेट के अपघटन से CO2 प्राप्त होती है।
(छात्र प्रतिक्रिया समीकरण लिखता है.)
प्रयोगशाला में, CO2 अम्लों को चाक या मार्बल के साथ परस्पर क्रिया द्वारा प्राप्त किया जाता है।
(छात्र एक प्रयोगशाला प्रयोग करते हैं।)

जीव विज्ञान शिक्षक।शरीर में कार्बन डाइऑक्साइड का निर्माण किन प्रक्रियाओं के परिणामस्वरूप होता है?
विद्यार्थी।कार्बन डाइऑक्साइड शरीर में कार्बनिक पदार्थों के ऑक्सीकरण प्रतिक्रियाओं के परिणामस्वरूप बनता है जो कोशिका बनाते हैं।
(छात्र एक प्रयोगशाला प्रयोग करते हैं।)

चूने का घोल बादल बन गया क्योंकि कैल्शियम कार्बोनेट बनता है। सांस लेने की प्रक्रिया के अलावा, किण्वन और क्षय के परिणामस्वरूप CO2 निकलता है।
जीव विज्ञान शिक्षक।क्या शारीरिक गतिविधि श्वास प्रक्रिया को प्रभावित करती है?
विद्यार्थी।अत्यधिक शारीरिक (मांसपेशियों) भार के साथ, मांसपेशियां रक्त की तुलना में तेजी से ऑक्सीजन का उपयोग करती हैं, और फिर वे किण्वन द्वारा अपने काम के लिए आवश्यक एटीपी को संश्लेषित करती हैं। मांसपेशियों में लैक्टिक एसिड सी 3 एच 6 ओ 3 बनता है, जो रक्तप्रवाह में प्रवेश करता है। बड़ी मात्रा में लैक्टिक एसिड का जमा होना शरीर के लिए हानिकारक होता है। भारी शारीरिक परिश्रम के बाद, हम कुछ समय के लिए जोर से सांस लेते हैं - हम "ऑक्सीजन ऋण" का भुगतान करते हैं।
रसायन विज्ञान शिक्षक।जब जीवाश्म ईंधन जलाया जाता है तो कार्बन मोनोऑक्साइड (IV) की एक बड़ी मात्रा वातावरण में छोड़ी जाती है। घर में, हम प्राकृतिक गैस का उपयोग ईंधन के रूप में करते हैं, और यह लगभग 90% मीथेन (CH4) है। मेरा सुझाव है कि आप में से एक ब्लैकबोर्ड पर जाएं, एक प्रतिक्रिया समीकरण लिखें और ऑक्सीकरण-कमी के संदर्भ में इसका विश्लेषण करें।

जीव विज्ञान शिक्षक।एक कमरे को गर्म करने के लिए गैस ओवन का उपयोग क्यों नहीं किया जा सकता है?
विद्यार्थी।मीथेन एक अभिन्न अंग है प्राकृतिक गैस... जब यह जलता है, तो हवा में कार्बन डाइऑक्साइड की मात्रा बढ़ जाती है, और ऑक्सीजन कम हो जाती है। ( तालिका "सामग्री" के साथ काम करनासीओ 2 हवा में".)
जब हवा में 0.3% सीओ 2 होता है, तो व्यक्ति तेजी से सांस लेने का अनुभव करता है; 10% पर - चेतना की हानि, 20% पर - तत्काल पक्षाघात और त्वरित मृत्यु। एक बच्चे को विशेष रूप से स्वच्छ हवा की आवश्यकता होती है, क्योंकि बढ़ते जीव के ऊतकों द्वारा ऑक्सीजन की खपत एक वयस्क की तुलना में अधिक होती है। इसलिए, कमरे को नियमित रूप से हवादार करना आवश्यक है। यदि रक्त में CO2 की अधिकता हो जाती है, तो श्वसन केंद्र की उत्तेजना बढ़ जाती है और श्वास अधिक बार-बार और गहरी हो जाती है।
जीव विज्ञान शिक्षक।पौधों के जीवन में कार्बन मोनोऑक्साइड (IV) की भूमिका पर विचार करें।
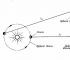
विद्यार्थी।पौधों में प्रकाश में CO2 और H2O से कार्बनिक पदार्थों का निर्माण होता है, कार्बनिक पदार्थों के अतिरिक्त ऑक्सीजन का निर्माण होता है।

![]()
प्रकाश संश्लेषण वातावरण में कार्बन डाइऑक्साइड सामग्री को नियंत्रित करता है, जो ग्रह को बढ़ते तापमान से रोकता है। पौधे सालाना 300 अरब टन कार्बन डाइऑक्साइड को वायुमंडल से अवशोषित करते हैं। प्रकाश संश्लेषण की प्रक्रिया में हर साल 200 अरब टन ऑक्सीजन वायुमंडल में छोड़ी जाती है। आंधी के दौरान ऑक्सीजन से ओजोन का निर्माण होता है।
रसायन विज्ञान शिक्षक।विचार करना रासायनिक गुणकार्बन मोनोऑक्साइड (IV)।

जीव विज्ञान शिक्षक।श्वसन के दौरान मानव शरीर में कार्बोनिक अम्ल का क्या महत्व है? ( फिल्म पट्टी टुकड़ा.)
रक्त में एंजाइम कार्बन डाइऑक्साइड को कार्बोनिक एसिड में परिवर्तित करते हैं, जो हाइड्रोजन और बाइकार्बोनेट आयनों में अलग हो जाते हैं। यदि रक्त में H + आयनों की अधिकता है, अर्थात। यदि रक्त की अम्लता बढ़ जाती है, तो कुछ H + आयन बाइकार्बोनेट आयनों के साथ मिलकर कार्बोनिक एसिड बनाते हैं और इस तरह रक्त को अतिरिक्त H + आयनों से मुक्त करते हैं। यदि रक्त में बहुत कम H + आयन होते हैं, तो कार्बोनिक एसिड अलग हो जाता है और रक्त में H + आयनों की सांद्रता बढ़ जाती है। 37 डिग्री सेल्सियस पर, रक्त पीएच 7.36 है।
शरीर में, कार्बन डाइऑक्साइड रक्त द्वारा रासायनिक यौगिकों - सोडियम और पोटेशियम बाइकार्बोनेट के रूप में ले जाया जाता है।
सामग्री की सुरक्षा
परीक्षण
फेफड़ों और ऊतकों में गैस विनिमय की प्रस्तावित प्रक्रियाओं से, पहला विकल्प प्रदर्शन करने वालों को बाईं ओर सही उत्तरों के सिफर और दूसरे को दाईं ओर चुनना होगा।
(1) फेफड़ों से रक्त में O 2 का स्थानांतरण। (13)
(2) रक्त से ऊतक में O 2 का स्थानांतरण। (चौदह)
(3) ऊतकों से रक्त में CO2 का स्थानांतरण। (15)
(4) रक्त से फेफड़ों में CO2 का स्थानांतरण। (16)
(5) एरिथ्रोसाइट्स द्वारा ओ 2 का तेज। (17)
(6) एरिथ्रोसाइट्स से ओ 2 का विमोचन। (अठारह)
(7) धमनी रक्त का शिरापरक रक्त में रूपांतरण। (19)
(8) शिरापरक रक्त का धमनी रक्त में परिवर्तन। (बीस)
(9) ब्रेक रसायनिक बंधओ 2 हीमोग्लोबिन के साथ। (21)
(10) हीमोग्लोबिन के लिए O 2 का रासायनिक बंधन। (22)
(11) ऊतकों में केशिकाएं। (23)
(12) पल्मोनरी केशिकाएँ। (24)
पहला विकल्प प्रश्न
1. ऊतकों में गैस विनिमय की प्रक्रियाएं।
2. गैस विनिमय के दौरान भौतिक प्रक्रियाएं।
दूसरा विकल्प प्रश्न
1.
फेफड़ों में गैस विनिमय प्रक्रियाएं।
2. गैस विनिमय के दौरान रासायनिक प्रक्रियाएं
टास्क
कार्बन मोनोऑक्साइड (IV) का आयतन निर्धारित करें जो 50 ग्राम कैल्शियम कार्बोनेट के अपघटन के दौरान निकलता है।
सामान्य परिस्थितियों में कार्बन मोनोऑक्साइड (IV) (कार्बन डाइऑक्साइड, कार्बन डाइऑक्साइड) एक रंगहीन गैस होती है, जो हवा से भारी होती है, तापीय रूप से स्थिर होती है, और जब संपीड़ित और ठंडा किया जाता है, तो यह आसानी से एक तरल और ठोस अवस्था में बदल जाती है।
घनत्व - 1.997 ग्राम / एल। ठोस CO2, जिसे शुष्क बर्फ कहा जाता है, कमरे के तापमान पर उदात्त हो जाती है। यह पानी में खराब रूप से घुल जाता है, इसके साथ आंशिक रूप से प्रतिक्रिया करता है। अम्लीय गुण प्रदर्शित करता है। सक्रिय धातुओं, हाइड्रोजन और कार्बन के साथ कम।
कार्बन मोनोऑक्साइड का रासायनिक सूत्र 4
कार्बन मोनोऑक्साइड (IV) CO2 का रासायनिक सूत्र। यह दर्शाता है कि इस अणु में एक कार्बन परमाणु (Ar = 12 amu) और दो ऑक्सीजन परमाणु (Ar = 16 amu) हैं। कार्बन मोनोऑक्साइड (IV) के आणविक भार की गणना के लिए रासायनिक सूत्र का उपयोग किया जा सकता है:
मिस्टर (CO2) = Ar (C) + 2 × Ar (O);
श्रीमान (CO2) = 12+ 2 × 16 = 12 + 32 = 44।
समस्या समाधान के उदाहरण
उदाहरण 1
टास्क जब 26.7 ग्राम अमीनो एसिड (CxHyOzNk) को ऑक्सीजन की अधिकता में जलाया जाता है, तो 39.6 ग्राम कार्बन मोनोऑक्साइड (IV), 18.9 ग्राम पानी और 4.2 ग्राम नाइट्रोजन बनता है। अमीनो एसिड सूत्र निर्धारित करें।
हल आइए हम एक अमीनो अम्ल की दहन अभिक्रिया के लिए एक योजना बनाते हैं, जिसमें कार्बन परमाणुओं, हाइड्रोजन, ऑक्सीजन और नाइट्रोजन की संख्या को क्रमशः "x", "y", "z" और "k" द्वारा दर्शाया जाता है:
CxHyOzNk + Oz → CO2 + H2O + N2।
आइए हम इस पदार्थ को बनाने वाले तत्वों के द्रव्यमान का निर्धारण करें। D.I की आवर्त सारणी से लिए गए सापेक्ष परमाणु द्रव्यमान के मान। मेंडेलीव, पूर्णांक तक पूर्णांक: Ar (C) = 12 amu, Ar (H) = 1 amu, Ar (O) = 16 amu, Ar (N) = 14 amu
एम (सी) = एन (सी) × एम (सी) = एन (सीओ 2) × एम (सी) = × एम (सी);
एम (एच) = एन (एच) × एम (एच) = 2 × एन (एच 2 ओ) × एम (एच) = × एम (एच);
आइए कार्बन डाइऑक्साइड और पानी के दाढ़ द्रव्यमान की गणना करें। जैसा कि आप जानते हैं, अणु का दाढ़ द्रव्यमान उन परमाणुओं के सापेक्ष परमाणु द्रव्यमान के योग के बराबर होता है जो अणु बनाते हैं (एम = श्री):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
एम (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol।
एम (सी) = एक्स 12 = 10.8 ग्राम;
एम (एच) = 2 × 18.9 / 18 × 1 = 2.1 ग्राम।
M (O) = m (CxHyOzNk) - m (C) - m (H) - m (N) = 26.7 - 10.8 - 2.1 - 4.2 = 9.6 g।
हम परिभाषित करते हैं रासायनिक सूत्रअमीनो अम्ल:
X: y: z: k = m (C) / Ar (C): m (H) / Ar (H): m (O) / Ar (O): m (N) / Ar (N);
एक्स: वाई: जेड: के = 10.8 / 12: 2.1 / 1: 9.6 / 16: 4.2 / 14;
एक्स: वाई: जेड: के = 0.9: 2.1: 0.41: 0.3 = 3: 7: 1.5: 1 = 6: 14: 3: 2।
तो अमीनो एसिड का सबसे सरल सूत्र C6H14O3N2 है।
उत्तर C6H14O3N2
उदाहरण 2
कार्य एक यौगिक का सबसे सरल सूत्र तैयार करें जिसमें तत्वों के द्रव्यमान अंश लगभग बराबर हों: कार्बन - 25.4%, हाइड्रोजन - 3.17%, ऑक्सीजन - 33.86%, क्लोरीन - 37.57%।
समाधान संरचना HX के एक अणु में तत्व X के द्रव्यमान अंश की गणना निम्न सूत्र द्वारा की जाती है:
(X) = n × Ar (X) / M (HX) × 100%।
आइए अणु में कार्बन परमाणुओं की संख्या को "x", हाइड्रोजन के नाइट्रोजन परमाणुओं की संख्या को "y", ऑक्सीजन परमाणुओं की संख्या को "z" और क्लोरीन परमाणुओं की संख्या को "k" से निरूपित करें।
संबंधित रिश्तेदार खोजें परमाणु द्रव्यमानकार्बन, हाइड्रोजन, ऑक्सीजन और क्लोरीन के तत्व (डी.आई. मेंडेलीव की आवर्त सारणी से लिए गए सापेक्ष परमाणु द्रव्यमान के मान, पूर्ण संख्या में गोल)।
एआर (सी) = 12; एआर (एच) = 14; एआर (ओ) = 16; एआर (सीएल) = 35.5।
हम तत्वों के प्रतिशत को संबंधित सापेक्ष परमाणु द्रव्यमान से विभाजित करते हैं। इस प्रकार, हम यौगिक के अणु में परमाणुओं की संख्या के बीच का अनुपात ज्ञात करेंगे:
एक्स: वाई: जेड: के = ω (सी) / एआर (सी): (एच) / एआर (एच): ω (ओ) / एआर (ओ): (सीएल) / एआर (सीएल);
एक्स: वाई: जेड: के = 25.4 / 12: 3.17 / 1: 33.86 / 16: 37.57 / 35.5;
एक्स: वाई: जेड: के = 2.1: 3.17: 2.1: 1.1 = 2: 3: 2: 1।
इसका मतलब है कि कार्बन, हाइड्रोजन, ऑक्सीजन और क्लोरीन के यौगिक के लिए सबसे सरल सूत्र C2H3O2Cl होगा।