Де застосовується закон бій маріотта. Газові закони
Твердження закону Бойля - Маріотта полягає в наступному :
У математичній формі це твердження записується у вигляді формули
де - Тиск газу; - обсяг газу, а - Постійна в обумовлених умовах величина. У загальному випадку значення визначається хімічною природою, масою та температурою газу.
Очевидно, що якщо індексом 1 позначити величини, що належать до початкового стану газу, а індексом 2 - До кінцевого, то наведену формулу можна записати у вигляді
.
Зі сказаного і наведених формул випливає вигляд залежності тиску газу від його обсягу в ізотермічному процесі:
Ця залежність є інше, еквівалентне першому, вираз змісту закону Бойля - Маріотта. Вона означає, що
Тиск деякої маси газу, що знаходиться при постійній температурі, обернено пропорційно його обсягу.
Тоді зв'язок початкового та кінцевого станів газу, який брав участь в ізотермічному процесі, можна виразити у вигляді:
Слід зазначити, що застосування цієї і наведеної вище формули, що зв'язує початкові і кінцеві тиски і об'єми газу один з одним, не обмежується випадком ізотермічних процесів. Формули залишаються справедливими й у випадках, коли під час процесу температура змінюється, але результаті процесу кінцева температура виявляється рівної початкової.
Важливо уточнити, що цей закон справедливий лише в тих випадках, коли цей газ можна вважати ідеальним. Зокрема, з високою точністю закон Бойля - Маріотта виконується стосовно розріджених газів. Якщо ж газ дуже стиснутий, то спостерігаються суттєві відступи від цього закону.
Наслідки
Закон Бойля - Маріотта стверджує, що тиск газу в ізотермічному процесі обернено пропорційно займаному газом. Якщо врахувати, що щільність газу також обернено пропорційна об'єму, який він займає, то ми прийдемо до висновку:
При ізотермічному процесі тиск газу змінюється прямо пропорційно до його щільності.
Таким чином, приходимо до висновку:
Ізотермічний коефіцієнт стисливості ідеального газу дорівнює зворотній величині його тиску.
Див. також
Напишіть відгук про статтю "Закон Бойля - Маріотта"
Примітки
- Петрушевський Ф. Ф.// Енциклопедичний словник Брокгауза та Єфрона
- // Фізична енциклопедія/Гол. ред. А. М. Прохоров. – М.: Радянська енциклопедія, 1988. – Т. 1. – С. 221-222. – 704 с. - 100 000 прим.
- Сивухін Д. В.Загальний курс фізики - М.: Фізматліт, 2005. - Т. II. Термодинаміка та молекулярна фізика. – С. 21-22. – 544 с. - ISBN 5-9221-0601-5.
- Елементарний підручник фізики/За ред. Г. С. Ландсберга. - М.: Наука, 1985. - Т. I. Механіка. Теплота. Молекулярна фізика – С. 430. – 608 с.
- Кікоїн А. К., Кікоїн І. К.Молекулярна фізика – М.: Наука, 1976. – С. 35-36.
- При постійній масі.
- Лівшиць Л. Д.// Фізична енциклопедія/Гол. ред. А. М. Прохоров. – М.: Велика Російська енциклопедія, 1994. – Т. 4. – С. 492-493. – 704 с. - 40 000 екз. - ISBN 5-85270-087-8.
Література
- Петрушевський Ф. Ф.// Енциклопедичний словник Брокгауза та Єфрона: в 86 т. (82 т. і 4 дод.). - СПб. , 1890–1907.
Уривок, що характеризує Закон Бойля - Маріотта
– Вона сама, – почувся у відповідь грубий жіночий голос, і потім увійшла до кімнати Марія Дмитрівна.Усі панночки і навіть жінки, крім найстаріших, підвелися. Марія Дмитрівна зупинилася в дверях і, з висоти свого огрядного тіла, високо тримаючи свою з сивими буклями п'ятдесятилітню голову, оглянула гостей і, немов засучившись, виправила неквапливо широкі рукави своєї сукні. Марія Дмитрівна завжди говорила російською.
- Іменинниці дорогий з дітками, - сказала вона своїм голосним, густим голосом, що пригнічує всі інші звуки. - Ти що, старий гріховодник, - звернулася вона до графа, що цілував її руку, - чай, нудьгуєш у Москві? Собак ганяти нема де? Та що, батюшка, робити, ось як ці пташки підростуть… – Вона вказувала на дівчат. – Хочеш – не хочеш, треба наречених шукати.
– Ну що, козаку мій? (Мар'я Дмитрівна козаком називала Наташу) - говорила вона, пестячи рукою Наташу, що підходила до її руки без страху і весело. – Знаю, що зілля дівка, а люблю.
Вона дістала з величезного рідикюля яхонтові сережки грушками і, віддавши їх Наташі, що іменинно сяяла і розрум'янилася, відразу ж відвернулась від неї і звернулася до П'єра.
– Е, е! люб'язний! піди ка сюди, - сказала вона вдавано тихим і тонким голосом. – Мабуть, любий…
І вона грізно засукала рукави ще вище.
П'єр підійшов, наївно дивлячись на неї через окуляри.
- Підійди, підійди, любий! Я і батькові то твоєму правду одна говорила, коли він у разі був, а тобі то й Бог велить.
Вона помовчала. Всі мовчали, чекаючи на те, що буде, і відчуваючи, що була тільки передмова.
- Добре, нема чого сказати! хороший хлопчик!.. Батько на одрі лежить, а він бавиться, квартального на ведмедя верхи садить. Соромно, батюшка, соромно! Краще б на війну йшов.
Вона відвернулась і подала руку графові, який ледве утримувався від сміху.
- Ну, що ж, до столу, я чай, настав час? – сказала Марія Дмитрівна.
Попереду пішов граф із Марією Дмитрівною; потім графиня, яку повів гусарський полковник, потрібна людина, з якою Микола мав наздоганяти полк. Ганна Михайлівна – із Шиншиним. Берг подав руку Вірі. Усміхнена Жюлі Карагіна пішла з Миколою до столу. За ними йшли інші пари, що простяглися по всій залі, і позаду всіх поодинці діти, гувернери та гувернантки. Офіціанти заворушилися, стільці загриміли, на хорах заграла музика і гості розмістилися. Звуки домашньої музики графа замінилися звуками ножів та виделок, гомону гостей, тихих кроків офіціантів.
На одному кінці столу на чолі сиділа графиня. Праворуч Марія Дмитрівна, ліворуч Ганна Михайлівна та інші гості. На іншому кінці сидів граф, ліворуч гусарський полковник, праворуч Шиншин та інші гості чоловічої статі. З одного боку довгого столу молодь старша: Віра поруч із Бергом, П'єр поруч із Борисом; з іншого боку – діти, гувернери та гувернантки. Граф із-за кришталю, пляшок та ваз із фруктами поглядав на дружину та її високий чепець із блакитними стрічками і старанно підливав вина своїм сусідам, не забуваючи і себе. Графіня так само, через ананаси, не забуваючи обов'язки господині, кидала значні погляди на чоловіка, якого лисина і обличчя, здавалося їй, своєю почервонінням різкіше відрізнялися від сивого волосся. На жіночому кінці йшло рівномірне лепетання; на чоловічому все голосніше й голосніше чулися голоси, особливо гусарського полковника, який так багато їв і пив, дедалі більше червонів, що граф уже ставив його за приклад іншим гостям. Берг з ніжною усмішкою говорив з Вірою про те, що кохання є почуттям не земним, а небесним. Борис називав нового свого приятеля П'єру колишніх за столом гостей і переглядався з Наталкою, що сиділа проти нього. П'єр мало говорив, оглядав нові обличчя та багато їв. Починаючи від двох супів, з яких він вибрав a la tortue, [черепаховий,] і кулеб'яки і до рябчиків він не пропускав жодної страви та жодного вина, яке дворецький у загорнутій серветкою пляшці таємниче висовував із-за плеча сусіда, примовляючи чи «дрей» мадера», чи «угорське», чи «рейнвейн». Він підставляв першу з чотирьох кришталевих, з вензелем графа, чарок, що стояли перед кожним приладом, і пив із задоволенням, все з більш і більш приємним виглядом поглядаючи на гостей. Наташа, що сиділа проти нього, дивилася на Бориса, як дивляться дівчатка тринадцяти років на хлопчика, з яким вони вперше щойно поцілувалися і якого вони закохані. Цей погляд її іноді звертався на П'єра, і йому під поглядом цієї смішної, жвавої дівчинки хотілося сміятися самому, не знаючи чого.
Микола сидів далеко від Соні, біля Жюлі Карагіної, і знову з тією самою мимовільною усмішкою щось говорив з нею. Соня посміхалася парадно, але, мабуть, мучилася ревнощами: то блідла, то червоніла і всіма силами прислухалася до того, що говорили між собою Микола та Жюлі. Гувернантка неспокійно оглядалася, ніби готуючись до відсічі, якби хтось надумав образити дітей. Гувернер німець намагався запам'ятати свої пологи страв, десертів і вин для того, щоб описати все докладно в листі до домашніх до Німеччини, і дуже ображався тим, що дворецький, з загорнутою в серветку пляшкою, обносив його. Німець хмурився, намагався показати вигляд, що він і не хотів отримати цього вина, але ображався тому, що ніхто не хотів зрозуміти, що вино треба було йому не для того, щоб угамувати спрагу, не з жадібності, а з сумлінної допитливості.
На чоловічому кінці столу розмова дедалі більше пожвавлювалася. Полковник розповів, що маніфест про оголошення війни вже вийшов у Петербурзі, і що екземпляр, який він сам бачив, доставлений нині кур'єром головнокомандувачу.
22. Закон Бойля-Маріотта
Одним із законів ідеального газу є закон Бойля-Маріотта,який говорить: тиск тиску Pна обсяг Vгазу при постійних масі газу та температурі постійно. Ця рівність носить назву рівняння ізотерми. Ізотерма зображується на PV-діаграмі стану газу у вигляді гіперболи та в залежності від температури газу займає те чи інше положення. Процес, що йде при Т= const, називається ізотермічним.Газ при Т= const має постійну внутрішню енергію U. Якщо газ ізотермічно розширюється, то вся теплота йде на виконання роботи. Робота, яку здійснює газ, розширюючись ізотермічно, дорівнює кількості теплоти, яку потрібно повідомити газу для її виконання:
dА= dQ= PdV,
де d А- Елементарна робота;
dV-елементарний об'єм;
P- Тиск. Якщо V 1 > V 2 і P 1< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие Т= const виконувалося, необхідно вважати зміни тиску та обсягу нескінченно повільними. Також пред'являється вимога до середовища, в якому знаходиться газ: воно має мати досить велику теплоємність. Формули до розрахунку підходять у разі підведення до системи теплової енергії. Стисленістьгазу називається його властивість змінюватися в об'ємі за зміни тиску. Кожна речовина має коефіцієнт стисливості,і він дорівнює:
c = 1 / VПро (dV / CP) T ,
тут похідна береться за Т= Const.
Коефіцієнт стисливості вводиться, щоб охарактеризувати зміну обсягу зміни тиску. Для ідеального газу він дорівнює:
c = -1 / P.
У СІ коефіцієнт стисливості має таку розмірність: [c] = м2/Н.
Цей текст є ознайомлювальним фрагментом.З книги Творчість як точна наука [Теорія вирішення винахідницьких завдань] автора Альтшуллер Генріх Саулович1. Закон повноти частин системи Необхідною умовою принципової життєздатності технічної системи є наявність і мінімальна працездатність основних частин системи. Кожна технічна система повинна включати чотири основні частини: двигун,
Із книги Інтерфейс: нові напрямки в проектуванні комп'ютерних систем автора Раскін Джефф2. Закон «енергетичної провідності» системи Необхідною умовою принципової життєздатності технічної системи є наскрізний прохід енергії по всіх частинах системи. Будь-яка технічна система є перетворювачем енергії. Звідси очевидна
З книги Приладобудування автора Бабаєв М А6. Закон переходу в надсистему Вичерпавши можливості розвитку, система входить у надсистему як одну з елементів; при цьому розвиток йде на рівні надсистеми. Про цей закон ми вже говорили. Перейдемо до динаміки. Вона включає закони, що відображають
З книги Теплотехніка автора Бурханова Наталія7. Закон переходу з макрорівня на мікрорівень Розвиток робочих органів системи, йде спочатку на макро-, а потім на мікрорівні. У більшості сучасних технічних систем робочими органами є «залізниці», наприклад, гвинти літака, колеса автомобіля, різці
З книги Комп'ютерна лінгвістика для всіх: Міфи. Алгоритми. Мова автора Анісімов Анатолій Васильович8. Закон збільшення ступеня вепольності Розвиток технічних систем йде у напрямку збільшення ступеня вепольності. Сенс цього закону полягає в тому, що невепольні системи прагнуть стати вепольними, а у вепольних системах розвиток йде у напрямку
З книги Феномен науки [Кібернетичний підхід до еволюції] автора Турчин Валентин Федорович З книги Нанотехнології [Наука, інновації та можливості] автора Фостер Лінн4.4.1. Закон Фітса Уявімо, що ви переміщаєте курсор до кнопки на екрані. Кнопка є метою переміщення. Довжина прямої лінії, що з'єднує початкову позицію курсору та найближчу точку цільового об'єкта, визначається у законі Фітса як дистанція. на
З книги Історія видатних відкриттів та винаходів (електротехніка, електроенергетика, радіоелектроніка) автора Шнейберг Ян Абрамович4.4.2. Закон Хіка Перед тим як перемістити курсор до мети або зробити будь-яку іншу дію з набору безлічі варіантів, користувач повинен вибрати цей об'єкт або дію. У законі Хіка стверджується, що коли необхідно зробити вибір із n варіантів, час на вибір
З книги автора9. Закон розподілу Пуассона та Гауса Закон Пуассона. Інша назва його - закон визначення рідкісних подій. Закон Пуассона (З. П.) застосовується в тих випадках, коли малоймовірно, і тому застосування Б/З/Р недоцільно. Достоїнствами закону є: зручність при
З книги автора23. Закон Гей-Люссака Закон Гей-Люссака говорить: відношення обсягу газу до його температури при незмінних тиску газу та його масі постійно. назва рівняння ізобари.Ізобара зображується на PV-діаграмі прямий,
З книги автора24. Закон Шарля Закон Шарля стверджує, що відношення тиску газу до його температури постійно, якщо об'єм і маса газу незмінні: P / Т = m / MО R / V = const при V = const, m = const. Ця рівність має назву рівняння ізохори .Ізохора зображується на PV-діаграмі прямої, паралельної осі P, а
З книги автора30. Закон збереження та перетворення енергії Перший закон термодинаміки заснований на загальному законі збереження та перетворення енергії, який встановлює, що енергія не створюється і не зникає. Тіла, що беруть участь у термодинамічному процесі, взаємодіють один з
З книги автораЦАРІВНА-ЖАБА І ЗАКОН СТІЙКОСТІ Як уже наголошувалося раніше (закон абстракції), первісне мислення вміло аналізувати конкретні явища та синтезувати нові абстрактні системи. Оскільки будь-який сконструйований свідомістю об'єкт сприймався живим, а живе
З книги автора1.1. Основний закон еволюції У процесі еволюції життя, наскільки нам відомо, завжди відбувалося і відбувається зараз збільшення загальної маси живої речовини та ускладнення її організації. Ускладнюючи організацію біологічних утворень, природа діє за методом спроб і
З книги автора4.2. Закон Мура У своєму найпростішому формулюванні закон Мура зводиться до твердження, що щільність монтажу транзисторних схем зростає вдвічі за кожні 18 місяців. Авторство закону приписують одному із засновників відомої фірми Intel Гордону Муру. Строго кажучи, в
ВИЗНАЧЕННЯ
Процеси, при яких один із параметрів стану газу залишається постійним називають ізопроцесами.
ВИЗНАЧЕННЯ
Газові закони- це закони, що описують ізопроцеси в ідеальному газі.
Газові закони були відкриті експериментально, але вони можуть бути отримані з рівняння Менделєєва-Клапейрона.
Розглянемо кожен із них.
Закон Бойля-Маріотта (ізотермічний процес)
Ізотермічним процесомназивають зміну стану газу, у якому його температура залишається постійної.
Для постійної маси газу при постійній температурі тиск тиску газу на обсяг є величина стала:
Цей закон можна переписати в іншому вигляді (для двох станів ідеального газу):
Цей закон випливає з рівняння Менделєєва – Клапейрона:
![]()
Очевидно, що при незмінній масі газу та при постійній температурі права частина рівняння залишається постійною величиною.
Графіки залежності параметрів газу за постійної температури називаються ізотермами.
Позначивши константу буквою, запишемо функціональну залежність тиску від об'єму при ізотермічному процесі:
Видно, що тиск газу обернено пропорційно його обсягу. Графіком зворотної пропорційності, а, отже, і графіком ізотерми в координатах є гіпербола(Рис.1, а). На рис.1 б) та в) представлені ізотерми в координатах і відповідно.

Рис.1. Графіки ізотермічних процесів у різних координатах
Закон Гей-Люссака (ізобарний процес)
Ізобарним процесомназивають зміну стану газу, у якому його тиск залишається постійним.
Для постійної маси газу при постійному тиску відношення обсягу газу до температури є постійна величина:
Цей закон також випливає з рівняння Менделєєва – Клапейрона:
![]()
ізобарами.
Розглянемо два ізобарні процеси з тисками і title="(!LANG:Rendered by QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Визначимо вид графіка в координатах. Позначивши константу буквою, запишемо функціональну залежність об'єму від температури при ізобарному процесі:
Видно, що при постійному тиску обсяг газу прямо пропорційний його температурі. Графіком прямої пропорційності, а, отже, і графіком ізобари в координатах є пряма, яка проходить через початок координат(Рис.2, в). Насправді за досить низьких температур всі гази перетворюються на рідини, яких газові закони вже непридатні. Тому поблизу початку координат ізобари на рис.2, в) показані пунктиром.

Рис.2. Графіки ізобарних процесів у різних координатах
Закон Шарля (ізохорний процес)
Ізохорним процесомназивають зміну стану газу, у якому його обсяг залишається постійним.
Для постійної маси газу при постійному обсязі відношення тиску газу до його температури є постійна величина:
Для двох станів газу цей закон запишеться у вигляді:
Цей закон також можна отримати з рівняння Менделєєва – Клапейрона:
![]()
Графіки залежності параметрів газу при постійному тиску називаються ізохорами.
Розглянемо два ізохорні процеси з обсягами та title="(!LANG:Rendered by QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
Для визначення виду графіка ізохорного процесу в координатах позначимо константу в законі Шарля буквою отримаємо:
Таким чином, функціональна залежність тиску від температури при постійному обсязі є прямою пропорційністю, графіком такої залежності є пряма, яка проходить через початок координат (рис.3, в).

Рис.3. Графіки ізохорних процесів у різних координатах
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | До якої температури потрібно ізобарично охолодити деяку масу газу з початковою температурою, щоб обсяг газу при цьому зменшився на одну чверть? |
| Рішення | Ізобарний процес описується законом Гей-Люссака: За умовою завдання обсяг газу внаслідок ізобарного охолодження зменшується на одну чверть, отже: звідки кінцева температура газу: Переведемо одиниці у систему СІ: початкова температура газу . Обчислимо:
|
| Відповідь | Газ потрібно охолодити до температури. |
ПРИКЛАД 2
| Завдання | У закритій посудині знаходиться газ під тиском 200 кПа. Яким стане тиск газу, якщо температуру підвищити на 30%? |
| Рішення | Оскільки посудина з газом закрита, обсяг газу не змінюється. Ізохорний процес описується законом Шарля: За умовою завдання температура газу підвищилася на 30%, тому можна записати: Підставивши останнє співвідношення до закону Шарля, отримаємо: Переведемо одиниці у систему СІ: початковий тиск газу кПа= Па. Обчислимо: |
| Відповідь | Тиск газу дорівнюватиме 260 кПа. |
ПРИКЛАД 3
| Завдання | У кисневій системі, якою обладнано літак, є |
| Рішення | Ізотермічний процес описується законом Бойля-Маріотта: |
Закон Бойля - Маріотта
Закон Бойля - Маріотта- один з основних газових законів, відкритий в 1662 Робертом Бойлем і незалежно перевідкритий Едмом Маріоттом в 1676 році. Описує поведінку газу в ізотермічному процесі. Закон є наслідком рівняння Клапейрона.
- 1 Формулювання
- 2 Наслідки
- 3 Див.
- 4 Примітки
- 5 Література
Формулювання
Твердження закону Бойля - Маріотта полягає в наступному:
При постійних температурі та масі газу добуток тиску газу на його обсяг постійно.
У математичній формі це твердження записується у вигляді формули
де – тиск газу; - Обсяг газу, а - постійна в обумовлених умовах величина. У загальному випадку значення визначається хімічною природою, масою та температурою газу.
Очевидно, якщо індексом 1 позначити величини, які стосуються початкового стану газу, а індексом 2 - до кінцевого, то наведену формулу можна записати як
.
Зі сказаного і наведених формул випливає вигляд залежності тиску газу від його обсягу в ізотермічному процесі:
Ця залежність є інше, еквівалентне першому, вираз змісту закону Бойля - Маріотта. Вона означає, що
Тиск деякої маси газу, що знаходиться при постійній температурі, обернено пропорційно його обсягу.
Тоді зв'язок початкового та кінцевого станів газу, який брав участь в ізотермічному процесі, можна виразити у вигляді:
Слід зазначити, що застосування цієї і наведеної вище формули, що зв'язує початкові і кінцеві тиски і об'єми газу один з одним, не обмежується випадком ізотермічних процесів. Формули залишаються справедливими й у випадках, коли під час процесу температура змінюється, але результаті процесу кінцева температура виявляється рівної початкової.
Важливо уточнити, що цей закон справедливий лише в тих випадках, коли газ, що розглядається, можна вважати ідеальним. Зокрема, з високою точністю закон Бойля - Маріотта виконується стосовно розріджених газів. Якщо ж газ дуже стислий, то спостерігаються суттєві відступи від цього закону.
Закон Бойля – Маріотта, закон Шарля та закон Гей-Люссака, доповнені законом Авогадро, є достатньою основою для отримання рівняння стану ідеального газу.
Наслідки
Закон Бойля - Маріотта стверджує, що тиск газу в ізотермічному процесі обернено пропорційно займаному газом. Якщо врахувати, що щільність газу також обернено пропорційна об'єму, який він займає, то ми прийдемо до висновку:
При ізотермічному процесі тиск газу змінюється прямо пропорційно до його щільності.
Відомо, що стисливість, тобто здатність газу змінювати свій обсяг під впливом тиску, характеризується коефіцієнтом стисливості. У разі ізотермічного процесу говорять про ізотермічний коефіцієнт стисливості, який визначається формулою
де індекс T означає, що похідна приватна береться при постійній температурі. Підставляючи в цю формулу вираз для зв'язку тиску та обсягу із закону Бойля - Маріотта, отримуємо:Таким чином, приходимо до висновку:
Ізотермічний коефіцієнт стисливості ідеального газу дорівнює зворотній величині його тиску.
Див. також
- Закон Гей-Люссака
- Закон Шарля
- Закон Авогадро
- Ідеальний газ
- Рівняння стану ідеального газу
Примітки
- Бойля – Маріотта закон // Фізична енциклопедія / Гол. ред. А. М. Прохоров. - М: Радянська енциклопедія, 1988. - Т. 1. - С. 221-222. – 704 с. - 100 000 екз.
- Сівухін Д. В. Загальний курс фізики. – М.: Фізматліт, 2005. – Т. II. Термодинаміка та молекулярна фізика. – С. 21-22. – 544 с. - ISBN 5-9221-0601-5.
- 1 2 Елементарний підручник фізики/За ред. Г. С. Ландсберг. - М: Наука, 1985. - Т. I. Механіка. Теплота. Молекулярна фізика – С. 430. – 608 с.
- 1 2 3 Кікоїн А. К., Кікоїн І. К. Молекулярна фізика. - М: Наука, 1976. - С. 35-36.
- При постійній масі.
- Лівшиць Л. Д. Стиснення // Фізична енциклопедія / Гол. ред. А. М. Прохоров. - М: Велика Російська енциклопедія, 1994. - Т. 4. - С. 492-493. – 704 с. - 40 000 екз.
ISBN 5-85270-087-8.
Література
- Петрушевський Ф. Ф. Бойля-Маріотта закон // Енциклопедичний словник Брокгауза та Єфрона: у 86 т. (82 т. та 4 дод.). – СПб., 1890-1907.
Закон Бойля - Маріотта Інформація Про
Закон Бойля - Маріотта
Закон Бойля - Маріотта
Закон Бойля - МаріоттаВи переглядаєте суб'єкт
Закон Бойля - Маріотта що, Закон Бойля - Маріотта хто, Закон Бойля - Маріотта опис
Там є excerpts from wikipedia on this article and video
Наш сайт має систему у функції пошукової системи. Вище: «що ви шукали?» Ви можете запросити все у системі з коробкою. Ласкаво просимо до нашої простої, стильної та швидкої пошукової системи, яку ми підготували, щоб надати вам найточнішу та найактуальнішу інформацію.
Пошукова система, розроблена для вас, доставляє вам найактуальнішу та найточнішу інформацію з простим дизайном та системою швидкого функціонування. Ви можете знайти майже будь-яку інформацію, яку ви шукаєте на нашому сайті.
На даний момент ми служимо лише англійською, турецькою, російською, українською, казахською та білоруською мовами.
Незабаром до системи будуть додані нові мови.
Життя відомих людей дає вам інформацію, зображення та відео про сотні тем, таких як політики, урядовці, лікарі, інтернет-сайти, рослини, технологічні транспортні засоби, автомобілі і т.д.
Закон Бойля-Маріотта

Кількісне співвідношення між обсягом і тиском газу вперше встановив Роберт Бойль в 1662 * Закон Бойля-Маріотта свідчить, що при постійній температурі обсяг газу обернено пропорційний його тиску.
Цей закон застосовний до будь-якої фіксованої кількості газу. Як видно із рис. 3.2, його графічне уявлення може бути різним. Лівий графік показує, що з малому тиску обсяг фіксованого кількості газу великий.
Об'єм газу зменшується при збільшенні його тиску. Математично це записується так:
Однак зазвичай закон Бойля-Маріотта записують у вигляді
Такий запис дозволяє, наприклад, знаючи вихідний обсяг газу V1 та його тиск р обчислити тиск р2 у новому обсязі V2.
Закон Гей-Люссака (закон Шарля)
У 1787 р. Шарль показав, що з постійному тиску обсяг газу змінюється (пропорційно його температурі. Ця залежність представлена у графічній формі на рис. 3.3, з якого видно, що обсяг газу лінійно пов'язаний з його температурою. У математичній формі ця залежність виражається так :
Закон Шарля найчастіше записують в іншому вигляді:
V1IT1 = V2T1 (2)
Закон Шарля удосконалив Ж. Гей-Люссак, який у 1802 р. встановив, що обсяг газу за зміни його температури на 1°С змінюється на 1/273 частину того обсягу, що він займав при 0°С.
Звідси випливає, що й узяти довільний обсяг будь-якого газу при 0°З постійним тиском зменшити його температуру на 273°С, то кінцевий обсяг виявиться рівним нулю. Це відповідає температурі -273 ° С, або 0 К. Така температура називається абсолютним нулем. Насправді її не можна досягти. На рис.
3.3 показано, як екстраполяція графіків залежності об'єму газу від температури призводить до нульового об'єму при 0К.
Абсолютний нуль, строго кажучи, недосяжний. Однак у лабораторних умовах вдається досягти температур, що відрізняються від абсолютного нуля всього на 0,001 К. За таких температур безладні рухи молекул практично припиняються. Це призводить до появи дивовижних властивостей.
Наприклад, метали, охолоджені до температур, близьких до абсолютного нуля, майже повністю втрачають електричний опір і стають надпровідними. Приклад речовин з іншими незвичайними низькотемпературними властивостями є гелій.
При температурах, близьких до абсолютного нуля, у гелію зникає в'язкість і він стає надплинним.* У 1987 р. виявлено речовини (кераміка, спечена з оксидів лантаноїдних елементів, барію та міді), які стають надпровідними при порівняно високих температурах, близько 100 К (- 173 °С). Ці «високотемпературні» надпровідники відкривають великі перспективи у техніці. - Прим. перев.
Основним обладнанням лабораторіїє робочий стіл, у якому проводиться вся експериментальна робота.
У кожній лабораторії має бути хороша вентиляція. Обов'язковою є витяжна шафа, в якій проводять усі роботи з використанням погано пахнуть або отруйних сполук, а також спалювання в тиглях органічних речовин.
У спеціальній витяжній шафі, в якій не проводять робіт, пов'язаних з нагріванням, зберігають легколеткі, шкідливі або погано пахнуть речовини (рідкий бром, концентровані азотну та соляну кислоти тощо).
), а також легкозаймисті речовини (сірковуглець, ефір, бензол та ін).
У лабораторії необхідні водопровід, каналізація, проводка технічного струму, газу та водонагрівальні прилади. Бажано також мати підведення стисненого повітря, вакуум-лінію, підведення гарячої води та пари.
Якщо пет спеціальної підводки, для отримання гарячої води застосовують водонагрівачі різних систем.
За допомогою цих апаратів, що обігріваються електрикою або газом, можна швидко отримати струмінь гарячої води з температурою майже 100°.
Лабораторія повинна мати установки для дистиляції (або демінералізації) води, тому що без дистильованої чи демінералізованої води в лабораторії працювати не можна. У тих випадках, коли отримання дистильованої води утруднене або неможливе, користуються продажною дистильованою водою
Біля робочих столів та водопровідних раковин обов'язково повинні бути глиняні банки ємністю 10-15 л для зливання непотрібних розчинів, реактивів тощо, а також кошики для битого скла, паперу та іншого сухого сміття.
Окрім робочих столів, у лабораторії мають бути письмовий стіл, де зберігаються всі зошити та записи, і, за потреби, титрувальний стіл. Біля робочих столів мають бути високі табурети чи стільці.
Аналітичні ваги та прилади, що вимагають стаціонарної установки (електрометричні, оптичні та ін.), поміщають в окремому, пов'язаному з лабораторією приміщенні, причому для аналітичних ваг має бути виділена спеціальна вагова кімната. Бажано, щоб вагова була розташована вікнами на північ. Це важливо тому, що на ваги не попадає сонячне світло («Ваги і зважування»).
У лабораторії потрібно мати також найнеобхідніші довідкові книги, посібники та підручники, оскільки нерідко під час роботи виникає потреба в тон чи іншій довідці.
Див. також
Page 3
Хімічний посуд, що застосовується в лабораторіях, може бути розділений на ряд груп. За призначенням посуд можна розділити на посуд загального призначення, спеціального призначення та мірний. За матеріалом - на посуд із простого скла, спеціального скла, із кварцу.
До групи. загального призначення відносяться ті предмети, які завжди повинні бути в лабораторії і без яких не можна провести більшість робіт. Такими є: пробірки, вирви прості та ділильні, склянки, плоскодонні колби, кристалізатори, конічні колби (Ерленмейєра), колби Бунзена, холодильники, реторти, колби для дистильованої води, трійники, крани.
До групи спеціального призначення належать ті предмети, які використовуються для однієї будь-якої мети, наприклад: апарат Кіппа, апарат Сік-зльоту, прилад К'єльдаля, дефлегматори, склянки Вуль-фа, склянки Тищенка, пікнометри, ареометри, склянки Дрекселя, калі-апарати , прилад визначення двоокису вуглецю, круглодонні колби, спеціальні холодильники, прилад визначення молекулярного ваги, прилади визначення температури плавлення і кипіння та інших.
До мірного посуду відносяться: мірні циліндри та мензурки, піпетки, бюретки та мірні колби.Для початку пропонуємо подивитися наступний відеоролик, де коротко та доступно розглянуті основні види хімічного посуду.
Див. також:
Посуд загального призначення
Пробірки (рис. 18) являють собою вузькі циліндричні форми судини із закругленим дном; вони бувають різної величини та діаметра та з різного скла. Звичайні лабораторні пробірки виготовляють з легкоплавкого скла, але для особливих робіт, коли потрібно нагрівання до високих температур, пробірки виготовляють з тугоплавкого скла або кварцу.
Крім звичайних, простих пробірок, застосовують також градуйовані та центрифужні конічні пробірки.
Для зберігання пробірок, що у роботі, служать спеціальні дерев'яні, пластмасові чи металеві штативи (рис. 19).
Мал. 18. Проста та градуйована пробірки
Мал. 20. Внесення у пробірку бирки порошкоподібних речовин.
Пробірки застосовують для проведення переважно аналітичних або мікрохімічних робіт. При проведенні реакцій у пробірці реактиви не слід застосовувати у надто великій кількості. Цілком неприпустимо, щоб пробірка була наповнена до країв.
Реакцію проводять з невеликою кількістю речовин; досить буває 1/4 і навіть 1/8 ємності пробірки. Іноді в пробірку потрібно ввести тверду речовину (порошки, кристали тощо).
), для цього смужку паперу шириною трохи менше діаметра пробірки складають удвічі по довжині і отриманий совочок насипають потрібну кількість твердої речовини. Пробірку тримають у лівій руці, нахиливши її горизонтально, і вводять до неї совок майже до дна (рис. 20).
Потім пробірку ставлять «вертикаль», але й злегка вдаряють по ній. Коли вся тверда речовина висипається, паперовий совочок виймають.
Для перемішування налитих реактивів пробірку тримають великим і вказівним пальцями лівої руки за верхній кінець і підтримують її середнім пальцем, а вказівним пальцем правої руки б'ють косим ударом по низу пробірки. Цього достатньо, щоб її вміст був добре перемішаний.
Цілком неприпустимо закривати пробірку пальцем і струшувати її у такому вигляді; при цьому можна не тільки ввести щось стороннє в рідину, що знаходиться в пробірці, але іноді і пошкодити шкіру пальця, отримати опік та ін.
Якщо пробірка наповнена рідиною більше ніж на половину, вміст перемішують скляною паличкою.
Якщо пробірку потрібно нагріти, її слід затиснути у тримачі.
При невмілому і сильному нагріванні пробірки рідина швидко закипає і виплескується з неї, тому нагрівати потрібно обережно. При нагріванні відкритий кінець пробірки повинен бути звернений у бік від працюючого та сусідів по столу.Якщо не потрібно сильного нагріву, пробірку з рідиною, що нагрівається, краще опустити в гарячу воду. Якщо працюють з маленькими пробірками (для напівмікроаналізу), то нагрівають їх лише у гарячій воді, налитій у скляну склянку відповідного розміру (ємністю не більше 100 мл).
Вирвислужать для переливання - рідин, для фільтрування і т. д. Хімічні вирви випускають різних розмірів, верхній діаметр їх становить 35, 55, 70, 100, 150, 200, 250 і 300 мм.
Звичайні вирви мають рівну внутрішню стінку, але для прискореного фільтрування іноді застосовують вирви з ребристою внутрішньою поверхнею.
Воронки для фільтрування мають кут 60° і зрізаний довгий кінець.
При роботі вирви встановлюють або у спеціальному штативі, або у кільці на звичайному лабораторному штативі (рис. 21).
Для фільтрування в склянку корисно зробити простий тримач для лійки (рис.22). Для цього з листового алюмінію завтовшки близько 2 мм вирізають смужку довжиною 70-80 лш і шириною 20 мм.
На одному з кінців смужки просвердлюють отвір діаметром 12-13 мм та смужку згинають так, як показано на рис. 22, а. Як зміцнити вирву на склянці, показано на рис. 22, б.
При переливанні рідини в сулію або колбу не слід наповнювати вирву до країв.
Якщо вирва щільно прилягає до горла судини, в яку переливають рідину, то переливання утруднюється, тому що всередині судини створюється підвищений тиск. Тому вирву час від часу треба піднімати.
Ще краще зробити між лійкою та горлом судини щілину, вклавши між ними, наприклад, шматочок паперу. При цьому слід стежити, щоб прокладка не потрапила до посудини. Доцільніше застосовувати дротяний трикутник, який можна зробити самому.Цей трикутник поміщають на горло судини і потім вставляють лійку.
Існують спеціальні гумові або пластмасові насадки на шийку посуду, які забезпечують повідомлення внутрішньої частини колби із зовнішньою атмосферою (рис. 23).
Мал. 21. Зміцнення скляної хімічної вирви
Мал. 22. Пристосування для кріплення вирви на склянці, у штативі.
Для аналітичних робіт при фільтруванні краще скористатися аналітичними воронками (рис. 24). Особливість цих воронок полягає в тому, що вони мають зрізаний подовжений кінець, внутрішній діаметр якого у верхній частині менше, ніж у нижній частині; така конструкція прискорює фільтрування.
Крім того, бувають аналітичні вирви з ребристою внутрішньою поверхнею, що підтримує фільтр, і з кулястим розширенням у місці переходу вирви в трубку. Вирви такої конструкції прискорюють процес фільтрування майже втричі в порівнянні зі звичайними воронками.
Мал. 23. Насадки на горла сулій. Мал. 24. Аналітична вирва.
Ділісні вирви(рис. 25) застосовують для поділу рідин, що не змішуються (наприклад, води і масла). Вони мають або циліндричну, або грушоподібну форму і здебільшого забезпечені притертою скляною пробкою.
У верхній частині відвідної трубки знаходиться притертий скляний кран. Місткість ділильних вирв різна (від 50 мл і до декількох літрів), залежно від ємності змінюється і товщина стінок.
Чим менша ємність вирви, тим тонша її стінка, і навпаки.
При роботі ділильні вирви залежно від ємності та форми зміцнюють по-різному. Циліндричну вирву невеликої ємності можна зміцнити просто в лапці. Великі воронки поміщають між двома кільцями.
Нижня частина циліндричної вирви повинна спиратися на кільце, діаметр якого трохи менше діаметра вирви, верхнє кільце має діаметр дещо більший.
Якщо вирва при цьому хитається, між кільцем і вирвою слід покласти платівку з пробки.
Грушоподібну ділильну вирву зміцнюють на кільці, шийку її затискають лапкою. Завжди спочатку закріплюють воронку, а вже потім наливають у неї рідини, що підлягають поділу.Краплі воронки (рис. 26) відрізняються від ділильних тим, що вони легші, тонкостінні і
Мал. 25. Дільні воронки. Мал. 26. Краплі воронки.
У більшості випадків з довгим кінцем. Ці воронки застосовують при багатьох роботах, коли речовину додають в реакційну масу невеликими порціями або краплями. Тому вони зазвичай становлять частину приладу. Вирви зміцнюють у горлі колби на шліфі або за допомогою коркової або гумової пробки.
Перед роботою з ділильною або краплинною лійкою шліф скляного крана потрібно обережно змастити вазеліном або спеціальним мастилом.
Це дає можливість відкривати кран легко і без зусиль, що дуже важливо, тому що якщо кран відкривається туго, то при відкриванні зламати його або пошкодити весь прилад.
Змащення потрібно наносити дуже тонким шаром так, щоб при повертанні крана вона не потрапляла в трубку воронки або всередину отвори крана.
Для більш рівномірного стікання крапель рідини з краплинної лійки та для спостереження за швидкістю подачі рідини застосовують краплинні лійки з насадкою (рис. 27). У таких вирв відразу після крана знаходиться розширена частина, що переходить у трубку. Рідина через кран надходить у це розширення по короткій трубці і потім трубку воронки.
Мал. 27. Капельна вирва з насадкою
Мал. 28. Хімічні склянки.
Мал. 29. Плоскопельна вирва з насадкою
Скляний посуд 1 2 3
Див. також
Урок 25. Закон Бойля-Маріотта - HIMI4KA

Архів уроків › Основні закони хімії
В уроці 25 « Закон Бойля-Маріотта» з курсу « Хімія для чайників» Розглянемо закон, що зв'язує тиск та обсяг газу, а також графіки залежності тиску від обсягу та обсягу від тиску. Нагадаю, що в минулому уроці «Тиск газу» ми розглянули пристрій та принцип дії ртутного барометра, а також дали визначення тиску та розглянули його одиниці виміру.
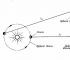
Роберт Бойль(1627-1691), якому завдячуємо першим практично правильним визначенням хімічного елемента (дізнаємося в гол. 6), цікавився також явищами, які у судинах з розрідженим повітрям.
Винаходячи вакуумні насоси для викачування повітря із закритих судин, він звернув увагу на властивість, знайому кожному, кому траплялося накачувати камеру футбольного м'яча або обережно стискати повітряну кульку: чим сильніше стискають повітря в закритій посудині, тим сильніше вона чинить опір стиску.
Бойль називав цю властивість « пружинистістюповітря і вимірював його за допомогою простого пристрою, показаного на рис. 3.2, а і б.
Бойль замикав ртуттю трохи повітря в закритому кінці зігнутої трубки (мал. 3-2, а), а потім стискав це повітря, потроху додаючи ртуть у відкритий кінець трубки (рис. 3-2, б).
Тиск, що зазнає повітря в закритій частині трубки, дорівнює сумі атмосферного тиску і тиску стовпчика ртуті заввишки h (h - висота, на яку рівень ртуті у відкритому кінці трубки перевищує рівень ртуті в закритому кінці). Отримані Бойлем дані вимірювання тиску та обсягу наведено у табл. 3-1.
Хоча Бойль не вживав спеціальних заходів для підтримки постійної температури газу, мабуть, у його дослідах вона змінювалася лише незначною мірою. Проте Бойль зауважив, що тепло від полум'я свічки викликало значні зміни властивостей повітря.
Аналіз даних про тиск та обсяг повітря при його стисканні
Таблиця 3-1, яка містить експериментальні дані Бойля про взаємозв'язок тиску та об'єму для атмосферного повітря, розташована під спойлером.
Після того як дослідник отримує дані, подібні до наведених у табл. 3-1, він намагається знайти математичне рівняння, що пов'язує між собою дві залежні один від одного величини, які він вимірював.
Один із способів отримання такого рівняння полягає в графічній побудові залежності різних ступенів однієї величини від іншої в надії отримати прямолінійний графік.
Загальне рівняння прямої лінії має вигляд:
де х і у - пов'язані між собою змінні, а і b - постійні числа. Якщо b дорівнює нулю, то пряма лінія проходить через початок координат.
На рис. 3-3 показані різні способи графічного представлення даних для тиску Р та обсягу V, наведених у табл. 3-1.Графіки залежності Р від 1/К і залежності V від 1/Р є прямі лінії, що проходять через початок координат.
Графік залежності логарифму Р від логарифму V також є прямою лінією з негативним нахилом, тангенс кута якого дорівнює - 1. Всі ці три графіки призводять до еквівалентних рівнянь:
- P = a/V (3-3а)
- V = a/P (3-3б)
- lg V = lg а - lg Р (3-3в)
Кожне з цих рівнянь є одним з варіантів закону Бойля-Маріотта, Який зазвичай формулюється так: для заданого числа молей газу його тиск пропорційно обсягу, за умови, що температура газу залишається постійною.
До речі, напевно, вам стало цікаво, чому закон Бойля-Маріотта названий подвійним ім'ям. Це сталося так, тому що цей закон незалежно від Роберта Бойля, який відкрив його у 1662 році, був перевідкритий Едмом Маріоттом у 1676 році. Ось так.
Коли взаємозв'язок між двома вимірюваними величинами простий настільки, як у цьому випадку, його можна встановити і чисельним способом.
Якщо кожне значення тиску Р помножити на відповідне значення обсягу V, неважко переконатися, що всі твори заданого зразка газу при постійній температурі виявляються приблизно однаковими (див. табл. 3-1). Таким чином, можна записати, що
Рівняння (З-Зг) описує гіперболічну залежність між величинами Р та V (див. рис. 3-3,а). Для перевірки того, що побудований за експериментальними даними графік залежності Р від V дійсно відповідає гіперболі, побудуємо ще додатковий графік залежності твору PV від Р і переконаємося, що він являє собою горизонтальну пряму лінію (див. рис. 3-3,д) .
Бойль встановив, що для заданої кількості будь-якого газу при постійній температурі взаємозв'язок між тиском Р та обсягом V цілком задовільно описується співвідношенням
- P · V = const (при постійних Т і n) (3-4)
Формула із закону Бойля-Маріотта
Для зіставлення обсягів і тисків одного і того ж зразка газу за різних умов (але постійної температури) зручно уявити закон Бойля-Маріоттау наступній формулі:
де індекси 1 та 2 відповідають двом різним умовам.
Приклад 4. Пластмасові мішечки з харчовими продуктами, що доставляють на плато Колорадо (див. приклад 3) часто лопаються, тому що повітря, що знаходиться в них, при підйомі від рівня моря на висоту 2500 м, в умовах зниженого атмосферного тиску, розширюється.
Якщо припустити, що всередині мішечка при атмосферному тиску, що відповідає рівню моря, укладено 100 см3 повітря, який обсяг повинен займати це повітря за тієї ж температури на плато Колорадо? (Припустимо, що для доставки продуктів використовуються зморщені мішечки, що не обмежують розширення повітря; дані, що відсутні, слід взяти з прикладу 3.)Рішення
Скористаємося законом Бойля у формі рівняння (3-5), де індекс 1 відноситимемо до умов на рівні моря, а індекс 2 - до умов на висоті 2500 м над рівнем моря. Тоді Р1 = 1000 атм, V1 = 100 см3, Р2 = 0,750 атм, а V2 слід обчислити. Отже,
Вивчення залежності між параметрами, що характеризують стан даної маси газу, почнемо з вивчення газових процесів, що протікають за незмінності одного з параметрів. Англійський вчений Бойль(1669 р.) і французький вчений Маріотт(1676 р.) відкрили закон, який виражає залежність зміни тиску від зміни обсягу газу при постійній температурі. Проведемо наступний досвід.
Повертанням рукоятки змінюватимемо обсяг газу (повітря) у циліндрі А (рис. 11, а). За показанням манометра зауважимо, що і тиск газу при цьому змінюється. Змінюватимемо обсяг газу в посудині (обсяг визначається за шкалою В) і, помічаючи тиск, запишемо їх в табл. 1. З неї видно, що добуток обсягу газу на його тиск був майже постійним: у скільки разів “зменшувався обсяг газу, у стільки ж разів збільшувався його тиск.

В результаті подібних, більш точних дослідів було відкрито: для даної маси газу при постійній температурі тиск газу змінюється обернено пропорційно до зміни обсягу газу. Це і є формулювання закону Бойля-Маріотта. Математично він для двох станів запишеться так:
![]()
Процес зміни стану газу за постійної температури називається ізотермічним.Формула закону Бойля-Маріотта є рівнянням ізотермічного стану газу. За постійної температури середня швидкість руху молекул не змінюється. Зміна обсягу газу викликає зміну числа ударів молекул об стінки судини. Це і є причиною зміни тиску газу.
Зобразимо графічно цей процес, наприклад для випадку V = 12 л, р = 1 ат.. Відкладатимемо на осі абсцис об'єм газу, а на осі ординат - його тиск (рис. 11, б). Знайдемо точки, що відповідають кожній парі значень V і р, і, поєднавши їх між собою, отримаємо графік ізотермічного процесу. Лінія, що зображує залежність між об'ємом і тиском газу. При постійній температурі називається ізотермою. Ізотермічні процеси у чистому вигляді не зустрічаються. Але нерідкі випадки, коли температура газу мало змінюється, наприклад, при накачуванні компресором повітря в балони, при впуску горючої суміші в циліндр двигуна внутрішнього згоряння. У таких випадках розрахунки обсягу та тиску газу проводяться за законом Бойля-Маріотта*.