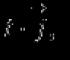Qayerda boilie mariotte qonuni amal qiladi. Gaz qonunlari
Boyl-Mariott qonuni quyidagicha:
Matematik shaklda bu bayonot formula shaklida yoziladi
qayerda - gaz bosimi; - gaz hajmi, va - kelishilgan shartlarda doimiy qiymat. Umuman olganda, qiymat gazning kimyoviy tabiati, massasi va harorati bilan belgilanadi.
Shubhasiz, agar indeks 1 gazning dastlabki holatiga bog'liq miqdorlarni va pastki belgisini bildiring 2 - finalgacha, keyin berilgan formulani shaklda yozish mumkin
.
Yuqoridagi va yuqoridagi formulalardan izotermik jarayonda gaz bosimining uning hajmiga bog'liqlik shakli quyidagicha:
Bu bog'liqlik Boyl - Mariotte qonuni mazmunining boshqa, birinchisiga teng ifodasidir. Bu shuni anglatadiki
Doimiy haroratda gaz massasining bosimi uning hajmiga teskari proportsionaldir.
U holda izotermik jarayonda ishtirok etuvchi gazning boshlang'ich va oxirgi holatlari o'rtasidagi munosabatni quyidagicha ifodalash mumkin:
Shuni ta'kidlash kerakki, gazning boshlang'ich va oxirgi bosimlari va hajmlarini bir-biri bilan bog'laydigan ushbu va yuqoridagi formulaning qo'llanilishi izotermik jarayonlar bilan cheklanmaydi. Jarayon davomida harorat o'zgargan hollarda formulalar o'z kuchini saqlab qoladi, ammo jarayon natijasida oxirgi harorat dastlabki haroratga teng bo'ladi.
Ushbu qonunni faqat ko'rib chiqilayotgan gazni ideal deb hisoblash mumkin bo'lgan hollardagina amal qilishini aniqlashtirish muhimdir. Xususan, Boyl - Mariott qonuni kam uchraydigan gazlarga nisbatan yuqori aniqlik bilan bajariladi. Agar gaz kuchli siqilgan bo'lsa, unda bu qonundan sezilarli og'ishlar kuzatiladi.
Oqibatlari
Boyl qonuni - Mariotte izotermik jarayonda gazning bosimi gaz egallagan hajmga teskari proportsional ekanligini ta'kidlaydi. Agar gazning zichligi uning egallagan hajmiga ham teskari proportsional ekanligini hisobga olsak, shunday xulosaga kelamiz:
Izotermik jarayonda gaz bosimi uning zichligiga to'g'ridan-to'g'ri mutanosib ravishda o'zgaradi.
Shunday qilib, biz shunday xulosaga kelamiz:
Ideal gazning izotermik siqilish koeffitsienti uning bosimining o'zaro nisbatiga teng.
Shuningdek qarang
Boyl qonuni - Mariotte haqida sharh yozing
Eslatmalar (tahrirlash)
- Petrushevskiy F.F.// Brokxaus va Efronning entsiklopedik lug'ati
- // Jismoniy ensiklopediya / Ch. ed. A. M. Proxorov. - M .: Sovet Entsiklopediyasi, 1988 .-- T. 1. - S. 221-222. - 704 b. - 100 000 nusxa
- Sivuxin D.V. Umumiy fizika kursi. - Moskva: Fizmatlit, 2005 .-- T. II. Termodinamika va molekulyar fizika. - S. 21-22. - 544 b. - ISBN 5-9221-0601-5.
- Boshlang'ich fizika darsligi / Ed. G. S. Landsberg. - M .: Fan, 1985. - T. I. Mexanika. Issiqlik. Molekulyar fizika. - S. 430 .-- 608 b.
- Kikoin A.K., Kikoin I.K. Molekulyar fizika. - M .: Nauka, 1976 .-- S. 35-36.
- Doimiy massada.
- Livshits L. D.// Jismoniy ensiklopediya / Ch. ed. A. M. Proxorov. - M .: Buyuk rus entsiklopediyasi, 1994 .-- T. 4. - S. 492-493. - 704 b. - 40 000 nusxa - ISBN 5-85270-087-8.
Adabiyot
- Petrushevskiy F.F.// Brokxauz va Efronning entsiklopedik lug'ati: 86 jildda (82 jild va 4 ta qo'shimcha). - SPb. , 1890-1907.
Boyl qonunidan parcha - Mariotte
"U o'sha", deb javoban qo'pol ayol ovozi eshitildi va shundan keyin xonaga Mariya Dmitrievna kirdi.Barcha yosh xonimlar va hatto xonimlar, eng keksasidan tashqari, o'rnidan turishdi. Marya Dmitrievna eshik oldida to'xtadi va o'zining baquvvat tanasining balandligidan ellik yoshli kulrang jingalak boshini baland ko'tarib, mehmonlarga qaradi va go'yo o'ralib ketayotgandek, shoshilmasdan ko'ylagining keng yenglarini tuzatdi. Mariya Dmitrievna har doim ruscha gapirardi.
"Aziz bolalar bilan tug'ilgan kun qizi", dedi u o'zining baland va qalin ovozida boshqa barcha tovushlarni bosib o'tib. - Sen nimasan, qari gunohkor, - qo'lini o'pgan grafga o'girildi u, - choy, Moskvani sog'inganmisan? Itlarni haydash uchun joy yo'qmi? Lekin, ota, nima qilish kerak, bu qushlar shunday o'sadi ... - U qizlarga ishora qildi. - Xohlasangiz ham, xohlamasangiz ham, sovchilar qidirishingiz kerak.
- Xo'sh, nima, mening kazakam? (Marya Dmitrievna Natashani kazak deb atadi) - dedi u qo'li bilan qo'li bilan erkalab, qo'rqmasdan va quvnoq qo'liga yaqinlashdi. - Men iksir qiz ekanligini bilaman, lekin men uni yaxshi ko'raman.
U ulkan retikuladan nok bilan yaxta sirg'alarini chiqarib, tug'ilgan kunida porlab, qizarib ketgan Natashaga berib, darhol undan yuz o'girib, Perga o'girildi.
- E, e! mehribon! Bu erga kel, - dedi u o'zini past va ozg'in ovoz bilan. - Qani, azizim...
Va u qo'rqinchli tarzda yenglarini shimaladi.
Per yaqinlashdi va ko'zoynagi orqali unga sodda tikildi.
- Kel, kel, azizim! Otangga yolg‘iz o‘zi ishda bo‘lganida haqiqatni aytdim, keyin Xudo senga buyuradi.
U pauza qildi. Hamma jim qoldi, nima bo'lishini kutdi va faqat so'zboshi borligini his qildi.
- Yaxshi, aytadigan gap yo'q! yaxshi bola!... Ota karavotda yotibdi va u o'zini quvnoq qilib, chorak ustasini ayiq ustiga qo'ydi. Uyal, ota, uyal! Urushga ketsa yaxshi bo'lardi.
U ortiga o‘girilib, kulishdan o‘zini tiya olgan grafga qo‘lini uzatdi.
- Xo'sh, stolga, choy ichaman, vaqt keldimi? - dedi Mariya Dmitrievna.
Hisob Mariya Dmitrievnadan oldinga chiqdi; keyin Nikolay polkni quvib yetishi kerak bo'lgan to'g'ri odam bo'lgan hussar polkovnigi boshchiligidagi grafinya. Anna Mixaylovna - Shinshin bilan. Berg qo'lini Veraga berdi. Tabassum qilgan Juli Karagina Nikolay bilan stolga bordi. Ularning ortidan zal bo'ylab cho'zilgan boshqa juftliklar va ularning orqasida birin-ketin bolalar, repetitorlar va gubernatorlar kelishdi. Ofitsiantlar qo‘zg‘aldi, stullar shaqirdi, xorda musiqa yangradi, mehmonlar joylashishdi. Grafning uy musiqasi sadolari pichoq va vilkalar sadolari, mehmonlarning suhbati, ofitsiantlarning sokin qadamlari bilan almashtirildi.
Grafinya stolning bir chetida o‘tirdi. O'ng tomonda Mariya Dmitrievna, chap tomonda Anna Mixaylovna va boshqa mehmonlar. Boshqa tomonda graf, chap tomonda hussar polkovnik, o'ng tomonda Shinshin va boshqa erkak mehmonlar o'tirdi. Uzun stolning bir tomonida yoshi kattaroq yoshlar bor: Bergning yonida Vera, Borisning yonida Per; boshqa tomondan, bolalar, repetitorlar va hokimlar. Kristallar, shishalar va mevali kosalar ortidan graf xotiniga va uning ko‘k lentali baland qalpoqchasiga qaradi va o‘zini ham unutmagan holda qo‘shnilariga astoydil vino quydi. Grafinya ham ananas tufayli, styuardessaning vazifalarini unutmasdan, eriga jiddiy nigoh tashladi, uning boshi va yuzi, qizarishdagi kulrang sochlardan keskinroq farq qilganday tuyuldi. Ayollar uchida bir xil gap bor edi; erkaklarnikida esa, ayniqsa, shunchalik ko'p yeb-ichadigan, borgan sari qizarib ketgan hussar polkovnikining ovozlari tobora balandroq eshitilardi, graf uni boshqa mehmonlarga o'rnak qilib ko'rsata boshlagan edi. Berg Vera bilan muloyim tabassum bilan gapirdi, sevgi bu erdagi tuyg'u emas, balki samoviy tuyg'u. Boris o'zining yangi do'sti Perni mehmonlarni stolga chaqirdi va uning qarshisida o'tirgan Natasha bilan ko'z qirini tashladi. Per kam gapirdi, yangi yuzlarga qaradi va ko'p ovqatlandi. U ikkita sho'rvadan boshlab, la tortue, [toshbaqa] va kulebyaki, fındık uchun tanlab oldi, u birorta taomni yoki bitta sharobni o'tkazib yubormadi, oshpaz qo'shnisining yelkasidan sirli ravishda shishaga o'ralgan holda chiqarib tashladi. salfetkada yoki “Madeira, yoki venger yoki Reyn. U har bir qurilma oldida turgan to‘rtta billur qadahning birinchisini graf monogrammasi bilan almashtirdi va zavq bilan ichib, mehmonlarga yanada yoqimli tikildi. Uning qarshisida o'tirgan Natasha, o'n uch yoshli qizlar birinchi marta o'pishgan va sevib qolgan bolaga qaragandek Borisga qaradi. Uning aynan shu nigohi ba'zan Perga qaradi va bu kulgili, jonli qizning nigohi ostida u nima uchunligini bilmay, o'zini kulgisi kelardi.
Nikolay Sonyadan uzoqda, Juli Karaginaning yonida o'tirar va yana o'sha beixtiyor tabassum bilan u bilan gaplashardi. Sonya tantanali jilmayib qo'ydi, lekin, shekilli, rashkdan azob chekdi: rangi oqarib ketdi, keyin qizarib ketdi va Nikolay va Julining o'zaro gaplashayotganlarini bor kuchi bilan tingladi. Gubernator, agar kimdir bolalarni xafa qilishni o'ylagan bo'lsa, javob berishga tayyorlanayotgandek bezovtalanib atrofga qaradi. Nemis gubernatori Germaniyadagi oilasiga yo‘llagan maktubida hamma narsani batafsil bayon qilish uchun har xil taomlar, shirinliklar va vinolarni yod olishga urinib ko‘rdi va butlerning shishani ro‘molchaga o‘rab olib yurganidan qattiq ranjidi. Nemis qovog‘ini chimirib, o‘zini bu vinoni olishni istamagandek ko‘rsatishga urinib ko‘rdi, lekin hech kim sharob chanqog‘ini qondirish uchun emas, ochko‘zlikdan emas, vijdonan qiziquvchanlik tufayli kerakligini tushunishni istamaganidan xafa bo‘ldi.
Stolning erkaklar oxirida suhbat tobora qizg'inlashib bordi. Polkovnikning aytishicha, urush e'lon qilingani haqidagi manifest allaqachon Sankt-Peterburgda nashr etilgan va o'zi ko'rgan nusxasi endi bosh qo'mondonga kurer orqali yetkazilgan.
22. Boyl-Mariot qonuni
Ideal gaz qonunlaridan biri Boyl-Mariott qonuni, unda: bosim mahsuloti P hajmi bo'yicha V gaz doimiy gaz massasi va harorat doimiysi. Bu tenglik deyiladi izoterm tenglamalari... Izoterm gaz holatining PV-diagrammasida giperbola shaklida tasvirlangan va gaz haroratiga qarab u yoki bu pozitsiyani egallaydi. Jarayon sodir bo'ladi T= const deyiladi izotermik. Gaz T= const doimiy ichki energiyaga ega U. Agar gaz izotermik ravishda kengaysa, u holda barcha issiqlik ishlaydi. Gazning izotermik kengaygan ishi uni bajarish uchun gazga berilishi kerak bo'lgan issiqlik miqdoriga teng:
dA= dQ= PdV,
qaerda d A- boshlang'ich ish;
dV- elementar hajm;
P- bosim. Agar V 1> V 2 va P 1 bo'lsa< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие T= const bajarildi, bosim va hajmdagi o'zgarishlarni cheksiz sekin deb hisoblash kerak. Gaz joylashgan muhit uchun ham talab mavjud: u etarlicha yuqori issiqlik quvvatiga ega bo'lishi kerak. Hisoblash formulalari tizimga issiqlik energiyasini etkazib berishda ham mos keladi. Siqilish qobiliyati gaz bosim o'zgarganda uning hajmini o'zgartirish xususiyati deb ataladi. Har bir modda bor siqilish omili, va u quyidagilarga teng:
c = 1 / V O (dV / CP) T,
bu yerda hosila da qabul qilinadi T= const.
Siqilish omili bosimning o'zgarishi bilan hajmning o'zgarishini tavsiflash uchun kiritilgan. Ideal gaz uchun u quyidagilarga teng:
c = -1 / P.
SIda siqilish omili quyidagi o'lchamga ega: [c] = m 2 / N.
Ushbu matn kirish qismidir."Ijodkorlik aniq fan sifatida" kitobidan [Ixtirochilik muammolarini hal qilish nazariyasi] muallif Altshuller Genrix Saulovich1. Tizim qismlarining to'liqligi qonuni Texnik tizimning fundamental hayotiyligining zaruriy sharti tizimning asosiy qismlarining mavjudligi va minimal ishlashi hisoblanadi. Har bir texnik tizim to'rtta asosiy qismni o'z ichiga olishi kerak: dvigatel,
"Interfeys: Kompyuter tizimlarini loyihalashda yangi yo'nalishlar" kitobidan muallif Ruskin Jeff2. Tizimning "energiya o'tkazuvchanligi" qonuni Texnik tizimning fundamental hayotiyligining zaruriy sharti energiyaning tizimning barcha qismlaridan o'tishidir. Har qanday texnik tizim energiya konvertori hisoblanadi. Shuning uchun aniq
Instrumentation kitobidan muallif Babayev M.A6. Supertizimga o'tish qonuni Rivojlanish imkoniyatlari tugagach, tizim o'zining qismlaridan biri sifatida supertizimga kiradi; bu holda keyingi rivojlanish supertizim darajasida sodir bo'ladi. Biz allaqachon ushbu qonun haqida gapirgan edik. Keling, "dinamika" ga o'tamiz. U aks ettiruvchi qonunlarni o'z ichiga oladi
Issiqlik muhandisi kitobidan muallif Burxanova Natalya7.Makrodarajadan mikrodarajaga o'tish qonuni Tizimning ish organlarining rivojlanishi avval makro-, keyin esa mikro darajaga o'tadi. Ko'pgina zamonaviy texnik tizimlarda ishchi organlar "temir bo'laklari" dir, masalan, samolyot pervanellari, avtomobil g'ildiraklari, kesgichlar.
Hamma uchun hisoblash tilshunosligi kitobidan: Miflar. Algoritmlar. Til muallif Anisimov Anatoliy Vasilevich8. Su-maydon darajasini oshirish qonuni Texnik tizimlarning rivojlanishi su-maydon darajasini oshirish yo'nalishida boradi. Ushbu qonunning ma'nosi shundan iboratki, maydon bo'lmagan tizimlar su-maydonga aylanadi va su-maydon tizimlarida rivojlanish yo'nalishda boradi.
"Fan fenomeni" kitobidan [Evolyutsiyaga kibernetik yondashuv] muallif Turchin Valentin Fedorovich Nanotexnologiya kitobidan [Fan, innovatsiya va imkoniyatlar] Foster Lynn tomonidan4.4.1. Fitts qonuni Tasavvur qiling-a, siz kursorni ekrandagi tugmachaga olib borasiz. Tugma bu harakatning maqsadi hisoblanadi. Kursorning boshlang'ich pozitsiyasi va nishonning eng yaqin nuqtasini bog'laydigan to'g'ri chiziq uzunligi Fitts qonunida masofa sifatida belgilanadi. Yoniq
“Ajoyib kashfiyotlar va ixtirolar tarixi” kitobidan (elektrotexnika, elektroenergetika, radioelektronika) muallif Shnayberg Yan Abramovich4.4.2. Xik qonuni Kursorni nishonga o'tkazish yoki ko'p variantlar to'plamidan boshqa harakatni bajarishdan oldin foydalanuvchi ushbu ob'ekt yoki harakatni tanlashi kerak. Hik qonunida aytilishicha, n variantdan tanlash kerak bo'lganda, tanlash vaqti
Muallifning kitobidan9. Puasson va Gauss taqsimot qonuni Puasson qonuni. Uning boshqa nomi - nodir hodisalarning ra-ta'rifi qonuni. Puasson qonuni (Z.P) bu mumkin bo'lmagan hollarda qo'llaniladi va shuning uchun B / Z / R dan foydalanish amaliy emas. Qonunning afzalliklari quyidagilardan iborat: qulaylik.
Muallifning kitobidan23. Gey-Lyussak qonuni Gey-Lyussak qonuni shunday deydi: gazning doimiy bosimi va massasidagi gaz hajmining haroratiga nisbati doimiy.V / T = m / MO R / P = P = const da const, m = const. Bu tenglik izobar tenglamasining nomi.Izobar to'g'ri chiziqning PV-diagrammasida tasvirlangan,
Muallifning kitobidan24. Charlz qonuni Charlz qonunida aytilishicha, gazning hajmi va massasi o'zgarmagan bo'lsa, gaz bosimining uning haroratiga nisbati doimiy bo'ladi: P / T = m / MO R / V = const at V = const, m = const.Bu tenglik izoxor tenglamasi deyiladi.Isochora PV-diagrammada P o'qiga parallel to'g'ri chiziq bilan tasvirlangan va
Muallifning kitobidan30. Energiyaning saqlanish va oʻzgarish qonuni Termodinamikaning birinchi qonuni energiyaning saqlanish va oʻzgarishining universal qonuniga asoslanadi, bu qonun energiya hosil boʻlmaydi va yoʻqolmaydi.Termodinamik jarayonda ishtirok etuvchi jismlar bir-biri bilan oʻzaro taʼsir qiladi.
Muallifning kitobidanTSAREVNA-QURBAKA VA BARQARORLIK QONUNI Yuqorida ta'kidlanganidek (abstraksiya qonuni) ibtidoiy tafakkur konkret hodisalarni mohirona tahlil qiladi va yangi mavhum tizimlarni sintez qiladi. Chunki ong tomonidan qurilgan har qanday ob'ekt tirik va tirik sifatida qabul qilingan
Muallifning kitobidan1.1. Evolyutsiyaning asosiy qonuni Hayot evolyutsiyasi jarayonida, bizga ma'lum bo'lishicha, doimo tirik materiyaning umumiy massasining ko'payishi va uning tashkil etilishining murakkablashishi sodir bo'lgan. Biologik shakllanishlarni tashkil qilishni murakkablashtirib, tabiat namunalar usuli bilan harakat qiladi va
Muallifning kitobidan4.2. Mur qonuni eng oddiy ko'rinishida, Mur qonuni tranzistorli davrlarning simi zichligi har 18 oyda ikki baravar oshishini bildiradi. Qonun muallifligi taniqli Intel kompaniyasi asoschilaridan biri Gordon Murga tegishli. Qattiq aytganda, in
TA’RIF
Gaz holatining parametrlaridan biri o'zgarmas bo'lib qoladigan jarayonlar deyiladi izoprotsesslar.
TA’RIF
Gaz qonunlari ideal gazdagi izoprotsesslarni tavsiflovchi qonunlardir.
Gaz qonunlari eksperimental ravishda ochilgan, ammo ularning barchasini Mendeleyev-Klapeyron tenglamasidan olish mumkin.
Keling, ularning har birini ko'rib chiqaylik.
Boyl-Mariott qonuni (izotermik jarayon)
Izotermik jarayon gaz holatining o'zgarishi deyiladi, bunda uning harorati doimiy bo'lib qoladi.
Doimiy haroratda gazning doimiy massasi uchun gaz bosimi va hajmining mahsuloti doimiy qiymatdir:
Xuddi shu qonun boshqa shaklda qayta yozilishi mumkin (ideal gazning ikkita holati uchun):
Bu qonun Mendeleyev-Klapeyron tenglamasidan kelib chiqadi:
![]()
Shubhasiz, doimiy gaz massasida va doimiy haroratda tenglamaning o'ng tomoni doimiy bo'lib qoladi.
O'zgarmas haroratda gaz parametrlarining bog'liqligi grafiklari deyiladi izotermlar.
Konstantani harf bilan belgilab, izotermik jarayonda bosimning hajmga funktsional bog'liqligini yozamiz:
Ko'rinib turibdiki, gaz bosimi uning hajmiga teskari proportsionaldir. Teskari proportsionallik grafigi va shuning uchun izotermaning koordinatadagi grafigi giperboladir(1-rasm, a). 1 b) va c) rasmlarda mos ravishda koordinatalar va izotermlar ko'rsatilgan.

1-rasm. Turli koordinatalarda izotermik jarayonlarning grafiklari
Gey-Lyussak qonuni (izobarik jarayon)
Izobarik jarayon gaz holatining o'zgarishi deyiladi, bunda uning bosimi doimiy bo'lib qoladi.
Doimiy bosimdagi gazning doimiy massasi uchun gaz hajmining haroratga nisbati doimiy qiymatdir:
Bu qonun Mendeleyev-Klapeyron tenglamasidan ham kelib chiqadi:
![]()
izobarlar.
Bosimlari va sarlavhasi = "(! LANG: QuickLaTeX.com tomonidan taqdim etilgan) ikkita izobarik jarayonni ko'rib chiqing." height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Grafik shaklini koordinatalarda aniqlaymiz.Konstantani harf bilan belgilab, izobar jarayonda hajmning haroratga funksional bog`liqligini yozamiz:
Ko'rinib turibdiki, doimiy bosimda gazning hajmi uning haroratiga to'g'ridan-to'g'ri proportsionaldir. To'g'ridan-to'g'ri proportsionallik grafigi va shuning uchun koordinatalardagi izobar grafigi koordinatalarning koordinatalaridan o'tuvchi to'g'ri chiziqdir(2-rasm, c). Haqiqatda, etarlicha past haroratlarda barcha gazlar suyuqlikka aylanadi, ular uchun gaz qonunlari endi qo'llanilmaydi. Shuning uchun, koordinatalarning kelib chiqishi yaqinida 2-rasm, c)dagi izobarlar nuqta chiziq bilan ko'rsatilgan.

2-rasm. Turli koordinatalardagi izobar jarayonlarning grafiklari
Charlz qonuni (izoxorik jarayon)
Izoxorik jarayon gaz hajmining o'zgarmasligicha qolgan holatining o'zgarishi deyiladi.
Doimiy hajmdagi gazning doimiy massasi uchun gaz bosimining uning haroratiga nisbati doimiy qiymatdir:
Gazning ikkita holati uchun ushbu qonun quyidagi shaklda yoziladi:
Bu qonunni Mendeleyev - Klapeyron tenglamasidan ham olish mumkin:
![]()
O'zgarmas bosimdagi gaz parametrlarining bog'liqligi grafiklari deyiladi izoxoralar.
Jilmlari va sarlavhasi = "(! LANG: QuickLaTeX.com tomonidan taqdim etilgan) ikkita izoxorik jarayonni ko'rib chiqing." height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
Koordinatalarda izoxorik jarayon grafigining turini aniqlash uchun Charlz qonunida doimiyni harf bilan belgilaymiz, biz quyidagilarni olamiz:
Shunday qilib, doimiy hajmdagi haroratga bosimning funktsional bog'liqligi to'g'ridan-to'g'ri proportsionallik bo'lib, bunday bog'liqlikning grafigi koordinata boshidan o'tadigan to'g'ri chiziqdir (3-rasm, s).

3-rasm. Turli koordinatalardagi izoxorik jarayonlarning grafiklari
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Dastlabki haroratga ega bo'lgan ma'lum bir gaz massasi qanday haroratgacha izobar tarzda sovutilishi kerak, shunda gaz hajmi to'rtdan bir qismga kamayadi? |
| Yechim | Izobar jarayon Gey-Lyusak qonuni bilan tavsiflanadi: Muammoning shartiga ko'ra, izobarik sovutish natijasida gaz hajmi to'rtdan birga kamayadi, shuning uchun: Yakuniy gaz harorati qaerdan: Keling, birliklarni SI tizimiga aylantiramiz: boshlang'ich gaz harorati. Keling, hisoblab chiqamiz:
|
| Javob | Gazni haroratgacha sovutish kerak. |
2-MISA
| Mashq qilish | Yopiq idishda 200 kPa bosimdagi gaz mavjud. Agar harorat 30% ga oshirilsa, gaz bosimi qanday bo'ladi? |
| Yechim | Gazli idish yopiq bo'lgani uchun gaz hajmi o'zgarmaydi. Izoxorik jarayon Charlz qonuni bilan tavsiflanadi: Muammoning shartiga ko'ra, gaz harorati 30% ga oshdi, shuning uchun siz yozishingiz mumkin: Charlz qonunidagi oxirgi nisbatni almashtirsak, biz quyidagilarni olamiz: Keling, birliklarni SI tizimiga aylantiramiz: gazning dastlabki bosimi kPa = Pa. Keling, hisoblab chiqamiz: |
| Javob | Gaz bosimi 260 kPa ga etadi. |
MISOL 3
| Mashq qilish | Samolyot bilan jihozlangan kislorod tizimi mavjud |
| Yechim | Izotermik jarayon Boyl-Mariot qonuni bilan tavsiflanadi: |
Boyl qonuni - Mariotte
Boyl qonuni - Mariott 1662 yilda Robert Boyl tomonidan kashf etilgan va 1676 yilda Edm Mariotte tomonidan mustaqil ravishda qayta kashf etilgan asosiy gaz qonunlaridan biridir. Gazning izotermik jarayondagi harakatini tavsiflaydi. Qonun Klapeyron tenglamasining natijasidir.
- 1 Formulyatsiyalar
- 2 Oqibatlari
- 3 Shuningdek qarang
- 4 Eslatma
- 5 Adabiyot
So'z birikmasi
Boyl-Mariott qonuni quyidagicha:
Doimiy harorat va gaz massasida gaz bosimi va uning hajmining mahsuloti doimiydir.
Matematik shaklda bu bayonot formula shaklida yoziladi
gaz bosimi qayerda; gaz hajmi bo'lib, kelishilgan sharoitlarda doimiy qiymatdir. Umuman olganda, qiymat gazning kimyoviy tabiati, massasi va harorati bilan belgilanadi.
Shubhasiz, agar 1 pastki belgisi gazning dastlabki holatiga, 2 pastki belgisi esa yakuniy holatga bog'liq miqdorlarni bildirsa, yuqoridagi formulani ko'rinishda yozish mumkin.
.
Yuqoridagi va yuqoridagi formulalardan izotermik jarayonda gaz bosimining uning hajmiga bog'liqlik shakli quyidagicha:
Bu bog'liqlik Boyl - Mariotte qonuni mazmunining boshqa, birinchisiga teng ifodasidir. Bu shuni anglatadiki
Doimiy haroratda gaz massasining bosimi uning hajmiga teskari proportsionaldir.
U holda izotermik jarayonda ishtirok etuvchi gazning boshlang'ich va oxirgi holatlari o'rtasidagi munosabatni quyidagicha ifodalash mumkin:
Shuni ta'kidlash kerakki, gazning boshlang'ich va oxirgi bosimlari va hajmlarini bir-biri bilan bog'laydigan ushbu va yuqoridagi formulaning qo'llanilishi izotermik jarayonlar bilan cheklanmaydi. Jarayon davomida harorat o'zgargan hollarda formulalar o'z kuchini saqlab qoladi, ammo jarayon natijasida oxirgi harorat dastlabki haroratga teng bo'ladi.
Ushbu qonunni faqat ko'rib chiqilayotgan gazni ideal deb hisoblash mumkin bo'lgan hollardagina amal qilishini aniqlashtirish muhimdir. Xususan, Boyl - Mariott qonuni kam uchraydigan gazlarga nisbatan yuqori aniqlik bilan bajariladi. Agar gaz kuchli siqilgan bo'lsa, unda bu qonundan sezilarli og'ishlar kuzatiladi.
Boyl qonuni - Mariotte, Charlz qonuni va Avogadro qonuni bilan to'ldirilgan Gey-Lyusak qonuni ideal gazning holat tenglamasini olish uchun etarli asosdir.
Oqibatlari
Boyl qonuni - Mariotte izotermik jarayonda gazning bosimi gaz egallagan hajmga teskari proportsional ekanligini ta'kidlaydi. Agar gazning zichligi uning egallagan hajmiga ham teskari proportsional ekanligini hisobga olsak, shunday xulosaga kelamiz:
Izotermik jarayonda gaz bosimi uning zichligiga to'g'ridan-to'g'ri mutanosib ravishda o'zgaradi.
Ma'lumki, siqilish, ya'ni gazning bosim ta'sirida hajmini o'zgartirish qobiliyati siqilish koeffitsienti bilan tavsiflanadi. Izotermik jarayonda, formula bilan aniqlanadigan izotermik siqilish koeffitsienti haqida gap boradi.
bu yerda T pastki belgisi qisman hosila doimiy haroratda olinganligini bildiradi. Ushbu formulaga bosim va hajm o'rtasidagi bog'liqlik ifodasini Boyl-Mariot qonuni bilan almashtirsak, biz quyidagilarni olamiz:Shunday qilib, biz shunday xulosaga kelamiz:
Ideal gazning izotermik siqilish koeffitsienti uning bosimining o'zaro nisbatiga teng.
Shuningdek qarang
- Gey Lussak qonuni
- Charlz qonuni
- Avogadro qonuni
- Ideal gaz
- Ideal gaz holati tenglamasi
Eslatmalar (tahrirlash)
- Boyl - Mariotte qonuni // Fizika ensiklopediyasi / Ch. ed. A. M. Proxorov. - M .: Sovet ensiklopediyasi, 1988 .-- T. 1. - S. 221-222. - 704 b. - 100 000 nusxa
- Sivuxin D.V. Umumiy fizika kursi. - M .: Fizmatlit, 2005 .-- T. II. Termodinamika va molekulyar fizika. - S. 21-22. - 544 b. - ISBN 5-9221-0601-5.
- 1 2 Boshlang'ich fizika darsligi / Ed. G. S. Landsberg. - Moskva: Nauka, 1985. - T. I. Mexanika. Issiqlik. Molekulyar fizika. - S. 430 .-- 608 b.
- 1 2 3 Kikoin A.K., Kikoin I.K., Molekulyar fizika. - M .: Nauka, 1976 .-- S. 35-36.
- Doimiy massada.
- Livshits L. D. Siqilish // Jismoniy ensiklopediya / Ch. ed. A. M. Proxorov. - M .: Buyuk rus entsiklopediyasi, 1994 .-- T. 4. - S. 492-493. - 704 b. - 40 000 nusxa
ISBN 5-85270-087-8.
Adabiyot
- Petrushevskiy F.F. Boyle-Mariotte qonuni // Brokxauz va Efron entsiklopedik lug'ati: 86 jildda (82 jild va 4 ta qo'shimcha) - SPb., 1890-1907.
Boyl qonuni - Marriott haqida ma'lumot
Boyl qonuni - Mariotte
Boyl qonuni - Mariotte
Boyl qonuni - Mariotte Siz mavzuni ko'rib chiqyapsiz
Boyl qonuni - Mariotte nima, Boyl qonuni - Mariotte kim, Boyl qonuni - Mariott tavsifi
Ushbu maqola va videoda vikipediyadan parchalar mavjud
Saytimizda qidiruv tizimi funksiyasida tizim mavjud. Yuqorida: "nima izlayotgan edingiz?" Siz tizimdagi hamma narsani quti bilan so'rashingiz mumkin. Sizga eng aniq va dolzarb ma'lumotlarni taqdim etish uchun tayyorlagan oddiy, zamonaviy va tezkor qidiruv tizimimizga xush kelibsiz.
Siz uchun mo'ljallangan qidiruv tizimi oddiy dizayn va tez ishlaydigan tizim bilan sizga eng dolzarb va aniq ma'lumotlarni taqdim etadi. Siz bizning veb-saytimizda deyarli har qanday ma'lumotni topishingiz mumkin.
Hozirda biz faqat ingliz, turk, rus, ukrain, qozoq va belarus tillarida xizmat qilamiz.
Tez orada tizimga yangi tillar qo'shiladi.
Mashhur odamlarning hayoti sizga siyosatchilar, hukumat amaldorlari, shifokorlar, veb-saytlar, o'simliklar, texnologiya vositalari, avtomobillar va boshqalar kabi yuzlab mavzular bo'yicha ma'lumotlar, tasvirlar va videolarni taqdim etadi.
Boyl-Mariot qonuni

Gazning hajmi va bosimi o'rtasidagi miqdoriy bog'liqlik birinchi marta 1662 yilda Robert Boyl tomonidan o'rnatilgan * Boyl-Mariot qonunida aytilishicha, doimiy haroratda gaz hajmi uning bosimiga teskari proportsionaldir.
Ushbu qonun har qanday belgilangan gaz miqdori uchun amal qiladi. Shakldan ko'rinib turibdiki. 3.2, uning grafik tasviri har xil bo'lishi mumkin. Chapdagi grafik past bosimda belgilangan miqdordagi gazning hajmi katta ekanligini ko'rsatadi.
Gazning hajmi bosim oshishi bilan kamayadi. Matematik jihatdan u shunday yozilgan:
Biroq, odatda Boyl-Mariotte qonuni shaklda yoziladi
Bunday yozuv, masalan, V1 gazining dastlabki hajmini va uning p bosimini bilish, yangi V2 hajmida p2 bosimini hisoblash imkonini beradi.
Gey-Lyusak qonuni (Charlz qonuni)
1787 yilda Charlz doimiy bosimda gaz hajmining (uning haroratiga mutanosib ravishda) o'zgarishini ko'rsatdi. Bu bog'liqlik 3.3-rasmda grafik ko'rinishda ko'rsatilgan, shundan ko'rinib turibdiki, gaz hajmi uning bilan chiziqli bog'liq. harorat.Matematik ko'rinishda bu bog'liqlik quyidagicha ifodalanadi:
Charlz qonuni ko'pincha boshqa shaklda yoziladi:
V1IT1 = V2T1 (2)
Charlz qonunini J. Gey-Lyussak takomillashgan, u 1802 yilda gazning harorati 1 ° C ga o'zgarganda uning hajmi 0 ° C da egallagan hajmning 1/273 ga o'zgarishini aniqladi.
Bundan kelib chiqadiki, agar biz har qanday gazning ixtiyoriy hajmini 0 ° S da olsak va doimiy bosimda uning haroratini 273 ° S ga kamaytirsak, yakuniy hajm nolga teng bo'ladi. Bu -273 ° C yoki 0 K haroratga to'g'ri keladi. Bu harorat mutlaq nol deb ataladi. Aslida, bunga erishish mumkin emas. Shaklda.
3.3 gaz hajmining harorat grafigiga nisbatan ekstrapolyatsiyasi 0 K da nol hajmga olib kelishini ko'rsatadi.
Mutlaq nolga, qat'iy aytganda, erishib bo'lmaydi. Biroq, laboratoriya sharoitida mutlaq noldan atigi 0,001 K ga farq qiladigan haroratga erishish mumkin. Bunday haroratlarda molekulalarning tasodifiy harakatlari amalda to'xtaydi. Bu ajoyib xususiyatlarga olib keladi.
Masalan, mutlaq nolga yaqin haroratgacha sovutilgan metallar elektr qarshiligini deyarli butunlay yo'qotadi va o'ta o'tkazuvchanlikka aylanadi *. Boshqa g'ayrioddiy past haroratli xususiyatlarga ega moddalarga misol geliydir.
Mutlaq nolga yaqin haroratlarda geliyning yopishqoqligi yo'qoladi va u ortiqcha suyuqlikka aylanadi.* 1987 yilda nisbatan yuqori haroratlarda 100 K (- 173 ° C) gacha bo'lgan o'ta o'tkazuvchanlikka ega bo'lgan moddalar (lantanid elementlari, bariy va mis oksidlaridan sinterlangan keramika) topildi. Ushbu "yuqori haroratli" o'ta o'tkazgichlar texnologiyada katta istiqbollarni ochadi. tarjima.
Asosiy laboratoriya jihozlari barcha eksperimental ishlar olib boriladigan ish stoli.
Har bir laboratoriya yaxshi ventilyatsiyaga ega bo'lishi kerak. Tutun qopqog'i talab qilinadi, unda barcha ishlar yomon hidli yoki zaharli birikmalar, shuningdek, tigellarda yondirilgan organik moddalar yordamida amalga oshiriladi.
Yuqori uchuvchan, zararli yoki yomon hidli moddalar (suyuq brom, konsentrlangan nitrat va xlorid kislotalar va boshqalar).
), shuningdek yonuvchan moddalar (uglerod disulfidi, efir, benzol va boshqalar).
Laboratoriyaga sanitariya-tesisat, kanalizatsiya, texnik oqim, gaz va suv isitish moslamalari kerak. Bundan tashqari, siqilgan havo, vakuum liniyasi, issiq suv va bug 'ta'minoti bo'lishi maqsadga muvofiqdir.
Agar maxsus aloqa bo'lmasa, issiq suv olish uchun turli tizimlarning suv isitgichlari ishlatiladi.
Elektr yoki gaz bilan isitiladigan ushbu qurilmalar yordamida siz tezda deyarli 100 ° S haroratli issiq suv oqimini olishingiz mumkin.
Laboratoriyada suvni distillash (yoki demineralizatsiya qilish) qurilmalari bo'lishi kerak, chunki distillangan yoki demineralizatsiyalangan suvsiz laboratoriyada ishlash mumkin emas. Distillangan suvni olish qiyin yoki imkonsiz bo'lgan hollarda tijorat distillangan suv ishlatiladi.
Ish stollari va suv lavabolari yonida keraksiz eritmalar, reagentlar va boshqalarni to'kish uchun sig'imi 10-15 litr bo'lgan loydan idishlar, shuningdek, singan shisha, qog'oz va boshqa quruq chiqindilar uchun savat bo'lishi kerak.
Laboratoriyada stollardan tashqari barcha daftarlar va eslatmalar saqlanadigan stol, kerak bo'lganda sarlavhalar jadvali bo'lishi kerak. Ish stollari yonida baland stullar yoki stullar bo'lishi kerak.
Statsionar o'rnatishni talab qiluvchi analitik tarozilar va asboblar (elektrometrik, optik va boshqalar) laboratoriya bilan bog'langan alohida xonaga joylashtiriladi va analitik tarozi uchun maxsus tortish xonasi ajratilishi kerak. Tarozi shimoldagi derazalar bilan joylashganligi ma'qul. Bu juda muhim, chunki muvozanat quyosh nuriga ta'sir qilmasligi kerak ("Tarozi va tortish").
Laboratoriyada siz eng kerakli ma'lumotnomalar, qo'llanmalar va darsliklarga ega bo'lishingiz kerak, chunki ish paytida ko'pincha ohang yoki boshqa ma'lumotnomaga ehtiyoj seziladi.
Shuningdek qarang
3-sahifa
Laboratoriyalarda ishlatiladigan kimyoviy shisha idishlarni bir qancha guruhlarga bo'lish mumkin. Maqsadga ko'ra, idishlarni umumiy, maxsus va hajmli idishlarga bo'lish mumkin. Materiallar bo'yicha - oddiy shisha, maxsus shisha, kvartsdan tayyorlangan idishlar uchun.
Guruhga. umumiy maqsad - har doim laboratoriyalarda bo'lishi kerak bo'lgan va ularsiz ko'p ishlarni bajarish mumkin bo'lmagan narsalar. Bular: probirkalar, oddiy va ajratuvchi voronkalar, stakanlar, yassi tubli kolbalar, kristalizatorlar, konussimon kolbalar (Erlenmeyer), Bunsen kolbalari, muzlatgichlar, retortlar, distillangan suv uchun kolbalar, troyniklar, musluklar.
Maxsus maqsadli guruhga har qanday maqsadda ishlatiladigan buyumlar kiradi, masalan: Kipp apparati, Sok-rally apparati, Kjeldahl apparati, reflyuks kondensatorlari, Wul-fa kolbalari, Tishchenko kolbalari, piknometrlar, gidrometrlar, Drexel kolbalari. , kaliy apparati, karbonat angidrid analizatori, dumaloq tubli kolbalar, maxsus muzlatgichlar, molekulyar og'irlikdagi asbob, erish va qaynash nuqtasi asboblari va boshqalar.
Volumetrik asboblarga quyidagilar kiradi: gradusli silindrlar va stakanlar, pipetkalar, byuretkalar va o'lchov kolbalari.Boshlash uchun biz quyidagi videoni tomosha qilishni taklif qilamiz, unda kimyoviy shisha idishlarning asosiy turlari qisqacha va foydalanish mumkin.
Shuningdek qarang:
Umumiy maqsadlar uchun idishlar
Probirkalar (18-rasm) pastki qismi yumaloq bo'lgan tor silindrsimon idishlar; ular turli o'lcham va diametrlarda bo'ladi va turli xil shishadan tayyorlanadi. Oddiy "laboratoriya probirkalari past eriydigan shishadan tayyorlanadi, lekin maxsus ish uchun yuqori haroratgacha qizdirish kerak bo'lganda, probirkalar yuqori eriydigan shisha yoki kvartsdan tayyorlanadi.
Oddiy, oddiy quvurlardan tashqari, gradusli va santrifüjli konusli quvurlar ham qo'llaniladi.
Probirkalarni ish holatida saqlash uchun maxsus yog'och, plastmassa yoki metall tokchalar qo'llaniladi (19-rasm).
Guruch. 18. Oddiy va darajali quvurlar
Guruch. 20. Probirkaga kukun holidagi moddalar yorlig'ini qo'yish.
Probirkalar asosan analitik yoki mikrokimyoviy ishlar uchun ishlatiladi. Probirkada reaksiyalar olib borilayotganda reagentlarni juda katta miqdorda ishlatmaslik kerak. Probirkaning chetiga qadar to'ldirilganligi mutlaqo qabul qilinishi mumkin emas.
Reaktsiya oz miqdordagi moddalar bilan amalga oshiriladi; Probirka sig'imining 1/4 qismi yoki hatto 1/8 qismi etarli. Ba'zida probirkaga qattiq moddani (changlar, kristallar va boshqalar) kiritish kerak bo'ladi.
), buning uchun eni probirkaning diametridan sal kichikroq bo'lgan qog'oz tasmasi uning uzunligi bo'ylab yarmiga buklanadi va hosil bo'lgan qoshiqqa kerakli miqdordagi qattiq moddalar quyiladi. Probirka chap qo'lda gorizontal egilib ushlab turiladi va uning ichiga chanoq deyarli pastki qismigacha kiritiladi (20-rasm).
Keyin probirka vertikal ravishda joylashtiriladi, lekin unga engil uriladi. Barcha qattiq moddalar to'kilgach, qog'oz qoshiqni olib tashlang.
To'kilgan reaktivlarni aralashtirish uchun probirka yuqori uchidan chap qo'lning bosh va ko'rsatkich barmog'i bilan ushlab, o'rta barmoq bilan tayanib turiladi, o'ng qo'lning ko'rsatkich barmog'i bilan probirkaning pastki qismiga uriladi. Bu uning tarkibini yaxshilab aralashtirish uchun etarli.
Probirkani barmog'ingiz bilan yopish va uni shunday silkitish mutlaqo qabul qilinishi mumkin emas; bu holda, siz nafaqat probirkadagi suyuqlikka begona narsalarni kiritishingiz, balki ba'zida barmoqning terisini shikastlashingiz, kuyishingiz va hokazo.
Agar kolba yarmidan ko'p suyuqlik bilan to'la bo'lsa, tarkibini shisha tayoq bilan aralashtiring.
Agar trubkani isitish kerak bo'lsa, uni ushlagichga mahkamlash kerak.
Probirkaning noto'g'ri va kuchli qizdirilishi bilan suyuqlik tezda qaynaydi va undan sachraydi, shuning uchun uni ehtiyotkorlik bilan isitish kerak. Pufakchalar paydo bo'lganda, probirkani chetga surib qo'yish kerak va uni o'choq olovida ushlab turmaslik kerak. , lekin uning yonida yoki yuqorisida, issiq havo bilan isitishni davom eting. Qizdirilganda, probirkaning ochiq uchi ishchidan va stol ustidagi qo'shnilardan uzoqroqqa yo'naltirilishi kerak.Kuchli isitish kerak bo'lmaganda, trubkani qizdirilgan suyuqlik bilan issiq suvga botirish yaxshiroqdir. Agar kichik probirkalar bilan ishlayotgan bo'lsa (yarim mikrotahlil uchun), u holda ular faqat tegishli o'lchamdagi (sig'imi 100 ml dan ortiq bo'lmagan) shisha stakanga quyilgan issiq suvda isitiladi.
Hunilar quyish uchun ishlatiladi - suyuqliklar, filtrlash uchun va boshqalar Kimyoviy voronkalar turli o'lchamlarda ishlab chiqariladi, ularning yuqori diametrlari 35, 55, 70, 100, 150, 200, 250 va 300 mm.
An'anaviy voronkalar silliq ichki devorga ega, ammo tezroq filtrlash uchun ba'zida qovurg'ali ichki yuzasi bo'lgan voronkalar qo'llaniladi.
Filtr hunilari har doim 60 ° burchakka va kesilgan uzun uchiga ega.
Ishlash vaqtida voronkalar maxsus shtativda yoki oddiy laboratoriya shtativdagi halqada o'rnatiladi (21-rasm).
Stakanga filtrlash uchun voronka uchun oddiy ushlagich yasash foydalidir (22-rasm) Buning uchun qalinligi taxminan 2 mm bo'lgan alyuminiy varaqdan uzunligi 70-80 lsh va kengligi 20 mm bo'lgan tasma kesiladi. .
Ipning uchlaridan birida diametri 12-13 mm bo'lgan teshik ochiladi va chiziq rasmda ko'rsatilgandek egiladi. 22, a. Shisha ustidagi huni qanday tuzatish kerakligi rasmda ko'rsatilgan. 22, b.
Shisha yoki kolbaga suyuqlik quyayotganda, voronkani chetiga qadar to'ldirmang.
Agar huni suyuqlik quyilgan idishning tomog'iga mahkam o'rnashgan bo'lsa, u holda o'tkazish qiyinlashadi, chunki idish ichida yuqori bosim hosil bo'ladi. Shuning uchun, huni vaqti-vaqti bilan ko'tarilishi kerak.
Huni va idishning bo'yni o'rtasida, masalan, qog'oz parchasini qo'yish orqali bo'shliq qilish yaxshiroqdir. Bunday holda, qistirma idishga tushmasligi uchun ehtiyot bo'lish kerak. O'zingiz qilishingiz mumkin bo'lgan simli uchburchakdan foydalanish tavsiya etiladi.Bu uchburchak idishning bo'yniga qo'yiladi va keyin huni kiritiladi.
Idishlarning bo'ynida maxsus rezina yoki plastmassa nozullar mavjud bo'lib, ular kolbaning ichki qismini tashqi atmosfera bilan aloqa qilishni ta'minlaydi (23-rasm).
Guruch. 21. Shishasimon kimyoviy hunini mustahkamlash
Guruch. 22. Voronkani stakanga, tripodga mahkamlash uchun qurilma.
Filtrlashda analitik ish uchun analitik voronkalardan foydalanish yaxshidir (24-rasm). Bu hunilarning o'ziga xos xususiyati shundaki, ular cho'zilgan kesilgan uchiga ega, uning ichki diametri pastki qismga qaraganda yuqori qismda kichikroq; bu dizayn filtrlashni tezlashtiradi.
Bundan tashqari, filtrni qo'llab-quvvatlovchi qovurg'ali ichki yuzasi bo'lgan va huni quvurga o'tadigan nuqtada sharsimon kengayishi bilan analitik voronkalar mavjud. Ushbu dizayndagi hunilar filtrlash jarayonini an'anaviy voronkalarga nisbatan uch barobargacha tezlashtiradi.
Guruch. 23. Shisha bo'yinbog'lari uchun nozullar. Guruch. 24. Analitik voronka.
Hunilarni ajratish(25-rasm) aralashmaydigan suyuqliklarni (masalan, suv va moy) ajratish uchun ishlatiladi. Ular silindrsimon yoki nok shaklida bo'lib, aksariyat hollarda shisha to'xtatuvchi bilan jihozlangan.
Filial quvurining yuqori qismida shisha kran mavjud. Ajratish hunilarining sig'imi har xil (50 ml dan bir necha litrgacha), sig'imga qarab devor qalinligi ham o'zgaradi.
Huni sig'imi qanchalik kichik bo'lsa, uning devorlari ingichka bo'ladi va aksincha.
Ishlash jarayonida ajratuvchi hunilar sig'im va shaklga qarab turli yo'llar bilan mustahkamlanadi. Kichik hajmli silindrsimon huni oddiygina oyoqqa biriktirilishi mumkin. Ikki halqa orasiga katta hunilar o'rnatiladi.
Silindrsimon voronkaning pastki qismi halqaga tayanishi kerak, uning diametri huni diametridan bir oz kichikroq, yuqori halqa biroz kattaroq diametrga ega.
Agar huni bir vaqtning o'zida chayqalayotgan bo'lsa, halqa va huni orasiga mantardan plastinka qo'yish kerak.
Armut shaklidagi ajratuvchi huni halqaga o'rnatiladi, uning bo'yni panjasi bilan qisiladi. Har doim avval hunini mahkamlang va shundan keyingina unga ajratiladigan suyuqliklarni quying.Tomchilovchi voronkalar (26-rasm) ajratuvchi voronkalardan yengilroq, yupqa devorli va
Guruch. 25. Ajratish voronkalari. guruch. 26. Damlamali voronkalar.
Ko'p hollarda uzoq oxiri bilan. Ushbu voronkalar ko'p ishlarda, moddani reaksiya massasiga kichik qismlarda yoki tomchilab qo'shilganda qo'llaniladi. Shuning uchun ular odatda qurilmaning bir qismini tashkil qiladi. Voronkalar kolba bo'yniga yupqa bo'lakda yoki tiqin yoki rezina tiqin bilan o'rnatiladi.
Ajratish yoki tushirish huni bilan ishlashdan oldin, shisha jo'mrak qismini neft jeli yoki maxsus moy bilan ehtiyotkorlik bilan yog'lash kerak.
Bu kranni osongina va qiyinchiliksiz ochish imkonini beradi, bu juda muhim, chunki kran mahkam ochilsa, uni ochishda uni buzishi yoki butun qurilmaga zarar etkazishi mumkin.
Yog 'juda nozik bir qatlamda qo'llanilishi kerak, shunda valfni aylantirganda, u huni trubasiga yoki valf teshigi ichiga tushmaydi.
Suyuqlik tomchilarining tomizuvchi voronkadan bir tekis oqib chiqishi va suyuqlikning oqish tezligini nazorat qilish uchun shtutserli tomchi voronkalardan foydalaniladi (27-rasm). Bunday hunilar krandan keyin darhol kengaytirilgan qismga ega bo'lib, u quvurga aylanadi. Suyuqlik kran orqali bu kengayishga qisqa trubka orqali, so'ngra huni trubkasiga oqib o'tadi.
Guruch. 27. Ko'krak bilan tomiziladigan huni
Guruch. 28. Stakanlar.
Guruch. 29. Ko‘krakli tekis huni
Shisha idishlar 1 2 3
Shuningdek qarang
25-dars. Boyl-Marriott qonuni - HIMI4KA

Darslar arxivi ›Kimyoning asosiy qonunlari
25-dars " Boyl-Mariot qonuni"Kursdan" Dummies uchun kimyo»Gazning bosimi va hajmi haqidagi qonunni, shuningdek, bosimning hajmga va hajmning bosimga bog'liqligi grafiklarini ko'rib chiqing. Eslatib o'taman, "Gaz bosimi" o'tgan darsimizda biz simob barometrining qurilmasi va ishlash printsipini ko'rib chiqdik, shuningdek bosimning ta'rifini berdik va uning o'lchov birliklarini ko'rib chiqdik.
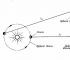
Robert Boyl Kimyoviy elementning birinchi amaliy to'g'ri ta'rifiga qarzdormiz (1627-1691) (biz 6-bobda o'rganamiz), havo kamaygan idishlarda sodir bo'ladigan hodisalar bilan ham qiziqdi.
Yopiq idishlardan havo chiqarish uchun vakuum nasoslarini ixtiro qilar ekan, u futbol to'pi kamerasini pompalagan yoki pufakni ehtiyotkorlik bilan siqib qo'ygan har bir kishiga tanish bo'lgan xususiyatga e'tibor qaratdi: yopiq idishda havo qanchalik ko'p siqilgan bo'lsa, u shunchalik ko'p qarshilik ko'rsatadi. siqilish.
Boyl bu mulkni " bahoriylik»Havo va uni rasmda ko'rsatilgan oddiy qurilma bilan o'lchagan. 3.2, a va b.
Boyl qiyshiq trubaning yopiq uchida bir oz havoni simob bilan to'sib qo'ydi (3-2-rasm, a) va keyin bu havoni siqib, simobni asta-sekin naychaning ochiq uchiga qo'shib qo'ydi (3-2-rasm, b).
Naychaning yopiq qismidagi havoning bosimi atmosfera bosimi va h balandlikdagi simob ustunining bosimi yig'indisiga teng (h - simobning ochiq uchida joylashgan balandlik). kolba yopiq uchida simob darajasidan oshib ketadi). Boyl tomonidan olingan bosim va hajm o'lchovlari 1-jadvalda keltirilgan. 3-1.
Boyl gazning doimiy haroratini ushlab turish uchun maxsus choralar ko'rmagan bo'lsa-da, uning tajribalarida u faqat bir oz o'zgargan ko'rinadi. Shunga qaramay, Boyl sham alangasidagi issiqlik havoning xususiyatlarida sezilarli o'zgarishlarga olib kelganini payqadi.
Havoning siqish paytidagi bosimi va hajmi haqidagi ma'lumotlarni tahlil qilish
3-1-jadval, atmosfera havosi uchun bosim va hajm o'rtasidagi bog'liqlik bo'yicha Boylning eksperimental ma'lumotlarini o'z ichiga olgan spoyler ostida joylashgan.
Tadqiqotchi jadvalda ko'rsatilganlarga o'xshash ma'lumotlarni olgandan so'ng. 3-1, u o'lchagan ikkita bog'liq miqdorni bog'laydigan matematik tenglamani topishga harakat qiladi.
Bunday tenglamani olishning usullaridan biri to'g'ri chiziqli grafikni olish umidida bir miqdorning turli darajalarining boshqasiga bog'liqligini grafik tarzda chizishdir.
To'g'ri chiziqning umumiy tenglamasi:
bu yerda x va y bog'liq o'zgaruvchilar, a va b doimiy sonlar. Agar b nolga teng bo'lsa, to'g'ri chiziq koordinata boshidan o'tadi.
Shaklda. 3-3 jadvalda ko'rsatilgan bosim P va V hajmi uchun ma'lumotlarni grafik qilishning turli usullarini ko'rsatadi. 3-1.P ga qarshi 1 / K va V ga qarshi 1 / P chizmalari koordinata boshidan o'tuvchi to'g'ri chiziqlardir.
P logarifmining V ning logarifmiga bog’liqligi grafigi ham manfiy qiyalikli to’g’ri chiziq bo’lib, uning burchagi tangensi - 1. Bu uchta chizmaning barchasi ekvivalent tenglamalarga olib keladi:
- P = a / V (3-3a)
- V = a / P (3-3b)
- lg V = lg a - lg P (3-3v)
Ushbu tenglamalarning har biri variantlardan birini ifodalaydi Boyl-Mariot qonuni, odatda quyidagicha formulalanadi: gazning ma'lum miqdordagi mollari uchun gaz harorati doimiy bo'lib qolishi sharti bilan uning bosimi hajmga mutanosibdir.
Aytgancha, siz Boyl-Mariotte qonuni nima uchun qo'sh nom bilan atalganiga hayron bo'lsangiz kerak. Buning sababi, 1662 yilda uni kashf etgan Robert Boyldan mustaqil ravishda ushbu qonunni 1676 yilda Edm Mariotte qayta kashf etgan. Mana shunaqa.
Ikki o'lchangan kattalik o'rtasidagi bog'liqlik shu holatda bo'ladigan darajada oddiy bo'lsa, uni raqamli ravishda ham aniqlash mumkin.
Agar P bosimining har bir qiymati V hajmning mos keladigan qiymatiga ko'paytirilsa, doimiy haroratda berilgan gaz namunasi uchun barcha mahsulotlar taxminan bir xil ekanligiga ishonch hosil qilish oson (3-1-jadvalga qarang). Shunday qilib, biz buni yozishimiz mumkin
Tenglama (Z-Zg) P va V qiymatlari orasidagi giperbolik munosabatni tavsiflaydi (3-3, a-rasmga qarang). Tajriba ma'lumotlari asosida tuzilgan P ning V ga bog'liqligi grafigi haqiqatan ham giperbolaga mos kelishini tekshirish uchun biz PV mahsulotining P ga bog'liqligining qo'shimcha grafigini quramiz va uning gorizontal to'g'ri chiziq ekanligiga ishonch hosil qilamiz (qarang. 3-3-rasm, e) ...
Boyl aniqladiki, har qanday gazning ma'lum miqdori uchun doimiy haroratda bosim P va V hajm o'rtasidagi bog'liqlik munosabatlar bilan qoniqarli tarzda tavsiflanadi.
- P V = const (doimiy T va n da) (3-4)
Boyl-Mariot formulasi
Turli sharoitlarda (lekin doimiy harorat) bir xil gaz namunasining hajmlari va bosimini solishtirish uchun uni ifodalash qulay Boyl-Mariot qonuni quyidagi formulada:
bu erda 1 va 2 indekslar ikki xil shartga mos keladi.
4-misol. Kolorado platosiga yetkazib beriladigan oziq-ovqat mahsulotlari solingan plastik qoplar (3-misolga qarang) tez-tez yorilib ketadi, chunki ulardagi havo dengiz sathidan 2500 m balandlikka ko'tarilganda, atmosfera bosimining pasayishi sharoitida kengayadi.
Agar xalta ichida dengiz sathiga mos keladigan atmosfera bosimida 100 sm3 havo bor deb hisoblasak, Kolorado platosida bir xil haroratda bu havo qancha hajmni egallashi kerak? (Kichik xaltalar havo kengayishini cheklamaydigan mahsulotlarni etkazib berish uchun ishlatiladi deb faraz qiling; etishmayotgan ma'lumotlar 3-misoldan olinishi kerak.)Yechim
Boyl qonunidan (3-5) tenglama ko'rinishida foydalanamiz, bunda 1 indeks dengiz sathidagi sharoitlarga, indeks 2 esa dengiz sathidan 2500 m balandlikdagi sharoitlarga tegishli bo'ladi. Keyin R1 = 1000 atm, V1 = 100 sm3, R2 = 0,750 atm va V2 ni hisoblash kerak. Shunday qilib,
Berilgan gaz massasining holatini tavsiflovchi parametrlar o'rtasidagi munosabatni o'rganish, biz parametrlardan biri o'zgarishsiz qolganda sodir bo'ladigan gaz jarayonlarini o'rganishdan boshlaymiz. Ingliz olimi Boyl(1669 yilda) va fransuz olimi Marriott(1676 yilda) bosim o'zgarishining doimiy haroratda gaz hajmining o'zgarishiga bog'liqligini ifodalovchi qonunni kashf etdi. Keling, quyidagi tajribani amalga oshiramiz.
Tutqichni aylantirib, biz A silindridagi gaz (havo) hajmini o'zgartiramiz (11-rasm, a). Manometrning o'qishiga ko'ra, biz gaz bosimining ham o'zgarishini ta'kidlaymiz. Biz idishdagi gaz hajmini o'zgartiramiz (hajm B shkalasida aniqlanadi) va bosimni ko'rib, ularni jadvalga yozamiz. 1. Undan ko'rinib turibdiki, gaz hajmining uning bosimiga ko'paytmasi deyarli o'zgarmas bo'lgan: gaz hajmi necha marta kamaygan, uning bosimi bir xil miqdorda oshgan.

Shunga o'xshash, aniqroq tajribalar natijasida aniqlandi: gazning ma'lum massasi uchun doimiy haroratda gaz bosimi gaz hajmining o'zgarishiga teskari mutanosib ravishda o'zgaradi. Bu Boyl-Mariotte qonunining formulasi. Matematik jihatdan u ikki holat uchun quyidagicha yoziladi:
![]()
Doimiy haroratda gaz holatini o'zgartirish jarayoni deyiladi izotermik. Boyl-Mariot formulasi gazning izotermik holatining tenglamasidir. Doimiy haroratda molekulalarning o'rtacha harakat tezligi o'zgarmaydi. Gaz hajmining o'zgarishi molekulalarning tomir devorlariga ta'siri sonining o'zgarishiga olib keladi. Bu gaz bosimining o'zgarishining sababi.
Keling, ushbu jarayonni, masalan, ish uchun grafik tarzda tasvirlaylik V = 12 litr, p = 1 at.... Gaz hajmini abtsissa o'qiga, uning bosimini esa ordinata o'qiga chizamiz (11-rasm, b). Biz V va p qiymatlarining har bir juftiga mos keladigan nuqtalarni topamiz va ularni bir-biriga bog'lab, biz izotermik jarayonning grafigini olamiz. Doimiy haroratda gazning hajmi va bosimi o'rtasidagi bog'liqlikni ko'rsatadigan chiziq izoterm deb ataladi. Sof izotermik jarayonlar sodir bo'lmaydi. Ammo gaz haroratining ozgina o'zgarishi odatiy hol emas, masalan, kompressor tsilindrlarga havo quyayotganda, yonuvchi aralashmani ichki yonish dvigatelining tsilindriga AOK qilganda. Bunday hollarda gaz hajmi va bosimi Boyl-Mariot qonuni * bo'yicha hisoblanadi.