Dove si applica la legge sulle boilies mariotte. leggi del gas
La legge di Boyle-Mariotte è la seguente:
In forma matematica, questa affermazione è scritta nella forma della formula
dove - pressione del gas; - volume di gas, e - valore costante alle condizioni concordate. In generale, il valore è determinata dalla natura chimica, dalla massa e dalla temperatura del gas.
Ovviamente, se l'indice 1 denotano le grandezze relative allo stato iniziale del gas, e il pedice 2 - alla finale, quindi la formula data può essere scritta nella forma
.
Dalle formule sopra e sopra, segue la forma della dipendenza della pressione del gas dal suo volume nel processo isotermico:
Questa dipendenza è un'altra, equivalente alla prima, espressione del contenuto della legge Boyle - Mariotte. Significa che
La pressione di una massa di gas a temperatura costante è inversamente proporzionale al suo volume.
Allora la relazione tra gli stati iniziale e finale del gas che partecipa al processo isotermico può essere espressa come:
Va notato che l'applicabilità di questa e della precedente formula, che collega tra loro le pressioni e i volumi di gas iniziale e finale, non è limitata al caso dei processi isotermici. Le formule rimangono valide in quei casi in cui la temperatura cambia durante il processo, ma a seguito del processo la temperatura finale risulta essere uguale a quella iniziale.
È importante chiarire che questa legge è valida solo nei casi in cui il gas in questione può essere considerato ideale. In particolare, la legge Boyle - Mariotte è soddisfatta con elevata precisione in relazione ai gas rarefatti. Se il gas è fortemente compresso, si osservano deviazioni significative da questa legge.
Conseguenze
Legge di Boyle - Mariotte afferma che la pressione di un gas in un processo isotermico è inversamente proporzionale al volume occupato dal gas. Se teniamo conto che la densità di un gas è anche inversamente proporzionale al volume che occupa, allora arriviamo alla conclusione:
In un processo isotermico, la pressione del gas cambia in proporzione diretta alla sua densità.
Quindi, arriviamo alla conclusione:
Il coefficiente isotermico di compressibilità di un gas ideale è uguale al reciproco della sua pressione.
Guarda anche
Scrivi una recensione su Legge di Boyle - Mariotte
Note (modifica)
- Petrushevsky F.F.// Dizionario enciclopedico di Brockhaus ed Efron
- // Enciclopedia fisica / Cap. ed. A.M. Prokhorov. - M .: Enciclopedia Sovietica, 1988 .-- T. 1. - S. 221-222. - 704 pagg. - 100.000 copie
- Sivukhin D.V. Corso generale di fisica. - Mosca: Fizmatlit, 2005 .-- T. II. Termodinamica e Fisica Molecolare. - S. 21-22. - 544 pagg. - ISBN 5-9221-0601-5.
- Manuale elementare di fisica / Ed. G.S. Landsberg. - M .: Scienza, 1985. - T. I. Meccanica. Calore. Fisica molecolare. - S. 430 .-- 608 p.
- Kikoin A.K., Kikoin I.K. Fisica molecolare. - M.: Nauka, 1976 .-- S. 35-36.
- A massa costante.
- Livshits L. D.// Enciclopedia fisica / Cap. ed. A.M. Prokhorov. - M .: Grande Enciclopedia Russa, 1994 .-- T. 4. - S. 492-493. - 704 pagg. - 40.000 copie - ISBN 5-85270-087-8.
Letteratura
- Petrushevsky F.F.// Dizionario enciclopedico di Brockhaus ed Efron: in 86 volumi (82 volumi e 4 aggiuntivi). - SPb. , 1890-1907.
Estratto dalla legge di Boyle - Mariotte
"Lei è quella giusta", si udì in risposta una voce di donna ruvida, dopodiché Marya Dmitrievna entrò nella stanza.Tutte le signorine e anche le signore, tranne la più anziana, si alzarono. Marya Dmitrievna si fermò sulla soglia e, dall'alto del suo corpo corpulento, tenendo alta la testa da cinquantenne con riccioli grigi, guardò gli ospiti e, come se si arrotolasse, si raddrizzò senza fretta le ampie maniche del suo vestito. Marya Dmitrievna ha sempre parlato russo.
"Cara festeggiata con i bambini", disse con la sua voce forte e spessa che travolgeva tutti gli altri suoni. - Cosa sei, vecchio peccatore, - si rivolse al conte, che le baciò la mano, - tè, Mosca ti manca? Non c'è un posto dove guidare i cani? Ma che fare, papà, è così che crescono questi uccellini... - Indicò le ragazze. - Se vuoi o no, devi cercare corteggiatori.
- Bene, cosa, mio cosacco? (Maria Dmitrievna chiamava Natasha cosacca) - disse, accarezzando Natasha con la mano, che si avvicinò alla sua mano senza paura e allegramente. - So che la pozione è una ragazza, ma la adoro.
Tirò fuori gli orecchini da yacht con pere da un enorme reticolo e, dandoli a Natasha, che splendeva e arrossì per il suo compleanno, si voltò immediatamente da lei e si rivolse a Pierre.
- Ehi, ehi! tipo! vieni qui ", ha detto con una voce finta bassa e sottile. - Dai, mia cara...
E si rimboccò minacciosamente le maniche.
Pierre si avvicinò, guardandola ingenuamente attraverso gli occhiali.
- Vieni, vieni, caro! Ho detto la verità a tuo padre da solo, quando era in causa, e poi Dio te lo comanda.
Si fermò. Tutti tacevano, aspettandosi cosa sarebbe successo e sentendo che c'era solo una prefazione.
- Bene, non c'è niente da dire! bravo ragazzo!... Papà si stende sul letto, e si diverte, mette il furiere su un orso. Vergogna, padre, vergogna! Sarebbe meglio se andasse in guerra.
Si voltò e tese la mano al conte, che non poté trattenersi dal ridere.
- Bene, bene, a tavola, ho il tè, è ora? - disse Marya Dmitrievna.
Il conte è andato avanti con Marya Dmitrievna; poi la contessa, che era guidata dal colonnello ussaro, la persona giusta con cui Nikolai doveva raggiungere il reggimento. Anna Mikhailovna - con Shinshin. Berg ha dato la mano a Vera. La sorridente Julie Karagina è andata al tavolo con Nikolai. Altre coppie li seguivano, allungandosi per l'atrio, e dietro a loro tutti, uno per uno, bambini, precettori e governanti. I camerieri si mossero, le sedie sbatterono, la musica risuonò nel coro e gli ospiti si accomodarono. I suoni della musica casalinga del conte furono sostituiti dai suoni di coltelli e forchette, gli ospiti che parlavano, i passi silenziosi dei camerieri.
La contessa sedeva a un'estremità del tavolo. A destra c'è Marya Dmitrievna, a sinistra c'è Anna Mikhailovna e altri ospiti. All'altro capo sedeva il conte, a sinistra un colonnello ussaro, a destra Shinshin e altri ospiti maschi. Da un lato del lungo tavolo ci sono i giovani più grandi: Vera accanto a Berg, Pierre accanto a Boris; dall'altro bambini, tutori e governanti. Da dietro i cristalli, le bottiglie ei vasi di frutta, il conte guardava sua moglie e il suo alto berretto con nastri blu e versava diligentemente vino ai vicini, senza dimenticare se stesso. Anche la contessa, a causa degli ananas, non dimenticando i doveri della padrona di casa, lanciava sguardi significativi al marito, la cui testa e viso calvi, le sembrava, erano più nettamente diversi dai capelli grigi nel loro rossore. C'era un balbettio uniforme da parte delle signore; su quella maschile si udivano voci sempre più alte, specie dell'ussaro colonnello, che mangiava e beveva tanto, arrossendo sempre di più che già il conte lo poneva ad esempio agli altri commensali. Berg ha parlato con Vera con un sorriso gentile che l'amore non è un sentimento terreno, ma celeste. Boris chiamò il suo nuovo amico Pierre gli ospiti al tavolo e scambiò un'occhiata con Natasha, che era seduta di fronte a lui. Pierre parlava poco, guardava facce nuove e mangiava molto. Partendo da due zuppe, di cui scelse a la tortue, [guscio di tartaruga,] e kulebyaki, ai galli cedroni, non gli mancò un solo piatto o un solo vino, che il maggiordomo fece uscire misteriosamente dalla spalla di un vicino in una bottiglia avvolta in un tovagliolo, dicendo o "dray Madeira, o ungherese, o Reno. Sostituì il primo dei quattro bicchieri di cristallo con il monogramma del conte in piedi davanti a ciascun dispositivo e bevve con piacere, guardando gli ospiti con aria sempre più piacevole. Natasha, che gli era seduta di fronte, guardava Boris come le ragazze di tredici anni guardano il ragazzo con cui si erano appena baciate per la prima volta e di cui sono innamorate. Questo stesso suo sguardo a volte si rivolgeva a Pierre, e sotto lo sguardo di questa ragazza divertente e vivace voleva ridere anche lui, non sapendo perché.
Nikolai era seduto lontano da Sonya, accanto a Julie Karagina, e di nuovo con lo stesso sorriso involontario le stava parlando. Sonya sorrise cerimoniosamente, ma, a quanto pare, fu tormentata dalla gelosia: impallidì, poi arrossì e con tutte le sue forze ascoltò ciò che Nikolai e Julie stavano dicendo tra loro. La governante si guardò intorno a disagio, come se si preparasse a un rifiuto, se qualcuno avesse pensato di offendere i bambini. Il governatore tedesco cercò di memorizzare tutti i tipi di cibo, dolci e vini per descrivere tutto in dettaglio in una lettera alla sua famiglia in Germania, e fu molto offeso che il maggiordomo, con una bottiglia avvolta in un tovagliolo, lo portasse in giro. Il tedesco si accigliò, cercando di fingere di non volere questo vino, ma si offese perché nessuno voleva capire che aveva bisogno di vino non per dissetarsi, non per avidità, ma per coscienziosa curiosità.
All'estremità maschile del tavolo, la conversazione si fece sempre più vivace. Il colonnello disse che il manifesto sulla dichiarazione di guerra era già stato pubblicato a San Pietroburgo e che la copia che aveva visto di persona era stata ora consegnata per corriere al comandante in capo.
22. Legge di Boyle-Mariotte
Una delle leggi del gas ideale è Legge di Boyle-Mariotte, che recita: il prodotto della pressione P per volume V gas a massa e temperatura costanti. Questa uguaglianza si chiama equazioni isoterme... L'isoterma è rappresentata sul diagramma PV dello stato del gas sotto forma di un'iperbole e, a seconda della temperatura del gas, occupa l'una o l'altra posizione. Il processo che si svolge a T= si chiama const isotermico. Gas a T= const ha energia interna U costante. Se il gas si espande isotermicamente, allora tutto il calore entra in funzione. Il lavoro che compie il gas, espandendosi isotermicamente, è pari alla quantità di calore che deve essere impartita al gas per svolgerlo:
dА= dQ= PdV,
dove d UN- lavoro elementare;
dV- volume elementare;
P- pressione. Se V1>V2 e P1< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие T= const è stato rispettato, è necessario considerare le variazioni di pressione e volume come infinitamente lente. Esiste anche un requisito per il mezzo in cui si trova il gas: deve avere una capacità termica sufficientemente elevata. Le formule di calcolo sono adatte anche nel caso di fornitura di energia termica all'impianto. Comprimibilità il gas è chiamato la sua proprietà di cambiare di volume al variare della pressione. Ogni sostanza ha fattore di comprimibilità, ed è uguale a:
c = 1 / V(dV / CP) T,
qui la derivata è presa in T= cost.
Il fattore di comprimibilità viene introdotto per caratterizzare la variazione di volume con una variazione di pressione. Per un gas ideale è uguale a:
c = -1 / P.
In SI, il fattore di compressibilità ha la seguente dimensione: [c] = m 2 / N.
Questo testo è un frammento introduttivo. Dal libro La creatività come scienza esatta [Teoria della soluzione creativa dei problemi] l'autore Altshuller Genrikh Saulovich1. La legge della completezza delle parti di un sistema Condizione necessaria per l'attuabilità fondamentale di un sistema tecnico è la presenza e le prestazioni minime delle parti principali del sistema. Ogni sistema tecnico deve comprendere quattro parti principali: il motore,
Dal libro Interface: New Directions in the Design of Computer Systems autore Ruskin Jeff2. La legge della “conducibilità energetica” del sistema Condizione necessaria per la fondamentale vitalità di un sistema tecnico è il passaggio di energia attraverso tutte le parti del sistema. Qualsiasi sistema tecnico è un convertitore di energia. Da qui l'ovvio
Dal libro Strumentazione autore Babaev MA6. La legge di transizione al supersistema Esaurite le possibilità di sviluppo, il sistema è incluso nel supersistema come una delle sue parti; in questo caso, l'ulteriore sviluppo avviene a livello di supersistema. Abbiamo già parlato di questa legge. Passiamo alla "dinamica". Include leggi che riflettono
Dal libro Ingegnere termico l'autore Burkhanova Natalia7. La legge di transizione dal macrolivello al microlivello Lo sviluppo degli organi di lavoro del sistema va prima al macrolivello - e poi al microlivello. Nei sistemi tecnici più moderni, i corpi di lavoro sono "pezzi di ferro", ad esempio eliche di aerei, ruote di automobili, frese
Dal libro Linguistica computazionale per tutti: miti. Algoritmi. Lingua l'autore Anisimov Anatoly Vasilievich8. La legge dell'aumento del grado di su-campo Lo sviluppo di sistemi tecnici va nella direzione di aumentare il grado di su-campo. Il significato di questa legge sta nel fatto che i sistemi non di campo tendono a diventare su-campo, e nei sistemi su-campo, lo sviluppo va nella direzione
Dal libro Il fenomeno della scienza [Approccio cibernetico all'evoluzione] l'autore Turchin Valentin Fedorovich Dal libro Nanotecnologie [Scienza, innovazione e opportunità] di Foster Lynn4.4.1. Legge di Fitts Immagina di spostare il cursore su un pulsante sullo schermo. Il pulsante è l'obiettivo di questo movimento. La lunghezza della linea retta che collega la posizione iniziale del cursore e il punto più vicino del bersaglio è definita nella legge di Fitts come una distanza. Sopra
Dal libro Storia di scoperte e invenzioni eccezionali (ingegneria elettrica, ingegneria dell'energia elettrica, elettronica radio) l'autore Schneiberg Jan Abramovich4.4.2. Legge di Hick Prima di spostare il cursore su un bersaglio o eseguire qualsiasi altra azione da un insieme di molte opzioni, l'utente deve selezionare questo oggetto o azione. La legge di Hick afferma che quando è necessario effettuare una scelta tra n opzioni, il tempo per scegliere
Dal libro dell'autore9. Legge di distribuzione di Poisson e Gauss Legge di Poisson. Il suo altro nome è la legge di ra-definizione degli eventi rari. La legge di Poisson (Z.P) viene applicata nei casi in cui è improbabile, e quindi l'uso di B / Z / R è impraticabile.I vantaggi della legge sono: convenienza con
Dal libro dell'autore23. Legge di Gay-Lussac La legge di Gay-Lussac dice: il rapporto tra il volume del gas e la sua temperatura a pressione del gas e massa costanti è costante V / T = m / MO R / P = const a P = const, m = const. Questa uguaglianza è il nome dell'equazione isobare.L'isobare è rappresentata sul diagramma PV di una linea retta,
Dal libro dell'autore24. Legge di Charles La legge di Charles afferma che il rapporto tra la pressione del gas e la sua temperatura è costante se il volume e la massa del gas sono invariati: P / T = m / MO R / V = const a V = const, m = cost. Questa uguaglianza è chiamata equazione isocora .Isochora è rappresentata sul diagramma PV da una linea retta parallela all'asse P, e
Dal libro dell'autore30. La legge di conservazione e trasformazione dell'energia La prima legge della termodinamica si basa sulla legge universale di conservazione e trasformazione dell'energia, la quale afferma che l'energia non si crea e non scompare: i corpi che partecipano al processo termodinamico interagiscono tra loro
Dal libro dell'autoreTSAREVNA-RANA E LA LEGGE DI STABILITÀ Come già sottolineato in precedenza (la legge dell'astrazione), il pensiero primitivo analizza abilmente i fenomeni concreti e sintetizza nuovi sistemi astratti. Poiché ogni oggetto costruito dalla coscienza era percepito come vivente e vivente
Dal libro dell'autore1.1. La Legge Fondamentale dell'Evoluzione Nel processo dell'evoluzione della vita, per quanto ne sappiamo, c'è sempre stato un aumento della massa totale della materia vivente e la complicazione della sua organizzazione. Complicando l'organizzazione delle formazioni biologiche, la natura agisce con il metodo dei campioni e
Dal libro dell'autore4.2. Legge di Moore Nella sua forma più semplice, la Legge di Moore si riduce ad affermare che la densità di cablaggio dei circuiti a transistor raddoppia ogni 18 mesi. La paternità della legge è attribuita a uno dei fondatori della nota azienda Intel, Gordon Moore. A rigor di termini, in
DEFINIZIONE
I processi in cui uno dei parametri dello stato del gas rimane costante sono chiamati isoprocessi.
DEFINIZIONE
leggi del gas sono le leggi che descrivono gli isoprocessi in un gas ideale.
Le leggi dei gas sono state scoperte sperimentalmente, ma tutte possono essere ottenute dall'equazione di Mendeleev-Clapeyron.
Consideriamo ciascuno di essi.
Legge di Boyle-Mariotte (processo isotermico)
Processo isotermico si chiama cambiamento di stato di un gas in cui la sua temperatura rimane costante.
Per una massa costante di gas a temperatura costante, il prodotto tra pressione e volume del gas è un valore costante:
La stessa legge può essere riscritta in una forma diversa (per due stati di un gas ideale):
Questa legge segue dall'equazione Mendeleev - Clapeyron:
![]()
Ovviamente, a massa di gas costante ea temperatura costante, il membro destro dell'equazione rimane costante.
I grafici della dipendenza dei parametri del gas a temperatura costante sono chiamati isoterme.
Indicando la costante con una lettera, scriviamo la dipendenza funzionale della pressione dal volume in un processo isotermico:
Si può notare che la pressione del gas è inversamente proporzionale al suo volume. Grafico di proporzionalità inversa e, di conseguenza, il grafico dell'isoterma in coordinate è l'iperbole(Fig. 1, a). Le figure 1 b) ec) mostrano le isoterme in coordinate e, rispettivamente.

Fig. 1. Grafici di processi isotermici in varie coordinate
Legge di Gay-Lussac (processo isobarico)
Processo isobarico si chiama cambiamento di stato di un gas in cui la sua pressione rimane costante.
Per una massa costante di gas a pressione costante, il rapporto tra volume di gas e temperatura è un valore costante:
Questa legge segue anche dall'equazione Mendeleev - Clapeyron:
![]()
isobare.
Considera due processi isobarici con pressioni e titolo = "(! LANG: Reso da QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Definiamo la forma del grafico in coordinate Denotando la costante con una lettera, scriviamo la dipendenza funzionale del volume dalla temperatura nel processo isobarico:
Si può vedere che a pressione costante, il volume del gas è direttamente proporzionale alla sua temperatura. Il grafico della proporzionalità diretta, e, quindi, un grafico isobare in coordinate è una retta passante per l'origine(Fig. 2, c). In realtà, a temperature sufficientemente basse, tutti i gas si trasformano in liquidi, ai quali le leggi sui gas non sono più applicabili. Pertanto, vicino all'origine delle coordinate, le isobare in Fig. 2, c) sono mostrate con una linea tratteggiata.

figura 2. Grafici di processi isobarici in varie coordinate
Legge di Charles (processo isocoro)
Processo isocoro si chiama cambiamento di stato di un gas in cui il suo volume rimane costante.
Per una massa costante di gas a volume costante, il rapporto tra la pressione del gas e la sua temperatura è un valore costante:
Per due stati del gas, questa legge sarà scritta nella forma:
Questa legge può essere ottenuta anche dall'equazione di Mendeleev - Clapeyron:
![]()
I grafici della dipendenza dei parametri del gas a pressione costante sono chiamati isocore.
Considera due processi isocore con volumi e titolo = "(! LANG: reso da QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
Per determinare il tipo di grafico del processo isocoro in coordinate, denotiamo una costante nella legge di Charles con una lettera, otteniamo:
Pertanto, la dipendenza funzionale della pressione dalla temperatura a un volume costante è una proporzionalità diretta, il grafico di tale dipendenza è una linea retta che passa attraverso l'origine (Fig. 3, c).

figura 3. Grafici di processi isocori in varie coordinate
Esempi di problem solving
ESEMPIO 1
| Esercizio | A quale temperatura dovrebbe essere raffreddata isobaricamente una certa massa di gas con una temperatura iniziale in modo che il volume del gas diminuisca di un quarto? |
| Soluzione | Il processo isobarico è descritto dalla legge di Gay-Lussac: A seconda delle condizioni del problema, il volume di gas dovuto al raffreddamento isobarico diminuisce di un quarto, quindi: da cui la temperatura finale del gas: Convertiamo le unità nel sistema SI: temperatura iniziale del gas. Calcoliamo:
|
| Risposta | Il gas deve essere raffreddato a temperatura. |
ESEMPIO 2
| Esercizio | Un recipiente chiuso contiene gas a una pressione di 200 kPa. Quale sarà la pressione del gas se la temperatura viene aumentata del 30%? |
| Soluzione | Poiché il contenitore con il gas è chiuso, il volume del gas non cambia. Il processo isocoro è descritto dalla legge di Charles: In base alle condizioni del problema, la temperatura del gas è aumentata del 30%, quindi puoi scrivere: Sostituendo l'ultimo rapporto nella legge di Charles, otteniamo: Convertiamo le unità nel sistema SI: pressione iniziale del gas kPa = Pa. Calcoliamo: |
| Risposta | La pressione del gas diventa 260 kPa. |
ESEMPIO 3
| Esercizio | Il sistema di ossigeno di cui è dotato l'aereo ha |
| Soluzione | Il processo isotermico è descritto dalla legge di Boyle-Mariotte: |
Legge di Boyle - Mariotte
Legge di Boyle - Mariottè una delle principali leggi dei gas, scoperta nel 1662 da Robert Boyle e riscoperta indipendentemente da Edm Mariotte nel 1676. Descrive il comportamento di un gas in un processo isotermico. La legge è una conseguenza dell'equazione di Clapeyron.
- 1 Formulazioni
- 2 conseguenze
- 3 Vedi anche
- 4 note
- 5 Letteratura
La formulazione
La legge di Boyle-Mariotte è la seguente:
A temperatura e massa del gas costanti, il prodotto della pressione del gas per il suo volume è costante.
In forma matematica, questa affermazione è scritta nella forma della formula
dov'è la pressione del gas; è il volume di gas, ed è un valore costante alle condizioni concordate. In generale, il valore è determinato dalla natura chimica, dalla massa e dalla temperatura del gas.
Ovviamente, se il pedice 1 indica le quantità relative allo stato iniziale del gas e il pedice 2 - allo stato finale, allora la formula sopra può essere scritta nella forma
.
Dalle formule sopra e sopra, segue la forma della dipendenza della pressione del gas dal suo volume nel processo isotermico:
Questa dipendenza è un'altra, equivalente alla prima, espressione del contenuto della legge Boyle - Mariotte. Significa che
La pressione di una massa di gas a temperatura costante è inversamente proporzionale al suo volume.
Allora la relazione tra gli stati iniziale e finale del gas che partecipa al processo isotermico può essere espressa come:
Va notato che l'applicabilità di questa e della precedente formula, che collega tra loro le pressioni e i volumi di gas iniziale e finale, non è limitata al caso dei processi isotermici. Le formule rimangono valide in quei casi in cui la temperatura cambia durante il processo, ma a seguito del processo la temperatura finale risulta essere uguale a quella iniziale.
È importante chiarire che questa legge è valida solo nei casi in cui il gas in questione può essere considerato ideale. In particolare, la legge Boyle - Mariotte è soddisfatta con elevata precisione in relazione ai gas rarefatti. Se il gas è fortemente compresso, si osservano deviazioni significative da questa legge.
La legge di Boyle - Mariotte, la legge di Charles e la legge di Gay-Lussac, integrate dalla legge di Avogadro, sono una base sufficiente per ottenere l'equazione di stato per un gas ideale.
Conseguenze
Legge di Boyle - Mariotte afferma che la pressione di un gas in un processo isotermico è inversamente proporzionale al volume occupato dal gas. Se teniamo conto che la densità di un gas è anche inversamente proporzionale al volume che occupa, allora arriviamo alla conclusione:
In un processo isotermico, la pressione del gas cambia in proporzione diretta alla sua densità.
È noto che la compressibilità, cioè la capacità di un gas di modificare il proprio volume sotto l'influenza della pressione, è caratterizzata dal coefficiente di compressibilità. Nel caso di un processo isotermico si parla di coefficiente di comprimibilità isoterma, che è determinato dalla formula
dove il pedice T significa che la derivata parziale è presa a temperatura costante. Sostituendo in questa formula l'espressione della relazione tra pressione e volume della legge di Boyle - Mariotte, si ottiene:Quindi, arriviamo alla conclusione:
Il coefficiente isotermico di compressibilità di un gas ideale è uguale al reciproco della sua pressione.
Guarda anche
- Legge di Gay Lussac
- Carlo legge
- Legge di Avogadro
- gas ideale
- Equazione di stato dei gas perfetti
Note (modifica)
- Boyle - Legge di Mariotte // Enciclopedia fisica / Cap. ed. A.M. Prokhorov. - M .: Enciclopedia sovietica, 1988 .-- T. 1. - S. 221-222. - 704 pagg. - 100.000 copie
- Sivukhin D.V. Corso generale di fisica. - M.: Fizmatlit, 2005 .-- T. II. Termodinamica e Fisica Molecolare. - S. 21-22. - 544 pagg. - ISBN 5-9221-0601-5.
- 1 2 Manuale elementare di fisica / Ed. G.S. Landsberg. - Mosca: Nauka, 1985. - Meccanica T.I. Calore. Fisica molecolare. - S. 430 .-- 608 p.
- 1 2 3 Kikoin A.K., Kikoin I.K., Fisica Molecolare. - M.: Nauka, 1976 .-- S. 35-36.
- A massa costante.
- Livshits L. D. Comprimibilità // Enciclopedia fisica / Cap. ed. A.M. Prokhorov. - M .: Grande Enciclopedia Russa, 1994 .-- T. 4. - S. 492-493. - 704 pagg. - 40.000 copie
ISBN 5-85270-087-8.
Letteratura
- Petrushevsky F.F. Boyle-Mariotte law // Dizionario enciclopedico Brockhaus ed Efron: in 86 volumi (82 volumi e 4 aggiuntivi) - SPb., 1890-1907.
Legge di Boyle - Informazioni su Marriott
Legge di Boyle - Mariotte
Legge di Boyle - Mariotte
Legge di Boyle - Mariotte Stai navigando argomento
Legge di Boyle - Mariotte cosa, Legge di Boyle - Mariotte chi, Legge di Boyle - Descrizione di Mariotte
Ci sono estratti da wikipedia su questo articolo e video
Il nostro sito dispone di un sistema in funzione di un motore di ricerca. Sopra: "cosa stavi cercando?" Puoi interrogare tutto nel sistema con la scatola. Benvenuto nel nostro motore di ricerca semplice, elegante e veloce, che abbiamo preparato per fornirti le informazioni più accurate e aggiornate.
Un motore di ricerca progettato per te ti fornisce le informazioni più pertinenti e accurate con un design semplice e un sistema di funzionamento rapido. Puoi trovare quasi tutte le informazioni che stai cercando sul nostro sito web.
Al momento serviamo solo in inglese, turco, russo, ucraino, kazako e bielorusso.
Nuove lingue verranno aggiunte al sistema molto presto.
Le vite di personaggi famosi ti forniscono informazioni, immagini e video su centinaia di argomenti come politici, funzionari governativi, medici, siti Web, impianti, veicoli tecnologici, automobili e altro ancora.
Legge di Boyle-Mariotte

La relazione quantitativa tra volume e pressione di un gas fu stabilita per la prima volta da Robert Boyle nel 1662 * La legge di Boyle-Mariotte afferma che a temperatura costante, il volume di un gas è inversamente proporzionale alla sua pressione.
Questa legge si applica a qualsiasi quantità fissa di gas. Come si può vedere dalla figura. 3.2, la sua rappresentazione grafica può essere diversa. Il grafico a sinistra mostra che a bassa pressione, il volume di una quantità fissa di gas è grande.
Il volume del gas diminuisce all'aumentare della pressione. Matematicamente si scrive così:
Tuttavia, di solito la legge di Boyle-Mariotte è scritta nella forma
Tale registrazione consente, ad esempio, conoscendo il volume di gas iniziale V1 e la sua pressione p, di calcolare la pressione p2 nel nuovo volume V2.
Legge di Gay-Lussac (legge di Charles)
Nel 1787 Charles mostrò che a pressione costante il volume di un gas cambia (in proporzione alla sua temperatura. Questa dipendenza è mostrata in forma grafica in Fig. 3.3, dalla quale si può vedere che il volume di un gas è linearmente correlato alla sua temperatura In forma matematica, questa dipendenza è espressa come segue:
La legge di Carlo è spesso scritta in una forma diversa:
V1IT1 = V2T1 (2)
La legge di Charles fu migliorata da J. Gay-Lussac, che nel 1802 stabilì che il volume di un gas quando la sua temperatura cambia di 1°C cambia di 1/273 del volume che occupava a 0°C.
Quindi ne consegue che se prendiamo un volume arbitrario di qualsiasi gas a 0 ° С e a pressione costante riduciamo la sua temperatura di 273 ° С, allora il volume finale sarà uguale a zero. Ciò corrisponde a una temperatura di -273 ° C, o 0 K. Questa temperatura è chiamata zero assoluto. In realtà, non può essere raggiunto. Nella fig.
3.3 mostra come l'estrapolazione del volume del gas rispetto ai grafici della temperatura porta a volume zero a 0 K.
Lo zero assoluto è, in senso stretto, irraggiungibile. Tuttavia, in condizioni di laboratorio, è possibile raggiungere temperature che differiscono dallo zero assoluto di soli 0,001 K. A tali temperature, i movimenti casuali delle molecole praticamente cessano. Questo porta a proprietà sorprendenti.
Ad esempio, i metalli raffreddati a temperature prossime allo zero assoluto perdono quasi completamente la loro resistenza elettrica e diventano superconduttori*. Un esempio di sostanze con altre proprietà insolite alle basse temperature è l'elio.
A temperature prossime allo zero assoluto, la viscosità dell'elio scompare e diventa superfluido.* Nel 1987 sono state scoperte sostanze (ceramiche sinterizzate da ossidi di elementi lantanidi, bario e rame), che diventano superconduttrici a temperature relativamente elevate, dell'ordine di 100 K (-173°C). Questi superconduttori "ad alta temperatura" aprono grandi prospettive nella tecnologia. trad.
Il principale attrezzatura da laboratorioè il desktop su cui viene svolto tutto il lavoro sperimentale.
Ogni laboratorio deve avere una buona ventilazione. È necessaria una cappa aspirante, in cui tutto il lavoro viene eseguito utilizzando composti maleodoranti o velenosi, nonché bruciando sostanze organiche nei crogioli.
Sostanze altamente volatili, nocive o maleodoranti (bromo liquido, acido nitrico e cloridrico concentrati, ecc.)
), nonché sostanze infiammabili (bisolfuro di carbonio, etere, benzene, ecc.).
Il laboratorio necessita di impianti idraulici, fognari, corrente tecnica, gas e scaldacqua. È anche desiderabile avere una fornitura di aria compressa, una linea del vuoto, una fornitura di acqua calda e vapore.
Se non esiste un collegamento speciale, vengono utilizzati scaldabagni di vari sistemi per ottenere acqua calda.
Con questi dispositivi, riscaldati da elettricità o gas, è possibile ottenere rapidamente un getto di acqua calda con una temperatura di quasi 100°C.
Il laboratorio deve disporre di impianti per la distillazione (o demineralizzazione) dell'acqua, poiché è impossibile lavorare in laboratorio senza acqua distillata o demineralizzata. Nei casi in cui è difficile o impossibile ottenere acqua distillata, viene utilizzata acqua distillata commerciale.
In prossimità di tavoli da lavoro e lavelli per l'acqua devono essere presenti vasi di terracotta con una capacità di 10-15 litri per lo scarico di soluzioni non necessarie, reagenti, ecc., nonché cestini per vetri rotti, carta e altri rifiuti secchi.
Oltre alle scrivanie, il laboratorio dovrebbe avere una scrivania dove sono conservati tutti i quaderni e gli appunti e, se necessario, una tabella dei titoli. Ci dovrebbero essere sgabelli o sedie alti vicino ai tavoli di lavoro.
Le bilance analitiche e gli strumenti che richiedono un'installazione fissa (elettrometrica, ottica, ecc.) sono collocati in una stanza separata associata al laboratorio e per la bilancia analitica dovrebbe essere assegnata una stanza di pesatura speciale. È auspicabile che la bilancia si trovi con finestre a nord. Questo è importante perché la bilancia non deve essere esposta alla luce solare ("Bilancia e pesatura").
In laboratorio, devi anche avere i libri di riferimento, i manuali e i libri di testo più necessari, poiché spesso durante il lavoro è necessario un tono o un altro riferimento.
Guarda anche
Pagina 3
La vetreria chimica utilizzata nei laboratori può essere suddivisa in diversi gruppi. A seconda dello scopo, i piatti possono essere suddivisi in piatti generici, speciali e volumetrici. Per materiale: per piatti in vetro semplice, vetro speciale, quarzo.
Al gruppo. uso generale sono quegli elementi che dovrebbero essere sempre nei laboratori e senza i quali la maggior parte del lavoro non può essere eseguita. Si tratta di: provette, imbuti, semplici e separatori, bicchieri, beute, cristallizzatori, beute coniche (Erlenmeyer), beute di Bunsen, frigoriferi, storte, beute per acqua distillata, tee, rubinetti.
Il gruppo per scopi speciali comprende quegli articoli che vengono utilizzati per uno scopo qualsiasi, ad esempio: l'apparato Kipp, l'apparato Sok-rally, l'apparato Kjeldahl, condensatori a ricadere, palloni Wul-fa, palloni Tishchenko, picnometri, densimetri, palloni Drexel , apparato di potassio, analizzatore di anidride carbonica, palloni a fondo tondo, frigoriferi speciali, strumento di peso molecolare, strumenti di fusione e punto di ebollizione, ecc.
Gli strumenti volumetrici includono: cilindri e bicchieri graduati, pipette, burette e matracci tarati.Per cominciare, ti suggeriamo di guardare il seguente video, in cui vengono brevemente e facilmente considerati i principali tipi di vetreria chimica.
Guarda anche:
Pentole per uso generale
Le provette (Fig. 18) sono recipienti cilindrici stretti con un fondo arrotondato; sono disponibili in varie dimensioni e diametri e sono realizzati in vetro diverso. Le normali "provette da laboratorio sono realizzate in vetro a basso punto di fusione, ma per lavori speciali, quando è richiesto il riscaldamento ad alte temperature, le provette sono realizzate in vetro o quarzo ad alto punto di fusione.
Oltre ai normali, semplici tubi, vengono utilizzati anche tubi conici graduati e centrifughi.
Per riporre le provette in funzione vengono utilizzate speciali rastrelliere in legno, plastica o metallo (Fig. 19).
Riso. 18. Tubi semplici e graduati
Riso. 20. Mettere un tag di sostanze in polvere nella provetta.
Le provette vengono utilizzate principalmente per lavori analitici o microchimici. Quando si eseguono reazioni in una provetta, i reagenti non devono essere usati in quantità troppo grandi. È assolutamente inaccettabile che la provetta venga riempita fino all'orlo.
La reazione viene condotta con piccole quantità di sostanze; È sufficiente 1/4 o anche 1/8 della capacità della provetta. A volte è necessario iniettare nella provetta una sostanza solida (polveri, cristalli, ecc.).
), per questo una striscia di carta con una larghezza leggermente inferiore al diametro della provetta viene piegata a metà lungo la sua lunghezza e la quantità richiesta di solido viene versata nella paletta risultante. La provetta viene tenuta nella mano sinistra, inclinandola orizzontalmente, e la paletta viene inserita in essa quasi fino in fondo (Fig. 20).
Quindi la provetta viene posizionata verticalmente, ma anche leggermente colpita su di essa. Quando tutti i solidi sono fuoriusciti, rimuovere la paletta di carta.
Per mescolare i reagenti versati, la provetta viene trattenuta dall'estremità superiore con il pollice e l'indice della mano sinistra e sostenuta con il dito medio, e il fondo della provetta viene colpito con l'indice della mano destra. Questo è sufficiente perché il suo contenuto sia ben miscelato.
È assolutamente inaccettabile chiudere la provetta con il dito e agitarla così; in questo caso, non solo puoi introdurre qualcosa di estraneo nel liquido nella provetta, ma a volte danneggiare la pelle del dito, ustionarti, ecc.
Se la provetta è piena di liquido per più della metà, mescolare il contenuto con una bacchetta di vetro.
Se il tubo deve essere riscaldato, deve essere bloccato nel supporto.
Con un riscaldamento inetto e forte della provetta, il liquido bolle rapidamente e ne schizza fuori, quindi è necessario riscaldarlo con cura. Quando iniziano a comparire le bolle, la provetta deve essere messa da parte e, tenendola non nella fiamma del bruciatore , ma vicino o sopra, continuare a riscaldare con aria calda. Una volta riscaldata, l'estremità aperta della provetta deve essere rivolta lontano dal lavoratore e dai vicini sul tavolo.Quando non è richiesto un forte riscaldamento, è meglio immergere il tubo con il liquido riscaldato in acqua calda. Se si lavora con piccole provette (per semi-microanalisi), vengono riscaldate solo in acqua calda versata in un bicchiere di vetro della dimensione appropriata (con una capacità non superiore a 100 ml).
imbuti vengono utilizzati per versare - liquidi, per filtrare, ecc. Gli imbuti chimici sono prodotti in varie dimensioni, i loro diametri superiori sono 35, 55, 70, 100, 150, 200, 250 e 300 mm.
Gli imbuti convenzionali hanno una parete interna liscia, ma a volte vengono utilizzati imbuti con una superficie interna a coste per una filtrazione più rapida.
Gli imbuti filtranti hanno sempre un angolo di 60° e un'estremità lunga tagliata.
Durante il funzionamento, gli imbuti sono installati in uno speciale treppiede o in un anello su un normale treppiede da laboratorio (Fig. 21).
Per filtrare in un bicchiere, è utile realizzare un semplice supporto per un imbuto (Fig. 22).Per questo, una striscia di 70-80 lsh lunga e larga 20 mm viene ritagliata da un foglio di alluminio con uno spessore di circa 2 mm .
Viene praticato un foro con un diametro di 12-13 mm su una delle estremità della striscia e la striscia viene piegata come mostrato in Fig. 22, a. Come fissare l'imbuto sul vetro è mostrato in fig. 22, B.
Quando si versa del liquido in una bottiglia o in una fiaschetta, non riempire l'imbuto fino all'orlo.
Se l'imbuto si adatta perfettamente alla gola del recipiente in cui viene versato il liquido, il trasferimento diventa difficile, poiché all'interno del recipiente viene creata una pressione maggiore. Pertanto, l'imbuto deve essere sollevato di tanto in tanto.
È ancora meglio creare uno spazio tra l'imbuto e il collo della nave posizionando, ad esempio, un pezzo di carta tra di loro. In questo caso, bisogna fare attenzione che la guarnizione non entri nella nave. È più consigliabile utilizzare un triangolo di filo, che puoi realizzare da solo.Questo triangolo viene posizionato sul collo della nave e quindi viene inserito l'imbuto.
Ci sono speciali attacchi in gomma o plastica sul collo dei piatti, che assicurano la comunicazione dell'interno del pallone con l'atmosfera esterna (Fig. 23).
Riso. 21. Rafforzare l'imbuto chimico vetroso
Riso. 22. Dispositivo per il fissaggio dell'imbuto su un vetro, in un treppiede.
Per il lavoro analitico durante il filtraggio, è meglio utilizzare imbuti analitici (Fig. 24). La particolarità di questi imbuti è che hanno un'estremità tagliata allungata, il cui diametro interno è più piccolo nella parte superiore che nella parte inferiore; questo design accelera la filtrazione.
Sono inoltre presenti imbuti analitici con superficie interna nervata che sostiene il filtro e con espansione sferica nel punto in cui l'imbuto passa nel tubo. Gli imbuti di questo design accelerano il processo di filtrazione fino a tre volte rispetto agli imbuti convenzionali.
Riso. 23. Ugelli per colli di bottiglia. Riso. 24. Imbuto analitico.
Imbuti separatori(fig. 25) servono per separare liquidi immiscibili (es. acqua e olio). Sono cilindrici oa forma di pera e nella maggior parte dei casi sono dotati di un tappo di vetro.
Nella parte superiore del tubo di derivazione è presente un rubinetto smerigliato in vetro. La capacità degli imbuti separatori è diversa (da 50 ml a diversi litri), a seconda della capacità cambia anche lo spessore della parete.
Più piccola è la capacità dell'imbuto, più sottili sono le sue pareti e viceversa.
Durante il funzionamento, gli imbuti separatori vengono rinforzati in modi diversi, a seconda della capacità e della forma. L'imbuto cilindrico di piccola capacità può essere semplicemente fissato al piede. Grandi imbuti sono posti tra due anelli.
La parte inferiore dell'imbuto cilindrico dovrebbe poggiare su un anello, il cui diametro è leggermente più piccolo del diametro dell'imbuto, l'anello superiore ha un diametro leggermente maggiore.
Se l'imbuto oscilla contemporaneamente, è necessario posizionare un piatto di sughero tra l'anello e l'imbuto.
Un imbuto divisorio a forma di pera è fissato su un anello, il suo collo è fissato con una zampa. Fissare sempre prima l'imbuto e solo dopo versarvi i liquidi da separare.Gli imbuti gocciolatori (Fig. 26) differiscono dagli imbuti divisori in quanto sono più leggeri, a parete sottile e
Riso. 25. Imbuti di separazione. Riso. 26. Imbuti gocciolanti.
Nella maggior parte dei casi con una fine lunga. Questi imbuti vengono utilizzati in molti lavori, quando una sostanza viene aggiunta alla massa di reazione in piccole porzioni o goccia a goccia. Pertanto, di solito fanno parte del dispositivo. Gli imbuti sono fissati nel collo del pallone su una sezione sottile o con un tappo di sughero o gomma.
Prima di lavorare con un imbuto separatore o gocciolatore, la sezione del rubinetto in vetro deve essere accuratamente lubrificata con vaselina o grasso speciale.
Ciò consente di aprire il rubinetto facilmente e senza sforzo, il che è molto importante, poiché se il rubinetto si apre ermeticamente, può romperlo quando lo si apre o danneggiare l'intero dispositivo.
Il grasso deve essere applicato in uno strato molto sottile in modo che quando si gira la valvola, non cada nel tubo dell'imbuto o all'interno dell'apertura della valvola.
Per un flusso più uniforme di gocce di liquido dall'imbuto gocciolatore e per monitorare la portata del liquido, vengono utilizzati imbuti gocciolatori con ugello (Fig. 27). Tali imbuti hanno una parte espansa subito dopo il rubinetto, che si trasforma in un tubo. Il liquido scorre attraverso il rubinetto in questa espansione attraverso un tubo corto e poi nel tubo dell'imbuto.
Riso. 27. Imbuto di gocciolamento con ugello
Riso. 28. Bicchieri.
Riso. 29. Imbuto piatto con beccuccio
ARTICOLI IN VETRO 1 2 3
Guarda anche
Lezione 25. Legge di Boyle-Marriott - HIMI4KA

Archivio delle lezioni ›Leggi di base della chimica
Lezione 25” Legge di Boyle-Mariotte"Dal corso" Chimica per manichini»Considerare la legge relativa alla pressione e al volume del gas, nonché i grafici della dipendenza della pressione dal volume e del volume dalla pressione. Permettetemi di ricordarvi che nell'ultima lezione "Pressione del gas" abbiamo esaminato il dispositivo e il principio di funzionamento di un barometro a mercurio, e abbiamo anche dato una definizione di pressione e considerato le sue unità di misura.
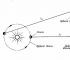
Robert Boyle(1627-1691), al quale si deve la prima definizione praticamente corretta di elemento chimico (apprendiamo nel capitolo 6), si interessò anche ai fenomeni che si verificano nei vasi con aria rarefatta.
Inventando pompe a vuoto per pompare aria da recipienti chiusi, ha richiamato l'attenzione su una proprietà familiare a tutti coloro che hanno avuto occasione di pompare una camera da calcio o di spremere con cura un pallone: più l'aria viene compressa in un recipiente chiuso, più resiste compressione.
Boyle ha chiamato questa proprietà " elasticità»Aria e l'ho misurata con un semplice dispositivo mostrato in fig. 3.2, a e b.
Boyle ha bloccato dell'aria con del mercurio all'estremità chiusa del tubo curvo (Figura 3-2, a) e poi ha spremuto quest'aria, aggiungendo gradualmente mercurio all'estremità aperta del tubo (Figura 3-2, b).
La pressione percepita dall'aria nella parte chiusa del tubo è uguale alla somma della pressione atmosferica e della pressione di una colonna di mercurio di altezza h (h è l'altezza alla quale il livello di mercurio all'estremità aperta di il tubo supera il livello di mercurio all'estremità chiusa). Le misurazioni di pressione e volume ottenute da Boyle sono mostrate nella Tabella 1. 3-1.
Sebbene Boyle non abbia adottato misure speciali per mantenere una temperatura costante del gas, sembra che nei suoi esperimenti sia cambiata solo leggermente. Tuttavia, Boyle ha notato che il calore della fiamma della candela ha causato cambiamenti significativi nelle proprietà dell'aria.
Analisi dei dati sulla pressione e sul volume dell'aria durante la sua compressione
Tabella 3-1, che contiene i dati sperimentali di Boyle sulla relazione tra pressione e volume per l'aria atmosferica, si trova sotto lo spoiler.
Dopo che il ricercatore riceve dati simili a quelli mostrati in tabella. 3-1, cerca di trovare un'equazione matematica che metta in relazione le due quantità dipendenti che ha misurato.
Un modo per ottenere tale equazione è tracciare graficamente la dipendenza di vari gradi di una quantità da un'altra, nella speranza di ottenere un grafico a linee rette.
L'equazione generale di una retta è:
dove xey sono variabili correlate e aeb sono numeri costanti. Se b è zero, una retta passa per l'origine.
Nella fig. 3-3 mostrano diversi modi di rappresentare graficamente i dati per la pressione P e il volume V, mostrati nella tabella. 3-1.I grafici di P contro 1 / K e V contro 1 / P sono linee rette che passano per l'origine.
Anche il grafico della dipendenza del logaritmo di P dal logaritmo di V è una linea retta con pendenza negativa, la cui tangente dell'angolo è - 1. Tutti e tre questi grafici portano a equazioni equivalenti:
- P = a / V (3-3a)
- V = a/P (3-3b)
- lg V = lg a - lg P (3-3v)
Ognuna di queste equazioni rappresenta una delle opzioni Legge di Boyle-Mariotte, che di solito è così formulato: per un dato numero di moli di gas, la sua pressione è proporzionale al volume, purché la temperatura del gas rimanga costante.
A proposito, probabilmente ti starai chiedendo perché la legge Boyle-Mariotte sia chiamata con un doppio nome. Ciò accadde perché questa legge, indipendentemente da Robert Boyle, che la scoprì nel 1662, fu riscoperta da Edm Mariotte nel 1676. Quindi è così.
Quando la relazione tra due grandezze misurate è semplice nella misura in cui lo è in questo caso, può essere stabilita anche numericamente.
Se ogni valore di pressione P viene moltiplicato per il corrispondente valore di volume V, è facile assicurarsi che tutti i prodotti per un dato campione di gas a temperatura costante siano approssimativamente gli stessi (vedi Tabella 3-1). Quindi, possiamo scrivere che
L'equazione (З-Зг) descrive la relazione iperbolica tra i valori di P e V (vedi Fig. 3-3, a). Per verificare che il grafico della dipendenza di P su V costruito dai dati sperimentali corrisponda realmente all'iperbole, costruiremo un grafico aggiuntivo della dipendenza del prodotto PV su P e ci assicureremo che sia una retta orizzontale (vedi Fig. 3-3, e) ...
Boyle ha scoperto che per una data quantità di qualsiasi gas a temperatura costante, la relazione tra la pressione P e il volume V è descritta in modo abbastanza soddisfacente dalla relazione
- P V = const (a T e n costanti) (3-4)
Formula Boyle-Mariotte
Per confrontare volumi e pressioni dello stesso campione di gas in condizioni diverse (ma temperatura costante), è conveniente rappresentare Legge di Boyle-Mariotte nella seguente formula:
dove gli indici 1 e 2 corrispondono a due diverse condizioni.
Esempio 4. I sacchetti di plastica con gli alimenti consegnati all'altopiano del Colorado (vedi esempio 3) spesso scoppiano, perché l'aria al loro interno, quando si sale dal livello del mare a un'altitudine di 2500 m, in condizioni di pressione atmosferica ridotta, si espande.
Se assumiamo che ci siano 100 cm3 di aria all'interno del sacco alla pressione atmosferica corrispondente al livello del mare, quanto volume dovrebbe occupare quest'aria alla stessa temperatura sull'altopiano del Colorado? (Si supponga che le buste termoretraibili siano utilizzate per consegnare prodotti che non limitano l'espansione dell'aria; i dati mancanti dovrebbero essere presi dall'Esempio 3.)Soluzione
Usiamo la legge di Boyle sotto forma di equazione (3-5), dove l'indice 1 si riferirà alle condizioni al livello del mare e l'indice 2 - alle condizioni a un'altitudine di 2500 m sul livello del mare. Quindi 1 = 1.000 atm, V1 = 100 cm3, Р2 = 0,750 atm e V2. Così,
Lo studio della relazione tra i parametri che caratterizzano lo stato di una data massa di gas, iniziamo con lo studio dei processi del gas che si verificano quando uno dei parametri rimane invariato. scienziato inglese Boyle(nel 1669) e uno scienziato francese Marriott(nel 1676) scoprì una legge che esprime la dipendenza di una variazione di pressione da una variazione del volume di gas a temperatura costante. Eseguiamo il seguente esperimento.
Ruotando la maniglia, modificheremo il volume di gas (aria) nel cilindro A (Fig. 11, a). In base alla lettura del manometro, notiamo che cambia anche la pressione del gas. Cambieremo il volume di gas nella nave (il volume è determinato sulla scala B) e, notando la pressione, li annoteremo nella tabella. 1. Si può vedere da esso che il prodotto del volume del gas per la sua pressione era quasi costante: quante volte "il volume del gas è diminuito, la sua pressione è aumentata della stessa quantità.

Come risultato di esperimenti simili, più accurati, è stato scoperto: per una data massa di gas a temperatura costante, la pressione del gas cambia in proporzione inversa alla variazione del volume del gas. Questa è la formulazione della legge Boyle-Mariotte. Matematicamente, sarà scritto per due stati come segue:
![]()
Il processo di cambiamento di stato di un gas a temperatura costante è chiamato isotermico. La formula di Boyle-Mariotte è l'equazione per lo stato isotermico di un gas. A temperatura costante, la velocità media di movimento delle molecole non cambia. Un cambiamento nel volume del gas provoca un cambiamento nel numero di impatti delle molecole sulle pareti della nave. Questo è il motivo della variazione della pressione del gas.
Rappresentiamo graficamente questo processo, ad esempio, per il caso V = 12 litri, p = 1 a.... Tracciamo il volume del gas sull'asse delle ascisse e la sua pressione sull'asse delle ordinate (Fig. 11, b). Troviamo i punti corrispondenti a ciascuna coppia di valori di V e p e, collegandoli insieme, otteniamo un grafico del processo isotermico. La linea che mostra la relazione tra il volume e la pressione di un gas a temperatura costante è chiamata isoterma. Non si verificano processi isotermici puri. Ma non è raro che la temperatura del gas cambi poco, ad esempio quando il compressore pompa aria nei cilindri, quando la miscela combustibile viene iniettata nel cilindro di un motore a combustione interna. In tali casi, il volume e la pressione del gas sono calcolati secondo la legge di Boyle-Mariotte *.