보일리 마리오뜨 법칙이 적용되는 곳. 가스법
보일-마리오트 법칙은 다음과 같다.
수학적 형태로이 진술은 공식의 형태로 작성됩니다.
어디 - 가스 압력; - 가스 부피, 및 - 합의된 조건에서 일정한 값. 일반적으로 값 가스의 화학적 성질, 질량 및 온도에 의해 결정됩니다.
분명히 인덱스라면 1 기체의 초기 상태와 관련된 양을 나타내고 아래 첨자 2 - 최종까지 주어진 수식은 다음 형식으로 작성할 수 있습니다.
.
위와 위의 공식에서 등온 과정에서 부피에 대한 가스 압력 의존성의 형태는 다음과 같습니다.
이 의존성은 보일-마리오트 법칙의 내용에 대한 첫 번째 표현과 동등한 또 다른 것입니다. 그 의미
일정한 온도에서 기체 덩어리의 압력은 부피에 반비례합니다.
그러면 등온 과정에 참여하는 기체의 초기 상태와 최종 상태 사이의 관계는 다음과 같이 표현될 수 있습니다.
이것과 기체의 초기 및 최종 압력과 부피를 연결하는 상기 공식의 적용 가능성은 등온 과정의 경우에만 제한되지 않는다는 점에 유의해야 합니다. 공식은 프로세스 중에 온도가 변하는 경우에도 유효하지만 프로세스의 결과로 최종 온도는 초기 온도와 동일하게 나타납니다.
이 법칙은 문제의 가스가 이상적이라고 간주될 수 있는 경우에만 유효하다는 것을 명확히 하는 것이 중요합니다. 특히, 보일-마리오트 법칙은 희박 가스와 관련하여 높은 정확도로 충족됩니다. 가스가 강하게 압축되면 이 법칙에서 상당한 편차가 관찰됩니다.
결과
보일의 법칙 - Mariotte는 등온 과정에서 기체의 압력은 기체가 차지하는 부피에 반비례한다고 말합니다. 기체의 밀도도 기체가 차지하는 부피에 반비례한다는 점을 고려하면 다음과 같은 결론에 도달합니다.
등온 과정에서 기체 압력은 밀도에 정비례하여 변합니다.
따라서 우리는 다음과 같은 결론에 도달합니다.
이상 기체의 압축률 등온 계수는 압력의 역수와 같습니다.
또한보십시오
보일의 법칙 - Mariotte에 대한 리뷰 쓰기
메모(편집)
- 페트루셰프스키 F.F.// Brockhaus와 Efron의 백과사전
- // 물리적 백과사전 / Ch. 에드. 오전 프로호로프. - M .: 소련 백과사전, 1988 .-- T. 1. - S. 221-222. - 704쪽 - 100,000부
- 시부킨 D.V.물리학의 일반 과정. - M .: Fizmatlit, 2005. - T. II. 열역학 및 분자 물리학. - S. 21-22. - 544쪽 - ISBN 5-9221-0601-5.
- 물리학의 초등 교과서 / Ed. G. S. Landsberg. - M .: 과학, 1985. - T. I. 역학. 열. 분자 물리학. - S. 430 .-- 608 p.
- 키코인 A.K., 키코인 I.K.분자 물리학. - M .: Nauka, 1976 .-- S. 35-36.
- 일정한 질량에서.
- 리브쉬츠 L.D.// 물리적 백과사전 / Ch. 에드. 오전 프로호로프. - M .: Big Russian Encyclopedia, 1994 .-- T. 4. - S. 492-493. - 704쪽 - 40,000부 - ISBN 5-85270-087-8.
문학
- 페트루셰프스키 F.F.// Brockhaus와 Efron의 백과사전: 86권(82권 및 4권 추가). - SPb. , 1890-1907.
보일의 법칙에서 발췌 - 마리오트
"그녀가 바로 그 여자야." 거친 여성의 목소리가 응답으로 들렸고, 그 후 Marya Dmitrievna가 방에 들어왔습니다.맏이를 제외한 모든 젊은 숙녀들과 심지어 숙녀들이 일어섰다. Marya Dmitrievna는 출입구에서 멈춰 섰고, 그녀의 뚱뚱한 몸의 높이에서 회색 곱슬 머리로 50세의 머리를 높이 들고 손님들을 바라보았고, 마치 말리는 것처럼 서두르지 않고 그녀의 드레스의 넓은 소매를 곧게 펴었습니다. Marya Dmitrievna는 항상 러시아어를 사용했습니다.
그녀는 다른 모든 소리를 압도하는 크고 두꺼운 목소리로 "아이들과 함께 하는 친애하는 생일 소녀"라고 말했습니다. 그녀는 손에 입맞춤을 하고 있던 백작을 바라보며 말했다. 개를 쫓아갈 곳이 없습니까? 그러나 아버지, 어떻게해야합니까, 이것이이 새들이 자라는 방식입니다 ... - 그녀는 소녀들을 가리 켰습니다. - 원하든 원하지 않든 구혼자를 찾아야 한다.
- 뭐, 내 Cossack? (Marya Dmitrievna는 Natasha를 Cossack이라고 불렀습니다) - 그녀는 두려움없이 쾌활하게 그녀의 손에 접근 한 Natasha를 손으로 애무하면서 말했습니다. - 나는 그 물약이 여자라는 것을 알고 있지만 나는 그것을 사랑한다.
그녀는 거대한 조준경에서 배가 달린 요트 귀걸이를 꺼내 생일에 빛나고 얼굴을 붉히는 나타샤에게 주었고 즉시 그녀에게서 등을 돌리고 피에르로 향했습니다.
- 어, 어! 친절한! 이리와.” 그녀는 낮고 가느다란 목소리로 가장했다. - 어서, 내 사랑 ...
그리고 그녀는 불길하게 소매를 더 높이 걷어 올렸습니다.
피에르는 안경 너머로 천진난만하게 그녀를 바라보며 다가갔다.
- 이리와, 이리와! 나는 당신의 아버지가 사건에 처했을 때 진실만을 말했고 하나님이 당신에게 명령하셨습니다.
그녀는 잠시 멈췄다. 무슨 일이 일어날지 예상하고 서문만 있을 거라 생각하며 모두 침묵했다.
- 좋아, 할 말이 없어! 좋은 소년! ... 아버지는 침대에 누워 자신을 즐겁게하고 말을 타고 곰에게 분기별을 둡니다. 부끄러워, 아버지, 부끄러워! 그가 전쟁에 나가면 더 좋을 것입니다.
그녀는 고개를 돌려 웃음을 참을 수 없는 백작에게 손을 내밀었다.
- 그럼, 테이블에 차를 마실 시간이 되었나요? - Marya Dmitrievna가 말했습니다.
카운트는 Marya Dmitrievna와 함께 진행되었습니다. 그런 다음 Nikolai가 연대를 따라 잡아야했던 올바른 사람 인 hussar 대령이 이끄는 백작 부인. Anna Mikhailovna - Shinshin과 함께. 버그는 베라에게 손을 내밀었다. 웃고 있는 Julie Karagina는 Nikolai와 함께 테이블에 갔습니다. 다른 커플들이 복도를 가로질러 기지개를 켰고, 그들 뒤에는 아이들, 가정교사, 가정교사가 하나씩 따라왔습니다. 웨이터는 요동치고 의자는 덜거덕거리고 합창단에서는 음악이 흘러나오고 손님들은 자리에 앉았습니다. 백작의 홈 음악 소리는 나이프와 포크 소리, 손님들이 말하는 소리, 웨이터의 조용한 발걸음 소리로 바뀌었습니다.
백작 부인은 테이블의 한쪽 끝에 앉았습니다. 오른쪽에는 Marya Dmitrievna가 있고 왼쪽에는 Anna Mikhailovna와 다른 손님들이 있습니다. 반대편 끝에는 백작이, 왼쪽에는 후사르 대령이, 오른쪽에는 신신과 다른 남성 손님들이 앉아 있었다. 긴 테이블의 한쪽에는 나이든 젊은이들이 있습니다. Berg 옆에는 Vera, Boris 옆에는 Pierre가 있습니다. 반면에 어린이, 교사 및 가정교사. 수정, 병, 과일 그릇 뒤에서 백작은 아내와 파란 리본이 달린 높은 모자를보고 자신을 잊지 않고 이웃에게 부지런히 포도주를 부었습니다. 백작부인도 파인애플 때문에 안주인의 의무를 잊지 않고 대머리와 얼굴이 그녀에게 붉게 보였고 흰머리와 더 뚜렷하게 다른 남편을 빤히 쳐다 보았습니다. 숙녀 쪽에서 심지어 옹알이가있었습니다. 남자의 목소리는 점점 더 크게 들렸고, 특히 너무 많이 먹고 마신 후사르 대령은 점점 더 얼굴을 붉히며 백작이 이미 그를 다른 손님에게 본보기로 삼고 있었다. Berg는 사랑은 지상의 감정이 아니라 하늘의 감정이라고 부드러운 미소로 Vera와 이야기했습니다. 보리스는 그의 새 친구 피에르를 테이블의 손님이라고 부르고 맞은편에 앉아 있던 나타샤와 시선을 교환했다. 피에르는 말을 거의 하지 않고 새로운 얼굴을 바라보며 많이 먹었습니다. 라토르튀(거북껍데기)와 쿨레뱌키를 고른 두 가지 수프와 헤이즐 그라우스를 시작으로 집사는 병에 담긴 이웃의 어깨에서 신비롭게 찔러 넣은 요리나 와인 한 개도 놓치지 않았다. 냅킨에 싸서 "마데이라, 헝가리, 라인을 드레이합니다. 그는 네 개의 크리스탈 잔 중 첫 번째 잔을 각 기기 앞에 서 있는 백작의 모노그램으로 대체하고, 점점 더 기분 좋은 공기로 손님을 바라보며 즐겁게 술을 마셨다. 맞은편에 앉아 있던 나타샤는 보리스를 13세 소녀처럼 바라보며 처음으로 키스를 하고 사랑에 빠진 소년을 바라보았다. 그녀의 바로 그 시선은 때때로 피에르를 향했고, 이 웃기고 활기찬 소녀의 시선 아래 그는 이유도 모른 채 혼자 웃고 싶었습니다.
Nikolay는 Sonya에서 멀리 떨어진 Julie Karagina 옆에 앉아 있었고, 다시 같은 무의식적인 미소를 지으며 그녀에게 이야기하고 있었습니다. Sonya는 의례적으로 미소 지었지만 분명히 질투로 괴로워했습니다. 그녀는 창백해지고 얼굴이 붉어졌으며 Nikolai와 Julie가 그들 사이에서 말하는 것을 온 힘을 다해 들었습니다. 여교사는 혹시라도 아이들의 기분을 상하게 하는 사람이 있을까 하는 생각에 거절을 준비하는 것처럼 불안하게 주위를 둘러보았다. 독일 총독은 독일에 있는 가족들에게 보내는 편지에서 모든 것을 자세히 설명하기 위해 온갖 음식과 디저트, 와인을 외우려 했고, 집사가 병을 냅킨에 싸서 들고 다니는 것이 매우 불쾌했습니다. 독일인은 인상을 찌푸리며 이 와인을 받고 싶지 않은 척 하려고 했지만 탐욕이 아니라 양심적인 호기심에서 갈증을 풀기 위해 와인이 필요하다는 것을 아무도 이해하고 싶지 않았기 때문에 기분이 상했습니다.
테이블의 남자 쪽 끝에서 대화는 점점 더 활발해졌습니다. 대령은 이미 선전포고 선언문이 상트페테르부르크에서 출판되었고, 자신이 본 사본이 이제 택배를 통해 총사령관에게 전달되었다고 말했다.
22. 보일-마리오트의 법칙
이상기체 법칙 중 하나는 보일-마리오트의 법칙,압력의 곱 NS볼륨으로 V일정한 기체 질량과 온도에서 기체. 이 평등을 등온 방정식... 등온선은 쌍곡선의 형태로 가스 상태의 PV-다이어그램에 표시되며 가스 온도에 따라 하나 또는 다른 위치를 차지합니다. 에서 진행되는 프로세스 NS= const가 호출됨 등온.가스 NS= const는 내부 에너지가 일정합니다. U. 기체가 등온적으로 팽창하면 모든 열이 작용합니다. 기체가 하는 일은 등온적으로 팽창하여 그것을 수행하기 위해 기체에 전달되어야 하는 열의 양과 같습니다.
dА= dQ= PDV,
어디서 d NS- 초등 작업;
dV-기본 볼륨;
NS- 압력. V 1> V 2 및 P 1인 경우< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие NS= const가 충족되면 압력과 부피의 변화를 무한히 느린 것으로 간주할 필요가 있습니다. 또한 가스가 있는 매체에 대한 요구 사항이 있습니다. 즉, 열용량이 충분히 높아야 합니다. 계산 공식은 시스템에 열 에너지를 공급하는 경우에도 적합합니다. 압축성기체는 압력이 변할 때 부피가 변하는 성질이라고 합니다. 모든 물질에는 압축 계수,다음과 같습니다.
c = 1 / VО (dV / CP) T,
여기서 도함수는 다음에서 취합니다. NS= 상수
압축률 계수는 압력 변화에 따른 부피 변화를 특성화하기 위해 도입되었습니다. 이상 기체의 경우 다음과 같습니다.
c = -1 / NS.
SI에서 압축률 계수는 [c] = m 2 / N 차원입니다.
이 텍스트는 소개 부분입니다.정확한 과학으로서의 창의성 책에서 [창의적 문제 해결 이론] 저자 알트슐러 겐릭 사울로비치1. 시스템 부분의 완전성의 법칙 기술 시스템의 근본적인 생존을 위한 필요 조건은 시스템의 주요 부분의 존재와 최소 성능입니다. 각 기술 시스템에는 엔진,
책 인터페이스: 컴퓨터 시스템 설계의 새로운 방향에서 저자 러스킨 제프2. 시스템의 "에너지 전도도" 법칙 기술 시스템의 기본적인 생존을 위한 필요 조건은 시스템의 모든 부분을 통한 에너지의 통과입니다. 모든 기술 시스템은 에너지 변환기입니다. 따라서 명백한
책에서 저자 바바예프 MA6. 상위 시스템으로의 전환 법칙 개발 가능성이 소진 된 시스템은 상위 시스템의 일부로 상위 시스템에 포함됩니다. 이 경우 수퍼 시스템 수준에서 추가 개발이 발생합니다. 우리는 이미 이 법에 대해 이야기했습니다. "역학"으로 넘어 갑시다. 반영하는 법률을 포함합니다.
책에서 열 엔지니어 저자 부르카노바 나탈리아7. 거시적 수준에서 미시적 수준으로의 전환 법칙 시스템의 작업 기관 개발은 먼저 거시적 수준으로 진행되고 그 다음 미시적 수준으로 진행됩니다. 대부분의 현대 기술 시스템에서 작업 본체는 항공기 프로펠러, 자동차 바퀴, 절단기와 같은 "철 조각"입니다.
모두를 위한 전산 언어학: 신화에서. 알고리즘. 언어 저자 아니시모프 아나톨리 바실리에비치8. su-field의 정도를 높이는 법칙 기술 시스템의 발달은 su-field의 정도를 높이는 방향으로 진행된다. 이 법칙의 의미는 non-field 시스템이 su-field가 되는 경향이 있고, su-field 시스템에서 개발이 방향으로 진행된다는 것입니다.
The Phenomenon of Science [Cybernetic Approach to Evolution] 책에서 저자 투르친 발렌틴 페도로비치 책에서 나노기술 [과학, 혁신 및 기회] 포스터 린4.4.1. Fitts의 법칙 커서를 화면의 버튼으로 이동한다고 상상해 보십시오. 버튼은 이 움직임의 대상입니다. 커서의 시작 위치와 목표의 가장 가까운 점을 연결하는 직선의 길이는 Fitts의 법칙에서 거리로 정의됩니다. 에
뛰어난 발견 및 발명의 역사(전기 공학, 전력 공학, 무선 전자) 책에서 저자 슈나이베르크 얀 아브라모비치4.4.2. 힉스의 법칙 커서를 대상으로 이동하거나 여러 옵션 집합에서 다른 작업을 수행하기 전에 사용자는 이 개체 또는 작업을 선택해야 합니다. 힉스의 법칙(Hick's Law)은 n개의 선택지 중 하나를 선택해야 할 때 선택하는 시간을 말한다.
작가의 책에서9. 포아송 및 가우스 분포 법칙 포아송의 법칙. 그것의 다른 이름은 희귀 사건의 ra-definition의 법칙입니다. Poisson의 법칙(Z.P)은 가능성이 희박한 경우에 적용되므로 B/Z/R의 사용이 비실용적입니다. 법칙의 장점은 다음과 같습니다.
작가의 책에서23. Gay-Lussac의 법칙 Gay-Lussac의 법칙은 다음과 같이 말한다: 일정한 기체 압력과 질량에서 기체의 부피와 온도의 비율은 일정하다 V / T = m / MO R / P = const at P = const, m = const. 이 등식은 isobar 방정식의 이름입니다. isobar는 직선의 PV-다이어그램에 표시되며,
작가의 책에서24. 샤를의 법칙 샤를의 법칙은 기체의 부피와 질량이 변하지 않는 경우 온도에 대한 기체 압력의 비율은 일정하다고 명시합니다. P / T = m / MO R / V = V = const, m =에서 const const. 이 등식을 isochore 방정식이라고 합니다.Isochora는 P 축에 평행한 직선으로 PV-다이어그램에 표시됩니다.
작가의 책에서30. 에너지 보존과 변환의 법칙 열역학 제1법칙은 에너지는 생성되지 않고 사라지지 않는다는 보편적인 에너지 보존 및 변환 법칙에 기초하고 있으며, 열역학적 과정에 참여하는 물체는 서로 상호작용한다.
작가의 책에서TSAREVNA-FROG와 안정성 법칙 앞에서 이미 강조했듯이(추상 법칙) 원시적 사고는 구체적인 현상을 능숙하게 분석하고 새로운 추상 시스템을 합성합니다. 의식에 의해 구성되는 모든 대상은 살아 있는 것으로 지각되고 살아 있는 것으로 지각되기 때문에
작가의 책에서1.1. 진화의 기본 법칙 우리가 아는 한, 생명체가 진화하는 과정에서 생명체의 총량은 항상 증가하고 있으며 그 구성은 복잡합니다. 생물학적 형성의 조직을 복잡하게 만드는 자연은 샘플 및
작가의 책에서4.2. 무어의 법칙 가장 단순한 형태로 무어의 법칙은 트랜지스터 회로의 배선 밀도가 18개월마다 2배가 된다는 것으로 요약됩니다. 이 법의 저자는 잘 알려진 Intel 회사인 Gordon Moore의 창립자 중 한 사람에게 귀속됩니다. 엄밀히 말하면,
정의
기체 상태의 매개변수 중 하나가 일정하게 유지되는 과정을 아이소프로세스.
정의
가스법이상 기체의 등공정을 설명하는 법칙입니다.
기체 법칙은 실험적으로 발견되었지만 모두 Mendeleev-Clapeyron 방정식에서 얻을 수 있습니다.
각각을 고려해 보겠습니다.
보일-마리오트의 법칙(등온 과정)
등온 과정온도가 일정하게 유지되는 기체 상태의 변화라고 합니다.
일정한 온도에서 일정한 질량의 기체에 대해 기체 압력과 부피의 곱은 일정한 값입니다.
동일한 법칙을 다른 형태로 다시 작성할 수 있습니다(이상 기체의 두 가지 상태에 대해).
이 법칙은 Mendeleev-Clapeyron 방정식을 따릅니다.
![]()
분명히, 일정한 기체 질량과 일정한 온도에서 방정식의 오른쪽은 일정하게 유지됩니다.
일정한 온도에서 가스 매개 변수의 의존성 그래프를 호출합니다. 등온선.
상수를 문자로 표시하면 등온 과정에서 부피에 대한 압력의 기능적 의존성을 기록합니다.
기체의 압력은 부피에 반비례한다는 것을 알 수 있습니다. 역비례 그래프, 그리고 결과적으로, 좌표의 등온선 그래프는 쌍곡선입니다.(그림 1, a). 그림 1 b) 및 c)는 각각 좌표 및 등온선을 보여줍니다.

그림 1. 다양한 좌표에서의 등온 과정 그래프
게이 루삭의 법칙(등압 과정)
등압 공정압력이 일정하게 유지되는 기체 상태의 변화라고 합니다.
일정한 압력에서 일정한 질량의 기체에 대해 온도에 대한 기체 부피의 비율은 다음과 같이 일정한 값입니다.
이 법칙은 Mendeleev-Clapeyron 방정식에서도 따릅니다.
![]()
등압선.
압력 및 제목 = "(! LANG: QuickLaTeX.com에서 렌더링됨" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
좌표로 그래프의 형태를 정의하자 상수를 문자로 표시하면 등압 과정에서 온도에 대한 부피의 기능적 의존성을 기록합니다.
일정한 압력에서 기체의 부피는 온도에 정비례함을 알 수 있습니다. 직접 비례 그래프, 그리고 결과적으로, 좌표의 등압선 플롯은 원점을 통과하는 직선입니다.(그림 2, c). 실제로, 충분히 낮은 온도에서 모든 기체는 기체 법칙이 더 이상 적용되지 않는 액체로 변합니다. 따라서 좌표의 원점 근처에서 그림 2, c)의 등압선은 점선으로 표시됩니다.

그림 2. 다양한 좌표에서 등압 과정의 그래프
샤를의 법칙(등변성 과정)
등변성 과정부피가 일정하게 유지되는 기체 상태의 변화라고 합니다.
일정한 부피의 일정한 기체의 경우 온도에 대한 기체 압력의 비율은 일정한 값입니다.
두 가지 기체 상태에 대해 이 법칙은 다음 형식으로 작성됩니다.
이 법칙은 Mendeleev - Clapeyron 방정식에서도 얻을 수 있습니다.
![]()
일정한 압력에서 가스 매개 변수의 의존성 그래프를 호출합니다 아이소코어.
볼륨 및 제목 = "(! LANG: QuickLaTeX.com에서 렌더링됨" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
좌표에서 등변성 과정의 그래프 유형을 결정하기 위해 Charles의 법칙에서 상수를 문자로 표시하면 다음을 얻습니다.
따라서 일정한 부피에서 온도에 대한 압력의 기능적 의존성은 정비례하며 이러한 의존성의 그래프는 원점을 통과하는 직선입니다(그림 3, c).

그림 3. 다양한 좌표에서 등코릭 프로세스의 그래프
문제 해결의 예
실시예 1
| 연습 | 기체의 부피가 1/4로 감소하려면 초기 온도의 특정 질량의 기체를 등압 냉각해야 하는 온도는 얼마입니까? |
| 해결책 | 등압 과정은 Gay-Lussac 법칙에 의해 설명됩니다. 문제의 조건에 따라 등압 냉각으로 인한 가스 부피는 1/4로 감소하므로 다음과 같습니다. 최종 가스 온도: 단위를 SI 시스템으로 변환합시다: 초기 가스 온도. 계산해보자:
|
| 답변 | 가스는 온도까지 냉각되어야 합니다. |
실시예 2
| 연습 | 밀폐된 용기에는 200kPa 압력의 가스가 들어 있습니다. 온도가 30% 증가하면 가스 압력은 어떻게 됩니까? |
| 해결책 | 가스가 담긴 용기가 닫혀 있기 때문에 가스의 부피는 변하지 않습니다. isochoric 과정은 Charles의 법칙으로 설명됩니다. 문제의 조건에 따라 가스 온도가 30% 증가하므로 다음과 같이 쓸 수 있습니다. Charles의 법칙에서 마지막 비율을 대입하면 다음을 얻습니다. 단위를 SI 시스템으로 변환합시다: 초기 가스 압력 kPa = Pa. 계산해보자: |
| 답변 | 가스 압력은 260kPa가 됩니다. |
실시예 3
| 연습 | 항공기에 장착된 산소 시스템에는 다음이 포함됩니다. |
| 해결책 | 등온 과정은 보일-마리오트 법칙으로 설명됩니다. |
보일의 법칙 - 마리오트
보일의 법칙 - 마리오트 1662년 Robert Boyle에 의해 발견되고 1676년 Edm Mariotte에 의해 독립적으로 재발견된 기본 기체 법칙 중 하나입니다. 등온 과정에서 기체의 거동을 설명합니다. 법칙은 Clapeyron 방정식의 결과입니다.
- 1 제형
- 2 결과
- 3 참조
- 4 노트
- 5 문학
문구
보일-마리오트 법칙은 다음과 같다.
일정한 온도와 기체의 질량에서 기체의 압력과 부피의 곱은 일정하다.
수학적 형태로이 진술은 공식의 형태로 작성됩니다.
가스 압력은 어디에 있습니까? 는 기체의 부피이며 합의된 조건에서 일정한 값입니다. 일반적으로 값은 가스의 화학적 성질, 질량 및 온도에 따라 결정됩니다.
분명히 아래 첨자 1이 가스의 초기 상태와 관련된 양을 나타내고 아래 첨자 2-최종 상태와 관련된 양을 나타내는 경우 위의 공식은 다음 형식으로 작성할 수 있습니다
.
위와 위의 공식에서 등온 과정에서 부피에 대한 가스 압력 의존성의 형태는 다음과 같습니다.
이 의존성은 보일-마리오트 법칙의 내용에 대한 첫 번째 표현과 동등한 또 다른 것입니다. 그 의미
일정한 온도에서 기체 덩어리의 압력은 부피에 반비례합니다.
그러면 등온 과정에 참여하는 기체의 초기 상태와 최종 상태 사이의 관계는 다음과 같이 표현될 수 있습니다.
이것과 기체의 초기 및 최종 압력과 부피를 연결하는 상기 공식의 적용 가능성은 등온 과정의 경우에만 제한되지 않는다는 점에 유의해야 합니다. 공식은 프로세스 중에 온도가 변하는 경우에도 유효하지만 프로세스의 결과로 최종 온도는 초기 온도와 동일하게 나타납니다.
이 법칙은 문제의 가스가 이상적이라고 간주될 수 있는 경우에만 유효하다는 것을 명확히 하는 것이 중요합니다. 특히, 보일-마리오트 법칙은 희박 가스와 관련하여 높은 정확도로 충족됩니다. 가스가 강하게 압축되면 이 법칙에서 상당한 편차가 관찰됩니다.
보일의 법칙 - Mariotte, Charles의 법칙 및 Gay-Lussac의 법칙은 Avogadro의 법칙으로 보완되어 이상 기체의 상태 방정식을 얻는 데 충분한 기초가 됩니다.
결과
보일의 법칙 - Mariotte는 등온 과정에서 기체의 압력은 기체가 차지하는 부피에 반비례한다고 말합니다. 기체의 밀도도 기체가 차지하는 부피에 반비례한다는 점을 고려하면 다음과 같은 결론에 도달합니다.
등온 과정에서 기체 압력은 밀도에 정비례하여 변합니다.
압축성, 즉 압력의 영향으로 기체가 부피를 변화시키는 능력은 압축성 계수로 특징지어지는 것으로 알려져 있습니다. 등온 과정의 경우 등온 압축 계수에 대해 말하며 이는 다음 공식에 의해 결정됩니다.
여기서 첨자 T는 편미분이 일정한 온도에서 취함을 의미합니다. 보일-마리오트 법칙의 압력과 부피 관계에 대한 식을 이 공식에 대입하면 다음을 얻습니다.따라서 우리는 다음과 같은 결론에 도달합니다.
이상 기체의 압축률 등온 계수는 압력의 역수와 같습니다.
또한보십시오
- 게이 루삭의 법칙
- 찰스 법칙
- 아보가드로의 법칙
- 이상기체
- 이상 기체 상태 방정식
메모(편집)
- 보일 - 마리오트의 법칙 // 물리 백과사전 / Ch. 에드. 오전 프로호로프. - M .: 소련 백과사전, 1988 .-- T. 1. - S. 221-222. - 704쪽 - 100,000부
- Sivukhin D.V. 일반 물리학 과정. - M .: Fizmatlit, 2005. - T. II. 열역학 및 분자 물리학. - S. 21-22. - 544쪽 - ISBN 5-9221-0601-5.
- 1 2 물리학의 초등 교과서 / Ed. G. S. Landsberg. - M .: Nauka, 1985. - T.I. 역학. 열. 분자 물리학. - S. 430 .-- 608 p.
- 1 2 3 Kikoin A.K., Kikoin I.K., 분자 물리학. - M .: Nauka, 1976 .-- S. 35-36.
- 일정한 질량에서.
- Livshits L. D. 압축성 // 물리적 백과사전 / Ch. 에드. 오전 프로호로프. - M .: Great Russian Encyclopedia, 1994 .-- T. 4. - S. 492-493. - 704쪽 - 40,000부
ISBN 5-85270-087-8.
문학
- Petrushevsky F.F. Boyle-Mariotte 법칙 // Brockhaus와 Efron 백과사전: 86권(82권 및 4권 추가). - SPb., 1890-1907.
보일의 법칙 - 메리어트 정보
보일의 법칙 - 마리오트
보일의 법칙 - 마리오트
보일의 법칙 - 마리오트당신은 주제를 탐색하고 있습니다
보일의 법칙 - Mariotte what, Boyle의 법칙 - Mariotte who, Boyle의 법칙 - Mariotte 설명
이 기사 및 비디오에 대한 wikipedia에서 발췌한 내용이 있습니다.
당사 사이트에는 검색 엔진 기능의 시스템이 있습니다. 위: "무엇을 찾고 계셨습니까?" 상자를 사용하여 시스템의 모든 것을 쿼리할 수 있습니다. 가장 정확하고 최신 정보를 제공하기 위해 준비한 간단하고 세련되며 빠른 검색 엔진에 오신 것을 환영합니다.
귀하를 위해 설계된 검색 엔진은 단순한 디자인과 빠른 작동 시스템으로 가장 관련성이 높고 정확한 정보를 제공합니다. 사이트에서 찾고 있는 거의 모든 정보를 찾을 수 있습니다.
현재 영어, 터키어, 러시아어, 우크라이나어, 카자흐어 및 벨로루시어로만 서비스를 제공합니다.
새로운 언어가 곧 시스템에 추가됩니다.
유명인의 삶은 정치인, 공무원, 의사, 웹사이트, 식물, 기술 차량, 자동차 등과 같은 수백 가지 주제에 대한 정보, 이미지 및 비디오를 제공합니다.
보일-마리오트 법칙

기체의 부피와 압력 사이의 양적 관계는 1662년 Robert Boyle에 의해 처음 확립되었습니다. * Boyle-Mariotte의 법칙에 따르면 일정한 온도에서 기체의 부피는 압력에 반비례합니다.
이 법칙은 고정된 양의 가스에 적용됩니다. 그림에서 볼 수 있듯이 3.2, 그래픽 표현이 다를 수 있습니다. 왼쪽 그래프는 저압에서 일정량의 기체의 부피가 크다는 것을 보여줍니다.
기체의 부피는 압력이 증가함에 따라 감소합니다. 수학적으로는 다음과 같이 작성됩니다.
그러나 일반적으로 Boyle-Mariotte 법칙은 다음 형식으로 작성됩니다.
이러한 기록을 통해 예를 들어 초기 가스 부피 V1과 압력 p를 알고 있으면 새 부피 V2에서 압력 p2를 계산할 수 있습니다.
게이 뤼삭의 법칙(샤를의 법칙)
1787년 Charles는 일정한 압력에서 기체의 부피가 온도에 비례하여 변한다는 것을 보여주었습니다. 이 의존성은 그림 3.3에 그래프 형태로 표시되며, 여기서 기체의 부피는 온도 수학적 형태로 이 의존성은 다음과 같이 표현됩니다.
샤를의 법칙은 종종 다른 형식으로 작성됩니다.
V1IT1 = V2T1 (2)
Charles의 법칙은 1802년에 온도가 1°C 변할 때 기체의 부피가 0°C에서 차지하는 부피의 1/273만큼 변한다는 것을 확립한 J. Gay-Lussac에 의해 개선되었습니다.
따라서 0 ° С에서 임의의 가스량을 취하고 일정한 압력에서 온도를 273 ° С로 낮추면 최종 부피는 0이됩니다. 이것은 -273 ° C 또는 0K의 온도에 해당합니다. 이 온도를 절대 영도라고 합니다. 실제로는 달성할 수 없습니다. 그림에서.
3.3은 가스 부피 대 온도 플롯의 외삽이 0K에서 부피가 0이 되는 방법을 보여줍니다.
절대 영도는 엄밀히 말하면 도달할 수 없습니다. 그러나 실험실 조건에서는 절대 영도와 0.001K 차이가 나는 온도에 도달하는 것이 가능합니다. 이러한 온도에서 분자의 무작위 움직임은 실제로 멈춥니다. 이것은 놀라운 속성으로 이어집니다.
예를 들어, 절대 영도에 가까운 온도로 냉각된 금속은 전기 저항을 거의 완전히 잃어 초전도 *가 됩니다. 다른 특이한 저온 특성을 가진 물질의 예는 헬륨입니다.
절대 영도에 가까운 온도에서 헬륨의 점도는 사라지고 초유체가 됩니다.* 1987년에 100K(-173°C) 정도의 비교적 높은 온도에서 초전도체가 되는 물질(란탄족 원소, 바륨 및 구리의 산화물에서 소결된 세라믹)이 발견되었습니다. 이러한 "고온" 초전도체는 기술 분야에서 큰 가능성을 열어줍니다. 번역
메인 실험실 장비모든 실험 작업이 수행되는 데스크탑입니다.
모든 실험실은 환기가 잘 되어야 합니다. 모든 작업이 악취가 나거나 유독한 화합물을 사용하여 수행되고 도가니에서 유기 물질을 태우는 흄 후드가 필요합니다.
휘발성이 높거나 유해하거나 악취가 나는 물질(액체 브롬, 농축 질산, 염산 등)은 가열과 관련된 작업이 수행되지 않는 특수 연기 찬장에 보관됩니다.
) 뿐만 아니라 가연성 물질(이황화탄소, 에테르, 벤젠 등).
실험실에는 배관, 하수도, 기술 전류, 가스 및 물 가열 장치가 필요합니다. 또한 압축 공기 공급, 진공 라인, 온수 및 증기 공급 장치가 있는 것이 바람직합니다.
특별한 연결이 없으면 다양한 시스템의 온수기를 사용하여 온수를 얻습니다.
전기 또는 가스로 가열되는 이러한 장치의 도움으로 거의 100 ° C의 온도로 뜨거운 물을 빠르게 얻을 수 있습니다.
실험실에는 증류수나 탈염수 없이는 작업이 불가능하기 때문에 물의 증류(또는 탈염) 설비가 있어야 합니다. 증류수를 구하기 어렵거나 불가능한 경우에는 시판되는 증류수를 사용합니다.
작업대와 물 싱크 근처에는 불필요한 용액, 시약 등을 배출하기 위한 10-15리터 용량의 점토 항아리와 깨진 유리, 종이 및 기타 건조 폐기물 바구니가 있어야 합니다.
실험실에는 책상 외에도 모든 공책과 메모를 보관할 수 있는 책상이 있어야 하며, 필요한 경우 제목 테이블이 있어야 합니다. 작업대 근처에는 키가 큰 의자나 의자가 있어야 합니다.
고정 설치가 필요한 분석용 저울 및 기기(전자계측기, 광학식 등)는 실험실과 연결된 별도의 공간에 배치하고 분석용 저울을 위한 특수 칭량실을 할당해야 합니다. 저울은 북쪽에 창문이 있는 것이 바람직합니다. 이것은 저울이 햇빛에 노출되어서는 안 되기 때문에 중요합니다("저울 및 무게 측정").
실험실에서는 작업 중에 톤이나 기타 참조가 필요하기 때문에 가장 필요한 참고서, 매뉴얼 및 교과서도 있어야 합니다.
또한보십시오
3페이지
실험실에서 사용되는 화학 유리 제품은 여러 그룹으로 나눌 수 있습니다. 요리는 목적에 따라 일반용, 특수용, 체적용으로 나눌 수 있습니다. 재료별 - 간단한 유리, 특수 유리, 석영으로 만든 요리용.
그룹에. 일반 목적은 항상 실험실에 있어야 하며 대부분의 작업을 수행할 수 없는 항목입니다. 다음은 시험관, 단순 분리 깔때기, 비이커, 평평한 바닥 플라스크, 결정화기, 원뿔형 플라스크(Erlenmeyer), 분젠 플라스크, 냉장고, 레토르트, 증류수용 플라스크, 티, 꼭지입니다.
특수 목적 그룹에는 한 가지 목적으로 사용되는 품목이 포함됩니다. 예: Kipp 장치, Sok-rally 장치, Kjeldahl 장치, 환류 응축기, Wul-fa 플라스크, Tishchenko 플라스크, 비중병, 비중계, Drexel 플라스크 , 칼륨 장치, 이산화탄소 측정 장치, 둥근 바닥 플라스크, 특수 냉장고, 분자량 측정 장치, 녹는점 및 끓는점 측정 장치 등
용적 측정 기기에는 눈금 실린더 및 비커, 피펫, 뷰렛 및 부피 플라스크가 포함됩니다.먼저 화학 유리 제품의 주요 유형을 간단하고 쉽게 살펴볼 수 있는 다음 비디오를 시청하는 것이 좋습니다.
또한보십시오:
범용 조리기구
시험관(그림 18)은 바닥이 둥근 좁은 원통형 용기입니다. 그들은 다양한 크기와 직경으로 제공되며 다른 유리로 만들어집니다. 일반 "실험실 시험관은 저융점 유리로 만들어지지만 특수한 작업을 위해 고온 가열이 필요한 경우에는 고융점 유리나 석영으로 시험관을 만든다.
일반 단순 튜브 외에도 눈금 및 원심 분리기 원추형 튜브도 사용됩니다.
작동 중인 시험관의 보관을 위해 특수 목재, 플라스틱 또는 금속 랙이 사용됩니다(그림 19).
쌀. 18. 단순하고 눈금이 매겨진 튜브
쌀. 20. 시험관에 분말상 물질의 꼬리표를 붙인다.
시험관은 주로 분석 또는 미량화학 작업에 사용됩니다. 시험관에서 반응을 수행할 때 시약을 너무 많이 사용해서는 안 됩니다. 시험관이 가장자리까지 채워지는 것은 완전히 용납될 수 없습니다.
반응은 소량의 물질로 수행됩니다. 시험관 용량의 1/4 또는 1/8이면 충분합니다. 때때로 고체(분말, 결정체 등)를 시험관에 주입해야 합니다.
), 이를 위해 시험관의 지름보다 약간 작은 너비의 종이 조각을 길이를 따라 반으로 접고 필요한 양의 고체를 결과 국자에 붓습니다. 시험관을 왼손으로 잡고 수평으로 기울이고 국자를 거의 바닥까지 삽입합니다(그림 20).
그런 다음 시험관을 수직으로 놓고 "또한 가볍게 치십시오. 고형물이 모두 쏟아지면 국자를 제거합니다.
부은 시약을 섞기 위해 왼손의 엄지와 검지로 시험관 상단을 잡고 가운데 손가락으로 시험관을 받치고 오른손 검지로 시험관 바닥을 친다. 내용물이 잘 섞이면 충분합니다.
손가락으로 시험관을 닫고 이렇게 흔드는 것은 완전히 용납될 수 없습니다. 이 경우 시험관의 액체에 이물질이 들어갈 수 있을 뿐만 아니라 때로는 손가락의 피부가 손상되거나 화상을 입을 수 있습니다.
튜브에 액체가 반 이상 차면 유리 막대로 내용물을 저어줍니다.
튜브를 가열해야 하는 경우 홀더에 고정해야 합니다.
시험관의 부적절하고 강한 가열로 인해 액체가 빨리 끓고 튀어 나오므로 조심스럽게 가열해야합니다. 기포가 나타나기 시작하면 시험관을 따로 보관해야하며 버너 불꽃이 아닌 상태로 유지해야합니다. , 그러나 그 근처 또는 그 위는 뜨거운 공기로 계속 가열하십시오. 가열될 때 시험관의 열린 끝은 작업자와 테이블에 있는 이웃에게서 멀리 향해야 합니다.강한 가열이 필요하지 않을 때는 가열된 액체가 담긴 튜브를 뜨거운 물에 담그는 것이 좋습니다. 작은 시험관(반미세 분석용)으로 작업하는 경우 적절한 크기(100ml를 초과하지 않는 용량)의 유리 비커에 부은 뜨거운 물에서만 가열됩니다.
깔때기액체, 여과 등에 사용됩니다. 화학 깔때기는 다양한 크기로 생산되며 상단 직경은 35, 55, 70, 100, 150, 200, 250 및 300mm입니다.
기존 깔때기는 내부 벽이 매끄럽지만 내부 표면에 골이 있는 깔때기가 더 빠른 여과를 위해 사용되기도 합니다.
필터 깔때기는 항상 60 °의 각도와 절단 길이가 있습니다.
작동 중 깔때기는 특수 삼각대 또는 일반 실험실 삼각대의 링에 설치됩니다(그림 21).
유리로 여과하려면 깔때기 용 간단한 홀더를 만드는 것이 유용합니다 (그림 22).이를 위해 길이 70-80lsh, 너비 20mm의 스트립을 두께가 약 2mm 인 시트 알루미늄에서 잘라냅니다. .
스트립의 끝 부분 중 하나에 직경 12-13mm의 구멍을 뚫고 그림 1과 같이 스트립을 구부립니다. 22, 에이. 유리에 깔때기를 고정하는 방법이 그림에 나와 있습니다. 22, 나.
병이나 플라스크에 액체를 부을 때 깔때기를 너무 많이 채우지 마십시오.
깔때기가 액체가 부어지는 용기의 목에 꼭 맞으면 용기 내부에 압력이 증가하기 때문에 이송이 어려워집니다. 따라서 깔때기는 때때로 들어올려져야 합니다.
깔때기와 용기 목 사이에 예를 들어 종이 한 장을 넣어 간격을 만드는 것이 훨씬 좋습니다. 이 경우 가스켓이 용기 내부로 들어가지 않도록 주의해야 합니다. 스스로 만들 수있는 와이어 삼각형을 사용하는 것이 더 좋습니다.이 삼각형을 용기의 목에 놓고 깔때기를 삽입합니다.
플라스크 내부와 외부 대기의 소통을 보장하는 특수 고무 또는 플라스틱 부착물이 접시의 목 부분에 있습니다(그림 23).
쌀. 21. 유리질 화학 깔때기 강화
쌀. 22. 깔때기를 삼각대에 유리에 부착하는 장치.
필터링 시 분석 작업의 경우 분석 깔때기를 사용하는 것이 좋습니다(그림 24). 이 깔때기의 특징은 길쭉한 절단 끝이 있다는 것입니다. 끝 부분의 내경은 아래쪽보다 위쪽이 더 작습니다. 이 디자인은 여과 속도를 높입니다.
또한, 필터를 지지하는 늑골이 있는 내부 표면이 있고 깔때기가 튜브로 통과하는 지점에서 구형 팽창이 있는 분석 깔때기가 있습니다. 이 디자인의 깔때기는 기존 깔때기에 비해 여과 과정을 최대 3배까지 가속화합니다.
쌀. 23. 병목용 노즐. 쌀. 24. 분석 깔때기.
깔때기 분리(그림 25) 섞이지 않는 액체(예: 물과 기름)를 분리하는 데 사용됩니다. 그들은 원통형 또는 배 모양이며 대부분의 경우 유리 마개가 장착되어 있습니다.
지관 상부에 유리 탭이 있습니다. 분리 깔때기의 용량은 용량에 따라 다르며(50ml에서 몇 리터까지) 벽 두께도 변경됩니다.
깔때기 용량이 작을수록 벽이 더 얇아지며 그 반대의 경우도 마찬가지입니다.
작동 중 분리 깔때기는 용량과 모양에 따라 다양한 방식으로 강화됩니다. 작은 용량의 원통형 깔때기를 발에 간단히 부착할 수 있습니다. 큰 깔때기는 두 개의 링 사이에 배치됩니다.
원통형 깔때기의 아래쪽 부분은 지름이 깔때기의 지름보다 약간 작고 위쪽 고리의 지름이 약간 더 큰 링 위에 있어야 합니다.
깔때기가 동시에 흔들리면 링과 깔때기 사이에 코르크 판을 놓아야 합니다.
배 모양의 분할 깔때기가 링에 고정되고 목이 발로 고정됩니다. 항상 깔때기를 먼저 고정한 다음 분리할 액체를 붓습니다.점적 깔때기(그림 26)는 더 가볍고 얇으며 분할 깔때기와 다릅니다.
쌀. 25. 분리 깔때기. 쌀. 26. 드립 깔때기.
대부분의 경우 끝이 깁니다. 이 깔때기는 물질이 반응 질량에 소량 또는 적가될 때 많은 작업에서 사용됩니다. 따라서 일반적으로 장치의 일부를 형성합니다. 깔때기는 플라스크 목의 얇은 부분이나 코르크 마개 또는 고무 마개로 고정됩니다.
분리 또는 적하 깔때기로 작업하기 전에 유리 탭 부분을 바셀린 또는 특수 그리스로 조심스럽게 윤활해야 합니다.
이렇게 하면 탭을 쉽고 간편하게 열 수 있습니다. 탭이 꽉 열리면 열 때 부러지거나 전체 장치가 손상될 수 있으므로 매우 중요합니다.
그리스는 밸브를 돌릴 때 깔때기 튜브나 밸브 개구부 내부로 떨어지지 않도록 매우 얇은 층으로 도포해야 합니다.
적하 깔때기에서 액적의 보다 균일한 흐름과 액체 공급 속도를 모니터링하기 위해 노즐이 있는 적하 깔때기가 사용됩니다(그림 27). 이러한 깔때기는 탭 직후에 확장 된 부분이있어 튜브로 바뀝니다. 액체는 코크를 통해 짧은 튜브를 통해 이 팽창으로 흐른 다음 깔때기의 튜브로 흐릅니다.
쌀. 27. 노즐이 있는 드립 깔때기
쌀. 28. 비커.
쌀. 29. 노즐이 있는 평면 깔때기
유리 식기 1 2 3
또한보십시오
25과 보일-마리오트의 법칙 - HIMI4KA

수업 자료실 ›화학의 기본 법칙
25과에서 " 보일-마리오트 법칙"코스에서" 인형을 위한 화학»기체의 압력과 부피에 관한 법칙은 물론 부피에 대한 압력의 의존성과 압력에 대한 부피의 그래프를 고려하십시오. 마지막 수업 "가스 압력"에서 우리는 수은 기압계의 장치와 작동 원리를 조사하고 압력의 정의를 제공하고 측정 단위를 고려했음을 상기시켜 드리겠습니다.
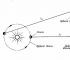
로버트 보일(1627-1691) 화학 원소에 대한 최초의 실질적으로 정확한 정의를 받은 사람(6장에서 배웁니다)은 희박한 공기가 있는 용기에서 발생하는 현상에도 관심을 보였습니다.
밀폐된 용기에서 공기를 펌핑하기 위한 진공 펌프를 발명하는 동안 그는 축구공 챔버를 펌프질하거나 조심스럽게 풍선을 짜내는 모든 사람에게 친숙한 속성에 주의를 기울였습니다. 압축.
보일은 이 속성을 " 탄력»공기를 불어 넣고 그림과 같은 간단한 장치를 사용하여 측정했습니다. 3.2, a 및 b.
보일은 구부러진 관의 닫힌 끝 부분에 있는 공기를 수은으로 막고(그림 3-2, a) 이 공기를 짜내서 관의 열린 끝 부분에 점차적으로 수은을 추가했습니다(그림 3-2, b).
튜브의 닫힌 부분에서 공기가 경험하는 압력은 대기압과 높이가 h인 수은 기둥의 압력의 합과 같습니다(h는 튜브의 열린 끝 부분에서 수은 수준이 되는 높이입니다. 튜브가 닫힌 끝에서 수은 수준을 초과함). Boyle의 획득된 압력 및 부피 측정은 표 1에 나와 있습니다. 3-1.
보일은 기체의 온도를 일정하게 유지하기 위해 특별한 조치를 취하지 않았지만 그의 실험에서는 약간만 변한 것으로 보입니다. 그럼에도 불구하고 Boyle은 양초 불꽃의 열이 공기의 특성에 상당한 변화를 일으킨다는 것을 알아차렸습니다.
압축 중 공기의 압력 및 부피에 대한 데이터 분석
표 3-1주변 공기의 압력과 부피 사이의 관계에 대한 Boyle의 실험 데이터가 포함된 은 스포일러 아래에 있습니다.
연구원이 표에 표시된 것과 유사한 데이터를 받은 후. 3-1, 그는 자신이 측정한 두 개의 종속 수량과 관련된 수학 방정식을 찾으려고 합니다.
그러한 방정식을 얻는 한 가지 방법은 직선 그래프를 얻기 위해 한 수량의 다양한 정도가 다른 수량에 의존하는 정도를 그래프로 그리는 것입니다.
직선의 일반 방정식은 다음과 같습니다.
여기서 x와 y는 관련 변수이고 a와 b는 상수입니다. b가 0이면 직선이 원점을 통과합니다.
그림에서. 3-3은 표에 나와 있는 압력 P와 부피 V에 대한 데이터를 그래프로 표시하는 다양한 방법을 보여줍니다. 3-1.P 대 1 / K 및 V 대 1 / P의 플롯은 원점을 통과하는 직선입니다.
V의 로그에 대한 P의 로그 의존도 플롯은 음의 기울기를 갖는 직선이며, 그 탄젠트는 -1입니다. 이 세 가지 플롯은 모두 등가 방정식으로 이어집니다.
- P = a / V (3-3a)
- V = a / P (3-3b)
- lg V = lg a - lg P(3-3v)
이 방정식은 각각 다음 옵션 중 하나를 나타냅니다. 보일-마리오트 법칙, 이는 일반적으로 다음과 같이 공식화됩니다. 주어진 몰 수의 기체에 대해 기체 온도가 일정하게 유지된다면 압력은 부피에 비례합니다.
그건 그렇고, 보일-마리오트 법칙이 이중 이름으로 불리는 이유가 궁금할 것입니다. 이것은 1662년에 그것을 발견한 로버트 보일과는 별도로 이 법칙이 1676년 에드엠 마리오트에 의해 재발견되었기 때문에 일어난 일입니다. 그게 다야
이 경우와 같이 두 측정량 사이의 관계가 단순할 때 수치적으로도 성립될 수 있다.
압력 P의 각 값에 해당하는 부피 V 값을 곱하면 일정한 온도에서 주어진 가스 샘플에 대한 모든 제품이 거의 동일하다는 것을 쉽게 확인할 수 있습니다(표 3-1 참조). 따라서 우리는 다음과 같이 쓸 수 있습니다.
방정식(З-Зг)은 P와 V 값 사이의 쌍곡선 관계를 설명합니다(그림 3-3, a 참조). 실험 데이터에서 구성된 V에 대한 P의 의존도 플롯이 쌍곡선과 실제로 일치하는지 확인하기 위해 P에 대한 곱 PV의 의존도에 대한 추가 플롯을 구성하고 이것이 수평 직선인지 확인합니다(참조: 그림 3-3, 마) ...
Boyle은 일정한 온도에서 주어진 양의 기체에 대해 압력 P와 부피 V 사이의 관계는 다음 관계식으로 매우 만족스럽게 설명된다는 것을 발견했습니다.
- P V = const(상수 T 및 n에서) (3-4)
보일-마리오트 공식
다른 조건(그러나 일정한 온도)에서 동일한 가스 샘플의 부피와 압력을 비교하려면 다음을 나타내는 것이 편리합니다. 보일-마리오트 법칙다음 공식에서:
여기서 인덱스 1과 2는 서로 다른 두 조건에 해당합니다.
예 4. 콜로라도 고원(예 3 참조)으로 배달된 식품이 담긴 비닐 봉지는 대기압이 감소한 상태에서 해수면에서 2500m 높이로 상승할 때 그 안의 공기가 팽창하기 때문에 종종 파열됩니다.
해수면에 해당하는 대기압에서 가방 내부에 100cm3의 공기가 있다고 가정하면 이 공기는 콜로라도 고원에서 같은 온도에서 얼마만큼의 부피를 차지해야 합니까? (수축 파우치가 공기 팽창을 제한하지 않는 식료품을 배달하는 데 사용된다고 가정합니다. 누락된 데이터는 예 3에서 가져와야 합니다.)해결책
보일의 법칙을 방정식 (3-5)의 형태로 사용합시다. 여기서 지수 1은 해수면 조건을 나타내고 지수 2는 해발 2500m 고도의 조건을 나타냅니다. 그런 다음 Р1 = 1,000 atm, V1 = 100 cm3, Р2 = 0.750 atm, V2를 계산해야 합니다. 그래서,
주어진 가스 질량의 상태를 특성화하는 매개 변수 사이의 관계에 대한 연구는 매개 변수 중 하나가 변경되지 않은 상태로 유지될 때 발생하는 가스 프로세스에 대한 연구로 시작합니다. 영국 과학자 보일(1669년) 프랑스 과학자 메리어트(1676년) 일정한 온도에서 기체의 부피 변화에 대한 압력 변화의 의존성을 표현하는 법칙을 발견했습니다. 다음 실험을 해보자.
핸들을 돌리면 실린더 A의 가스(공기) 부피가 변경됩니다(그림 11, a). 압력계의 판독 값에 따르면 가스 압력이 동시에 변하는 것을 알 수 있습니다. 우리는 용기의 가스 부피를 변경하고 (부피는 B 눈금에서 결정됨) 압력에 주목하여 표에 기록합니다. 1. 압력에 의한 기체 부피의 곱은 거의 일정하다는 것을 알 수 있습니다. 기체 부피는 몇 배나 감소하고 동시에 압력은 증가합니다.

유사하고 더 정확한 실험의 결과, 일정한 온도에서 주어진 가스 질량에 대해 가스 압력은 가스 체적의 변화에 반비례하여 변한다는 것이 발견되었습니다. 이것이 보일-마리오트 법칙의 공식화입니다. 수학적으로 다음과 같이 두 가지 상태에 대해 작성됩니다.
![]()
일정한 온도에서 기체의 상태를 변화시키는 과정을 등온.보일-마리오트 공식은 기체의 등온 상태에 대한 방정식입니다. 일정한 온도에서 분자의 평균 운동 속도는 변하지 않습니다. 기체 부피의 변화는 용기 벽에 대한 분자의 충격 횟수의 변화를 일으킵니다. 이것이 가스 압력의 변화에 대한 이유입니다.
예를 들어, 이 프로세스를 그래픽으로 묘사해 보겠습니다. V = 12리터, p = 1 at.... 가로축에 가스 부피를 표시하고 세로축에 압력을 표시합니다(그림 11, b). 우리는 V와 p 값의 각 쌍에 해당하는 점을 찾고 이들을 연결하여 등온 과정의 그래프를 얻습니다. 일정한 온도에서 기체의 부피와 압력 사이의 관계를 나타내는 선을 등온선이라고 합니다. 순수한 등온 과정은 발생하지 않습니다. 그러나 예를 들어 압축기가 공기를 실린더로 펌핑할 때, 가연성 혼합물이 내연 기관의 실린더에 주입될 때와 같이 가스 온도가 거의 변하지 않는 경우가 종종 있습니다. 이러한 경우 기체의 부피와 압력은 보일-마리오트 법칙*에 따라 계산됩니다.