Gdzie obowiązuje prawo o kulkach mariotek. Przepisy dotyczące gazu
Prawo Boyle-Mariotte jest następujące:
W formie matematycznej to stwierdzenie jest zapisane w formie wzoru
gdzie - ciśnienie gazu; - objętość gazu, oraz - stała wartość na uzgodnionych warunkach. Ogólnie rzecz biorąc, wartość zależy od charakteru chemicznego, masy i temperatury gazu.
Oczywiście, jeśli indeks 1 oznaczają ilości związane ze stanem początkowym gazu, a indeks dolny 2 - do finału podaną formułę można zapisać w postaci
.
Z powyższych i powyższych wzorów wynika postać zależności ciśnienia gazu od jego objętości w procesie izotermicznym:
Ta zależność jest kolejnym, równoważnym pierwszemu, wyrazem treści prawa Boyle'a - Mariotte'a. To znaczy, że
Ciśnienie masy gazu o stałej temperaturze jest odwrotnie proporcjonalne do jego objętości.
Wówczas zależność pomiędzy stanem początkowym i końcowym gazu biorącego udział w procesie izotermicznym można wyrazić jako:
Należy zauważyć, że stosowalność tego i powyższego wzoru łączącego początkowe i końcowe ciśnienia i objętości gazu nie ogranicza się do przypadku procesów izotermicznych. Wzory zachowują ważność w przypadkach, gdy temperatura zmienia się w trakcie procesu, ale w wyniku procesu temperatura końcowa okazuje się równa temperaturze początkowej.
Ważne jest, aby wyjaśnić, że to prawo obowiązuje tylko w przypadkach, gdy dany gaz można uznać za idealny. W szczególności prawo Boyle'a - Mariotte'a jest spełnione z dużą dokładnością w odniesieniu do gazów rozrzedzonych. Jeśli gaz jest silnie sprężony, obserwuje się znaczne odchylenia od tego prawa.
Konsekwencje
Prawo Boyle'a - Mariotte stwierdza, że ciśnienie gazu w procesie izotermicznym jest odwrotnie proporcjonalne do objętości zajmowanej przez gaz. Jeśli weźmiemy pod uwagę, że gęstość gazu jest również odwrotnie proporcjonalna do zajmowanej przez niego objętości, to dochodzimy do wniosku:
W procesie izotermicznym ciśnienie gazu zmienia się wprost proporcjonalnie do jego gęstości.
Dochodzimy więc do wniosku:
Izotermiczny współczynnik ściśliwości gazu doskonałego jest równy odwrotności jego ciśnienia.
Zobacz też
Napisz recenzję artykułu „Prawo Boyle-Mariotte”
Notatki (edytuj)
- Pietruszewski F.F.// Encyklopedyczny słownik Brockhausa i Efron
- // Encyklopedia fizyczna / Ch. wyd. AM Prochorow. - M .: Radziecka encyklopedia, 1988 .-- T. 1. - S. 221-222. - 704 pkt. - 100 000 egzemplarzy
- Sivukhin D.V. Ogólny kurs fizyki. - Moskwa: Fizmatlit, 2005 .-- T. II. Termodynamika i fizyka molekularna. - S. 21-22. - 544 pkt. - ISBN 5-9221-0601-5.
- Podstawowy podręcznik fizyki / Wyd. GS Landsberg. - M .: Nauka, 1985. - T. I. Mechanika. Ciepło. Fizyka molekularna. - S. 430 .-- 608 s.
- Kikoin AK, Kikoin I.K. Fizyka molekularna. - M .: Nauka, 1976 .-- S. 35-36.
- Przy stałej masie.
- Livshits L.D.// Encyklopedia fizyczna / Ch. wyd. AM Prochorow. - M .: Wielka rosyjska encyklopedia, 1994 .-- T. 4. - S. 492-493. - 704 pkt. - 40 000 egzemplarzy - ISBN 5-85270-087-8.
Literatura
- Pietruszewski F.F.// Słownik encyklopedyczny Brockhausa i Efrona: w 86 tomach (82 tomy i 4 dodatkowe). - SPb. , 1890-1907.
Fragment z Prawa Boyle'a - Mariotte
„To ta” – usłyszał w odpowiedzi szorstki kobiecy głos, a potem do pokoju weszła Marya Dmitrievna.Wszystkie młode damy, a nawet panie, z wyjątkiem najstarszych, wstały. Marya Dmitrievna zatrzymała się w drzwiach i z wysokości swojego korpulentnego ciała, trzymając 50-letnią głowę wysoko z siwymi lokami, spojrzała na gości i jakby zwijając się, niespiesznie wyprostowała szerokie rękawy sukienki. Marya Dmitrievna zawsze mówiła po rosyjsku.
„Droga urodzinowa dziewczyno z dziećmi”, powiedziała swoim głośnym, grubym głosem, który przytłaczał wszystkie inne dźwięki. - Kim jesteś, stary grzesznik - zwróciła się do hrabiego, który pocałował ją w rękę, - herbaty, tęsknisz za Moskwą? Nie ma gdzie gonić psów? Ale co, ojcze, zrobić, tak dorastają te ptaszki... - wskazała na dziewczynki. - Chcąc czy nie, trzeba szukać zalotników.
- No co, mój Kozak? (Marya Dmitrievna nazwała Nataszę Kozakiem) - powiedziała, pieszcząc dłonią Natashę, która bez strachu i radośnie podeszła do jej ręki. - Wiem, że eliksir to dziewczyna, ale kocham go.
Wyjęła jachtowe kolczyki z gruszkami z ogromnej siatki i wręczając je Nataszy, która świeciła i rumieniła się na urodziny, natychmiast odwróciła się od niej i zwróciła do Pierre'a.
- Ech, ech! uprzejmy! chodź tutaj - powiedziała udawanym niskim i cienkim głosem. - Chodź, moja droga ...
I złowieszczo podwinęła rękawy jeszcze wyżej.
Pierre zbliżył się, patrząc na nią naiwnie przez okulary.
- Chodź, chodź, kochanie! Sam powiedziałem twojemu ojcu prawdę, kiedy był w sprawie, a potem Bóg ci nakazuje.
Zatrzymała się. Wszyscy milczeli, oczekując, co się stanie, i czując, że jest tylko przedmowa.
- Dobrze, nie ma nic do powiedzenia! dobry chłopczyk!... Ojciec leży na łóżku i bawi się, kładzie kwatermistrza na niedźwiedziu. Wstyd, ojcze, wstyd! Byłoby lepiej, gdyby poszedł na wojnę.
Odwróciła się i wyciągnęła rękę do hrabiego, który z trudem powstrzymał się od śmiechu.
- No cóż, do stołu mam herbatę, czy już czas? - powiedziała Marya Dmitrievna.
Hrabia poszedł naprzód z Maryą Dmitrievną; potem hrabina, której przewodził pułkownik husarski, właściwa osoba, z którą Mikołaj musiał dogonić pułk. Anna Michajłowna - z Shinshin. Berg podał rękę Verze. Uśmiechnięta Julie Karagina podeszła z Nikołajem do stołu. Podążały za nimi inne pary, ciągnąc się w poprzek sali, a za nimi wszystkie, jedno po drugim, dzieci, wychowawcy i guwernantki. Kelnerzy poruszyli się, krzesła zagrzechotały, w chórze zabrzmiała muzyka, a goście usadowili się. Dźwięki domowej muzyki hrabiego zastąpiły odgłosy noży i widelców, rozmowy gości, ciche kroki kelnerów.
Hrabina siedziała przy jednym końcu stołu. Po prawej stronie Marya Dmitrievna, po lewej Anna Michajłowna i inni goście. Na drugim końcu siedział hrabia, po lewej pułkownik huzarów, po prawej Shinshin i inni goście płci męskiej. Po jednej stronie długiego stołu stoi starsza młodzież: Vera obok Berga, Pierre obok Borisa; z drugiej strony dzieci, wychowawcy i guwernantki. Zza kryształów, butelek i wazonów z owocami hrabia patrzył na żonę i jej wysoką czapkę z niebieskimi wstążkami i pilnie nalewał wino sąsiadom, nie zapominając o sobie. Hrabina również, ze względu na ananasy, nie zapominając o obowiązkach gospodyni, rzuciła znaczące spojrzenia na męża, którego łysina i twarz, jak jej się wydawało, wyraźniej różniły się od siwych włosów w rumieńcu. Po stronie pań rozległo się równe bełkotanie; na męskiej coraz głośniej słychać było głosy, zwłaszcza pułkownika huzarów, który tak dużo jadł i pił, rumieniąc się coraz bardziej, że hrabia już dawał mu przykład dla innych gości. Berg rozmawiał z Verą z delikatnym uśmiechem, że miłość nie jest uczuciem ziemskim, ale niebiańskim. Boris nazwał swojego nowego przyjaciela Pierre'a gośćmi przy stole i wymienił spojrzenia z Nataszą, która siedziała naprzeciwko niego. Pierre mówił mało, rozglądał się po nowych twarzach i dużo jadł. Począwszy od dwóch zup, z których wybrał a la tortue, [szylkret] i kulebyaki, po cietrzewie leszczyny nie ominęło go ani jedno danie, ani jedno wino, które lokaj w tajemniczy sposób wyciągnął z ramienia sąsiada w owiniętej butelce w serwetce, mówiąc lub „smaruj Maderę, Węgierkę lub Ren. Pierwszy z czterech kryształowych kieliszków zastąpił stojącym przed każdym urządzeniem monogramem hrabiego i pił z przyjemnością, patrząc na gości coraz przyjemniejszym powietrzem. Natasza, siedząca naprzeciwko niego, patrzyła na Borysa, jak trzynastoletnie dziewczynki patrzą na chłopca, z którym właśnie pocałowali się po raz pierwszy iw którym są zakochani. To samo jej spojrzenie czasami zwracało się do Pierre'a i pod spojrzeniem tej zabawnej, żywiołowej dziewczyny sam chciał się śmiać, nie wiedząc dlaczego.
Nikołaj siedział daleko od Soni, obok Julie Karaginy i znowu z tym samym mimowolnym uśmiechem mówił do niej. Sonia uśmiechnęła się uroczyście, ale najwyraźniej dręczyła ją zazdrość: zbladła, potem zarumieniła się i ze wszystkich sił słuchała, co Nikołaj i Julia rozmawiali między sobą. Guwernantka rozejrzała się niespokojnie, jakby przygotowywała się do odmowy, gdyby ktoś pomyślał, że obrazi dzieci. Niemiecki gubernator starał się zapamiętać wszelkiego rodzaju potrawy, desery i wina, aby wszystko szczegółowo opisać w liście do rodziny w Niemczech i był bardzo urażony, że lokaj z butelką owiniętą w serwetkę nosi go ze sobą. Niemiec zmarszczył brwi, próbował udawać, że nie chce tego wina, ale obraził się, bo nikt nie chciał zrozumieć, że potrzebuje wina, by nie gasić pragnienia, nie z chciwości, ale z sumiennej ciekawości.
Na męskim końcu stołu rozmowa stawała się coraz bardziej ożywiona. Pułkownik powiedział, że manifest o wypowiedzeniu wojny został już opublikowany w Petersburgu, a egzemplarz, który sam widział, został teraz dostarczony kurierem do głównodowodzącego.
22. Prawo Boyle-Mariotte
Jednym z praw gazu doskonałego jest: Prawo Boyle-Mariotte'a, który brzmi: iloczyn ciśnienia P objętościowo V gaz o stałej masie gazu i stałej temperaturze. Ta równość nazywa się równania izoterm... Izoterma jest przedstawiona na wykresie PV stanu gazu w postaci hiperboli iw zależności od temperatury gazu zajmuje jedną lub drugą pozycję. Proces odbywający się w T= const nazywa się izotermiczny. Gaz w T= const ma stałą energię wewnętrzną U. Jeśli gaz rozpręża się izotermicznie, wtedy całe ciepło zaczyna działać. Praca, którą wykonuje gaz, rozszerzając się izotermicznie, jest równa ilości ciepła, które musi zostać dostarczone gazowi, aby ją wykonać:
d= dQ= PdV,
gdzie d A- praca podstawowa;
dV- podstawowa objętość;
P- nacisk. Jeśli V 1> V 2 i P 1< P 2 , то газ сжимается, и работа принимает отрицательное значение. Для того чтобы условие T= const zostało spełnione, należy uważać zmiany ciśnienia i objętości za nieskończenie powolne. Istnieje również wymóg dotyczący medium, w którym znajduje się gaz: musi mieć dostatecznie dużą pojemność cieplną. Wzory obliczeniowe sprawdzają się również w przypadku dostarczania energii cieplnej do układu. Ściśliwość gaz nazywa się jego właściwością zmiany objętości, gdy zmienia się ciśnienie. Każda substancja ma współczynnik ściśliwości, i jest równy:
c = 1 / V(dV/CP) T,
tutaj pochodna jest brana w T= const.
Współczynnik ściśliwości wprowadza się, aby scharakteryzować zmianę objętości wraz ze zmianą ciśnienia. Dla gazu doskonałego jest równy:
c = -1 / P.
W SI współczynnik ściśliwości ma następujący wymiar: [c] = m 2 / N.
Ten tekst jest fragmentem wprowadzającym. Z książki Kreatywność jako nauka dokładna [Teoria rozwiązywania problemów wynalazczych] Autor Altszuller Genrikh Saulovich1. Prawo zupełności części systemu Niezbędnym warunkiem podstawowej żywotności systemu technicznego jest obecność i minimalna wydajność głównych części systemu. Każdy system techniczny musi składać się z czterech głównych części: silnika,
Z książki Interfejs: Nowe kierunki w projektowaniu systemów komputerowych autor Ruskin Jeff2. Prawo „przewodności energetycznej” systemu Warunkiem koniecznym fundamentalnej żywotności systemu technicznego jest przelotowy przepływ energii przez wszystkie części systemu. Każdy system techniczny jest konwerterem energii. Stąd oczywiste
Z książki Oprzyrządowanie autor Babaev MA6. Prawo przejścia do supersystemu Po wyczerpaniu możliwości rozwoju system zostaje włączony do supersystemu jako jedna z jego części; w tym przypadku dalszy rozwój odbywa się na poziomie supersystemu. Mówiliśmy już o tym prawie. Przejdźmy do „dynamiki”. Obejmuje prawa odzwierciedlające
Z książki Inżynier ciepła Autor Burkhanova Natalia7. Prawo przejścia z poziomu makro do poziomu mikro. Rozwój organów roboczych systemu przechodzi najpierw na poziom makro, a następnie na mikro. W większości nowoczesnych systemów technicznych ciałami roboczymi są „kawałki żelaza”, na przykład śmigła lotnicze, koła samochodowe, noże
Z książki Computational Linguistics for All: Myths. Algorytmy. Język Autor Anisimow Anatolij Wasiliewicz8. Prawo zwiększania stopnia podpola Rozwój systemów technicznych idzie w kierunku zwiększania stopnia podpola. Znaczenie tego prawa polega na tym, że układy niepolowe mają tendencję do stawania się podpolami, a w układach podpolowych rozwój idzie w kierunku
Z książki The Phenomenon of Science [Cybernetyczne podejście do ewolucji] Autor Turchin Valentin Fiodorowicz Z książki Nanotechnology [Science, Innovation and Opportunity] autor: Foster Lynn4.4.1. Prawo Fittsa Wyobraź sobie, że przesuwasz kursor na przycisk na ekranie. Celem tego ruchu jest przycisk. Długość linii prostej łączącej pozycję początkową kursora i najbliższy punkt celu jest zdefiniowana w prawie Fittsa jako odległość. Na
Z książki Historia wybitnych odkryć i wynalazków (elektrotechnika, elektroenergetyka, elektronika radiowa) Autor Schneiberg Jan Abramowicz4.4.2. Prawo Hicka Przed przesunięciem kursora do celu lub wykonaniem jakiejkolwiek innej czynności z zestawu wielu opcji, użytkownik musi wybrać ten obiekt lub czynność. Prawo Hicka mówi, że kiedy konieczne jest dokonanie wyboru spośród n opcji, czas na wybór
Z książki autora9. Prawo rozkładu Poissona i Gaussa Prawo Poissona. Jego inna nazwa to prawo ra-definicji rzadkich zdarzeń. Prawo Poissona (Z.P) stosuje się w przypadkach, w których jest to mało prawdopodobne, a zatem stosowanie B / Z / R jest niepraktyczne.Zaletami prawa są: wygoda z
Z książki autora23. Prawo Gay-Lussaca Prawo Gay-Lussaca mówi: stosunek objętości gazu do jego temperatury przy stałym ciśnieniu i masie gazu jest stały V / T = m / MO R / P = const przy P = const, m = const. Ta równość to nazwa równania izobary.Izobara jest przedstawiona na wykresie PV linii prostej,
Z książki autora24. Prawo Karola Prawo Karola mówi, że stosunek ciśnienia gazu do jego temperatury jest stały, jeśli objętość i masa gazu pozostają niezmienione: P / T = m / MO R / V = const przy V = const, m = const. Ta równość nazywana jest równaniem izochorowym .Isochora jest przedstawiona na wykresie PV linią prostą równoległą do osi P, a
Z książki autora30. Prawo zachowania i przemiany energii Pierwsza zasada termodynamiki opiera się na uniwersalnym prawie zachowania i przemiany energii, które mówi, że energia nie jest tworzona i nie znika.Ciała uczestniczące w procesie termodynamicznym oddziałują ze sobą
Z książki autoraTSAREWNA-ŻABKA I PRAWO STABILNOŚCI Jak już wcześniej podkreślano (prawo abstrakcji), myślenie prymitywne umiejętnie analizuje konkretne zjawiska i syntetyzuje nowe abstrakcyjne systemy. Ponieważ każdy obiekt skonstruowany przez świadomość był postrzegany jako żywy i żywy
Z książki autora1.1. Podstawowe prawo ewolucji O ile nam wiadomo, w procesie ewolucji życia zawsze następował wzrost całkowitej masy materii ożywionej i komplikacje w jej organizacji. Komplikując organizację formacji biologicznych, natura działa metodą próbek i
Z książki autora4.2. Prawo Moore'a W swojej najprostszej postaci prawo Moore'a sprowadza się do stwierdzenia, że gęstość okablowania obwodów tranzystorowych podwaja się co 18 miesięcy. Autorstwo ustawy przypisuje się jednemu z założycieli znanej firmy Intel, Gordonowi Moore'owi. Ściśle mówiąc, w
DEFINICJA
Procesy, w których jeden z parametrów stanu gazowego pozostaje stały, nazywamy izoprocesy.
DEFINICJA
Przepisy dotyczące gazu są prawami opisującymi izoprocesy w gazie doskonałym.
Prawa gazowe odkryto eksperymentalnie, ale wszystkie można uzyskać z równania Mendelejewa-Clapeyrona.
Rozważmy każdy z nich.
Prawo Boyle-Mariotte'a (proces izotermiczny)
Proces izotermiczny nazywa się zmianą stanu gazu, w którym jego temperatura pozostaje stała.
Dla stałej masy gazu w stałej temperaturze iloczyn ciśnienia gazu i objętości jest wartością stałą:
To samo prawo można przepisać w innej postaci (dla dwóch stanów gazu doskonałego):
To prawo wynika z równania Mendelejewa - Clapeyrona:
![]()
Oczywiście, przy stałej masie gazu i stałej temperaturze prawa strona równania pozostaje stała.
Nazywa się wykresy zależności parametrów gazu w stałej temperaturze izotermy.
Oznaczając stałą literą, zapisujemy funkcjonalną zależność ciśnienia od objętości w procesie izotermicznym:
Widać, że ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości. Wykres odwrotnej proporcjonalności, a w konsekwencji wykres izotermy we współrzędnych to hiperbola(ryc. 1, a). Rysunki 1 b) i c) pokazują izotermy odpowiednio we współrzędnych i.

Rys. 1. Wykresy procesów izotermicznych w różnych współrzędnych
Prawo Gay-Lussaca (proces izobaryczny)
Proces izobaryczny nazywa się zmianą stanu gazu, w którym jego ciśnienie pozostaje stałe.
Dla stałej masy gazu przy stałym ciśnieniu stosunek objętości gazu do temperatury jest wartością stałą:
To prawo wynika również z równania Mendelejewa - Clapeyrona:
![]()
izobary.
Rozważ dwa procesy izobaryczne z ciśnieniami i tytułem = "(! LANG: Renderowane przez QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).!}
Zdefiniujmy postać wykresu we współrzędnych, oznaczając stałą literą, zapisujemy funkcjonalną zależność objętości od temperatury w procesie izobarycznym:
Widać, że przy stałym ciśnieniu objętość gazu jest wprost proporcjonalna do jego temperatury. Wykres bezpośredniej proporcjonalności, a zatem wykres izobary we współrzędnych jest linią prostą przechodzącą przez początek(ryc. 2, c). W rzeczywistości, przy wystarczająco niskich temperaturach, wszystkie gazy zamieniają się w ciecze, do których nie mają już zastosowania prawa gazowe. Dlatego w pobliżu początku współrzędnych izobary na ryc. 2, c) są pokazane linią przerywaną.

Rys. 2. Wykresy procesów izobarycznych w różnych współrzędnych
Prawo Karola (proces izochoryczny)
Proces izochoryczny nazywa się zmianą stanu gazu, w którym jego objętość pozostaje stała.
Dla stałej masy gazu o stałej objętości stosunek ciśnienia gazu do jego temperatury jest wartością stałą:
Dla dwóch stanów gazowych prawo to będzie zapisane w postaci:
To prawo można również uzyskać z równania Mendelejewa - Clapeyrona:
![]()
Nazywa się wykresy zależności parametrów gazu przy stałym ciśnieniu izochory.
Rozważ dwa procesy izochoryczne z woluminami i tytułem = "(! LANG: Renderowane przez QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).!}
Aby określić typ wykresu procesu izochorycznego we współrzędnych, oznaczamy stałą w prawie Charlesa literą, otrzymujemy:
Zatem funkcjonalna zależność ciśnienia od temperatury przy stałej objętości jest bezpośrednią proporcjonalnością, wykres takiej zależności jest linią prostą przechodzącą przez początek współrzędnych (ryc. 3, c).

Rys. 3. Wykresy procesów izochorycznych w różnych współrzędnych
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenie | Do jakiej temperatury należy izobarycznie schładzać określoną masę gazu o temperaturze początkowej, aby objętość gazu zmniejszyła się o jedną czwartą? |
| Rozwiązanie | Proces izobaryczny opisuje prawo Gay-Lussaca: W zależności od stanu problemu, objętość gazu z powodu chłodzenia izobarycznego zmniejsza się o jedną czwartą, a zatem: skąd końcowa temperatura gazu: Przeliczmy jednostki na układ SI: początkowa temperatura gazu. Obliczmy:
|
| Odpowiedź | Gaz należy schłodzić do temperatury. |
PRZYKŁAD 2
| Ćwiczenie | Zamknięte naczynie zawiera gaz pod ciśnieniem 200 kPa. Jakie będzie ciśnienie gazu, jeśli temperatura wzrośnie o 30%? |
| Rozwiązanie | Ponieważ pojemnik z gazem jest zamknięty, objętość gazu się nie zmienia. Proces izochoryczny opisuje prawo Karola: W zależności od stanu problemu temperatura gazu wzrosła o 30%, więc można napisać: Podstawiając ostatni stosunek w prawie Karola, otrzymujemy: Przeliczmy jednostki na układ SI: początkowe ciśnienie gazu kPa = Pa. Obliczmy: |
| Odpowiedź | Ciśnienie gazu wynosi 260 kPa. |
PRZYKŁAD 3
| Ćwiczenie | System tlenowy, w który wyposażony jest samolot, zawiera: |
| Rozwiązanie | Proces izotermiczny opisuje prawo Boyle-Mariotte: |
Prawo Boyle'a - Mariotte
Prawo Boyle'a - Mariott to jedno z podstawowych praw dotyczących gazu, odkryte w 1662 przez Roberta Boyle'a i niezależnie odkryte przez Edma Marriotta w 1676. Opisuje zachowanie gazu w procesie izotermicznym. Prawo jest konsekwencją równania Clapeyrona.
- 1 Receptury
- 2 Konsekwencje
- 3 Zobacz także
- 4 notatki
- 5 Literatura
Treść
Prawo Boyle-Mariotte jest następujące:
Przy stałej temperaturze i masie gazu iloczyn ciśnienia gazu i jego objętości jest stały.
W formie matematycznej to stwierdzenie jest zapisane w formie wzoru
gdzie jest ciśnienie gazu; jest objętością gazu i jest wartością stałą w uzgodnionych warunkach. Ogólnie rzecz biorąc, wartość zależy od charakteru chemicznego, masy i temperatury gazu.
Oczywiście, jeżeli indeks 1 oznacza wielkości związane ze stanem początkowym gazu, a indeks 2 – stanem końcowym, to powyższy wzór można zapisać w postaci
.
Z powyższych i powyższych wzorów wynika postać zależności ciśnienia gazu od jego objętości w procesie izotermicznym:
Ta zależność jest kolejnym, równoważnym pierwszemu, wyrazem treści prawa Boyle'a - Mariotte'a. To znaczy, że
Ciśnienie masy gazu o stałej temperaturze jest odwrotnie proporcjonalne do jego objętości.
Wówczas zależność pomiędzy stanem początkowym i końcowym gazu biorącego udział w procesie izotermicznym można wyrazić jako:
Należy zauważyć, że stosowalność tego i powyższego wzoru łączącego początkowe i końcowe ciśnienia i objętości gazu nie ogranicza się do przypadku procesów izotermicznych. Wzory zachowują ważność w przypadkach, gdy temperatura zmienia się w trakcie procesu, ale w wyniku procesu temperatura końcowa okazuje się równa temperaturze początkowej.
Ważne jest, aby wyjaśnić, że to prawo obowiązuje tylko w przypadkach, gdy dany gaz można uznać za idealny. W szczególności prawo Boyle'a - Mariotte'a jest spełnione z dużą dokładnością w odniesieniu do gazów rozrzedzonych. Jeśli gaz jest silnie sprężony, obserwuje się znaczne odchylenia od tego prawa.
Prawo Boyle'a - Mariotte'a, Charles'a i Gay-Lussaca, uzupełnione o prawo Avogadro, są wystarczającą podstawą do uzyskania równania stanu gazu doskonałego.
Konsekwencje
Prawo Boyle'a - Mariotte stwierdza, że ciśnienie gazu w procesie izotermicznym jest odwrotnie proporcjonalne do objętości zajmowanej przez gaz. Jeśli weźmiemy pod uwagę, że gęstość gazu jest również odwrotnie proporcjonalna do zajmowanej przez niego objętości, to dochodzimy do wniosku:
W procesie izotermicznym ciśnienie gazu zmienia się wprost proporcjonalnie do jego gęstości.
Wiadomo, że ściśliwość, czyli zdolność gazu do zmiany objętości pod wpływem ciśnienia, charakteryzuje się współczynnikiem ściśliwości. W przypadku procesu izotermicznego mówi się o współczynniku ściśliwości izotermicznej, który określa wzór
gdzie indeks dolny T oznacza, że pochodna cząstkowa jest pobierana w stałej temperaturze. Podstawiając do tego wzoru wyrażenie na zależność między ciśnieniem a objętością z prawa Boyle'a - Mariotte'a otrzymujemy:Dochodzimy więc do wniosku:
Izotermiczny współczynnik ściśliwości gazu doskonałego jest równy odwrotności jego ciśnienia.
Zobacz też
- Prawo geja Lussaca
- Prawo Karola
- Prawo Avogadro
- Gaz doskonały
- Równanie stanu gazu doskonałego
Notatki (edytuj)
- Boyle - Prawo Mariotte'a // Encyklopedia fizyczna / Ch. wyd. AM Prochorow. - M .: radziecka encyklopedia, 1988 .-- T. 1. - S. 221-222. - 704 pkt. - 100 000 egzemplarzy
- Sivukhin D.V. Ogólny kurs fizyki. - M .: Fizmatlit, 2005 .-- T. II. Termodynamika i fizyka molekularna. - S. 21-22. - 544 pkt. - ISBN 5-9221-0601-5.
- 1 2 Podstawowy podręcznik fizyki / Wyd. GS Landsberg. - Moskwa: Nauka, 1985. - T. I. Mechanika. Ciepło. Fizyka molekularna. - S. 430 .-- 608 s.
- 1 2 3 Kikoin AK, Kikoin I.K., Fizyka Molekularna. - M .: Nauka, 1976 .-- S. 35-36.
- Przy stałej masie.
- Livshits L. D. Ściśliwość // Encyklopedia fizyczna / Ch. wyd. AM Prochorow. - M .: Wielka rosyjska encyklopedia, 1994 .-- T. 4. - S. 492-493. - 704 pkt. - 40 000 egzemplarzy
ISBN 5-85270-087-8.
Literatura
- Pietruszewski F.F. Prawo Boyle-Mariotte // Słownik encyklopedyczny Brockhausa i Efrona: w 86 tomach (82 tomy i 4 dodatkowe). - SPb., 1890-1907.
Prawo Boyle'a — informacje o hotelu Marriott
Prawo Boyle'a - Mariotte
Prawo Boyle'a - Mariotte
Prawo Boyle'a - Mariotte Przeglądasz temat
Prawo Boyle'a - Mariotte co, Prawo Boyle'a - Mariotte kto, Prawo Boyle'a - opis Mariotte
W tym artykule i wideo znajdują się fragmenty z wikipedii
Nasza strona posiada system w funkcji wyszukiwarki. Powyżej: „Czego szukałeś?” Możesz zapytać o wszystko w systemie za pomocą pudełka. Witamy w naszej prostej, stylowej i szybkiej wyszukiwarce, którą przygotowaliśmy, aby zapewnić Ci najdokładniejsze i najbardziej aktualne informacje.
Wyszukiwarka zaprojektowana dla Ciebie dostarcza najbardziej trafnych i dokładnych informacji dzięki prostej konstrukcji i szybko działającemu systemowi. Na naszej stronie internetowej możesz znaleźć prawie wszystkie informacje, których szukasz.
W tej chwili obsługujemy tylko w języku angielskim, tureckim, rosyjskim, ukraińskim, kazachskim i białoruskim.
Wkrótce do systemu zostaną dodane nowe języki.
Życie sławnych osób dostarcza informacji, obrazów i filmów na setki tematów, takich jak politycy, urzędnicy państwowi, lekarze, strony internetowe, fabryki, pojazdy technologiczne, samochody i nie tylko.
Prawo Boyle-Mariotte

Zależność ilościową między objętością a ciśnieniem gazu po raz pierwszy ustalił Robert Boyle w 1662 r. * Prawo Boyle'a-Mariotte'a mówi, że w stałej temperaturze objętość gazu jest odwrotnie proporcjonalna do jego ciśnienia.
To prawo dotyczy każdej ustalonej ilości gazu. Jak widać na ryc. 3.2, jego graficzna reprezentacja może być inna. Wykres po lewej pokazuje, że przy niskim ciśnieniu objętość ustalonej ilości gazu jest duża.
Objętość gazu maleje wraz ze wzrostem ciśnienia. Matematycznie jest napisane tak:
Jednak zazwyczaj prawo Boyle-Mariotte jest napisane w formie
Taki zapis pozwala, na przykład, znając początkową objętość gazu V1 i jego ciśnienie p, obliczyć ciśnienie p2 w nowej objętości V2.
Prawo Gaya Lussaca (Prawo Karola)
W 1787 Charles wykazał, że przy stałym ciśnieniu objętość gazu zmienia się (proporcjonalnie do jego temperatury. Zależność tę przedstawiono w formie graficznej na Rys. 3.3, z której wynika, że objętość gazu jest liniowo związana z jego temperaturą. W postaci matematycznej: zależność ta jest wyrażona jako :
Prawo Karola jest często pisane w innej formie:
V1IT1 = V2T1 (2)
Prawo Karola zostało ulepszone przez J. Gay-Lussaca, który w 1802 r. ustalił, że objętość gazu przy zmianie jego temperatury o 1 ° С zmienia się o 1/273 objętości, którą zajmował przy 0 ° С.
Wynika z tego, że jeśli przyjmiemy dowolną objętość dowolnego gazu o temperaturze 0 ° С i przy stałym ciśnieniu zmniejszymy jego temperaturę o 273 ° С, wówczas końcowa objętość będzie równa zeru. Odpowiada to temperaturze -273 ° C, czyli 0 K. Temperatura ta nazywana jest zerem absolutnym. W rzeczywistości nie da się tego osiągnąć. Na ryc.
3.3 pokazuje, w jaki sposób ekstrapolacja wykresów objętości gazu w funkcji temperatury prowadzi do zerowej objętości w temperaturze 0 K.
Zero absolutne jest, ściśle rzecz biorąc, nieosiągalne. Jednak w warunkach laboratoryjnych możliwe jest osiągnięcie temperatur różniących się od zera absolutnego tylko o 0,001 K. W takich temperaturach losowe ruchy cząsteczek praktycznie ustają. Prowadzi to do niesamowitych właściwości.
Na przykład metale schłodzone do temperatur bliskich zeru bezwzględnego prawie całkowicie tracą swoją oporność elektryczną i stają się nadprzewodnikami*. Przykładem substancji o innych niezwykłych właściwościach niskotemperaturowych jest hel.
W temperaturach bliskich zeru bezwzględnego lepkość helu zanika i staje się on nadciekły.* W 1987 r. odkryto substancje (ceramika spiekana z tlenków pierwiastków lantanowców, baru i miedzi), które stają się nadprzewodnikami w stosunkowo wysokich temperaturach, rzędu 100 K (- 173°C). Te „wysokotemperaturowe” nadprzewodniki otwierają wielkie perspektywy technologiczne. przeł.
Główny sprzęt laboratoryjny to pulpit, na którym przeprowadzane są wszystkie prace eksperymentalne.
Każde laboratorium musi mieć dobrą wentylację. Wymagany jest dygestorium, w którym wszystkie prace wykonuje się przy użyciu związków śmierdzących lub trujących, a także spalając w tyglach substancje organiczne.
Wysoce lotne, szkodliwe lub śmierdzące substancje (płynny brom, stężony kwas azotowy i solny itp.)
), a także substancje łatwopalne (dwusiarczek węgla, eter, benzen itp.).
Laboratorium wymaga urządzeń wodno-kanalizacyjnych, techniczno-prądowych, gazowych i grzewczych. Pożądane jest również posiadanie doprowadzenia sprężonego powietrza, linii próżniowej, doprowadzenia gorącej wody i pary.
Jeśli nie ma specjalnego połączenia, do uzyskania ciepłej wody wykorzystywane są podgrzewacze wody różnych systemów.
Dzięki tym urządzeniom ogrzewanym prądem lub gazem można szybko uzyskać strumień gorącej wody o temperaturze prawie 100°C.
Laboratorium musi posiadać instalacje do destylacji (lub demineralizacji) wody, ponieważ nie można pracować w laboratorium bez wody destylowanej lub demineralizowanej. W przypadkach, gdy uzyskanie wody destylowanej jest trudne lub niemożliwe, stosuje się komercyjną wodę destylowaną.
W pobliżu stołów roboczych i zlewów muszą znajdować się gliniane słoiki o pojemności 10-15 litrów do spuszczania zbędnych roztworów, odczynników itp., a także kosze na potłuczone szkło, papier i inne suche odpady.
Oprócz biurek laboratorium powinno posiadać biurko, w którym przechowywane są wszystkie zeszyty i notatki oraz w razie potrzeby tabelę tytułową. W pobliżu stołów roboczych powinny znajdować się wysokie taborety lub krzesła.
Wagi analityczne i przyrządy wymagające stacjonarnego montażu (elektrometryczne, optyczne itp.) umieszcza się w oddzielnym pomieszczeniu związanym z laboratorium, a dla wagi analitycznej należy wyznaczyć specjalne pomieszczenie wagowe. Pożądane jest, aby waga znajdowała się z oknami na północ. Jest to ważne, ponieważ waga nie może być wystawiona na działanie promieni słonecznych („Waga i ważenie”).
W laboratorium trzeba również mieć najpotrzebniejsze podręczniki, podręczniki i podręczniki, ponieważ często podczas pracy potrzebny jest ton lub inne źródło.
Zobacz też
Strona 3
Szkło chemiczne stosowane w laboratoriach można podzielić na kilka grup. Zgodnie z przeznaczeniem naczynia można podzielić na naczynia uniwersalne, specjalistyczne i wolumetryczne. Według materiału - do naczyń ze szkła prostego, szkła specjalnego, kwarcu.
Do grupy. ogólnego przeznaczenia to te przedmioty, które zawsze powinny znajdować się w laboratoriach i bez których nie można wykonać większości prac. Są to: probówki, lejki, proste i rozdzielające, zlewki, kolby płaskodenne, krystalizatory, kolby stożkowe (Erlenmeyera), kolby Bunsena, lodówki, retorty, kolby na wodę destylowaną, trójniki, krany.
Grupa specjalnego przeznaczenia obejmuje te przedmioty, które są używane do jednego celu, na przykład: aparat Kippa, aparat Sok-rally, aparat Kjeldahla, chłodnice zwrotne, kolby Wul-fa, kolby Tiszczenki, piknometry, areometry, kolby Drexel , aparat potasowy, analizator dwutlenku węgla, kolby okrągłodenne, specjalne lodówki, przyrząd do pomiaru masy cząsteczkowej, przyrządy do pomiaru temperatury topnienia i wrzenia itp.
Przyrządy pomiarowe obejmują: cylindry miarowe i zlewki, pipety, biurety i kolby miarowe.Na początek sugerujemy obejrzenie poniższego filmu, w którym krótko i łatwo omówiono główne rodzaje szkła chemicznego.
Zobacz też:
Naczynia ogólnego przeznaczenia
Probówki (ryc. 18) to wąskie cylindryczne naczynia z zaokrąglonym dnem; występują w różnych rozmiarach i średnicach i są wykonane z innego szkła. Zwykłe „probówki laboratoryjne są wykonane ze szkła niskotopliwego, ale do prac specjalnych, gdy wymagane jest podgrzanie do wysokich temperatur, probówki są wykonane ze szkła wysokotopliwego lub kwarcu.
Oprócz zwykłych, prostych probówek stosuje się również probówki z podziałką i stożkowe wirówkowe.
Do przechowywania pracujących probówek służą specjalne drewniane, plastikowe lub metalowe stojaki (rys. 19).
Ryż. 18. Rury proste i stopniowane
Ryż. 20. Wkładanie do probówki kolczyk ze sproszkowanymi substancjami.
Probówki są używane głównie do prac analitycznych lub mikrochemicznych. Podczas przeprowadzania reakcji w probówce odczynników nie należy stosować w zbyt dużych ilościach. Absolutnie niedopuszczalne jest wypełnienie probówki po brzegi.
Reakcja odbywa się z małymi ilościami substancji; Wystarczy 1/4 lub nawet 1/8 pojemności probówki. Czasami do probówki trzeba wstrzyknąć substancję stałą (proszki, kryształy itp.).
), w tym celu pasek papieru o szerokości nieco mniejszej niż średnica probówki jest składany na pół wzdłuż jej długości i do powstałej miarki wlewa się wymaganą ilość substancji stałej. Probówkę trzyma się w lewej ręce, przechylając ją poziomo, a miarkę wprowadza się do niej prawie do samego dna (ryc. 20).
Następnie probówkę umieszcza się pionowo, ale też lekko w nią uderza. Gdy wszystkie ciała stałe się rozsypą, wyjmij papierową szufelkę.
W celu wymieszania nalewanych odczynników probówkę trzyma się za górny koniec kciukiem i palcem wskazującym lewej ręki i podpiera palcem środkowym, a spód probówki uderza się palcem wskazującym prawej ręki. To wystarczy, aby jego zawartość była dobrze wymieszana.
Absolutnie niedopuszczalne jest zamykanie probówki palcem i potrząsanie nią w ten sposób; w takim przypadku można nie tylko wprowadzić coś obcego do płynu w probówce, ale czasami uszkodzić skórę palca, poparzyć itp.
Jeśli tubka jest wypełniona więcej niż w połowie płynem, wymieszaj zawartość szklanym prętem.
Jeśli rura wymaga podgrzania, należy ją zacisnąć w uchwycie.
Przy nieudolnym i mocnym nagrzaniu probówki płyn szybko się gotuje i wylewa się z niej, dlatego należy ją ostrożnie podgrzać. Gdy zaczną pojawiać się bąbelki, probówkę należy odstawić na bok i nie trzymać jej w płomieniu palnika , ale w pobliżu lub powyżej, kontynuuj ogrzewanie gorącym powietrzem. Po podgrzaniu otwarty koniec probówki należy skierować z dala od pracownika i sąsiadów na stole.Gdy nie jest wymagane mocne ogrzewanie, lepiej zanurzyć rurkę z podgrzaną cieczą w gorącej wodzie. W przypadku pracy z małymi probówkami (do półmikroanalizy) podgrzewa się je tylko w gorącej wodzie wlewanej do szklanej zlewki odpowiedniej wielkości (o pojemności nie większej niż 100 ml).
Lejki służą do nalewania - płynów, do filtrowania itp. Lejki chemiczne produkowane są w różnych rozmiarach, ich górne średnice to 35, 55, 70, 100, 150, 200, 250 i 300 mm.
Konwencjonalne lejki mają gładką ściankę wewnętrzną, ale lejki z żebrowaną powierzchnią wewnętrzną są czasami używane do szybszej filtracji.
Lejki filtrujące mają zawsze kąt 60 ° i odcięty długi koniec.
Podczas pracy lejki montuje się albo w specjalnym statywie, albo w pierścieniu na zwykłym statywie laboratoryjnym (rys. 21).
Do filtrowania do szklanki przydatne jest wykonanie prostego uchwytu na lejek (ryc. 22).W tym celu z blachy aluminiowej o grubości około 2 mm wycina się pasek o długości 70-80 lsh i szerokości 20 mm .
Na jednym z końców taśmy wierci się otwór o średnicy 12-13 mm i taśmę wygina się, jak pokazano na rys. 22,a. Sposób mocowania lejka na szkle pokazano na ryc. 22, ur.
Wlewając płyn do butelki lub kolby, nie napełniaj lejka po brzegi.
Jeśli lejek ściśle przylega do gardła naczynia, do którego wlewa się ciecz, wówczas przenoszenie staje się trudne, ponieważ wewnątrz naczynia powstaje zwiększone ciśnienie. Dlatego od czasu do czasu trzeba podnosić lejek.
Jeszcze lepiej zrobić przerwę między lejkiem a szyjką naczynia umieszczając między nimi np. kartkę. W takim przypadku należy uważać, aby uszczelka nie dostała się do naczynia. Bardziej wskazane jest użycie trójkąta z drutu, który możesz wykonać samodzielnie.Ten trójkąt umieszcza się na szyjce naczynia, a następnie wprowadza się lejek.
Na szyjkach naczyń znajdują się specjalne gumowe lub plastikowe nakładki, które zapewniają komunikację wnętrza kolby z atmosferą zewnętrzną (rys. 23).
Ryż. 21. Wzmocnienie szklistego lejka chemicznego
Ryż. 22. Urządzenie do mocowania lejka na szkle, w statywie.
Do prac analitycznych podczas filtrowania lepiej jest użyć lejków analitycznych (ryc. 24). Cechą charakterystyczną tych lejków jest to, że mają wydłużony cięty koniec, którego wewnętrzna średnica jest mniejsza w górnej części niż w dolnej; ta konstrukcja przyspiesza filtrację.
Ponadto istnieją lejki analityczne z żebrowaną powierzchnią wewnętrzną podtrzymującą filtr oraz z kulistym rozszerzeniem w miejscu, w którym lejek przechodzi do rurki. Lejki tej konstrukcji przyspieszają proces filtracji nawet trzykrotnie w porównaniu do lejków konwencjonalnych.
Ryż. 23. Dysze do szyjek butelek. Ryż. 24. Lejek analityczny.
Rozdzielacze(rys. 25) służą do oddzielania niemieszających się cieczy (np. wody i oleju). Mają kształt cylindryczny lub gruszkowy iw większości przypadków są wyposażone w szklany korek.
W górnej części odgałęzienia znajduje się szklany kran. Pojemność rozdzielaczy jest różna (od 50 ml do kilku litrów), w zależności od pojemności zmienia się również grubość ścianek.
Im mniejsza pojemność lejka, tym cieńsze są jego ścianki i odwrotnie.
Podczas pracy rozdzielacze są wzmacniane na różne sposoby, w zależności od pojemności i kształtu. Cylindryczny lejek o małej pojemności można po prostu przymocować do stopy. Pomiędzy dwoma pierścieniami umieszczone są duże lejki.
Dolna część cylindrycznego lejka powinna spoczywać na pierścieniu, którego średnica jest nieco mniejsza od średnicy lejka, górny pierścień ma nieco większą średnicę.
Jeśli lejek się kołysze w tym samym czasie, talerz z korka należy umieścić między pierścieniem a lejkiem.
Na pierścieniu zamocowany jest lejek dzielący w kształcie gruszki, którego szyjka jest zaciśnięta łapą. Zawsze najpierw zamocuj lejek, a dopiero potem wlej do niego rozdzielane płyny.Wkraplacze (rys. 26) różnią się od rozdzielaczy tym, że są lżejsze, cienkościenne i
Ryż. 25. Lejki rozdzielające. Ryż. 26. Lejki kroplowe.
W większości przypadków z długim końcem. Lejki te znajdują zastosowanie w wielu pracach, gdy substancję dodaje się do masy reakcyjnej małymi porcjami lub kroplami. Dlatego zwykle stanowią część urządzenia. Lejki mocuje się w szyjce kolby na cienkim odcinku lub korkiem lub gumowym korkiem.
Przed rozpoczęciem pracy z rozdzielaczem lub wkraplaczem szklaną część kranu należy dokładnie nasmarować wazeliną lub specjalnym smarem.
Pozwala to na łatwe i bezwysiłkowe odkręcenie kranu, co jest bardzo ważne, gdyż szczelnie odkręcony kran może go złamać podczas otwierania lub uszkodzić całe urządzenie.
Smar należy nakładać bardzo cienką warstwą, aby podczas obracania zaworu nie wpadł do rurki lejka ani do wnętrza otworu zaworu.
Dla bardziej równomiernego wypływu kropel cieczy z wkraplacza oraz do monitorowania natężenia przepływu cieczy stosuje się wkraplacze z dyszą (rys. 27). Takie lejki mają rozszerzoną część zaraz po odbiciu, która zamienia się w rurkę. Ciecz przepływa przez kran do tego rozszerzenia przez krótką rurkę, a następnie do rurki lejka.
Ryż. 27. Lejek kroplowy z dyszą
Ryż. 28. Zlewki.
Ryż. 29. Płaski lejek z dyszą
NACZYNIA SZKLANE 1 2 3
Zobacz też
Lekcja 25. Prawo Boyle-Mariotte'a - HIMI4KA

Archiwum lekcji ›Podstawowe prawa chemii
Lekcja 25” Prawo Boyle-Mariotte„Z kursu” Chemia dla manekinów»Rozważ prawo dotyczące ciśnienia i objętości gazu oraz wykresy zależności ciśnienia od objętości i objętości od ciśnienia. Przypomnę, że w ostatniej lekcji „Ciśnienie gazu” zbadaliśmy urządzenie i zasadę działania barometru rtęciowego, a także podaliśmy definicję ciśnienia i rozważyliśmy jego jednostki miary.
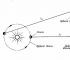
Robert Boyle(1627-1691), któremu zawdzięczamy pierwszą praktycznie poprawną definicję pierwiastka chemicznego (dowiadujemy się w rozdziale 6), interesowały się również zjawiskami zachodzącymi w naczyniach z rozrzedzonym powietrzem.
Wymyślając pompy próżniowe do wypompowywania powietrza z zamkniętych naczyń zwrócił uwagę na właściwość znaną każdemu, kto zdarzył się pompować komorę do piłki nożnej lub ostrożnie ściskać balon: im bardziej powietrze jest sprężone w zamkniętym naczyniu, tym bardziej odporny na ściskanie.
Boyle nazwał tę nieruchomość „ sprężystość»Powietrze i zmierzyłem je prostym urządzeniem pokazanym na ryc. 3.2, a i b.
Boyle zablokował trochę powietrza rtęcią na zamkniętym końcu zakrzywionej rurki (zdjęcie 3-2, a), a następnie wycisnąć to powietrze, stopniowo dodając rtęć do otwartego końca rurki (zdjęcie 3-2, b).
Ciśnienie wywierane przez powietrze w zamkniętej części rury jest równe sumie ciśnienia atmosferycznego i ciśnienia słupa rtęci o wysokości h (h jest wysokością, na której poziom rtęci na otwartym końcu rurka przekracza poziom rtęci na zamkniętym końcu). Uzyskane przez Boyle pomiary ciśnienia i objętości przedstawiono w tabeli 1. 3-1.
Chociaż Boyle nie podejmował specjalnych środków, aby utrzymać stałą temperaturę gazu, wydaje się, że w jego eksperymentach zmieniła się ona tylko nieznacznie. Niemniej jednak Boyle zauważył, że ciepło płomienia świecy powodowało znaczne zmiany właściwości powietrza.
Analiza danych dotyczących ciśnienia i objętości powietrza podczas jego sprężania
Tabela 3-1, który zawiera dane eksperymentalne Boyle'a dotyczące zależności między ciśnieniem a objętością powietrza atmosferycznego, znajduje się pod spojlerem.
Po tym, jak badacz otrzymuje dane podobne do przedstawionych w tabeli. 3-1, próbuje znaleźć równanie matematyczne, które łączy dwie zależne wielkości, które zmierzył.
Jednym ze sposobów uzyskania takiego równania jest graficzne wykreślenie zależności różnych stopni jednej wielkości od drugiej, w nadziei uzyskania wykresu linii prostej.
Ogólne równanie prostej to:
gdzie x i y są zmiennymi powiązanymi, a aib są liczbami stałymi. Jeśli b wynosi zero, linia prosta przechodzi przez początek.
Na ryc. 3-3 pokazują różne sposoby wykreślania danych dla ciśnienia P i objętości V, pokazane w tabeli. 3-1.Wykresy P versus 1/K i V versus 1/P są liniami prostymi przechodzącymi przez początek.
Wykres zależności logarytmu P od logarytmu V jest również linią prostą o ujemnym nachyleniu, której tangens wynosi -1. Wszystkie te trzy wykresy prowadzą do równoważnych równań:
- P = a / V (3-3a)
- V = a / P (3-3b)
- lg V = lg a - lg P (3-3v)
Każde z tych równań reprezentuje jedną z opcji Prawo Boyle-Mariotte, które zwykle formułuje się następująco: dla danej liczby moli gazu jego ciśnienie jest proporcjonalne do objętości, pod warunkiem, że temperatura gazu pozostaje stała.
Nawiasem mówiąc, prawdopodobnie zastanawiasz się, dlaczego prawo Boyle-Mariotte nosi podwójne imię. Stało się tak, ponieważ prawo to, niezależnie od Roberta Boyle'a, który odkrył je w 1662 roku, zostało ponownie odkryte przez Edma Mariotte'a w 1676 roku. Więc to jest to.
Gdy związek między dwiema mierzonymi wielkościami jest prosty do tego stopnia, jak w tym przypadku, można go również ustalić numerycznie.
Jeżeli każdą wartość ciśnienia P przemnożymy przez odpowiadającą jej wartość objętości V, łatwo można upewnić się, że wszystkie produkty dla danej próbki gazu w stałej temperaturze są w przybliżeniu takie same (patrz Tabela 3-1). Tak więc możemy to napisać
Równanie (З-Зг) opisuje hiperboliczną zależność między wartościami P i V (patrz ryc. 3-3, a). Aby sprawdzić, czy wykres zależności P od V skonstruowany na podstawie danych eksperymentalnych rzeczywiście odpowiada hiperboli, skonstruujemy dodatkowy wykres zależności iloczynu PV od P i upewnimy się, że jest to pozioma linia prosta (patrz Ryc. 3-3, e) ...
Boyle stwierdził, że dla danej ilości dowolnego gazu w stałej temperaturze zależność między ciśnieniem P a objętością V jest dość zadowalająco opisana zależnością
- P V = const (przy stałej T i n) (3-4)
Formuła Boyle-Mariotte
Aby porównać objętości i ciśnienia tej samej próbki gazu w różnych warunkach (ale w stałej temperaturze), wygodnie jest przedstawić Prawo Boyle-Mariotte w następującym wzorze:
gdzie indeksy 1 i 2 odpowiadają dwóm różnym warunkom.
Przykład 4. Plastikowe torby z żywnością dostarczaną na płaskowyż Kolorado (patrz przykład 3) często pękają, ponieważ powietrze w nich unoszące się z poziomu morza na wysokość 2500 m w warunkach obniżonego ciśnienia atmosferycznego rozszerza się.
Jeśli przyjmiemy, że w worku znajduje się 100 cm3 powietrza o ciśnieniu atmosferycznym odpowiadającym poziomowi morza, jaką objętość powinno zajmować to powietrze przy tej samej temperaturze na płaskowyżu Kolorado? (Załóżmy, że skurczone torebki są używane do dostarczania produktów, które nie ograniczają rozszerzania się powietrza; brakujące dane należy zaczerpnąć z przykładu 3.)Rozwiązanie
Wykorzystajmy prawo Boyle'a w postaci równania (3-5), gdzie indeks 1 będzie odnosić się do warunków na poziomie morza, a indeks 2 do warunków na wysokości 2500 m n.p.m. Następnie należy obliczyć Р1 = 1000 atm, V1 = 100 cm3, Р2 = 0,750 atm i V2. Więc,
Badanie zależności pomiędzy parametrami charakteryzującymi stan danej masy gazu rozpoczynamy od badania procesów gazowych zachodzących przy niezmienionym jednym z parametrów. angielski naukowiec Boyle(w 1669) i francuski naukowiec Marriott(w 1676) odkryli prawo, które wyraża zależność zmiany ciśnienia od zmiany objętości gazu w stałej temperaturze. Przeprowadźmy następujący eksperyment.
Obracając uchwyt zmienimy objętość gazu (powietrza) w butli A (ryc. 11, a). Zgodnie z odczytem manometru zauważamy, że zmienia się również ciśnienie gazu. Zmienimy objętość gazu w naczyniu (objętość określamy na skali B) i widząc ciśnienie zapiszemy je w tabeli. 1. Widać z niego, że iloczyn objętości gazu przez jego ciśnienie był prawie stały: ile razy „objętość gazu zmniejszyła się, w tym samym czasie jego ciśnienie wzrosło.

W wyniku podobnych, dokładniejszych eksperymentów odkryto: dla danej masy gazu w stałej temperaturze ciśnienie gazu zmienia się odwrotnie ze zmianą objętości gazu. To jest sformułowanie prawa Boyle-Mariotte. Matematycznie będzie to napisane dla dwóch stanów w następujący sposób:
![]()
Nazywa się proces zmiany stanu gazu w stałej temperaturze izotermiczny. Wzór Boyle-Mariotte jest równaniem stanu izotermicznego gazu. W stałej temperaturze średnia prędkość ruchu cząsteczek nie zmienia się. Zmiana objętości gazu powoduje zmianę liczby uderzeń cząsteczek na ścianki naczynia. To jest powód zmiany ciśnienia gazu.
Zobrazujmy ten proces graficznie, na przykład dla przypadku V = 12 litrów, p = 1 at.... Wykreślimy objętość gazu na osi odciętej, a jego ciśnienie na osi rzędnych (ryc. 11, b). Znajdujemy punkty odpowiadające każdej parze wartości V i p, a łącząc je ze sobą otrzymujemy wykres procesu izotermicznego. Linia pokazująca zależność między objętością a ciśnieniem gazu w stałej temperaturze nazywana jest izotermą. Czysto izotermiczne procesy nie występują. Ale nierzadko zdarza się, że temperatura gazu zmienia się nieznacznie, na przykład, gdy sprężarka pompuje powietrze do cylindrów, gdy palna mieszanka jest wtryskiwana do cylindra silnika spalinowego. W takich przypadkach objętość i ciśnienie gazu oblicza się zgodnie z prawem Boyle-Mariotte*.