Metall bog'lanish - bu. Metall bog'lanish: hosil bo'lish mexanizmi
Barcha metallar quyidagi xususiyatlarga ega:
Tashqi energiya darajasidagi oz sonli elektronlar (ba'zi istisnolardan tashqari, 6,7 va 8 bo'lishi mumkin);
Katta atom radiusi;
Kam ionlanish energiyasi.
Bularning barchasi yadrodan tashqi juftlanmagan elektronlarni oson ajratilishiga yordam beradi. Bunday holda, atom juda ko'p erkin orbitallarga ega. Metall bog'lanishning sxemasi turli atomlarning ko'p sonli orbital hujayralarining bir -biriga o'xshashligini ko'rsatadi, natijada ular umumiy kristalli bo'shliqni hosil qiladi. Unga har bir atomdan elektronlar kiradi, ular erkin aylana boshlaydi turli qismlar panjara. Vaqti -vaqti bilan ularning har biri kristall joyidagi ionga birikadi va uni atomga aylantiradi, keyin yana ajralib, ion hosil qiladi.
Shunday qilib, metall bog'lanish - oddiy metall kristalli atomlar, ionlar va erkin elektronlar orasidagi bog'lanish. Tarkibda erkin harakatlanadigan elektron bulutga "elektron gaz" deyiladi. Aynan ular ko'pchilikni tushuntiradi jismoniy xususiyatlar metallar va ularning qotishmalari.
Metall kimyoviy bog'lanish qanday aniq amalga oshadi? Turli xil misollar mavjud. Keling, lityum parchasini ko'rib chiqishga harakat qilaylik. Agar siz uni no'xatdek olsangiz ham, minglab atomlar bo'ladi. Keling, tasavvur qilaylik, bu minglab atomlarning har biri o'zining yagona valentlik elektronini umumiy kristalli makonga beradi. Bundan tashqari, ma'lum bir elementning elektron tuzilishini bilib, bo'sh orbitallar sonini ko'rishingiz mumkin. Lityumda ulardan 3 tasi bo'ladi (p-orbitallar ikkinchi darajali energiya). O'n minglab har bir atom uchun uchta - bu "elektron gaz" erkin harakatlanadigan kristal ichidagi umumiy bo'shliq.
Metall bog'langan modda har doim kuchli bo'ladi. Axir elektron gaz kristalning qulashiga yo'l qo'ymaydi, faqat qatlamlarni siljitadi va uni darhol tiklaydi. U porlaydi, ma'lum zichlikka ega (ko'pincha yuqori), eriydiganlik, egiluvchanlik va egiluvchanlik.
Metall bog'lanish yana qaerda amalga oshiriladi? Moddalarga misollar:
Oddiy tuzilmalar shaklidagi metallar;
Barcha metall qotishmalari bir -biri bilan;
Barcha metallar va ularning qotishmalari suyuq va qattiq holatda bo'ladi.
Aniq misollar shunchaki aql bovar qilmas miqdorda keltirilishi mumkin, chunki metallar davriy tizim 80 dan ortiq!
Ichkarida shakllanish mexanizmi umumiy ko'rinish quyidagi yozuv bilan ifodalanadi: Me 0 - e - ↔ Me n +. Diagrammadan aniq bo'ladiki, metall kristalda qanday zarralar bor.
Har qanday metall musbat zaryadlangan ionga aylanib, elektronlarni berishga qodir.
Masalan, temir: Fe 0 -2e - = Fe 2+
Ajratilgan manfiy zaryadlangan zarralar - elektronlar qayerga boradi? Minus har doim plyusga jalb qilinadi. Elektronlar kristall panjaradagi temirning boshqa ioniga (musbat zaryadli) tortiladi: Fe 2+ + 2e - = Fe 0
Ion neytral atomga aylanadi. Va bu jarayon ko'p marta takrorlanadi.
Ma'lum bo'lishicha, temirning erkin elektronlari ichkarida doimiy harakat kristalning butun hajmida, parchalanib ketadigan joylarga ionlarga birikadi. Bu hodisaning yana bir nomi delokalizatsiya qilingan elektron bulut... "Delokalizatsiya qilingan" atamasi bepul, biriktirilmagan degan ma'noni anglatadi.
Mavzular Kodifikatordan foydalaning: Kovalent kimyoviy bog ', uning navlari va hosil bo'lish mexanizmlari. Kovalent boglanish xususiyatlari (qutblanish va boglanish energiyasi). Ion aloqasi. Metall bog'lanish. Vodorod aloqasi
Intramolekulyar kimyoviy bog'lanishlar
Birinchidan, molekulalar ichidagi zarrachalar o'rtasida paydo bo'ladigan aloqalarni ko'rib chiqing. Bunday aloqalar deyiladi molekulalararo.
Kimyoviy bog'lanish atomlar orasida kimyoviy elementlar elektrostatik tabiatga ega va tomonidan shakllanadi tashqi (valentlik) elektronlarning o'zaro ta'siri, ko'proq yoki kamroq darajada musbat zaryadlangan yadrolar tomonidan ushlab turiladi bog'langan atomlar.
Bu erda asosiy tushuncha ELEKTRIK NEGATIV. U turini aniqlaydi kimyoviy bog'lanish atomlar va bu bog'lanish xossalari o'rtasida.
Atomning tortish (ushlab turish) qobiliyati tashqi(valentlik) elektronlar... Elektronegativlik tashqi elektronlarning yadroga tortilish darajasi bilan belgilanadi va asosan atom radiusi va yadro zaryadiga bog'liq.
Elektronegativlikni aniq aniqlash qiyin. L. Pauling nisbiy elektronegativlik jadvalini tuzdi (ikki atomli molekulalarning bog'lanish energiyalari asosida). Eng elektronegativ element ftor ma'nosi bilan 4 .
Shuni ta'kidlash kerakki, har xil manbalarda siz turli xil o'lchovlar va elektromagnitlik qiymatlari jadvallarini topishingiz mumkin. Bu qo'rqmaslik kerak, chunki u kimyoviy bog'lanishning shakllanishida muhim rol o'ynaydi atomlar va har qanday tizimda ham xuddi shunday.
Agar A: B kimyoviy bog'lanishidagi atomlardan biri elektronlarni kuchliroq tortsa, elektron jufti unga qarab siljiydi. Ko'proq Elektronativlikning farqi atomlar qancha ko'p bo'lsa, elektron jufti shunchalik joyidan siljiydi.
Agar o'zaro ta'sir qiluvchi atomlarning elektromagnitligi qiymatlari teng yoki taxminan teng bo'lsa: EO (A) ≈EO (B), keyin umumiy elektron jufti hech bir atomga o'tkazilmaydi: A: B.... Bu ulanish deyiladi polar bo'lmagan kovalent.
Agar o'zaro ta'sir qiluvchi atomlarning elektromagnitivligi turlicha bo'lsa -da, lekin unchalik katta bo'lmasa (elektromagnitlikdagi farq 0,4 dan 2 gacha: 0,4<ΔЭО<2 ), keyin elektron jufti atomlardan biriga siljiydi. Bu ulanish deyiladi kovalent qutb .
Agar o'zaro ta'sir qiluvchi atomlarning elektromagnitivligi sezilarli darajada farq qilsa (elektromagnitlikdagi farq 2dan katta: OEO> 2), keyin elektronlardan biri shakllanishi bilan deyarli boshqa atomga o'tkaziladi ionlar... Bu ulanish deyiladi ionli.
Kimyoviy bog'lanishlarning asosiy turlari: kovalent, ionli va metall aloqa. Keling, ularni batafsil ko'rib chiqaylik.
Kovalent kimyoviy boglanish
Kovalent bog – bu kimyoviy bog'lanish tomonidan shakllangan A: B umumiy elektron juftining shakllanishi ... Bunday holda, ikkita atom bir -biriga yopishmoq atom orbitallari. Kovalent bog`lanish elektromagnitivlikdagi ozgina farqli atomlarning o`zaro ta`siridan hosil bo`ladi (qoida tariqasida, ikkita metall bo'lmagan o'rtasida) yoki bitta element atomlari.
Kovalent boglarning asosiy xossalari
- diqqat,
- to'yinganlik,
- qutblilik,
- qutblanish.
Bu bog'lanish xususiyatlari moddalarning kimyoviy va fizik xususiyatlariga ta'sir qiladi.
Aloqa yo'nalishi moddalarning kimyoviy tuzilishi va shaklini tavsiflaydi. Ikki bog'lanish orasidagi burchaklar bog'lanish burchagi deyiladi. Masalan, suv molekulasida H-O-H bog'lanish burchagi 104,45 o, shuning uchun suv molekulasi qutbli, metan molekulasida esa H-C-H bog'lanish burchagi 108 o 28 '.

To'yinganlik Bu atomlarning cheklangan miqdordagi kovalent kimyoviy bog'lanish hosil qilish qobiliyatidir. Atom yaratishi mumkin bo'lgan bog'lanishlar soni deyiladi.
Polarlik Bog'lanish har xil elektromagnitivlikdagi ikkita atom o'rtasida elektron zichligining notekis taqsimlanishidan kelib chiqadi. Kovalent aloqalar qutbli va qutbsiz bo'linadi.
Polarizatsiya ulanishlar Bog'lanish elektronlarining tashqi elektr maydoni ta'sirida joyidan siljish qobiliyati(xususan, boshqa zarrachaning elektr maydoni). Polarizatsiyalanish elektronlarning harakatchanligiga bog'liq. Elektron yadrodan qanchalik uzoq bo'lsa, u shunchalik harakatchan va shunga mos ravishda molekula qutblanuvchan bo'ladi.

Kovalent polar bo'lmagan kimyoviy bog'lanish
Kovalent bog'lanishning 2 turi mavjud - POLAR va POLARSIZ .
Misol . H 2 vodorod molekulasining tuzilishini ko'rib chiqing. Har bir vodorod atomi tashqi energiya darajasida 1 ta ulanmagan elektronni tashiydi. Atomni ko'rsatish uchun biz Lyuis tuzilmasidan foydalanamiz - bu elektronlar nuqta bilan belgilanadigan atomning tashqi energiya sathining tuzilish diagrammasi. Lyuis nuqta tuzilishi modellari ikkinchi davr elementlari bilan ishlashda yordam beradi.
H. +. H = H: H
Shunday qilib, vodorod molekulasida bitta umumiy elektron jufti va bitta kimyoviy bog'lanish H - H mavjud. Bu elektron jufti vodorod atomlarining hech biriga siljimaydi, chunki vodorod atomlarining elektromagnitligi bir xil. Bu ulanish deyiladi polar bo'lmagan kovalent .

Kovalent qutbsiz (simmetrik) bog Kovalent bog'lanish-bu elektromagnitligi teng bo'lgan atomlar (qoida tariqasida, bir xil metall bo'lmaganlar) va shuning uchun atomlar yadrolari o'rtasida elektron zichligining bir xil taqsimlanishi bilan hosil bo'lgan kovalent bog'lanish.
Polar bo'lmagan bog'lanishlarning dipol momenti 0 ga teng.
Misollar: H 2 (H-H), O 2 (O = O), S 8.
Kovalent qutbli kimyoviy bog'lanish
Kovalent qutbli boglanish O'rtasida paydo bo'ladigan kovalent bog'lanishdir har xil elektromobillik atomlari (Qoida sifatida, har xil metallar) va bilan tavsiflanadi siljish Elektronegativ atomga umumiy elektron juftlik (polarizatsiya).
Elektron zichligi ko'proq elektronegativ atomga o'tkaziladi - shuning uchun unda qisman manfiy zaryad (δ-), qisman musbat zaryad (δ +, delta +) esa kamroq elektronegativ atomda paydo bo'ladi.
Atomlarning elektromagnitligi farqi qanchalik katta bo'lsa, shuncha yuqori bo'ladi qutblilik ulanishlar va boshqalar dipol moment ... Qo'shimcha jozibali kuchlar qo'shni molekulalar va qarama -qarshi belgi zaryadlari o'rtasida harakat qiladi, bu esa ortadi kuch aloqa.
Bog'lanishning polarligi birikmalarning fizikaviy va kimyoviy xossalariga ta'sir qiladi. Reaksiya mexanizmlari va hatto qo'shni bog'lanishlarning reaktivligi bog'lanishning qutblanishiga bog'liq. Ulanishning kutupluluğu ko'pincha aniqlaydi molekula polarligi Shunday qilib, qaynash nuqtasi va erish nuqtasi, qutbli erituvchilarda eruvchanlik kabi fizik xususiyatlarga bevosita ta'sir qiladi.
Misollar: HCl, CO 2, NH 3.
Kovalent bog hosil qilish mexanizmlari
Kovalent kimyoviy bog'lanish 2 mexanizm orqali sodir bo'lishi mumkin:
1. Ayirboshlash mexanizmi Kovalent kimyoviy bog'lanishning shakllanishi - bu har bir zarracha umumiy elektron juftini hosil qilish uchun bitta ulanmagan elektronni berganida bo'ladi:
A . + . B = A: B
2. kovalent bog'lanish hosil qilish mexanizmi bo'lib, unda zarrachalardan biri yolg'iz elektron juftini, ikkinchisi esa bu elektron jufti uchun bo'sh orbitalni beradi:
A: + B = A: B

Bunday holda, atomlardan biri yolg'iz elektron juftligini ta'minlaydi ( donor) va boshqa atom bu juftlik uchun bo'sh orbitalni beradi ( qabul qiluvchi). Bog'lanish natijasida elektron energiyasi ham kamayadi, ya'ni. atomlar uchun foydalidir.
Donor-akseptor mexanizmi tomonidan hosil qilingan kovalent bog boshqacha emas almashinuv mexanizmi hosil qilgan boshqa kovalent boglardan olingan xossalarda. Donor-akseptor mexanizmi tomonidan kovalent bog'lanishning shakllanishi tashqi energiya darajasida ko'p sonli elektronlar (elektron donorlar) yoki aksincha, juda kam sonli elektronlar (elektron qabul qiluvchilar) bo'lgan atomlarga xosdir. Atomlarning valentlik imkoniyatlari tegishli bo'limda batafsilroq ko'rib chiqilgan.
Donor-akseptor mexanizmi tomonidan kovalent bog hosil bo'ladi:
- molekulada karbon monoksit CO(molekuladagi bog 'uch barobar, almashinish mexanizmi 2 dona, donor-akseptor mexanizmi orqali hosil bo'ladi): C≡O;
- v ammoniy ioni NH 4 +, ionlarda organik aminlar, masalan, metilammoniy ionida CH 3 -NH 2 +;
- v murakkab birikmalar, markaziy atom va ligand guruhlari orasidagi kimyoviy bog'lanish, masalan, natriy tetrahidroksoaluminat Na, alyuminiy va gidroksid ionlari orasidagi bog'lanish;
- v azot kislotasi va uning tuzlari- nitratlar: HNO 3, NaNO 3, boshqa ba'zi azotli birikmalarda;

- molekulada ozon O 3.
Kovalent bog'lanishning asosiy xususiyatlari
Kovalent bog 'odatda metall bo'lmagan atomlar o'rtasida hosil bo'ladi. Kovalent bog'lanishning asosiy xususiyatlari uzunlik, energiya, ko'plik va yo'nalish.
Kimyoviy bog'lanishning ko'pligi
Kimyoviy bog'lanishning ko'pligi - bu birikmadagi ikkita atom orasidagi umumiy elektron juftlari soni... Bog'ning ko'pligini molekulani tashkil etuvchi atomlarning qiymatidan osongina aniqlash mumkin.
Masalan , H 2 vodorod molekulasida bog'lanish ko'pligi 1 ga teng, chunki har bir vodorodda tashqi energiya darajasida faqat bitta ulanmagan elektron bor, shuning uchun bitta umumiy elektron jufti hosil bo'ladi.
Kislorod molekulasida O 2, bog'lanish ko'pligi 2 ga teng tashqi energiya sathidagi har bir atom 2 ta ulanmagan elektronga ega: O = O.
Azot molekulasida N 2, bog'lanish ko'pligi 3 ga teng, chunki har bir atom o'rtasida tashqi energiya darajasida 3 ta ulanmagan elektron bor va atomlar 3 ta umumiy elektron juftini hosil qiladi N≡N.
Kovalent bog'lanish uzunligi
Kimyoviy bog'lanish uzunligi
Bog'ni tashkil etuvchi atom yadrolari markazlari orasidagi masofa. Bu eksperimental fizik usullar bilan aniqlanadi. Bog'lanish uzunligini taxminan qo'shilish qoidasi bo'yicha hisoblash mumkin, unga ko'ra AB molekulasidagi bog'lanish uzunligi A2 va B2 molekulalaridagi bog'lanish uzunliklarining yarim yig'indisiga teng: 
Kimyoviy bog'lanish uzunligini taxminan taxmin qilish mumkin atom radiusi bo'ylab rishta hosil qilish, yoki aloqa chastotasi bo'yicha agar atomlarning radiusi unchalik farq qilmasa.
Aloqa hosil qiluvchi atomlarning radiusi oshishi bilan bog'lanish uzunligi oshadi.
Masalan
Atomlar orasidagi bog'lanishning ko'payishi bilan (atom radiusi bir -biridan farq qilmaydi yoki unchalik farq qilmaydi) bog'lanish uzunligi kamayadi.
Masalan ... Seriyada: C - C, C = C, C≡C, bog'lanish uzunligi kamayadi.
Aloqa energiyasi
Bog'lanish energiyasi kimyoviy bog'lanish kuchining o'lchovidir. Aloqa energiyasi aloqani uzish va bir -biridan cheksiz katta masofada bu aloqani hosil qiluvchi atomlarni olib tashlash uchun zarur bo'lgan energiya bilan aniqlanadi.
Kovalent bog`lanish juda bardoshli. Uning energiyasi bir necha o'ndan bir necha yuz kJ / molgacha. Bog'lanish energiyasi qanchalik yuqori bo'lsa, bog'lanish kuchi shunchalik katta bo'ladi va aksincha.
Kimyoviy bog'lanishning mustahkamligi bog'lanish uzunligiga, bog'lanish polaritesiga va bog'lanishning ko'pligiga bog'liq. Kimyoviy bog'lanish qancha uzoq bo'lsa, uni sindirish osonroq bo'ladi va bog'lanish energiyasi qanchalik past bo'lsa, uning kuchi shunchalik past bo'ladi. Kimyoviy bog'lanish qanchalik qisqa bo'lsa, u shunchalik kuchli bo'ladi va bog'lanish energiyasi katta bo'ladi.
Masalan, HF, HCl, HBr birikmalar qatorida, chapdan o'ngga, kimyoviy bog'lanish kuchi kamayadi beri ulanish uzunligi oshadi.
Ionik kimyoviy bog'lanish

Ion aloqasi Asosan kimyoviy bog'lanishdir ionlarning elektrostatik tortilishi.
Yunus atomlar tomonidan elektronlarni qabul qilish yoki ulardan voz kechish jarayonida vujudga keladi. Masalan, barcha metallarning atomlari tashqi energiya darajasidagi elektronlarni zaif ushlab turadi. Shuning uchun metall atomlari xarakterlanadi tiklovchi xususiyatlar- elektronlarni berish qobiliyati.

Misol. Natriy atomi 3 -chi energiya darajasida 1 elektronni o'z ichiga oladi. Natriy atomi osonlikcha berilib, ancha barqaror Na + ionini hosil qiladi, elektron konfiguratsiyasi neon gazining elektron konfiguratsiyasi bilan. Natriy ionida 11 proton va atigi 10 elektron bor, shuning uchun ionning umumiy zaryadi -10 + 11 = +1:
+11Na) 2) 8) 1 - 1e = +11 Na +) 2 ) 8
Misol. Tashqi energiya darajasidagi xlor atomi 7 elektronni o'z ichiga oladi. Turg'un inert argon atomining konfiguratsiyasini olish uchun xlorga 1 elektron biriktirilishi kerak. Elektron biriktirilgandan so'ng, elektronlardan tashkil topgan, barqaror xlor ioni hosil bo'ladi. Ionning umumiy zaryadi -1:
+17Cl) 2) 8) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Eslatma:
- Ionlarning xossalari atomlarning xususiyatlaridan farq qiladi!
- Barqaror ionlar nafaqat hosil bo'lishi mumkin atomlar, Biroq shu bilan birga atomlar guruhlari... Masalan: ammoniy ioni NH 4 +, sulfat ioni SO 4 2- va boshqalar. Bunday ionlar hosil qilgan kimyoviy bog'lanishlar ham ionli hisoblanadi;
- Ion aloqasi, qoida tariqasida, bir -biri bilan hosil bo'ladi metallar va metall bo'lmaganlar(metall bo'lmagan guruhlar);
Yaratilgan ionlar elektr tortishish tufayli tortiladi: Na + Cl -, Na 2 + SO 4 2-.
Xulosa qilaylik kovalent va ionli bog'lanish turlari o'rtasidagi farq:


Metall bog'lanish Bu nisbatan shakllangan aloqa erkin elektronlar o'rtasida metall ionlari kristall panjara hosil qiladi.
Tashqi energiya darajasidagi metall atomlari odatda joylashadi birdan uchta elektrongacha... Metall atomlarining radiusi, qoida tariqasida, katta - shuning uchun metall atomlari, metall bo'lmaganlardan farqli o'laroq, tashqi elektronlarni juda oson beradi, ya'ni. kuchli qaytaruvchi moddalardir.
Elektronlarni berish orqali metall atomlari aylanadi musbat zaryadlangan ionlar ... Ajratilgan elektronlar nisbatan erkin harakat qilmoq musbat zaryadlangan metall ionlari orasida. Bu zarralar orasida aloqasi bor beri umumiy elektronlar qatlamli metall kationlarini birgalikda ushlab turadi , shuning uchun etarlicha kuchli yaratish metall kristalli panjara ... Bu holda elektronlar uzluksiz tartibsiz harakat qiladi, ya'ni. yangi neytral atomlar va yangi kationlar doimo paydo bo'ladi.

Molekulalararo o'zaro ta'sirlar
Alohida -alohida, moddaning alohida molekulalari o'rtasida paydo bo'ladigan o'zaro ta'sirlarni ko'rib chiqishga arziydi. molekulalararo o'zaro ta'sirlar ... Molekulalararo o'zaro ta'sir - bu yangi kovalent aloqalar paydo bo'lmaydigan neytral atomlar orasidagi o'zaro ta'sirning bir turi. Molekulalar orasidagi o'zaro ta'sir kuchlari 1869 yilda van der Vals tomonidan kashf etilgan va uning nomi bilan atalgan Van dar Vals kuchlari... Van der Vals kuchlari bo'linadi yo'nalish, induksiya va tarqoq ... Molekulalararo o'zaro ta'sir energiyasi kimyoviy bog'lanish energiyasidan ancha kam.
Og'irlikning yo'naltiruvchi kuchlari qutbli molekulalar o'rtasida sodir bo'ladi (dipol-dipol o'zaro ta'siri). Bu kuchlar qutbli molekulalar o'rtasida paydo bo'ladi. Induksion o'zaro ta'sirlar Bu qutbli va qutbsiz molekulaning o'zaro ta'siri. Qutbiy bo'lmagan molekula qutblangan, bu qo'shimcha elektrostatik tortishish hosil qiladi.
Molekulalararo o'zaro ta'sirning o'ziga xos turi - vodorod aloqalari. - bu kuchli qutbli kovalent aloqalar mavjud bo'lgan molekulalar o'rtasida paydo bo'ladigan molekulalararo (yoki molekulalararo) kimyoviy bog'lanishlar. H-F, H-O yoki H-N... Agar molekulada shunday bog'lanishlar bo'lsa, u holda molekulalar o'rtasida bo'ladi qo'shimcha tortish kuchlari .
Formalash mexanizmi vodorod bilan bog'lanish, qisman elektrostatik va qisman donor-akseptor. Bunda elektron juftining donori kuchli elektronegativ elementning (F, O, N) atomidir, akseptor esa shu atomlarga bog'langan vodorod atomlari hisoblanadi. Vodorod aloqasi xarakterlanadi diqqat kosmosda va to'yinganlik.
Vodorod aloqasini nuqta bilan belgilash mumkin: N ··· O. Vodorod bilan birlashtirilgan atomning elektrgatuvchanligi qanchalik katta bo'lsa va uning kattaligi qanchalik kichik bo'lsa, vodorod aloqasi kuchliroq bo'ladi. Bu birinchi navbatda birikmalarga xosdir vodorod bilan ftor va shuningdek vodorod bilan kislorod , Kamroq azot vodorod bilan .

Vodorod aloqalari quyidagi moddalar orasida paydo bo'ladi:
— vodorod ftorli HF(gaz, vodorod ftoridining suvdagi eritmasi - gidroflorik kislota), suv H 2 O (bug ', muz, suyuq suv):
— ammiak va organik ominlarning eritmasi- ammiak va suv molekulalari o'rtasida;
— organik birikmalar, ular ichida O-H yoki N-H bog'lanishlari: spirtlar, karboksilik kislotalar, aminlar, aminokislotalar, fenollar, anilin va uning hosilalari, oqsillar, uglevodlar - monosakkaridlar va disaxaridlar eritmalari.
Vodorod aloqasi moddalarning fizik va kimyoviy xossalariga ta'sir qiladi. Shunday qilib, molekulalar orasidagi qo'shimcha tortishish moddalar qaynab ketishini qiyinlashtiradi. Vodorod aloqasi bo'lgan moddalar uchun qaynash nuqtasida g'ayritabiiy o'sish kuzatiladi.
Masalan , qoida tariqasida, molekulyar og'irlikning oshishi bilan moddalarning qaynash nuqtasining oshishi kuzatiladi. Biroq, bir qator moddalarda H 2 O-H 2 S-H 2 Se-H 2 Te qaynash nuqtalarida chiziqli o'zgarishni kuzatmaymiz.

Ya'ni, da suvning qaynash nuqtasi g'ayritabiiy darajada yuqori - -61 o C dan kam emas, to'g'ri chiziq bizga ko'rsatganidek, lekin juda ko'p, +100 o C. Bu anomaliya suv molekulalari o'rtasida vodorod aloqalari mavjudligi bilan izohlanadi. Shuning uchun normal sharoitda (0-20 ° C) suv suyuqlik fazaviy holat bo'yicha.
Kimyoviy moddalar kimyoviy elementlarning alohida, o'zaro bog'liq bo'lmagan atomlaridan tashkil topganligi juda kam uchraydi. Oddiy sharoitda faqat olijanob gazlar deb nomlangan gazlar shunday tuzilishga ega: geliy, neon, argon, kripton, ksenon va radon. Ko'pincha kimyoviy moddalar tarqoq atomlardan emas, balki ularning turli guruhlarga birikmalaridan iborat. Bunday atomlar assotsiatsiyasi bir nechta birlik, yuzlab, minglab va hatto undan ham ko'p atomlarni o'z ichiga olishi mumkin. Bu atomlarni shunday guruhlar tarkibida ushlab turuvchi kuch deyiladi kimyoviy bog'lanish.
Boshqacha aytganda, aytishimiz mumkinki, kimyoviy bog'lanish - bu alohida atomlar orasidagi murakkab tuzilmalarga (molekulalar, ionlar, radikallar, kristallar va boshqalar) bog'lanishni ta'minlaydigan o'zaro ta'sir.
Kimyoviy bog'lanishning paydo bo'lishining sababi shundaki, murakkab tuzilmalar energiyasi uni tashkil etuvchi alohida atomlarning umumiy energiyasidan kamdir.
Xususan, agar X va Y atomlarining o'zaro ta'siri paytida XY molekulasi hosil bo'lsa, demak, bu modda molekulalarining ichki energiyasi u hosil bo'lgan alohida atomlarning ichki energiyasidan past bo'ladi:
E (XY)< E(X) + E(Y)
Shu sababli, alohida atomlar o'rtasida kimyoviy bog'lanishlar paydo bo'lganda, energiya ajralib chiqadi.
Kimyoviy bog'lanishlarning shakllanishida yadro bilan bog'lanish energiyasi eng past bo'lgan tashqi elektron qatlamining elektronlari ishtirok etadi. valentlik... Masalan, borda bu 2 energiya darajasidagi elektronlar - 2 uchun 2 elektron s- orbitallar va 1 dan 2 gacha p-orbitallar:
Kimyoviy bog'lanish hosil bo'lganda, har bir atom olijanob gazlar atomlarining elektron konfiguratsiyasini olishga intiladi, ya'ni. shunday qilib, uning tashqi elektron qatlamida 8 ta elektron bor (2 - birinchi davr elementlari uchun). Bu hodisa oktet qoidasi deb ataladi.
Agar atomlar tomonidan valent elektronlarining bir qismi boshqa atomlarga xos bo'lsa, olijanob gazning elektron konfiguratsiyasiga erishish mumkin. Bunday holda, umumiy elektron juftlari hosil bo'ladi.
Elektronlarning ijtimoiylashuv darajasiga qarab, kovalent, ionli va metallli bog'lanishlarni ajratish mumkin.
Kovalent bog
Kovalent bog'lanish ko'pincha metall bo'lmagan elementlarning atomlari o'rtasida sodir bo'ladi. Agar kovalent bog hosil qiluvchi metall bo'lmagan atomlar har xil kimyoviy elementlarga tegishli bo'lsa, bunday bog'lanish kovalent qutbli bog'lanish deyiladi. Bu nomning sababi shundaki, turli elementlarning atomlari ham umumiy elektron juftini jalb qilish qobiliyatiga ega. Shubhasiz, bu umumiy elektron juftining atomlardan biriga tomon siljishiga olib keladi, buning natijasida qisman manfiy zaryad hosil bo'ladi. O'z navbatida, boshqa atomda qisman musbat zaryad hosil bo'ladi. Masalan, vodorod xlorid molekulasida elektron jufti vodorod atomidan xlor atomiga ko'chiriladi:
Kovalent qutbli bog'lanishli moddalarga misollar:
CCl 4, H 2 S, CO 2, NH 3, SiO 2 va boshqalar.
Xuddi shu kimyoviy elementning metall bo'lmagan atomlari o'rtasida kovalent polar bo'lmagan aloqa hosil bo'ladi. Atomlar bir xil bo'lgani uchun ularning umumiy elektronlarni tortib olish qobiliyati bir xil. Shu munosabat bilan elektron juftining siljishi kuzatilmaydi:
Yuqorida aytilgan kovalent aloqaning paydo bo'lish mexanizmi, ikkala atom ham umumiy elektron juftlarini hosil qilish uchun elektronlar bilan ta'minlanganida, almashinuv deyiladi.
Donor-akseptor mexanizmi ham mavjud.
Donor-akseptor mexanizmi yordamida kovalent bog hosil bo'lganda, bitta atomning (ikkita elektronli) va boshqa atomning bo'sh orbitalining to'ldirilgan orbitasi tufayli umumiy elektron jufti hosil bo'ladi. Yolg'iz elektron juftini ta'minlaydigan atom donor, erkin orbitalli atom esa akseptor deb ataladi. Juft elektronli atomlar elektron juftlarining donori vazifasini bajaradi, masalan, N, O, P, S.
Masalan, donor-akseptor mexanizmiga ko'ra, NH 4 +ammoniy kationida to'rtinchi kovalent N-H aloqasi hosil bo'ladi:
Kutupluluktan tashqari, kovalent aloqalar ham energiya bilan tavsiflanadi. Bog'lanish energiyasi - bu atomlar orasidagi aloqani uzish uchun zarur bo'lgan minimal energiya.
Bog'lanish energiyasi bog'langan atomlarning radiusi oshishi bilan kamayadi. Biz bilganimizdek, atom radiusi kichik guruhlar bo'ylab pastga qarab oshgani uchun, masalan, galogen-vodorod aloqasining kuchi ketma-ket ortadi degan xulosaga kelish mumkin:
Salom< HBr < HCl < HF
Bundan tashqari, bog'lanish energiyasi uning ko'pligiga bog'liq - bog'lanish ko'pligi qanchalik ko'p bo'lsa, energiyasi shuncha ko'p bo'ladi. Bog'lanishning ko'pligi ikki atom orasidagi umumiy elektron juftlarining sonini bildiradi.
Ion aloqasi
Ion aloqani kovalent qutbli bog'lanishning cheklangan holati deb hisoblash mumkin. Agar kovalent-qutbli bog'lanishda umumiy elektron jufti qisman atom juftlaridan biriga siljigan bo'lsa, u holda ionda u deyarli butunlay atomlardan biriga "berilgan" bo'ladi. Elektron (lar) ni bergan atom musbat zaryad oladi va bo'ladi kation va undan elektronlarni olgan atom manfiy zaryad oladi va bo'ladi anion.
Shunday qilib, ionli aloqa - bu kationlarning anionlarga elektrostatik tortilishi natijasida hosil bo'lgan bog'lanishdir.
Bu turdagi bog'lanishning shakllanishi tipik metallar va tipik metall bo'lmagan atomlarning o'zaro ta'siriga xosdir.
Masalan, kaliy ftorid. Kaliy kationi neytral atomdan bitta elektronning ajralishi natijasida olinadi va ftor ioniga bitta elektron birikganda ftor ioni hosil bo'ladi:

Olingan ionlar o'rtasida elektrostatik tortishish kuchi paydo bo'ladi, buning natijasida ionli birikma hosil bo'ladi.
Kimyoviy bog'lanish hosil bo'lganda, natriy atomidan elektronlar xlor atomiga o'tdi va qarama -qarshi zaryadlangan ionlar paydo bo'ldi, ular to'liq tashqi energiya darajasiga ega.
Aniqlanishicha, metall atomidan elektronlar to'liq ajralmagan, faqat kovalent bog'dagi kabi xlor atomi tomon siljigan.
Metall atomlarini o'z ichiga olgan ko'pchilik ikkilik birikmalar iondir. Masalan, oksidlar, halogenlar, sulfidlar, nitridlar.
Ion bog`lanish oddiy kationlar va oddiy anionlar (F -, Cl -, S 2-), shuningdek oddiy kationlar va murakkab anionlar (NO 3 -, SO 4 2-, PO 4 3-, OH -) orasida ham sodir bo`ladi. . Shuning uchun ionli birikmalarga tuzlar va asoslar kiradi (Na 2 SO 4, Cu (NO 3) 2, (NH 4) 2 SO 4), Ca (OH) 2, NaOH)
Metall bog'lanish
Bu turdagi bog'lanish metallarda hosil bo'ladi.
Barcha metallarning atomlari tashqi elektron qatlamida atom yadrosi bilan bog'lanish energiyasi past bo'lgan elektronlarga ega. Ko'pgina metallar uchun tashqi elektronlarni yo'qotish jarayoni energetik jihatdan qulaydir.
Yadro bilan bunday zaif o'zaro ta'sirni hisobga olsak, metallardagi bu elektronlar juda harakatchan va har bir metall kristallida quyidagi jarayon doimiy ravishda sodir bo'ladi:
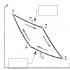
M 0 - ne - = M n +,
bu erda M 0 - neytral metall atomi va M n + bir xil metalning kationi. Quyidagi rasmda davom etayotgan jarayonlarning tasviri ko'rsatilgan.
Ya'ni, elektronlar metall kristal bo'ylab "olib yuradi", bitta metall atomidan ajralib, undan kation hosil qiladi, boshqa kationga qo'shilib, neytral atom hosil qiladi. Bu hodisa "elektron shamol", metall bo'lmagan atom kristalidagi erkin elektronlar to'plami "elektron gaz" deb nomlangan. Metall atomlari orasidagi o'zaro ta'sirning bu turi metall bog'lanish deb ataldi.
Vodorod aloqasi
Agar har qanday moddaning vodorod atomi yuqori elektromagnitivlik (azot, kislorod yoki ftor) bilan bog'liq bo'lsa, bunday modda vodorod aloqasi kabi hodisa bilan tavsiflanadi.
Vodorod atomi elektronegativ atom bilan bog'langanligi sababli, vodorod atomida qisman musbat zaryad, elektron -atom atomida esa qisman manfiy zaryad hosil bo'ladi. Shu nuqtai nazardan, bitta molekulaning qisman musbat zaryadlangan vodorod atomi bilan boshqasining elektronegativ atomi o'rtasida elektrostatik tortishish mumkin bo'ladi. Masalan, suv molekulalari uchun vodorod aloqasi kuzatiladi:
Bu vodorod aloqasi suvning g'ayritabiiy yuqori erish nuqtasini tushuntiradi. Suvdan tashqari vodorod ftorid, ammiak, kislorodli kislotalar, fenollar, spirtlar va ominlar kabi moddalarda ham kuchli vodorod aloqalari hosil bo'ladi.
Metall bog'lanish. Metall bog'lanish xususiyatlari.
Metall bog'lanish - bu nisbatan erkin elektronlarning mavjudligi natijasida hosil bo'lgan kimyoviy bog'lanish. Bu sof metallar va ularning qotishmalari va intermetalik birikmalar uchun xosdir.
Metall bog'lanish mexanizmi
Ijobiy metall ionlari kristall panjaraning barcha tugunlarida joylashgan. Ularning orasida ionlar hosil bo'lishi paytida atomlardan ajralib chiqqan valent elektronlar gaz molekulalari kabi tasodifiy harakatlanadi. Bu elektronlar musbat ionlarni ushlab turuvchi tsement vazifasini bajaradi; aks holda, ionlar orasidagi itaruvchi kuchlar ta'sirida panjara parchalanib ketardi. Shu bilan birga, elektronlar kristall panjara ichida ionlar tomonidan ushlab turiladi va uni tark eta olmaydi. Aloqa kuchlari mahalliylashtirilmagan va yo'naltirilmagan. Shu sababli, ko'p hollarda yuqori koordinatsion raqamlar paydo bo'ladi (masalan, 12 yoki 8). Ikkita metall atomlari birlashganda, tashqi qobiqlarining orbitallari bir -birining ustiga chiqib, molekulyar orbitallarni hosil qiladi. Agar uchinchi atom mos bo'lsa, uning orbitali birinchi ikkita atomning orbitallari bilan bir -biriga to'g'ri keladi, bu esa boshqa molekulyar orbitalni beradi. Atomlar ko'p bo'lganda, har tomonga cho'zilgan juda ko'p sonli uch o'lchovli molekulyar orbitallar paydo bo'ladi. Orbitallarning bir -biriga o'xshashligi tufayli har bir atomning valentlik elektronlariga ko'plab atomlar ta'sir ko'rsatadi.
Xarakterli kristall panjaralar
Ko'pgina metallar quyidagi atom simlari bilan o'ralgan yuqori nosimmetrik panjaralardan birini hosil qiladi: kubik korpusli, kub yuzli markazli va olti burchakli.
Kubik tanaga asoslangan panjara (BCC) da, atomlar kubning tepasida, bitta atom esa kub hajmining markazida joylashgan. Metalllarning kubikli markazlashgan panjaralari bor: Pb, K, Na, Li, b-Ti, b-Zr, Ta, W, V, a-Fe, Cr, Nb, Ba va boshqalar.
Yuzga yo'naltirilgan kubik panjarasida (FCC) atomlar kubning tepasida va har bir yuzning markazida joylashgan. Bu turdagi metallarning panjarasi bor: a-Ca, Ce, a-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, p-Fe, Cu, a-Co va boshqalar.
Olti burchakli panjarada atomlar prizmaning olti burchakli asoslari tepasida va markazida, uchta atom esa prizmaning o'rta tekisligida joylashgan. Metalllarda shunday atomlar bor: Mg, a-Ti, Cd, Re, Os, Ru, Zn, b-Co, Be, b-Ca va boshqalar.
Boshqa xususiyatlar
Erkin harakatlanadigan elektronlar yuqori elektr va issiqlik o'tkazuvchanligini ta'minlaydi. Metall bog'langan moddalar ko'pincha kuchni plastika bilan birlashtiradi, chunki atomlar bir -biriga nisbatan siljiganida, aloqalar uzilmaydi. Metall aromati ham muhim xususiyatdir.
Metall issiqlik va elektr energiyasini yaxshi o'tkazadi, ular etarlicha mustahkam, ular buzilmasdan deformatsiyalanishi mumkin. Ba'zi metallar egiluvchan (ularni yasash mumkin), ba'zilari yopishqoq (simdan tortib olish mumkin). Bu noyob xususiyatlar metall atomlarini bir -biri bilan bog'laydigan kimyoviy bog'lanishning maxsus turi bilan izohlanadi.
Qattiq holatda bo'lgan metallar musbat ionlar kristallari ko'rinishida bo'ladi, go'yo ular o'rtasida erkin harakatlanayotgan elektronlar dengizida "suzadi".
Metall bog'lanish metallarning xususiyatlarini, xususan, ularning mustahkamligini tushuntiradi. Deformatsiya qiluvchi kuch ta'sirida metall panjara, ion kristallaridan farqli o'laroq, shaklini yorilishsiz o'zgartirishi mumkin.
Metalllarning yuqori issiqlik o'tkazuvchanligi, agar bir parcha metall bir tomondan qizdirilsa, elektronlarning kinetik energiyasi ortishi bilan izohlanadi. Energiyaning bunday ko'payishi "elektron dengizda" namuna bo'ylab katta tezlikda tarqaladi.
Metalllarning elektr o'tkazuvchanligi ham aniq bo'ladi. Agar metall namunaning uchlariga potentsial farq qo'llanilsa, delokalizatsiyalangan elektronlar buluti ijobiy potentsial tomon siljiydi: bir yo'nalishda harakatlanayotgan elektronlar oqimi - bu tanish elektr toki.
Metall bog'lanish. Metall bog'lanish xususiyatlari. - tushuncha va turlari. "Metall bog'lanish. Metall bog'lanish xususiyatlari" toifasining tasnifi va xususiyatlari. 2017, 2018.
Darsning maqsadi
- Metall kimyoviy bog'lanish haqida tushuncha bering.
- Metall bog'lanishning shakllanishini yozishni o'rganing.
- Metalllarning fizik xossalari bilan tanishing.
- Turlarni aniq ajratishni o'rganing kimyoviy bog'lanishlar .
Dars maqsadi
- Ularning bir -biri bilan qanday munosabatda bo'lishini bilib oling metall atomlari
- Metall bog'lanish u hosil qilgan moddalarning xususiyatlariga qanday ta'sir qilishini aniqlang
Asosiy shartlar:
- Elektronegativlik - molekuladagi atomning umumiy elektron juftlarini o'ziga jalb qilish qobiliyatining miqdoriy xarakteristikasi bo'lgan atomning kimyoviy xossasi.
- Kimyoviy bog'lanish - o'zaro ta'sir qiluvchi atomlarning elektron bulutlarining bir -biriga to'g'ri kelishi natijasida atomlarning o'zaro ta'siri fenomeni.
- Metall bog'lanish - Bu elektronlarning sotsializatsiyasi natijasida hosil bo'lgan atomlar va ionlar orasidagi metallardagi bog'lanishdir.
- Kovalent bog - bir juft valentli elektronlarning bir -biriga yopishishi natijasida hosil bo'lgan kimyoviy bog'lanish. Bog'lanishni ta'minlaydigan elektronlar umumiy elektron juftligi deb ataladi. 2 xil: qutbli va qutbsiz.
- Ion aloqasi - metall bo'lmagan atomlar o'rtasida hosil bo'ladigan kimyoviy bog'lanish, bunda umumiy elektron juftligi elektromagnitivligi yuqori bo'lgan atomga o'tadi. Natijada, atomlar qarama -qarshi zaryadlangan jismlar kabi tortiladi.
- Vodorod aloqasi
- elektronegativ atom va vodorod atomi H o'rtasidagi kimyoviy bog'lanish, boshqa elektronegativ atom bilan kovalent bog'langan. N, O yoki F elektronegativ atomlar vazifasini bajarishi mumkin. Vodorod aloqalari molekulalararo yoki molekulalararo bo'lishi mumkin.
DARSLARDA
Metall kimyoviy bog'lanish
Noto'g'ri "navbatda" turgan narsalarni aniqlang. Nega?
Ca Fe P K Al Mg Na
Jadvaldagi qaysi elementlar Mendeleyev metallar deyiladi?
Bugun biz metallar qanday xususiyatlarga ega ekanligini va ularning metall ionlari orasidagi bog'lanishiga bog'liqligini bilib olamiz.
Boshlash uchun, davriy tizimda metallarning joylashishini eslaylikmi?
Metalllar, hammamiz bilganimizdek, odatda izolyatsiya qilingan atomlar shaklida emas, balki bo'lak, ingot yoki metall mahsulot shaklida bo'ladi. Keling, ajralmas hajmda metall atomlarini nima yig'ishini bilib olaylik.
Misolda biz oltin bo'lakni ko'ramiz. Aytgancha, oltin - noyob metal. Sof oltindan yasash yordamida siz 0,002 mm qalinlikdagi folga yasashingiz mumkin! Bunday yupqa folga varag'i deyarli shaffof va lümenida yashil rangga ega. Natijada, gugurt qutisi kattaligidagi oltindan siz tennis korti maydonini qoplaydigan yupqa folga olishingiz mumkin.
Kimyoviy jihatdan barcha metallar valentlik elektronlaridan voz kechish qulayligi bilan ajralib turadi va natijada musbat zaryadlangan ionlar hosil bo'ladi va faqat musbat oksidlanishni namoyon qiladi. Shuning uchun erkin metallar qaytaruvchi moddalardir. Metall atomlarining umumiy xususiyati ularning metall bo'lmaganlarga nisbatan kattaligi. Tashqi elektronlar yadrodan juda uzoq masofalarda joylashgan va shuning uchun ular bilan zaif bog'langan, shuning uchun ular osonlikcha yirtilib ketadi.
Tashqi sathdagi ko'p miqdordagi metallarning atomlarida oz sonli elektronlar bor - 1,2,3. Bu elektronlar osongina yirtilib ketadi va metall atomlari ionga aylanadi.
Me0 - n ē ⇆ Erkaklar +
metall atomlari - tashqi elektronlar metall ionlari orbitasida
Shunday qilib, ajratilgan elektronlar bir iondan ikkinchisiga o'tishi mumkin, ya'ni ular erkin bo'lib qoladilar va xuddi ularni bir butunga bog'laydilar .. Demak, hamma ajratilgan elektronlar keng tarqalgan bo'lib chiqadi, chunki buning iloji yo'q. qaysi elektron metall atomlariga tegishli ekanligini tushunish.
Elektronlar kationlar bilan birlashishi mumkin, keyin atomlar vaqtincha hosil bo'ladi, undan keyin elektronlar hidlashdan yirtilib ketadi. Bu jarayon uzluksiz va to'xtovsiz sodir bo'ladi. Ma'lum bo'lishicha, metall atomlarining asosiy qismi doimiy ravishda ionlarga aylanadi va aksincha. Bunday holda, oz sonli umumiy elektronlar ko'p miqdordagi metall atomlari va ionlarini bog'laydi. Ammo metalldagi elektronlar soni musbat ionlarning umumiy zaryadiga teng bo'lishi muhim, ya'ni ma'lum bo'lishicha, metall umuman neytral bo'lib qoladi.
Bu jarayon model sifatida taqdim etilgan - metall ionlari elektronlar bulutida. Bunday elektron bulutga "elektron gaz" deyiladi.
Masalan, bu rasmda biz elektronlarning metall kristalli panjara ichidagi harakatsiz ionlar orasida qanday harakatlanishini ko'ramiz. 
Guruch. 2. Elektron harakat
Electron Gas nima ekanligini va u turli metallarning kimyoviy reaktsiyalarida o'zini qanday tutishini yaxshiroq tushunish uchun biz qiziqarli videoni tomosha qilamiz. (bu videodagi oltin faqat rang deb ataladi!)
Endi biz ta'rifni yozishimiz mumkin: metall bog'lanish - bu metallarning elektronlar sotsializatsiyasi natijasida hosil bo'lgan atomlar va ionlar orasidagi bog'lanish.
Keling, biz biladigan barcha turdagi ulanishlarni solishtirib, ularni yaxshiroq ajratish uchun tuzataylik, buning uchun biz videoni tomosha qilamiz.
Metall bog'lanish nafaqat sof metallarda, balki har xil agregat holatidagi turli metallar, qotishmalar aralashmalariga xosdir.
Metall bog'lanish muhim va metallarning asosiy xossalarini aniqlaydi
- elektr o'tkazuvchanligi - metall hajmidagi elektronlarning tartibsiz harakati. Ammo kichik potentsial farq bilan, elektronlar tartibli harakat qiladi. Eng yaxshi o'tkazuvchanlikka ega bo'lgan metallar Ag, Cu, Au, Al.
- plastisitivlik
Metall qatlamlar orasidagi bog'lanishlar unchalik ahamiyatli emas, bu qatlamlarni yuk ostida siljitishga imkon beradi (metallni buzmasdan deformatsiyalash). Eng yaxshi deformatsiyalanadigan metallar (yumshoq) Au, Ag, Cu.
- metall nashrida
Elektron gaz deyarli barcha yorug'lik nurlarini aks ettiradi. Shuning uchun sof metallar juda porlaydilar va ko'pincha kulrang yoki oq rangda bo'ladi. Eng yaxshi reflektorlar Ag, Cu, Al, Pd, Hg bo'lgan metallar
Uy vazifasi
1 -mashq
Tarkibida mavjud bo'lgan moddalarning formulasini tanlang
a) kovalent qutbli bog'lanish: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
b) ion aloqasi bilan: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
2 -mashq
Keraksizlarni kesib tashlang:
a) CuCl2, Al, MgS
b) N2, HCl, O2
c) Ca, CO2, Fe
d) MgCl2, NH3, H2
Metall natriy, metall lityum va boshqa gidroksidi metallar olov rangini o'zgartiradi. Lityum metall va uning tuzlari olovga qizil rang, natriy natriy va natriy tuzlari - sariq, metall kaliy va uning tuzlari - binafsha, rubidiy va seziy - binafsha, ammo engilroq rang beradi.
Guruch. 4. Metall lityum bo'lagi 
Guruch. 5. Olovni metallar bilan bo'yash
Lityum (Li). Lityum metall, natriy metal kabi, ishqoriy metallarga tegishli. Ikkalasi ham suvda eriydi. Natriy suvda eriydi va juda kuchli kislota gidroksidi hosil qiladi. Ishqoriy metallar suvda eriganida juda ko'p issiqlik va gaz (vodorod) ajralib chiqadi. Qo'llaringiz bilan bunday metallarga tegmaslik tavsiya etiladi, chunki siz kuyishingiz mumkin.
Adabiyotlar ro'yxati
1. "Metall kimyoviy bog'lanish" mavzusidagi dars, kimyo o'qituvchisi To'xta Valentina Anatolyevna "Esenovichskaya o'rta maktabi" MOU.
2. F. A. Derkach "Kimyo" - ilmiy -uslubiy qo'llanma. - Kiev, 2008 yil.
3. LB Tsvetkova "Noorganik kimyo" - 2 -nashr, qayta ko'rib chiqilgan va kattalashtirilgan. - Lvov, 2006 yil.
4. V. V. Malinovskiy, P. G. Nagorniy "Noorganik kimyo" - Kiev, 2009 yil.
5. Glinka N.L. Umumiy kimyo. - 27 -nashr. / Ostida. ed V.A. Rabinovich. - L.: Kimyo, 2008.- 704 p.
A.V. Lisnyak tomonidan tahrirlangan va yuborilgan
Dars ustida ishladi:
To'xta V.A.
Lisnyak A.V.
Siz zamonaviy ta'lim haqida savol tug'dirishingiz, fikr bildirishingiz yoki dolzarb muammoni hal qilishingiz mumkin Ta'lim forumi bu erda yangi fikr va harakatning ta'lim kengashi xalqaro miqyosda yig'iladi. Yaratish orqali blog, kimyo 8 -sinf