धात्विक बंधन है। धातु बंधन: गठन का तंत्र
सभी धातुओं में ऐसी विशेषताएं होती हैं:
बाहरी ऊर्जा स्तर पर इलेक्ट्रॉनों की एक छोटी संख्या (कुछ अपवादों को छोड़कर, जिनमें 6,7 और 8 हो सकते हैं);
बड़ा परमाणु त्रिज्या;
कम आयनीकरण ऊर्जा।
यह सब बाहरी अयुग्मित इलेक्ट्रॉनों को नाभिक से आसानी से अलग करने में योगदान देता है। इस मामले में, परमाणु में बहुत सारे मुक्त कक्षक होते हैं। धातु बंधन के गठन की योजना केवल एक दूसरे के साथ विभिन्न परमाणुओं की कई कक्षीय कोशिकाओं के ओवरलैप को दिखाएगी, जिसके परिणामस्वरूप, एक सामान्य इंट्राक्रिस्टलाइन स्थान बनता है। प्रत्येक परमाणु से इलेक्ट्रॉन इसमें भर जाते हैं, जो स्वतंत्र रूप से इधर-उधर भटकने लगते हैं विभिन्न भागजाली समय-समय पर, उनमें से प्रत्येक एक क्रिस्टल साइट पर एक आयन से जुड़ जाता है और इसे एक परमाणु में बदल देता है, फिर एक आयन का निर्माण करते हुए फिर से अलग हो जाता है।
इस प्रकार, एक धातु बंधन एक सामान्य धातु क्रिस्टल में परमाणुओं, आयनों और मुक्त इलेक्ट्रॉनों के बीच एक बंधन है। एक संरचना के भीतर स्वतंत्र रूप से घूमने वाले इलेक्ट्रॉन बादल को "इलेक्ट्रॉन गैस" कहा जाता है। यह वे हैं जो बहुमत की व्याख्या करते हैं भौतिक गुणधातु और उनके मिश्र।
एक धात्विक रासायनिक बंधन वास्तव में खुद को कैसे महसूस करता है? अलग-अलग उदाहरण हैं। आइए लिथियम के एक टुकड़े पर विचार करने का प्रयास करें। अगर आप इसे मटर के आकार का भी लें तो हजारों परमाणु होंगे। तो आइए कल्पना करें कि इन हजारों परमाणुओं में से प्रत्येक अपने एकमात्र वैलेंस इलेक्ट्रॉन को सामान्य क्रिस्टल स्पेस में दान करता है। इसके अलावा, किसी दिए गए तत्व की इलेक्ट्रॉनिक संरचना को जानकर, आप खाली ऑर्बिटल्स की संख्या देख सकते हैं। लिथियम में उनमें से 3 होंगे (दूसरे ऊर्जा स्तर के पी-ऑर्बिटल्स)। हजारों में से प्रत्येक परमाणु के लिए तीन - यह क्रिस्टल के अंदर का सामान्य स्थान है, जिसमें "इलेक्ट्रॉन गैस" स्वतंत्र रूप से चलती है।
धातु बंधन वाला पदार्थ हमेशा मजबूत होता है। आखिरकार, इलेक्ट्रॉन गैस क्रिस्टल को ढहने नहीं देती है, लेकिन केवल परतों को विस्थापित करती है और तुरंत इसे पुनर्स्थापित करती है। यह चमकता है, इसमें एक निश्चित घनत्व (सबसे अधिक बार उच्च), फ्यूसिबिलिटी, लचीलापन और लचीलापन होता है।
धातु बंधन को और कहाँ महसूस किया जाता है? पदार्थों के उदाहरण:
सरल संरचनाओं के रूप में धातु;
एक दूसरे के साथ सभी धातु मिश्र धातु;
सभी धातुएँ और उनकी मिश्रधातुएँ द्रव और ठोस अवस्था में होती हैं।
विशिष्ट उदाहरणों को केवल एक अविश्वसनीय मात्रा में उद्धृत किया जा सकता है, क्योंकि धातुओं में आवधिक प्रणाली 80 से अधिक!
में गठन का तंत्र सामान्य दृष्टि सेनिम्नलिखित संकेतन द्वारा व्यक्त किया गया: е 0 - e - е n +। आरेख से स्पष्ट है कि धातु के क्रिस्टल में कौन से कण मौजूद हैं।
कोई भी धातु सकारात्मक रूप से आवेशित आयन में बदलकर इलेक्ट्रॉनों को दान करने में सक्षम है।
उदाहरण के लिए, लोहा: Fe 0 -2e - = Fe 2+
पृथक्कृत ऋणावेशित कण - इलेक्ट्रॉन - कहाँ जा रहे हैं? माइनस हमेशा प्लस की ओर आकर्षित होता है। क्रिस्टल जालक में इलेक्ट्रॉन लोहे के एक अन्य आयन (धनात्मक आवेशित) की ओर आकर्षित होते हैं: Fe 2+ + 2e - = Fe 0
आयन एक उदासीन परमाणु बन जाता है। और यह प्रक्रिया कई बार दोहराई जाती है।
यह पता चला है कि लोहे के मुक्त इलेक्ट्रॉन हैं निरंतर गतिक्रिस्टल के पूरे आयतन में, जाली स्थलों पर आयनों को तोड़ना और संलग्न करना। इस घटना का दूसरा नाम है डेलोकलाइज़्ड इलेक्ट्रॉन क्लाउड... "डेलोकलाइज़्ड" शब्द का अर्थ है मुक्त, संलग्न नहीं।
विषयों कोडिफायर का उपयोग करें: सहसंयोजक रासायनिक बंधन, इसकी किस्में और गठन के तंत्र। सहसंयोजक बंधन विशेषताएं (ध्रुवीयता और बंधन ऊर्जा)। आयोनिक बंध। धात्विक बंधन। हाइड्रोजन बंध
इंट्रामोल्युलर रासायनिक बंधन
सबसे पहले, अणुओं के भीतर कणों के बीच उत्पन्न होने वाले बंधनों पर विचार करें। ऐसे कनेक्शन कहलाते हैं इंट्रामोलीक्युलर.
रसायनिक बंध परमाणुओं के बीच रासायनिक तत्वएक इलेक्ट्रोस्टैटिक प्रकृति है और द्वारा बनाई गई है बाहरी (वैलेंस) इलेक्ट्रॉनों की बातचीत, कम या ज्यादा डिग्री में धनात्मक आवेशित नाभिक द्वारा धारण किया जाता हैबंधे हुए परमाणु।
यहाँ प्रमुख अवधारणा है विद्युत नकारात्मकता. यह वह है जो प्रकार निर्धारित करती है रसायनिक बंधपरमाणुओं और इस बंधन के गुणों के बीच।
एक परमाणु की आकर्षित करने की क्षमता है (पकड़) बाहरी(वैलेंस) इलेक्ट्रॉनों... इलेक्ट्रोनगेटिविटी बाहरी इलेक्ट्रॉनों के नाभिक के प्रति आकर्षण की डिग्री से निर्धारित होती है और मुख्य रूप से परमाणु की त्रिज्या और नाभिक के आवेश पर निर्भर करती है।
इलेक्ट्रोनगेटिविटी को स्पष्ट रूप से परिभाषित करना मुश्किल है। एल. पॉलिंग ने आपेक्षिक वैद्युतीयऋणात्मकता (डायटोमिक अणुओं की बंध ऊर्जा के आधार पर) की एक तालिका तैयार की। सबसे विद्युत ऋणात्मक तत्व है एक अधातु तत्त्वअर्थ के साथ 4 .
यह ध्यान रखना महत्वपूर्ण है कि विभिन्न स्रोतों में आप वैद्युतीयऋणात्मकता के मूल्यों के विभिन्न पैमानों और तालिकाओं को पा सकते हैं। इससे डरना नहीं चाहिए, क्योंकि यह एक रासायनिक बंधन के निर्माण में भूमिका निभाता है परमाणु, और यह लगभग किसी भी प्रणाली में समान है।
यदि रासायनिक बंधन A: B में से एक परमाणु इलेक्ट्रॉनों को अधिक मजबूती से आकर्षित करता है, तो इलेक्ट्रॉन युग्म उसकी ओर विस्थापित हो जाता है। अधिक इलेक्ट्रोनगेटिविटी का अंतरपरमाणु, जितना अधिक इलेक्ट्रॉन युग्म विस्थापित होता है।
यदि परस्पर क्रिया करने वाले परमाणुओं की वैद्युतीयऋणात्मकता का मान बराबर या लगभग बराबर है: ईओ (ए) ईओ (बी), तो कुल इलेक्ट्रॉन जोड़ी किसी भी परमाणु में स्थानांतरित नहीं होती है: ए: बी... इस कनेक्शन को कहा जाता है सहसंयोजक गैर-ध्रुवीय।
यदि परस्पर क्रिया करने वाले परमाणुओं की इलेक्ट्रोनगेटिविटी भिन्न होती है, लेकिन ज्यादा नहीं (इलेक्ट्रोनेगेटिविटी में अंतर लगभग 0.4 से 2 है: 0,4<ΔЭО<2 ), फिर इलेक्ट्रॉन जोड़ी को परमाणुओं में से एक में स्थानांतरित कर दिया जाता है। इस कनेक्शन को कहा जाता है सहसंयोजक ध्रुवीय .
यदि परस्पर क्रिया करने वाले परमाणुओं की इलेक्ट्रोनगेटिविटी काफी भिन्न होती है (इलेक्ट्रोनेगेटिविटी में अंतर 2 से अधिक है: ईओ> 2), तो इलेक्ट्रॉनों में से एक लगभग पूरी तरह से दूसरे परमाणु में स्थानांतरित हो जाता है, गठन के साथ आयनों... इस कनेक्शन को कहा जाता है ईओण का.
रासायनिक बंध के प्रमुख प्रकार हैं - सहसंयोजक, ईओण कातथा धातुसंचार। आइए उन पर अधिक विस्तार से विचार करें।
सहसंयोजक रासायनिक बंधन
सहसंयोजक बंधन – यह एक रासायनिक बंधन है द्वारा गठित एक आम इलेक्ट्रॉन जोड़ी का गठन ए: बी ... इस मामले में, दो परमाणु ओवरलैपपरमाणु कक्षक। एक सहसंयोजक बंधन इलेक्ट्रोनगेटिविटी में एक छोटे से अंतर के साथ परमाणुओं की बातचीत से बनता है (एक नियम के रूप में, दो अधातुओं के बीच) या एक तत्व के परमाणु।
सहसंयोजक बंधों के मूल गुण
- केंद्र,
- संतृप्ति,
- polarity,
- polarizability.
ये बंधन गुण पदार्थों के रासायनिक और भौतिक गुणों को प्रभावित करते हैं।
संचार की दिशा रासायनिक संरचना और पदार्थों के रूप की विशेषता है। दो बंधों के बीच के कोणों को बंध कोण कहते हैं। उदाहरण के लिए, एक पानी के अणु में H-O-H बॉन्ड कोण 104.45 о है, इसलिए पानी का अणु ध्रुवीय है, और मीथेन अणु में H-C-H बॉन्ड कोण 108 о 28 है।

संतृप्ति परमाणुओं की सीमित संख्या में सहसंयोजक रासायनिक बंध बनाने की क्षमता है। एक परमाणु जितने बंधों का निर्माण कर सकता है, उसे कहते हैं।
विचारों में भिन्नताअलग-अलग इलेक्ट्रोनगेटिविटी वाले दो परमाणुओं के बीच इलेक्ट्रॉन घनत्व के असमान वितरण से बंधन उत्पन्न होता है। सहसंयोजक बंधन ध्रुवीय और गैर-ध्रुवीय में विभाजित हैं।
polarizability कनेक्शन हैं बाहरी विद्युत क्षेत्र के प्रभाव में बंधन इलेक्ट्रॉनों को विस्थापित करने की क्षमता(विशेष रूप से, दूसरे कण का विद्युत क्षेत्र)। ध्रुवीकरण इलेक्ट्रॉन गतिशीलता पर निर्भर करता है। इलेक्ट्रॉन नाभिक से जितना दूर होता है, वह उतना ही अधिक गतिशील होता है, और, तदनुसार, अणु अधिक ध्रुवीकरण योग्य होता है।

सहसंयोजक गैर-ध्रुवीय रासायनिक बंधन
सहसंयोजक बंध 2 प्रकार के होते हैं - ध्रुवीयतथा गैर-ध्रुवीय .
उदाहरण . हाइड्रोजन अणु H2 की संरचना पर विचार करें। बाहरी ऊर्जा स्तर पर प्रत्येक हाइड्रोजन परमाणु में 1 अयुग्मित इलेक्ट्रॉन होता है। परमाणु को प्रदर्शित करने के लिए, हम लुईस संरचना का उपयोग करते हैं - यह परमाणु के बाहरी ऊर्जा स्तर की संरचना का एक आरेख है, जब इलेक्ट्रॉनों को डॉट्स द्वारा दर्शाया जाता है। दूसरी अवधि के तत्वों के साथ काम करते समय लुईस बिंदु संरचना मॉडल सहायक होते हैं।
एच। +. एच = एच: एच
इस प्रकार, हाइड्रोजन अणु में एक उभयनिष्ठ इलेक्ट्रॉन युग्म और एक रासायनिक बंध H-H होता है। यह इलेक्ट्रॉन युग्म किसी भी हाइड्रोजन परमाणु में स्थानांतरित नहीं होता है, क्योंकि हाइड्रोजन परमाणुओं की वैद्युतीयऋणात्मकता समान होती है। इस कनेक्शन को कहा जाता है सहसंयोजक गैर-ध्रुवीय .

सहसंयोजक गैर-ध्रुवीय (सममित) बंधन समान वैद्युतीयऋणात्मकता (एक नियम के रूप में, समान गैर-धातु) के साथ परमाणुओं द्वारा गठित एक सहसंयोजक बंधन है और इसलिए, परमाणुओं के नाभिक के बीच इलेक्ट्रॉन घनत्व के एक समान वितरण के साथ।
अध्रुवीय बंधों का द्विध्रुव आघूर्ण 0 होता है।
के उदाहरण: एच 2 (एच-एच), ओ 2 (ओ = ओ), एस 8।
सहसंयोजक ध्रुवीय रासायनिक बंधन
सहसंयोजक ध्रुवीय बंधन एक सहसंयोजक बंधन है जो के बीच होता है विभिन्न वैद्युतीयऋणात्मकता वाले परमाणु (आमतौर पर, विभिन्न अधातु) और इसकी विशेषता है विस्थापनएक अधिक विद्युतीय परमाणु (ध्रुवीकरण) के लिए एक सामान्य इलेक्ट्रॉन जोड़ी।
इलेक्ट्रॉन घनत्व एक अधिक विद्युत ऋणात्मक परमाणु में स्थानांतरित हो जाता है - इसलिए, उस पर एक आंशिक ऋणात्मक आवेश (δ-) उत्पन्न होता है, और एक कम विद्युत ऋणात्मक परमाणु पर एक आंशिक धनात्मक आवेश (δ +, डेल्टा +) उत्पन्न होता है।
परमाणुओं की वैद्युतीयऋणात्मकता में जितना अधिक अंतर होता है, उतना ही अधिक polarityकनेक्शन और भी बहुत कुछ द्विध्रुव आघूर्ण ... अतिरिक्त आकर्षक बल पड़ोसी अणुओं और विपरीत चिन्ह के आवेशों के बीच कार्य करते हैं, जो बढ़ता है ताकतसंचार।
एक बंधन की ध्रुवीयता यौगिकों के भौतिक और रासायनिक गुणों को प्रभावित करती है। प्रतिक्रिया तंत्र और यहां तक कि पड़ोसी बंधनों की प्रतिक्रियाशीलता बंधन की ध्रुवीयता पर निर्भर करती है। कनेक्शन की ध्रुवीयता अक्सर द्वारा निर्धारित की जाती है अणु ध्रुवताऔर इस प्रकार क्वथनांक और गलनांक, ध्रुवीय सॉल्वैंट्स में घुलनशीलता जैसे भौतिक गुणों को सीधे प्रभावित करता है।
उदाहरण: एचसीएल, सीओ 2, एनएच 3।
सहसंयोजक बंधन गठन के तंत्र
एक सहसंयोजक रासायनिक बंधन 2 तंत्रों के माध्यम से हो सकता है:
1. विनिमय तंत्र एक सहसंयोजक रासायनिक बंधन का निर्माण तब होता है जब प्रत्येक कण एक सामान्य इलेक्ट्रॉन जोड़े के निर्माण के लिए एक अयुग्मित इलेक्ट्रॉन प्रदान करता है:
ए . + . बी = ए: बी
2. सहसंयोजक बंधन गठन एक तंत्र है जिसमें कणों में से एक अकेला इलेक्ट्रॉन जोड़ी प्रदान करता है, और दूसरा कण इस इलेक्ट्रॉन जोड़ी के लिए एक खाली कक्षीय प्रदान करता है:
ए: + बी = ए: बी

इस मामले में, परमाणुओं में से एक एक अकेला इलेक्ट्रॉन युग्म प्रदान करता है ( दाता), और दूसरा परमाणु इस जोड़ी के लिए एक खाली कक्षीय कक्ष प्रदान करता है ( हुंडी सकारनेवाला) बंध निर्माण के परिणामस्वरूप, दोनों इलेक्ट्रॉन ऊर्जा कम हो जाती है, अर्थात। यह परमाणुओं के लिए फायदेमंद है।
दाता-स्वीकर्ता तंत्र द्वारा गठित एक सहसंयोजक बंधन अलग नहीं हैविनिमय तंत्र द्वारा गठित अन्य सहसंयोजक बंधों के गुणों में। दाता-स्वीकर्ता तंत्र द्वारा एक सहसंयोजक बंधन का निर्माण बाहरी ऊर्जा स्तर (इलेक्ट्रॉन दाताओं) पर बड़ी संख्या में इलेक्ट्रॉनों के साथ परमाणुओं की विशेषता है, या इसके विपरीत, बहुत कम संख्या में इलेक्ट्रॉनों (इलेक्ट्रॉन स्वीकर्ता) के साथ। परमाणुओं की संयोजकता क्षमताओं पर संबंधित अनुभाग में अधिक विस्तार से विचार किया गया है।
दाता-स्वीकर्ता तंत्र द्वारा एक सहसंयोजक बंधन बनता है:
- एक अणु में कार्बन मोनोऑक्साइड CO(अणु में बंधन ट्रिपल है, 2 बांड विनिमय तंत्र द्वारा बनते हैं, एक दाता-स्वीकर्ता तंत्र द्वारा): C≡O;
- वी अमोनियम आयन NH4+, आयनों में कार्बनिक अमाइन, उदाहरण के लिए, मिथाइलमोनियम आयन सीएच 3 -एनएच 2 + में;
- वी जटिल यौगिक, केंद्रीय परमाणु और लिगैंड समूहों के बीच एक रासायनिक बंधन, उदाहरण के लिए, सोडियम टेट्राहाइड्रॉक्सोएल्यूमिनेट ना में एल्यूमीनियम और हाइड्रॉक्साइड आयनों के बीच का बंधन;
- वी नाइट्रिक एसिड और उसके लवण- नाइट्रेट्स: HNO 3, NaNO 3, कुछ अन्य नाइट्रोजन यौगिकों में;

- एक अणु में ओजोनओ 3.
सहसंयोजक बंधन की मुख्य विशेषताएं
एक सहसंयोजक बंधन आमतौर पर अधातु परमाणुओं के बीच बनता है। सहसंयोजक बंधन की मुख्य विशेषताएं हैं लंबाई, ऊर्जा, बहुलता और दिशा।
रासायनिक बंधन की बहुलता
रासायनिक बंधन की बहुलता - यह है एक यौगिक में दो परमाणुओं के बीच सामान्य इलेक्ट्रॉन जोड़े की संख्या... बंधन की बहुलता को अणु बनाने वाले परमाणुओं के मूल्य से आसानी से निर्धारित किया जा सकता है।
उदाहरण के लिए , हाइड्रोजन अणु एच 2 में, बांड बहुलता 1 है, क्योंकि प्रत्येक हाइड्रोजन में बाह्य ऊर्जा स्तर पर केवल 1 अयुग्मित इलेक्ट्रॉन होता है, इसलिए, एक सामान्य इलेक्ट्रॉन युग्म बनता है।
ऑक्सीजन अणु O 2 में, बंध बहुलता 2 है, क्योंकि बाहरी ऊर्जा स्तर पर प्रत्येक परमाणु में 2 अयुग्मित इलेक्ट्रॉन होते हैं: O = O।
नाइट्रोजन अणु N 2 में, बंध बहुलता 3 है, क्योंकि प्रत्येक परमाणु के बीच बाहरी ऊर्जा स्तर पर 3 अयुग्मित इलेक्ट्रॉन होते हैं, और परमाणु 3 सामान्य इलेक्ट्रॉन जोड़े N≡N बनाते हैं।
सहसंयोजक बंधन लंबाई
रासायनिक बंधन लंबाई
बंधन बनाने वाले परमाणुओं के नाभिक के केंद्रों के बीच की दूरी है। यह प्रयोगात्मक भौतिक विधियों द्वारा निर्धारित किया जाता है। बॉन्ड की लंबाई का अनुमान लगभग एडिटिविटी नियम के अनुसार लगाया जा सकता है, जिसके अनुसार AB अणु में बॉन्ड की लंबाई A2 और B2 अणुओं में बॉन्ड की लंबाई के आधे योग के बराबर होती है: 
रासायनिक बंधन की लंबाई का मोटे तौर पर अनुमान लगाया जा सकता है परमाणुओं की त्रिज्या के साथएक बंधन बनाना, या संचार की आवृत्ति सेयदि परमाणुओं की त्रिज्याएँ बहुत भिन्न नहीं हैं।
एक बंधन बनाने वाले परमाणुओं की त्रिज्या में वृद्धि के साथ, बंधन की लंबाई बढ़ जाएगी।
उदाहरण के लिए
परमाणुओं के बीच बंधन की बहुलता में वृद्धि के साथ (जिसकी परमाणु त्रिज्या भिन्न नहीं होती है, या नगण्य रूप से भिन्न होती है), बंधन की लंबाई कम हो जाएगी।
उदाहरण के लिए ... श्रृंखला में: सी - सी, सी = सी, सी≡सी, बांड की लंबाई घट जाती है।
संचार ऊर्जा
बंधन ऊर्जा एक रासायनिक बंधन की ताकत का एक उपाय है। संचार ऊर्जा एक बंधन को तोड़ने और एक दूसरे से असीम रूप से बड़ी दूरी पर इस बंधन को बनाने वाले परमाणुओं को हटाने के लिए आवश्यक ऊर्जा द्वारा निर्धारित किया जाता है।
एक सहसंयोजक बंधन है बहुत टिकाऊ।इसकी ऊर्जा कई दसियों से लेकर कई सौ kJ / mol तक होती है। बंधन ऊर्जा जितनी अधिक होगी, बंधन शक्ति उतनी ही अधिक होगी, और इसके विपरीत।
एक रासायनिक बंधन की ताकत बंधन की लंबाई, बंधन ध्रुवीयता और बंधन बहुलता पर निर्भर करती है। रासायनिक बंधन जितना लंबा होगा, उसे तोड़ना उतना ही आसान होगा, और बंधन ऊर्जा जितनी कम होगी, उसकी ताकत उतनी ही कम होगी। रासायनिक बंधन जितना छोटा होगा, वह उतना ही मजबूत होगा और बंधन ऊर्जा उतनी ही अधिक होगी।
उदाहरण के लिए, यौगिकों की श्रृंखला में एचएफ, एचसीएल, एचबीआर, बाएं से दाएं, रासायनिक बंधन की ताकत कम हो जाती हैजबसे कनेक्शन की लंबाई बढ़ जाती है।
आयनिक रासायनिक बंधन

आयोनिक बंध एक रासायनिक बंधन पर आधारित है आयनों का स्थिरवैद्युत आकर्षण.
जोनाहपरमाणुओं द्वारा इलेक्ट्रॉनों को स्वीकार करने या छोड़ने की प्रक्रिया में बनते हैं। उदाहरण के लिए, सभी धातुओं के परमाणु बाहरी ऊर्जा स्तर के इलेक्ट्रॉनों को कमजोर रूप से बनाए रखते हैं। इसलिए, धातु परमाणुओं की विशेषता है दृढ गुण- इलेक्ट्रॉनों को दान करने की क्षमता।

उदाहरण. सोडियम परमाणु में तीसरे ऊर्जा स्तर पर 1 इलेक्ट्रॉन होता है। इसे आसानी से छोड़ने पर, सोडियम परमाणु एक अधिक स्थिर Na + आयन बनाता है, जिसमें नोबल नियॉन गैस Ne का इलेक्ट्रॉनिक विन्यास होता है। सोडियम आयन में 11 प्रोटॉन और केवल 10 इलेक्ट्रॉन होते हैं, इसलिए आयन का कुल आवेश -10 + 11 = +1 होता है:
+11ना) 2) 8) 1 - 1e = +11 ना +) 2 ) 8
उदाहरण. बाहरी ऊर्जा स्तर पर क्लोरीन परमाणु में 7 इलेक्ट्रॉन होते हैं। एक स्थिर अक्रिय आर्गन परमाणु Ar का विन्यास प्राप्त करने के लिए, क्लोरीन को 1 इलेक्ट्रॉन संलग्न करने की आवश्यकता होती है। एक इलेक्ट्रॉन के जुड़ाव के बाद, इलेक्ट्रॉनों से मिलकर एक स्थिर क्लोरीन आयन बनता है। आयन का कुल आवेश -1 है:
+17NS) 2) 8) 7 + 1e = +17 NS — ) 2 ) 8 ) 8
ध्यान दें:
- आयनों के गुण परमाणुओं के गुणों से भिन्न होते हैं!
- स्थिर आयन न केवल बना सकते हैं परमाणुओं, लेकिन परमाणुओं के समूह... उदाहरण के लिए: अमोनियम आयन NH 4 +, सल्फेट आयन SO 4 2-, आदि। ऐसे आयनों द्वारा निर्मित रासायनिक बंधों को भी आयनिक माना जाता है;
- आयनिक बंधन, एक नियम के रूप में, एक दूसरे के साथ बनता है धातुओंतथा गैर धातु(गैर धातुओं के समूह);
परिणामी आयन विद्युत आकर्षण से आकर्षित होते हैं: Na + Cl -, Na 2 + SO 4 2-।
आइए संक्षेप करें सहसंयोजक और आयनिक बंधन प्रकारों के बीच भेद:


धात्विक बंधन एक कनेक्शन है जो अपेक्षाकृत बनता है मुक्त इलेक्ट्रॉनके बीच धातु आयनक्रिस्टल जाली का निर्माण।
बाहरी ऊर्जा स्तर पर धातु परमाणु आमतौर पर स्थित होते हैं एक से तीन इलेक्ट्रॉन... धातु परमाणुओं की त्रिज्या, एक नियम के रूप में, बड़ी होती है - इसलिए, धातु परमाणु, गैर-धातुओं के विपरीत, बाहरी इलेक्ट्रॉनों को काफी आसानी से दान करते हैं, अर्थात। मजबूत कम करने वाले एजेंट हैं.
इलेक्ट्रॉन दान करने से धातु के परमाणु में बदल जाते हैं धनात्मक आवेशित आयन ... पृथक इलेक्ट्रॉन अपेक्षाकृत मुक्त होते हैं कदमधनात्मक आवेशित धातु आयनों के बीच। इन कणों के बीच एक कनेक्शन हैजबसे साझा इलेक्ट्रॉन स्तरित धातु के पिंजरों को एक साथ रखते हैं , इस प्रकार एक पर्याप्त रूप से मजबूत धातु क्रिस्टल जाली ... इस मामले में, इलेक्ट्रॉन लगातार अराजक रूप से चलते हैं, अर्थात। नए तटस्थ परमाणु और नए धनायन लगातार उभर रहे हैं।

इंटरमॉलिक्युलर इंटरैक्शन
अलग-अलग, किसी पदार्थ में अलग-अलग अणुओं के बीच उत्पन्न होने वाली बातचीत पर विचार करना उचित है - इंटरमॉलिक्युलर इंटरैक्शन ... इंटरमॉलिक्युलर इंटरैक्शन तटस्थ परमाणुओं के बीच एक प्रकार की बातचीत है जिसमें नए सहसंयोजक बंधन प्रकट नहीं होते हैं। 1869 में वैन डेर वाल्स द्वारा अणुओं के बीच बातचीत की ताकतों की खोज की गई और उनके नाम पर रखा गया वैन डार वाल्स फोर्सेज... वैन डेर वाल्स बलों को विभाजित किया गया है अभिविन्यास, प्रवेश तथा फैलानेवाला ... इंटरमॉलिक्युलर इंटरैक्शन की ऊर्जा एक रासायनिक बंधन की ऊर्जा से बहुत कम है।
आकर्षण के उन्मुखीकरण बल ध्रुवीय अणुओं के बीच होता है (द्विध्रुवीय-द्विध्रुवीय अंतःक्रिया)। ये बल ध्रुवीय अणुओं के बीच उत्पन्न होते हैं। प्रेरण बातचीत एक ध्रुवीय अणु और एक गैर-ध्रुवीय के बीच की बातचीत है। एक गैर-ध्रुवीय अणु एक ध्रुवीय की क्रिया के कारण ध्रुवीकृत होता है, जो अतिरिक्त इलेक्ट्रोस्टैटिक आकर्षण उत्पन्न करता है।
एक विशेष प्रकार की अंतर-आणविक बातचीत हाइड्रोजन बांड है। - ये इंटरमॉलिक्युलर (या इंट्रामोल्युलर) रासायनिक बंधन हैं जो अणुओं के बीच उत्पन्न होते हैं जिनमें दृढ़ता से ध्रुवीय सहसंयोजक बंधन होते हैं - एच-एफ, एच-ओ या एच-एन... यदि किसी अणु में ऐसे बंधन हों, तो अणुओं के बीच होगा गुरुत्वाकर्षण के अतिरिक्त बल .
गठन तंत्र हाइड्रोजन बॉन्डिंग आंशिक रूप से इलेक्ट्रोस्टैटिक और आंशिक रूप से दाता-स्वीकर्ता है। इस मामले में, इलेक्ट्रॉन जोड़ी का दाता एक जोरदार विद्युतीय तत्व (एफ, ओ, एन) का परमाणु है, और स्वीकर्ता इन परमाणुओं से जुड़ा हाइड्रोजन परमाणु है। हाइड्रोजन बांड की विशेषता है केंद्र अंतरिक्ष में और संतृप्ति
हाइड्रोजन बांड को डॉट्स द्वारा निरूपित किया जा सकता है: ··· O. हाइड्रोजन के साथ संयुक्त परमाणु की वैद्युतीयऋणात्मकता जितनी अधिक होगी, और उसका आकार जितना छोटा होगा, हाइड्रोजन बंधन उतना ही मजबूत होगा। यह मुख्य रूप से यौगिकों की विशेषता है हाइड्रोजन के साथ फ्लोरीन और करने के लिए भी हाइड्रोजन के साथ ऑक्सीजन , कम हाइड्रोजन के साथ नाइट्रोजन .

निम्नलिखित पदार्थों के बीच हाइड्रोजन बंध उत्पन्न होते हैं:
— हाइड्रोजन फ्लोराइड एचएफ(गैस, पानी में हाइड्रोजन फ्लोराइड का घोल - हाइड्रोफ्लोरिक एसिड), पानीएच 2 ओ (भाप, बर्फ, तरल पानी):
— अमोनिया और कार्बनिक अमाइन समाधान- अमोनिया और पानी के अणुओं के बीच;
— कार्बनिक यौगिक जिनमें ओ-एच या एनएच बांड: अल्कोहल, कार्बोक्जिलिक एसिड, एमाइन, अमीनो एसिड, फिनोल, एनिलिन और इसके डेरिवेटिव, प्रोटीन, कार्बोहाइड्रेट के समाधान - मोनोसेकेराइड और डिसैकराइड।
हाइड्रोजन बांड पदार्थों के भौतिक और रासायनिक गुणों को प्रभावित करता है। इस प्रकार, अणुओं के बीच अतिरिक्त आकर्षण पदार्थों को उबालना मुश्किल बना देता है। हाइड्रोजन बांड वाले पदार्थों के लिए, क्वथनांक में असामान्य वृद्धि देखी जाती है।
उदाहरण के लिए , एक नियम के रूप में, आणविक भार में वृद्धि के साथ, पदार्थों के क्वथनांक में वृद्धि देखी जाती है। हालांकि, कई पदार्थों में एच २ ओ-एच २ एस-एच २ से-एच २ टीहम क्वथनांक में एक रैखिक परिवर्तन नहीं देखते हैं।

अर्थात्, अत क्वथनांक असामान्य रूप से उच्च - कम से कम -61 o C, जैसा कि सीधी रेखा हमें दिखाती है, लेकिन बहुत अधिक, +100 o C. इस विसंगति को पानी के अणुओं के बीच हाइड्रोजन बांड की उपस्थिति से समझाया गया है। इसलिए, सामान्य परिस्थितियों में (0-20 डिग्री सेल्सियस), पानी है तरलचरण राज्य द्वारा।
यह अत्यंत दुर्लभ है कि रसायन रासायनिक तत्वों के अलग, असंबंधित परमाणुओं से बने होते हैं। सामान्य परिस्थितियों में केवल कुछ ही गैसों को महान गैस कहा जाता है, ऐसी संरचना होती है: हीलियम, नियॉन, आर्गन, क्रिप्टन, क्सीनन और रेडॉन। अधिकतर रासायनिक पदार्थों में बिखरे हुए परमाणु नहीं होते हैं, बल्कि उनके संयोजन विभिन्न समूहों में होते हैं। परमाणुओं के ऐसे संघ कई इकाइयों, सैकड़ों, हजारों या उससे भी अधिक परमाणुओं की संख्या कर सकते हैं। वह बल जो इन परमाणुओं को ऐसे समूहों की संरचना में रखता है, कहलाता है रसायनिक बंध.
दूसरे शब्दों में, हम कह सकते हैं कि एक रासायनिक बंधन एक अंतःक्रिया है जो व्यक्तिगत परमाणुओं के बीच अधिक जटिल संरचनाओं (अणु, आयन, रेडिकल, क्रिस्टल, आदि) में एक बंधन प्रदान करता है।
एक रासायनिक बंधन के गठन का कारण यह है कि अधिक जटिल संरचनाओं की ऊर्जा इसे बनाने वाले व्यक्तिगत परमाणुओं की कुल ऊर्जा से कम होती है।
इसलिए, विशेष रूप से, यदि परमाणुओं X और Y की परस्पर क्रिया के दौरान एक XY अणु बनता है, तो इसका मतलब है कि इस पदार्थ के अणुओं की आंतरिक ऊर्जा उन व्यक्तिगत परमाणुओं की आंतरिक ऊर्जा से कम है जिनसे इसे बनाया गया था:
ई (एक्सवाई)< E(X) + E(Y)
इस कारण से, जब व्यक्तिगत परमाणुओं के बीच रासायनिक बंधन बनते हैं, तो ऊर्जा निकलती है।
रासायनिक बंधों के निर्माण में बाहरी इलेक्ट्रॉन परत के इलेक्ट्रॉनों द्वारा नाभिक के साथ सबसे कम बंधन ऊर्जा के साथ भाग लिया जाता है, जिसे कहा जाता है संयोजक... उदाहरण के लिए, बोरॉन में, ये 2 ऊर्जा स्तरों के इलेक्ट्रॉन होते हैं - 2 इलेक्ट्रॉनों के लिए 2 एस-कक्षक और 1 बटा 2 पी-ऑर्बिटल्स:
जब एक रासायनिक बंधन बनता है, तो प्रत्येक परमाणु महान गैसों के परमाणुओं का इलेक्ट्रॉनिक विन्यास प्राप्त करना चाहता है, अर्थात। ताकि इसकी बाहरी इलेक्ट्रॉन परत (पहली अवधि के तत्वों के लिए 2) में 8 इलेक्ट्रॉन हों। इस परिघटना को अष्टक नियम कहते हैं।
परमाणुओं द्वारा एक उत्कृष्ट गैस के इलेक्ट्रॉनिक विन्यास की उपलब्धि संभव है यदि शुरू में एकल परमाणु अन्य परमाणुओं के लिए अपने वैलेंस इलेक्ट्रॉनों का हिस्सा बनाते हैं। इस मामले में, सामान्य इलेक्ट्रॉन जोड़े बनते हैं।
इलेक्ट्रॉन समाजीकरण की डिग्री के आधार पर, सहसंयोजक, आयनिक और धातु बंधनों को प्रतिष्ठित किया जा सकता है।
सहसंयोजक बंधन
एक सहसंयोजक बंधन अधातु तत्वों के परमाणुओं के बीच सबसे अधिक बार होता है। यदि अधातुओं के परमाणु जो एक सहसंयोजक बंधन बनाते हैं, विभिन्न रासायनिक तत्वों से संबंधित होते हैं, तो ऐसे बंधन को सहसंयोजक ध्रुवीय कहा जाता है। इस नाम का कारण यह है कि विभिन्न तत्वों के परमाणुओं में भी एक सामान्य इलेक्ट्रॉन जोड़े को आकर्षित करने की एक अलग क्षमता होती है। जाहिर है, इससे एक परमाणु की ओर सामान्य इलेक्ट्रॉन युग्म का विस्थापन होता है, जिसके परिणामस्वरूप उस पर आंशिक ऋणात्मक आवेश बनता है। बदले में, दूसरे परमाणु पर एक आंशिक धनात्मक आवेश बनता है। उदाहरण के लिए, हाइड्रोजन क्लोराइड अणु में, एक इलेक्ट्रॉन जोड़ी हाइड्रोजन परमाणु से क्लोरीन परमाणु में विस्थापित हो जाती है:
सहसंयोजक ध्रुवीय बंधन वाले पदार्थों के उदाहरण:
Cl 4, H 2 S, CO 2, NH 3, SiO 2, आदि।
एक ही रासायनिक तत्व के गैर-धातुओं के परमाणुओं के बीच एक सहसंयोजक गैर-ध्रुवीय बंधन बनता है। चूंकि परमाणु समान हैं, इसलिए साझा इलेक्ट्रॉनों को खींचने की उनकी क्षमता समान है। इस संबंध में, इलेक्ट्रॉन युग्म का विस्थापन नहीं देखा जाता है:
सहसंयोजक बंधन के निर्माण के लिए उपरोक्त तंत्र, जब दोनों परमाणु सामान्य इलेक्ट्रॉन जोड़े के निर्माण के लिए इलेक्ट्रॉन प्रदान करते हैं, विनिमय कहा जाता है।
एक दाता-स्वीकर्ता तंत्र भी है।
जब दाता-स्वीकर्ता तंत्र द्वारा एक सहसंयोजक बंधन बनता है, तो एक परमाणु के भरे हुए कक्षीय (दो इलेक्ट्रॉनों के साथ) और दूसरे परमाणु के खाली कक्षीय के कारण एक सामान्य इलेक्ट्रॉन युग्म बनता है। एक अकेला इलेक्ट्रॉन युग्म प्रदान करने वाले परमाणु को दाता कहा जाता है, और एक मुक्त कक्षीय वाले परमाणु को स्वीकर्ता कहा जाता है। युग्मित इलेक्ट्रॉनों वाले परमाणु इलेक्ट्रॉन जोड़े के दाताओं के रूप में कार्य करते हैं, उदाहरण के लिए, एन, ओ, पी, एस।
उदाहरण के लिए, दाता-स्वीकर्ता तंत्र के अनुसार, चौथा सहसंयोजक NH बंध अमोनियम धनायन NH 4 + में बनता है:
ध्रुवीयता के अलावा, सहसंयोजक बंध भी ऊर्जा की विशेषता रखते हैं। बांड ऊर्जा परमाणुओं के बीच एक बंधन को तोड़ने के लिए आवश्यक न्यूनतम ऊर्जा है।
बंधित परमाणुओं की त्रिज्या बढ़ने के साथ बंधन ऊर्जा कम होती जाती है। चूंकि, जैसा कि हम जानते हैं, परमाणु त्रिज्या उपसमूहों के साथ नीचे की ओर बढ़ती है, उदाहरण के लिए, यह निष्कर्ष निकाला जा सकता है कि श्रृंखला में हलोजन-हाइड्रोजन बंधन की ताकत बढ़ जाती है:
नमस्ते< HBr < HCl < HF
साथ ही, बंध ऊर्जा इसकी बहुलता पर निर्भर करती है - बंध बहुलता जितनी अधिक होगी, इसकी ऊर्जा उतनी ही अधिक होगी। बंधन बहुलता दो परमाणुओं के बीच सामान्य इलेक्ट्रॉन जोड़े की संख्या को संदर्भित करती है।
आयोनिक बंध
आयनिक बंधन को सहसंयोजक ध्रुवीय बंधन का सीमित मामला माना जा सकता है। यदि एक सहसंयोजक-ध्रुवीय बंधन में कुल इलेक्ट्रॉन जोड़ी आंशिक रूप से परमाणुओं की जोड़ी में से एक में विस्थापित हो जाती है, तो एक आयनिक में यह परमाणुओं में से एक को लगभग पूरी तरह से "दिया" जाता है। जिस परमाणु ने इलेक्ट्रॉन (ओं) को दान किया है, वह एक धनात्मक आवेश प्राप्त कर लेता है और बन जाता है कटियन, और परमाणु, जो इससे इलेक्ट्रॉन लेता है, ऋणात्मक आवेश प्राप्त कर लेता है और बन जाता है ऋणायन.
इस प्रकार, एक आयनिक बंधन एक बंधन है जो आयनों के इलेक्ट्रोस्टैटिक आकर्षण के कारण बनता है।
इस प्रकार के बंधन का निर्माण विशिष्ट धातुओं और विशिष्ट गैर-धातुओं के परमाणुओं की परस्पर क्रिया की विशेषता है।
उदाहरण के लिए, पोटेशियम फ्लोराइड। तटस्थ परमाणु से एक इलेक्ट्रॉन के अमूर्त होने के परिणामस्वरूप पोटेशियम धनायन प्राप्त होता है, और फ्लोरीन आयन तब बनता है जब एक इलेक्ट्रॉन फ्लोरीन परमाणु से जुड़ा होता है:

परिणामी आयनों के बीच इलेक्ट्रोस्टैटिक आकर्षण का एक बल उत्पन्न होता है, जिसके परिणामस्वरूप एक आयनिक यौगिक बनता है।
एक रासायनिक बंधन के निर्माण के दौरान, सोडियम परमाणु से इलेक्ट्रॉन क्लोरीन परमाणु में चले गए और विपरीत रूप से आवेशित आयनों का निर्माण हुआ, जिनमें एक पूर्ण बाहरी ऊर्जा स्तर होता है।
यह पाया गया कि धातु परमाणु से इलेक्ट्रॉन पूरी तरह से अलग नहीं होते हैं, लेकिन केवल क्लोरीन परमाणु की ओर विस्थापित होते हैं, जैसा कि एक सहसंयोजक बंधन में होता है।
अधिकांश द्विआधारी यौगिक जिनमें धातु के परमाणु होते हैं, आयनिक होते हैं। उदाहरण के लिए, ऑक्साइड, हैलाइड, सल्फाइड, नाइट्राइड।
एक आयनिक बंधन सरल धनायनों और सरल आयनों (F -, Cl -, S 2-) के साथ-साथ सरल धनायनों और जटिल आयनों (NO 3 -, SO 4 2-, PO 4 3-, OH -) के बीच भी होता है। . इसलिए, आयनिक यौगिकों में लवण और क्षार (Na 2 SO 4, Cu (NO 3) 2, (NH 4) 2 SO 4), Ca (OH) 2, NaOH) शामिल हैं।
धात्विक बंधन
इस प्रकार का बंधन धातुओं में बनता है।
सभी धातुओं के परमाणुओं में बाहरी इलेक्ट्रॉन परत पर इलेक्ट्रॉन होते हैं, जिनकी परमाणु नाभिक के साथ कम बाध्यकारी ऊर्जा होती है। अधिकांश धातुओं के लिए, बाह्य इलेक्ट्रॉनों की हानि की प्रक्रिया ऊर्जावान रूप से अनुकूल होती है।
नाभिक के साथ इस तरह की कमजोर बातचीत को देखते हुए, धातुओं में ये इलेक्ट्रॉन बहुत गतिशील होते हैं और प्रत्येक धातु क्रिस्टल में निम्नलिखित प्रक्रिया लगातार होती रहती है:
0 - एन - = एम एन +,
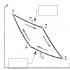
जहाँ M 0 एक उदासीन धातु परमाणु है, और M n + एक ही धातु का धनायन है। नीचे दिया गया आंकड़ा चल रही प्रक्रियाओं का एक उदाहरण दिखाता है।
अर्थात्, इलेक्ट्रॉन धातु के क्रिस्टल के साथ "ले जाते हैं", एक धातु परमाणु से अलग होकर, इससे एक धनायन बनाते हैं, दूसरे धनायन में जुड़ते हैं, एक तटस्थ परमाणु बनाते हैं। इस घटना को "इलेक्ट्रॉनिक हवा" कहा जाता था, और एक गैर-धातु परमाणु के क्रिस्टल में मुक्त इलेक्ट्रॉनों के सेट को "इलेक्ट्रॉन गैस" कहा जाता था। धातु के परमाणुओं के बीच इस प्रकार की बातचीत को धातु बंधन कहा जाता था।
हाइड्रोजन बंध
यदि किसी पदार्थ में हाइड्रोजन परमाणु उच्च इलेक्ट्रोनगेटिविटी (नाइट्रोजन, ऑक्सीजन या फ्लोरीन) वाले तत्व से जुड़ा होता है, तो ऐसे पदार्थ को हाइड्रोजन बंधन जैसी घटना की विशेषता होती है।
चूंकि हाइड्रोजन परमाणु एक विद्युत ऋणात्मक परमाणु से बंधा होता है, हाइड्रोजन परमाणु पर आंशिक धनात्मक आवेश बनता है, और विद्युत ऋणात्मक तत्व पर आंशिक ऋणात्मक आवेश बनता है। इस संबंध में, एक अणु के आंशिक रूप से धनात्मक आवेशित हाइड्रोजन परमाणु और दूसरे के विद्युत ऋणात्मक परमाणु के बीच इलेक्ट्रोस्टैटिक आकर्षण संभव हो जाता है। उदाहरण के लिए, पानी के अणुओं के लिए एक हाइड्रोजन बंधन देखा जाता है:
यह हाइड्रोजन बांड है जो पानी के असामान्य रूप से उच्च गलनांक की व्याख्या करता है। पानी के अलावा, हाइड्रोजन फ्लोराइड, अमोनिया, ऑक्सीजन युक्त एसिड, फिनोल, अल्कोहल और एमाइन जैसे पदार्थों में भी मजबूत हाइड्रोजन बांड बनते हैं।
धात्विक बंधन। धातु बंधन गुण।
एक धात्विक बंधन एक रासायनिक बंधन है जो अपेक्षाकृत मुक्त इलेक्ट्रॉनों की उपस्थिति के कारण होता है। यह शुद्ध धातुओं और उनके मिश्र धातुओं और इंटरमेटेलिक यौगिकों दोनों के लिए विशिष्ट है।
धातु लिंक तंत्र
सकारात्मक धातु आयन क्रिस्टल जाली के सभी नोड्स पर स्थित होते हैं। उनके बीच, वैलेंस इलेक्ट्रॉन, आयनों के निर्माण के दौरान परमाणुओं से अलग हो जाते हैं, गैस के अणुओं की तरह बेतरतीब ढंग से चलते हैं। ये इलेक्ट्रॉन सकारात्मक आयनों को एक साथ पकड़े हुए सीमेंट के रूप में कार्य करते हैं; अन्यथा, आयनों के बीच प्रतिकारक बलों की कार्रवाई के तहत जाली विघटित हो जाएगी। उसी समय, इलेक्ट्रॉन क्रिस्टल जाली के भीतर आयनों द्वारा धारण किए जाते हैं और इसे छोड़ नहीं सकते। संचार बल स्थानीयकृत और निर्देशित नहीं हैं। इस कारण से, ज्यादातर मामलों में, उच्च समन्वय संख्याएं दिखाई देती हैं (उदाहरण के लिए, 12 या 8)। जब दो धातु परमाणु एक साथ आते हैं, तो उनके बाहरी कोशों के कक्षक अतिव्यापन करके आण्विक कक्षक बनाते हैं। यदि तीसरा परमाणु उपयुक्त है, तो इसका कक्षक पहले दो परमाणुओं के कक्षकों के साथ अतिव्यापन करता है, जो एक अन्य आणविक कक्षक देता है। जब कई परमाणु होते हैं, तो बड़ी संख्या में त्रि-आयामी आणविक कक्षाएँ उत्पन्न होती हैं, जो सभी दिशाओं में फैलती हैं। ऑर्बिटल्स के कई ओवरलैप के कारण, प्रत्येक परमाणु के वैलेंस इलेक्ट्रॉन कई परमाणुओं से प्रभावित होते हैं।
विशेषता क्रिस्टल जाली
अधिकांश धातुएं परमाणुओं की करीबी पैकिंग के साथ निम्नलिखित अत्यधिक सममित जाली में से एक बनाती हैं: घन शरीर-केंद्रित, घन चेहरा-केंद्रित, और हेक्सागोनल।
एक घन शरीर-केंद्रित जाली (BCC) में, परमाणु घन के शीर्ष पर स्थित होते हैं और एक परमाणु घन के आयतन के केंद्र में होता है। धातुओं में एक घन शरीर-केंद्रित जाली होती है: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba, आदि।
एक फलक-केंद्रित घन जाली (FCC) में, परमाणु घन के शीर्षों पर और प्रत्येक फलक के केंद्र में स्थित होते हैं। इस प्रकार की धातुओं में एक जाली होती है: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, -Fe, Cu, α-Co, आदि।
एक हेक्सागोनल जाली में, परमाणु प्रिज्म के हेक्सागोनल बेस के केंद्र और शीर्ष पर स्थित होते हैं, और तीन परमाणु प्रिज्म के मध्य तल में स्थित होते हैं। धातुओं में परमाणुओं की ऐसी पैकिंग होती है: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca, आदि।
अन्य गुण
स्वतंत्र रूप से चलने वाले इलेक्ट्रॉन उच्च विद्युत और तापीय चालकता प्रदान करते हैं। धात्विक बंधन वाले पदार्थ अक्सर ताकत को लचीलापन के साथ जोड़ते हैं, क्योंकि जब परमाणु एक दूसरे के सापेक्ष विस्थापित होते हैं, तो बंधन नहीं टूटते हैं। धात्विक सुगंध भी एक महत्वपूर्ण गुण है।
धातुएं गर्मी और बिजली का संचालन अच्छी तरह से करती हैं, वे काफी मजबूत हैं, उन्हें बिना विनाश के विकृत किया जा सकता है। कुछ धातुएँ निंदनीय होती हैं (उन्हें जाली बनाया जा सकता है), कुछ चिपचिपी होती हैं (उन्हें तार से बाहर निकाला जा सकता है)। इन अद्वितीय गुणों को एक विशेष प्रकार के रासायनिक बंधन द्वारा समझाया गया है जो धातु के परमाणुओं को एक दूसरे से जोड़ता है - एक धातु बंधन।
ठोस अवस्था में धातुएँ सकारात्मक आयनों के क्रिस्टल के रूप में मौजूद होती हैं, जैसे कि इलेक्ट्रॉनों के समुद्र में "तैरते हुए" स्वतंत्र रूप से उनके बीच घूम रहे हों।
धातु बंधन धातुओं के गुणों, विशेष रूप से उनकी ताकत की व्याख्या करता है। विकृत बल की कार्रवाई के तहत, धातु की जाली आयनिक क्रिस्टल के विपरीत, बिना दरार के अपना आकार बदल सकती है।
धातुओं की उच्च तापीय चालकता को इस तथ्य से समझाया जाता है कि यदि धातु के एक टुकड़े को एक तरफ गर्म किया जाता है, तो इलेक्ट्रॉनों की गतिज ऊर्जा बढ़ जाएगी। ऊर्जा में यह वृद्धि "इलेक्ट्रॉन समुद्र" में पूरे नमूने में बड़ी गति से फैल जाएगी।
धातुओं की विद्युत चालकता भी स्पष्ट हो जाती है। यदि धातु के नमूने के सिरों पर एक संभावित अंतर लागू किया जाता है, तो डेलोकाइज्ड इलेक्ट्रॉनों का बादल सकारात्मक क्षमता की दिशा में स्थानांतरित हो जाएगा: एक दिशा में चलने वाले इलेक्ट्रॉनों का यह प्रवाह एक परिचित विद्युत प्रवाह है।
धात्विक बंधन। धातु बंधन गुण। - अवधारणा और प्रकार। वर्गीकरण और श्रेणी की विशेषताएं "धातु बंधन। धातु बंधन के गुण।" 2017, 2018।
पाठ का उद्देश्य
- धात्विक रासायनिक बंधन का एक विचार दें।
- धातु बंधन के गठन को लिखना सीखें।
- धातुओं के भौतिक गुणों से परिचित हों।
- प्रजातियों को स्पष्ट रूप से अलग करना सीखें रासायनिक बन्ध .
पाठ मकसद
- जानें कि वे एक दूसरे के साथ कैसे बातचीत करते हैं धातु परमाणु
- निर्धारित करें कि धातु बंधन इससे बनने वाले पदार्थों के गुणों को कैसे प्रभावित करता है
मूल शर्तें:
- वैद्युतीयऋणात्मकता - एक परमाणु का रासायनिक गुण, जो एक अणु में एक परमाणु की सामान्य इलेक्ट्रॉन जोड़े को अपनी ओर आकर्षित करने की क्षमता की मात्रात्मक विशेषता है।
- रसायनिक बंध - परमाणुओं के परस्पर क्रिया की घटना, परस्पर क्रिया करने वाले परमाणुओं के इलेक्ट्रॉन बादलों के अतिच्छादन के कारण।
- धातु बंधन - यह परमाणुओं और आयनों के बीच धातुओं में एक बंधन है, जो इलेक्ट्रॉनों के समाजीकरण के कारण बनता है।
- सहसंयोजक बंधन - एक रासायनिक बंधन, जो वैलेंस इलेक्ट्रॉनों की एक जोड़ी को ओवरलैप करके बनता है। बंधन प्रदान करने वाले इलेक्ट्रॉनों को एक सामान्य इलेक्ट्रॉन जोड़ी कहा जाता है। 2 प्रकार हैं: ध्रुवीय और गैर-ध्रुवीय।
- आयोनिक बंध - एक रासायनिक बंधन जो गैर-धातुओं के परमाणुओं के बीच बनता है, जिसमें एक सामान्य इलेक्ट्रॉन जोड़ी अधिक विद्युतीयता वाले परमाणु में जाती है। नतीजतन, परमाणु विपरीत रूप से चार्ज किए गए निकायों की तरह आकर्षित होते हैं।
- हाइड्रोजन बंध
- एक इलेक्ट्रोनगेटिव परमाणु और एक हाइड्रोजन परमाणु एच के बीच एक रासायनिक बंधन, सहसंयोजक रूप से दूसरे इलेक्ट्रोनगेटिव परमाणु से जुड़ा होता है। एन, ओ, या एफ इलेक्ट्रोनगेटिव परमाणुओं के रूप में कार्य कर सकते हैं। हाइड्रोजन बांड इंटरमॉलिक्युलर या इंट्रामोल्युलर हो सकते हैं।
कक्षाओं के दौरान
धात्विक रासायनिक बंधन
उन वस्तुओं की पहचान करें जो गलत "कतार" में हैं। क्यों?
सीए फे पी के अल एमजी ना
तालिका से कौन से तत्व मेंडलीवधातु कहलाते हैं?
आज हम यह पता लगाएंगे कि धातुओं में क्या गुण होते हैं और वे धातु आयनों के बीच बनने वाले बंधन पर कैसे निर्भर करते हैं।
आरंभ करने के लिए, आइए आवर्त प्रणाली में धातुओं के स्थान को याद रखें?
धातु, जैसा कि हम सभी जानते हैं, आमतौर पर पृथक परमाणुओं के रूप में नहीं, बल्कि एक गांठ, पिंड या धातु उत्पाद के रूप में मौजूद होते हैं। आइए जानें कि धातु के परमाणुओं को एक अभिन्न आयतन में कौन एकत्रित करता है।
उदाहरण में, हम सोने का एक टुकड़ा देखते हैं। और वैसे तो सोना एक अनोखी धातु है। शुद्ध सोने से फोर्जिंग की मदद से आप 0.002 मिमी मोटी पन्नी बना सकते हैं! पन्नी की इतनी पतली शीट लगभग पारदर्शी होती है और लुमेन में हरे रंग की टिंट होती है। नतीजतन, एक माचिस के आकार के सोने के पिंड से, आप एक पतली पन्नी प्राप्त कर सकते हैं जो टेनिस कोर्ट के क्षेत्र को कवर करेगी।
रासायनिक रूप से, सभी धातुओं को वैलेंस इलेक्ट्रॉनों को छोड़ने में आसानी होती है, और इसके परिणामस्वरूप, सकारात्मक रूप से चार्ज किए गए आयनों का निर्माण होता है और केवल सकारात्मक ऑक्सीकरण प्रदर्शित करता है। इसीलिए मुक्त धातुएं अपचायक हैं। धातु परमाणुओं की एक सामान्य विशेषता अधातुओं के सापेक्ष उनका बड़ा आकार है। बाहरी इलेक्ट्रॉन नाभिक से बड़ी दूरी पर स्थित होते हैं और इसलिए इससे कमजोर रूप से बंधे होते हैं, इसलिए वे आसानी से अलग हो जाते हैं।
बाहरी स्तर पर बड़ी संख्या में धातुओं के परमाणुओं में इलेक्ट्रॉनों की एक छोटी संख्या होती है - 1,2,3। ये इलेक्ट्रॉन आसानी से फट जाते हैं और धातु के परमाणु आयन बन जाते हैं।
е0 - n पुरुष +
धातु परमाणु - इलेक्ट्रॉन बाहरी कक्षाएँ धातु आयन
इस प्रकार, अलग किए गए इलेक्ट्रॉन एक आयन से दूसरे में जा सकते हैं, अर्थात, वे मुक्त हो जाते हैं, और, जैसा कि वे थे, उन्हें एक पूरे में जोड़ते हैं। इसलिए, यह पता चला है कि सभी अलग किए गए इलेक्ट्रॉन सामान्य हैं, क्योंकि यह असंभव है यह समझने के लिए कि कौन सा इलेक्ट्रॉन किस धातु परमाणु से संबंधित है।
इलेक्ट्रॉनों को धनायनों के साथ जोड़ा जा सकता है, फिर परमाणु अस्थायी रूप से बनते हैं, जिससे इलेक्ट्रॉनों को फिर सूँघने से दूर कर दिया जाता है। यह प्रक्रिया निरंतर और बिना किसी रुकावट के चलती रहती है। यह पता चला है कि अधिकांश धातु परमाणु लगातार आयनों में परिवर्तित होते हैं और इसके विपरीत। इस मामले में, सामान्य इलेक्ट्रॉनों की एक छोटी संख्या बड़ी संख्या में धातु परमाणुओं और आयनों को बांधती है। लेकिन यह महत्वपूर्ण है कि किसी धातु में इलेक्ट्रॉनों की संख्या धनात्मक आयनों के कुल आवेश के बराबर हो, अर्थात यह पता चलता है कि धातु समग्र रूप से विद्युत रूप से तटस्थ रहती है।
इस प्रक्रिया को एक मॉडल के रूप में प्रस्तुत किया जाता है - धातु आयन इलेक्ट्रॉनों के एक बादल में होते हैं। ऐसे इलेक्ट्रॉन बादल को "इलेक्ट्रॉन गैस" कहा जाता है।
उदाहरण के लिए, इस तस्वीर में हम देखते हैं कि धातु के क्रिस्टल जाली के अंदर स्थिर आयनों के बीच इलेक्ट्रॉन कैसे चलते हैं। 
चावल। 2. इलेक्ट्रॉनिक आंदोलन
इलेक्ट्रॉन गैस क्या है और विभिन्न धातुओं की रासायनिक प्रतिक्रियाओं में यह कैसे व्यवहार करती है, इसे बेहतर ढंग से समझने के लिए, हम एक दिलचस्प वीडियो देखेंगे। (इस वीडियो में सोने को विशेष रूप से एक रंग के रूप में संदर्भित किया गया है!)
अब हम परिभाषा लिख सकते हैं: एक धातु बंधन परमाणुओं और आयनों के बीच धातुओं में एक बंधन है, जो इलेक्ट्रॉनों के समाजीकरण द्वारा बनता है।
आइए उन सभी प्रकार के कनेक्शनों की तुलना करें जिन्हें हम जानते हैं और उन्हें बेहतर ढंग से अलग करने के लिए उन्हें ठीक करते हैं, इसके लिए हम वीडियो देखेंगे।
धात्विक बंधन न केवल शुद्ध धातुओं में होता है, बल्कि विभिन्न धातुओं के मिश्रण, एकत्रीकरण के विभिन्न राज्यों में मिश्र धातुओं की भी विशेषता है।
धातु बंधन महत्वपूर्ण है और धातुओं के मूल गुणों को निर्धारित करता है
- विद्युत चालकता - धातु के आयतन में इलेक्ट्रॉनों की अव्यवस्थित गति। लेकिन एक छोटे से संभावित अंतर के साथ, ताकि इलेक्ट्रॉन एक व्यवस्थित तरीके से आगे बढ़ सकें। सबसे अच्छी चालकता वाली धातुएँ Ag, Cu, Au, Al हैं।
- प्लास्टिसिटी
धातु की परतों के बीच के बंधन बहुत महत्वपूर्ण नहीं हैं, यह आपको परतों को लोड के तहत स्थानांतरित करने की अनुमति देता है (धातु को बिना तोड़े विकृत करें)। सबसे अच्छा विकृत धातु (नरम) Au, Ag, Cu।
- धातु आभा
इलेक्ट्रॉन गैस लगभग सभी प्रकाश किरणों को परावर्तित कर देती है। यही कारण है कि शुद्ध धातुएँ इतनी अधिक चमकती हैं और प्रायः धूसर या सफेद रंग की होती हैं। धातुएँ जो सबसे अच्छे परावर्तक हैं Ag, Cu, Al, Pd, Hg
होम वर्क
अभ्यास 1
उन पदार्थों के सूत्र चुनें जिनमें
ए) सहसंयोजक ध्रुवीय बंधन: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
बी) आयनिक बंधन के साथ: एचसीएल, केबीआर, पी 4, एच 2 एस, ना 2 ओ, सीओ 2, सीएएस।
व्यायाम २
अनावश्यक को पार करें:
क) CuCl2, Al, MgS
बी) एन 2, एचसीएल, ओ 2
सी) सीए, सीओ 2, फे
घ) MgCl2, NH3, H2
धात्विक सोडियम, धात्विक लिथियम और अन्य क्षार धातुएँ लौ का रंग बदल देती हैं। लिथियम धातु और उसके लवण आग को लाल रंग देते हैं, धात्विक सोडियम और सोडियम लवण - पीला, धात्विक पोटेशियम और उसके लवण - बैंगनी, और रूबिडियम और सीज़ियम - भी बैंगनी, लेकिन हल्का।
चावल। 4. धातु लिथियम का एक टुकड़ा 
चावल। 5. लौ को धातुओं से रंगना
लिथियम (ली)। लिथियम धातु, सोडियम धातु की तरह, क्षार धातुओं से संबंधित है। दोनों पानी में घुल जाते हैं। सोडियम पानी में घुल जाता है और कास्टिक सोडा बनाता है, एक बहुत मजबूत एसिड। जब क्षार धातुएं पानी में घुल जाती हैं, तो बहुत अधिक ऊष्मा और गैस (हाइड्रोजन) निकलती है। यह सलाह दी जाती है कि ऐसी धातुओं को अपने हाथों से न छुएं, क्योंकि आप जल सकते हैं।
ग्रन्थसूची
1. "धातु रासायनिक बंधन" विषय पर पाठ, रसायन विज्ञान के शिक्षक तुखता वेलेंटीना अनातोल्येवना एमओयू "एसेनोविचस्काया माध्यमिक विद्यालय"
2. F. A. Derkach "रसायन विज्ञान" - वैज्ञानिक और कार्यप्रणाली मैनुअल। - कीव, 2008।
3. LB Tsvetkova "इनऑर्गेनिक केमिस्ट्री" - दूसरा संस्करण, संशोधित और बड़ा। - ल्वीव, 2006।
4. वी। वी। मालिनोव्स्की, पी। जी। नागोर्न "इनऑर्गेनिक केमिस्ट्री" - कीव, 2009।
5. ग्लिंका एन.एल. सामान्य रसायन शास्त्र। - २७वां संस्करण/अंडर. ईडी। वी.ए. राबिनोविच। - एल।: रसायन विज्ञान, 2008।-- 704 पीपी।
ए.वी. लिस्न्याक द्वारा संपादित और भेजा गया
सबक पर काम किया:
तुखता वी.ए.
लिस्न्याक ए.वी.
आप आधुनिक शिक्षा के बारे में सवाल उठा सकते हैं, एक विचार व्यक्त कर सकते हैं या एक जरूरी समस्या का समाधान कर सकते हैं शैक्षिक मंचजहां ताजा विचार और कार्रवाई की एक शैक्षिक परिषद अंतरराष्ट्रीय स्तर पर मिलती है। बनाने से ब्लॉग, रसायन शास्त्र ग्रेड 8