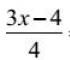k2s 염의 가수분해에 대한 방정식을 작성하십시오. 염 가수분해의 이온 분자 및 분자 방정식의 편집
1.4. 염가수분해
가수 분해는 염 이온과 물의 상호 작용을 교환하여 해리가 잘 안되는 물질을 형성하고 반응의 변화를 동반하는 과정입니다 ( pH) 환경.
염 가수 분해의 본질은 이온 중 하나가 잘 해리되거나 난용성 물질의 형성과 결합하여 물 해리 평형이 이동한다는 것입니다. 가수분해의 결과로 약산과 염기의 분자, 산성 염의 음이온 또는 염기성 염의 양이온이 형성될 수 있습니다. 대부분의 경우 가수분해는 가역적인 과정입니다. 온도와 희석이 증가함에 따라 가수분해가 향상됩니다. 가수분해는 염을 형성하는 산과 염기의 강도에 따라 다르게 진행됩니다. 염의 가수분해의 다양한 경우를 살펴보자.
a) 소금이 형성된다 약산그리고 강력한 기반( 케이 2 에스).
물에 용해되면 K 2 S가 해리됩니다.
K 2 S2K + + S 2- .
가수분해 방정식을 작성할 때 우선 물 이온을 저 해리 화합물로 결합하는 염 이온을 결정해야 합니다. 가수분해를 위한 이온.
에 이 경우 S 2- 이온은 H + 양이온과 결합하여 HS 이온 -
S 2– + H 2 OHS – + OH –
분자 형태의 가수분해 방정식
K 2 S + H 2 OKHS + KOH.
실제로, 염의 가수분해는 주로 산성 염(이 경우 KHS)의 형성과 함께 첫 번째 단계로 제한됩니다. 따라서, 강염기와 약산(K 2 S와 같은)에 의해 형성된 염의 가수분해는 염의 음이온에서 진행된다. 과량의 OH 이온 - 용액에서 원인 알칼리 반응용액 중 배지(pH>7).
비)씨Ol은 약염기와 강산(CuCl2, 알 2 ( 그래서 4 ) 3).
물에 용해되면 CuCl 2가 해리됩니다.
CuCl 2 Cu 2+ + 2Cl -
Cu 2+ 이온은 OH - 이온과 결합하여 수산화 이온 CuOH + 를 형성합니다. 염가수분해는 첫 번째 단계로 제한되며 Cu(OH) 2 분자의 형성이 일어나지 않습니다. 이온 분자 방정식은
Cu 2+ + HOHCuOH + + H + .
이 경우 가수분해 생성물은 염기성 염과 산이다. 분자 형태의 가수분해 방정식은 다음과 같이 작성됩니다.
CuCl 2 + H 2 OCuOHCl + HCl.
따라서 약염기와 강산(이 경우 CuCl 2 )에 의해 형성된 염의 가수분해는 염 양이온에서 진행된다. 용액에서 과량의 H + 이온은 용액에서 매질의 산성 반응을 일으킴(pH<7).
물에 녹였을 때 Al 2 (SO 4 ) 3 해리
Al 2 (SO 4 ) 3 2 Al 3+ + 3 SO 4 2-.
이 경우 이온알 3+ OH - 이온과 결합하여 수산화 이온을 형성 AlOH 2+ . 염가수분해는 첫 번째 단계로 제한되며 분자의 형성알(OH ) 3은 발생하지 않습니다. 이온 분자 방정식은
Al 3+ + H 2 O AlOH 2+ + H + .
전기분해 생성물은 염기성 염과 산이다.
분자 형태의 가수분해 방정식은 다음과 같이 작성됩니다.
Al 2 (SO 4) 3 +2 H 2 O 2AlOHSO 4 + H 2 SO 4.
c) 염은 약산과 약염기(CH 3 COONH 4)에 의해 형성된다.
CH 3 COO - + NH 4 + + H 2 O CH 3 COOH + NH 4 OH.
이 경우 약간 해리된 두 개의 화합물이 형성되고 용액의 pH는 산과 염기의 상대적 강도에 따라 달라집니다. 가수분해 생성물이 용액에서 제거될 수 있으면 가수분해가 완료될 때까지 진행됩니다. 예를 들어
Al 2 S 3 + 6 H 2 O \u003d 2Al (OH) 3↓ + 3H 2 S .
비가역적 가수분해의 다른 경우도 가능하며, 예측하기 어렵지 않습니다. 공정의 비가역성을 위해 가수분해 생성물 중 하나 이상이 반응 영역을 떠나는 것이 필요하기 때문입니다.
G) 강산과 강염기에서 형성된 염( 염화나트륨, 케이 2 그래서 4 , RbBr등) 가수 분해를 겪지 않고, 왜냐하면 유일한 저 해리 화합물은 H 2 O(рН=7)입니다. 이러한 염의 용액은 중성입니다. 예를 들어
NaCl + H2O NaOH + HCl
나 + + Cl - + H 2 O 나 + + OH – + H + + Cl –
H 2 O H + + OH -.
가역적 가수분해 반응은 완전히 르 샤틀리에의 원리를 따릅니다. 그래서 염 가수분해가 향상될 수 있습니다. (심지어 되돌릴 수 없게 만들기까지) 다음과 같은 방법으로:
1) 물을 첨가한다.
2) 용액을 가열하여 물의 흡열 해리를 증가시키며, 이는 염의 가수분해에 필요한 H + 및 OH 이온의 수가 증가함을 의미합니다.
3) 가수분해 생성물 중 하나를 난용성 화합물로 결합하거나 생성물 중 하나를 기체상으로 제거한다. 예: 시안화암모늄의 가수분해 NH4CN 암모니아의 형성과 함께 암모니아 수화물의 분해에 의해 크게 향상됩니다. NH 3 및 물:
NH 4 + + CN - + H 2 O NH 3 + H 2 O + HCN.
가수분해를 억제할 수 있다 , 다음과 같이 진행합니다.
1) 용질의 농도를 증가시킨다.
2) 용액을 식힌다(가수분해를 약화시키려면 염 용액을 농축하여 저온에서 보관해야 함);
3) 가수분해 생성물 중 하나를 용액에 도입한다. 예를 들어, 매체가 가수분해의 결과로 산성인 경우 용액을 산성화하거나 알칼리성인 경우 알칼리화합니다.
가수분해의 상호 강화 평형이 다른 용기에 설정되어 있다고 가정합시다.
CO 3 2– + H 2 O HCO 3 – + OH –
Al 3+ + H 2 O AlOH 2+ + H +
두 염 모두 약간 가수분해되지만 용액이 혼합되면 H + 및 OH - 이온의 결합이 발생합니다. 르 샤틀리에 원리에 따라 양쪽 평형이 오른쪽으로 이동하고 가수분해가 강화되어 완전히 진행됩니다.
2 AlCl 3 + 3 Na 2 CO 3 + 3 H 2 O \u003d 2 Al (OH) 3↓ + 3 CO 2 + 6 NaCl.
그것은이라고 가수 분해의 상호 향상 . 따라서 하나는 양이온에 의해 다른 하나는 음이온에 의해 가수분해되는 염 용액을 혼합하면 가수분해가 강화되어 완전히 진행됩니다.
O.A. N.S. 나필코바 도조르체바
작업 201.
K의 용액을 혼합할 때 발생하는 가수분해의 이온-분자 및 분자 방정식을 작성하십시오. 2 S 및 CrCl 3 . 취한 각 염은 해당 염기와 산의 형성과 함께 끝까지 비가역적으로 가수분해됩니다.
결정:
K 2 S - 강염기와 약산의 염은 음이온에 의해 가수분해되고, CrCl 3 - 약염기와 강산의 염은 양이온에 의해 가수분해된다.
K 2 S ⇔ 2K + + S 2- ; CrCl3 ⇔ Cr3+ + 3Cl - ;
a) S 2- + H 2 O ⇔ HS - + OH -;
b) Cr 3+ + H 2 O ⇔ CrOH 2+ + H +.
이러한 염의 용액이 동일한 용기에 있으면 H + 및 OH- 이온이 서로 결합하여 약한 전해질 H 2 O의 분자를 형성하기 때문에 각각의 가수 분해가 상호 향상됩니다. H + + OH - ⇔ H 2 O). 추가 양의 물이 형성되면 두 염의 가수 분해 평형이 오른쪽으로 이동하고 각 염의 가수 분해는 침전물과 가스가 형성되면서 끝납니다.
3S 2- + 2Cr 3+ + 6H 2 O ⇔ 2Cr(OH) 3 ↓ + 3H 2 S (이온성 분자 형태);
3K 2 S + 2CrCl 3 + 6H 2 O ⇔ 2Cr(OH) 3 ↓ + 3H 2 S + 6KCl (분자 형태).
과제 202.
하기 물질을 FeCl 3 용액에 첨가하였다: a) HCl; b) KOH; c) ZnCl 2 ; d) Na 2 CO 3. 어떤 경우에 염화철(III)의 가수분해가 증가합니까? 왜요? 해당 염의 가수분해에 대한 이온-분자 방정식을 작성하십시오.
결정:
a) 염 FeCl3는 양이온에 의해 가수분해되고, HCl은 수용액에서 해리된다:
FeCl 3 ⇔ Fe 3+ + 3Cl -;
HCl ⇔ H + + Cl -
이러한 물질의 용액이 동일한 용기에 있으면 과량의 수소 이온 H +가 형성되고 가수 분해 평형이 왼쪽으로 이동하기 때문에 FeCl 3 염의 가수 분해가 억제됩니다.
b) FeCl 3 염은 양이온에 의해 가수분해되고 KOH는 수용액에서 해리되어 OH를 형성합니다.
FeCl 3 ⇔ Fe 3+ + 3Cl -;
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +;
KOH ⇔ K + + OH -
이러한 물질의 용액이 동일한 용기에 있으면 FeCl3 염의 가수 분해와 KOH의 해리가 발생합니다. H + 및 OH- 이온이 서로 결합하여 약한 전해질 H 2 O (H + + OH - ⇔ H 2 O). 이 경우 FeCl 3 염의 가수분해 평형과 KOH의 해리가 오른쪽으로 이동하고 Fe(OH) 3 의 침전물이 형성되면서 염의 가수분해와 염기의 해리가 끝까지 간다. . 실제로 FeCl3와 KOH가 혼합되면 교환반응이 일어난다. 이온-
Fe 3+ + 3OH - ⇔ Fe(OH) 3 ↓;
분자 과정 방정식:
FeCl 3 + 3KOH ⇔ Fr(OH) 3 ↓ + 3KCl.
c) FeCl 3 염과 ZnCl 2 염은 양이온에 의해 가수분해됩니다.
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +;
Zn 2+ + H 2 O ⇔ ZnOH + + H +
이러한 염의 용액이 같은 용기에 있으면 과량의 H + 이온이 가수분해 평형을 왼쪽으로 이동하여 수소 이온 농도 H +.
d) FeCl 3 염은 양이온에 의해 가수분해되고 Na 2 CO 3 염은 음이온에 의해 가수분해됩니다.
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +;
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -
이러한 염의 용액이 동일한 용기에 있으면 H + 및 OH - 이온이 서로 결합하여 약한 전해질 H 2 O의 분자를 형성하기 때문에 각각의 가수 분해가 상호 강화됩니다. H + + OH - ⇔ H 2 O). 추가 양의 물이 형성되면 두 염의 가수 분해 평형이 오른쪽으로 이동하고 각 염의 가수 분해는 약한 전해질 H 2 인 Fe (OH) 3 ↓의 침전물 형성으로 끝납니다. 이산화탄소 3:
2Fe 3+ + 3СO 3 2- + 3H 2 O ⇔ 2Fe(OH) 3 ↓ + 3CO 2 (이온-분자 형태);
2FeCl 3 + 3Na 2 CO 3 + 3H 2 O ⇔ 2Fe(OH) 3 ↓ + 3CO 2 + 6NaCl (분자 형태).
과제 203.
Al 2 (SO4) 3, K 2 S, Pb (NO 3) 2, KCl 중 어떤 염이 가수분해됩니까? 해당 염의 가수분해에 대한 이온-분자 및 분자 방정식을 작성하십시오. pH 값은 무엇입니까 (> 7 <)
이 소금의 해결책이 있습니까?
결정:
a) Al2(SO4)3은 약염기와 강산의 염이다. 이 경우 Al 3+ 양이온은 OH - 물 이온과 결합하여 염기성 염 AlOH 2+ 의 양이온을 형성합니다. Al(OH) 2+ 와 Al(OH) 3 의 형성은 일어나지 않습니다. 왜냐하면 AlOH 2+ 이온은 Al(OH) 2+ 이온과 Al(OH) 3 분자보다 훨씬 더 어렵게 해리되기 때문입니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Al2(SO4)3⇔ Al3+ + 3SO42-;
또는 분자 형태:
Al 2 (SO 4 ) 3 + 2H 2 O ⇔ 2AlOHSO 4 + H 2 SO 4
과량의 수소 이온이 용액에 나타나 Al2(SO4)3 용액에 산성 환경을 제공하고, pH< 7 .
b) K 2 S - 강한 염 일산 염기 KOH와 약한 다염기산 H 2 S. 이 경우, S2- 음이온은 물의 수소 이온 H +와 결합하여 산염 HS-의 음이온을 형성합니다. HS- 이온은 H2S 분자보다 훨씬 더 어렵게 해리되기 때문에 H2S의 형성은 일어나지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
K 2 S ⇔ 2K + + S 2-;
S 2- + H 2 O ⇔ H S- + OH -
또는 분자 형태:
K 2 S + 2H 2 O ⇔ KHS + KOH
과량의 수산화물 이온이 용액에 나타나 K 2 S 용액에 알칼리성 환경을 제공하고, pH > 7.
c) Pb(NO 3 ) 2 는 약염기와 강산의 염이다. 이 경우 Pb 2+ 양이온은 OH-물 이온과 결합하여 염기성염 PbOH + 의 양이온을 형성합니다. PbOH + 이온이 Pb(OH) 2 분자보다 훨씬 더 어렵게 해리되기 때문에 Pb(OH) 2 의 형성은 일어나지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Pb2+ + H2O ⇔ PbOH + + H +
또는 분자 형태:
< 7.
d) KCl - 이온 K +, Cl -는 물 이온 H + 및 OH -에 결합되지 않기 때문에 강염기와 강산의 염은 가수분해를 겪지 않습니다. 이온 K + , Cl - , H + 및 OH -는 용액에 남아 있습니다. 염 용액에는 동일한 양의 H + 및 OH - 이온이 있으므로 용액은 중성 환경을 가지며, pH = 0.
과제 204.
FeCl 3 및 Na 2 CO 3 용액을 혼합할 때, 취한 각각의 염은 상응하는 염기 및 산의 형성과 함께 끝까지 비가역적으로 가수분해된다. 이 결합 가수분해를 이온-분자 및 분자 방정식으로 표현합니다.
결정:
FeCl3는 약염기와 강산의 염이다. 이 경우 Fe 3+ 양이온은 OH - 물 이온과 결합하여 염기성 FeOH 2+ 염의 양이온을 형성합니다. FeOH 2+ 이온은 Fe(OH) 2+ 이온 및 Fe(OH) 3 분자보다 훨씬 더 어렵게 해리되기 때문에 Fe(OH)2+ 및 Fe(OH)3의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
FeC l3 ⇔ Fe 3+ + 3Cl -
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +
Na 2 CO 3 는 강염기와 약산의 염입니다. 이 경우 CO 3 2- 음이온은 물의 수소 이온 H + 와 결합하여 산염 HCO 3 - 의 음이온을 형성합니다. HCO 3 - 이온이 H 2 CO 3 분자보다 훨씬 더 어렵게 해리되기 때문에 H 2 CO 3의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
2Fe 3+ + 3CO 3 2- + 3H 2 O 2Fe(OH) 3 ⇔ + 3CO 2 (이온성 분자 형태);
2FeCl 3 + 3Na 2 CO 3 + 3H 2 O ⇔ 2Fe(OH) 3 + + 3CO 2 + 6NaCl.
과제 205.
하기 물질을 Na 2 CO 3 용액에 첨가하였다: a) HCl; b) NaOH; c) Cu(NO3)2; d) K 2 S. 어떤 경우에 탄산나트륨의 가수분해가 증가합니까? 왜요? 해당 염의 가수분해에 대한 이온-분자 방정식을 작성하십시오.
결정:
a) 염 Na 2 CO 3 는 음이온에 의해 가수분해되고 HCl은 수용액에서 해리됩니다.
Na 2 CO 3 ⇔ 2Na + + CO 3 2-;
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -;
HCl ⇔ H + + Cl -
이러한 물질의 용액이 동일한 용기에 있으면 H + 및 OH - 이온이 서로 결합하여 약한 전해질 H 2 O 분자를 형성하기 때문에 각각의 가수 분해가 상호 강화됩니다. H + + OH - ⇔ H 2 O). 이 경우, Na 2 CO 3 염의 가수분해 평형과 HCl의 해리는 오른쪽으로 이동하고, 염의 가수분해와 산의 해리는 기체 이산화탄소의 형성과 함께 끝까지 간다. 공정의 이온 분자 방정식:
CO 3 2- + 2H + ⇔ CO 2 + H 2 O
분자 과정 방정식:
Na 2 CO 3 + 2HCl ⇔ 2NaCl + CO 2 + H 2 O
b) 염 Na 2 CO 3 는 음이온에 의해 가수분해되고 NaOH는 수용액에서 해리됩니다.
NaOH ⇔ Na + + OH - .
이러한 물질의 용액이 혼합되면 과량의 OH 이온이 형성되어 Na 2 CO 3 가수분해의 평형이 왼쪽으로 이동하고 염 가수분해가 억제됩니다.
c) 염 Na 2 CO 3 는 음이온에 의해 가수분해되고 염 Cu (NO 3) 2 - 양이온에 의해:
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -;
Сu 2+ + H 2 O ⇔ CuOH + + H +.
이러한 염의 용액이 동일한 용기에 있으면 H + 및 OH - 이온이 서로 결합하여 약한 전해질 H 2 O의 분자를 형성하기 때문에 각각의 가수 분해가 상호 강화됩니다. H + + OH - ⇔ H 2 O). 추가 양의 물이 형성되면 두 염의 가수 분해 평형이 오른쪽으로 이동하고 각 염의 가수 분해는 침전물과 가스가 형성되면서 끝납니다.
Cu 2+ + CO 3 2- + H 2 O ⇔ Cu(OH) 2 ↓ + CO 2 (이온성 분자 형태);
Cu(NO 3) 2 + Na 2 CO 3 + H 2 O ⇔ Cu(OH) 2 ↓ + CO 2 + 2NaNO 3 (분자 형태).
d) Na 2 CO 3 및 K 2 S는 강염기 및 약산의 염이므로 둘 다 음이온에 의해 가수분해됩니다.
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -;
S 2- + H 2 O ⇔ HS - + OH -.
이러한 염의 용액이 동일한 용기에 있으면 Le Chatelier의 원리에 따라 과량의 OH - 이온이 두 염의 가수 분해 평형을 다음으로 이동시키기 때문에 각각의 가수 분해가 상호 억제됩니다. 왼쪽, OH - 이온의 농도가 감소하는 방향, 즉 두 염의 가수분해가 억제됩니다.
작업 206.
pH 값은 무엇입니까(> 7<) имеют растворы солей Na 2 S, АlСl 3 , NiSO 4 ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
결정:
a) Na 2 S - 강한 염 일산 염기 NaOH와 약한 다염기산 H 2 S. 이 경우 음이온 S 2-는 물의 수소 이온 H +와 결합하여 산염 HS-의 음이온을 형성합니다. HS - 이온은 H 2 S 분자보다 훨씬 더 어렵게 해리되기 때문에 H 2 S의 형성은 일어나지 않으며 정상적인 조건에서는 가수분해가 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Na 2 S ⇔ 2Na + + S 2-;
S2- + H2O ⇔ H2S - + OH -
또는 분자 형태:
Na 2 S + 2H 2 O ⇔ NaHS + KOH
과량의 수산화 이온이 용액에 나타나 Na2S 용액에 pH > 7의 알칼리성 환경을 제공합니다.
b) AlCl 3 는 약염기와 강산의 염이다. 이 경우 Al3+ 양이온은 OH-물 이온과 결합하여 염기성 염 AlOH2+의 양이온을 형성합니다. Al(OH) 2+ 및 Al(OH) 3 의 형성은 일어나지 않습니다. 왜냐하면 AlOH 2+ 이온은 Al(OH) 2+ 이온과 Al(OH) 3 분자보다 훨씬 더 어렵게 해리되기 때문입니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
AlCl 3 ⇔ Al 3+ + 3Cl - ;
Al 3+ + H 2 O ⇔ AlOH 2+ + H +
또는 분자 형태:
AlCl 3 + H 2 O ⇔ 2AlOHCl 2 + HCl
과량의 수소 이온이 용액에 나타나 Al2(SO4)3 용액에 산성 환경, pH를 제공합니다.< 7.
c) NiSO4는 약한 다산 염기 Ni(OH)2와 강한 이염기산 H2SO4의 염입니다. 이 경우 Ni2+ 양이온은 OH-물 이온과 결합하여 염기성 NiOH+ 염의 양이온을 형성합니다. NiOH+ 이온이 Ni(OH)2 분자보다 훨씬 더 어렵게 해리되기 때문에 Ni(OH)2의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Ni(NO 3 ) 2 ⇔ Ni 2+ + 2NO 3 - ;
Ni 2+ + H 2 O ⇔ NiOH + + H +
또는 분자 형태:
2NiSO 4 + 2H 2 O (NiOH) 2 SO 4 + H 2 SO 4
과량의 수소 이온이 용액에 나타나 NiSO 4 용액에 산성 환경, pH를 제공합니다.< 7.
과제 207.
염 Pb(NO 3 ) 2 , Na 2 CO 3 , Fe 2 (SO 4) 3 의 가수분해에 대한 이온-분자 및 분자 방정식을 작성하십시오. pH 값은 무엇입니까(> 7<) имеют растворы этих солей?
결정:
a) Pb (NO 3) 2 - 약염기와 강산의 염. 이 경우 Pb 2+ 양이온은 OH - 물 이온과 결합하여 염기성 염 PbOH + 의 양이온을 형성합니다. PbOH + 이온이 Pb(OH) 2 분자보다 훨씬 더 어렵게 해리되기 때문에 Pb(OH) 2 의 형성은 일어나지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Pb(NO 3) 2 ⇔ Pb 2+ + 2NO 3 - ;
Pb2+ + H2O ⇔ PbOH + + H +
또는 분자 형태:
Pb(NO 3) 2 + H 2 O ⇔ PbOHNO 3 + HNO 3
과량의 수소 이온이 용액에 나타나 Pb (NO 3) 2 용액에 산성 환경, pH를 제공합니다.< 7.
b) Na 2 CO 3 는 강염기와 약산의 염이다. 이 경우 CO 3 2- 음이온은 물의 수소 이온 H + 와 결합하여 산염 HCO 3 - 의 음이온을 형성합니다. HCO 3 - 이온이 H 2 CO 3 분자보다 훨씬 더 어렵게 해리되기 때문에 H 2 CO 3의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Na 2 CO 3 ⇔ 2Na + + CO 3 2-;
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -
또는 분자 형태:
Na 2 CO 3 + H 2 O ⇔ CO 2 + 2NaOH
과량의 수산화 이온이 용액에 나타나 Na2CO3 용액에 pH > 7의 알칼리성 환경을 제공합니다.
c) Fe 2 (SO 4) 3 - 약염기와 강산의 염. 이 경우 Fe 3+ 양이온은 OH - 물 이온과 결합하여 염기성 FeOH 2+ 염의 양이온을 형성합니다. FeOH 2+ 이온은 Fe(OH) 2+ 이온 및 Fe(OH) 3 분자보다 훨씬 더 어렵게 해리되기 때문에 Fe(OH) 2+ 및 Fe(OH) 3의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Fe 2 (SO 4) 3 ⇔ 2Fe 3+ + 3SO 4 2 -
Fe 3+ + H 2 O ⇔ FeOH 2+ + H +
프로세스의 분자 형태:
Fe 2 (SO 4) 3 + 2H 2 O ⇔ 2FeOHSO 4 + H 2 SO 4.
과량의 수소 이온이 용액에 나타나 Fe2(SO4)3 용액에 산성 환경, pH를 제공합니다.< 7.
과제 208.
염 HCOOK, ZnSO4, Al(NO3)3의 가수분해에 대한 이온-분자 및 분자 방정식을 작성하십시오. pH 값은 무엇입니까(> 7<) имеют растворы этих солей?
결정:
a) LSOOK은 강한 소금입니다 일산 염기 KOH와 약한 일염기산 UNSD. 이 경우 음이온 HCOO -는 수소 이온 H + 물을 결합하여 약한 전해질 HCOOH를 형성합니다. 이온 분자 가수분해 방정식:
NSOOK ⇔ K + + NSOO - ;
HCOO - + H 2 O ⇔ HCOOH + OH -
또는 분자 형태:
LSOOK + H 2 O HCOOH + KOH
과량의 수산화 이온이 용액에 나타나 LSOOK 용액에 pH > 7의 알칼리성 환경을 제공합니다.
b) ZnSO4는 약한 다산염기 Zn(OH)2와 강한 다염기산의 염이다. 이 경우 Zn 2+ 양이온은 OH - 물 이온과 결합하여 주요 염 ZnOH + 의 양이온을 형성합니다. CoOH + 이온이 Zn(OH) 2 분자보다 훨씬 더 어렵게 해리되기 때문에 Zn(OH) 2 의 형성은 일어나지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
ZnSO 4 Zn 2+ + SO 4 2-;
Zn 2+ + H 2 O ZnOH + + H +
또는 분자 형태:
2ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4
과량의 수소 이온이 용액에 나타나 ZnSO 4 용액에 산성 환경, pH를 제공합니다.< 7.
c) Al (NO 3) 3 - 약한 염 폴리산 염기 Al(OH) 3 및 강함 일염기산 HNO3. 이 경우 Al 3+ 양이온은 OH - 물 이온과 결합하여 염기성 염 AlOH2+의 양이온을 형성합니다. Al(OH) 2+ 와 Al(OH) 3 의 형성은 일어나지 않습니다. 왜냐하면 AlOH 2+ 이온은 Al(OH) 2+ 이온과 Al(OH) 3 분자보다 훨씬 더 어렵게 해리되기 때문입니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Al(NO3) 3 ⇔ Cr 3+ + 3NO 3 -
Al 3+ + H 2 O ⇔ AlOH 2+ + H +
Al(NO 3 ) 3 + H 2 O ⇔ AlOH(NO 3) 2 + HNO 3
< 7.
과제 209.
pH 값은 무엇입니까(> 7<) имеют растворы солей Na 3 PO 4 , K 2 S, CuSO 4 ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
결정:
a) 오르토인산나트륨 Na 3 PO 4 는 약한 다염기산 H 3 PO 4 와 강한 단일 산 염기의 염입니다. 이 경우 음이온 PO 4 3-는 수소 이온 H + 물과 결합하여 산염 HPO 4 2-의 음이온을 형성합니다. H 2 RO 4 - 및 H 3 RO 4 형성은 HPO 4 2 - 이온이 H 2 RO 4 - 이온 및 H 3 RO 4 분자보다 훨씬 더 어렵게 해리되기 때문에 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Na 3 PO 4 ⇔ 3Na + + PO 4 3-;
RO 4 3- + H 2 O ⇔ HRO 4 2- + OH -
또는 분자 형태:
Na 3 PO 4 + H 2 O ⇔ Na 2 HPO 4 + NaOH
과량의 수산화 이온이 용액에 나타나 Na 3 PO 4 용액에 pH> 7의 알칼리성 환경을 제공합니다.
b) K2S는 강일산염기 KOH와 약다염기산 H2S의 염이다. 이 경우 S2-음이온은 물의 수소이온 H+와 결합하여 산염 HS-의 음이온을 형성한다. HS - 이온은 H 2 S 분자보다 훨씬 더 어렵게 해리되기 때문에 H 2 S의 형성은 일어나지 않으며 정상적인 조건에서는 가수분해가 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
K 2 S ⇔ 2K + + S 2-;
S2- + H2O ⇔ H2S - + OH -
또는 분자 형태:
K2S + 2H 2 O ⇔ KNS + KOH
과량의 수산화 이온이 용액에 나타나 K2S 용액에 pH > 7의 알칼리성 환경을 제공합니다.
c) CuSO 4 는 약염기와 강산의 염이다. 이 경우 Cu 2+ 양이온은 OH - 물 이온과 결합하여 주요 염 CuOH + 의 양이온을 형성합니다. CuOH + 이온은 Cu(OH) 2 분자보다 훨씬 더 어렵게 해리되기 때문에 Cu(OH) 2 의 형성은 일어나지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
CuSO 4 ⇔ Cu 2+ + SO 4 2-;
Cu2+ + H2O ⇔ CuOH + + H +
또는 분자 형태:
2CuSO 4 + 2H 2 O ⇔ (CuOH) 2 SO 4 + H 2 SO 4
과량의 수소 이온이 용액에 나타나 CuSO 4 용액에 산성 환경, pH를 제공합니다.< 7.
작업 210.
CuCl 2 , Cs 2 CO 3 , Cr(NO 3) 3 염의 가수분해에 대한 이온-분자 및 분자 방정식을 작성하십시오. pH 값은 무엇입니까(> 7<) имеют растворы этих солей?
결정:
a) CuCl 2 는 약한 다산 염기 Cu(OH) 2 와 강한 일염기산 HCl의 염이다. 이 경우 Cu 2+ 양이온은 OH - 물 이온과 결합하여 주요 염 CuOH + 의 양이온을 형성합니다. CuOH + 이온은 Cu(OH) 2 분자보다 훨씬 더 어렵게 해리되기 때문에 Cu(OH) 2 의 형성은 일어나지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
CuCl 2 ⇔ Cu 2+ + 2Cl - ;
Cu2+ + H2O ⇔ CuOH + + H +
또는 분자 형태:
CuCl 2 + H 2 O ⇔ CuOHCl + HCl
과량의 수소 이온 H +가 용액에 나타나 CuCl 2 용액에 산성 환경, pH를 제공합니다.< 7.
b) Cs 2 CO 3 는 강한 일산 염기 CsOH와 약한 이염기 산 H 2 CO 3의 염입니다. 이 경우 CO 3 2- 음이온은 물의 수소 이온 H + 와 결합하여 산염 HCO 3 - 의 음이온을 형성합니다. HCO 3 - 이온이 H 2 CO 3 분자보다 훨씬 더 어렵게 해리되기 때문에 H 2 CO 3의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 음이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Cs 2 CO 3 ⇔ 2Cs + + CO 3 2-;
CO 3 2- + H 2 O ⇔ HCO 3 - + OH -
또는 분자 형태:
Cs2CO 3 + H 2 O ⇔ CO 2 + 2CsOH
과량의 수산화 이온이 용액에 나타나 Cs2CO3 용액에 pH > 7의 알칼리성 환경을 제공합니다.
c) Cr(NO 3 ) 3 은 약한 다산 염기 Cr(OH) 3 과 강한 1염기산 HNO 3 의 염이다. 이 경우 Cr 3+ 양이온은 OH - 물 이온과 결합하여 염기성 염 CrOH 2+ 의 양이온을 형성합니다. CrOH 2+ 이온이 Cr(OH) 2 + 이온 및 Cr(OH) 3 분자보다 훨씬 더 어렵게 해리되기 때문에 Cr(OH) 2 + 및 Cr(OH) 3의 형성은 발생하지 않습니다. 정상적인 조건에서 가수분해는 첫 번째 단계에서 진행됩니다. 염은 양이온에서 가수분해된다. 이온 분자 가수분해 방정식:
Cr(NO 3) 3 ⇔ Cr 3+ + 3NO 3 -
Cr 3+ + H 2 O ⇔ CrOH 2+ + H +
분자 반응식:
Cr(NO 3 ) 3 + H 2 O ⇔ CrOH(NO 3) 2 + HNO 3
과량의 수소 이온이 용액에 나타나 Cr (NO 3) 3 용액에 산성 환경, pH를 제공합니다.< 7.
정의
황화칼륨- 강염기 - 수산화칼륨(KOH) 및 약산 - 황화수소(H 2 S)에 의해 형성된 평균 염. 공식 - K 2 S.
몰 질량 - 110g / mol. 무색의 입방정입니다.
황화칼륨의 가수분해
음이온에서 가수분해됨. 매체의 성질은 알칼리성입니다. 가수분해 방정식은 다음과 같습니다.
첫 단계:
K 2 S ↔ 2K + + S 2- (염 해리);
S 2- + HOH ↔ HS - + OH - (음이온 가수분해);
2K + + S 2- + HOH ↔ HS - + 2K + + OH - (이온 형태의 방정식);
K 2 S + H 2 O ↔ KHS + KOH (분자 방정식).
두번째 단계:
KHS ↔ K + +HS - (염해리);
HS - + HOH ↔H 2 S + OH - (음이온 가수분해);
K + + 2HS - + HOH ↔ H 2 S + K + + OH - (이온 형태의 방정식);
KHS + H 2 O ↔ H 2 S + KOH (분자 방정식).
문제 해결의 예
실시예 1
| 연습 | 황화칼륨은 칼륨과 황의 혼합물을 100-200 o C의 온도에서 가열하여 얻습니다. 11g의 칼륨과 16g의 황이 상호 작용하면 형성되는 반응 생성물의 질량은 얼마입니까? |
| 결정 | 우리는 황과 칼륨의 상호 작용에 대한 반응 방정식을 씁니다. 문제의 조건에 나타난 데이터를 이용하여 출발물질의 몰수를 구해보자. 칼륨의 몰 질량은 -39g / mol, 황 - 32g / mol입니다. υ (K) \u003d m (K) / M (K) \u003d 11/39 \u003d 0.28 mol; υ (S) \u003d m (S) / M (S) \u003d 16/32 \u003d 0.5 mol. 칼륨 결핍(υ(K)< υ(S)). Согласно уравнению υ (K 2 S) \u003d 2 × υ (K) \u003d 2 × 0.28 \u003d 0.56 mol. 황화 칼륨의 질량 찾기 (몰 질량 - 110g / mol) : m (K 2 S) \u003d υ (K 2 S) × M (K 2 S) \u003d 0.56 × 110 \u003d 61.6g. |
| 답변 | 황화칼륨의 질량은 61.6g입니다. |
염가수분해- 이것은 염 이온과 물 이온의 화학적 상호 작용으로 약한 전해질이 형성됩니다.
우리가 염을 산으로 염기를 중화시킨 산물로 생각하면 염은 4개의 그룹으로 나눌 수 있으며 각 그룹은 가수분해가 자체 방식으로 진행될 것입니다.
1). 가수분해 불가
강염기와 강산으로 이루어진 염( KBr, 염화나트륨, 나노3), 이 경우 약한 전해질이 형성되지 않기 때문에 가수분해가 일어나지 않습니다.
이러한 용액의 pH = 7. 매체의 반응은 중성으로 유지됩니다.
2). 양이온에 의한 가수분해(양이온만 물과 반응)
약염기와 강산으로 이루어진 염( FeCl2,NH4Cl, Al2(SO4)3, 마그네슘) 양이온은 가수분해를 겪는다:
FeCl 2 + HOH<=>Fe(OH)Cl + HCl
Fe 2+ + 2Cl - + H + + OH -<=>FeOH + + 2Cl - +
시간 +
가수 분해의 결과 약한 전해질, H + 이온 및 기타 이온이 형성됩니다.
용액 pH< 7 (раствор приобретает кислую реакцию).
3).음이온 가수분해(음이온만 물과 반응)
강염기와 약산으로 이루어진 염( KClO, K 2 SiO 3, Na2CO3, CH 3 쿠나)는 음이온에서 가수분해되어 약한 전해질, 수산화물 이온 OH - 및 기타 이온을 형성합니다.
K 2 SiO 3 + HOH<=>KH2SiO3 + KOH
2K + +SiO 3 2- + H + + OH -<=>HSiO3 - + 2K + + OH -
이러한 용액의 pH는 > 7입니다(용액은 알칼리성 반응을 얻음).
4). 공동 가수분해(양이온과 음이온 모두 물과 반응)
약염기와 약산으로 이루어진 염( 채널 3 쿠오 4, (NH4) 2 CO 3, Al2S3), 양이온과 음이온을 모두 가수분해합니다. 결과적으로 해리가 낮은 염기와 산이 형성됩니다. 이러한 염 용액의 pH는 산과 염기의 상대적 강도에 따라 달라집니다. 산과 염기의 강도를 나타내는 척도는 해당 시약의 해리 상수입니다.
이러한 용액의 환경 반응은 중성, 약산성 또는 약알칼리성일 수 있습니다.
Al 2 S 3 + 6H 2 O \u003d\u003e 2Al (OH) 3 ↓ + 3H 2 S
가수분해는 가역적인 과정입니다.
반응이 불용성 염기 및(또는) 휘발성 산을 생성하는 경우 가수분해는 비가역적으로 진행됩니다.
염 가수분해 방정식을 컴파일하는 알고리즘
|
추론의 과정 |
예시 |
||||
|
1. 우리는 전해질의 강도, 즉 문제의 염을 형성하는 염기와 산을 결정합니다. 기억하다! 가수분해는 항상 약한 전해질을 통해 진행되며 강한 전해질은 물에 결합되지 않은 이온 형태로 용액에 있습니다.
|
나 2 CO 3 - 탄산나트륨, 강염기에 의해 형성된 염(NaOH) 및 약산(시간 2 CO 3 ) |
||||
|
2. 수용액에서 염의 해리를 기록하고 염의 일부인 약한 전해질의 이온을 결정합니다. |
2 나 + + CO 3 2- + 시간 + 오 - ↔ 이것은 음이온 가수분해 약한 전해질에서 음이온이 소금에 존재합니다.CO 3 2- , 그것은 물 분자에 의해 약한 전해질로 결합될 것입니다 - 음이온 가수분해가 발생합니다. |
||||
|
3. 완전한 기록 이온 방정식가수분해 - 약한 전해질 이온이 물 분자에 의해 결합됨 |
2나 + + CO 3 2- + H+ OH - ↔ (HCO 3) - + 2Na + + OH - 반응 생성물에는 OH - 이온이 포함되어 있으므로 환경은 알칼리성입니다.pH>7 |
||||
|
4 . 우리는 분자 가수 분해를 씁니다. |
Na 2 CO 3 + HOH ↔ NaHCO 3 + NaOH |
실용적인 사용.
실제로 교사는 가수분해성 염(예: 아세트산납) 용액을 준비할 때 가수분해를 다루어야 합니다. 일반적인 "방법": 물을 플라스크에 붓고 소금을 붓고 흔듭니다. 흰색 침전물이 남습니다. 물을 더 넣고 흔들어도 침전물이 사라지지 않습니다. 주전자에서 추가 뜨거운 물- 침전물이 더 커 보인다... 그리고 그 이유는 용해와 동시에 염 가수분해가 일어나고 우리가 보는 흰색 침전물은 이미 가수분해 생성물인 난용성 염기성 염이기 때문입니다. 우리의 모든 추가 조치, 희석, 가열은 가수분해 정도만 증가시킵니다. 가수 분해를 억제하는 방법? 가열하지 말고 너무 묽은 용액을 조제하지 말고 양이온에서의 가수분해를 주로 방해하므로 산을 첨가한다. 해당하는 것, 즉 아세트산보다 낫습니다.
다른 경우에는 가수 분해도를 높이는 것이 바람직하며 알칼리성 세척 소다 용액을보다 활성화시키기 위해 가열합니다. 탄산 나트륨의 가수 분해도가 증가합니다.
가수분해는 폭기에 의한 물 탈철 과정에서 중요한 역할을 합니다. 물이 산소로 포화되면 그 안에 포함된 중탄산철(II)이 철(III) 염으로 산화되어 훨씬 더 강하게 가수분해됩니다. 그 결과 완전한 가수분해가 일어나고 철은 철(Ⅲ) 수산화물 침전물의 형태로 분리된다.
수질 정화 공정에서 응고제로 알루미늄 염을 사용하는 것도 이를 기반으로 합니다. 중탄산염 이온의 존재하에 물에 첨가된 알루미늄 염은 완전히 가수분해되고 부피가 큰 수산화알루미늄이 응고되어 다양한 불순물을 동반합니다."가열 시 염의 가수분해 증가"
강화과제
№1.염의 가수분해 방정식을 작성하고 매질을 결정하십시오. 수용액(pH) 및 가수분해 유형:
Na 2 SiO 3, AlCl 3, K 2 S.
2번. 염의 가수 분해 방정식을 작성하고 가수 분해 유형과 용액의 매질을 결정하십시오.
아황산칼륨, 염화나트륨, 브롬화철(III)
3. 가수 분해 방정식을 작성하고 다음 물질에 대한 가수 분해 유형과 염 수용액의 매질을 결정하십시오.
황화칼륨 - K 2 S, 브롬화알루미늄 - AlBr 3 , 염화리튬 - LiCl, 인산나트륨 - Na 3 PO 4 , 황산칼륨 - K 2 SO 4 , 염화아연 - ZnCl 2 , 아황산나트륨 - Na 2 SO 3 , 황산암모늄 - (NH 4 ) 2 SO 4, 브롬화 바륨 - BaBr 2.