Оксид вуглецю 4 будова. Вуглець - характеристика елемента та хімічні властивості
Фізичні властивості:вуглець утворює безліч алотропних модифікацій: алмаз– одна з найтвердіших речовин, графіт, вугілля, сажа.
Атом вуглецю має 6 електронів: 1s 2 2s 2 2p 2 . Останні два електрони розташовуються на окремих р-орбіталях і є неспареними. У принципі, ця пара могла б займати одну орбіталь, але в такому разі зростає міжелектронне відштовхування. Тому один з них займає 2р х, а інший, або 2р у , або 2р z-орбіталі.
Відмінність енергії s- і р-підрівнів зовнішнього шару невелика, тому атом досить легко переходить у збуджений стан, при якому один із двох електронів з 2s-орбіталі переходить на вільну 2р.Виникає валентний стан, що має конфігурацію 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Саме такий стан атома вуглецю характерний для решітки алмазу — тетраедричне просторове розташування гібридних орбіталей, однакова довжина та енергія зв'язків.
Це явище, як відомо, називають sp 3 -гібридизацією,а функції, що виникають - sp 3 -гібридними . Утворення чотирьох sp 3 -зв'язків забезпечує атому вуглецю більш стійкий стан, ніж три р-р-та одна s-s-зв'язку. Крім sp 3 -гібридизації у атома вуглецю спостерігається також sp 2 - і sp-гібридизація . У першому випадку виникає взаємне накладення s-та двох р-орбіталей. Утворюються три рівнозначні sp 2 - гібридних орбіталі, розташовані в одній площині під кутом 120 ° один до одного. Третя орбіталь р незмінна і спрямована перпендикулярно до площини. sp 2 .

При sp-гібридизації відбувається накладення орбіталей s та р. Між двома утвореними рівноцінними гібридними орбіталями виникає кут 180 °, при цьому дві р-орбіталі у кожного з атомів залишаються незмінними.

Алотрорпію вуглецю. Алмаз та графіт
У кристалі графіту атоми вуглецю розташовані в паралельних площинах, займаючи в них вершини правильних шестикутників. Кожен із атомів вуглецю пов'язаний з трьома сусідніми sp 2 -гібридними зв'язками. Між паралельними площинами зв'язок здійснюється за рахунок ван-дер-ваальсових сил. Вільні р-орбіталі кожного з атомів спрямовані перпендикулярно до площин ковалентних зв'язків. Їх перекриття пояснюється додатковий π-зв'язок між атомами вуглецю. Таким чином, від валентного стану, в якому знаходяться атоми вуглецю в речовині, залежать властивості цієї речовини.
Хімічні властивості вуглецю
Найбільш характерні ступеня окиснення: +4, +2.
При низьких температурах вуглець інертний, але при нагріванні його активність зростає.
Вуглець як відновник:
- З киснем
C 0 + O 2 - t ° = CO 2 вуглекислий газ
при нестачі кисню - неповне згоряння:
2C 0 + O 2 – t° = 2C +2 O чадний газ
- зі фтором
З + 2F 2 = CF 4
- З водяною парою
C 0 + H 2 O – 1200° = +2 O + H 2 водяний газ
- З оксидами металів. Таким чином виплавляють метал із руди.
C 0 + 2CuO - t ° = 2Cu + C +4 O 2
- З кислотами - окислювачами:
C 0 + 2H 2 SO 4 (конц.) = З +4 O 2 + 2SO 2 + 2H 2 O
З 0 + 4HNO 3 (конц.) = З +4 O 2 + 4NO 2 + 2H 2 O
- із сіркою утворює сірковуглець:
С + 2S2 = СS2.
Вуглець як окислювач:
- з деякими металами утворює карбіди
4Al + 3C 0 = Al 4 C 3
Ca + 2C 0 = CaC 2 -4
- з воднем - метан (а також величезна кількість органічних сполук)
C 0 + 2H 2 = CH 4
- З кремнієм, утворює карборунд (при 2000 ° C в електропечі):
Знаходження вуглецю в природі
Вільний вуглець зустрічається у вигляді алмазу та графіту. У вигляді сполук вуглець перебуває у складі мінералів: крейди, мармуру, вапняку – СаСО 3 , доломіту – MgCO 3 *CaCO 3 ; гідрокарбонатів - Mg(НCO 3) 2 і Са(НCO 3) 2 , 2 входить до складу повітря; вуглець є головною складовою природних органічних сполук – газу, нафти, кам'яного вугілля, торфу, входить до складу органічних речовинбілків, жирів, вуглеводів, амінокислот, що входять до складу живих організмів.

Неорганічні сполуки вуглецю
Ні іони С 4+ , ні С 4- ‑ ні за яких звичайних хімічних процесів не утворюються: у сполуках вуглецю є ковалентні зв'язки різної полярності.
Оксид вуглецю (II)СО
Чадний газ; безбарвний, без запаху, малорозчинний у воді, розчинний в органічних розчинниках, отруйний, t ° кип = -192 ° C; t пл. = -205°C.
Отримання
1) У промисловості (у газогенераторах):
C + O 2 = CO 2
2) У лабораторії - термічним розкладанням мурашиної або щавлевої кислоти у присутності H 2 SO 4 (конц.):
HCOOH = H 2 O + CO
H 2 C 2 O 4 = CO + CO 2 + H 2 O
Хімічні властивості
За звичайних умов CO інертний; при нагріванні – відновник; несолетворний оксид.
1) із киснем
2C +2 O + O 2 = 2C +4 O 2
2) з оксидами металів
C +2 O + CuO = Сu + C +4 O 2
3) із хлором (на світлі)
CO + Cl 2 - hn = COCl 2 (фосген)
4) реагує з розплавами лугів (під тиском)
CO + NaOH = HCOONa (форміат натрію)
5) з перехідними металами утворює карбоніли
Ni + 4CO – t° = Ni(CO) 4
Fe + 5CO – t° = Fe(CO) 5
Оксид вуглецю (IV) СO2
Вуглекислий газ, безбарвний, без запаху, розчинність у воді - 1V H 2 O розчиняється 0,9V CO 2 (за нормальних умов); важче за повітря; t°пл.= -78,5°C (твердий CO 2 називається «сухий лід»); не підтримує горіння.
Отримання
- Термічне розкладання солей вугільної кислоти (карбонатів). Випалення вапняку:
CaCO 3 - t ° = CaO + CO 2
- Дія сильних кислот на карбонати та гідрокарбонати:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
ХімічнівластивостіЗ2
Кислотний оксид: реагує з основними оксидами та основами, утворюючи солі вугільної кислоти
Na 2 O + CO 2 = Na 2 CO 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 = NaHCO 3
При підвищеній температурі може виявляти окислювальні властивості
З +4 O 2 + 2Mg - t ° = 2Mg +2 O + C 0
Якісна реакція
Помутніння вапняної води:
Ca(OH) 2 + CO 2 = CaCO 3 ¯(білий осад) + H 2 O
Воно зникає за тривалого пропускання CO 2 через вапняну воду, т.к. нерозчинний карбонат кальцію переходить у розчинний гідрокарбонат:
CaCO 3 + H 2 O + CO 2 = Сa(HCO 3) 2
Вугільна кислота та їїсолі
H 2CO 3 -Кислота слабка, існує тільки у водному розчині:
CO 2 + H 2 O ↔ H 2 CO 3
Двоосновна:
H 2 CO 3 ↔ H + + HCO 3 — Кислі солі — бікарбонати, гідрокарбонати
HCO 3 - ↔ H + + CO 3 2- Середні солі - карбонати
Характерні властивості кислот.
Карбонати та гідрокарбонати можуть перетворюватися один на одного:
2NaHCO 3 – t° = Na 2 CO 3 + H 2 O + CO 2
Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
Карбонати металів (крім лужних металів) при нагріванні декарбоксилюються з утворенням оксиду:
CuCO 3 - t ° = CuO + CO 2
Якісна реакція- «закипання» при дії сильної кислоти:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
CO 3 2- + 2H + = H 2 O + CO 2
Карбіди
Карбід кальцію:
CaO + 3 C = CaC 2 + CO
CaC 2 + 2 H 2 O = Ca(OH) 2 + C 2 H 2 .
Ацетилен виділяється при реакції з водою карбідів цинку, кадмію, лантану та церію:
2 LaC 2 + 6 H 2 O = 2La(OH) 3 + 2 C 2 H 2 + H 2 .
Be 2 C та Al 4 C 3 розкладаються водою з утворенням метану:
Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3 = 3 CH 4 .
У техніці застосовують карбіди титану TiC, вольфраму W 2 C (тверді сплави), кремнію SiC (карборунд – як абразив та матеріал для нагрівачів).
Ціаніди
отримують при нагріванні соди в атмосфері аміаку та чадного газу:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Синільна кислота HCN – важливий продукт хімічної промисловості, що широко застосовується в органічному синтезі. Її світове виробництво сягає 200 тис. т на рік. Електронна будова ціанід-аніону аналогічна оксиду вуглецю (II), такі частинки називають ізоелектронними:
C = O: [:C = N:] –
Ціаніди (0,1-0,2%-ний водний розчин) застосовують при видобутку золота:
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K + 2 KOH.
При кип'ятінні розчинів ціанідів з сіркою або сплавлення твердих речовин утворюються роданіди:
KCN+S=KSCN.
При нагріванні ціанідів малоактивних металів виходить диціан: Hg(CN) 2 = Hg + (CN) 2 . Розчини ціанідів окислюються до ціанатів:
2 KCN + O 2 = 2 KOCN.
Ціанова кислота існує у двох формах:
H-N=C=O; H-O-C = N:
У 1828 р. Фрідріх Велер (1800-1882) отримав із ціанату амонію сечовину: NH 4 OCN = CO(NH 2) 2 при упарюванні водного розчину.
Ця подія зазвичай сприймається як перемога синтетичної хімії над «віталістичної теорією».
Існує ізомер ціанової кислоти – гримуча кислота
H-O-N=C.
Її солі (гримуча ртуть Hg(ONC) 2) використовуються в ударних запальниках.
Синтез сечовини(карбаміду):
CO 2 + 2 NH 3 = CO(NH 2) 2 + H 2 O. При 130 0 С та 100 атм.
Сечовина є амідом вугільної кислоти, існує її «азотний аналог» – гуанідин.
Карбонати
Найважливіші неорганічні сполукивуглецю – солі вугільної кислоти (карбонати). H 2 CO 3 - слабка кислота (К 1 = 1,3 · 10 -4; До 2 = 5 · 10 -11). Карбонатний буфер підтримує вуглекислотна рівновагау атмосфері. Світовий океан має величезну буферну ємність, тому що він є відкритою системою. Основна буферна реакція – рівновага при дисоціації вугільної кислоти:
H 2 CO 3 ↔ H + + HCO 3 - .
При зниженні кислотності відбувається додаткове поглинання вуглекислого газу з атмосфери з утворенням кислоти:
CO 2 + H 2 O ↔ H 2 CO 3 .
При підвищенні кислотності відбувається розчинення карбонатних порід (раковини, крейдяні та вапнякові відкладення в океані); цим компенсується спад гідрокарбонатних іонів:
H + + CO 3 2- ↔ HCO 3 -
CaCO 3 (тв.) ↔ Ca 2+ + CO 3 2-
Тверді карбонати переходять у розчинні гідрокарбонати. Саме цей процес хімічного розчинення надлишкового вуглекислого газу протидіє «парниковому ефекту» – глобальному потеплінню через поглинання вуглекислим газом. теплового випромінюванняЗемлі. Приблизно третина світового виробництва соди (карбонат натрію Na2CO3) використовується у виробництві скла.
Вуглець
У вільному стані вуглець утворює 3 алотропні модифікації: алмаз, графіт і карбін, що штучно одержується.
У кристалі алмазу кожен атом вуглецю пов'язаний міцними ковалентними зв'язками з чотирма іншими, розміщеними навколо нього однакових відстанях.
Усі атоми вуглецю перебувають у стані sp 3 -гібридизації. Атомні кристалічні грати алмазу мають тетраедричну будову.
Алмаз - безбарвна, прозора речовина, що сильно заломлює світло. Відрізняється найбільшою твердістю серед усіх відомих речовин. Алмаз тендітний, тугоплавкий, погано проводить тепло та електричний струм. Невеликі відстані між сусідніми атомами вуглецю (0,154 нм) зумовлюють досить велику густину алмазу (3,5 г/см 3 ).
У кристалічній решітці графіту кожен атом вуглецю знаходиться в стані sp 2 -гібридизації і утворює три міцні ковалентні зв'язки з атомами вуглецю, розташованими в тому ж шарі. В освіті цих зв'язків беруть участь по три електрони кожного атома, вуглецю, а четверті валентні електрони утворюють л-зв'язки і є відносно вільними (рухливими). Вони зумовлюють електро- та теплопровідність графіту.
Довжина ковалентного зв'язку між сусідніми атомами вуглецю в одній площині дорівнює 0,152 нм, а відстань між атомами в різних шарах більше в 2,5 рази, тому зв'язки між ними слабкі.
Графіт - непрозора, м'яка, жирна на дотик речовина сіро-чорного кольору з металевим блиском; добре проводить тепло та електричний струм. Графіт має меншу щільність у порівнянні з алмазом, легко розщеплюється на тонкі лусочки.
Розупорядкована структура дрібнокристалічного графіту лежить в основі будівлі різних формаморфного вуглецю, найважливішими з яких є кокс, буре та кам'яне вугілля, сажа, активоване (активне) вугілля.
Цю алотропну модифікацію вуглецю одержують каталітичним окисленням (дегідрополіконденсацією) ацетилену. Карбін - ланцюжковий полімер, що має дві форми:
С=С-С=С-... та...=С=С=С=
Карбін має напівпровідникові властивості.
При звичайній температурі обидві модифікації вуглецю (алмаз та графіт) хімічно інертні. Дрібнокристалічні форми графіту - кокс, сажа, активоване вугілля - більш реакційноздатні, але, як правило, після їхнього попереднього нагрівання до високої температури.
1. Взаємодія із киснем
З + O 2 = З O 2 + 393,5 кДж (надлишку O 2)
2С + O 2 = 2СО + 221 кДж (при нестачі O 2)
Спалювання вугілля - одне з найважливіших джерел енергії.
2. Взаємодія з фтором та сіркою.
С + 2F 2 = CF 4 тетрафторид вуглецю
С + 2S = CS 2 сірковуглець
3. Кокс - одне з найважливіших відновників, що у промисловості. У металургії з його допомогою одержують метали з оксидів, наприклад:
ЗС + Fe 2 O 3 = 2Fe + ЗСО
З + ZnO = Zn + СО
4. При взаємодії вуглецю з оксидами лужних та лужноземельних металів відновлений метал, з'єднуючись з вуглецем, утворює карбід. Наприклад: ЗС + СаО = СаС 2 + СО карбід кальцію
5. Кокс застосовується також для одержання кремнію:
2С + SiO 2 = Si + 2СО
6. При надлишку коксу утворюється карбід кремнію (карборунд) SiC.
Отримання "водяного газу" (газифікація твердого палива)
Пропусканням водяної пари через розпечене вугілля отримують горючу суміш СО і Н 2 , звану водяним газом:
З + Н 2 О = СО + Н 2
7. Реакції з окислюючими кислотами.
Активоване або деревне вугілля при нагріванні відновлює аніони NO 3 - і SO 4 2 - з концентрованих кислот:
З + 4HNO 3 = З 2 + 4NO 2 + 2Н 2
С + 2H 2 SO 4 = СO 2 + 2SO 2 + 2Н 2 О
8. Реакції з розплавленими нітратами лужних металів
У розплавах KNO 3 і NaNO 3 подрібнене вугілля інтенсивно згоряє з утворенням сліпучого полум'я:
5С + 4KNO 3 = 2К 2 СО 3 + ЗСО 2 + 2N 2
1. Утворення солеподібних карбідів з активними металами.
Значне ослаблення неметалічних властивостей у вуглецю виявляється у тому, що функції його як окислювача виявляються набагато меншою мірою, ніж відновлювальні функції.
2. Тільки в реакціях з активними металами атоми вуглецю переходять у негативно заряджені іони С -4 і (С=С) 2- утворюючи солеподібні карбіди:
ЗС + 4Al = Аl 4 С 3 карбід алюмінію
2С + Са = СаС 2 карбід кальцію
3. Карбіди іонного типу - дуже нестійкі сполуки, вони легко розкладаються під дією кислот та води, що свідчить про нестійкість негативно заряджених аніонів вуглецю:
Аl 4 З 3 + 12Н 2 О = ЗСН 4 + 4Аl(ОН) 3
СаС 2 + 2Н 2 О = С 2 Н 2 + Са(ОН) 2
4. Утворення ковалентних з'єднань із металами
У розплавах сумішей вуглецю з перехідними металами утворюються карбіди переважно з ковалентним типом зв'язку. Молекули їх мають змінний склад, а речовини загалом близькі до сплавів. Такі карбіди відрізняються високою стійкістю, вони хімічно інертні по відношенню до води, кислот, лугів та багатьох інших реагентів.
5. Взаємодія з воднем
При високих Т і Р, у присутності нікелевого каталізатора, вуглець з'єднується з воднем:
С + 2Н 2 → СН 4
Реакція дуже оборотна і не має практичного значення.
Оксид вуглецю(II)- СО
(чадний газ, окис вуглецю, монооксид вуглецю)
Фізичні властивості:безбарвний отруйний газ без смаку та запаху, горить блакитним полум'ям, легше за повітря, погано розчинний у воді. Концентрація чадного газу повітря 12,5-74 % вибухонебезпечна.
Отримання:
1) У промисловості
C + O 2 = CO 2 + 402 кДж
CO 2 + C = 2CO - 175 кДж
У газогенераторах іноді через розпечене вугілля продують водяну пару:
З + Н 2 О = СО + Н 2 - Q,
суміш СО + Н 2 – називається синтез – газом.
2) У лабораторії- термічним розкладанням мурашиної чи щавлевої кислоти у присутності H 2 SO 4 (конц.):
HCOOH t˚C, H2SO4 → H 2 O + CO
H 2 C 2 O 4 t˚C,H2SO4 → CO + CO 2 + H 2 O
Хімічні властивості:
За звичайних умов CO інертний;при нагріванні – відновник;
CO - несолетворний оксид.
1) із киснем
2C +2 O + O 2 t ˚ C → 2C +4 O 2
2) з оксидами металів CO + Me x O y = CO 2 + Me
C +2 O + CuO t C → Сu + C +4 O 2
3) із хлором (на світлі)
CO + Cl 2 світло → COCl 2 (фосген – отруйний газ)
4)* реагує з розплавами лугів (під тиском)
CO + NaOH P → HCOONa (форміат натрію)
Вплив чадного газу на живі організми:
Чадний газ небезпечний, тому що він позбавляє можливості кров нести кисень до життєво важливих органів, таких як серце та мозок. Чадний газ поєднується з гемоглобіном, який переносить кисень до клітин організму, внаслідок чого той стає непридатним для транспортування кисню. Залежно від кількості, що вдихається, чадний газ погіршує координацію, загострює серцево-судинні захворювання і викликає втому, головний біль, слабкість, Вплив чадного газу на здоров'я людини залежить від його концентрації і часу впливу на організм. Концентрація чадного газу повітря більше 0,1% призводить до смерті протягом однієї години, а концентрація понад 1,2% протягом трьох хвилин.
Застосування оксиду вуглецю:
Головним чином чадний газ застосовують, як горючий газ у суміші з азотом, так званий генераторний або повітряний газ, або ж у суміші з воднем водяний газ. У металургії для відновлення металів з їхньої руд. Для отримання металів високої чистоти під час розкладання карбонілів.
Оксид вуглецю (IV) СO2 – вуглекислий газ
Фізичні властивості:Вуглекислий газ, безбарвний, без запаху, розчинність у воді - у 1V H 2 O розчиняється 0,9V CO 2 (за нормальних умов); важче за повітря; t°пл.= -78,5°C (твердий CO 2 називається "сухий лід"); не підтримує горіння.
Будова молекули:
Вуглекислий газ має наступні електронну та структурну формули -
3. Згоряння вуглецевмісних речовин:
СН 4 + 2О 2 → 2H 2 O + CO 2
4. При повільному окисленні у біохімічних процесах (дихання, гниття, бродіння)
Хімічні властивості:
Оксиди вуглецю (II) та (IV)
Інтегрований урок з хімії та біології
Завдання:вивчити та систематизувати знання про оксиди вуглецю (II) та (IV); розкрити взаємозв'язок живої та неживої природи; закріпити знання про вплив оксидів вуглецю на організм людини; закріпити навички вміння працювати із лабораторним обладнанням.
Обладнання:розчин НСl, лакмус, Ca(OH) 2 , CaCO 3 , скляна паличка, саморобні таблиці, переносна дошка, шарострижнева модель.
ХІД УРОКУ
Вчитель біологіїповідомляє тему та завдання уроку.
Вчитель хімії.Грунтуючись на вченні про ковалентний зв'язок, складіть електронну та структурну формули оксидів вуглецю (II) та (IV).
Хімічна формула оксиду вуглецю (II) - ЗІ, атом вуглецю знаходиться в нормальному стані.
За рахунок парування неспарених електронів утворюються два ковалентні полярні зв'язки, а третя ковалентний зв'язокутворюється за донорно-акцепторним механізмом. Донором є атом кисню, т.к. він надає вільну пару електронів; акцептором - атом вуглецю, т.к. надає вільну орбіталь.
У промисловості оксид вуглецю (II) отримують, пропускаючи 2 над розжареним вугіллям при високій температурі. Він утворюється також у процесі згоряння вугілля за нестачі кисню. ( Учень записує рівняння реакції на дошці)

У лабораторії СО отримують дією концентрованої Н 2 SО 4 на мурашину кислоту. ( Рівняння реакції записує вчитель.)
![]()
Вчитель біології.Отже, ви познайомилися з одержанням оксиду вуглецю (ІІ). А якими фізичними властивостямимає оксид вуглецю (II)?
Учень.Це безбарвний газ, отруйний, без запаху, легший за повітря, погано розчиняється у воді, температура кипіння –191,5 °C, твердне при –205 °С.
Вчитель хімії.Чадний газ у кількостях, небезпечних для життя людиниміститься у вихлопних газах автомобілів. Тому гаражі повинні добре провітрюватись, особливо при запуску двигуна.
Вчитель біології.Який вплив чадний газ на організм людини?
Учень.Чадний газ вкрай отруйний для людини – це пояснюється тим, що він утворює карбоксигемоглобін. Карбоксигемоглобін – дуже міцна сполука. Внаслідок його утворення гемоглобін крові не взаємодіє з киснем, і при сильному отруєнні людина може загинути від кисневого голодування.
Вчитель біології.Яку першу допомогу необхідно надати людині при отруєнні чадним газом?
Учні.Треба викликати «швидку допомогу», потерпілого треба винести надвір, зробити штучне дихання, приміщення добре провітрити.
Вчитель хімії.Напишіть хімічну формулу оксиду вуглецю (IV) і, використовуючи шарострижневу модель, збудуйте його структуру.
Атом вуглецю знаходиться у збудженому стані. Усі чотири ковалентні полярні зв'язки утворилися за рахунок парування неспарених електронів. Однак через лінійну будову молекула його загалом неполярна.
У промисловості 2 отримують при розкладанні карбонату кальцію у виробництві вапна.
(Учень записує рівняння реакції.)
У лабораторії 2 отримують при взаємодії кислот з крейдою або мармуром.
(Учні виконують лабораторний досвід.)

Вчитель біології.Внаслідок яких процесів утворюється вуглекислий газ в організмі?
Учень.Вуглекислий газ утворюється в організмі в результаті реакцій окислення органічних речовин, що входять до складу клітини.
(Учні виконують лабораторний досвід.)

Вапняний розчин став каламутним, т.к. утворюється карбонат кальцію. Крім процесу дихання, СО2 виділяється внаслідок бродіння, гниття.
Вчитель біології.Чи впливає фізичне навантаження на процес дихання?
Учень.При надмірному фізичному (м'язовому) навантаженні м'язи використовують кисень швидше, ніж кров встигає його доставити, і тоді вони синтезують необхідну для їх роботи АТФ шляхом бродіння. У м'язах утворюється молочна кислота C 3 H 6 O 3 яка надходить у кров. Накопичення великої кількості молочної кислоти шкідливе для організму. Після важкого фізичного навантаження ми ще деякий час важко дихаємо – виплачуємо кисневу заборгованість.
Вчитель хімії.Велика кількість оксиду вуглецю (ІV) виділяється в атмосферу при спалюванні органічного палива. Удома ми як паливо використовуємо природний газ, а він майже на 90% складається з метану (СН 4). Я пропоную одному з вас вийти до дошки, скласти рівняння реакції та розібрати його з погляду окислення-відновлення.

Вчитель біології.Чому не можна використовувати газові печі для опалення приміщення?
Учень.Метан – складова частина природного газу. При його горінні вміст вуглекислого газу повітря підвищується, а кисню – знижується. ( Робота з таблицею «ЗмістСО 2 в повітрі".)
При вмісті в повітрі 0,3% 2 у людини спостерігається прискорене дихання; при 10% – втрата свідомості, при 20% – миттєвий параліч та швидка смерть. Особливо потребує чистого повітря дитина, тому що споживання кисню тканинами зростаючого організму більше, ніж у дорослого. Отже, необхідно регулярно провітрювати приміщення. Якщо крові є надлишок СО 2 , збудливість дихального центру підвищується і дихання стає більш частим і глибоким.
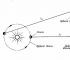
Вчитель біології.Розглянемо роль оксиду вуглецю (IV) у житті рослин.
Учень.У рослин утворення органічних речовин походить із СО 2 і Н 2 O на світлі, крім органічних речовин, утворюється кисень.

![]()
Фотосинтез регулює вміст вуглекислого газу в атмосфері, що перешкоджає підвищенню температури планети. Щорічно рослини поглинають із атмосфери 300 млрд т вуглекислого газу. У процесі фотосинтезу в атмосферу щорічно виділяється 200 млрд. т кисню. З кисню під час грози утворюється озон.
Вчитель хімії.Розглянемо Хімічні властивостіоксиду вуглецю (ІV).

Вчитель біології.Яке значення має вугільна кислота в організмі людини у процесі дихання? ( Фрагмент діафільму.)
Ферменти, що містяться в крові, перетворюють вуглекислий газ на вугільну кислоту, яка дисоціює на іони водню і гідрокарбонату. Якщо крові міститься надлишок іонів Н + , тобто. якщо кислотність крові підвищена, то частина іонів Н+ з'єднується з гідрокарбонат-іонами, утворюючи вугільну кислоту та звільняючи тим самим кров від надлишку Н+-іонів. Якщо ж у крові надто мало Н+-іонів, то вугільна кислота дисоціює і концентрація Н+-іонів у крові підвищується. При температурі 37 ° С рН крові дорівнює 7,36.
В організмі вуглекислий газ переноситься кров'ю у вигляді хімічних сполук – гідрокарбонатів натрію та калію.
Закріплення матеріалу
Тест
Із запропонованих процесів газообміну в легенях та тканинах виконують перший варіант повинні вибрати шифри правильних відповідей зліва, а другий – праворуч.
(1) Перехід O 2 з легенів у кров. (13)
(2) Перехід O 2 з крові у тканини. (14)
(3) Перехід СО 2 з тканин у кров. (15)
(4) Перехід СО 2 з крові в легені. (16)
(5) Поглинання O2 еритроцитами. (17)
(6) Виділення O2 з еритроцитів. (18)
(7) Перетворення артеріальної крові на венозну. (19)
(8) Перетворення венозної крові на артеріальну. (20)
(9) Розрив хімічного зв'язку O 2 з гемоглобіном. (21)
(10) Хімічне зв'язування O2 з гемоглобіном. (22)
(11) Капіляри у тканинах. (23)
(12) Легкові капіляри. (24)
Питання першого варіанта
1. Процеси газообміну у тканинах.
2. Фізичні процеси під час газообміну.
Питання другого варіанта
1.
Процеси газообміну у легенях.
2. Хімічні процеси під час газообміну
Завдання
Визначте об'єм оксиду вуглецю (IV), що виділяється при розкладанні 50 г карбонату кальцію.
Оксид вуглецю (IV) (діоксид вуглецю, вуглекислий газ) у звичайних умовах являє собою безбарвний газ, важчий за повітря, термічно стійкий, а при стисканні та охолодженні легко переходить у рідкий і твердий стан.
Щільність – 1997 г/л. Твердий CO2, що зветься «сухий лід», виганяється при кімнатній температурі. Погано розчиняється у воді, частково реагуючи з нею. Виявляє кислотні властивості. Відновлюється активними металами, воднем та вуглецем.
Хімічна формула оксиду вуглецю 4
Хімічна формула оксиду вуглецю (ІV) CO2. Вона показує, що до складу цієї молекули входять один атом вуглецю (Ar = 12 а.е.м.) та два атоми кисню (Ar = 16 а.е.м.). За хімічною формулою можна обчислити молекулярну масу оксиду вуглецю (IV):
Mr(CO2) = Ar(C) + 2×Ar(O);
Mr(CO2) = 12 + 2 16 = 12 + 32 = 44.
Приклади розв'язання задач
ПРИКЛАД 1
При спалюванні 26,7 г амінокислоти (CxHyOzNk) у надлишку кисню утворюється 39,6 г оксиду вуглецю (IV), 18,9 г води та 4,2 г азоту. Визначте формулу амінокислоти.
Рішення Складемо схему реакції згоряння амінокислоти, позначивши кількість атомів вуглецю, водню, кисню та азоту за «x», «у», «z» і «k» відповідно:
CxHyOzNk+ Oz→CO2 + H2O + N2.
Визначимо маси елементів, що входять до складу цієї речовини. Значення відносних атомних мас, взяті із Періодичної таблиці Д.І. Менделєєва, округлим до цілих чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м., Ar(N) = 14 а.о.м.
M(C) = n(C)×M(C) = n(CO2)×M(C) = ×M(C);
M(H) = n(H)×M(H) = 2×n(H2O)×M(H) = ×M(H);
Розрахуємо молярні маси вуглекислого газу та води. Як відомо, молярна маса молекули дорівнює сумі відносних атомних мас атомів, що входять до складу молекули (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
M(C) = ×12 = 10,8 г;
M(H) = 2×18,9 / 18×1= 2,1 р.
M(O) = m(CxHyOzNk) - m(C) - m(H) - m(N) = 26,7 - 10,8 - 2,1 - 4,2 = 9,6 г.
Визначимо хімічну формулуамінокислоти:
X: y: z: k = m(C)/Ar(C): m(H)/Ar(H): m(O)/Ar(O): m(N)/Ar(N);
X:y:z:k= 10,8/12:2,1/1:9,6/16: 4,2/14;
X: y: z: k = 0,9: 2,1: 0,41: 0,3 = 3: 7: 1,5: 1 = 6: 14: 3: 2.
Значить найпростіша формула амінокислоти C6H14O3N2.
Відповідь C6H14O3N2
ПРИКЛАД 2
Завдання Складіть найпростішу формулу сполуки, де масові частки елементів приблизно рівні: вуглецю – 25,4%, водню – 3,17%, кисню – 33,86%, хлору – 37,57%.
Рішення Масова частка елемента Х у молекулі складу НХ розраховується за такою формулою:
ω (Х) = n × Ar (X) / M (HX) × 100%.
Позначимо кількість атомів вуглецю в молекулі через «х», кількість атомів азоту водню через «у», кількість атомів кисню за «z» і кількість атомів хлору за «k».
Знайдемо відповідні відносні атомні масиелементів вуглецю, водню, кисню та хлору (значення відносних атомних мас, взяті з Періодичної таблиці Д.І. Менделєєва, округлим до цілих чисел).
Ar(C) = 12; Ar(H) = 14; Ar(O) = 16; Ar(Cl) = 35,5.
Відсотковий вміст елементів розділимо відповідні відносні атомні маси. Таким чином, ми знайдемо співвідношення між числом атомів у молекулі сполуки:
X:y:z:k = ω(C)/Ar(C) : ω(H)/Ar(H) : ω(O)/Ar(O) : ω(Cl)/Ar(Cl);
X: y: z: k = 25,4/12: 3,17/1: 33,86/16: 37,57/35,5;
X: y: z: k = 2,1: 3,17: 2,1: 1,1 = 2: 3: 2: 1.
Значить найпростіша формула сполуки вуглецю, водню, кисню та хлору матиме вигляд C2H3O2Cl.