Каква е връзката между металите. Метална връзка: механизъм на образуване и примери
Метална връзка. Свойства на метална връзка.
Металната връзка е химическа връзка, причинена от наличието на относително свободни електрони. Характерно е както за чистите метали, така и за техните сплави и интерметални съединения.
Механизъм за метална връзка
Положителните метални йони са разположени във всички възли на кристалната решетка. Между тях валентните електрони, отделени от атомите при образуването на йони, се движат произволно, като газови молекули. Тези електрони действат като цимент͵ държащ положителните йони заедно; в противен случай решетката би се разпаднала под действието на силите на отблъскване между йоните. В същото време електроните се задържат от йони в кристалната решетка и не могат да я напуснат. Комуникационните сили не са локализирани и насочени. Поради тази причина в повечето случаи се появяват високи координационни числа (например 12 или 8). Когато два метални атома се съберат заедно, орбиталите на техните външни обвивки се припокриват, за да образуват молекулярни орбитали. Ако третият атом е подходящ, неговата орбитала се припокрива с орбиталите на първите два атома, което дава друга молекулярна орбитала. Когато има много атоми, възникват огромен брой триизмерни молекулярни орбитали, простиращи се във всички посоки. Поради многократното припокриване на орбиталите, валентните електрони на всеки атом се влияят от много атоми.
Характерни кристални решетки
Повечето метали образуват една от следните силно симетрични решетки с плътно опаковане на атоми: кубично центрирано по тялото, кубично лицево центрирано и шестоъгълно.
В кубична решетка, центрирана по тялото (BCC), атомите са разположени във върховете на куба и един атом в центъра на обема на куба. Металите имат кубична решетка, центрирана по тялото: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В лицево-центрирана кубична решетка (FCC) атомите са разположени във върховете на куба и в центъра на всяко лице. Металите от този тип имат решетка: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В шестоъгълна решетка атомите са разположени във върховете и центъра на шестоъгълните основи на призмата, а три атома са разположени в средната равнина на призмата. Металите имат такава опаковка от атоми: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Други имоти
Свободно движещите се електрони осигуряват висока електрическа и топлопроводимост. Веществата с метална връзка често комбинират здравина с пластичност, тъй като когато атомите се изместват един спрямо друг, връзките не се прекъсват. Метален аромат също е важно свойство.
Металите провеждат добре топлината и електричеството, достатъчно са здрави, могат да се деформират без разрушаване. Някои метали са ковки (могат да бъдат изковани), някои са вискозни (могат да бъдат извадени от тел). Тези уникални свойства се дължат на специален вид химическа връзкасвързване на атомите на металите един с друг - метална връзка.
Металите в твърдо състояние съществуват под формата на кристали от положителни йони, сякаш „плуващи“ в морето от електрони, свободно движещи се между тях.
Металната връзка обяснява свойствата на металите, по-специално тяхната здравина. Под действието на деформиращата сила металната решетка може да промени формата си без напукване, за разлика от йонните кристали.
Високата топлопроводимост на металите се обяснява с факта, че ако парче метал се нагрее от едната страна, кинетичната енергия на електроните ще се увеличи. Това увеличение на енергията ще се разпространи в "електронното море" в цялата проба с голяма скорост.
Електрическата проводимост на металите също става ясна. Ако се приложи потенциална разлика към краищата на метална проба, облакът от делокализирани електрони ще се измести в посока на положителен потенциал: този поток от електрони, движещи се в една посока, е познат електрически ток.
Метална връзка. Свойства на метална връзка. - понятие и видове. Класификация и характеристики на категорията "Метална връзка. Свойства на метална връзка." 2017 г., 2018 г.
169957 0
Всеки атом има определен брой електрони.
Влизане в химична реакция, атомите даряват, придобиват или социализират електрони, достигайки най-стабилната електронна конфигурация. Най-стабилната конфигурация е тази с най-ниска енергия (както в атомите на благородните газове). Този модел се нарича "правило на октета" (Фигура 1).
Ориз. 1.
Това правило важи за всички видове връзки... Електронните връзки между атомите им позволяват да образуват стабилни структури, от най-простите кристали до сложни биомолекули, като в крайна сметка образуват живи системи. Те се различават от кристалите по непрекъснатия си метаболизъм. Освен това много химични реакции протичат по механизми електронен трансфер, които играят съществена роля в енергийните процеси в организма.
Химичната връзка е силата, която държи два или повече атома, йони, молекули или всяка комбинация от тях заедно.
Природата на химичната връзка е универсална: това е електростатичната сила на привличане между отрицателно заредени електрони и положително заредени ядра, определена от конфигурацията на електроните във външната обвивка на атомите. Нарича се способността на атома да образува химични връзки валентност, или степен на окисление... Концепцията за валентност се свързва с валентни електрони- електроните, които образуват химични връзки, тоест са в най-високите енергийни орбитали. респективно външна обвивкаатом, съдържащ тези орбитали, се нарича валентна обвивка... Понастоящем не е достатъчно да се посочи наличието на химична връзка, но е необходимо да се изясни нейният тип: йонна, ковалентна, дипол-диполна, метална.
Първият вид комуникация ейонна Връзка
В съответствие със електронна теориявалентности на Люис и Косел, атомите могат да постигнат стабилна електронна конфигурация по два начина: първо, чрез загуба на електрони, превръщайки се в катиони, второ, придобиването им, превръщането им в аниони... В резултат на пренос на електрони поради електростатичната сила на привличане между йони със заряди с противоположен знак се образува химическа връзка, наречена Косел " електровалентен"(Сега се нарича йонна).
В този случай аниони и катиони образуват стабилна електронна конфигурация с запълнена външна електронна обвивка. Типичните йонни връзки се образуват от катиони от Т и II групи периодична системаи аниони на неметални елементи от VI и VII групи (съответно 16 и 17 подгрупи, халкогении халогени). Връзките на йонните съединения са ненаситени и ненасочени, така че запазват възможността за електростатично взаимодействие с други йони. На фиг. Фигури 2 и 3 показват примери за йонни връзки, съответстващи на модела на електронен трансфер на Косел.
Ориз. 2.
Ориз. 3.Йонна връзка в молекула готварска сол(NaCl)
Тук е уместно да припомним някои от свойствата, които обясняват поведението на веществата в природата, по-специално да разгледаме концепцията за киселинии основания.
Водните разтвори на всички тези вещества са електролити. Те променят цвета си по различни начини индикатори... Механизмът на действие на индикаторите е открит от F.V. Оствалд. Той показа, че индикаторите са слаби киселини или основи, чийто цвят в недисоциирано и дисоциирано състояние е различен.
Основите са способни да неутрализират киселини. Не всички основи са разтворими във вода (например някои органични съединения, които не съдържат - OH групи са неразтворими, по-специално, триетиламин N (C 2 H 5) 3); разтворими основи се наричат алкали.
Водните разтвори на киселини влизат в характерни реакции:
а) с метални оксиди - с образуване на сол и вода;
б) с метали - с образуването на сол и водород;
в) с карбонати - с образуването на сол, CO 2 и Х 2 О.
Свойствата на киселините и основите се описват от няколко теории. В съответствие с теорията на S.A. Arrhenius, киселината е вещество, което се дисоциира, за да образува йони Х+, докато основата образува йони ТОЙ-. Тази теория не взема предвид съществуването на органични основи, които нямат хидроксилни групи.
В съответствие с протонтеорията на Бронстед и Лоури, киселината е вещество, съдържащо молекули или йони, които даряват протони ( донорипротони), а основата е вещество, състоящо се от молекули или йони, които приемат протони ( акцепторипротони). Имайте предвид, че във водни разтвори водородните йони съществуват в хидратирана форма, тоест под формата на хидрониеви йони H 3 O+. Тази теория описва реакции не само с вода и хидроксидни йони, но също така се извършват в отсъствието на разтворител или с неводен разтворител.
Например при реакцията между амоняк NH 3 (слаба основа) и хлороводородът в газовата фаза образува твърд амониев хлорид, а в равновесна смес от две вещества винаги има 4 частици, две от които са киселини, а другите две са основи:
Тази равновесна смес се състои от две конюгирани двойки киселини и основи:
1)NH 4 + и NH 3
2) HClи Сl ‑
Тук във всяка конюгатна двойка киселината и основата се различават с един протон. Всяка киселина има конюгирана с нея основа. Силна киселина съответства на слаба конюгирана основа и слаба киселина- силна конюгирана основа.
Теорията на Бронстед-Лоури дава възможност да се обясни уникалността на ролята на водата за живота на биосферата. Водата, в зависимост от веществото, което взаимодейства с нея, може да проявява свойствата на киселина или основа. Например при реакции с водни разтвориоцетна киселина, водата е основа, а с водни разтвори на амоняк - киселина.
1) CH3COOH + H 2 O ↔ H 3 O + + CH 3 COO-. Тук молекула на оцетна киселина дарява протон на молекула на водата;
2) NH 3 + H 2 O ↔ NH 4 + + ТОЙ-. Тук молекулата на амоняка приема протон от водна молекула.
Така водата може да образува две конюгирани двойки:
1) H 2 O(киселина) и ТОЙ- (конюгирана основа)
2) H 3 O+ (киселина) и H 2 O(конюгирана основа).
В първия случай водата дарява протон, а във втория го приема.
Това свойство се нарича амфипротонност... Наричат се вещества, които могат да реагират както като киселини, така и като основи амфотерни... В живата природа такива вещества са често срещани. Например, аминокиселините са способни да образуват соли както с киселини, така и с основи. Следователно, пептидите лесно образуват координационни съединения с наличните метални йони.
Поради това, характерно свойствойонна връзка - пълното движение на купето на свързващите електрони към едно от ядрата. Това означава, че има област между йоните, където електронната плътност е почти нула.
Вторият вид комуникация ековалентен Връзка
Атомите могат да се образуват стабилни електронни конфигурациичрез социализиране на електрони.
Такава връзка се образува, когато двойка електрони се социализират един по един. от всекиатом. В този случай социализираните електрони на връзката са равномерно разпределени между атомите. Примери за ковалентни връзки включват хомоядрендвуатомни молекули H 2 , н 2 , Ф 2. Алотропите имат същия тип връзка. О 2 и озон О 3 и многоатомната молекула С 8, както и хетероядрени молекулихлороводород Hcl, въглероден двуокис CO 2, метан CH 4, етанол С 2 Х 5 ТОЙ, серен хексафлуорид SF 6, ацетилен С 2 Х 2. Всички тези молекули имат едни и същи общи електрони, а връзките им са наситени и насочени по един и същи начин (фиг. 4).
За биолозите е важно двойните и тройните връзки да имат ковалентни атомни радиуси в сравнение с единична връзканамален.
Ориз. 4.Ковалентна връзка в Cl 2 молекулата.
Йонните и ковалентните видове връзки са два ограничаващи случая на много съществуващи видове химически връзки и на практика повечето връзки са междинни.
Съединенията от два елемента, разположени в противоположните краища на един или различни периоди от системата на Менделеев, образуват предимно йонни връзки. Тъй като елементите се приближават един към друг в рамките на периода, йонният характер на техните съединения намалява, а ковалентният характер се увеличава. Например, халогенидите и оксидите на елементите от лявата страна на периодичната таблица образуват предимно йонни връзки ( NaCl, AgBr, BaSO 4, CaCO 3, KNO 3, CaO, NaOH), и същите съединения на елементите от дясната страна на таблицата са ковалентни ( H2O, CO2, NH3, NO2, CH4, фенол C6H5OH, глюкоза C6H12O6, етанол C2H5OH).
Ковалентната връзка от своя страна има друга модификация.
В многоатомните йони и в сложните биологични молекули и двата електрона могат да идват само от единатом. Нарича се донорелектронна двойка. Атомът, който социализира тази двойка електрони с донора, се нарича акцепторелектронна двойка. Този вид ковалентна връзка се нарича координация (донор-акцептор, илидателен падеж) комуникация(фиг. 5). Този тип връзка е най-важен за биологията и медицината, тъй като химията на най-важните d-елементи за метаболизма се описва до голяма степен от координационните връзки.
Фиг. 5.
По правило в сложно съединение металният атом действа като акцептор на електронна двойка; напротив, при йонни и ковалентни връзки металният атом е донор на електрони.
Същността на ковалентната връзка и нейното разнообразие - координационната връзка - могат да бъдат изяснени с помощта на друга теория за киселините и основите, предложена от GN. Луис. Той донякъде разшири концепцията за термините "киселина" и "основа" според теорията на Бронстед-Лоури. Теорията на Люис обяснява естеството на образуването на сложни йони и участието на веществата в реакциите на нуклеофилно заместване, тоест при образуването на CS.
Според Луис киселината е вещество, способно да образува ковалентна връзка, като приема електронна двойка от база. Базата на Люис е вещество, което има самотна електронна двойка, която, отдавайки електрони, образува ковалентна връзка с Люизинова киселина.
Тоест теорията на Люис разширява обхвата на киселинно-основните реакции и до реакции, в които протоните изобщо не участват. Освен това самият протон, според тази теория, също е киселина, тъй като е в състояние да приеме електронна двойка.
Следователно, според тази теория, катионите са киселини на Люис, а анионите са бази на Люис. Пример са следните реакции:
По-горе беше отбелязано, че подразделянето на веществата на йонни и ковалентни е относително, тъй като не се осъществява пълен преход на електрон от метални атоми към акцепторни атоми в ковалентни молекули. В съединения с йонни връзки всеки йон е в електрическото поле на йони с противоположен знак, така че те са взаимно поляризирани и техните обвивки се деформират.
Поляризацияопределя се от електронната структура, заряда и размера на йона; той е по-висок за аниони, отколкото за катиони. Най-високата поляризуемост сред катионите е за катиони с по-голям заряд и по-малък размер, например за Hg 2+, Cd 2+, Pb 2+, Al 3+, Tl 3+... Има силен поляризиращ ефект Х+. Тъй като влиянието на йонната поляризация е двустранно, то значително променя свойствата на образуваните от тях съединения.
Третият тип връзка едипол-дипол Връзка
Освен изброените видове комуникация има и дипол-дипол междумолекулнавзаимодействия, наричани още вандерваалс .
Силата на тези взаимодействия зависи от природата на молекулите.
Има три вида взаимодействия: постоянен дипол - постоянен дипол ( дипол-диполатракция); постоянен дипол - индуциран дипол ( индукцияатракция); моментен дипол - индуциран дипол ( дисперсионенгравитацията или лондонските сили; ориз. 6).
Ориз. 6.
Само молекули с полярни ковалентни връзки ( HCl, NH3, SO2, H2O, C6H5Cl), а силата на свързване е 1-2 дебая(1D = 3,338 × 10 ‑30 кулона - Kl × m).
В биохимията се разграничава друг вид връзка - водород ограничаваща връзка дипол-диполатракция. Тази връзка се образува чрез привличане между водороден атом и малък електроотрицателен атом, най-често кислород, флуор и азот. При големи атоми, които имат подобна електроотрицателност (например с хлор и сяра), водородната връзка е много по-слаба. Водородният атом се различава по една съществена характеристика: когато свързващите електрони се изтеглят назад, неговото ядро - протонът - се излага и престава да бъде екранирано от електрони.
Следователно атомът се превръща в голям дипол.
Водородната връзка, за разлика от връзката на Ван дер Ваалс, се образува не само по време на междумолекулни взаимодействия, но и в рамките на една молекула - интрамолекулноводородна връзка. Водородни връзкииграят важна роля в биохимията, например за стабилизиране на структурата на протеините под формата на а-спирала или за образуване на двойна спирала на ДНК (фиг. 7).
Фиг. 7.
Водородните и ван дер Ваалсовите връзки са много по-слаби от йонните, ковалентните и координационните връзки. Енергията на междумолекулните връзки е посочена в табл. 1.
Маса 1.Енергия на междумолекулните сили
Забележка: Степента на междумолекулните взаимодействия отразява енталпията на топене и изпаряване (кипене). Йонните съединения изискват значително повече енергия за разделяне на йони, отколкото за разделяне на молекули. Енталпията на топене на йонните съединения е много по-висока от тази на молекулярните съединения.
Четвъртият тип връзка еметална връзка
И накрая, има друг тип междумолекулни връзки - метални: свързване на положителни йони на решетката на металите със свободни електрони. Този тип връзка не се среща в биологичните обекти.
От кратък преглед на видовете връзки става ясна една подробност: важен параметър на атом или метален йон - донор на електрони, както и на атом - акцептор на електрони, е неговият размерът.
Без да навлизаме в подробности, отбелязваме, че ковалентните радиуси на атомите, йонните радиуси на металите и радиусите на Ван дер Ваалс на взаимодействащите молекули се увеличават с увеличаване на техния порядков номер в групите на периодичната система. В този случай стойностите на радиусите на йоните са най-малки, а стойностите на радиусите на Ван дер Ваалс са най-големи. По правило при движение надолу по групата се увеличават радиусите на всички елементи, както ковалентни, така и ван дер Ваалс.
Най-важни за биолозите и лекарите са координиране(донор-акцептор) връзки, разглеждани от координационната химия.
Медицински бионеорганични вещества. Г.К. Барашков
Атомите на повечето елементи не съществуват отделно, тъй като могат да взаимодействат един с друг. Това взаимодействие създава по-сложни частици.
Природата на химичната връзка е действието на електростатичните сили, които са силите на взаимодействие между електрическите заряди. Такива заряди имат електроните и атомните ядра.
Електроните, разположени на външните електронни нива (валентни електрони), които са най-отдалечени от ядрото, взаимодействат най-слабо с него и следователно са в състояние да се отделят от ядрото. Те са отговорни за свързването на атомите един с друг.
Видове взаимодействия в химията
Видовете химични връзки могат да бъдат представени под формата на следната таблица:
Характеристика на йонната връзка
 Химично взаимодействие, което се образува поради привличане на йонис различни заряди се нарича йонен. Това се случва, ако свързаните атоми имат значителна разлика в електроотрицателността (тоест способността да привличат електрони) и електронната двойка отива към по-електроотрицателен елемент. Резултатът от такъв преход на електрони от един атом към друг е образуването на заредени частици - йони. Между тях възниква привличане.
Химично взаимодействие, което се образува поради привличане на йонис различни заряди се нарича йонен. Това се случва, ако свързаните атоми имат значителна разлика в електроотрицателността (тоест способността да привличат електрони) и електронната двойка отива към по-електроотрицателен елемент. Резултатът от такъв преход на електрони от един атом към друг е образуването на заредени частици - йони. Между тях възниква привличане.
Най-ниски показатели за електроотрицателност притежават типични метали, а най-големите са типични неметали. По този начин йоните се образуват от взаимодействия между типични метали и типични неметали.
Металните атоми се превръщат в положително заредени йони (катиони), дарявайки електрони на външни електронни нива, а неметалните поемат електрони, като по този начин се превръщат в отрицателно зареденийони (аниони).
Атомите преминават в по-стабилно енергийно състояние, завършвайки електронните си конфигурации.
Йонната връзка е ненасочена и ненаситена, тъй като електростатичното взаимодействие се случва във всички посоки, съответно йонът може да привлича йони с противоположния знак във всички посоки.
Подреждането на йоните е такова, че около всеки има определен брой противоположно заредени йони. Концепцията за "молекула" за йонни съединения няма смисъл.
Примери за образование
 Образуването на връзка в натриев хлорид (nacl) се дължи на прехвърлянето на електрон от Na атома към Cl атома с образуването на съответните йони:
Образуването на връзка в натриев хлорид (nacl) се дължи на прехвърлянето на електрон от Na атома към Cl атома с образуването на съответните йони:
Na 0 - 1 e = Na + (катион)
Cl 0 + 1 e = Cl - (анион)
В натриевия хлорид има шест хлорни аниона около натриевите катиони и шест натриеви йона около всеки хлорен йон.
По време на образуването на взаимодействие между атомите в бариевия сулфид протичат следните процеси:
Ba 0 - 2 e = Ba 2+
S 0 + 2 e = S 2-
Ba отдава своите два електрона на сяра, което води до образуването на серни аниони S 2- и бариеви катиони Ba 2+.
Метална химическа връзка
 Броят на електроните във външните енергийни нива на металите е малък; те лесно се отделят от ядрото. В резултат на това разделяне се образуват метални йони и свободни електрони. Тези електрони се наричат "електронен газ". Електроните се движат свободно в обема на метала и постоянно се свързват и отделят от атомите.
Броят на електроните във външните енергийни нива на металите е малък; те лесно се отделят от ядрото. В резултат на това разделяне се образуват метални йони и свободни електрони. Тези електрони се наричат "електронен газ". Електроните се движат свободно в обема на метала и постоянно се свързват и отделят от атомите.
Структурата на металното вещество е следната: кристалната решетка е гръбнакът на веществото и електроните могат свободно да се движат между неговите възли.
Примерите включват:
Mg - 2e<->Mg 2+
Cs - e<->Cs +
Ca - 2e<->Ca 2+
Fe - 3e<->Fe 3+
Ковалентни: полярни и неполярни
 Най-често срещаният тип химично взаимодействие е ковалентната връзка. Стойностите на електроотрицателността на взаимодействащите елементи не се различават рязко, в това отношение се случва само изместване на общата електронна двойка към по-електроотрицателен атом.
Най-често срещаният тип химично взаимодействие е ковалентната връзка. Стойностите на електроотрицателността на взаимодействащите елементи не се различават рязко, в това отношение се случва само изместване на общата електронна двойка към по-електроотрицателен атом.
Ковалентното взаимодействие може да се образува чрез обменен механизъм или чрез донорно-акцепторно.
Обменният механизъм се реализира, ако всеки от атомите има несдвоени електрони на външните електронни нива и припокриването на атомни орбитали води до появата на двойка електрони, принадлежащи на двата атома. Когато единият от атомите има двойка електрони на външно електронно ниво, а другият има свободна орбитала, тогава когато атомните орбитали се припокриват, електронната двойка се социализира и взаимодейства според механизма донор-акцептор.
Ковалентните са разделени по множество на:
- прости или единични;
- двойно;
- тройна.
Двойките осигуряват социализацията на две двойки електрони наведнъж, а тройките - три.
Според разпределението на електронната плътност (полярността) между свързаните атоми, ковалентната връзка се разделя на:
- неполярни;
- полярни.
Неполярна връзка се образува от едни и същи атоми, а полярната връзка се образува от различна електроотрицателност.
 Взаимодействието на атоми, близки по електроотрицателност, се нарича неполярна връзка. Общата двойка електрони в такава молекула не е привлечена от нито един от атомите, а принадлежи еднакво и на двата.
Взаимодействието на атоми, близки по електроотрицателност, се нарича неполярна връзка. Общата двойка електрони в такава молекула не е привлечена от нито един от атомите, а принадлежи еднакво и на двата.
Взаимодействието на елементи, различаващи се по електроотрицателност, води до образуване на полярни връзки. При този тип взаимодействие общите електронни двойки се привличат от по-електроотрицателен елемент, но не се прехвърлят напълно към него (тоест образуването на йони не се случва). В резултат на такова изместване на електронната плътност върху атомите се появяват частични заряди: на по-електроотрицателния - отрицателен заряд, а на по-малко - положителен.
Свойства и характеристики на ковалентността
Основни характеристики на ковалентната връзка:
- Дължината се определя от разстоянието между ядрата на взаимодействащите атоми.
- Полярността се определя от изместването на електронния облак към един от атомите.
- Насоченост - свойството да образуват пространствено ориентирани връзки и съответно молекули, които имат определени геометрични форми.
- Насищането се определя от способността за образуване на ограничен брой връзки.
- Поляризацията се определя от способността да се променя полярността при излагане на външно електрическо поле.
- Енергията, необходима за прекъсване на връзката, която определя нейната сила.
 Пример за ковалентно неполярно взаимодействие могат да бъдат молекули на водород (H2), хлор (Cl2), кислород (O2), азот (N2) и много други.
Пример за ковалентно неполярно взаимодействие могат да бъдат молекули на водород (H2), хлор (Cl2), кислород (O2), азот (N2) и много други.
H + H → H-H молекулаима единична неполярна връзка,
O: +: O → O = O молекулата има двойна неполярна,
Ṅ: + Ṅ: → N≡N молекулата има тройна неполярна.
Като примери за ковалентни връзки химични елементиможете да донесете молекули на въглероден диоксид (CO2) и въглероден оксид (CO) газ, сероводород (H2S), на солна киселина(HCL), вода (H2O), метан (CH4), серен оксид (SO2) и много други.
В молекулата на CO2 връзката между въглеродните и кислородните атоми е ковалентно полярна, тъй като по-електроотрицателният водород привлича електронната плътност. Кислородът има два несдвоени електрона на външно ниво, а въглеродът може да осигури четири валентни електрона за образуване на взаимодействия. В резултат на това се образуват двойни връзки и молекулата изглежда така: O = C = O.
За да се определи вида на връзката в конкретна молекула, достатъчно е да се разгледат атомите, които я изграждат. Прости вещества, метали образуват метални, метали с неметали - йонни, прости веществанеметалите са ковалентни неполярни, а молекулите, състоящи се от различни неметали, се образуват чрез ковалентна полярна връзка.
Научихте как атомите на металните елементи и неметалните елементи взаимодействат помежду си (електроните преминават от първия към втория), както и атомите на неметалните елементи един с друг (несдвоените електрони на външните електронни слоеве техните атоми се комбинират в общи електронни двойки). Сега ще се запознаем с това как атомите на металните елементи взаимодействат един с друг. Металите обикновено не съществуват като изолирани атоми, а като слитък или метален продукт. Какво държи металните атоми в един обем?
Атомите на повечето метални елементи на външното ниво съдържат малък брой електрони - 1, 2, 3. Тези електрони лесно се откъсват, а атомите се превръщат в положителни йони. Отделените електрони се движат от един йон към друг, свързвайки ги в едно цяло.
Просто е невъзможно да се разбере кой електрон на кой атом принадлежи. Всички отделени електрони станаха общи. Комбинирайки се с йони, тези електрони временно образуват атоми, след което отново се откъсват и се комбинират с друг йон и т.н. Процесът продължава безкрайно, което може да бъде изобразено на диаграмата:
Следователно в по-голямата част от метала атомите непрекъснато се трансформират в йони и обратно. Те също се наричат атомни йони.
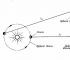
Фигура 41 показва схематично структурата на фрагмент от натриев метал. Всеки натриев атом е заобиколен от осем съседни атома.

Ориз. 41.
Диаграма на структурата на фрагмент от кристален натрий
Отделените външни електрони се движат свободно от един образуван йон към друг, съединявайки, сякаш залепвайки, ядрото на натриевия йон в един гигантски метален кристал (фиг. 42).

Ориз. 42.
Схема на метална връзка
Металната връзка има известна прилика с ковалентната връзка, тъй като се основава на споделянето на външни електрони. Въпреки това, по време на образуването на ковалентна връзка външните несдвоени електрони само на два съседни атома се социализират, докато когато се образува метална връзка, всички атоми участват в социализацията на тези електрони. Ето защо кристалите с ковалентна връзка са крехки, докато кристалите с метална връзка обикновено са пластични, електропроводими и имат метален блясък.
Фигура 43 показва древна златна фигурка на елен, която е на повече от 3,5 хиляди години, но не е загубила благородния метален блясък, характерен за златото - този най-пластичен от металите.

ориз. 43. Златен елен. VI век пр.н.е NS
Металната връзка е характерна както за чисти метали, така и за смеси от различни метали - сплави в твърдо и течно състояние. Въпреки това, в състояние на пара, металните атоми са свързани помежду си чрез ковалентна връзка (например, натриевите пари се използват за пълнене на жълти лампи за осветяване на улиците на големите градове). Металните двойки са изградени от отделни молекули (едноатомни и двуатомни).
Въпросът за химичните връзки е централният въпрос на химичната наука. Запознахте се с първоначалното разбиране за видовете химични връзки. В бъдеще ще научите много интересни неща за природата на химичните връзки. Например, че в повечето метали освен металната връзка има и ковалентна връзка, че има и други видове химични връзки.
Ключови думи и фрази
- Метална връзка.
- Атомни йони.
- Споделени електрони.
Работа с компютър
- Говоря с електронно приложение... Проучете материала от урока и изпълнете предложените задачи.
- Потърсете в интернет имейл адреси, които могат да служат допълнителни източници, разкривайки съдържанието на ключовите думи и фрази на параграфа. Предложете да помогнете на учителя да подготви нов урок - направете съобщение на ключови думии фрази от следващия параграф.
Въпроси и задачи
- Металната връзка има характеристики, подобни на ковалентната връзка. Сравнете тези химични връзки една с друга.
- Металната връзка има характеристики, подобни на йонната връзка. Сравнете тези химични връзки една с друга.
- Как може да се увеличи твърдостта на металите и сплавите?
- По формулите на веществата определете вида на химичната връзка в тях: Ва, ВаВr 2, НВr, Вr 2.
Металната връзка е връзка, образувана между атоми при условия на силно изразена делокализация (разпространение на валентни електрони през няколко химични връзки в съединение) и дефицит на електрони в атом (кристал). Той е ненаситен и пространствено ненасочен.
Делокализацията на валентните електрони в металите е следствие от многоцентровата природа на металната връзка. Многоцентровата природа на металната връзка осигурява висока електрическа и топлопроводимост на металите.
Насищаемост определя се от броя на валентните орбитали, участващи в образуването на хим. комуникация. Количествената характеристика е валентност. Валентността е броят на връзките, които един атом може да образува с други; - се определя от броя на валентните орбитали, участващи в образуването на връзки от обменните и донорно-акцепторни механизми.
Фокус - връзката се образува в посока на максималното припокриване на електронни облаци; - определя химичната и кристалохимичната структура на веществото (как са свързани атомите в кристална решетка).
Когато се образува ковалентна връзка, електронната плътност се концентрира между взаимодействащите атоми (рисуване от тетрадка)... В случай на метална връзка, електронната плътност е делокализирана в целия кристал. (рисуване от тетрадка)
(пример от тетрадка)
Поради ненаситеността и ненасочеността на металната връзка, металните тела (кристали) са силно симетрични и силно координирани. По-голямата част от кристалните структури на метала съответстват на 3 вида атомна опаковка в кристали:
1. HCC- граната-центрирана кубична плътно опакована структура. Плътност на опаковката - 74.05%, координационен номер = 12.
2. графичен процесор- шестоъгълна плътно уплътнена структура, плътност на опаковане = 74,05%, c.h. = 12.
3. Ск- обемът е центриран, плътност на опаковката = 68,1%, c.h. = 8.
Металната връзка не изключва известна степен на ковалентност. Чиста метална връзка е характерна само за алкални и алкалоземни метали.
Чиста метална връзка се характеризира с енергия от порядъка на 100/150/200 kJ / mol, което е 4 пъти по-слабо от ковалентната връзка.
36. Хлор и неговите свойства. B = 1 (III, IV, V и VII) етап на окисление = 7, 6, 5, 4, 3, 1, −1
жълто-зелен газ с остра дразнеща миризма. Хлорът се среща в природата само под формата на съединения. В природата, под формата на калиев хлорид, магнезий, нитрий, образувани в резултат на изпаряване на бивши морета и езера. Получаване.об: 2NaCl + 2H2O = 2NaOH + H2 + Cl2, електролиза на води на разтвори на хлориди Ме. въглерод, азот, кислород, инертни газове), замества водорода пред НС и свързва ненаситени съединения, измества брома и йода от техните съединения. Фосфор се запалва в атмосфера на хлор PCl3, а при по-нататъшно хлориране - PCl5; сяра с хлор = S2Сl2, SCl2 и други SnClm. Смес от хлор с водород изгаря.С кислород хлорът образува оксиди: Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8, както и хипохлорити (соли на хипохлорна киселина), хлорити, хлорати и перхлорати. Всички оксигенирани хлорни съединения образуват експлозивни смеси с лесно окисляеми вещества. Хлорните оксиди са нестабилни и могат да експлодират спонтанно, хипохлоритите се разлагат бавно по време на съхранение, хлоратите и перхлоратите могат да експлодират под въздействието на инициатори. във вода - хипохлорна и солена: Сl2 + Н2О = НСlО + НСl. При хлориране на водни разтвори на алкали в студа се образуват хипохлорити и хлориди: 2NаОН + Сl2 = NaСlO + NaСl + Н2О, а при нагряване - хлорати. Когато амонякът взаимодейства с хлора, се образува азотен трихлорид. интерхалогенни съединения с други халогени. Флуоридите ClF, ClF3, ClF5 са много реактивни; например стъклената вата се запалва спонтанно в атмосфера на ClF3. Известни съединения на хлора с кислород към флуор - хлорни оксифлуориди: СlО3F, СlО2F3, СlOF, СlОF3 и флуорен перхлорат FСlO4. Приложение:производство на химични съединения, пречистване на вода, синтези в храни, фармацевтични промишлени бактерициди, антисептики, избелване на хартии, платове, пиротехника, кибрит, унищожава плевели в селското стопанство.
Биологична роля: биогенен, компонент на растителните и животинските тъкани. 100 г е основното осмотично активно вещество на кръвната плазма, лимфата, гръбначно-мозъчната течност и някои тъкани Натриев хлорид на ден = 6-9 г-хляб, месо и млечни продукти. Играе роля във водно-солевия метаболизъм, като допринася за задържането на вода от тъканите. Регулирането на киселинно-алкалния баланс в тъканите се осъществява заедно с други процеси чрез промяна на разпределението на хлора между кръвта и другите тъкани, хлорът участва в обмен на енергияв растенията, активирайки както окислителното фосфорилиране, така и фотофосфорилирането. Хлорът има положителен ефект върху усвояването на кислорода от корените, компонент на железния сок.
37. Водород, вода B = 1; st.оксиди = + 1-1 Водородният йон е напълно лишен от електронни обвивки, може да се приближава на много близки разстояния и да прониква в електронните обвивки.
Най-често срещаният елемент във Вселената. Той съставлява по-голямата част от Слънцето, звездите и други космически тела.В свободно състояние на Земята се среща сравнително рядко – съдържа се в нефт и горими газове, присъства под формата на включвания в някои минерали, голяма част в състава на водата. Получаване: 1. Лаборатория Zn + 2HCl = ZnCl2 + H2; 2.Si + 2NaOH + H2O = Na2SiO3 + 2H2; 3. Al + NaOH + H 2 O = Na (AlOH) 4 + H 2. 4. В индустрията: преобразуване, електролиза: CH4 + H2O = CO + 3H2 \ CO + H2O = CO + Х2 / Хим св-ва.В n.s.: H 2 + F 2 = 2HF. При облъчване, осветяване, катализатори: H 2 + O 2, S, N, P = H 2 O, H 2 S, NH 3, Ca + H2 = CaH2 \ F2 + H2 = 2HF \ N2 + 3H2 → 2NH3 \ Cl2 + H2 → 2HCl, 2NO + 2H2 = N2 + 2H2O, CuO + H2 = Cu + H2O, CO + H2 = CH3OH. Водородът образува хидриди: йонни, ковалентни и метални. До йонна –NaH - &, CaH 2 - & + H 2 O = Ca (OH) 2; NaH + H 2 O = NaOH + H 2. Ковалентен –B 2 H 6, AlH 3, SiH 4. Металик - с d-елементи; променлив състав: MeH ≤1, MeH ≤2 - проникват в кухини между атомите.Провеждат топлина, ток, твърдо вещество. WATER.sp3-хибридна силно полярна молекула под ъгъл 104,5 , диполи, най-разпространеният разтворител Водата реагира при стайна температура: с активни халогени (F, Cl) и интерхалогенни съединения със соли, форми на слаби към-то и слаби основи, предизвиквайки пълната им хидролиза; с анхидриди и халогениди на карбоксилни и неорганични. коте; с активни металургични съединения; с карбиди, нитриди, фосфиди, силициди, хидриди на активен Ме; с много соли, образуващи хидрати; с борани, силани; с кетени, въглероден пероксид; с благородни газови флуориди. Водата реагира при нагряване: с Fe, Mg с въглища, метан; с някои алкилхалогениди. Приложение: водород - синтез на амоняк, метанол, хлороводород, тв.мазнини, водороден пламък - за заваряване, топене, в металургията за редуциране на Me от оксид, гориво за ракети, във фармацията - вода, антисептичен пероксид, бактерицид, измиване, изрусяване на косата , стерилизация.
Биологична роля: водород-7kg, Основната функция на водорода е структурирането на биологичното пространство (вода и водородни връзки) и образуването на различни org молекули (включени в структурата на протеини, въглехидрати, мазнини, ензими).
копиране на ДНК молекула. Водата участва в огромна
броят на биохимичните реакции във всички физиологични и биологични
процеси, осигурява обмена на вещества между организма и външна среда, между
клетки и вътре в клетките. Водата е структурната основа на клетките, тя е необходима за
поддържайки оптималния им обем, той определя пространствената структура и
функции на биомолекулите.