Структура на въглероден окис 4. Въглерод - характеристика на елемента и химични свойства
Физически свойства:въглеродът образува много алотропни модификации: диамант- едно от най-твърдите вещества графит, въглища, сажди.
Въглероден атом има 6 електрона: 1s 2 2s 2 2p 2 . Последните два електрона са разположени на отделни p-орбитали и са несдвоени. По принцип тази двойка може да заема една орбитала, но в този случай електрон-електронното отблъскване силно се увеличава. Поради тази причина единият от тях взема 2p x, а другият или 2p y , или 2p z-орбитали.
Разликата между енергиите на s- и p-поднивата на външния слой е малка, поради което атомът доста лесно преминава във възбудено състояние, при което един от двата електрона от 2s орбитала преминава в свободния. 2стр.Валентно състояние с конфигурация 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Именно това състояние на въглеродния атом е характерно за диамантената решетка - тетраедричното пространствено разположение на хибридните орбитали, еднаква дължина на връзката и енергия.
Известно е, че това явление се нарича sp 3 -хибридизация,и възникващите функции са sp 3 -хибридни . Образуването на четири sp 3 връзки осигурява на въглеродния атом по-стабилно състояние от три п-п-и една s-s-връзка. В допълнение към sp 3 хибридизация при въглеродния атом, sp 2 и sp хибридизация също се наблюдава . В първия случай има взаимно припокриване с-и две p-орбитали. Образуват се три еквивалентни sp 2 - хибридни орбитали, разположени в една равнина под ъгъл от 120 ° една спрямо друга. Третата орбитала p е непроменена и насочена перпендикулярно на равнината sp 2.

По време на sp хибридизация, s и p орбиталите се припокриват. Между двете образувани еквивалентни хибридни орбитали възниква ъгъл от 180°, докато двете p-орбитали на всеки от атомите остават непроменени.

Алотропия на въглерода. Диамант и графит
В графитен кристал въглеродните атоми са разположени в успоредни равнини, заемайки върхове в тях правилни шестоъгълници... Всеки от въглеродните атоми е свързан с три съседни sp2-хибридни връзки. Връзката между успоредните равнини се осъществява от ван дер Ваалсови сили. Свободните p-орбитали на всеки от атомите са насочени перпендикулярно на равнините на ковалентните връзки. Тяхното припокриване обяснява допълнителната π-връзка между въглеродните атоми. Така че от валентно състояние, в което въглеродните атоми са в дадено вещество, свойствата на това вещество зависят.
Химични свойства на въглерода
Най-типичните степени на окисление са +4, +2.
При ниски температури въглеродът е инертен, но при нагряване неговата активност се увеличава.
Въглеродът като редуциращ агент:
- с кислород
C 0 + O 2 - t ° = CO 2 въглероден диоксид
при липса на кислород - непълно изгаряне:
2C 0 + O 2 - t ° = 2C +2 O въглероден оксид
- с флуор
C + 2F 2 = CF 4
- с водна пара
C 0 + H 2 O - 1200 ° = C +2 O + H 2 воден газ
- с метални оксиди. Така металът се топи от руда.
C 0 + 2CuO - t ° = 2Cu + C +4 O 2
- с киселини - окислители:
C 0 + 2H 2 SO 4 (конц.) = C +4 O 2 + 2SO 2 + 2H 2 O
C 0 + 4HNO 3 (конц.) = C +4 O 2 + 4NO 2 + 2H 2 O
- образува въглероден дисулфид със сяра:
C + 2S 2 = CS 2.
Въглеродът като окислител:
- образува карбиди с някои метали
4Al + 3C 0 = Al 4 C 3
Ca + 2C 0 = CaC 2 -4
- с водород - метан (както и огромно количество органични съединения)
C0 + 2H2 = CH4
- със силиций, образува карборунд (при 2000 ° C в електрическа пещ):
Намиране на въглерод в природата
Свободният въглерод се среща под формата на диамант и графит. Под формата на съединения въглеродът е в състава на минерали: креда, мрамор, варовик - CaCO 3, доломит - MgCO 3 * CaCO 3; хидрокарбонати - Mg (HCO 3) 2 и Ca (HCO 3) 2, CO 2 е част от въздуха; въглеродът е основният компонент на естествените органични съединения - газ, нефт, въглища, торф, е част от органична материя, протеини, мазнини, въглехидрати, аминокиселини, които изграждат живите организми.

Неорганични въглеродни съединения
Нито С4+, нито С4- йони се образуват при никакви обикновени химични процеси: във въглеродните съединения има ковалентни връзки с различна полярност.
въглероден оксид (II) CO
Въглероден окис; безцветен, без мирис, слабо разтворим във вода, разтворим в органични разтворители, отровен, температура на бала = -192°C; т мн.ч. = -205°C.
Получаване
1) В промишлеността (в газовите генератори):
C + O 2 = CO 2
2) В лабораторията - чрез термично разлагане на мравчена или оксалова киселина в присъствието на H 2 SO 4 (конц.):
HCOOH = H2O + CO
H 2 C 2 O 4 = CO + CO 2 + H 2 O
Химични свойства
CO е инертен при нормални условия; при нагряване - редуциращ агент; несолеобразуващ оксид.
1) с кислород
2C +2 O + O 2 = 2C +4 O 2
2) с метални оксиди
C +2 O + CuO = Cu + C +4 O 2
3) с хлор (на светлина)
CO + Cl 2 - hn = COCl 2 (фосген)
4) реагира с алкални стопилки (под налягане)
CO + NaOH = HCOONa (натриев формиат)
5) образува карбонили с преходни метали
Ni + 4CO - t° = Ni (CO) 4
Fe + 5CO - t° = Fe (CO) 5
Въглероден оксид (IV) CO2
Въглероден диоксид, безцветен, без мирис, разтворимост във вода - 0.9V CO 2 се разтваря в 1V H 2 O (при нормални условия); по-тежък от въздуха; t ° pl. = -78,5 ° C (твърдият CO 2 се нарича "сух лед"); не поддържа горенето.
Получаване
- Термично разлагане на соли на въглеродната киселина (карбонати). Печене на варовик:
CaCO 3 - t ° = CaO + CO 2
- Действието на силните киселини върху карбонатите и бикарбонатите:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
химическиИмотиCO2
Киселинен оксид: Реагира с основни оксиди и основи, за да образува соли на въглеродната киселина
Na 2 O + CO 2 = Na 2 CO 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 = NaHCO 3
Може да прояви окислителни свойства при повишени температури
С +4 O 2 + 2Mg - t ° = 2Mg +2 O + C 0
Качествена реакция
Мътност на варовата вода:
Ca (OH) 2 + CO 2 = CaCO 3 ¯ (бяла утайка) + H 2 O
Изчезва при продължително преминаване на СО 2 през варовита вода, т.к неразтворимият калциев карбонат се трансформира в разтворим бикарбонат:
CaCO 3 + H 2 O + CO 2 = Ca (HCO 3) 2
Въглеродната киселина и нейнитесол
H 2CO 3 -Киселината е слаба, съществува само във воден разтвор:
CO 2 + H 2 O ↔ H 2 CO 3
Двуосновни:
H 2 CO 3 ↔ H + + HCO 3 - Киселинни соли - бикарбонати, въглеводороди
HCO 3 - ↔ H + + CO 3 2- Средни соли - карбонати
Всички свойства на киселините са характерни.
Карбонатите и въглеводородите могат да се превръщат един в друг:
2NaHCO3 - t° = Na 2 CO 3 + H 2 O + CO 2
Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO3
Метални карбонати (освен алкални метали) при нагряване те се декарбоксилират, за да образуват оксид:
CuCO 3 - t ° = CuO + CO 2
Качествена реакция- "кипене" под действието на силна киселина:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CO 3 2- + 2H + = H 2 O + CO 2
Карбиди
калциев карбид:
CaO + 3 C = CaC 2 + CO
CaC 2 + 2 H 2 O = Ca (OH) 2 + C 2 H 2.
Ацетиленът се освобождава, когато карбидите на цинк, кадмий, лантан и церий реагират с вода:
2 LaC 2 + 6 H 2 O = 2La (OH) 3 + 2 C 2 H 2 + H 2.
Be 2 C и Al 4 C 3 се разлагат с вода, за да образуват метан:
Al 4 C 3 + 12 H 2 O = 4 Al (OH) 3 = 3 CH 4.
В технологията се използват титанови карбиди TiC, волфрам W 2 C (твърди сплави), силициев SiC (карборунд като абразив и материал за нагреватели).
цианид
получен чрез нагряване на сода в атмосфера от амоняк и въглероден оксид:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Циановодородната киселина HCN е важен продукт на химическата промишленост и се използва широко в органичния синтез. Световното му производство достига 200 хиляди тона годишно. Електронната структура на цианидния анион е подобна на въглеродния оксид (II), такива частици се наричат изоелектронни:
° С = О: [: C = Н:] -
цианиди (0,1-0,2% воден разтвор) се използват при добива на злато:
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K + 2 KOH.
При кипене на разтвори на цианид със сяра или сливане на твърди вещества, тиоцианати:
KCN + S = KSCN.
При нагряване на цианиди от нискоактивни метали се получава цианоген: Hg (CN) 2 = Hg + (CN) 2. Цианидните разтвори се окисляват до цианати:
2 KCN + O 2 = 2 KOCN.
Цианова киселина се предлага в две форми:
H-N = C = О; H-O-C = Н:
През 1828 г. Фридрих Вьолер (1800-1882) получава урея от амониев цианат: NH 4 OCN = CO (NH 2) 2 чрез изпаряване на воден разтвор.
Това събитие обикновено се разглежда като победа на синтетичната химия над "виталистичната теория".
Има изомер на цианова киселина - летлива киселина
H-O-N = C.
Неговите соли (експлозивен живак Hg (ONC) 2) се използват в ударни възпламенители.
Синтез урея(урея):
CO 2 + 2 NH 3 = CO (NH 2) 2 + H 2 O. При 130 0 С и 100 атм.
Уреята е амид на въглеродната киселина, има и нейният "азотен аналог" - гуанидин.
Карбонати
Най-важните неорганични съединениявъглерод - соли на въглеродната киселина (карбонати). H 2 CO 3 е слаба киселина (K 1 = 1,3 · 10 -4; K 2 = 5 · 10 -11). Подпори за карбонатен буфер равновесие на въглероден диоксидв атмосферата. Океаните имат огромен буферен капацитет, защото са отворена система... Основната буферна реакция е равновесие в дисоциацията на въглеродната киселина:
H 2 CO 3 ↔ H + + HCO 3 -.
С намаляване на киселинността се получава допълнително усвояване на въглероден диоксид от атмосферата с образуването на киселина:
CO 2 + H 2 O ↔ H 2 CO 3.
С повишаване на киселинността настъпва разтваряне на карбонатни скали (черупки, креда и варовикови отлагания в океана); това компенсира загубата на хидрокарбонатни йони:
H + + CO 3 2- ↔ HCO 3 -
CaCO 3 (твърд) ↔ Ca 2+ + CO 3 2-
Твърдите карбонати се превръщат в разтворими хидрокарбонати. Именно този процес на химическо разтваряне на излишния въглероден диоксид противодейства на "парниковия ефект" - глобалното затопляне поради усвояването на въглероден диоксид топлинно излъчванеЗемята. Около една трета от содата в света (натриев карбонат Na 2 CO 3) се използва в производството на стъкло.
въглерод
В свободно състояние въглеродът образува 3 алотропни модификации: диамант, графит и изкуствено произведен карбин.
В диамантен кристал всеки въглероден атом е плътно ковалентно свързан с четири други, разположени около него на равни разстояния.
Всички въглеродни атоми са в състояние на sp3-хибридизация. Атомната кристална решетка на диаманта има тетраедрична структура.
Диамантът е безцветно, прозрачно вещество, което силно пречупва светлината. Той има най-високата твърдост сред всички известни вещества. Диамантът е крехък, огнеупорен, лошо провежда топлина и електрически ток. Малките разстояния между съседни въглеродни атоми (0,154 nm) водят до доста висока плътност на диаманта (3,5 g / cm 3).
В кристалната решетка на графита всеки въглероден атом е в състояние на sp2-хибридизация и образува три силни ковалентни връзки с въглеродни атоми, разположени в същия слой. Три електрона на всеки атом, въглерод, участват в образуването на тези връзки, а четвъртите валентни електрони образуват n-връзки и са относително свободни (подвижни). Те определят електрическата и топлопроводимостта на графита.
Дължината на ковалентната връзка между съседни въглеродни атоми в една и съща равнина е 0,152 nm, а разстоянието между С атомите в различните слоеве е 2,5 пъти по-голямо, така че връзките между тях са слаби.
Графитът е непрозрачна, мека, мазна на допир субстанция със сиво-черен цвят с метален блясък; провежда добре топлина и електрически ток. Графитът има по-ниска плътност в сравнение с диаманта и лесно се разделя на тънки люспи.
Неуредената структура на финокристалния графит е в основата на структурата различни формиаморфен въглерод, най-важните от които са кокс, кафяви и битуминозни въглища, сажди, активен (активен) въглен.
Тази алотропна модификация на въглерода се получава чрез каталитично окисление (дехидрополикондензация) на ацетилен. Carbyne е верижен полимер, който има две форми:
C = C-C = C -... и ... = C = C = C =
Carbyne има полупроводникови свойства.
При обикновени температури и двете въглеродни модификации (диамант и графит) са химически инертни. Финокристалните форми на графит - кокс, сажди, активен въглен - са по-реактивни, но като правило след предварително загряване до висока температура.
1. Взаимодействие с кислород
C + O 2 = CO 2 + 393,5 kJ (над O 2)
2C + O 2 = 2CO + 221 kJ (с липса на O 2)
Горещите въглища са един от най-важните източници на енергия.
2. Взаимодействие с флуор и сяра.
C + 2F 2 = CF 4 въглероден тетрафлуорид
C + 2S = CS 2 въглероден дисулфид
3. Коксът е един от най-важните редуциращи агенти, използвани в индустрията. В металургията с негова помощ металите се получават от оксиди, например:
ЗС + Fe 2 O 3 = 2Fe + ЗСО
C + ZnO = Zn + CO
4. Когато въглеродът взаимодейства с оксиди на алкални и алкалоземни метали, редуцираният метал се комбинира с въглерод, за да образува карбид. Например: ZC + CaO = CaC 2 + CO калциев карбид
5. Коксът се използва и за получаване на силиций:
2С + SiO2 = Si + 2СО
6. При излишък от кокс се образува силициев карбид (карборунд) SiC.
Получаване на "воден газ" (газификация на твърдо гориво)
Преминаването на водна пара през горещи въглища произвежда горима смес от CO и H 2, наречена воден газ:
C + H 2 O = CO + H 2
7. Реакции с окислителни киселини.
Активният въглен или въглен, когато се нагрява, намалява анионите NO 3 - и SO 4 2- от концентрирани киселини:
C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O
C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O
8. Реакции с разтопени нитрати на алкални метали
При топенето на KNO 3 и NaNO 3 натрошените въглища изгарят интензивно с образуването на заслепяващ пламък:
5C + 4KNO 3 = 2K 2 CO 3 + 3CO 2 + 2N 2
1. Образуване на солеподобни карбиди с активни метали.
Значително отслабване на неметалните свойства на въглерода се изразява във факта, че неговите функции като окислител се проявяват в много по-малка степен от редуциращите функции.
2. Само при реакции с активни метали въглеродните атоми преминават в отрицателно заредени йони C -4 и (C = C) 2-, образувайки солеподобни карбиди:
ЗС + 4Al = Аl 4 С 3 алуминиев карбид
2C + Ca = CaC 2 калциев карбид
3. Карбидите от йонен тип са много нестабилни съединения, те лесно се разлагат под действието на киселини и вода, което показва нестабилността на отрицателно заредените въглеродни аниони:
Al 4 C 3 + 12H 2 O = 3CH 4 + 4Al (OH) 3
CaC 2 + 2H 2 O = C 2 H 2 + Ca (OH) 2
4. Образуване на ковалентни съединения с метали
В стопилки на смеси от въглерод с преходни метали карбидите се образуват предимно с ковалентен тип връзка. Техните молекули имат променлив състав, а веществата като цяло са близки до сплавите. Такива карбиди са много устойчиви; те са химически инертни по отношение на вода, киселини, основи и много други реагенти.
5. Взаимодействие с водород
При високи T и P, в присъствието на никелов катализатор, въглеродът се комбинира с водород:
C + 2H 2 → CH 4
Реакцията е много обратима и непрактична.
въглероден оксид (II)- CO
(въглероден окис, въглероден окис, въглероден окис)
Физически свойства:безцветен отровен газ, без вкус и мирис, гори със синкав пламък, по-лек е от въздуха, слабо разтворим във вода. Концентрацията на въглероден окис във въздуха е 12,5-74% експлозивна.
Получаване:
1) В индустрията
C + O 2 = CO 2 + 402 kJ
CO 2 + C = 2CO - 175 kJ
В газовите генератори водната пара понякога се издухва през горещи въглища:
C + H 2 O = CO + H 2 - Q,
смес CO + H 2 - наречена синтез газ.
2) В лабораторията- термично разлагане на мравчена или оксалова киселина в присъствието на H 2 SO 4 (конц.):
HCOOH t˚C, H2SO4 → H2O + CO
H 2 C 2 O 4 t˚C, H2SO4 → CO + CO 2 + H 2 O
Химични свойства:
CO е инертен при нормални условия;при нагряване - редуциращ агент;
CO - несолеобразуващ оксид.
1) с кислород
2C +2 O + O 2 t ˚ C → 2C +4 O 2
2) с метални оксиди CO + Me x O y = CO 2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O 2
3) с хлор (на светлина)
CO + Cl 2 светлина → COCl 2 (фосгенът е отровен газ)
4) * реагира с алкални стопилки (под налягане)
CO + NaOH P → HCOONa (натриев формиат)
Ефектът на въглеродния оксид върху живите организми:
Въглеродният оксид е опасен, защото прави невъзможно кръвта да пренася кислород до жизненоважни органи като сърцето и мозъка. Въглеродният оксид се комбинира с хемоглобина, който пренася кислород до клетките на тялото, което го прави неподходящ за транспортиране на кислород. В зависимост от вдишаното количество въглеродният оксид нарушава координацията, обостря сърдечно-съдовите заболявания и причинява умора, главоболие, слабост.Ефектът на въглеродния оксид върху човешкото здраве зависи от неговата концентрация и времето на излагане в организма. Концентрация на въглероден оксид във въздуха над 0,1% води до смърт в рамките на един час, а концентрация над 1,2% в рамките на три минути.
Приложение на въглероден оксид:
Въглеродният окис се използва главно като горим газ, смесен с азот, така нареченият генератор или въздушен газ, или воден газ, смесен с водород. В металургията за извличане на метали от техните руди. За получаване на метали с висока чистота чрез разлагане на карбонили.
Въглероден оксид (IV) СO2 - въглероден диоксид
Физически свойства:Въглероден диоксид, безцветен, без мирис, разтворимост във вода - 0.9V CO 2 се разтваря в 1V H 2 O (при нормални условия); по-тежък от въздуха; t ° pl. = -78,5 ° C (твърдият CO 2 се нарича "сух лед"); не поддържа горенето.
Структура на молекулата:
Въглеродният диоксид има следните електронни и структурни формули:
3. Изгаряне на въглеродни вещества:
CH 4 + 2O 2 → 2H2O + CO2
4. С бавно окисление в биохимичните процеси (дишане, гниене, ферментация)
Химични свойства:
Въглеродни оксиди (II) и (IV)
Интегриран урок по химия и биология
задачи:изучаване и систематизиране на знанията за въглеродните оксиди (II) и (IV); да разкрие връзката между живата и неживата природа; да затвърдят знанията за въздействието на въглеродните оксиди върху човешкото тяло; за затвърждаване на уменията за работа с лабораторно оборудване.
Оборудване: HCl разтвор, лакмус, Ca (OH) 2, CaCO 3, стъклена пръчка, самоделни маси, преносима дъска, модел на топка и пръчка.
ПО ВРЕМЕ НА УРОКИТЕ
Учител по биологиясъобщава темата и целите на урока.
Учител по химия.Въз основа на теорията на ковалентните връзки напишете електронните и структурните формули на въглеродните оксиди (II) и (IV).
Химическата формула на въглеродния оксид (II) е CO, въглеродният атом е в нормалното си състояние.
Поради сдвояването на несдвоени електрони се образуват две ковалентни полярни връзки, а третата ковалентна връзкасе образува от донорно-акцепторния механизъм. Донорът е кислороден атом, т.к осигурява свободна двойка електрони; акцепторът е въглероден атом, тъй като осигурява безплатна орбитала.
В промишлеността въглеродният оксид (II) се получава чрез преминаване на CO 2 върху горещи въглища при висока температура. Образува се и при изгаряне на въглища при липса на кислород. ( Ученик пише уравнението на реакцията на черната дъска)

В лабораторията CO се получава чрез действието на концентрирана H 2 SO 4 върху мравчена киселина. ( Учителят записва уравнението на реакцията.)
![]()
Учител по биология.И така, вие се запознахте с производството на въглероден оксид (II). И какво физични свойствапритежава въглероден окис (II)?
Студент.Това е безцветен газ, отровен, без мирис, по-лек от въздуха, слабо разтворим във вода, точка на кипене -191,5 ° C, втвърдява се при -205 ° C.
Учител по химия.Въглероден окис в количества, опасни за човешки животсъдържащи се в изгорелите газове на автомобилите. Следователно гаражите трябва да бъдат добре вентилирани, особено при стартиране на двигателя.
Учител по биология.Какъв е ефектът на въглеродния оксид върху човешкото тяло?
Студент.Въглеродният окис е изключително токсичен за хората - това се дължи на факта, че образува карбоксихемоглобин. Карбоксихемоглобинът е много силно съединение. В резултат на образуването му кръвният хемоглобин не взаимодейства с кислорода и в случай на тежко отравяне човек може да умре от кислороден глад.
Учител по биология.Каква първа помощ трябва да се окаже на човек в случай на отравяне с въглероден окис?
Студенти.Необходимо е да се извика линейка, жертвата трябва да бъде изведена на улицата, да се направи изкуствено дишане, стаята трябва да бъде добре проветрена.
Учител по химия.Напишете химичната формула на въглеродния оксид (IV) и, като използвате модел с топка и пръчка, изградете нейната структура.
Въглеродният атом е във възбудено състояние. Всичките четири ковалентни полярни връзки се образуват чрез сдвояване на несдвоени електрони. Въпреки това, поради линейната си структура, нейната молекула обикновено е неполярна.
В промишлеността CO 2 се получава от разлагането на калциев карбонат при производството на вар.
(Ученикът записва уравнението на реакцията.)
В лабораторията CO 2 се получава чрез взаимодействието на киселини с тебешир или мрамор.
(Учениците извършват лабораторен експеримент.)

Учител по биология.В резултат на какви процеси се образува въглероден диоксид в тялото?
Студент.Въглеродният диоксид се образува в тялото в резултат на окислителните реакции на органичните вещества, които изграждат клетката.
(Учениците извършват лабораторен експеримент.)

Варовата каша стана мътна т.к образува се калциев карбонат. В допълнение към процеса на дишане, CO2 се отделя в резултат на ферментация и гниене.
Учител по биология.Влияе ли физическата активност на дихателния процес?
Студент.При прекомерно физическо (мускулно) натоварване мускулите използват кислорода по-бързо, отколкото кръвта може да го достави, а след това чрез ферментация синтезират необходимия за тяхната работа АТФ. В мускулите се образува млечна киселина C 3 H 6 O 3, която навлиза в кръвния поток. Натрупването на големи количества млечна киселина е вредно за организма. След тежки физически натоварвания известно време дишаме тежко - плащаме "кислородния дълг".
Учител по химия.Голямо количество въглероден окис (IV) се отделя в атмосферата, когато се изгарят изкопаеми горива. У дома използваме природен газ като гориво и той е почти 90% метан (CH 4). Предлагам един от вас да отиде до черната дъска, да напише уравнението за реакцията и да го анализира от гледна точка на окислително-редукционното.

Учител по биология.Защо газовите фурни не могат да се използват за отопление на стая?
Студент.Метанът е неразделна част природен газ... Когато гори, съдържанието на въглероден диоксид във въздуха се увеличава, а кислородът намалява. ( Работа с таблицата „Съдържание CO 2 във въздуха".)
Когато въздухът съдържа 0,3% CO 2, човек изпитва учестено дишане; при 10% - загуба на съзнание, при 20% - мигновена парализа и бърза смърт. Детето се нуждае особено от чист въздух, тъй като консумацията на кислород от тъканите на растящия организъм е по-голяма от тази на възрастен. Ето защо е необходимо редовно да се проветрява помещението. Ако има излишък от CO 2 в кръвта, възбудимостта на дихателния център се повишава и дишането става по-често и по-дълбоко.
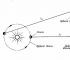
Учител по биология.Помислете за ролята на въглеродния оксид (IV) в живота на растенията.
Студент.При растенията образуването на органична материя става от CO 2 и H 2 O на светлина, освен органичната материя се образува и кислород.

![]()
Фотосинтезата регулира съдържанието на въглероден диоксид в атмосферата, което предотвратява повишаването на температурата на планетата. Растенията поглъщат 300 милиарда тона въглероден диоксид от атмосферата годишно. В процеса на фотосинтеза годишно в атмосферата се отделят 200 милиарда тона кислород. Озонът се образува от кислород по време на гръмотевична буря.
Учител по химия.Обмисли Химични свойствавъглероден оксид (IV).

Учител по биология.Какво е значението на въглеродната киселина в човешкото тяло по време на дишането? ( Фрагмент от филмова лента.)
Ензимите в кръвта превръщат въглеродния диоксид в въглеродна киселина, която се дисоциира на водородни и бикарбонатни йони. Ако кръвта съдържа излишък от Н + йони, т.е. ако киселинността на кръвта е повишена, тогава някои от йоните на Н + се свързват с бикарбонатни йони, образувайки въглеродна киселина и по този начин освобождавайки кръвта от излишните Н + йони. Ако има твърде малко Н + -йони в кръвта, тогава въглеродната киселина се дисоциира и концентрацията на Н + -йони в кръвта се увеличава. При 37 ° C рН на кръвта е 7,36.
В тялото въглеродният диоксид се пренася от кръвта под формата на химични съединения - натриев и калиев бикарбонат.
Осигуряване на материала
Тест
От предложените газообменни процеси в белите дробове и тъканите, тези, които изпълняват първия вариант, трябва да изберат шифрите на верните отговори вляво, а вторият вдясно.
(1) Прехвърляне на O 2 от белите дробове в кръвта. (13)
(2) Прехвърляне на O 2 от кръвта към тъканта. (четиринадесет)
(3) Прехвърляне на CO 2 от тъканите в кръвта. (15)
(4) Прехвърляне на CO 2 от кръвта към белите дробове. (16)
(5) Поемане на O 2 от еритроцитите. (17)
(6) Освобождаване на O 2 от еритроцитите. (осемнадесет)
(7) Превръщане на артериална кръв във венозна кръв. (19)
(8) Превръщане на венозна кръв в артериална. (двадесет)
(9) Пауза химическа връзка O 2 с хемоглобин. (21)
(10) Химическо свързване на O 2 с хемоглобина. (22)
(11) Капиляри в тъканите. (23)
(12) Белодробни капиляри. (24)
Въпроси за първа опция
1. Процеси на газообмен в тъканите.
2. Физични процеси при газообмен.
Въпроси за втория вариант
1.
Газообменни процеси в белите дробове.
2. Химични процеси при газообмен
Задача
Определете обема на въглероден оксид (IV), който се отделя при разлагането на 50 g калциев карбонат.
Въглеродният оксид (IV) (въглероден диоксид, въглероден диоксид) при нормални условия е безцветен газ, по-тежък от въздуха, термично стабилен и при компресиране и охлаждане лесно преминава в течно и твърдо състояние.
Плътност - 1,997 g / l. Твърдият CO2, наречен сух лед, сублимира при стайна температура. Разтваря се слабо във вода, частично реагира с нея. Показва киселинни свойства. Редуциран с активни метали, водород и въглерод.
Химическа формула на въглероден оксид 4
Химическа формула на въглероден оксид (IV) CO2. Това показва, че тази молекула съдържа един въглероден атом (Ar = 12 amu) и два кислородни атома (Ar = 16 amu). Химическата формула може да се използва за изчисляване на молекулното тегло на въглеродния оксид (IV):
Mr (CO2) = Ar (C) + 2 × Ar (O);
Mr (CO2) = 12+ 2 × 16 = 12 + 32 = 44.
Примери за решаване на проблеми
ПРИМЕР 1
Задача Когато 26,7 g аминокиселина (CxHyOzNk) се изгорят в излишък от кислород, се образуват 39,6 g въглероден окис (IV), 18,9 g вода и 4,2 g азот. Определете формулата на аминокиселината.
Решение Нека начертаем диаграма на реакцията на горене на аминокиселина, обозначаваща броя на въглеродните атоми, водорода, кислорода и азота съответно с "x", "y", "z" и "k":
CxHyOzNk + Oz → CO2 + H2O + N2.
Нека определим масите на елементите, които изграждат това вещество. Стойностите на относителните атомни маси, взети от периодичната таблица на D.I. Менделеев, закръглете до цели числа: Ar (C) = 12 amu, Ar (H) = 1 amu, Ar (O) = 16 amu, Ar (N) = 14 amu
M (C) = n (C) × M (C) = n (CO2) × M (C) = × M (C);
M (H) = n (H) × M (H) = 2 × n (H2O) × M (H) = × M (H);
Нека изчислим моларните маси на въглероден диоксид и вода. Както знаете, моларната маса на една молекула е равна на сумата от относителните атомни маси на атомите, които съставляват молекулата (M = Mr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol.
М (С) = х 12 = 10,8 g;
M (H) = 2 × 18,9 / 18 × 1 = 2,1 g.
M (O) = m (CxHyOzNk) - m (C) - m (H) - m (N) = 26,7 - 10,8 - 2,1 - 4,2 = 9,6 g.
Ние определяме химична формулааминокиселини:
X: y: z: k = m (C) / Ar (C): m (H) / Ar (H): m (O) / Ar (O): m (N) / Ar (N);
X: y: z: k = 10,8 / 12: 2,1 / 1: 9,6 / 16: 4,2 / 14;
X: y: z: k = 0,9: 2,1: 0,41: 0,3 = 3: 7: 1,5: 1 = 6: 14: 3: 2.
Следователно най-простата формула на аминокиселината е C6H14O3N2.
Отговор C6H14O3N2
ПРИМЕР 2
Задача Начертайте най-простата формула на съединение, в което масовите части на елементите са приблизително равни: въглерод - 25,4%, водород - 3,17%, кислород - 33,86%, хлор - 37,57%.
Решение Масовата част на елемента X в молекула от състав HX се изчислява по следната формула:
ω (X) = n × Ar (X) / M (HX) × 100%.
Нека обозначим броя на въглеродните атоми в една молекула с "x", броя на азотните атоми на водорода с "y", броя на кислородните атоми с "z" и броя на хлорните атоми с "k".
Намерете съответния роднина атомни масиелементи въглерод, водород, кислород и хлор (стойностите на относителните атомни маси, взети от периодичната таблица на Д.И.Менделеев, закръглени до цели числа).
Аг (С) = 12; Аг (Н) = 14; Аг (О) = 16; Ar (Cl) = 35,5.
Разделяме процента на елементите на съответните относителни атомни маси. Така ще намерим съотношението между броя на атомите в молекулата на съединението:
X: y: z: k = ω (C) / Ar (C): ω (H) / Ar (H): ω (O) / Ar (O): ω (Cl) / Ar (Cl);
X: y: z: k = 25,4 / 12: 3,17 / 1: 33,86 / 16: 37,57 / 35,5;
X: y: z: k = 2,1: 3,17: 2,1: 1,1 = 2: 3: 2: 1.
Това означава, че най-простата формула за съединение от въглерод, водород, кислород и хлор ще бъде C2H3O2Cl.