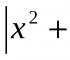Statgrad imtihon kimyo bo'yicha o'quv ishlari iyun. Mavzular bo'yicha testlar
Atomning hayajonlangan holatiga mos keladi elektron konfiguratsiya
1) 1s 2 2s 2 2p 6 3s 1
2) 1s 2 2s 2 2p 6 3s 2 3p 6
3) 1s 2 2s 2 2p 6 3s 1 3p 2
Javob: 3
Izoh:
3s-sublevelning energiyasi 3p-sublevelning energiyasidan pastroq, lekin 2s elektronni o'z ichiga olishi kerak bo'lgan 3s-sublevel to'liq to'ldirilmagan. Binobarin, bunday elektron konfiguratsiya atomning (alyuminiy) hayajonlangan holatiga mos keladi.
To'rtinchi variant bu javob emas, chunki 3d darajasi to'ldirilmagan bo'lsa ham, uning energiyasi 4s pastki sathidan yuqori, ya'ni. bu holda, u oxirgi to'ldiriladi.
Kimyoviy elementlar atom radiusini kamaytirish tartibida qaysi qatorda joylashgan?
1) Rb → K → Na
2) Mg → Ca → Sr
3) Si → Al → Mg
Javob: 1
Izoh:
Elementlarning atom radiusi elektronlar sonining kamayishi bilan kamayadi (elektronlar soni davriy jadval davri soniga to'g'ri keladi) kimyoviy elementlar) va metall bo'lmaganlarga o'tishda (ya'ni, tashqi darajadagi elektronlar sonining ko'payishi bilan). Binobarin, kimyoviy elementlar jadvalida elementlarning atom radiusi pastdan yuqoriga va chapdan o'ngga kamayadi.
Xuddi shu nisbiy elektr manfiyligi bo'lgan atomlar o'rtasida kimyoviy bog'lanish hosil bo'ladi
2) kovalent qutb
3) kovalent qutbsiz
Javob: 3
Izoh:
Kovalent qutbsiz bog'lanish bir xil nisbiy elektr manfiyligiga ega atomlar o'rtasida hosil bo'ladi, chunki elektron zichligi siljimaydi.
(NH 4) 2 SO 3 tarkibidagi oltingugurt va azotning oksidlanish darajasi mos ravishda tengdir
1) +4 va -3 2) -2 va +5 3) +6 va +3 4) -2 va +4
Javob: 1
Izoh:
(NH 4) 2 SO 3 (ammoniy sulfit) - bu oltingugurt kislotasi va ammiak tomonidan hosil bo'lgan tuz, shuning uchun oltingugurt va azotning oksidlanish darajasi mos ravishda +4 va -3 (oltingugurt kislotasida oltingugurtning oksidlanish darajasi +4) , ammiakdagi azotning oksidlanish darajasi 3).
Atom kristalli panjarasi bor
1) oq fosfor
3) kremniy
Javob: 3
Izoh:
Oq fosforning molekulyar kristalli panjarasi bor, oq fosfor molekulasining formulasi P 4.
Oltropik oltingugurtning ikkala modifikatsiyasi (rombik va monoklinik) joylashgan joylarida tsiklik toj shaklidagi S 8 molekulalari bo'lgan molekulyar kristall panjaralarga ega.
Qo'rg'oshin metall bo'lib, metall kristall panjaraga ega.
Kremniyda olmos tipidagi kristall panjaralar mavjud, ammo Si-Si bog'lanishining uzunroq bo'lishi sababli C-C bilan solishtirganda qattiqligicha olmosdan past.
Ro'yxatdagi moddalar orasida amfoter gidroksidlarga tegishli uchta moddani tanlang.
Javob: 245
Izoh:
Amfoter metallarga Be, Zn, Al ("BeZnAl" ni eslashingiz mumkin), shuningdek Fe III va Cr III kiradi. Shuning uchun taklif qilingan javob variantlaridan amfoter gidroksidlarga Be (OH) 2, Zn (OH) 2, Fe (OH) 3 kiradi.
Al (OH) 2 Br birikmasi asosiy tuz hisoblanadi.
Shundaymi? quyidagi hukmlar azotning xususiyatlari haqida?
A. Oddiy sharoitda azot kumush bilan reaksiyaga kirishadi.
B. Katalizator bo'lmagan holda normal sharoitda azot munosabat bildirmaydi vodorod bilan
1) faqat A to'g'ri
2) faqat B to'g'ri
3) ikkala hukm ham to'g'ri
Javob: 2
Izoh:
Azot juda inert gaz bo'lib, normal sharoitda litiydan boshqa metallar bilan reaksiyaga kirishmaydi.
Azotning vodorod bilan o'zaro ta'siri ammiakning sanoat ishlab chiqarishiga tegishli. Jarayon ekzotermik va qaytaruvchan bo'lib, faqat katalizatorlar ishtirokida sodir bo'ladi.
Uglerod oksidi (IV) har ikki moddaga ta'sir qiladi:
1) kislorod va suv
2) suv va kaltsiy oksidi
3) kaliy sulfat va natriy gidroksid
4) kremniy oksidi (IV) va vodorod
Javob: 2
Izoh:
Karbon monoksit (IV) (karbonat angidrid) kislotali oksiddir, shuning uchun suv bilan reaksiyaga kirishib, beqaror bo'ladi karbonat kislota, gidroksidi va gidroksidi va gidroksidi er metallarining tuzlari hosil bo'lgan oksidlari:
CO 2 + H 2 O-H 2 CO 3
CO 2 + CaO → CaCO 3
Ikkalasining har biri natriy gidroksid eritmasi bilan reaksiyaga kirishadi
3) H 2 O va P 2 O 5
Javob: 4
Izoh:
NaOH gidroksidi (asosiy xususiyatlarga ega), shuning uchun kislotali oksid - SO 2 va amfoter metalning gidroksidi - Al (OH) 3 bilan o'zaro ta'sirlashish mumkin:
2NaOH + SO 2 → Na 2 SO 3 + H 2 O yoki NaOH + SO 2 → NaHSO 3
NaOH + Al (OH) 3 → Na
Kaltsiy karbonat eritma bilan o'zaro ta'sir qiladi
1) natriy gidroksidi
2) vodorod xlorid
3) bariy xlorid
Javob: 2
Izoh:
Kaltsiy karbonat suvda erimaydigan tuzdir, shuning uchun tuzlar va asoslar bilan o'zaro ta'sir qilmaydi. Kaltsiy karbonat tuzlarning hosil bo'lishi va karbonat angidrid chiqishi bilan kuchli kislotalarda eriydi:
CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O
Transformatsiya sxemasida
1) temir (II) oksidi
2) temir (III) gidroksidi
3) temir (II) gidroksidi
4) temir (II) xlorid
Javob: X-5; Y-2
Izoh:
Xlor kuchli oksidlovchi moddadir (galogenlarning oksidlanish qobiliyati I 2 dan F 2 gacha ko'tariladi), u temirni Fe + 3 ga oksidlaydi:
2Fe + 3Cl 2 → 2FeCl 3
Temir (III) xlorid eruvchan tuz bo'lib, cho'kma - temir (III) gidroksidi hosil bo'lishi bilan ishqorlar bilan almashinish reaktsiyalariga kiradi:
FeCl 3 + 3NaOH → Fe (OH) 3 ↓ + NaCl
Gomologlar
1) glitserin va etilen glikol
2) metanol va butanol-1
3) propin va etilen
Javob: 2
Izoh:
Gomologlar - bu bir xil organik birikmalar sinfiga mansub va bir yoki bir nechta CH 2-guruhlari bilan farq qiluvchi moddalar.
Glitserin va etilen glikol o'z navbatida uch atomli va dihidrik spirtlar bo'lib, ular kislorod atomlari soniga ko'ra farq qiladi, shuning uchun ular na izomerlar, na gomologlardir.
Metanol va butanol-1 - tarvaqaylanmagan skeletlari bo'lgan birlamchi spirtlar, ikkita CH 2 guruhidan farq qiladi, shuning uchun ular gomologik hisoblanadi.
Propin va etilen alkinlar va alkenlar sinflariga mansub bo'lib, ular tarkibida turli miqdordagi uglerod va vodorod atomlari mavjud, shuning uchun ular na gomolog, na izomer emas.
Propanon va propanal turli xil organik birikmalar sinfiga kiradi, ammo tarkibida 3 ta uglerod, 6 ta vodorod va 1 ta kislorod atomi mavjud, shuning uchun funktsional guruh bo'yicha izomerlardir.
Buten-2 uchun imkonsiz reaktsiya
1) suvsizlanish
2) polimerizatsiya
3) galogenlanish
Javob: 1
Izoh:
Buten-2 alkenlar sinfiga kiradi, galogenlar, galogenoksidlar, suv va vodorod bilan qo'shimcha reaksiyalarga kirishadi. Bundan tashqari, to'yinmagan uglevodorodlar polimerlanadi.
Dehidratsiya reaktsiyasi - bu suv molekulasini yo'q qilish bilan yuzaga keladigan reaktsiya. Buten-2 uglevodorod bo'lgani uchun, ya'ni. heteroatomlarni o'z ichiga olmaydi, suvni yo'q qilish mumkin emas.
Fenol o'zaro ta'sir qilmaydi
1) azot kislotasi
2) natriy gidroksidi
3) bromli suv
Javob: 4
Izoh:
Fenol bilan nitrat kislota va bromli suv benzol halqasida elektrofil almashtirish reaktsiyasiga kirishadi, natijada navbati bilan nitrofenol va bromofenol hosil bo'ladi.
Kislotali xususiyatlarga ega bo'lgan fenol gidroksidi bilan reaksiyaga kirishib, fenolatlar hosil qiladi. Bunday holda natriy fenolat hosil bo'ladi.
Alkanlar fenol bilan reaksiyaga kirishmaydi.
Sirka kislotasi metil esteri bilan reaksiyaga kirishadi
1) NaCl 2) Br 2 (eritma) 3) Cu (OH) 2 4) NaOH (eritma)
Javob: 4
Izoh:
Sirka kislotasi metil efiri (metil asetat) efirlar sinfiga kiradi va kislota va ishqoriy gidrolizga uchraydi. Kislota gidrolizida metilatsetat sirka kislota va metanolga, gidroksidi natriy gidroksidi - natriy asetat va metanol bilan gidroksidi sharoitida aylanadi.
Buten-2 ni suvsizlantirish orqali olish mumkin
1) butanon 2) butanol-1 3) butanol-2 4) butanal
Javob: 3
Izoh:
Alkenlarni olish usullaridan biri bu suvsiz sulfat kislota ishtirokida va 140 o C dan yuqori haroratlarda sodir bo'ladigan birlamchi va ikkilamchi spirtlarning molekula ichidagi suvsizlanish reaktsiyasi, suv molekulasini alkogol molekulasidan chiqarib tashlash Zaytsevning fikriga ko'ra davom etadi. qoida: vodorod atomi va gidroksil guruhi qo'shni uglerod atomlaridan ajralib chiqadi, bundan tashqari vodorod mavjud bo'lgan uglerod atomidan ajralib chiqadi eng kichik raqam vodorod atomlari Shunday qilib, molekula ichidagi suvsizlanish birlamchi spirt- butanol-1 buten-1 hosil bo'lishiga olib keladi, ikkilamchi spirtning molekula ichidagi suvsizlanishi - butanol-2 buten-2 hosil bo'lishiga olib keladi.
Metilamin (c) bilan reaksiyaga kirishishi mumkin
1) ishqorlar va spirtlar
2) ishqorlar va kislotalar
3) kislorod va ishqorlar
4) kislotalar va kislorod
Javob: 4
Izoh:
Metilamin aminlar sinfiga kiradi va azot atomida yolg'iz elektron jufti borligi sababli asosiy xususiyatlarga ega. Bundan tashqari, metilaminning asosiy xususiyatlari ammiaknikiga qaraganda ancha aniqroq, chunki bu ijobiy induktiv ta'sirga ega bo'lgan metil guruhi mavjud. Shunday qilib, metilamin asosiy xususiyatlarga ega bo'lib, kislotalar bilan o'zaro ta'sirlanib, tuzlar hosil qiladi. Metilamin kislorodli atmosferada yonib, karbonat angidrid, azot va suvga aylanadi.
Berilgan o'zgartirishlar sxemasida
navbati bilan X va Y moddalar
1) etandiol-1,2
3) asetilen
4) dietil efir
Javob: X-2; Y-5
Izoh:
Bromoetan suvli gidroksidi eritmasida etanol hosil bo'lishi bilan nukleofil o'rnini bosuvchi reaktsiyaga kiradi:
CH 3 -CH 2 -Br + NaOH (aq) → CH 3 -CH 2 -OH + NaBr
140 ° C dan yuqori haroratlarda konsentrlangan sulfat kislota sharoitida molekula ichidagi suvsizlanish etilen va suv hosil bo'lishi bilan sodir bo'ladi:
Barcha alkenlar osongina brom bilan reaksiyaga kirishadi:
CH 2 = CH 2 + Br 2 → CH 2 Br-CH 2 Br
Almashtirish reaktsiyalari o'zaro ta'sirni o'z ichiga oladi
1) asetilen va brom vodorod
2) propan va xlor
3) eten va xlor
4) etilen va vodorod xlorid
Javob: 2
Izoh:
Qo'shilish reaktsiyalariga to'yinmagan uglevodorodlarning (alkenlar, alkinlar, alkadienlar) halogenlar, galogenodorodlar, vodorod va suv bilan o'zaro ta'siri kiradi. Asetilen (etin) va etilen navbati bilan alkin va alken sinflariga kiradi; shuning uchun ular brom vodorod, vodorod xlorid va xlor bilan qo'shimcha reaktsiyalarga kirishadilar.
Alkanlar nurda yoki yuqori haroratda galogenlar bilan almashtirish reaktsiyalariga kirishadi. Reaksiya zanjir mexanizmi bo'yicha erkin radikallar ishtirokida - bir juft elektronga ega bo'lmagan zarralar bilan davom etadi:
Tezlikda kimyoviy reaktsiya
HCOOCH 3 (l) + H 2 O (l) → HCOOH (l) + CH 3 OH (l)
ko'rsatmaydi ta'sir
1) bosimning oshishi
2) harorat ko'tarilishi
3) HCOOCH 3 kontsentratsiyasining o'zgarishi
4) katalizator yordamida
Javob: 1
Izoh:
Reaksiya tezligiga harorat va boshlang'ich reaktivlarning kontsentratsiyasining o'zgarishi hamda katalizator ishlatilishi ta'sir qiladi. Van't Xof qoidalariga binoan har 10 daraja uchun bir hil reaktsiyaning tezlik konstantasi 2-4 marta ko'payadi.
Katalizatordan foydalanish reaktsiyalarni ham tezlashtiradi, katalizator mahsulotlarga kiritilmaydi.
Boshlang'ich materiallar va reaktsiya mahsulotlari suyuq fazada, shuning uchun bosim o'zgarishi bu reaktsiya tezligiga ta'sir qilmaydi.
Qisqartirilgan ionli tenglama
Fe +3 + 3OH - = Fe (OH) 3 ↓
ga mos keladi molekulyar tenglama reaktsiyalar
1) FeCl 3 + 3NaOH = Fe (OH) 3 ↓ + 3NaCl
2) 4Fe (OH) 2 + O 2 + 2H 2 O = 4Fe (OH) 3
3) FeCl 3 + 3NaHCO 3 = Fe (OH) 3 ↓ + 3CO 2 + 3NaCl
Javob: 1
Izoh:
Suvli eritmada eruvchan tuzlar, ishqorlar va kuchli kislotalar ionlarga ajraladi, erimaydigan asoslar, erimaydigan tuzlar molekulyar shaklda yoziladi, kuchsiz kislotalar, gazlar, oddiy moddalar.
Tuzlar va asoslarning eruvchanlik holati birinchi tenglamaga to'g'ri keladi, unda tuz gidroksidi bilan almashinish reaktsiyasiga kirib, erimaydigan asos va boshqa eruvchan tuz hosil qiladi.
To'liq ionli tenglama quyidagicha yoziladi:
Fe +3 + 3Cl - + 3Na + + 3OH - = Fe (OH) 3 ↓ + 3Cl - + 3Na +
Quyidagi gazlardan qaysi biri zaharli va kuchli hidga ega?
1) vodorod
2) uglerod oksidi (II)
Javob: 3
Izoh:
Vodorod va karbonat angidrid hidsiz, toksik bo'lmagan gazlardir. Uglerod oksidi va xlor zaharli, ammo CO dan farqli o'laroq, xlor o'tkir hidga ega.
Polimerlanish reaktsiyasi kiradi
1) fenol 2) benzol 3) toluol 4) stirol
Javob: 4
Izoh:
Tavsiya etilgan variantlardan barcha moddalar aromatik uglevodorodlardir, ammo aromatik tizimlar uchun polimerlanish reaktsiyalari odatiy emas. Stirol molekulasida polimerizatsiya reaktsiyalari bilan ajralib turadigan etilen molekulasining bo'lagi bo'lgan vinil radikal mavjud. Shunday qilib, stirol polimerlanib polistirol hosil qiladi.
Massa ulushi 10% bo'lgan 240 g eritmaga 160 ml suv qo'shilgan. Olingan eritmadagi tuzning massa ulushini aniqlang. (Raqamni butun sonlarga yozing.)
Javob: 6%Izoh:
Eritmadagi tuzning massa ulushi quyidagi formula bilan hisoblanadi:
Ushbu formuladan kelib chiqib, dastlabki eritmadagi tuz massasini hisoblaymiz:
m (in-va) = ω (chiquvchi echimdagi in-va). m (asl eritma) / 100% = 10%. 240 g / 100% = 24 g
Eritmaga suv qo'shilsa, hosil bo'lgan eritmaning massasi 160 g + 240 g = 400 g (suv zichligi 1 g / ml) bo'ladi.
Olingan eritmadagi tuzning massa ulushi:
67,2 l (n.o.) ammiakning to'liq yonishi bilan qancha azot (n.o.) hosil bo'lishini hisoblang. (Raqamni o'ndan biriga yozing.)
Javob: 33,6 L
Izoh:
Ammiakning kislorodda to'liq yonishi tenglama bilan tavsiflanadi:
4NH 3 + 3O 2 → 2N 2 + 6H 2 O
Avogadro qonunining natijasi shundaki, bir xil sharoitdagi gazlar hajmi bir-biri bilan ushbu gazlarning mollari soniga o'xshash tarzda bog'liqdir. Shunday qilib, reaktsiya tenglamasiga muvofiq
ν (N 2) = 1/2 ν (NH 3),
shuning uchun ammiak va azot miqdori bir-biriga xuddi shunday bog'liqdir:
V (N 2) = 1/2V (NH 3)
V (N 2) = 1/2V (NH 3) = 67,2 l / 2 = 33,6 l
4 mol vodorod periksni parchalanishi paytida hosil bo'lgan kislorod hajmi (normal darajada litrda) qancha? (Raqamni o'ndan biriga yozing).
Javob: 44,8 l
Izoh:
Katalizator - marganets dioksidi mavjud bo'lganda, peroksid kislorod va suv hosil bo'lishi bilan parchalanadi:
2H 2 O 2 → 2H 2 O + O 2
Reaksiya tenglamasiga ko'ra, hosil bo'lgan kislorod miqdori vodorod peroksid miqdorining yarmiga teng:
ν (O 2) = 1/2 ν (H 2 O 2), shuning uchun, ν (O 2) = 4 mol / 2 = 2 mol.
Gazlar hajmi quyidagi formula bo'yicha hisoblanadi:
V = V m ν , bu erda V m - normal sharoitda gazlarning molyar hajmi, 22,4 l / mol ga teng
Peroksidning parchalanishi paytida hosil bo'lgan kislorod hajmi:
V (O 2) = V m ν (O 2) = 22,4 L / mol 2 mol = 44,8 L
Birikmalar sinflari va uning vakili bo'lgan moddaning ahamiyatsiz nomi o'rtasida yozishmalar o'rnating.
Javob: A-3; B-2; IN 1; G-5
Izoh:
Spirtli ichimliklar - bu to'yingan uglerod atomiga bevosita bog'langan bir yoki bir nechta gidroksil guruhlarini (-OH) o'z ichiga olgan organik moddalar. Etilen glikol - bu ikki gidroksil guruhini o'z ichiga olgan dihidrik spirt: CH 2 (OH) -CH 2 OH.
Uglevodlar karbonil va bir nechta gidroksil guruhlarini o'z ichiga olgan organik moddalardir, umumiy formula uglevodlar C n (H 2 O) m (bu erda m, n> 3) sifatida yoziladi. Tavsiya etilgan variantlardan uglevodlarga kraxmal - polisakkarid, ko'p miqdordagi monosaxarid qoldiqlaridan tashkil topgan yuqori molekulyar og'irlikdagi uglevod kiradi, ularning formulasi (C 6 H 10 O 5) n deb yozilgan.
Uglevodorodlar tarkibiga atigi ikkita element - uglerod va vodorod kiradi. Tavsiya etilgan variantlardan uglevodorodlarga toluol - faqat uglerod va vodorod atomlaridan iborat bo'lgan aromatik birikma kiradi va heteroatomli funktsional guruhlarni o'z ichiga olmaydi.
Karboksilik kislotalar - bu organik moddalar, ularning molekulalarida karboksil guruhi mavjud bo'lib, ular o'zaro bog'liq karbonil va gidroksil guruhlaridan iborat. Sinfga karbon kislotalari butirik (butanoik) kislotaga ishora qiladi - C 3 H 7 COOH.
Reaksiya tenglamasi va undagi oksidlovchining oksidlanish darajasining o'zgarishi o'rtasida moslikni o'rnating.
| Reaksiya tenglamasi
A) 4NH 3 + 5O 2 = 4NO + 6H 2 O B) 2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2 B) 4Zn + 10HNO 3 = NH 4 NO 3 + 4Zn (NO 3) 2 + 3H 2 O D) 3NO 2 + H 2 O = 2HNO 3 + NO |
Oksidantning oksidlanish darajasidagi o'zgarish |
Javob: A-1; B-4; AT 6; G-3
Izoh:
Oksidlanish agenti kimyoviy reaktsiya paytida elektronlarni biriktira oladigan va shu bilan oksidlanish holatini kamaytiradigan atomlarni o'z ichiga olgan moddadir.
Reduksion agent - bu kimyoviy reaktsiya paytida elektronlarni berishi va shu bilan oksidlanish darajasini oshirishi mumkin bo'lgan atomlarni o'z ichiga olgan moddadir.
A) Ammiakning kislorod bilan katalizator ishtirokida oksidlanishi azot oksidi va suv hosil bo'lishiga olib keladi. Oksidlovchi moddalar molekulyar kislorod bo'lib, dastlab 0 oksidlanish darajasiga ega bo'lib, u elektronlarni biriktirib, NO va H 2 O birikmalarida -2 oksidlanish darajasiga tushiriladi.
B) Mis nitrat Cu (NO 3) 2 - azot kislotasi bilan kislota qoldig'ini o'z ichiga olgan tuz. Nitrat anionidagi azot va kislorodning oksidlanish darajasi mos ravishda +5 va -2. Reaksiya davomida nitrat anioni NO 2 azot dioksidiga (azotning oksidlanish darajasi +4 bilan) va O 2 kislorodiga (oksidlanish darajasi 0 bilan) aylanadi. Shuning uchun azot oksidlovchi moddadir, chunki u oksidlanish darajasini nitrat ionidagi +5 dan azot dioksididagi +4 ga tushiradi.
C) Ushbu oksidlanish-qaytarilish reaktsiyasida oksidlovchi moddalar azot kislotasi bo'lib, u ammiakli selitraga aylanib, azotning oksidlanish darajasini +5 dan (gacha) pasaytiradi. azot kislotasi) dan -3 gacha (ammoniy kationida). Ammiakli selitra va rux nitratining kislotali qoldiqlarida azotning oksidlanish darajasi o'zgarishsiz qoladi, ya'ni. HNO 3 tarkibidagi azot bilan bir xil.
D) Ushbu reaktsiyada dioksiddagi azot nomutanosib bo'ladi, ya'ni. ikkalasi ham oshadi (NO 2 da N +4 dan HNO 3 da N +5 gacha) va kamayadi (NO 2dagi N +4 dan NO + 2 gacha) uning oksidlanish darajasi.
Moddaning formulasi va uning suvli eritmasining inert elektrodlarda chiqarilgan elektroliz mahsulotlari o'rtasida moslikni o'rnating.
Javob: A-4; B-3; AT 2; G-5
Izoh:
Elektroliz - bu to'g'ridan-to'g'ri elektr toki eritma yoki elektrolit eritmasi orqali o'tganda elektrodlarda paydo bo'ladigan oksidlanish-qaytarilish jarayoni. Katodda oksidlanish faolligi eng yuqori bo'lgan kationlarning kamayishi asosan sodir bo'ladi. Anodda, avvalo, eng yuqori qaytarilish qobiliyatiga ega bo'lgan anionlar oksidlanadi.
Suvli eritmaning elektrolizi
1) Elektroliz jarayoni suvli eritmalar katod katod materialiga bog'liq emas, balki kuchlanishning elektrokimyoviy qatoridagi metall kationining holatiga bog'liq.
Ketma-ket kationlar uchun
Li + - Al 3+ tiklash jarayoni:
2H 2 O + 2e → H 2 + 2OH - (H 2 katodda hosil bo'ladi)
Zn 2+ - Pb 2+ tiklash jarayoni:
Me n + + ne → Me 0 va 2H 2 O + 2e → H 2 + 2OH - (H 2 va Men katodda ajralib chiqadi)
Cu 2+ - Au 3+ kamaytirish jarayoni Me n + + ne → Me 0 (Me katodda chiqariladi)
2) Anoddagi suvli eritmalarning elektroliz jarayoni anod materialiga va anion tabiatiga bog'liq. Agar anod erimaydigan bo'lsa, ya'ni. inert (platina, oltin, ko'mir, grafit), jarayon faqat anionlarning tabiatiga bog'liq bo'ladi.
F -, SO 4 2-, NO 3 -, PO 4 3-, OH anionlari uchun - oksidlanish jarayoni:
4OH - - 4e → O 2 + 2H 2 O yoki 2H 2 O - 4e → O 2 + 4H + (kislorod anodda rivojlanadi)
galogenid ionlari (F - dan tashqari) oksidlanish jarayoni 2Hal - - 2e → Hal 2 (erkin galogenlar ajralib chiqadi)
organik kislotalarning oksidlanish jarayoni:
2RCOO - - 2e → R-R + 2CO 2
Umumiy elektroliz tenglamasi:
A) Na 2 CO 3 eritmasi:
2H 2 O → 2H 2 (katodda) + O 2 (anodda)
B) Cu (NO 3) 2 eritmasi:
2Cu (NO 3) 2 + 2H 2 O → 2Cu (katodda) + 4HNO 3 + O 2 (anodda)
B) AuCl 3 eritmasi:
2AuCl 3 → 2Au (katodda) + 3Cl 2 (anodda)
D) BaCl 2 eritmasi:
BaCl 2 + 2H 2 O → H 2 (katodda) + Ba (OH) 2 + Cl 2 (anodda)
Tuz nomi bilan ushbu tuzning gidrolizga nisbati o'rtasida moslik o'rnating.
Javob: A-2; B-3; AT 2; G-1
Izoh:
Tuzlarning gidrolizi - tuzlarning suv bilan o'zaro ta'siri, bu suv molekulasining vodorod kationi H + ni kislota qoldig'i anioniga va (yoki) gidroksil guruhi OH - metall kationiga qo'shilishiga olib keladi. Kuchsiz asoslarga mos keladigan kationlar va kuchsiz kislotalarga mos keladigan anionlardan hosil bo'lgan tuzlar gidrolizga uchraydi.
A) Natriy stearat - bu stearik kislota (alifatik qatorning kuchsiz bir asosli karbon kislotasi) va natriy gidroksidi (ishqor - kuchli asos) hosil qilgan tuz, shuning uchun u anionda gidrolizga uchraydi.
C 17 H 35 COONa → Na + + C 17 H 35 COO -
C 17 H 35 COO - + H 2 O ↔ C 17 H 35 COOH + OH - (kuchsiz dissotsiatsiyalanadigan karboksilik kislota hosil bo'lishi)
Eritma muhiti ishqoriy (pH> 7):
C 17 H 35 COONa + H 2 O ↔ C 17 H 35 COOH + NaOH
B) Ammoniy fosfat kuchsiz ortofosfor kislotasi va ammiak (kuchsiz asos) tomonidan hosil bo'lgan tuzdir, shuning uchun ham kation, ham anion bilan gidrolizga uchraydi.
(NH 4) 3 PO 4 → 3NH 4 + + PO 4 3-
PO 4 3- + H 2 O ↔ HPO 4 2- + OH - (zaif dissotsilanadigan vodorod fosfat ionining hosil bo'lishi)
NH 4 + + H 2 O-NH 3 · H 2 O + H + (suvda erigan ammiak hosil bo'lishi)
Eritma muhiti neytralga yaqin (pH ~ 7).
C) Natriy sulfid - zaif gidrosulfat kislota va natriy gidroksidi (gidroksidi kuchli asos) hosil qilgan tuz, shuning uchun u anionda gidrolizga uchraydi.
Na 2 S → 2Na + + S 2-
S 2- + H 2 O ↔ HS - + OH - (kuchsiz dissosilanuvchi gidrosulfid ionining hosil bo'lishi)
Eritma muhiti ishqoriy (pH> 7):
Na 2 S + H 2 O ↔ NaHS + NaOH
D) Berilliy sulfat - kuchli sulfat kislota va berilyum gidroksidi (kuchsiz asos) hosil qilgan tuz, shuning uchun u kation gidroliziga uchraydi.
BeSO 4 → Be 2+ + SO 4 2-
Be 2+ + H 2 O ↔ Be (OH) + + H + (kuchsiz dissotsiatsiyalangan Be (OH) + kationining hosil bo'lishi)
Eritma muhiti kislotali (pH)< 7):
2BeSO 4 + 2H 2 O ↔ (BeOH) 2 SO 4 + H 2 SO 4
Muvozanat tizimiga ta'sir o'tkazish usuli o'rtasida yozishmalar o'rnating
MgO (qattiq) + CO 2 (g) ↔ MgCO 3 (qattiq) + Q
va bu ta'sir natijasida kimyoviy muvozanatning siljishi
Javob: A-1; B-2; AT 2; G-3Izoh:
Ushbu reaktsiya ichida kimyoviy muvozanat, ya'ni oldinga reaktsiya tezligi teskari tezlikka teng bo'lgan holatda Muvozanatning kerakli yo'nalishga siljishi reaktsiya sharoitlarini o'zgartirish orqali amalga oshiriladi.
Le Shatelier printsipi: agar muvozanat tizimiga tashqi tomondan ta'sir etilsa, muvozanat holatini belgilaydigan omillarning har qandayini o'zgartirsa, u holda tizimda ushbu ta'sirni susaytiradigan jarayon yo'nalishi ortadi.
Muvozanat holatini belgilovchi omillar:
— bosim: bosimning oshishi muvozanatni hajmning pasayishiga olib keladigan reaktsiyaga yo'naltiradi (aksincha, bosimning pasayishi muvozanatni hajmning oshishiga olib keladigan reaktsiyaga qarab siljiydi)
— harorat: haroratning oshishi muvozanatni endotermik reaksiya tomon siljitadi (aksincha, haroratning pasayishi muvozanatni ekzotermik reaksiya tomon siljitadi)
— boshlang'ich moddalar va reaktsiya mahsulotlarining konsentratsiyasi: boshlang'ich moddalar konsentratsiyasining oshishi va mahsulotlarning reaktsiya doirasidan chiqarilishi muvozanatni to'g'ridan-to'g'ri reaktsiyaga yo'naltiradi (aksincha, boshlang'ich moddalar konsentratsiyasining pasayishi va reaktsiya mahsulotlarining ko'payishi muvozanatni qarama-qarshi tomonga siljitadi reaktsiya)
— katalizatorlar muvozanatning siljishiga ta'sir qilmaydi, balki uning erishilishini tezlashtiradi.
Shunday qilib,
A) magnezium karbonat olish reaksiyasi ekzotermik bo'lgani uchun haroratning pasayishi muvozanatni to'g'ridan-to'g'ri reaksiya tomon siljitadi;
B) karbonat angidrid magnezium karbonat ishlab chiqarishdagi boshlang'ich moddadir, shuning uchun uning kontsentratsiyasining pasayishi muvozanatning dastlabki moddalar tomon siljishiga olib keladi, chunki teskari reaktsiya yo'nalishi bo'yicha;
C) Magnezium oksidi va magnezium karbonat qattiq moddalardir, faqat CO 2 gazdir, shuning uchun uning konsentratsiyasi tizimdagi bosimga ta'sir qiladi. Karbonat angidrid konsentratsiyasining pasayishi bilan bosim pasayadi, shuning uchun reaksiya muvozanati boshlang'ich moddalar tomon siljiydi (teskari reaktsiya).
D) katalizatorning kiritilishi muvozanatning siljishiga ta'sir qilmaydi.
Moddaning formulasi va reaktivlar o'rtasida moslik o'rnating, ularning har biri bilan ushbu modda o'zaro ta'sir qilishi mumkin.
| Moddaning formulasi | Reaktivlar
1) H 2 O, NaOH, HCl 2) Fe, HCl, NaOH 3) HCl, HCHO, H 2 SO 4 4) O 2, NaOH, HNO 3 5) H 2 O, CO 2, HCl |
Javob: A-4; B-4; AT 2; G-3
Izoh:
A) oltingugurt oltingugurt dioksidini hosil qilish uchun kislorodda yonishi mumkin bo'lgan oddiy moddadir:
S + O 2 → SO 2
Ishqoriy eritmalardagi oltingugurt nomutanosib bo'lib, natijada sulfidlar va sulfitlar hosil bo'ladi:
3S + 6NaOH → 2Na 2 S + Na 2 SO 3 + 3H 2 O
Konsentrlangan nitrat kislota oltingugurtni S +6 ga oksidlaydi va azot dioksidiga kamaytiradi:
S + 6HNO 3 (kons.) → H 2 SO 4 + 6NO 2 + 2H 2 O
B) Forfor (III) oksidi kislotali oksiddir, shuning uchun ishqorlar bilan o'zaro ta'sirlanib fosfitlar hosil qiladi:
P 2 O 3 + 4NaOH → 2Na 2 HPO 3 + H 2 O
Bundan tashqari, fosfor (III) oksidi atmosfera kislorodi va azot kislotasi bilan oksidlanadi:
P 2 O 3 + O 2 → P 2 O 5
3P 2 O 3 + 4HNO 3 + 7H 2 O → 6H 3 PO 4 + 4NO
C) Temir (III) oksidi amfoter oksiddir, chunki kislotali va asosiy xususiyatlarni namoyish etadi (kislotalar va ishqorlar bilan reaksiyaga kirishadi):
Fe 2 O 3 + 6HCl → 2FeCl 3 + 3H 2 O
Fe 2 O 3 + 2NaOH → 2NaFeO 2 + H 2 O (termoyadroviy)
Fe 2 O 3 + 2NaOH + 3H 2 O → 2Na 2 (eritma)
Fe 2 O 3 temir bilan mutanosib reaktsiyaga kirishib, temir (II) oksidini hosil qiladi:
Fe 2 O 3 + Fe → 3FeO
D) Cu (OH) 2 - suvda erimaydigan asos, tegishli tuzlarga aylanib, kuchli kislotalar bilan eriydi:
Cu (OH) 2 + 2HCl → CuCl 2 + 2H 2 O
Cu (OH) 2 + H 2 SO 4 → CuSO 4 + 2H 2 O
Cu (OH) 2 aldegidlarni karboksilik kislotalarga oksidlaydi ("kumush oyna" reaktsiyasiga o'xshash):
HCHO + 4Cu (OH) 2 → CO 2 + 2Cu 2 O ↓ + 5H 2 O
Moddalar va ularni bir-biridan ajratib turadigan reaktiv o'rtasida yozishmalar o'rnating.
Javob: A-3; B-1; IN 3; G-5
Izoh:
A) CaCl 2 va KCl eruvchan ikkita tuzini kaliy karbonat eritmasi yordamida ajratish mumkin. Kaltsiy xlorid u bilan almashinish reaktsiyasiga kirishadi, natijada kaltsiy karbonat cho'kadi:
CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2KCl
B) Sulfit va natriy sulfatning eritmalarini indikator - fenolftalein bilan ajratish mumkin.
Natriy sulfit - zaif beqaror oltingugurt kislotasi va natriy gidroksidi (gidroksidi kuchli asos) hosil qilgan tuz, shuning uchun u anionda gidrolizga uchraydi.
Na 2 SO 3 → 2Na + + SO 3 2-
SO 3 2- + H 2 O ↔ HSO 3 - + OH - (kam dissotsilaydigan gidrosulfit ionining hosil bo'lishi)
Eritma muhiti ishqoriy (pH> 7), ishqoriy muhitdagi fenolftalein indikatorining rangi qirmizi rangga ega.
Natriy sulfat - kuchli sulfat kislota va natriy gidroksid (gidroksidi - kuchli asos) hosil qilgan tuz, gidrolizlanmaydi. Eritmaning muhiti neytral (pH = 7), neytral muhitdagi fenolftalein indikatorining rangi och pushti rangga ega.
B) Na 2 SO 4 va ZnSO 4 tuzlarini kaliy karbonat eritmasi bilan ham ajratish mumkin. Sink sulfat kaliy karbonat bilan almashinish reaktsiyasiga kirishadi, natijada sink karbonat cho'kadi:
ZnSO 4 + K 2 CO 3 → ZnCO 3 ↓ + K 2 SO 4
D) FeCl 2 va Zn (NO 3) 2 tuzlarini qo'rg'oshin nitratining eritmasi bilan ajratish mumkin. U temir xlorid bilan o'zaro ta'sirlashganda, yomon eriydigan PbCl 2 moddasi hosil bo'ladi:
FeCl 2 + Pb (NO 3) 2 → PbCl 2 ↓ + Fe (NO 3) 2
Reaktiv moddalar va ularning o'zaro ta'sirida uglerod o'z ichiga olgan mahsulotlar o'rtasida yozishmalar o'rnating.
| REAKTIV MADDALAR
A) CH 3 -C≡CH + H 2 (Pt) → B) CH 3 -C≡CH + H 2 O (Hg 2+) → B) CH 3 -C≡CH + KMnO 4 (H +) → D) CH 3 -C≡CH + Ag 2 O (NH 3) → |
Interaktiv mahsulot
1) CH 3 -CH 2 -CHO 2) CH 3 -CO-CH 3 3) CH 3 -CH 2 -CH 3 4) CH 3 -COOH va CO 2 5) CH 3 -CH 2 -COOAg 6) CH 3 -C≡CAg |
Javob: A-3; B-2; AT 4; G-6
Izoh:
A) Propin vodorodni qo'shib, uning ortiqcha miqdorini propanga aylantiradi:
CH 3 -C≡CH + 2H 2 → CH 3 -CH 2 -CH 3
B) Ikki valentli simob tuzlari ishtirokida alkinlar suvining qo'shilishi (hidratsiya), natijada karbonil birikmalari hosil bo'ladi, bu M.G.ning reaktsiyasi. Kucherov. Propinning hidratsiyasi aseton hosil bo'lishiga olib keladi:
CH 3 -C≡CH + H 2 O → CH 3 -CO-CH 3
C) Kislotali muhitda propinning kaliy permanganat bilan oksidlanishi alkin tarkibidagi uchli bog'lanishning uzilishiga olib keladi, natijada sirka kislotasi va karbonat angidrid hosil bo'ladi:
5CH 3 -C≡CH + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 -COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
D) Propinni kumush oksidining ammiak eritmasidan o'tkazishda kumush propinid hosil bo'ladi va cho'kadi. Ushbu reaktsiya zanjir uchida uch marta bog'langan alkinni aniqlashga xizmat qiladi.
2CH 3 -C≡CH + Ag 2 O → 2CH 3 -C≡CAg ↓ + H 2 O
Reaktiv moddalar va reaksiya mahsuloti bo'lgan organik moddalar o'rtasida yozishmalarni o'rnating.
| Interaktiv mahsulot
5) (CH 3 COO) 2 Cu |
Javob: A-4; B-6; IN 1; G-6
Izoh:
A) Etanolni mis (II) oksidi bilan oksidlanganda atsetaldegid hosil bo'ladi va oksid metallga aylanadi:
B) Konsentrlangan sulfat kislota spirtli ichimliklarga 140 0 C dan yuqori haroratda ta'sir qilganda, molekula ichidagi suvsizlanish reaktsiyasi paydo bo'ladi - bu suv molekulasini yo'q qilish, bu esa etilen hosil bo'lishiga olib keladi:
C) Spirtli ichimliklar gidroksidi va ishqoriy er metallari bilan kuchli reaksiyaga kirishadi. Faol metall spirtning gidroksil guruhidagi vodorod o'rnini bosadi:
2CH 3 CH 2 OH + 2K → 2CH 3 CH 2 OK + H 2
D) Ishqorning spirtli eritmasida spirtlar eliminatsiya (bo'linish) reaktsiyasiga kirishadi. Etanol bo'lsa, etilen hosil bo'ladi:
CH 3 CH 2 Cl + KOH (alkogol) → CH 2 = CH 2 + KCl + H 2 O
Usuldan foydalanish elektron balans, reaktsiya tenglamasini tuzing:
Ushbu reaktsiyada xlor kislotasi oksidlovchi moddadir, chunki tarkibidagi xlor oksidlanish darajasini HC1 da +5 dan -1 gacha tushiradi. Shuning uchun, qaytaruvchi vosita kislotali fosfor (III) oksidi bo'lib, bu erda fosfor oksidlanish darajasini +3 dan maksimal +5 ga ko'taradi, ortofosfor kislotasiga aylanadi.
Oksidlanish va qaytarilishning yarim reaksiyalarini tuzamiz:
Cl +5 + 6e → Cl -1 | 2
2P +3 - 4e → 2P +5 | 3
Oksidlanish-qaytarilish reaktsiyasining tenglamasini quyidagi shaklda yozamiz:
3P 2 O 3 + 2HClO 3 + 9H 2 O → 2HCl + 6H 3 PO 4
Mis konsentrlangan nitrat kislotada eritildi. Rivojlangan gaz isitilgan sink kukuni ustiga o'tkazildi. Olingan qattiq moddalar natriy gidroksid eritmasiga qo'shildi. Olingan eritma orqali karbonat angidridning ortiqcha miqdori o'tdi, cho'kma hosil bo'lishi kuzatildi.
Ta'riflangan to'rtta reaktsiya uchun tenglamalarni yozing.
1) Misni konsentrlangan nitrat kislotada eritganda, mis Cu +2 ga oksidlanib, jigarrang gaz chiqadi:
Cu + 4HNO 3 (kons.) → Cu (NO 3) 2 + 2NO 2 + 2H 2 O
2) Jigarrang gazni qizdirilgan rux kukuni ustiga o'tkazganda, rux oksidlanadi va azot dioksidi molekulyar azotga aylanadi (ko'pchilik Vikipediyaga asoslanib, qizdirilganda sink nitrat hosil bo'lmaydi deb o'ylashadi, chunki u termal beqaror):
4Zn + 2NO 2 → 4ZnO + N 2
3) ZnO - amfoter oksid, gidroksidi eritmasida eriydi va tetrahidroksozinkatga aylanadi:
ZnO + 2NaOH + H 2 O → Na 2
4) karbonat angidridning ortiqcha miqdorini tetrahidroksozinkat natriy eritmasi orqali o'tkazishda kislotali tuz hosil bo'ladi - natriy gidrokarbonat, rux gidroksidi cho'kadi:
Na 2 + 2CO 2 → Zn (OH) 2 ↓ + 2NaHCO 3
Quyidagi o'zgarishlarni amalga oshirishingiz mumkin bo'lgan reaktsiya tenglamalarini yozing:
Reaksiya tenglamalarini yozishda organik moddalarning tuzilish formulalaridan foydalaning.
1) Alkanlar uchun eng xarakterli reaktsiyalar erkin radikallarni almashtirish reaktsiyalari bo'lib, uning davomida vodorod atomi halogen atomi bilan almashtiriladi. Butanning brom bilan reaktsiyasida, ikkilamchi uglerod atomida vodorod atomining o'rnini bosishi asosan sodir bo'ladi, natijada 2-bromobutan hosil bo'ladi. Buning sababi shundaki, ikkilamchi uglerod atomida juftlanmagan elektron bo'lgan radikal, birlamchi uglerod atomida juftlanmagan elektron bo'lgan erkin radikalga qaraganda ancha barqaror:
2) 2-bromobutan alkogol eritmasida ishqor bilan o'zaro aloqada bo'lganda, brom vodorod molekulasini yo'q qilish natijasida er-xotin bog'lanish hosil bo'ladi (Zaytsev qoidasi: ikkilamchi va uchinchi haloalkanlardan vodorod galogeniti chiqarilganda, vodorod atomi eng kam gidrogenlangan uglerod atomidan ajralib chiqadi):
3) Buten-2 ning brom suvi yoki organik erituvchidagi brom eritmasi bilan o'zaro ta'siri brom molekulasini buten-2 ga qo'shilishi va 2 hosil bo'lishi natijasida bu eritmalarning tez rangsizlanishiga olib keladi. , 3-dibromobutan:
CH 3 -CH = CH-CH 3 + Br 2 → CH 3 -CHBr-CHBr-CH 3
4) Galogen atomlari qo'shni uglerod atomlarida (yoki bir xil atomda) joylashgan alkogolli gidroksidi eritmasi, ikki molekula vodorod galogenid ajraladi (dehidrohalogenatsiya) va uch karra bog'lanish hosil bo'lgan dibromo hosilasi bilan o'zaro aloqada bo'lganda. :
5) Ikki valentli simob tuzlari mavjud bo'lganda alkinlar suv qo'shib (gidratatsiya) karbonil birikmalar hosil qiladi:
Temir va rux kukunlari aralashmasi 153 ml 10% li eritma bilan reaksiyaga kirishadi xlorid kislota(r = 1,05 g / ml). Aralashmaning bir xil massasi bilan o'zaro ta'sir qilish uchun 40 ml 20% natriy gidroksid eritmasi kerak (r = 1.10 g / ml). Aralashmada temirning massa ulushini aniqlang.
Javobda masala shartida ko'rsatilgan reaktsiya tenglamalarini yozing va barcha kerakli hisob-kitoblarni keltiring.
Javob: 46,28%
Yonishda 2,65 g organik moddalar 4,48 litr karbonat angidrid (NU) va 2,25 g suv oldi.
Ma'lumki, ushbu modda kaliy permanganat sulfat eritmasi bilan oksidlanganda bir asosli kislota hosil bo'ladi va karbonat angidrid ajralib chiqadi.
Topshiriqning berilgan shartlari asosida:
1) organik moddalarning molekulyar formulasini yaratish uchun zarur hisob-kitoblarni amalga oshirish;
2) asl organik moddalarning molekulyar formulasini yozing;
3) ushbu moddaning atom molekulasidagi bog'lanish tartibini birma-bir aks ettiradigan strukturaviy formulasini tuzing;
4) ushbu moddaning kaliy permanganat sulfat eritmasi bilan oksidlanish reaktsiyasining tenglamasini yozing.
Javob:
1) C x H y; x = 8, y = 10
2) C 8 H 10
3) C 6 H 5 -CH 2 -CH 3 - etilbenzol
4) 5C 6 H 5 -CH 2 -CH 3 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 -COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O
Veb-sayt saytida kimyo fanidan imtihonga tayyorgarlik bo'yicha ko'rsatmalar
Kimyo bo'yicha imtihonni (va OGE) qanday qilib to'g'ri topshirish kerak? Agar vaqt atigi 2 oy bo'lsa va siz hali tayyor emassiz? Va kimyo bilan ham do'st bo'lmang ...
Har bir mavzu va topshiriq bo'yicha javoblar bilan testlarni taklif qiladi, siz kimyo bo'yicha imtihonda topilgan asosiy tamoyillar, qonuniyatlar va nazariyani o'rganishingiz mumkin. Sinovlarimiz kimyo bo'yicha imtihonda uchraydigan savollarning aksariyatiga javob topishga imkon beradi, testlarimiz esa materialni mustahkamlab, zaif tomonlarini topishga va materialni ishlashga imkon beradi.
Sizga faqat internet, ish yuritish materiallari, vaqt va veb-sayt kerak. Yaxshisi formulalar / echimlar / eslatmalar uchun alohida daftar va ahamiyatsiz qo'shma nomlarning lug'ati bo'lishi kerak.
- Eng boshidanoq, siz hozirgi darajangizni va kerakli ball sonini baholashingiz kerak, buning uchun o'tishga arziydi. Agar hamma narsa juda yomon bo'lsa, lekin sizga ajoyib ishlash kerak bo'lsa, tabriklayman, hatto hozir hammasi yo'qolmaydi. Repetitor yordamisiz muvaffaqiyatli o'tishga o'zingizni o'rgatishingiz mumkin.
Qaror bering minimal miqdor ochko to'plashni istasangiz, bu sizga kerakli nuqtani olish uchun aniq qancha vazifalarni hal qilishingiz kerakligini tushunishga imkon beradi.
Tabiiyki, narsalar shunchalik silliq o'tmasligi va iloji boricha ko'proq muammolarni hal qilishi mumkin, ammo umuman yaxshiroq bo'lishi mumkinligini yodda tuting. O'zingiz uchun belgilagan minimal miqdor - siz ideal tarzda hal qilishingiz kerak. - Keling, amaliy qismga - echim uchun mashg'ulotlarga o'tamiz.
Eng samarali usul quyidagilar. Faqat sizni qiziqtirgan imtihonni tanlang va tegishli testni tanlang. 20 ga yaqin echilgan vazifalar barcha turdagi vazifalarni bajarishni kafolatlaydi. Ko'rgan har bir vazifangizni boshidan oxirigacha qanday hal qilishni bilishingizni his qila boshlaganingiz bilanoq, keyingi vazifaga o'ting. Agar biron bir vazifani qanday hal qilishni bilmasangiz, bizning veb-saytimizdagi qidiruvdan foydalaning. Bizning veb-saytimizda deyarli har doim echim bor, aks holda chap pastki burchakdagi belgini bosish orqali repetitorga yozing - bu bepul. - Bunga parallel ravishda biz saytimizdagi har bir kishi uchun uchinchi nuqtani takrorlaymiz.
- Agar birinchi qism sizga hech bo'lmaganda o'rta darajada berilsa, siz qaror qila boshlaysiz. Agar topshiriqlardan biri yaxshi javob bermasa va siz uni bajarishda xatoga yo'l qo'ysangiz, unda ushbu topshiriq bo'yicha testlarga yoki tegishli mavzuni testlar bilan qaytaring.
- 2-qism. Agar o'qituvchingiz bo'lsa, u bilan ushbu qismni o'rganishga e'tiboringizni qarating. (qolgan qismini kamida 70% hal qila olish sharti bilan). Agar siz 2-qismni boshlagan bo'lsangiz, unda siz 100% vaqt muammosiz o'tish balini olishingiz kerak. Agar bu amalga oshmasa, hozircha birinchi qismida qolish yaxshiroqdir. 2-qismga tayyor bo'lgach, siz faqatgina 2-qismning echimlarini yozib qo'yadigan alohida daftarni olishni maslahat beramiz, muvaffaqiyatning kaliti 1-qismdagi kabi iloji boricha ko'proq vazifalarni hal qilishdir.
Og'irligi 8,3 g bo'lgan natriy nitridi oltingugurt kislotasi bilan massa ulushi 20% va massasi 490 g bo'lgan reaksiyaga kirishdi.Shundan so'ng olingan eritmaga og'irligi 57,2 g bo'lgan kristalli soda qo'shildi.so'nggi eritmadagi kislotaning massa ulushini (%) toping. Muammo sharoitida ko'rsatilgan reaktsiya tenglamalarini yozing, barcha kerakli hisob-kitoblarni keltiring (kerakli o'lchov birliklarini ko'rsating jismoniy miqdorlar). Sayt uchun javobni butun songa qadar yaxlitlang.
Haqiqiy imtihon 2017. 34-topshiriq.
Tsiklik modda A (kislorod va o'rnini bosuvchi moddalarni o'z ichiga olmaydi) 20,8 g og'irlikdagi B moddasiga tsiklning yorilishi bilan oksidlanadi, uning yonishi mahsuloti hajmi 13,44 litr bo'lgan karbonat angidrid va 7,2 g og'irlikdagi suvdir. vazifa shartlari: 1) B organik moddalarning molekulyar formulasini yaratish uchun zarur hisob-kitoblarni amalga oshirish; 2) A va B organik moddalarning molekulyar formulalarini yozing; 3) molekuladagi atomlarning bog'lanish tartibini birma-bir aks ettiradigan A va B organik moddalarning tarkibiy formulalarini tuzing; 4) A moddasini kaliy permanganat sulfat eritmasi bilan oksidlanish reaktsiyasi uchun B moddasini hosil qilish uchun tenglamani yozing. Sayt uchun javobda asl A organik moddasining bitta molekulasidagi barcha atomlarning yig'indisini ko'rsating.
Kimyo bo'yicha imtihon uchun mashg'ulotlar variantlari
2019 yilgi imtihon uchun kimyo bo'yicha o'quv testlarini javoblari va echimlari bilan ishlab chiqdik.
Tayyorgarlik, o'rganish 10 o'quv imkoniyatlari, yangisi asosida tuzilgan.
Kimyo fanidan imtihon testlarida topshiriqlarning xususiyatlari
Birinchi qismning ba'zi vazifalarining tipologiyasini va tuzilishini ko'rib chiqing:
- - shartli ravishda bir qator kimyoviy elementlar va ularning har biriga tegishli savollar berilgan, javob uchun hujayralar soniga e'tibor bering - ularning ikkitasi bor, shuning uchun ikkita echim bor;
- - ikkita to'plam o'rtasidagi yozishmalar: ikkita ustun bo'ladi, moddalarning bitta formulasida, ikkinchisida - moddalar guruhi, yozishmalarni topish kerak bo'ladi.
- Birinchi qismda, shuningdek, talaba imtihon savoliga to'g'ri javobni topish uchun formulalarni tanlaydigan "aqliy kimyoviy eksperiment" xulq-atvorini talab qiladigan vazifalar bo'ladi.
- Ikkinchi blokning vazifalari qiyinligi jihatidan yuqori bo'lib, bir nechta tarkib elementlarini va bir nechta ko'nikma va malakalarni o'zlashtirishni talab qiladi.
tezkor: masalani echishda moddalar, sinf va guruhni aniqlash muhim ahamiyatga ega.
To'liq javoblardan iborat vazifalar asosiy kurslar bo'yicha bilimlarni tekshirishga qaratilgan:
- Atom tuzilishi;
- Davriy qonunlar;
- Anorganik kimyo;
- Organik kimyo;
- Formulalarni hisoblash;
- Kimyodan hayotda foydalanish.
Kimyo bo'yicha imtihonga tayyorgarlik - tez va sifatli
Tez- olti oydan kam bo'lmagan muddatda:
- Matematikadan torting.
- Butun nazariyani ko'rib chiqing.
- Onlaynda hal qilish sinov imkoniyatlari kimyo fanidan, video darsliklarni tomosha qiling.
Bizning sayt bunday imkoniyatni taqdim etdi - mashg'ulotlarga boring va imtihonlarda yuqori ball to'plang.
Kimyo bo'yicha yagona davlat imtihonining natijasi belgilangan eng kam ball sonidan kam bo'lmagan holda, ro'yxatdagi ixtisosliklar bo'yicha oliy o'quv yurtlariga kirish huquqini beradi. kirish imtihonlari kimyo fani mavjud.
Universitetlar kimyo fani uchun 36 balldan past chegarani belgilash huquqiga ega emas. Nufuzli universitetlar o'zlarining minimal chegaralarini ancha yuqori belgilashga moyildirlar. Chunki birinchi kurs talabalari u erda o'qish uchun juda yaxshi bilimlarga ega bo'lishlari kerak.
FIPI rasmiy veb-saytida har yili kimyo bo'yicha yagona davlat imtihonining versiyalari nashr etiladi: namoyish, erta davr. Aynan shu variantlar kelajakdagi imtihonning tuzilishi va topshiriqlarning murakkabligi darajasi to'g'risida tasavvur beradi va imtihonga tayyorgarlik jarayonida ishonchli ma'lumot manbalari hisoblanadi.
Kimyo bo'yicha imtihonning dastlabki versiyasi 2017 yil
| Yil | Dastlabki versiyasini yuklab oling |
| 2017 | variant po himii |
| 2016 | yuklab olish |
FIPI-dan kimyo bo'yicha 2017 yilgi imtihonning namoyish versiyasi
| Vazifalar varianti + javoblar | Namoyish versiyasini yuklab oling |
| Texnik xususiyatlari | demo variant himiya ege |
| Kodifikator | kodifikator |
IN imtihonning variantlari 2017 yilda kimyo fanida o'tgan 2016 yildagi CMM bilan taqqoslaganda o'zgarishlar mavjud, shuning uchun mashg'ulotni amaldagi versiyaga muvofiq o'tkazish va bitiruvchilarning har xil rivojlanishi uchun avvalgi yillardagi variantlardan foydalanish maqsadga muvofiqdir.
Qo'shimcha materiallar va jihozlar
Ekspertizaning har bir varianti uchun imtihon ishi kimyo bo'yicha quyidagi materiallar ilova qilingan:
− davriy tizim kimyoviy elementlar D.I. Mendeleyev;
- tuzlar, kislotalar va asoslarning suvda eruvchanligi jadvali;
- metall kuchlanishlarining elektrokimyoviy seriyasi.
Imtihon ishi paytida dasturlashtirilmaydigan kalkulyatordan foydalanishga ruxsat beriladi. Yagona davlat imtihonida foydalanishga ruxsat berilgan qo'shimcha qurilmalar va materiallarning ro'yxati Rossiya Ta'lim va fan vazirligining buyrug'i bilan tasdiqlangan.
Universitetda o'qishni davom ettirishni istaganlar uchun fanlarni tanlash tanlangan mutaxassislik bo'yicha kirish imtihonlari ro'yxatiga bog'liq bo'lishi kerak.
(mashg'ulot yo'nalishi).
Barcha ixtisosliklar (o'qitish yo'nalishlari) bo'yicha universitetlarga kirish imtihonlari ro'yxati Rossiya Ta'lim va fan vazirligining buyrug'i bilan belgilanadi. Har bir universitet ushbu ro'yxatdan qabul qilish qoidalarida ko'rsatilgan ba'zi fanlarni tanlaydi. Tanlangan fanlarning ro'yxati bilan Yagona davlat imtihonida qatnashish uchun ariza topshirishdan oldin siz ushbu ma'lumotlar bilan tanlangan universitetlarning veb-saytlarida tanishishingiz kerak.