Praktyczna praca w mikrobiologii. Warsztaty z mikrobiologii
Federalna Agencja ds. Edukacji
Państwowa instytucja edukacyjna
Irkuck Uniwersytet stanowy»
MAŁA PRAKTYKA W MIKROBIOLOGII
Przewodnik do nauki
Irkuck 2009
UKD 579 (076.5)
Opublikowane decyzją Rady Redakcyjno-Wydawniczej Irkuckiego Uniwersytetu Państwowego
Warsztaty Zhilkina z mikrobiologii: Podręcznik.-metoda. instrukcja dla stadniny. wyższy. badanie. instytucje w specjalnościach „Mikrobiologia”, „Biologia” i „Fizjologia”.
6. Masa drobnoustrojów nie powinna zanieczyszczać rąk, stołu i otaczających przedmiotów. Rozlana zawiesina drobnoustrojów jest neutralizowana środkami dezynfekcyjnymi.
7. Po zakończeniu pracy kultury przekazuje się prowadzącemu, zaszczepione probówki i kubeczki umieszcza się w termostacie.
8. Pętle bakteriologiczne, igły, pęsety i inne metalowe przedmioty, po kontakcie z mikroorganizmami, są spalane w płomieniu lampy alkoholowej i umieszczane w specjalnym stojaku.
9. Zużyte szkiełka i szkiełka nakrywkowe, pipety, szpatułki itp. umieszcza się w 3-5% roztworze kwasu karbolowego lub innych roztworach dezynfekujących.
10. Zużyte kultury w probówkach, szalkach Petriego itp. neutralizuje się roztworami dezynfekującymi przez 24 godziny, następnie szalki gotuje się i myje.
11. Należy bezwzględnie przestrzegać higieny osobistej – po zakończeniu pracy ręce dokładnie umyć wodą z mydłem.
12. Podczas pracy z urządzeniami elektrycznymi i odczynnikami chemicznymi należy przestrzegać zasad bezpieczeństwa.
MIKROBIOLOGIA OGÓLNA
Rozdział I. Mikroskop i technika mikroskopowa
1. Mikroskopia świetlno-optyczna
2. Mikroskopia ciemnego pola
3. Mikroskopia kontrastu fazowego
4. Mikroskopia luminescencyjna (fluorescencyjna)
Rozdział II. Ogólne zrozumienie uprawy, techniki siewu i niezbędnego sprzętu do pracy z mikroorganizmami
Rozdział III. Metody przygotowania preparatów drobnoustrojów
Rozdział IV. Badania nad komórkami drobnoustrojów
1. Formy komórek mikroorganizmów
2. Struktura komórek mikroorganizmów (metody badań cytochemicznych)
3. Barwienie komórek mikroorganizmów metodą Grama
4. Zabarwienie zarodników w bakteriach
5. Kolorowanie kapsułek
6. Zabarwienie wici
7. Zabarwienie substancji jądrowej bakterii
8. Barwienie wtrąceń komórek mikroorganizmów
Rozdział V. Żywienie drobnoustrojów
1. Znaczenie poszczególnych składników odżywczych
2. Przygotowanie pożywek hodowlanych
3. Metody sterylizacji
Rozdział VI. Zliczanie bakterii i izolowanie czystej kultury
1. Liczenie bakterii w glebie
2. Oznaczanie składu jakościowego bakterii
3. Zliczanie drobnoustrojów w wodzie i innych cieczach
4. Liczenie bakterii w powietrzu
5. Izolacja czystych kultur bakterii
Rozdział VII. Określenie rodzaju bakterii
Rozdział VIII. Konwersja bezazotowych substancji organicznych przez mikroorganizmy
Procesy fermentacyjne
1. Fermentacja alkoholowa
2. Fermentacja kwasu mlekowego
3. Fermentacja kwasu masłowego
4. Fermentacja substancji pektynowych
5. Fermentacja celulozy
6. Utlenianie włókna
7. Utlenianie tłuszczu
8. Utlenianie węglowodorów
Rozdział IX. Konwersja organicznych i mineralnych związków azotu przez mikroorganizmy
1. Amonifikacja
2. Nitryfikacja
3. Denitryfikacja (oddychanie azotanowe)
4. Biologiczne wiązanie azotu atmosferycznego
Rozdział X. Przemiana związków siarki, żelaza i fosforu przez mikroorganizmy
1. Konwersja związków siarki przez mikroorganizmy
2. Udział mikroorganizmów w przemianie żelaza
3. Konwersja związków fosforu przez mikroorganizmy
MIKROBIOLOGIA ROLNICZA
Rozdział XI. Ogólna analiza mikrobiologiczna gleby
1. Metody badawcze
2. Grupy mikroorganizmów, skład i przygotowanie pożywek
3. Pobranie średniej próbki gleby i przygotowanie próbki do analizy mikrobiologicznej
4. Przygotowanie zawiesiny gleby
5. Uwzględnienie różnych grup mikroorganizmów
6. Oznaczanie całkowitej liczby drobnoustrojów w glebie metodą bezpośredniego zliczania pod mikroskopem
Rozdział XII. Badanie cenoz mikrobiologicznych
1. Metoda zanieczyszczenia szkła wg N.G. Kholodnego
2. Badanie cenoz drobnoustrojów w glebie metodą Perfiliewa i Gabe
3. Metoda kapilarna Perfiliewa zmodyfikowana przez Aristovskaya
4. Identyfikacja drobnoustrojów grupy autochtonicznej biorących udział w rozkładzie substancji humusowych według metody Vinogradsky'ego w modyfikacji Teppera
5. Identyfikacja drobnoustrojów biorących udział w rozkładzie substancji humusowych metodą Teppera
Rozdział XIII. Oznaczanie aktywności biologicznej gleby
1. Oznaczanie aktywności biologicznej gleby przez intensywność rozkładu płótna (metoda Miszustina, Wostrowa i Pietrowej)
2. Określenie ogólnej aktywności mikrobiologicznej gleby pod kątem uwalniania dwutlenku węgla
3. Oznaczanie aktywności amonifikacyjnej gleby
4. Oznaczanie aktywności amonifikacyjnej mikroorganizmów
5. Oznaczanie aktywności nitryfikacyjnej gleby
6. Oznaczanie aktywności denitryfikacyjnej gleby
7. Oznaczanie aktywności wiązania azotu mikroorganizmów
Rozdział XIV. Badanie bakterii w strefie korzeniowej roślin i na korzeniach
1. Liczenie bakterii w ryzosferze metodą Krasilnikowa
2. Analiza ryzosfery i mikroflory korzeni metodą sukcesywnego mycia korzeni wg E. 3. Tepper
3. Izolacja czystych kultur bakterii brodawkowych, rozliczenie ilościowe w glebie, określenie ich aktywności i zjadliwości
Rozdział XV. Analiza preparatów bakteryjnych
Rozdział XVI. Mikrobiologia pasz
1. Mikroflora epifityczna ziarna i jej zmiana podczas przechowywania paszy
2. Analiza silosu
3. Pasza drożdżowa
Rozdział XVII. Mikroflora mleka i przetworów mlecznych
1. Analiza bakteriologiczna mleka
2. Metody izolacji bakterii kwasu mlekowego w czystej kulturze
3. Znajomość mikroflory masła
Indeks literatury
Transkrypcja
1 Ministerstwo Edukacji i Nauki Federacja Rosyjska Federalna Agencja ds. Edukacji Moskiewski Państwowy Uniwersytet Inżynierii Środowiska Kustova N.A. PRAKTYKA LABORATORYJNA W MIKROBIOLOGII Moskwa 2005
2 Warsztaty laboratoryjne z mikrobiologii przeznaczone są dla studentów specjalności 3207 i 3302 w dyscyplinie „Podstawy Mikrobiologii i Biotechnologii”, a także dla studentów Katedry Biotechnologii Środowiskowej i Przemysłowej w dyscyplinie „Mikrobiologia Środowiskowa i Przemysłowa”. Warsztaty podzielone są na trzy sekcje. Pierwsza część poświęcona jest zagadnieniom mikrobiologii ogólnej. W pracach tego działu badana jest budowa morfologiczna różnych grup mikroorganizmów, metody badań mikroskopowych, technika inokulacji mikrobiologicznej, metody sterylizacji oraz metody ilościowego rozliczania mikroorganizmów. Drugi dział zawiera prace dotyczące wykorzystania drobnoustrojów w biotechnologii do otrzymywania różnych substancji kwasów organicznych, alkoholi, antybiotyków, enzymów. W pracach części trzeciej badane są zagadnienia mikrobiologii ekologicznej. Część prac pokazuje rolę mikroorganizmów w globalnych cyklach biogeochemicznych, pozostałe poświęcone są problematyce biotechnologicznej ochrony środowiska. Każdy temat zawiera wprowadzenie teoretyczne oraz część praktyczną, która opisuje zastosowane metody, procedurę wykonywania pracy, treść raportu z pracy, a także pytania kontrolne. 2
3 WSTĘP Warsztat laboratoryjny z mikrobiologii przeznaczony jest dla studentów III roku specjalności 3207 i 3302 w dyscyplinie „Podstawy Mikrobiologii i Biotechnologii”, a także dla studentów IV roku Katedry Biotechnologii Środowiska i Przemysłu, specjalność „Biotechnologiczna Ochrona Środowiska w dyscyplinie „Mikrobiologia środowiskowa i przemysłowa”. Podstawą warsztatu laboratoryjnego jest „Instrukcja metodyczna pracy laboratoryjnej”, wyd. PI Nikołajew, które były używane w dziale „Procesy i urządzenia produkcji mikrobiologicznej” od momentu powstania działu. W nauczaniu mikrobiologii podczas szkolenia inżynierów dla przemysłu mikrobiologicznego ogromny wkład wniósł starszy pracownik naukowy, dr hab. N.V. Pomortseva. Pod jej kierownictwem przygotowano wytyczne metodyczne akademicy wydziały: M.A. Boruzdina, I.E. Lomova, N.A. Kustova, T.A. Makhotkina i K.A. Solovieva. Zmiana program zgodnie z nową specjalnością inżynier środowiska spowodował konieczność poszerzenia kierunku mikrobiologii i uzupełnienia go o zadania z zakresu biotechnologicznych metod ochrony środowiska. Warsztat laboratoryjny podzielony jest na trzy sekcje. Pierwsza część poświęcona jest mikrobiologii ogólnej: morfologii drobnoustrojów, metodom jej badania, technice upraw mikrobiologicznych, metodom ilościowego rozliczania drobnoustrojów. Druga sekcja obejmuje kilka przykładów wykorzystania drobnoustrojów w przemyśle. Rozdział trzeci obejmuje zagadnienia ekologii mikroorganizmów, ich roli w globalnych cyklach pierwiastków oraz biotechnologicznych metod ochrony środowiska. W przygotowaniu tego warsztatu wzięli udział doktorant wydziału N.V. Zyabreva i starszy pracownik naukowy. E.S. Gorszyna. Autor wyraża głęboką wdzięczność doc. dział Mikrobiologia MSU N.N. Kolotilova za cenne uwagi i porady, a także starszy badacz. P.P. Makeev za pomoc w formatowaniu tekstu i materiałów ilustracyjnych. 3
4 4 OGÓLNE ZASADY PRACY W LABORATORIUM MIKROBIOLOGICZNYM Zasady pracy i zachowania w laboratorium Zasady pracy i zachowania w laboratorium laboratorium mikrobiologiczne mają wiele wspólnego z zasadami pracy w laboratoriach chemicznych, ale mają swoją specyfikę. W większości przypadków mikrobiolog pracuje z czystymi kulturami mikroorganizmów, tj. z mikroorganizmami dowolnego rodzaju, gatunku i szczepu. Ponieważ na wszystkich otaczających obiektach iw powietrzu znajdują się obce drobnoustroje, stosuje się specjalne metody pracy, aby uniknąć zanieczyszczenia badanej kultury mikroorganizmu lub samej osoby. W tym celu pożywki hodowlane, naczynia, instrumenty są sterylizowane, laboratorium i miejsca pracy są utrzymywane w czystości, a podczas pracy z drobnoustrojami przestrzegane są pewne zasady. W laboratorium nie powinno być żadnych zbędnych przedmiotów. Czyszczenie na mokro powinno odbywać się regularnie. Okresowo dezynfekowane są różne powierzchnie pomieszczeń laboratoryjnych. Dezynfekcja to dezynfekcja, tj. niszczenie patogenów chorób zakaźnych na stanowiskach otoczenie zewnętrzne... Aby to zrobić, użyj 0,5 do 3% roztworu chloraminy lub 35% roztworu fenolu (kwasu karbolowego). Stół roboczy należy zdezynfekować 70% roztworem alkoholu etylowego lub izopropylowego. Dezynfekcja powietrza jest osiągana przez prostą wentylację (przynajmniej min). Bardziej skutecznym sposobem dezynfekcji powietrza jest napromieniowanie pomieszczenia promieniami ultrafioletowymi za pomocą lamp bakteriobójczych. Szczególnie często do sterylizacji pudełka stosuje się promieniowanie ultrafioletowe. Boks to specjalne małe pomieszczenie do zaszczepiania czystych kultur, ilościowej rejestracji drobnoustrojów na szalkach Petriego i innych prac wymagających szczególnie czystych warunków. Przed pracą skrzynka jest naświetlana min. Stół jest przecierany alkoholem, ściany i podłoga są okresowo myte. Zamiast pudełka, laboratoria mogą być wyposażone w komory z przepływem laminarnym (ryc. 1), które są również sterylizowane lampami bakteriobójczymi. Na
Podczas pracy wentylator jest włączony, aby wytworzyć laminarny przepływ sterylnego powietrza przechodzącego przez filtry bakteriobójcze. Główne wyposażenie laboratorium mikrobiologicznego to: mikroskopy, termostaty do hodowli drobnoustrojów, sprzęt do sterylizacji (autoklaw i suszarnia), wirówki, destylator, lodówka do przechowywania kultur muzealnych drobnoustrojów, szafki do umieszczania naczyń szklanych i odczynników, niezbędne instrumenty (fotoelektryczne kolorymetry, pH-metry itp.). Każdemu uczniowi przydzielane jest stanowisko pracy, na którym umieszcza: mikroskop przykryty pokrywą, pętlę bakteriologiczną, szkiełka podstawowe i nakrywkowe, sterylne pipety, palnik alkoholowy, paski bibuły filtracyjnej, marker na szkle, naczynie z płynem dezynfekującym . Na stole nie powinno być niczego, co nie jest bezpośrednio związane z wykonywaniem pracy. Na zajęciach laboratoryjnych z mikrobiologii należy przestrzegać zasad bezpieczeństwa. 5
6 6 Krótka informacja o bezpieczeństwie w laboratorium W praktyce mikrobiologicznej szeroko stosowane są wyroby szklane wykonane ze szkła chemicznego. Podczas pracy z nim należy zachować ostrożność. Ostrożnie usuwaj odłamki potłuczonych naczyń. W analizach często stosuje się mocne roztwory zasad i kwasów. Należy z nimi pracować bardzo ostrożnie, ponieważ substancje te są szkodliwe dla skóry rąk i ubrań. W przypadku przypadkowego rozlania kwasu należy go zalać dużą ilością sody, a następnie kilkakrotnie spłukać wodą. Rozlane zasady należy dokładnie wytrzeć, a przedmioty, z którymi się zetknęły, należy potraktować słabym roztworem kwasu octowego. W przypadku kontaktu kwasów lub zasad ze skórą ludzką należy je natychmiast zmyć dużą ilością wody. Laboratorium mikrobiologiczne zajmuje się żywymi mikroorganizmami. Główna praca wykonywana jest sterylnie, tj. pracować z jedną kulturą drobnoustrojów, która nie powinna być skażona obcymi drobnoustrojami. Aby zapobiec zanieczyszczeniu upraw, stosuje się specjalne metody sterylizacji. Ważne jest również utrzymywanie laboratorium w czystości. Naczynia zawierające kultury drobnoustrojów nie powinny być otwarte. Biomasa mikroorganizmów, jeśli nie jest potrzebna do analizy, jest wyrzucana dopiero po sterylizacji w autoklawie. Rośliny drobnoustrojów powstają w pobliżu płomienia palnika gazowego lub alkoholowego, dlatego należy uważać na oparzenia, a przede wszystkim starannie zbierać długie włosy. Palnik powinien palić się tylko w razie potrzeby. Jeśli podczas siewu przypadkowo zapali się bawełniany zatyczka, lampa alkoholowa lub papier, gasić ogień ręcznikiem. W przypadku większych pożarów stosuje się gaśnice. Zużyte pipety, szkiełka, szkiełka nakrywkowe, szpatułki itp. umieścić w naczyniu z płynem dezynfekującym. Studenci muszą stale pamiętać, że mają do czynienia z drobnoustrojami, które nie zawsze mogą być bezpieczne, zwłaszcza w pracach nad izolacją drobnoustrojów z obiektów środowiskowych. Dlatego pod koniec lekcji uczniowie powinni posprzątać miejsce pracy i umyć ręce wodą z mydłem.
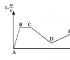
7 W przypadku awarii zasilania wyłącz urządzenia elektryczne i ich scentralizowane zasilanie. SEKCJA 1. MIKROBIOLOGIA OGÓLNA TEMAT 1. Morfologia drobnoustrojów i metody jej badania Mikrobiologia zajmuje się badaniem organizmów, które mają wymiary mikroskopowe, czyli tzw. mierzone w mikrometrach lub ułamkach mikrometrów. Jeden mikrometr to 10-6 metrów i jest skracany do mikronów. Mikroorganizmy charakteryzują się intensywnym metabolizmem i są zdolne do przeprowadzania różnorodnych przemian chemicznych. Różne mikroorganizmy różnią się zarówno budową, jak i przeprowadzanymi przez nie procesami biochemicznymi. Łączenie ich w jedną grupę wynika nie tylko z ich niewielkich rozmiarów, ale także ze wspólności metod uprawy i badań. Badanie struktury mikroorganizmów, ich wyglądu, kształtu, wielkości, tj. aby zbadać morfologię mikroorganizmów, użyj mikroskopu. Najmniejsze cząstki, które można zobaczyć we współczesnych mikroskopach świetlnych, to ponad 1/3 długości fali światła, czyli nie mniej niż 0,2 mikrona, co wiąże się z wykorzystaniem widzialnej części światła o długości fali od 0,4 mikrona do 0,7 mikrona. Urządzenie mikroskopowe Rys. 2 przedstawia wygląd mikroskopu MBI-3, który jest szeroko rozpowszechniony w praktyce badawczej i edukacyjnej. Badany preparat umieszcza się na stoliku i oświetla od dołu promieniami świetlnymi, które wychodzą z iluminatora, padają na zwierciadło, a następnie przechodzą przez kondensor i skupiają się na preparacie. Główne elementy mikroskopu: okulary, tubus, obrotowa przystawka z obiektywami, stolik z zaciskami preparatów, kondensor, makro i mikrośruby do ogniskowania i wreszcie statyw, w którym to wszystko jest zamontowane. 7
8 Przed mikroskopem sprawdź poprawność instalacji oświetleniowej (wg Koehlera). W tym celu przesuwając oprawkę lampy z żarówką, uzyskują wyraźny obraz gwintu 8
9 żarzenie lampy na całkowicie zamkniętej przesłonie kondensora tak, aby obraz ten całkowicie wypełniał otwór kondensora. Po zamknięciu przesłony iluminatora otworzyć przesłonę kondensora i przesuwając kondensor uzyskać ostry obraz przesłony iluminatora w polu widzenia mikroskopu. Aby jasne światło nie oślepiało oczu, najpierw zmniejsza się żarnik lampy. I wreszcie obraz otworu apertury ustawiany jest w centrum pola widzenia, a przesłona oświetlacza jest otwarta tak, że całe pole widzenia jest oświetlone. Mikroskop jest systemem optycznym z dwoma stopniami powiększenia: pierwsze powiększenie realizowane jest przez obiektyw, drugie przez okular. Soczewka daje powiększony odwrócony obraz obiektu, który jest oglądany przez okular. W rezultacie oko obserwatora widzi bardzo powiększony odwrócony obraz obiektu. Dlatego ruch obiektu w lewo jest postrzegany przez oko jako ruch w prawo. Całkowite powiększenie mikroskopu, tj. Powiększenie, z jakim obiekt jest oglądany pod mikroskopem, definiuje się jako iloczyn powiększenia obiektywu i okularu. Obiektywy dają powiększenie 10, 40, 60, 90 razy, czasami okulary. Jeśli używana jest przystawka dwuokularowa, zapewnia ona dodatkowe powiększenie. Na ryc. 3 przedstawia schematyczny diagram układu optycznego mikroskopu. Obiekt O tworzy w płaszczyźnie Z rzeczywisty odwrócony obraz A obiektu A. Obraz oddany przez obiektyw jest dodatkowo powiększany za pomocą okularu E. Ponieważ Z znajduje się w ognisku okularu E, obserwator widzi powiększony wirtualny obraz A w płaszczyzna X, która zwykle znajduje się 25 cm od oka, czyli w odległości najwygodniejszej dla widzenia w bliży. Należy mieć na uwadze, że takie wyobrażenie o mechanizmie formowania obrazu jest nieaktualne najwyższy stopień uproszczona, ponieważ ignoruje wpływ dyfrakcji i wielu innych czynników. W pracy z mikroskopem studenci studiują preparaty drobnoustrojów z powiększeniem w czasie. Najwyższe powiększenie podane przez mikroskop optyczny wynosi 3000 razy. Najmniejszy rozmiar cząstek, który można zobaczyć w takim mikroskopie, 9
10 jest równe 0,2 μm, co wynika z długości fali widzialnej części widma. Morfologia mikroorganizmów Świat mikroorganizmów obejmuje ogromną różnorodność form, które nie stanowią jednej grupy systematycznej. Głównymi przedmiotami mikrobiologii są bakterie, ale oprócz nich mikrobiolodzy badają także drożdże, grzyby, mikroskopijne glony i niektóre pierwotniaki. Na ryc. 4 przedstawia główne grupy mikroorganizmów (z wyjątkiem pierwotniaków); zachowane są proporcje ich rozmiarów. Wszystkie żywe organizmy, z wyjątkiem wirusów, mają struktura komórkowa... Zgodnie z ich organizacją komórkową dzielą się na prokariotyczne i eukariotyczne. dziesięć
11 Główną różnicą między eukariontami a prokariotami jest obecność wtórnych jam oddzielających jądro i inne struktury komórkowe od cytoplazmy. To pojawienie się wtórnych wnęk umożliwiło skok w ewolucji całego świata żywego dzięki wzrostowi wewnętrznej powierzchni błon eukariotycznych. Umożliwiło to, zgodnie ze wzrostem szybkości dyfuzji, jednoczesne prowadzenie większej liczby reakcji biochemicznych zachodzących na błonach. Prokarionty to bakterie, w tym promieniowce i cyjanobakterie. Eukarionty to wszystkie rośliny, zwierzęta, drożdże, grzyby, pierwotniaki. Wśród prokariontów wyróżnia się obecnie grupę archebakterii, do której zaliczają się metanogeny, ekstremalne halofile, (żyjące w bardzo słonej wodzie), niezwykle ciepłolubne bakterie utleniające i redukujące siarkę cząsteczkową, a także pozbawione ściany komórkowej termoplazmy. Nowy podział został dokonany na podstawie porównania sekwencji nukleotydowych w małych fragmentach rybosomalnego RNA. jedenaście
12 Archebakterie różnią się składem ścian komórkowych, lipidami oraz niektórymi innymi cechami fizjologicznymi i biochemicznymi (np. mają inny mechanizm wiązania CO 2 ). Tak więc w strukturze organizacji komórkowej wyróżnia się obecnie trzy grupy: archeony (według nowej nomenklatury Archaea, archaea), eubakterie (według nowej nomenklatury Bakterie, bakterie) i eukarionty (według nowej nomenklatury Eukarii). Praca 1. Badanie mikroskopowe bakterii Morfologia bakterii Wprowadzenie teoretyczne Ta grupa drobnoustrojów jest najliczniejsza, rozpowszechniona w przyrodzie i ma duże znaczenie przemysłowe. Do nazewnictwa mikroorganizmów używa się nomenklatury binarnej, jak w zoologii i botanice. Zgodnie z tą nomenklaturą każdy gatunek ma nazwę składającą się z dwóch słów łacińskich. Pierwsze słowo oznacza rodzaj, a drugie rodzaj. Nazwa rodzajowa jest zawsze pisana z dużej litery, a nazwa szczegółowa z małej litery. Większość bakterii Jednokomórkowe organizmy kulisty, prętowy lub zawiły. Wśród bakterii występuje niewielka liczba form nitkowatych. Bakterie są bardzo małe, średnica komórki bakterii kulistych wynosi 12 µm. Bakterie rozmnażają się przez podział (w sprzyjających warunkach podział następuje w minutach). Niektóre bakterie są mobilne. Zdolność do poruszania się wiąże się z obecnością specjalnych organelli wici. Najprostsze w kształcie są bakterie kuliste (cocci). Spotykają się w postaci pojedynczych kulek lub kulek połączonych ze sobą. W zależności od umiejscowienia komórek po podziale, kuliste bakterie dzielą się na monokoki (pojedyncze ziarna), tetrakoki (połączone przez 4), sarcyny (połączone przez 8), gronkowce (klastry), paciorkowce (łańcuchy ziaren). 12
13 Najliczniejszą grupę bakterii stanowią bakterie w kształcie pręcików. Mają cylindryczny kształt komórek z zaokrąglonymi lub spiczastymi końcami i różnią się znacznie stosunkiem długości do szerokości. Mogą być zlokalizowane pojedynczo lub tworzyć krótkie lub długie łańcuchy. Pręty mogą mieć różne długości, zwykle kilka mikronów i szerokość około 1 mikrona. Niektóre bakterie w kształcie pręcików tworzą wewnątrz komórki specjalne zarodniki. Każda komórka tworzy jeden zarodnik, który służy do znoszenia niekorzystnych warunków. Zarodnik kiełkuje w odpowiednich warunkach (temperatura, wilgotność, składniki odżywcze), zamieniając się w patyk. Odporność przetrwalników bakteryjnych jest większa niż jakiegokolwiek żywego organizmu. Na przykład zarodnik siana Bacillus subtilis może wytrzymać temperaturę 100°C przez 3 h. Ta odporność na zarodniki utrudnia walkę z infekcjami. Skręcone mikroorganizmy różnią się stopniem krzywizny komórek i liczbą zwojów. Dzielą się na vibrios, spirillae i krętki. Jeśli bakteria ma jeden niepełny skręt spirali, nazywa się to wibrio. Jeśli bakteria ma kilka spiralnych loków, nazywa się ją spirillą, a drobnoustroje o zwiniętym kształcie z dużą liczbą małych loków nazywane są krętkami. Bakterie nitkowate to włókna złożone z komórek cylindrycznych lub w kształcie dysku. Niektóre rodzaje nici są zamknięte w błonie śluzowej, którą można impregnować wodorotlenkiem żelaza lub solami manganu. W komórkach niektórych bakterii żelazowych dochodzi do akumulacji metali ciężkich z roztworów. Duże bakterie nitkowate s. Beggiatoa odkładają siarkę w swoich komórkach. Bakterie nitkowate żyją zwykle w wodach morskich i słodkich, znajdują się również w rozkładających się pozostałościach organicznych, w jelitach zwierząt. Cyjanobakterie obejmują dużą grupę organizmów, które łączą prokariotyczną strukturę komórki ze zdolnością do przeprowadzania fotosyntezy. Pigmenty komórek sinicowych, oprócz chlorofilu a (zielonego), zawierają pigment fikocyjaninowy 13
14 niebieski. Z tego powodu wcześniej nazywano je sinicami. Większość z nich to organizmy wielokomórkowe, które są długimi, najczęściej nierozgałęzionymi włóknami (włoskami). Komórki we włóknach są połączone wspólną ścianą zewnętrzną. Czasami tworzą się śluzowe nagromadzenia „mat”. Powielanie odbywa się poprzez rozbicie nici na oddzielne sekcje. Niektóre gatunki poruszają się ślizgając się (s. Spirulina). Promieniec (bakterie rozgałęziające się, grzyby promieniste) to duża grupa mikroorganizmów prokariotycznych, które tworzą cienkie, rozgałęzione włókna o długości kilku mm i średnicy 0,5–1,5 µm. Stanowią swoistą grupę mikroorganizmów, która morfologicznie przypomina pleśnie (ryc. 5). Komórki znacznej części przedstawicieli tej grupy są zdolne do rozgałęzień, co jest charakterystyczną cechą grzybów. Jednak długość rozgałęzionych włókien promieniowców sięga kilku milimetrów, podczas gdy długość grzybni grzybów wynosi kilka centymetrów. Strzępki grzybów są zwykle kilkakrotnie grubsze niż włókna promieniowców. Zgodnie z morfologią i rozwojem promieniowce dzielą się na formy wyższe i niższe. Najwyższe są organizmy z dobrym 14
15 rozwinęła septyczną lub nieseptyczną grzybnię i specjalne narządy zarodnikujące. Zarodniki powstają w postaci łańcuchów na specjalnych zarodnikowych strzępkach grzybni powietrznej. Struktura organów zarodnikowych jest różna u różnych gatunków: długa lub krótka, prosta lub spiralna (ryc. 6). Dzięki obecności grzybni i budowie organów zarodnikowych wyższe promieniowce przypominają grzyby strzępkowe. Niektóre promieniowce mają grzybnię tylko w młodej kulturze, która z wiekiem rozpada się, tworząc komórki w kształcie pręcików i kokoidów. Niższe formy promieniowców nie mają prawdziwej grzybni. Zdolność do tworzenia grzybni wyraża się w nich jedynie tendencją komórek do rozgałęziania. Do promieniowców niższych należą np. gatunki z rodzaju Mycobacterium, które mają zdolność zmiany kształtu komórek wraz z wiekiem hodowli (ryc. 7). Ta właściwość nazywa się pleomorfizmem. Wśród wyższych promieniowców wiodącą pozycję pod względem liczebności w środowiskach naturalnych zajmują gatunki z rodzaju Streptomyces. Promieniowce odgrywają ważną rolę w procesach 15
16 kształtowanie gleby i tworzenie żyzności gleby. Promieniowce niszczą złożone związki organiczne (celuloza, próchnica, chityna, lignina itp.), niedostępne dla wielu innych mikroorganizmów. Prawie wszystkie gatunki z rodzaju Streptomyces tworzą specyficzne produkty odpadowe o właściwościach antybiotycznych. Niektóre gatunki są przyczyną chorób roślin, zwierząt i ludzi. Oprócz głównych form bakterii istnieją bakterie macierzyste i pączkujące, które wyrastają, zwane protezami. (rys. 8) 16
17 Funkcje ściegów są różne. U niektórych bakterii służą do rozmnażania, u innych do przyczepiania się komórki do podłoża. 17
18 18 Część praktyczna Celem pracy jest zbadanie morfologii przedstawicieli bakterii Procedura wykonywania pracy Wykonując pierwszą pracę uczniowie uczą się posługiwania mikroskopem, patrzą na gotowe preparaty przedstawicieli bakterii, następnie samodzielnie przygotowują preparaty żywych bakterii i badaj je pod mikroskopem. Najpierw uczniowie pod mikroskopem podają gotowe preparaty bakteryjne. Preparaty stałe to mikroorganizmy zawieszone w środowisku wodnym, wysuszone na szkiełku podstawowym i wybarwione barwnikami anilinowymi. Studenci samodzielnie przygotowują preparaty niektórych żywych mikroorganizmów. W tym celu niewielką kroplę wody z kranu nanosi się na czyste szkiełko, do którego za pomocą kalcynowanej i schłodzonej pętli bakteriologicznej wprowadza się niewielką ilość badanych drobnoustrojów, dokładnie miesza i przykrywa szkiełkiem nakrywkowym. Nadmiar wody usuwa się bibułą filtracyjną. Próbkę umieszcza się na stoliku i zabezpiecza zaciskami. Najpierw patrząc przez okular i obracając makrośrubę, uzyskują ostry obraz obiektu przy małym powiększeniu z obiektywem 10x. Następnie mikroskop zostaje przeniesiony do dużego powiększenia z obiektywem 40x. Obracanie śrub musi być wykonywane ostrożnie, ponieważ w przypadku zbyt ostrego opuszczania soczewki mogą zostać zmiażdżone przez obiektyw. Podczas mikroskopowania należy pamiętać, że mikroskop, szczególnie przy dużych powiększeniach, nie uchwyci całej głębokości przedmiotu, dlatego przy stopniowym opuszczaniu tubusu za pomocą mikrośruby, przedmiot najpierw widziany jest z góry , a następnie w sekcji optycznej. 1. Oglądanie utrwalonych preparatów drobnoustrojów. Środek do fermentacji kwasu mlekowego Lactococcus lactis; kształt komórek to kuliste ziarna; komórki są połączone w łańcuchy. Służy do otrzymywania produktów kwasu mlekowego.
19 Bakterie w kształcie pałeczek Lactobacillus acidophilum; czynnik sprawczy fermentacji kwasu mlekowego. Służy do otrzymywania produktów kwasu mlekowego. Acetobacter aceti to bakterie w kształcie pałeczki, które utleniają etanol do kwasu octowego. Używany do robienia jadalnego octu. Streptomyces griseus promieniowiec, kształt komórki w postaci cienkich, rozgałęzionych włókien; producent antybiotyku streptomycyny. Saccacharopolyspora erythrae promieniowiec, kształt komórki w postaci cienkich, rozgałęzionych włókien; producent antybiotyku erytromycyny. 2. Oglądanie na żywo preparatów formujących się komórek Bacillus subtillis w postaci cienkich, ruchomych pręcików; tworzy zarodniki; producent preparatów enzymatycznych. cyjanobakterie Spirulina platensis; kształt komórek w postaci pojedynczej nici, składającej się z cylindrycznych komórek, ściśle przylegających do siebie; ma ruch ślizgowy. Jest stosowany jako dodatek do żywności. Treść referatu 1. Łacińska nazwa mikroorganizmu. 2. Morfologia komórek (podaj rysunek przedstawiający powiększenie mikroskopu i zachowanie proporcji wielkości komórek). 3. Wykorzystanie badanych bakterii w przemyśle. Pytania kontrolne 1. Opisz konstrukcję mikroskopu. 2. Jak określić powiększenie mikroskopu? 3. Jaki jest kształt komórek bakterii. 4. Wymień cechy morfologii promieniowców. 5. Jakich znasz przedstawicieli bakterii i jakie są ich Praktyczne znaczenie? Praca 2. Morfologia mikroorganizmów eukariotycznych Wprowadzenie teoretyczne 19
20 Do mikroorganizmów eukariotycznych badanych przez mikrobiologów należą grzyby, drożdże, mikroalgi i niektóre pierwotniaki. Morfologia grzybów Grzyby to wolne od chlorofilu mikroorganizmy z komórkami nitkowatymi. Tworzone przez nie długie, rozgałęzione włókna nazywane są strzępkami. Strzępki tworzą razem grzybnię. Pod względem wielkości strzępki grzybów są znacznie większe niż promieniowce. Grzybnia w wielu pleśni jest podzielona przez przegrody (grzybnia przegrodowa), podczas gdy inne typy przegród są nieobecne. W biotechnologii formy są wykorzystywane głównie jako producenci. Niektórzy przedstawiciele ficomycetes, torbaczy i niedoskonałych grzybów nazywani są „grzybami pleśniowymi”. Na gęstych podłożach pleśnie tworzą okrągłe, puszyste, przypominające pajęczyny, bawełniane lub sproszkowane kolonie o barwie zielonej, żółtawej, czarnej lub białej. Kolonie pleśni składają się z dużej liczby strzępek. Większość strzępek rozwija się w powietrzu, a niektóre na grubości podłoża. Konidiofory często tworzą się na strzępkach, na których zarodniki tworzą się albo wewnątrz zarodni, albo w postaci egzosporów ułożonych w łańcuchy. Zarodniki konidiów lub konidia służą do: rozmnażanie bezpłciowe(rys. 10). Konidia, dostając się w sprzyjające warunki, kiełkują w grzybnię. Pleśnie są bardzo rozpowszechnione w przyrodzie i mają potężny aparat enzymatyczny. Dlatego są głównymi destruktorami związków organicznych w przyrodzie. Pleśnie są również szeroko stosowane w przemyśle do produkcji kwasów organicznych, antybiotyków i enzymów. 20
21 Morfologia drożdży Drożdże to odrębna grupa jednokomórkowych mikroskopijnych grzybów o dużym znaczeniu praktycznym. Komórki drożdży to duże okrągłe lub owalne komórki (ryc. 11). Niektóre drożdże mogą tworzyć szczątkową grzybnię zwaną pseudogrzybnią. Wielkość komórek waha się od 3 µm do 10 µm długości i 2 do 8 µm szerokości. Większość drożdży rozmnaża się przez pączkowanie. Co więcej, w 21
Na powierzchni komórki pojawia się małe wybrzuszenie nerki (czasem nie jedno, ale kilka), stopniowo powiększające się i ostatecznie oddzielające się od komórki, która je wytwarza. Nerka oddzielona od komórki macierzystej staje się nową komórką drożdży. Niektóre drożdże mnożą się przez podział. W drobnoziarnistej zawartości żywych drożdży (protoplazmy) wyraźnie widoczne są duże wakuole. Wakuole to wnęki wewnątrz protoplazmy wypełnione sokiem komórkowym. Składa się z rozpuszczonych w wodzie elektrolitów, białek, węglowodanów i enzymów. W młodych komórkach drożdży protoplazma jest jednorodna, a w późniejszych stadiach rozwoju w protoplazmie pojawiają się wakuole wypełnione sokiem komórkowym z produktami przemiany materii. Kiedy pożywka jest wyczerpana, w wielu drożdżach dochodzi do zarodnikowania. U niektórych gatunków drożdży zarodniki są okrągłe i pokryte gładką skorupką. W sprzyjających warunkach zarodniki kiełkują. Drożdże są szeroko rozpowszechnione w przyrodzie. Można je znaleźć na winogronach, innych jagodach i owocach, mleku, wodzie i glebie oraz ludzkiej skórze. Wiele drożdży przeprowadza fermentację alkoholową i są wykorzystywane do produkcji alkoholu w piekarnictwie, winiarstwa i browarnictwie. 22 Morfologia pierwotniaków Pierwotniaki to jednokomórkowe organizmy świata zwierząt. Wśród mikroorganizmów są najbardziej złożone, posiadają prymitywne narządy charakterystyczne dla zwierząt wielokomórkowych. Niektóre z nich mają usta i odbyt, wakuole kurczliwe i trawienne. Pierwotniaki rozmnażają się bezpłciowo (poprzez podział komórek) i płciowo. Klasyfikacja pierwotniaków opiera się na sposobie poruszania się. 1. Sarkody. Poruszają się i chwytają jedzenie za pomocą pseudopodia, czyli fałszywych nóg. Ameba jest typowym przedstawicielem. Wielkość ameby nie przekracza mikronów.
23 2. Wiciowce. Mają gęstą błonę plazmatyczną i poruszają się za pomocą wici. Formy glebowe wici są bardzo małe (25 µm), a formy wodne duże (do 20 µm). Typowym przedstawicielem jest Euglena. 3. Rzęsek. Najlepiej zorganizowane pierwotniaki. Rozmiary komórek wahają się od 20 do 80 mikronów. Typowym przedstawicielem jest pantofelek podkowy, który jest hodowany do karmienia narybku. 4. Sporozoany. Formularze stałe. Wiele patogenów, takich jak malaria Plasmodium. Pierwotniaki są z natury szeroko rozpowszechnione. Występują w zbiornikach wodnych, w mule i glebie. Znaczenie pierwotniaków w przyrodzie jest bardzo zróżnicowane. Żyją w przewodzie pokarmowym różnych zwierząt, biorąc udział w trawieniu pokarmu roślinnego, uczestniczą w mineralizacji pozostałości organicznych w glebie, a także są ważnym elementem biocenozy w zakładach leczniczych. Żywiąc się bakteriami i zawieszonymi ciałami stałymi, pomagają klarować wodę. Najprostsze pełnią funkcję wskaźników: poprzez rozwój pewnych form można ocenić jakość oczyszczania ścieków. Tak więc przewaga ameb i brak orzęsków w osadzie czynnym wskazuje na słabą wydajność urządzeń do oczyszczania. Ciliate Tetrahymena jest szeroko stosowany do ocena wstępna toksyczność. Różne typy pierwotniaków pokazano na ryc. 12. Morfologia glonów Algi to duża grupa organizmów roślinnych. Wspólna dla nich wszystkich obecność chlorofilu i wynikające z niego odżywianie fotoautotroficzne, zdolność do syntezy materii organicznej z wykorzystaniem energii światło słoneczne i dwutlenek węgla. W wielu algach zielony kolor chlorofilu jest maskowany przez inne pigmenty. Wśród nich są bardzo małe formy jednokomórkowe i wielokomórkowe przypisywane mikroorganizmom, a także 23
24 wielokomórkowe organizmy żyjące w morzach i oceanach, czasami osiągające gigantyczne rozmiary.Przedmiotem badań mikrobiologii są niektóre mikroskopijne glony. Mają różnorodne formy i żyją zarówno na lądzie, jak iw środowisku wodnym (ryc. 13). 24
25 Część praktyczna Celem pracy jest zbadanie morfologii przedstawicieli różnych grup eukariontów. Procedura wykonywania pracy Studenci samodzielnie przygotowują żywe preparaty przedstawicieli grzybów, drożdży, alg i pierwotniaków; są one pod mikroskopem z obiektywem x40 i naszkicowane ze wskazaniem powiększenia mikroskopu. Pleśnie Aspergillus niger tworzą komórki w postaci grzybni z przegrodami; niektóre strzępki mają nierozgałęzione konidiofory z zarodnikami. Konidiofory są jednokomórkowe, kuliste spuchnięte, na powierzchni obrzęku znajdują się krótkie komórki w kształcie pinty (sterigmaty), z których każda jest sznurowana wzdłuż łańcucha czarnych konidiów. Służy do pozyskiwania kwasów organicznych i enzymów. strzępki Penicillium chrysogenum mają przegrody; na niektórych strzępkach znajdują się rozgałęzione konidiofory z zarodnikami. Konidia tworzą się na końcach całkowicie rozgałęzionych konidioforów. Służy do otrzymywania antybiotyku penicyliny. 25
26 Drożdże Saccharomyces cerevisiae samotne drożdże o owalnych i okrągłych komórkach; rozmnażać się przez pączkowanie. Wykorzystywane są w browarnictwie, piekarnictwie, produkcji alkoholu. W naturze znajdują się na powierzchni jagód i innych owoców. Komórki Saccharomyces vini są owalne i okrągłe; rozmnażać się przez pączkowanie; po pączkowaniu nie rozdzielają się przez pewien czas, tworząc małe „gałązki”. Są używane w produkcji wina. Komórki Rhodotorula glutinis są eliptyczne; komórki są pojedyncze; rozmnażać się przez pączkowanie. Są koloru pomarańczowego ze względu na zawartość karotenoidów w komórkach. Może rosnąć w środowiskach, w których źródłem węgla są węglowodory ropopochodne. Używany jako drożdże paszowe. Drożdże Candida tropicalis o owalnych i silnie wydłużonych komórkach, tworzące „pseudomycelium”. Może rosnąć w środowisku mineralnym z węglowodorami jako źródłem węgla. Używany jako drożdże paszowe. Na skalę przemysłową uprawia się je na odpadach z produkcji alkoholu i papieru. Algi Chlorella vulgaris to mikroskopijna zielona alga o zaokrąglonych komórkach (o średnicy 5-10 mikronów); rozmnażają się przez autospory, które powstają wewnątrz komórki macierzystej w ilości od 4 do 32 i są uwalniane po pęknięciu jej błony. Mogą być stosowane do masowej hodowli w celu uzyskania białka paszowego, a także do regeneracji powietrza w systemach zamkniętych (okręty podwodne, stacje kosmiczne itp.). Scenedesmus sp. należy do grupy zielenic; ma owalny kształt komórek; komórki zewnętrzne są często spiczaste; komórki są połączone w cztery. Służy do pozyskiwania białka spożywczego. 26
27 Pierwotniaki Preparat przygotowuje się z osadu czynnego zbiornika napowietrzania. Przestudiuj morfologię znalezionych pierwotniaków i naszkicuj je. Treść raportu 4. Łacińska nazwa mikroorganizmu. 5. Morfologia komórek (podaj rysunek przedstawiający powiększenie mikroskopu i zachowanie proporcji wielkości komórek). 6. Wykorzystanie badanych mikroorganizmów w przemyśle. Pytania kontrolne 1. Opisz kształt komórek przedstawicieli grzybów i ich praktyczne zastosowanie. 2. Opisać kształt komórek drożdży; wymienić przedstawicieli i opowiedzieć o ich praktycznym zastosowaniu. 3. Opowiedz nam o morfologii mikroalg i ich praktycznym zastosowaniu. 4. Wymień przedstawicieli najprostszych i opowiedz o ich zastosowaniu w biotechnologii. Praca 3. Metody badania morfologii mikroorganizmów Najpopularniejszą metodą badania morfologii bakterii jest mikroskopia utrwalonych preparatów przygotowanych z czystych kultur mikroorganizmów lub z próbki testowej. Badanie drobnoustrojów w stanie żywym wykorzystywane jest w badaniach większych form i obserwacji ruchliwości komórek. Przygotowanie utrwalonych preparatów drobnoustrojów W celu przygotowania utrwalonych preparatów drobnoustrojów najpierw przygotowuje się rozmaz, suszy, utrwala, a następnie barwi. Rozmazy przygotowywane są na idealnie czystych szkiełkach. Możesz odtłuścić szklanki alkoholem etylowym, mieszaniną równych objętości alkoholu i eteru i innymi 27
28 płynów. Najłatwiejszym i najwygodniejszym sposobem odtłuszczenia kieliszków jest przetarcie ich obustronnie mydłem do prania. Mydło usuwa się ze szkła kawałkiem suchej waty lub serwetką. Podczas robienia rozmazu z kolonii bakterii wyhodowanych na podłożu agarowym, najpierw na odtłuszczoną szklankę nakłada się kroplę wody lub soli fizjologicznej. Następnie w płomieniu palnika zapala się pętlę bakteriologiczną. Następnie, po schłodzeniu pętli na wewnętrznej ściance probówki, część kolonii bez agaru wychwytuje się ezą. Ezę hodowlaną umieszcza się w kropli wody lub soli fizjologicznej na szklance i wykonuje 2 3 ruchy okrężne. Niektóre bakterie są zawieszone w płynie. Nadmiar bakterii pozostających na pętli jest spalany w płomieniu palnika, rozgrzewając pętlę do czerwoności. Następnie schłodzoną pętlą posmaruj szklankę kroplą zawiesiny. Obszar rozmazu powinien mieć średnicę 1,5-2 cm Rozmaz powinien być cienki z równomiernym rozłożeniem materiału. Jeśli z kultury wyhodowanej w płynnej pożywce przygotowuje się rozmaz, to zachowując te same zasady sterylności, weź kroplę kultury za pomocą ezy lub pipety i nałóż ją na środek odtłuszczonej szklanki. Pipetę z resztą kultury zanurza się w naczyniu z roztworem dezynfekującym. Kropla jest równomiernie rozprowadzana na szkle za pomocą pętli bakteriologicznej. Pętla jest wypalana w płomieniu palnika i umieszczana w statywie lub szkle. Rozmaz suszy się na powietrzu lub w strumieniu ciepłego powietrza, trzymając go za podłużne żebra wysoko nad płomieniem palnika. Granice rozmazu są obrysowane ołówkiem woskowym z tyłu szklanki, a z boku rozmazu, na jednym z końców szklanki, umieszcza się numer preparatu. Dzięki tym znakom możesz łatwo nawigować w miejscu rozmazu na szkle. Wysuszony rozmaz jest utrwalony. Fiksacja ma następujące cele: 1) zabicie zarazków, co sprawia, że lek jest bezpieczny dla dalsza praca; 2) przymocować drobnoustroje do szkła, aby nie zostały spłukane podczas malowania i płukania wodą; 3) poprawić chłonność farby. 28
29 Najprostszą metodą, odpowiednią dla prawie wszystkich obiektów mikrobiologicznych i najbardziej rozpowszechnioną w praktyce, jest utrwalanie w płomieniu palnika. W tym celu szkiełko przepuszcza się 3-4 razy przez najgorętszą górną część płomienia palnika, unikając nadmiernego przegrzania preparatu, aby nie spowodować denaturacji białka oraz zaburzenia struktury i morfologii bakterii. Rozróżnij proste i złożone metody malowania różnicowego. Proste barwienie służy do wykrywania drobnoustrojów w badanym materiale, określenia ich liczby, kształtu i lokalizacji. Proste barwienie polega na nałożeniu na preparat jednego barwnika anilinowego. Najczęściej do tych celów stosuje się czerwoną fuksynę, a także alkaliczny roztwór błękitu metylenowego (błękit Lefflera). Technika barwienia: dobrze utrwalony preparat umieszcza się rozmazem do góry na szklanym mostku nad wanną. Jedną z tych farb nakłada się na powierzchnię rozmazu za pomocą pipety lub zakraplacza. Fuksynę utrzymuje się na rozmazie przez 1 do 3 minut, a niebieską przez 3 do 5 minut. Farbę spuszcza się z rozmazu, preparat myje się wodą, suszy na powietrzu lub dokładnie osusza bibułą filtracyjną. Na wysuszony rozmaz nanosi się kroplę olejku immersyjnego, preparat umieszcza się na stoliku mikroskopowym i pod mikroskopem z obiektywem immersyjnym (90) w świetle przechodzącym. Metody różnicowe barwienia bakterii. Wyrafinowane techniki barwienia są niezbędne do identyfikacji i różnicowania różnych typów drobnoustrojów. Opierają się na właściwościach fizykochemicznej struktury komórki drobnoustroju i służą do szczegółowego badania struktury komórki i identyfikacji cech charakterystycznych w odniesieniu do niektórych barwników. Dzięki tym metodom rozmaz barwiony jest kilkoma farbami i dodatkowo poddawany obróbce zaprawami lub środkami odbarwiającymi z alkoholem, kwasem itp. Metody te obejmują najważniejszą metodę barwienia dla różnicowania bakterii, barwienie metodą Grama. Ta metoda ujawnia 29
Zdolność bakterii do zatrzymywania barwnika lub odbarwienia w alkoholu, co jest związane z chemiczną strukturą ściany komórkowej. Wszystkie bakterie dzielą się na dwie grupy ze względu na budowę ściany komórkowej: 1) Gram-dodatnie barwiące się według Grama i 2) Gram-ujemne niebarwiące się według Grama. Stosunek do barwienia metodą Grama jest tak ważną różnicową cechą bakterii, że jest koniecznie wymieniany przy ich charakterystyce i służy jako cecha taksonomiczna. Technika barwienia 30 gramów Na utrwalony rozmaz umieszcza się pasek bibuły filtracyjnej wstępnie impregnowanej fioletem gencjanowym. Nanieś na pasek 3-5 kropli wody z kranu. Po 1-2 minutach bibułkę zdejmuje się pęsetą, a na preparat wylewa się płyn Lugola. Po 30 s i 1 min wylewa się płyn Lugola. Nakłada się kilka kropli alkoholu 96 O. Odbarwia się przez 1 min, aż znikną szaro-fioletowe smugi. Preparat myje się wodą. Fuksynę wylewa się na rozmaz i trzyma przez 12 minut. Farbę spuszcza się, preparat myje się wodą, suszy bibułą filtracyjną. Mikroskopowy z systemem zanurzeniowym. Bakterie Gram-dodatnie mają kolor fioletowo-niebieski (np. pałeczek fermentacyjny kwasu masłowego Clostridium pasteurianum), a bakterie Gram-ujemne zabarwiają się na różowo-czerwono (E. coli Escherichia coli). Oprócz tej tradycyjnej techniki barwienia metodą Grama istnieje szybka i łatwa metoda różnicowania metodą Grama bez barwienia. Komórki bakteryjne (najlepiej w wieku 1–2 dni) umieszcza się w pętli w kropli 3% KOH na szklanym szkiełku, miesza się ruchem okrężnym i po 5 8 s pętlę gwałtownie podnosi. Zawiesina bakterii Gram-ujemnych staje się lepka i rozciąga się za pętlą, tworząc błonę śluzową. Bakterie Gram-dodatnie są równomiernie rozmieszczone w kropli zasady (jak w wodzie). Reakcja jest uważana za negatywną, jeśli w ciągu 60 sekund nie zaobserwuje się tworzenia błon śluzowych. Wzrost lepkości jest spowodowany lizą ścian komórkowych bakterii Gram-ujemnych w roztworze
31 uwalnianie zasad i DNA. Metodę różnicowania bakterii według Grama bez barwienia należy stosować tylko do wstępnej diagnostyki lub do obliczenia przybliżonego stosunku kolonii bakterii Gram-dodatnich i Gram-ujemnych. Wykrywanie żywych i martwych komórek przez barwienie błękitem metylenowym Liczbę żywych i martwych komórek można określić przez barwienie roztworem błękitu metylenowego. Metoda opiera się na różnej przepuszczalności żywych i martwych komórek mikroorganizmów. Przepuszczalność komórek martwych komórek jest osłabiona, więc barwnik swobodnie przechodzi przez błonę cytoplazmatyczną i jest adsorbowany przez protoplazmę. Pod mikroskopem martwe komórki wydają się niebieskie, żywe komórki są bezbarwne lub bladoniebieskie. Barwienie przeprowadza się w następujący sposób: kroplę 2% roztworu błękitu metylenowego nanosi się na szkiełko przykryte szkiełkiem nakrywkowym, nadmiar farby odciąga się kawałkiem bibuły filtracyjnej. Lek jest oglądany pod mikroskopem, w 10 polach widzenia liczona jest liczba żywych i martwych komórek; liczba martwych komórek jest wyrażona w%. Przykład: średnia liczba żywych komórek w jednym polu widzenia to 10, średnia liczba martwych komórek w jednym polu widzenia to 5, Łączna komórki w jednym polu widzenia komórek 100% 5 komórek X X 33,3% 15 Zatem liczba martwych komórek w badanej zawiesinie mikroorganizmów wyniosła 33,3%. Określanie wielkości komórek Do określenia wielkości komórek drobnoustrojów niezbędne jest posiadanie specjalnego okularu ze skalą (mikrometr okularowy) oraz przedmiotu mikrometrycznego. Mikrometr okularowy, przy 31
32 w najprostszym przypadku to szklany krążek z nadrukowaną skalą liniową, który wkłada się do okularu (ryc. 14a). Przedmiotem mikrometru jest szkiełko mikroskopowe, na środku którego wygrawerowana jest skala liniowa o długości 1 mm, z podziałką 10 mikronów. Przed pomiarem konieczne jest określenie wartości podziałki mikrometru okularowego dla każdego powiększenia mikroskopu. W tym celu na stoliku mikroskopu umieszczany jest przedmiot mikrometryczny i traktowany jako preparat; w tym przypadku jeden z widocznych działek obiekt-mikrometr jest zrównany ze znakiem zerowym podziałki mikrometru okularowego i odnotowuje się zbieżność podziałek obu podziałek (rys. 15). W tym segmencie liczona jest ilość działek okularowych i obiektywowych oraz obliczana jest cena działek mikrometru okularowego. Jeśli po tym na scenie zamiast mikrometru zostanie umieszczony preparat drobnoustrojów i zbadany 32
33 przy tym samym powiększeniu można zmierzyć wielkość komórki drobnoustroju przy użyciu skali mikrometru okularowego jako linijki. Do dokładnych pomiarów stosuje się specjalny mikrometr okularowy z przesuwnym znacznikiem zerowym powiązanym z bębnem pomiarowym (rys. 14b). Pozwala określić wielkość drobnoustrojów z dokładnością do dziesiątych części mikrona. Znak zerowy to podwójna pionowa linia, której środek odpowiada przecięciu dwóch cienkich linii w formie krzyża. Przed pomiarem konieczne jest poznanie podziału skali bębna pomiarowego. Obiektem odniesienia jest mikrometr. Obracając bęben pomiarowy, kilka działek skali obiekt-mikrometr jest zakreślonych znakiem zerowym. Podwójna pionowa linia pokazuje liczbę pełnych obrotów bębna pomiarowego. Wykonując pomiary drobnoustrojów, przesuń znak zerowy wzdłuż obiektu i odczytaj odczyty z bębna pomiarowego. Część praktyczna Celem pracy jest opanowanie podstawowych metod badania morfologii drobnoustrojów. 33
34 Procedura wykonywania pracy 1. Przygotować utrwalone preparaty bakterii kwasu mlekowego z biokefiru i acidophilus. 2. Wykonać barwienie metodą Grama komórek Bacillus subtilis (gram +) i Escherichia coli (gram-). 3. Określić wielkość komórek drożdży Saccharomyces cerevisiae. 4. Określić liczbę żywych i martwych komórek Saccharomyces cerevisiae w zawiesinie drożdży. 34 Treść raportu 1. Morfologia komórek bakterii kwasu mlekowego (zdjęcia utrwalonych preparatów bakterii kwasu mlekowego, ze wskazaniem powiększenia mikroskopu). 2. Rysunki utrwalonych preparatów bakterii Gram-ujemnych i Gram-dodatnich. 3. Wyznaczenie skali bębna pomiarowego mikrometru okularowego. 4. Rozmiary komórki drożdży Saccharomyces cerevisiae. 5. Liczba żywych i martwych komórek w zawiesinie drożdży. Pytania testowe 1. Jak przygotować utrwalony preparat bakteryjny? 2. Jaki jest powód różnicy w bakteriach w barwieniu metodą Grama? 3. Jaka jest metoda barwienia metodą Grama? 4. Jak określić wielkość mikroorganizmów? 5. Jak określić liczbę żywych i martwych komórek drobnoustrojów poprzez barwienie błękitem metylenowym? Temat 2. Hodowla mikroorganizmów: zasady tworzenia pożywek; metody sterylizacji; metody inokulacji i ponownego wysiewu drobnoustrojów. Klasyfikacja i przygotowanie pożywek Hodowla mikroorganizmów oznacza sztuczne tworzenie warunków do ich wzrostu. Do uprawy
35 mikroorganizmów w laboratorium lub w przemyśle wykorzystuje się pożywki zawierające wszystkie substancje niezbędne do życiowej aktywności mikroorganizmów. Ze środowiska składniki odżywcze przedostają się do komórki mikroorganizmu, a produkty przemiany materii są usuwane z komórki do środowiska. Do życia mikroorganizmów potrzebna jest woda, węgiel, tlen, azot, siarka, fosfor, potas, wapń, magnez, żelazo i pierwiastki śladowe. Wszystkie te substancje muszą być zawarte w pożywce. Nawet bez jednego z nich w ogóle nie będzie wzrostu lub będzie on nieistotny. Węgiel, wodór, azot, fosfor i siarka nazywane są pierwiastkami biogennymi, ponieważ stanowią około 90-95% suchej masy komórek. Potas, magnez, wapń i sód nazywane są makroelementami lub elementami popiołu. Stanowią do 5-10% suchej masy komórek. Żelazo, mangan, molibden, kobalt, miedź, wanad, cynk, nikiel i niektóre inne kationy metali ciężkich nazywane są pierwiastkami śladowymi i stanowią ułamek procenta suchej masy komórek. Najwyższa wartość zawiera węgiel dla każdego żywego organizmu. Jest częścią wszystkich cząsteczek organicznych w komórce i stanowi około 50% suchej biomasy. W odniesieniu do węgla wszystkie organizmy dzielą się na autotroficzne i heterotroficzne. Autotrofy wykorzystują dwutlenek węgla jako źródło węgla. Heterotrofy potrzebują gotowych związków organicznych. Źródłem węgla dla większości mikroorganizmów mogą być różne substancje organiczne: białka i produkty ich rozpadu, węglowodany, tłuszcze, węglowodory. Żywienie azotem zajmuje drugie miejsce po odżywianiu węglowym pod względem wartości. Azot jest składnikiem aminokwasów i innych składników komórkowych zapewniających witalność organizmów. Azot stanowi 14% suchej masy komórek. Źródłem azotu są związki organiczne lub mineralne zawierające azot. Źródłami azotu mineralnego są najczęściej sole amonowe i azotany. Białka, aminokwasy, nukleotydy są wykorzystywane jako organiczne źródła azotu. Niektóre prokariota mogą używać azotu atmosferycznego. 35
36 Fosfor i siarka to ważne biopolimery komórkowe. Fosfor (3% suchej masy komórek) jest częścią nukleotydów i ATP, a siarka (mniej niż 1%) jest częścią niektórych aminokwasów. Fosforany są zwykle używane jako źródło fosforu, a siarczany są wykorzystywane jako siarka. Fosfor i siarka mogą być również stosowane jako związki organiczne. Do wzrostu mikroorganizmów potrzebne są niewielkie ilości makroelementów: jonów metale alkaliczne(Na+, K+) oraz metale ziem alkalicznych (Mg 2+, Ca 2+), które odgrywają ważną rolę w życiu mikroorganizmów. Makroelementy w komórkach drobnoustrojów są niezbędne do regulacji przepuszczalności, ciśnienia osmotycznego, wartości pH. Oprócz tych metali do rozwoju drobnoustrojów potrzebna jest pewna liczba pierwiastków śladowych (pierwiastków śladowych). Skład mineralny pożywki kształtuje rozkład ładunków elektrycznych na powierzchni komórki. Zmiana potencjału elektrycznego komórek może zmienić ich aktywność fizjologiczną. Jedną z głównych funkcji pierwiastków śladowych jest udział w katalizie enzymatycznej. Obecnie działanie jednej czwartej wszystkich enzymów w komórce jest związane z metalami. Oprócz głównych składników pożywki do normalnego rozwoju niektórych drobnoustrojów potrzebne są również dodatkowe substancje, zwane „czynnikami wzrostu”. Czynniki wzrostu to łączna nazwa różnych Natura chemiczna znajomości. Są to głównie substancje organiczne, których dodatek w bardzo małych ilościach stymuluje wzrost i rozmnażanie drobnoustrojów. Mają to samo znaczenie dla drobnoustrojów, co witaminy dla organizmów wyższych. Czynnikami wzrostu są głównie witaminy z grupy B, które pełnią rolę regulatorów i stymulatorów metabolizmu drobnoustrojów, czyli aminokwasów. Jako czynniki wzrostu stosuje się autolizat drożdżowy, ekstrakt drożdżowy, białka natywne (krew, surowica) itp. Wymagania pokarmowe drobnoustrojów są bardzo zróżnicowane. Z tego powodu nie ma uniwersalnego 36
37 pożywka, równie odpowiednia do hodowli każdego drobnoustroju. W zależności od celów uprawy i potrzeb danego drobnoustroju pożywki różnią się na trzy sposoby: składem, kondycją fizyczną i przeznaczeniem. Według składu pożywki dzielą się na dwie grupy: 1) naturalne (naturalne); 2) sztuczny (syntetyczny). Środowiska naturalne to takie, które mają nieokreślony skład chemiczny, ponieważ obejmują produkty pochodzenia roślinnego lub zwierzęcego, odpady różnych gałęzi przemysłu, zawierające związki organiczne. Naturalne pożywki zapewniają intensywny wzrost szerokiej gamy mikroorganizmów. Zawierają bogaty wachlarz organicznych i związki nieorganiczne, w tym wszystkie niezbędne elementy i substancje dodatkowe. Na przykład następujące podłoża hodowlane są najczęściej używane w warunkach laboratoryjnych. 1. Ekstrakt bulionu mięsno-peptonowego (MPB) z mięsa, zawiera produkty niecałkowitego rozkładu peptonów białkowych, które zawierają węgiel organiczny, azot organiczny, substancje organiczne zawierające fosfor i siarkę. BCH zawiera również wszystkie minerały niezbędne dla mikroorganizmów. BCH znajduje zastosowanie w hodowli wielu rodzajów bakterii. 2. Ekstrakt brzeczki piwnej z porośniętych ziaren jęczmienia, zawiera cukier (głównie maltozę), substancje azotowe, pierwiastki popiołu, różne czynniki wzrostu oraz witaminy z grupy B. Brzeczka jest dobrym środowiskiem dla rozwoju wielu mikroorganizmów, w szczególności drożdży grzyby pleśniowe. Dobrymi nośnikami naturalnymi są mleko, ziemniaki, wywary owocowe i warzywne. W przemyśle zwykle stosuje się media półsyntetyczne lub naturalne. Bardzo często jako źródło węgla wykorzystywane są odpady mikrobiologiczne lub mikrobiologiczne. Przemysł spożywczy: melasa (odpad z produkcji cukru), 37
Ministerstwo Rolnictwa Federacji Rosyjskiej FEDERALNA AGENCJA RYBOŁÓWSTWA PAŃSTWOWY UCZELNIA TECHNICZNA KAMCZACKI WYDZIAŁ BIOLOGII I CHEMII CHEMIA I MIKROBIOLOGIA PRZYGOTOWANIA WODY
Nazwisko Kod Imię Miejsce pracy Kod okręgowy Razem: Zadania praktycznej rundy etapu regionalnego XXXII Wszechrosyjskiego. BIOCHEMIA. IDENTYFIKACJA EKSTRAKTU Sprzęt: Probówki (3 probówki z ekstraktami)
Nazwisko Kod Nazwa Dzielnica / miasto Kod miejsca pracy Razem: ZADANIA rundy praktycznej etapu regionalnego XXVIII Ogólnorosyjskiej Olimpiady dla uczniów z biologii. Rok akademicki 2011-12 rok. Klasa 11 BIOCHEMIA. Ekwipunek,
MIKROBIOLOGIA NOTA WYJAŚNIAJĄCA DO PROGRAMU PRACY KURSU „Mikrobiologia”, klasa 9 „na podstawie autorskiego programu kursu do wyboru „Mikrobiologia” Averchinkova OE Biology. Przedmioty do wyboru... Leczniczy
ZADANIA MIKROBIOLOGIA (max. 20 pkt) Cel pracy: Przygotowanie i analiza leków z dwóch znanych fermentowane produkty mleczne... Wyposażenie: Mikroskopy, palniki lub lampy alkoholowe, szkiełka podstawowe,
KRÓLESTWO PROKARIOTÓW KRÓLESTWO BAKTERII Bakterie są klasyfikowane jako prokarionty. Są to najprostsze, najmniejsze i najbardziej rozpowszechnione organizmy, które istnieją na Ziemi od ponad 2 miliardów lat, ale razem
System ŚWIAT EKOLOGICZNY Wszystkie organizmy istniejące na Ziemi podzielone są na cztery królestwa: Drobyanki, Grzyby, Rośliny, Zwierzęta. Strzelby należą do prokariotów (organizmów przedjądrowych), grzybów, roślin,
Temat projektu Badania mikroorganizmów zamieszkujących stojący zbiornik w moskiewskim lesie Butowo
Praca laboratoryjna „Struktura korpusów grzybów kapowych” Cel: badanie budowy korpusów grzybów kapowych Sprzęt: grzyby kapowe (pieczarka biała, gołąbka, pieczarka, borowik, maślanka, grzyby miodowe itp.), gotowe- zrobiony
FEDERALNA PAŃSTWOWA INSTYTUCJA EDUKACYJNA WYŻSZEGO KSZTAŁCENIA ZAWODOWEGO „PAŃSTWOWY UNIWERSYTET ROLNICZY OMSK NAZWA PAŃSTWA STOLYPINA” INSTYTUT MEDYCYNY I BIOTECHNOLOGII WETERYNARYJNEJ
Zatwierdzony przez Zastępcę Głównego Państwowego Lekarza Sanitarnego Federacji Rosyjskiej - Naczelnego Lekarza Federalnego Centrum Państwowego Nadzoru Sanitarno-Epidemiologicznego Ministerstwa Zdrowia Rosji E.N.BELYAEV 20 lutego 2004 N 24FC / 900 Data
Praca badawcza Drożdże: ekscytujące życie małych grzybów Autor: uczennica klasy 5 „B” Gimnazjum GBOU 1748 „Pionowe” Kutaytsev Georgy Valerievich Promotor: Nosova Elena Vladimirovna,
Metoda wykrywania drożdży i grzybów pleśniowych w żywności ZALECENIA METODYCZNE Metody wykrywania drożdży i grzybów pleśniowych w żywności: Zalecenia metodyczne - Moskwa: Centrum Federalne
Temat 4. Bakterie. Grzyby. Porosty. Część A. 1. Obecność sinic w porostach zapewnia 1) wchłanianie wilgoci atmosferycznej i gleby 2) wykorzystanie światła do tworzenia składników odżywczych
BIOLOGIA NAUKA ŻYWEJ NATURY Biologia: CZYM BADA BIOLOGIA z budowy i funkcji życiowych organizmów żywych; z prawa jednostki i rozwój historyczny organizmy. 3 SYSTEM ORGANICZNY
1. Bakterie nitryfikacyjne są klasyfikowane jako 1) chemotrofy 2) fototrofy 3) saprotrofy 4) heterotrofy TEMAT „Fotosynteza” 2. Energia światła słonecznego jest zamieniana w komórkach na energię chemiczną 1) fototrofy
MIKROBIOLOGIA I GENETYKA Zadanie 1. Przygotuj i przeanalizuj preparaty z dwóch znanych fermentowanych produktów mlecznych. (max. 10 pkt) Sprzęt: Mikroskopy, palniki lub lampy spirytusowe, szkiełka podstawowe,
Testy kwalifikacyjne w specjalności „Bakteriologia” Bank przedmioty testowe przygotować się do certyfikacji Wybierz jedną lub więcej poprawnych odpowiedzi 1. Zgodnie z zarządzeniem Państwowego Komitetu Ochrony Środowiska Federacji Rosyjskiej N obowiązkowe
Zadania 3. Organizmy jednokomórkowe i wielokomórkowe. Królestwo grzybów 1. Co zawiera czarne kulki na końcach długich gałęzi grzyba mukor? 1) mikroskopijne owoce 2) składniki odżywcze 3)
FEDERALNE PAŃSTWO BUDŻETOWA INSTYTUCJA SZKOLNICTWA WYŻSZEGO „PAŃSTWOWY UNIWERSYTET ROLNICZY W ORENBURG” Zalecenia metodyczne dla niezależna praca uczniowie
Morfologia mikroorganizmów Opcja 1 1. Gracilicutes to: A. bakterie cienkościenne B. bakterie grubościenne C. bakterie z uszkodzoną ścianą komórkową. D. bakterie o delikatnej ścianie komórkowej. 2.K
Zadanie dla uczniów: należy wybrać poprawne odpowiedzi (może być od jednej do kilku). Morfologia mikroorganizmów Wariant 1 1. Gracilicutes to: A. bakterie cienkościenne B. grubościenne
Glony Glony rośliny niższe Glony to rozległa i niejednorodna grupa roślin niższych. Glony są najliczniejszymi i jednymi z najważniejszych organizmów fotosyntetycznych na naszej planecie. Spotykają się
Miejska budżetowa instytucja edukacyjna Średnia Alarskaya Szkoła ogólnokształcąca„Uznany” Szef MON Protokół z dnia 0 r. „Uzgodniony” Zastępca Dyrektora ds. Zarządzania Zasobami Wodnymi MBOU 0 g „Zatwierdził”
1 Podstawowe techniki pracy z mikroorganizmami Zadanie 1. Wprowadzenie do mikrobiologii Środki ostrożności podczas pracy z mikroorganizmami Cel zadania. Zadanie to zapozna Cię z zasadami bezpiecznej pracy w
Zadania 2. Struktura komórkowa organizmów 1. Jaki pierwiastek chemiczny wchodzi w skład ważnych związków organicznych komórki? 1) fluor 2) węgiel 3) miedź 4) potas 2. Jako substancja magazynująca
Pleśnie to wpływ czynników fizycznych na wzrost i rozwój grzybów. Logunov Stepan 7g Kierownik projektu Bulycheva M.B. Trafność badań Zarodniki grzybów są wysoce odporne na niekorzystne
Test 5 Opcja 1. Temat "Grzyby" Zadania z wyborem jednej poprawnej odpowiedzi. 1. Główna różnica między grzybami a roślinami polega na tym, że: mają strukturę komórkową, pobierają wodę i sole mineralne z gleby,
1. Nota wyjaśniająca Program przeznaczony jest dla osób rozpoczynających studia podyplomowe FSBEI HPE BSU w specjalności 03.02.03 - Mikrobiologia Program szkolenia wysoko wykwalifikowanych specjalistów na kierunku
FEDERALNA AGENCJA EDUKACJI
PAŃSTWOWA AKADEMIA TECHNOLOGICZNA KARACHAI-CZERKES
Wydział technologii produkcji produktów zwierzęcych
MIKROBIOLOGIA
INSTRUKCJE
na zajęcia laboratoryjne i praktyczne dla studentów
instytut agrarny
Czerkiesk - 2010
Opracowane na podstawie przybliżonych i programy pracy na kursie „Mikrobiologia” zgodnie z Państwowym Standardem Kształcenia Wyższego Szkolnictwa Zawodowego w specjalności 110305 „Technologia wytwarzania i przetwórstwa produktów rolnych” oraz 110201 „Agronomia” (2000).
Omówiono na posiedzeniu wydziału TPPZ (protokół z dnia 2.07.2009r.)
Zatwierdzony przez komisję metodyczną Instytut Rolniczy(Protokół nr 6 z dnia 01.01.2001). Opublikowane decyzją rady pedagogiczno-metodologicznej Państwowej Akademii Technologicznej Karaczajo-Czerkieskiej (protokół z dnia 01.01.2001 r.)
Opracowany przez: kandydat nauk biologicznych, profesor nadzwyczajny , kandydat nauk rolniczych, profesor nadzwyczajny , asystent
Recenzenci: – kandydat nauk biologicznych
Profesor nadzwyczajny Katedry Agronomii
Profesor nadzwyczajny Katedry "TPPZH"
Redaktor: dr hab. Nauki, profesor nadzwyczajny
Zadowolony
Wstęp ………………………………………………………………………… .. 6
1. Mikroskopia ………………………………………………………… .. 7
1.1 Mikroskopia pola świetlnego ……………………………………………. 0,7
1.1.1. Urządzenie mikroskopowe ……………………………………………… 7
2. Praca z mikroorganizmami ……………………………………………. osiem
2.1 Metody przygotowania preparatów ………………………………………………………………………………………………… ..... 8
2.1.1 Technika pobierania kultury do preparatów …………………………… 8
2.1.2. Badanie żywych komórek mikroorganizmów metodą
spadek ciśnienia ……………………………………………………… .. 8
2.1.3. Stałe preparaty drobnoustrojów ……………………… 9
Oświetlenie znajduje się pod sceną. Lustro odbija padające światło do kondensatora. Jedna strona lustra jest płaska, druga wklęsła. Podczas pracy z kondensorem należy używać płaskiego lustra. Lustro wklęsłe jest używane podczas pracy bez kondensora z soczewkami o małym powiększeniu. Kondensor składa się z 2-3 soczewek krótkoogniskowych, zbiera promienie pochodzące z lustra i kieruje je na obiekt. Podczas pracy z systemami zanurzeniowymi wymagany jest skraplacz. Kondensor posiada membranę irysową (płatkową) wykonaną ze stalowych płytek w kształcie półksiężyca.
Preparaty kolorowe są rozpatrywane z prawie całkowicie otwartą przesłoną, nieplamione - ze zmniejszoną aperturą przesłony.
Obiektyw- system wielosoczewkowy, od którego jakości zależy obraz obiektu. Soczewka zewnętrzna nazywana jest soczewką czołową i zapewnia powiększenie. Pozostałe soczewki pełnią funkcję korekcji wad optycznych.
Soczewki są suche i zanurzone (zanurzenie). Podczas pracy z suchymi obiektywami między przednią soczewką obiektywu a badanym obiektem znajduje się powietrze. Podczas pracy z obiektywem imersyjnym V = 90x pomiędzy szkiełkiem nakrywkowym a soczewkami obiektywu znajduje się olej cedrowy, którego współczynnik załamania światła jest zbliżony do współczynnika załamania szkła odpowiednio 1,515 i 1,52. Obiektywy mają powiększenia 8x, 40x i 90x.
Okular służy jako bezpośrednia kontynuacja „soczewek” (soczewek) ludzkich oczu.
Okular składa się z dwóch soczewek - górnej - ocznej i dolnej - zbiorczej, zamkniętej w metalowej oprawie. Zadaniem okularu jest powiększenie obrazu, jaki daje soczewka. Powiększenie okularu jest wygrawerowane na jego oprawce. Robocze powiększenie okularów wynosi od 4x do 15x.
Okulary są różne rodzaje, a wybór zależy od obiektywu. Podczas długiej pracy z mikroskopem używają przystawki dwuokularowej, ponieważ poprawia ona widoczność obiektu, zmniejsza jasność obrazu, a tym samym zachowuje widzenie.
Praca z mikroorganizmami2.1. Metody przygotowania
2.1.1. Technika pobierania kultury do preparatów
Niewielką ilość masy mikrobiologicznej pobiera się z probówki za pomocą igły bakteriologicznej, wypalanej w płomieniu. Jeśli kultura jest płynna, lepiej użyć do tego pętli, w innych przypadkach - igły.
2.1.2. Badanie żywych komórek drobnoustrojów metodą zgniecionej kropli
Żywe komórki drobnoustrojów badane są metodą kruszonej kropli, obiekt jest wstępnie barwiony witalnymi barwnikami - witalne zabarwienie(barwniki: błękit metylenowy, czerwień neutralna w stężeniach od 0,001 do 0,0001%).
Preparaty są pod mikroskopem, lekko zaciemniające pole widzenia; kondensor jest lekko obniżony, przepływ światła regulowany jest przez wklęsłe lustro. Początkowo używają małego powiększenia - obiektyw 8x, po wykryciu krawędzi kropli montuje się obiektyw 40x lub immersyjny (90x).
W przypadku metody kruszonej kropli na czysty szkiełko nakłada się kroplę wody z kranu. Wprowadza się do niego kulturę i miesza z wodą. Nadmiar wody usuwa się bibułą filtracyjną. Podczas korzystania z obiektywu immersyjnego kroplę oleju cedrowego nakłada się na szkiełko i poddaje mikroskopowi.
2.1.3. Stałe preparaty drobnoustrojów
Preparaty stałe zakładają taką obróbkę żywych komórek, która umożliwia szybkie przerwanie przebiegu procesów życiowych w obiekcie, zachowując jego drobną strukturę. W wyniku utrwalenia komórki są mocno przymocowane do szkła i są lepiej wybarwione. Umocowanie jest konieczne podczas pracy z drobnoustrojami chorobotwórczymi (ze względów bezpieczeństwa).
Przygotowanie rozmazu. Kroplę wody z kranu nakłada się na czystą, odtłuszczoną szkiełko. Do odtłuszczenia szkła stosuje się mieszaninę alkoholu etylowego i eteru siarkowego w stosunku 1: 1. Za pomocą kalcynowanej igły bakteriologicznej z probówki pobiera się niewielką ilość masy mikrobiologicznej i dodaje do kropli wody. Kroplę ostrożnie rozsmarowuje się pętlą na szkle na powierzchni około 4 cm2.
Jeśli zawiesina jest gęsta, najpierw rozcieńcza się ją wodą. W tym celu za pomocą kalcynowanej ezy pobiera się niewielką ilość zawiesiny i przenosi do kropli wody na innym szkiełku. Zawiesinę o normalnej gęstości rozmazuje się cienką warstwą na szkle, a następnie rozmaz suszy się na powietrzu w temperaturze pokojowej lub w niskiej temperaturze, utrzymując lek wysoko nad płomieniem palnika. Nie zaleca się silnego ogrzewania preparatu podczas suszenia, aby uniknąć koagulacji białek, która zaburza strukturę i kształt komórek. Wysuszony preparat jest utrwalony.
Utrwalenie rozmazu. Jest przeprowadzany nad płomieniem palnika lub za pomocą chemicznego cozwiązki. W pierwszym przypadku preparat przeprowadza się powoli trzy do czterech razy dolną stroną nad płomieniem palnika, w drugim przypadku stosuje się związki chromu: formalina, kwas osmowy, aceton. Jedną z powszechnych technik utrwalania jest leczenie leku 96% alkoholem lub mieszaniną równych objętości alkoholu etylowego i eteru (płyn Nikiforowa). W tym celu preparaty zanurza się w płynie utrwalającym na 10-30 minut.
Zabarwienie preparatu. Na rozmaz nakłada się kilka kropli barwnika. W zależności od rodzaju barwnika i celu badania czas barwienia waha się od 1 do 5 minut, w niektórych przypadkach trwa do 30 minut. Pod koniec barwienia preparat przemywa się wodą, wodę usuwa się bibułą filtracyjną, suszy na powietrzu i pod mikroskopem.
Istnieją proste i zróżnicowane metody malowania.
Na prosty do barwienia używa się jednego barwnika (błękit metylenowy, fuksyna, fiolet gencjanowy), barwiona jest cała komórka.
Na zróżnicowany Poprzez barwienie poszczególne struktury komórkowe są barwione różnymi barwnikami (barwienie metodą Grama, barwienie zarodników).
Badanie morfologii mikroorganizmów3.1. Kształt komórki
3.1.1. Bakteria
W kształcie wszystkie bakterie są podzielone na kuliste (cocci), w kształcie pręcika i karbowane.
Bakterie kuliste - kokcy.
1. Mikrokoki - pojedyncze komórki kuliste ( Mikrokok agilis).
2. Diplokoki - ziarniaki kuliste, połączone dwójkami. ( Azotobakteria chroococcum).
3. Tetracocci- ziarniaki kuliste, połączone w cztery.
4.Paciorkowce- bakterie kuliste połączone w łańcuchy (głównie patogenne, a także bakterie kwasu mlekowego) Lactococcus lactis).
5. Sarcinas- bakterie kuliste, zgrupowane po 8 komórek, powstają w wyniku podziału komórek w trzech wzajemnie prostopadłych płaszczyznach. Niektóre rodzaje sarcyny tworzą duże pakiety w kształcie sześcianu, w których po każdej stronie znajdują się 4 sarkiny. Typowy przedstawiciel Sarcina flava(sarcinum yellow) - najczęstszy przedstawiciel mikroflory powietrza.
Wszystkie kuliste formy bakterii, z wyjątkiem Paciorkowiec lactis, oglądane na preparatach utrwalonych i barwionych fuksyną.
Bakterie w kształcie pręcików. Należą do nich formy, które nie budzą kontrowersji (poród Pseudomonas, Achromobakteria, Lactobacillus i inne) oraz tworzenie sporów (poród Bakcyl, Clostridium itd.).
Kij do zarodników Pseudomonas stutzeri – jego cytoplazma jest wybarwiona równomiernie.
Pręty tworzące zarodniki Bacillus mycoides oraz Bacillus mesentericus. Pod mikroskopem wydają się nierównomiernie zabarwione. Zarodniki nie są zabarwione jako gęstsze struktury. Komórki Bakcyl mycoides ułożone w łańcuchy to paciorkowce.
Bakterie w kształcie pręcików są oglądane na utrwalonych i barwionych szkiełkach.
Zakrzywione kształty
1. Wibracje – lekko zakrzywione komórki.
2. Spirille mogą mieć jeden lok w postaci rosyjskiej litery C, dwa loki w formie łacińskiej litery S lub kilka - w formie spirali.
3. Krętki - długie i cienkie komórki z dużą ilością loków; długość komórek przekracza ich grubość o 5-200 razy.
Vibrios i spirillae są wygodnie oglądane na ustalonym i zabarwionym preparacie przygotowanym z zawiesiny, uprzednio inkubowanej przez kilka dni w termostacie. Spośród wielu mikroorganizmów na takim preparacie często znajdują się formy zawiłe.
Z krętkami można zapoznać się na utrwalonym wybarwionym preparacie płytki nazębnej, szczególnie skuteczne są preparaty do zeskrobywania zęba próchnicowego. Krętki zębowe są bardzo cienkie, przypominające włosy, krótkie (tylko 2-3 loki).
3.1.2. promieniowce
Promieniowce to promienne grzyby. Grzybnia promieniowców na pożywkach jest zróżnicowana: jedna jej część jest zanurzona w podłożu (grzybnia podłoża), druga znajduje się nad podłożem (grzybnia powietrzna).
Wielu przedstawicieli promieniowców wytwarza pigmenty, dlatego ich grzybnia powietrzna, a zwłaszcza kolonie, ma kolor niebieski, niebieski, fioletowy, różowy, brązowy, brązowy lub czarny. Promieniowce barwią podłoże hodowlane w odpowiednich kolorach.
Kawałek kolonii promieniowców nanosi się na szkiełko razem z pożywką. Za pomocą drugiego szkiełka element ten jest mocno dociskany do szkła, kruszony i rozmazany na szkle. Lek jest suszony, utrwalany, barwiony, oglądany pod mikroskopem, gdzie jednokomórkowe włókna grzybni są częściowo widoczne.
3.1.3. Drożdże
Drożdże - jednokomórkowe mikroskopijne grzyby o różnych kształtach: eliptyczne, gruszkowate, okrągłe, cylindryczne. Rozmnażaj się wegetatywnie i płciowo.
Do badań laboratoryjnych stosuje się drożdże piekarskie. Mały kawałek masy drożdżowej kilka godzin przed zajęciami umieszczamy w ciepłej osłodzonej wodzie i umieszczamy w ciepłym miejscu. Powstaje biaława, mętna ciecz. Kroplę tego płynu nanosi się na szkiełko przykryte szkiełkiem nakrywkowym, na wierzch nakłada się kroplę olejku cedrowego i preparat ogląda się systemem imersyjnym. Widoczne są pączkujące i dzielące się komórki.
3.2. Chemiczne metody badawcze
3.2.1. Barwienie komórek mikroorganizmów metodą Grama
Ta metoda różnicowania komórek drobnoustrojów opiera się na różnicy w skład chemiczny błony komórkowe. W komórkach niektórych typów mikroorganizmów powstaje nierozpuszczalny w alkoholu związek jodu z głównym barwnikiem, podczas gdy u innych gatunków związek ten pojawia się przejściowo i rozpuszcza się po potraktowaniu alkoholem. Mikroorganizmy z pierwszej grupy nazywane są gram-dodatni druga - gram-ujemny.
Technika barwienia metodą Grama. Na odtłuszczone szkiełko nanosi się trzy cienkie rozmazy różnych kultur drobnoustrojów (dwa z nich są kontrolnymi, o znanym związku z barwieniem Grama). Rozmazy suszy się na powietrzu, utrwala nad płomieniem palnika i barwi przez 1 min fenolowym roztworem fioletu gencjany (lub fioletu krystalicznego), trzymając szkło w pozycji lekko pochylonej. Następnie barwnik wylewa się i bez spłukiwania preparatu wodą nakłada się na niego roztwór Lugola na 1 minutę (aż rozmaz jest całkowicie zaczerniony). Szkło trzymane jest w pozycji pochylonej. Lek, bez spłukiwania wodą, jest traktowany, wstrząsając, z 96% alkoholem przez 15-20 sekund. Ważne jest przestrzeganie czasu przebarwienia, ponieważ po przekroczeniu określonego czasu odbarwiają się również komórki Gram-dodatnie.
Po spłukaniu wodą preparat barwi się fuksyną Pfeifera przez 1 min. Mikroorganizmy Gram-dodatnie nabierają ciemnofioletowego koloru, a mikroorganizmy Gram-ujemne są zabarwione dodatkowym kolorem (fuksyna).
Wyniki barwienia metodą Grama zależą od wieku hodowli: w starych kulturach martwe komórki są zawsze barwione metodą Gram-ujemną. Dlatego lepiej jest używać młodych upraw jednodniowych.
Drożdże, Bacillus mesentericus lub Bacillus subtilis(gram-dodatni) i Escherichia coli (gram-ujemny).
Barwniki i odczynniki do barwienia metodą Grama.
1. Roztwór fenolowy fioletu goryczki: fiołek gencjanowy - 1 g, alkohol 96% - 10 ml, fenol krystaliczny - 2 g, woda destylowana - 100 ml.
W niektórych przypadkach zastosuj roztwór alkoholu z goryczkipurpurowy: fiołek gencjanowy (lub fiolet krystaliczny) - 1 g, 96% alkohol (rektyfikowany) - 100 ml, gliceryna - 5 ml. Mieszaninę umieszcza się w termostacie na 24 godziny, a następnie filtruje.
2. Rozwiązanie Lugola(jodek potasu - 2 g, jod krystaliczny - 1 g, woda destylowana - 300 ml). Najpierw przygotowuje się stężony roztwór jodku potasu w 5 ml wody, rozpuszcza się w nim jod, a następnie dodaje wodę do 300 ml.
3. Alkohol 96%.
4. Fuksyna Pfeifer(wodny roztwór fuksyny karbolowej Ziehla): 1 ml fuksyny karbolowej Ziehla i 9 ml wody destylowanej. Sporządza się go w następujący sposób: 1 g fuksyny, 5 g krystalicznego fenolu, 96% alkoholu - 10 ml, kilka kropli gliceryny, 100 ml wody destylowanej, fuksynę rozpuszcza się w etanolu, dodaje się fenol rozpuszczony w wodzie. Roztwór miesza się i pozostawia na kilka dni. Jest filtrowany przed użyciem.
3.2.2. Barwienie zarodników u bakterii
Zarodniki bakterii, w porównaniu z komórkami wegetatywnymi, są wysoce odporne na niekorzystne warunki środowiskowe. Są to formacje okrągłe, owalne lub eliptyczne. Jeśli średnica zarodnika nie przekracza średnicy komórki, w której powstaje zarodnik, komórka nazywa się podrzędny, jeśli przekracza, to w zależności od umiejscowienia zarodnika w środku lub na końcu komórki, komórka ta jest odpowiednio nazywana Clostridium lub plektridialny . W komórce prątkowej zarodnik może znajdować się w środku komórki - centralny pozycja, na końcu - terminal i bliżej jednego końca - podterminal pozycja.
Obserwując żywe bakterie tworzące zarodniki, ich zarodniki można odróżnić po silniejszym załamaniu promieni świetlnych. Zarodniki są kwasoodporne, więc trudno je zabarwić barwnikami. Tłumaczy się to dużą gęstością błony, niskim stężeniem w niej wolnej wody oraz wysoką zawartością lipidów w zarodnikach. W preparatach kolorowych w prosty sposób lub według Grama zarodniki pozostają bezbarwne (negatywne zabarwienie).
Wszystkie metody barwienia zarodników oparte są na wspólna zasada: najpierw zarodniki są wytrawiane różnymi substancjami: kwasem chromowym, chlorowodorowym, siarkowym, octowym, amoniakiem, sodą kaustyczną lub nadtlenkiem wodoru, następnie komórka z zarodnikiem jest barwiona po podgrzaniu, a na końcu cytoplazma zostaje odbarwiona i dodatkowo zabarwiona barwnik kontrastowy.
Metoda Ziehla-Nielsena zmodyfikowana przez Müllera. Przed utrwaleniem rozmazu bakteryjnego na płomieniu preparat przygotowuje się w zwykły sposób. Następnie na utrwalony w płomieniu i schłodzony preparat nakłada się 5% roztwór kwasu chromowego. Po 5-10 minutach zmywa się wodą. Preparat pokryto paskiem bibuły filtracyjnej i bibułę obficie zwilżono fuksyną karbolową Tsil. Podgrzać preparat nad ogniem, aż pojawią się opary (nie do wrzenia), następnie odłożyć na bok i dodać nową porcję barwnika. Ta procedura jest przeprowadzana przez 7 minut. Ważne jest, aby barwnik wyparował, ale papier nie wysychał. Po schłodzeniu jest usuwany, preparat myje się wodą i dokładnie osusza bibułą filtracyjną. W wyniku tego zabiegu komórki z zarodnikami są równomiernie wybarwione.
Następnie cytoplazmę komórek (ale nie zarodników) odbarwia się traktując 1% roztworem kwasu solnego lub siarkowego przez 15-30 sekund. Podczas przygotowywania preparatu zarodniki Bakcyl mycoides lub Bakcyl krezka zaleca się odbarwienie cytoplazmy przez 16-18 s (mierzone głośno od 21 do 37-40). Jeśli ten czas zostanie przekroczony, zarodniki mogą również ulec odbarwieniu. Następnie preparat przemywa się wodą i barwi błękitem metylenowym przez 2 min.
Kolor jest kontrastowy, a jaskrawoczerwone zarodniki wyraźnie wyróżniają się na niebieskim tle cytoplazmy.
Metoda Peszkowa. Błękit metylenowy Lefflera wlewa się do preparatu utrwalonego w płomieniu, doprowadza do wrzenia i gotuje przez 15-20 s, trzymając szklankę nad płomieniem. Rozmaz przemywa się wodą i barwi przez 30 s 0,5% wodnym roztworem czerwieni obojętnej. Ponownie spłukać, osuszyć, a następnie zbadać preparat za pomocą zanurzenia obiektywu w oleju. Zarodniki mają kolor niebieski lub niebieski, cytoplazma - różowy.
Do badania sporów wygodne przedmioty mogą być Bakcyl krezka lub Bakcyl mycoides w wieku 4 dni.
Odczynniki do barwienia przetrwalników bakterii. 1. Fuksyna karbolowaCilya(patrz 3.2.1).
2. Błękit metylenowy Lefflera(patrz 3. 2. .1).
3. Nasycony wodny roztwór błękitu metylenowego. 2 g barwnika i 100 ml wody destylowanej.
4. kwas chromowy, 5% roztwór.
5. Sól(lub Kwas siarkowy, 1% roztwór.
4. Hodowla mikroorganizmów
4.1. Media kulturowe
4.1.1. Przygotowanie pożywek hodowlanych
Bulion mięsno-peptonowy (BCH). Do przygotowania podłoży mięsno-peptonowych użyj bulion mięsny, który otrzymuje się w następujący sposób: 500 g drobno posiekanego świeżego mięsa wlewa się do emaliowanej patelni z 1 litrem wody wodociągowej podgrzanej do 50 ° C i pozostawia do zaparzenia przez 12 godzin w temperaturze pokojowej lub 1 godzinę w 50-55 ° C . Mięso wykręca się, ekstrakt filtruje się przez gazę z warstwą waty, gotuje przez 30 minut w celu skrzepnięcia białek koloidalnych i filtruje dwukrotnie (pierwszy raz przez gazę z watą, drugi przez filtr papierowy). Do filtratu dodaje się wodę do 1 l, wlewa do kolb, zamyka bawełnianymi korkami i sterylizuje w temperaturze 120°C przez 20 minut (korki kolb zamyka się od góry papierowymi kapslami).
Bulion mięsny można wykorzystać w dowolnym momencie do przygotowania pożywki. Jeśli zostaną przygotowane natychmiast, nie jest wymagana wstępna sterylizacja bulionu mięsnego.
Aby przygotować BCH, dodaj 5-10 g na 1 litr bulionu mięsnego pepton(pierwszy produkt hydrolizy białka) w celu zwiększenia kaloryczności pożywki i 5 g sól kuchenna do tworzenia aktywności osmotycznej. Pożywkę ogrzewa się do rozpuszczenia peptonu, ciągle mieszając.
Ustal obojętną lub lekko zasadową reakcję podłoża, dodając 20% roztwór Na2C03, aż wilgotny czerwony papierek lakmusowy zmieni kolor na niebieski. Do sprawdzenia pH podłoża wygodnie jest użyć wskaźnika. bromothymalblow: 1-2 krople miesza się w porcelanowym kubku z kroplą bulionu. W środowisku obojętnym bromothymolblau jest butelkowo-zielony, w środowisku kwaśnym jest żółty, a w zasadowym jest niebieski.
Po ustawieniu pH, pożywkę gotuje się ponownie przez 5-10 minut, a białka, które ulegają koagulacji podczas zmiany reakcji pożywki, są filtrowane przez filtr papierowy bez klarowania bulionu lub klarowania go białkiem. W tym celu ubija się świeże białko jaja z podwójną objętością wody i miesza z bulionem schłodzonym do 50 ° C. Mieszaninę gotuje się, mieszając, na małym ogniu przez 10 minut, a następnie przesącza. Przezroczysty bulion mięsno-peptonowy wlewa się do probówek, zamyka bawełnianymi korkami i sterylizuje w 120 ° C przez 20 minut.
Agar mięsny z peptonem (MPA). Dodaj 15-20 g agaru do 1 l MPB. Pożywkę ogrzewa się do rozpuszczenia agaru (jego temperatura topnienia 100°C, jego krzepnięcie wynosi 40°C), lekko zasadowy odczyn pożywki ustala się 20% roztworem Na2C03 i wlewa się przez lejek do probówek (w przybliżeniu 10 ml agaru w kolumnie do późniejszego rozlania na szalki Petriego i po 5 ml do uzyskania agaru skośnego - roztwory).
Podczas rozlewania agaru krawędzie probówek muszą pozostać suche, w przeciwnym razie korki przykleją się do szkła. Probówki z pożywką sterylizuje się w autoklawie w temperaturze 120°C przez 20 minut.
4.2. Metody sterylizacji
Sterylizacja - Jest to całkowite zniszczenie komórek mikroorganizmów w pożywkach, naczyniach itp.
Znanych jest kilka metod sterylizacji. Częściej stosowana jest sterylizacja termiczna.
4.2.1. Podpalanie lub kalcynowanie
Platynowe pętle, igły, szpatułki, drobne przedmioty metalowe (nożyczki, lancety, pęsety), a także szklane pręty, szkiełka mikroskopowe, szkiełka nakrywkowe itp. można zapalić bezpośrednio przed użyciem.
4.2.2. Sterylizacja na sucho
Służy do obróbki naczyń i suchych materiałów, takich jak krochmal, kreda. W takim przypadku wysterylizowany przedmiot jest przechowywany w temperaturze 170°C przez 2 godziny (od momentu ustalenia wymaganej temperatury) w suszarniach elektrycznych. Nie zaleca się podnoszenia temperatury powyżej 170 ° С: waciki i papier zaczynają się psuć.
Przed sterylizacją szkło zamyka się bawełnianymi korkami i zawija w papier. Kubki, probówki, pipety, wata, gaza są owijane w papier lub umieszczane w specjalnych kasetkach i kasetkach, w których można przechowywać sterylne naczynia po sterylizacji.
Po zakończeniu sterylizacji szafkę otwiera się dopiero po spadku temperatury do temperatury pokojowej, w przeciwnym razie szkło może pęknąć.
4.2.3. Sterylizacja z przepływającą parą
Przepływająca para (100 ° C) służy do obróbki przedmiotów, które niszczą się pod wpływem suchego ciepła oraz niektórych pożywek, które nie wytrzymują wyższych temperatur (pożywki z węglowodanami, MPF, mleko). Sterylizację przeprowadza się w kotle Kocha przez 30 minut przez 3 dni każdego dnia. Ta sterylizacja nazywa się frakcyjny.
Przy pojedynczym ogrzewaniu w temperaturze 100 ° C przez 30 minut komórki wegetatywne giną, a zarodniki wielu mikroorganizmów pozostają żywe. Po takim podgrzaniu pożywkę umieszcza się w termostacie w temperaturze 28-30°C na 24 godziny. Zarodniki zachowane podczas pierwszego ogrzewania mają czas na wykiełkowanie w formy wegetatywne, które giną podczas kolejnego ogrzewania. Następnie ta operacja jest powtarzana jeszcze 2 razy.
4.2.4. Sterylizacja parą nasyconą pod ciśnieniem
Jest to najszybsza i najbardziej niezawodna metoda sterylizacji i zabija najbardziej uporczywe zarodniki. Z jego pomocą sterylizuje się większość pożywek i naczyń.
Obróbka parą nasyconą odbywa się w hermetycznie zamkniętym grubościennym kotle - autoklaw. Na pokrywie lub z boku autoklawu znajduje się zawór wylotowy pary, manometr i zawór bezpieczeństwa. Manometr pokazuje, o ile ciśnienie pary w kotle jest wyższe niż normalnie. Aby zapobiec wybuchowi, gdy limit ciśnienia zostanie przekroczony, uruchamiany jest zawór bezpieczeństwa, uwalniając parę.
Wskaźnik manometru w atmosferach fizycznych odpowiada określonej temperaturze.
Niezawodną sterylizację uzyskuje się przez ogrzewanie w temperaturze 120 ° C i ciśnieniu 1 atm przez 20 minut.
Sterylizację przeprowadza się w następujący sposób. Do autoklawu wlewa się wodę, umieszcza się w nim przedmioty przeznaczone do sterylizacji, przykręca się pokrywę autoklawu i rozpoczyna się ogrzewanie. Zawór pozostaje otwarty, aż całe powietrze w autoklawie zostanie zastąpione parą wodną. Gdy para zaczyna opuszczać kran w ciągłym strumieniu, kran jest zamykany, ciśnienie pary w autoklawie jest doprowadzane do 1 atm i utrzymywane na tym poziomie przez 20-30 minut. Następnie ogrzewanie zostaje zatrzymane, czekają, aż wskazówka manometru spadnie do 0, ostrożnie (pomalutku) odkręcają kran i wypuszczają parę. Dopiero wtedy odkręć pokrywę autoklawu. Jeśli kran zostanie otwarty przed spadkiem ciśnienia, płyn w wysterylizowanych naczyniach zagotuje się i wypchnie z nich zatyczki.
Autoklaw służy również do sterylizacji frakcyjnej za pomocą przepływającej pary. W takim przypadku pokrywka nie jest przykręcana, aby umożliwić swobodny odpływ pary.
4.2.5. Pasteryzacja
Pasteryzacja jest niepełną lub częściową sterylizacją, co oznacza podgrzewanie w temperaturze 65-80 ° C odpowiednio przez 30-10 minut, a następnie szybkie schłodzenie do 10-11 ° C. Mleko, piwo, wino i inne produkty są pasteryzowane.
Materiały i ekwipunek
MPB, agar, czerwony lakmus, bromotymolblow, porcelanowe płytki ze studzienkami lub kubeczkami, szklane pręciki, 20% roztwór Na2C03, probówki w statywie (do rozlewania agaru), lejki, wata, szalki Petriego, pipety Mohra 1 ml, papier do kubka i opakowania na pipety, kolby 250 ml, szorstkie nici.
5. Zliczanie i izolacja czystej kultury mikroorganizmów
5.1. Metody liczenia drobnoustrojów
5.1.1. Zliczanie liczby mikroorganizmów (CFU) w glebie metodą płytek odżywczych w połączeniu z metodą kolejnych rozcieńczeń
Gleba jest najkorzystniejszym środowiskiem dla rozwoju mikroorganizmów. Ze względu na dużą niejednorodność jego składu, biorąc pod uwagę liczbę zawartych w nim mikroorganizmów, biorą przeciętny próbka gleby.
Najpierw przygotowuje się zawiesiny (metodą rozcieńczania) zawierające różne stężenia gleby w 1 ml wody. W tym celu pobiera się próbkę gleby w 1 g ze słoika lub torby na sterylnym szkiełku zegarkowym za pomocą sterylnej porcelanowej szpatułki lub aluminiowej łyżeczki. Podczas ważenia gleby szkiełko zegarkowe jest przykrywane innym sterylnym szkiełkiem zegarkowym.
Próbkę gleby, obserwując warunki aseptyki, przenosi się do kolby o pojemności 250 ml z 99 ml sterylnej wody. Mieszaninę wstrząsa się przez 5 minut bez zwilżania korka. Sterylną pipetą pobrać 1 ml zawiesiny zawierającej 10-2 g gleby i przenieść do probówki z 9 ml sterylnej wody z kranu. Pipetę wielokrotnie przemywa się wodą w probówce, aby jak najdokładniej wypłukać komórki z jej ścianek. Drugą sterylną pipetą pobrać kolejny 1 ml zawiesiny z kolby i umieścić ją w drugiej kolbie zawierającej również 99 ml sterylnej wody z kranu. Ta pipeta jest myta w taki sam sposób jak w pierwszym przypadku. Probówkę i drugą kolbę wstrząsa się przez 1 min. Stężenie gleby w probówce wyniesie 10-3 g, w drugiej kolbie -10-4 g. W ten sam sposób 1 ml zawiesiny z drugiej kolby przenosi się nowymi jałowymi pipetami do drugiej probówki z 9 ml i do trzeciej kolby z 99 ml sterylnej wody z kranu i przygotować nowe zawiesiny zawierające 1 ml odpowiednio 10-5 i 10-6 g gleby.
PRACE PRAKTYCZNE
Dla studentów II roku
O MIKROBIOLOGII
1. Laboratorium mikrobiologiczne.
2. Metody badań mikroskopowych. Znajomość mikroskopu.
3. Metody barwienia preparatów. Metody przygotowania
do mikroskopii.
4. Metody zbierania materiału. Media kulturowe.
5. Bakteriologiczna metoda badań na przykładzie gronkowców.
6. Hodowla i oznaczanie wirusów.
9. Wpływ czynników środowiskowych na mikroorganizmy.
10. Reakcje serologiczne. Reakcja aglutynacji.
11. Reakcja hemaglutynacji.
12. Reakcja wiązania dopełniacza.
13. Reakcja opadów atmosferycznych. Reakcja strącania pierścienia.
14. Reakcja immunofluorescencji. Reakcja odpornościowa (testy skórne).
Reakcja opsonofagocytarna.
15. Szczepionki.
16. Preparaty surowicy.
Wstęp
zestaw narzędzi opracowany, aby pomóc studentom Moskiewskiego Kolegium Medycznego Transportu Kolejowego MIIT w przygotowaniu praktyczna praca w ramach dyscypliny „Podstawy Mikrobiologii, Wirusologii i Immunologii”.
Moduł edukacyjny
Temat lekcji: patrz spis treści
Rodzaj lekcji: praktyczna
Miejsce zajęć: laboratorium mikrobiologii
Czas: 16*2 godziny
Uczeń powinien wiedzieć:
SEKCJA 1
PODSTAWY MEDYCZNE
BAKTERIOLOGIA I MIKROBIOLOGIA
PRAKTYKA NR 1
Temat:„Laboratorium mikrobiologiczne”
W szpitalach i stacjach sanitarno-epidemiologicznych organizowane jest laboratorium mikrobiologiczne. Istnieją również specjalne laboratoria, w których pracują z patogenami szczególnie groźnych infekcji, są to:
laboratoria wirusologiczne itp.
Do zadań laboratorium mikrobiologicznego należy:
1) diagnostyka bakteriologiczna chorób zakaźnych;
2) badania sanitarne i bakteriologiczne wody, powietrza i obiektów
środowisko;
W skład laboratorium wchodzą:
1) sala laboratoryjna z przeszkloną skrzynką do prowadzenia
badania mikrobiologiczne (w pudełku muszą być zainstalowane)
lampa bakteriobójcza);
2) pranie;
3) przygotowawcze (pomieszczenie do przygotowywania potraw i inne)
praca pomocnicza);
4) autoklaw;
5) pomieszczenie do przyjmowania analiz i wydawania wyników badań;
6) wiwarium;
Laboratorium mikrobiologiczne musi być wyposażone w:
- termostat,
- lodówka,
- suszarnie,
- odwirować,
- szkło laboratoryjne;
A także wyposażenie:
- palnik alkoholowy lub gazowy
- pętle bakteriologiczne
- des. rozwiązanie